Строение молекулы воды
Строение молекулы воды
К.х.н. О.В. Мосин
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ В АНАЛИЗЕ СТРОЕНИЯ МОЛЕКУЛЫ ВОДЫ
Если нам захочется посмотреть, как устроена молекула воды, то придется в первую очередь вспомнить ее состав. Молекула воды состоит из одного атома кислорода, связанного ковалентной связью с двумя атомами водорода H2O (формула воды). В молекуле воды главное действующее лицо — атом кислорода. Вспомним его энергетическую диаграмму (рисунок слева):
Два неспаренных р-электрона
атома кислорода О очень
Рис. Так выглядит перекрывание р-орбиталей кислорода с s-орбиталями двух атомов водорода (рисунок справа):
Таким образом, из двух атомов водорода и одного атома кислорода получается угловая молекула воды которую можно условно изобразить еще так:
Рис. Молекула воды имеет угловую форму (ниже слева)
Поскольку атомы водорода
друг от друга заметно отталкиваются,
угол между химическими связями
(линиями, соединяющими ядра атомов) водород
— кислород не прямой (90°), а немного больше
— 104,5°.
Строение молекулы воды Н2О можно проанализировать с помощью метода молекулярных орбиталей (МО). Схема молекулярных орбиталей молекулы воды приведена ниже.
Рис. Схема расположения координатных осей (а) и энергетическая диаграмма орбиталей молекулы Н2О (б).
Для построения схемы молекулярной
орбитали молекулы воды Н2О совместим
начало координат с атомом кислорода,
а атомы водорода расположим в плоскости
xz (Подробнее см. Г.Грей «Электроны и
химическая связь»,М., изд-во «Мир»,
1967, с.155-62 и G.L.Miessier, D.A.Tarr, «Inorganic Chemistry»,
Prantice Hall Int. Inc., 1991, p.153-57).
Inc., 1991, p.153-57).
В формировании суммарной
молекулярной орбитали воды принимают
участие отдельные атомные
Рис. Перекрывание 2s- (а), 2px- (б) и 2pя- (в) орбиталей атома кислорода с 1s-орбиталями двух атомов водорода молекулы воды.
Из этих данных и умозаключений можно сделать следующие
1. Молекула Н2О диамагнитна.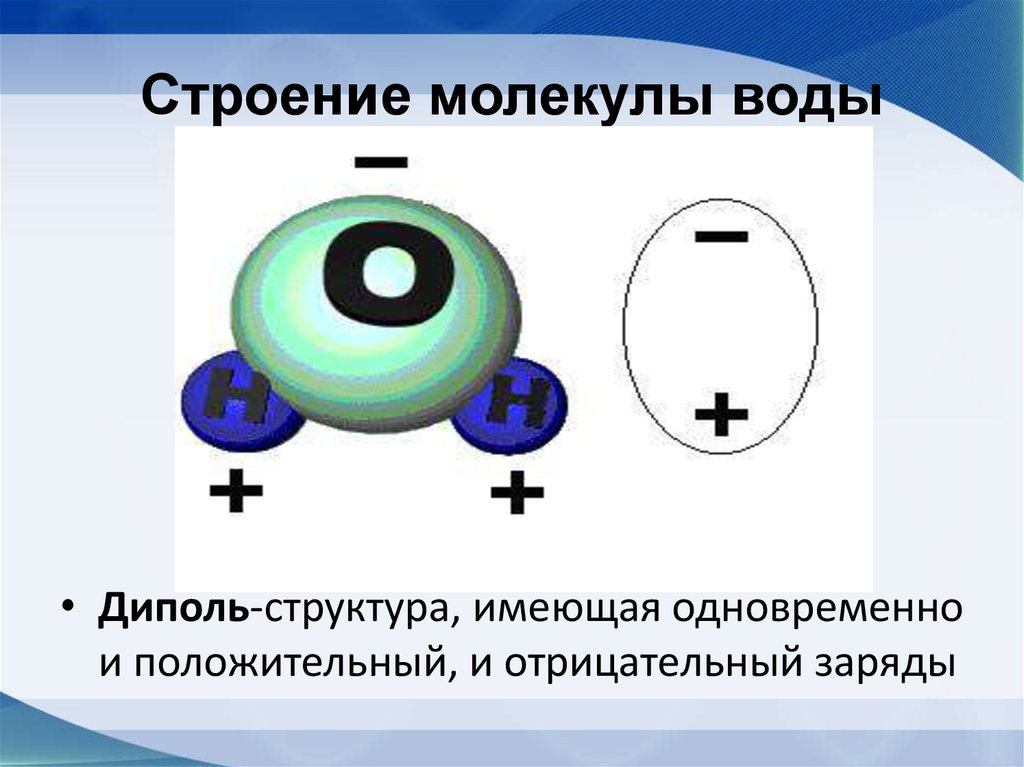
2. Электроны на связывающих 2а1 и 1b1 орбиталях обеспечивают связи О- Н, а на несвязывающих (3а1 и 1b2) орбиталях соответствуют свободным электронным парам в молекуле Н2О, как это описывается в рамках метода валентных связей.
3. Принципиальным
отличием метода молекулярных
орбиталей от метода валентных
связей является разная
4. Метод молекулярных
связей (в отличие от метода
валентных связей) позволяет оценить
разницу в энергиях 
Так как у
молекулы Н2О в образовании связей
принимают в основном участие 2р-орбитали
кислорода и 1s-орбитали водорода, то можно
ожидать, что угол Н- О- Н должен быть близким
к 90о. Однако из эксперимента следует,
что этот угол равен 104.5о. Причина такого
различия заключается в том, что этот угол
соответствует минимуму энергии. Согласно
квантово-механическим расчетам, энергия
молекулы зависит не только от энергии
молекулярных орбиталей и числа электронов
на них, но и от валентного угла Н- О- Н.
В приближении метода валентных связей
увеличение угла Н- О- Н от 90о (характерного
для взаимодействия р-орбиталей) до 104.
При переходе от
Н2О к другим двухатомным
молекулам Н
К.х.н. О.В. Мосин
Структура и физические свойства воды
Вода представляет собой прозрачную бесцветную жидкость, обладающую целым рядом аномальных физических свойств. Например, она имеет аномально высокие температуры замерзания и кипения, а также поверхностное натяжение. Ее удельные энтальпии испарения и плавления (в расчете на 1 г) выше, чем почти у всех остальных веществ. Редкой особенностью воды является то, что ее плотность в жидком состоянии при 4°С больше плотности льда. Поэтому лед плавает на поверхности воды.
Эти аномальные
свойства воды объясняются существованием
в ней водородных связей, которые
связывают между собой молекулы
как в жидком, так и в твердом
состоянии.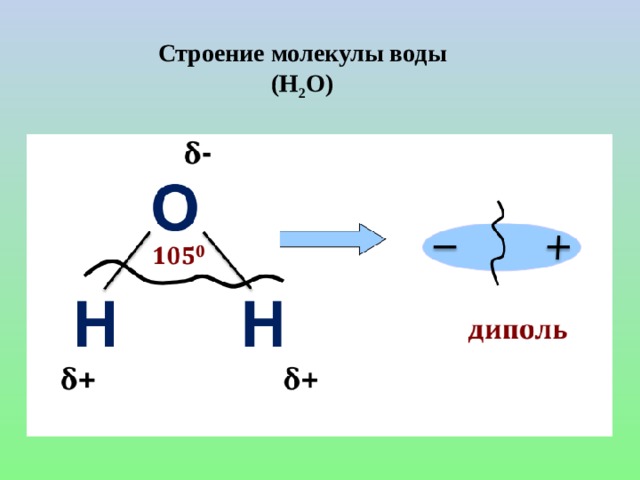 Вода плохо проводит электрический ток, но становится хорошим
проводником, если в ней растворены даже
небольшие количества ионных веществ.
Вода плохо проводит электрический ток, но становится хорошим
проводником, если в ней растворены даже
небольшие количества ионных веществ.
Универсальный растворитель
Вода широко используется в качестве растворителя в химической технологии, а также в лабораторной практике. Она представляет собой универсальный растворитель, необходимый для протекания биохимических реакций. Дело в том, что вода прекрасно растворяет ионные соединения, а также многие ковалентные соединения. Способность воды хорошо растворять многие вещества обусловлена полярностью ее молекул. Молекула воды обладает сравнительно большим дипольным моментом. Поэтому при растворении в ней ионных веществ молекулы воды ориентируются вокруг ионов, т.е. сольватируют их. Водные растворы ионных веществ являются электролитами.
Растворимость ковалентных соединений в воде
зависит от их способности образовывать
водородные связи с молекулами воды. Водородные
связи-это диполь-дипольные взаимодействия
между атомами водорода в молекулах воды
и электроотрицательными атомами молекул
растворенного вещества. Простые ковалентные
соединения, как, например, диоксид серы,
аммиак и хлороводород, растворяются в
воде. Кислород, азот и диоксид углерода
плохо растворяются в воде. Многие органические
соединения, содержащие атомы электроотрицательных
элементов, как, например, кислорода или
азота, растворимы в воде. В качестве примера
укажем этанол С2Н5ОН, уксусную кислоту
СН3СООН, сахар С12Н22О6 и диэтиламин (C2H5)2NH.
Простые ковалентные
соединения, как, например, диоксид серы,
аммиак и хлороводород, растворяются в
воде. Кислород, азот и диоксид углерода
плохо растворяются в воде. Многие органические
соединения, содержащие атомы электроотрицательных
элементов, как, например, кислорода или
азота, растворимы в воде. В качестве примера
укажем этанол С2Н5ОН, уксусную кислоту
СН3СООН, сахар С12Н22О6 и диэтиламин (C2H5)2NH.
Присутствие в воде нелетучих растворенных веществ, например хлорида натрия или сахара, понижает давление пара и температуру замерзания воды, но повышает ее температуру кипения.
|
Происхождение воды на Земле.
Известно, что вода является
основным элементом,
В статье представлены астрономические,
геологические и физические данные,
указывающие на то, что вода на Земле
появилась вследствие падения на
неё в далёком прошлом большого
космического тела. Это тело состояло
практически полностью из водяного льда
с примесью органики и имело массу порядка
1022 Кг.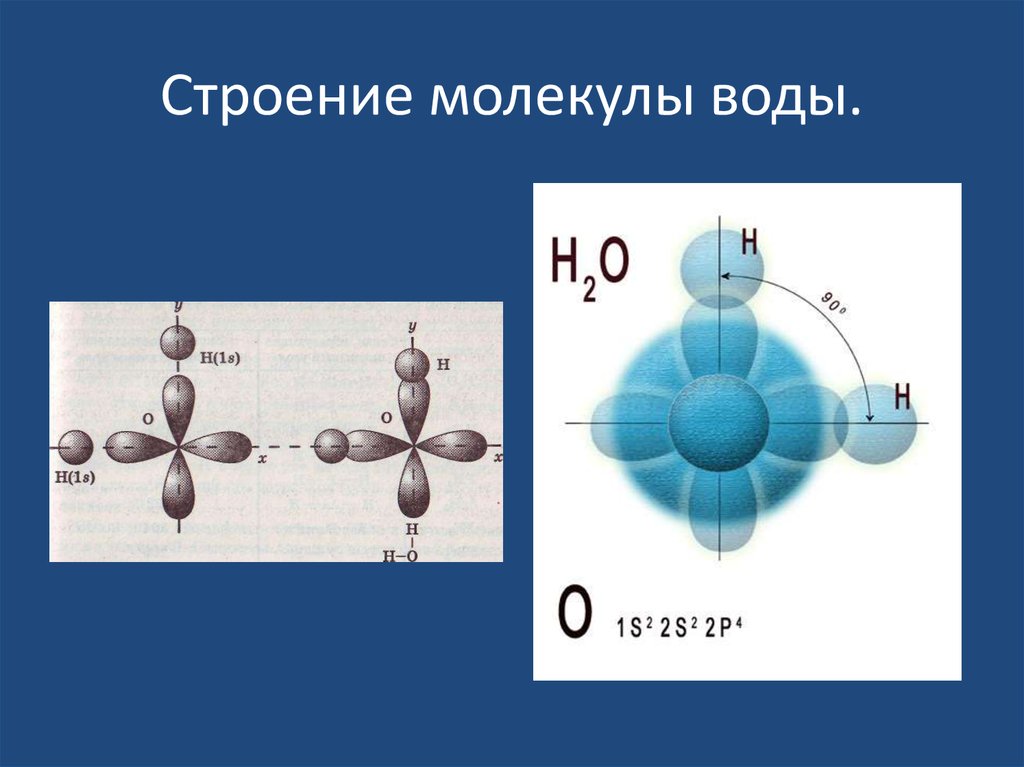 Тело упало в районе, где в настоящее
время находится Тихий Океан, далее шёл
медленный переходный процесс таяния
льда и перераспределения воды, как по
земной поверхности, так и движения её
вглубь планеты. Данный процесс продолжается
и в настоящее время и является причиной,
вызывающей наблюдаемое движение материков
и периодически повторяющихся землетрясений.
Тело упало в районе, где в настоящее
время находится Тихий Океан, далее шёл
медленный переходный процесс таяния
льда и перераспределения воды, как по
земной поверхности, так и движения её
вглубь планеты. Данный процесс продолжается
и в настоящее время и является причиной,
вызывающей наблюдаемое движение материков
и периодически повторяющихся землетрясений.
Астрономический аспект
К настоящему времени получено большое количество данных о физическом состоянии и пространственных параметрах тел, населяющих солнечную систему.
Следует определить место, где могло сформироваться интересующее нас тело, и указать на причину, способствовавшую попаданию его на Землю.
Исследованиями установлено, что большинство спутников планет гигантов состоят из водяного и других льдов и имеют подходящую массу, особенно у дальних спутников, чтобы стать прототипом предполагаемого тела.
По орбитальным характеристикам
среди спутников больших планет выделяются
дальние нерегулярные и внутренние, регулярные
тела.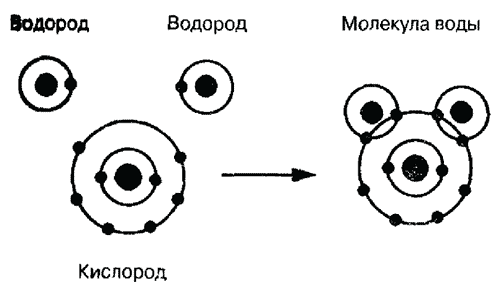 Например, особенностью в строении
системы Юпитера является наличие двух
групп дальних спутников на близких орбитах.
Не могут ли быть данные тела фрагментами
некогда существовавших массивных спутников?
Ведь это может свидетельствовать о том,
что солнечная система испытала мощное
возмущение на определённом этапе эволюции,
которое и привело к появлению крупного
ледяного тела, упавшего в последствие
на Землю.
Например, особенностью в строении
системы Юпитера является наличие двух
групп дальних спутников на близких орбитах.
Не могут ли быть данные тела фрагментами
некогда существовавших массивных спутников?
Ведь это может свидетельствовать о том,
что солнечная система испытала мощное
возмущение на определённом этапе эволюции,
которое и привело к появлению крупного
ледяного тела, упавшего в последствие
на Землю.
Обратим внимание на физические особенности состава планет земной группы и ближайших к Юпитеру спутников.
Исследования показали, что в
их составе преобладают скальные
породы. Это скорее всего свидетельствует
о том, что данные космические
объекты формировались при температуре
порядка 3000 К и были, по-видимому, первоначально
в расплавленном состоянии. При их образовании
вещество было в значительной степени
дегазировано. Лишь после того, как Солнце
уменьшило свою светимость, они стали
медленно остывать. Остывание сопровождалось
вулканической активностью.
Видимо, первоначально состав атмосфер планет земной группы был близок и содержал в основном СО2 и N2.
И вот на Землю, находившуюся в горячем состоянии, упало ледяное космическое тело. Модель процесса можно представить так. Ледяное тело с массой порядка 1022 Кг приближается к расплавленной Земле, покрытой корой и окружённой первичной атмосферой. Относительная скорость сближения предполагается 10 Км/сек.
Оно падает на Землю в районе современного Тихого Океана. Происходит неупругий удар. Энергия соударения расходуется на деформацию тела и возбуждение поверхностной волны в теле планеты. Происходит сброс импульса, при котором с противоположной стороны отделяется Луна.
Космические исследования выявили тот факт, что на Луне отсутствует вода, а поверхность обратной стороны Луны сложена более древними породами, чем видимая.
Затем произошло преобразование атмосферы,
из которой был вымыт углекислый
газ. Это привело к накоплению
древних карбонатов в основном в
окаймлении Тихого Океана.
Можно предположить, что большая часть поверхности Земли была покрыта ледником, а современные континенты находились в тесном контакте. И только в течение дальнейшей длительной эволюции Земля пришла к современному виду. Большую роль при этом, видимо, играл процесс таяния и перераспределения воды.
Кроме того, если в космическом теле находилась органика и некие эмбрионы жизни, то с появлением воды сразу же начался процесс становления жизни на планете.
В литературе можно найти данные по современному состоянию атмосфер планет земной группы и распределению летучих соединений. Оказывается, что на Марсе и Венере атмосферы состоят из СО2 и N2, и отсутствует большое количество воды на поверхности. На Земле основной составляющей атмосферы является N2 и наблюдается большое количество воды на поверхности. Углекислота входит в основном в состав горных пород.
Следует отметить, что количество СО2 и N2 на Земле и Венере одного порядка.
Конечно, такое событие должно было
сказаться на геологической истории Земли.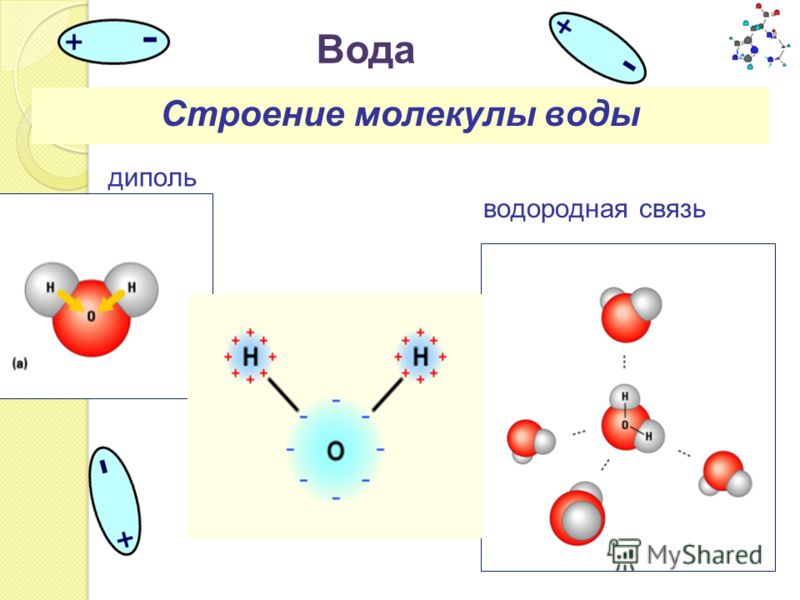
Геологический аспект
Становление исторической
Разработка методов петрографии позволила реконструировать термобарические условия, необходимые для формирования тех или иных структурных образований в породах. Изучение останков живых организмов дала возможность судить о динамике континентов и об этапах становления жизни.
Геологами были выявлены
периоды диастрофизма или
Молекула воды
Вода
(оксид водорода) Н2О
– простейшее устойчивое соединение
водорода с кислородом. Молекулярная
масса воды 18,0160, на водород приходится
11,19% по массе, а на кислород – 88,81%.
Как ранее говорилось, в природе существует три изотопа водорода – легкий водород Н1, дейтерий D (Н2) и тритий (Н3) и три изотопа кислорода – О16, О17 и О18. Искусственно получены в ускорителях сверхтяжелые изотопы водорода Н4 и Н5 и шесть изотопов кислорода: три легких – О13, О14, О15, два тяжелых – О19, О20 и один сверхтяжелый – О24. Теоретически пять изотопов водорода и девять изотопов кислорода могут образовать 135 разновидностей молекулы воды, из которых устойчивыми являются девять, включающих стабильные изотопы. В природной воде на долю О16 приходится 99,75% по массе, на долю О18 – 0,2%, на О17 – 0,04% и на Н1Н2О16 – примерно 0,093%; остальные пять разновидностей присутствуют в ничтожных количествах [4].
Молекула
воды имеет угловое строение: входящие
в её состав ядра образуют равнобедренный
треугольник, в основании которого
находятся два водорода, а в вершине –
атом кислорода.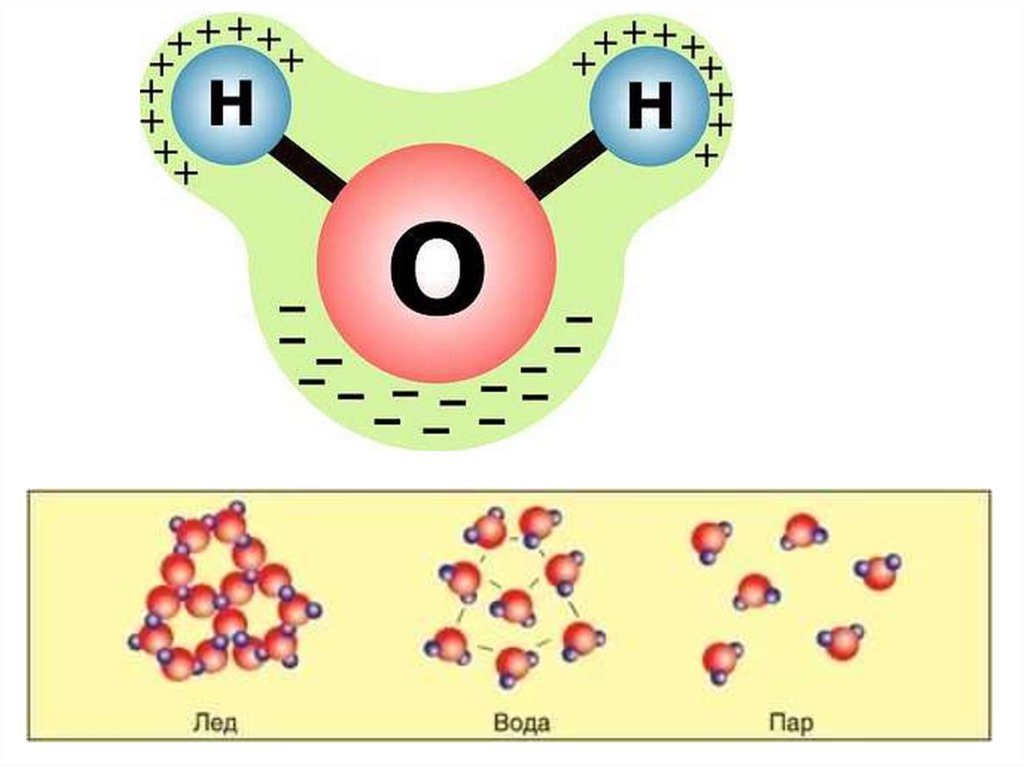 Межъядерные расстояния
О – Н близки к 0,1 нм, расстояние между
ядрами атомов водорода равно 0,15 нм. Из
шести электронов, составляющих внешний
электронный слой атома кислорода в
молекуле воды, две электронные пары
образуют ковалентные связи О-Н, а
остальные четыре электрона представляют
собой две неподелённые электронные
пары (рисунок 1).
Межъядерные расстояния
О – Н близки к 0,1 нм, расстояние между
ядрами атомов водорода равно 0,15 нм. Из
шести электронов, составляющих внешний
электронный слой атома кислорода в
молекуле воды, две электронные пары
образуют ковалентные связи О-Н, а
остальные четыре электрона представляют
собой две неподелённые электронные
пары (рисунок 1).
Рисунок 1 – Модели строения молекулы воды [3]
Молекула
воды представляет собой маленький
диполь, содержащий положительный и
отрицательный заряды на полюсах. Около
ядер водорода имеется недостаток
электронной плотности, а на противоположной
стороне молекулы, около ядра кислорода,
наблюдается избыток электронной
плотности. Именно такая структура и
определяет полярность молекулы воды.
Если соединить прямыми линиями эпицентры
положительных и отрицательных зарядов,
получится объемная геометрическая
фигура – правильный тетраэдр (рисунок
1) [19,20].
С позиций метода валентных связей образование химических связей в молекуле воды можно объяснить за счёт перекрывания двух одноэлектронных p-облаков атома кислорода и одноэлектронных s-облаков двух атомов водорода. Ввиду того что участвующие в образовании химических связей p-облака кислорода расположены относительно друг друга под углом в 90, валентный угол НОН должен был также соответствовать этому значению. Однако в действительности он состовляет 104,5. Отклонение валентного угла от ожидаемого можно объяснить с двух позиций.
Согласно одной из них увеличение валентного угла с 90 до 104,5можно объяснить отталкиванием атомов водорода, который вследствие большой разности в электроотрицательности с кислородом (разность составляет 1,4 по шкале Полинга) приобретают в молекуле воды частичный положительный заряд (плюс 0,33 на каждом атоме). Эффективный заряд атома кислорода составляет минус 0,66.
С
точки зрения концепции гибридизации
атом кислорода должен находится в
состоянии sp3-гибридизации,
в которой принимают участие две орбитали
с неподелёнными электронными парами и
две орбитали, осуществляющие связи с
водородом.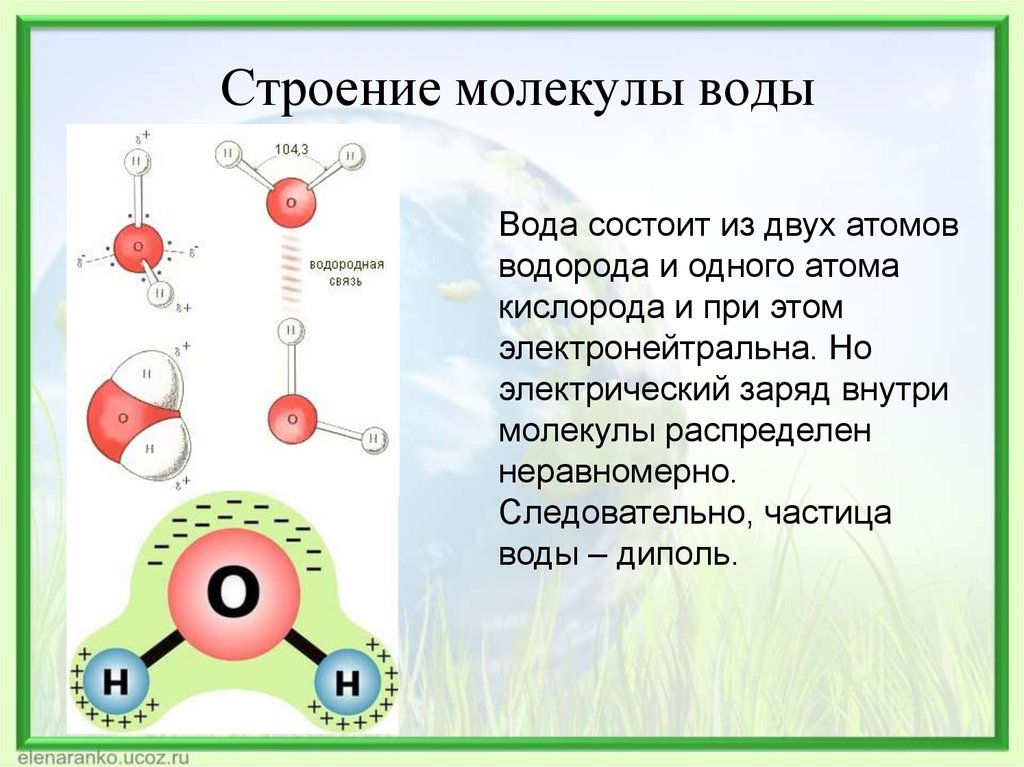 В соответствии с этим валентный
угол между тетраэдрически расположенными
в пространстве орбиталями кислорода
должен составить порядка 109,5.
Отклонение валентного угла НОН от
тетраэдрического можно объяснить тем,
что электронные пары связи О – Н занимают
в пространстве меньший объём, чем
неподелённые пары кислорода [3].
В соответствии с этим валентный
угол между тетраэдрически расположенными
в пространстве орбиталями кислорода
должен составить порядка 109,5.
Отклонение валентного угла НОН от
тетраэдрического можно объяснить тем,
что электронные пары связи О – Н занимают
в пространстве меньший объём, чем
неподелённые пары кислорода [3].
Особенности строения молекулы воды имеют важные следствия.
Во-первых, из-за неравномерности распределения электронной плотности валентных электронов молекула Н2О представляет собой диполь с отрицательным полюсом на кислороде и положительным со стороны атома водорода. Дипольный момент воды составляет 6,1710-30 Клм. Это достаточно большая величина. Для сравнения, дипольный момент метана равен 0, аммиака – 4,4410-30 Клм.
Во-вторых, большой дипольный момент воды является причиной возникновения диполь-дипольных и ион-дипольных взаимодействий в водных растворах.
В-третьих,
молекула воды образует водородные
связи.
В-четвёртых, неподелённые электронные пары кислорода позволяют Н2О выступать в качестве лиганда с образованием комплексных соединений [3].
Вода имеет очень высокие температуры замерзания (0) и кипения (100) (рисунок 2). Это позволяет ей существовать во всех агрегатных состояниях: твердом (лед), жидком (вода) и газообразном (пар) (рисунок 3).
Рисунок 2 – Аномалии точек кипения и замерзания воды
Рисунок 3 – Агрегаты состояния воды: а – лед, б – вода, в – пар [2]
Из
одиночных молекул вода состоит в
парообразном состоянии. При температуре
ниже температуры кипения, когда
кинетическая энергия молекул становится
ниже их потенциальной энергии
взаимодействия, вода, как и любое вещество
в этом случае, переходит в жидкое
состояние. Но температура этого фазового
перехода для воды почти на 200выше, чем это следовало бы ожидать из
характера того межмолекулярного
взаимодействия, которое должно
осуществлять между подобными ей по
составу молекулами, например сероводорода.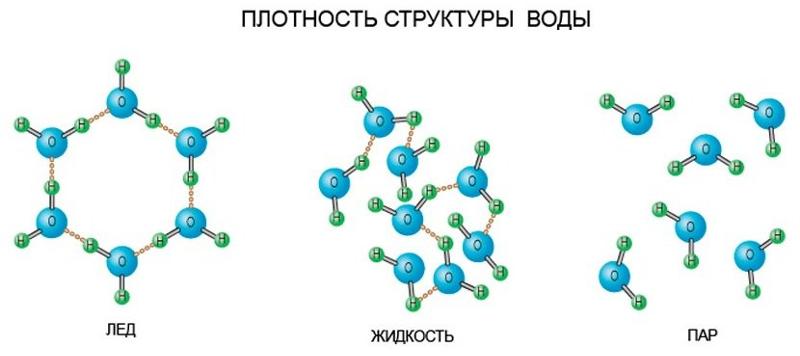
Высокая полярность воды является лишь одной из причин ассоциации молекул воды, которые могут комбинироваться по две, три и более вследствие взаимного притяжения противоположно заряженных концов диполя [3].
Главной причиной образования ассоциатов (Н2О)х являются водородные связи [3]. В твердом состоянии атом кислорода каждой молекулы воды образует две водородные связи (показаны пунктиром) с соседними молекулами по схеме (рисунок 4) [4]. Благодаря им жидкая вода – это не разупорядоченное движение молекул, а состояние, близкое к аморфному. В нём молекулы воды ассоциированы в агрегаты (Н2О)х – кластеры со степенью ассоциации () до 130 молекул воды при 0, до 90 – при 20, до 60 – при 72(рисунок 5) [3].
Рисунок 4 – Схема образования водородных связей [4]
Рисунок 5 – Некоторые возможные структуры кластеров воды
Время
жизни таких кластеров небольшое (10-11 – 10-10 с). В их образовании участвуют не все
молекулы, иначе бы их плотность в жидком
состоянии должна была бы составить не
1
г/см3,
а 1,84 г/см3.
Последняя величина рассчитана из
предположения плотной упаковки молекул
Н2О
с радиусом, равным 1,38
,
который определен из размеров
кристаллической решетки льда [3].
В их образовании участвуют не все
молекулы, иначе бы их плотность в жидком
состоянии должна была бы составить не
1
г/см3,
а 1,84 г/см3.
Последняя величина рассчитана из
предположения плотной упаковки молекул
Н2О
с радиусом, равным 1,38
,
который определен из размеров
кристаллической решетки льда [3].
Схема
кристаллической решетки льда представлена
на рисунке 6. Каждая молекула Н2О
(черные шарики) окружена тетраэдрически
четырьмя другими молекулами – тремя
из того же слоя и одной из соседнего
слоя молекул. Структура льда является
наименее плотной структурой. Ее
особенность заключается в наличии
пустот, размеры которых превышают
размеры молекул Н2О.
При плавлении льда часть водородных
связей разрушается, и в пустотах
оставшихся агрегатов могут разместиться
отдельные молекулы воды, вследствие
чего достигается более плотная упаковка
молекул. Поэтому при плавлении льда
объем воды уменьшается, а плотность
возрастает.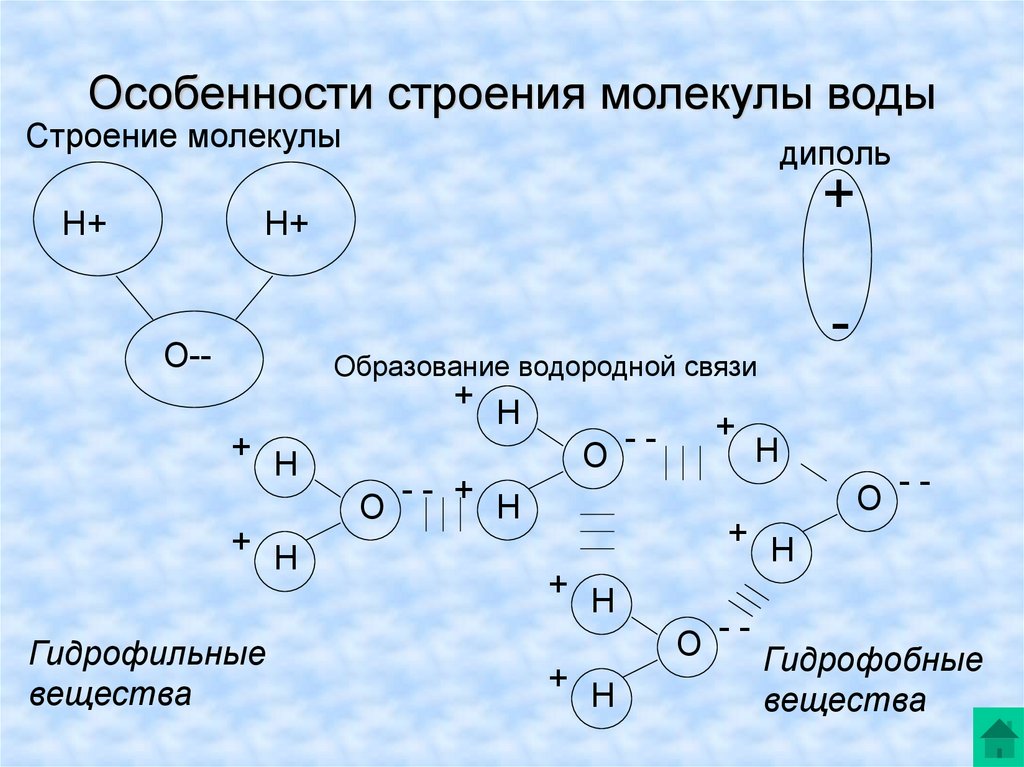
Рисунок 6 – Кристаллическая решетка льда [4]
Молекулярная структура воды (с диаграммой)
Навигация
Статья поделилась
РЕКЛАМА:
Вода является наиболее распространенным неорганическим соединением в живых системах. Содержание воды в организме связано с его возрастом и метаболической активностью.
Например, количество воды самое высокое у эмбриона (90-95%) и постепенно уменьшается у взрослых и пожилых людей.
Вода составляет 70-90% живых клеток. Почти 90-95% тела суккулентов составляет вода. У человека около двух третей тела состоит из воды, из них около 55% (20-22 литра) заключено внутри клеток в виде внутриклеточной жидкости (ВКЖ), а остальные 45% существуют в виде внеклеточной жидкости (ВКЖ), такой как кровь. , лимфа, тканевая жидкость и др.
РЕКЛАМА:
В клетке вода существует в двух формах: свободной и связанной. Свободная вода составляет 95% всей клеточной воды, которая используется в качестве природного растворителя. Связанная вода составляет всего 4-5% от общего количества клеточной воды, которая слабо связана с биомолекулами водородными связями и другими силами.
Связанная вода составляет всего 4-5% от общего количества клеточной воды, которая слабо связана с биомолекулами водородными связями и другими силами.
Молекулярная структура воды:
Молекула воды (H 2 O) имеет треугольную геометрию с длиной связи O-H 0,0965 нм и углом связи H-O-H 104,5°. Хотя вода в целом электрически нейтральна, она ведет себя как электрический диполь. Это потому что; атом кислорода более электроотрицательный, чем атомы водорода, поэтому он притягивает электроны от ядер водорода. Это дает атому кислорода два частичных отрицательных заряда (δ-), в то время как каждый атом водорода несет частичный положительный заряд (δ+).
В чистой жидкой воде каждая молекула H 2 O связана водородной связью в среднем с 3,4 соседними молекулами H 2 O по сравнению с 4 во льду. Водородная связь представляет собой слабую нековалентную связь, в которой атом водорода разделяется двумя другими атомами, то есть донором водорода (тесно связанным с водородом) и акцептором водорода. В биологических системах донором водорода является атом кислорода (как в воде) или атом азота (как в белке или в парах азотистых оснований).
В биологических системах донором водорода является атом кислорода (как в воде) или атом азота (как в белке или в парах азотистых оснований).
ОБЪЯВЛЕНИЙ:
Молекулы воды временно объединяются в решетку с водородными связями. Даже при температуре 37°C 15% молекул воды соединены с четырьмя другими в короткоживущую сборку, известную как «мерцающий кластер». Связная природа воды отвечает за многие ее необычные свойства, такие как высокое поверхностное натяжение, удельная теплоемкость и теплота парообразования.
Длина водородной связи составляет от 0,26 до 0,31 нм, что является промежуточным значением между ковалентной связью и связью Вандер-Ваальса. Энергия водородной связи в воде составляет около 5 ккал/моль, что сильнее связи Вандер-Ваальса (1 ккал/моль) и слабее ковалентной связи Н-О (1·10 ккал/моль).
При растворении неорганических солей в воде они диссоциируют на катионы и анионы. Каждый ион окружен слоем ориентированных диполей воды, называемым гидратной оболочкой. Толщина водородной оболочки у более мелких ионов больше, чем у более крупных, несущих такое же количество электрического заряда.
Толщина водородной оболочки у более мелких ионов больше, чем у более крупных, несущих такое же количество электрического заряда.
Эссе о витаминах: жиро- и водорастворимые витамины
Растительные гормоны и их типы
Это форум вопросов и ответов для студентов, преподавателей и обычных посетителей для обмена статьями, ответами и заметками. Ответьте сейчас и помогите другим.
Ответить сейчас
Вот как это работает:
- Любой может задать вопрос
- Любой может ответить
- Лучшие ответы голосуются и поднимаются на вершину
Чертеж для включения сложных химических концепций | Новости
Предложите учащимся нарисовать диаграммы, чтобы помочь им освоить химические понятия.
Многие химические понятия могут быть представлены более чем одним способом, каждый из которых дает разную информацию. Например, структура молекулы может быть представлена в виде формулы, двухмерного структурного чертежа, шаростержневой модели или модели, заполняющей пространство. Эти множественные представления часто являются источником путаницы для студентов.
Множественные представления
В некоторых случаях мы предлагаем учащимся предварительно построенные диаграммы для интерпретации. Например, это может быть научное оборудование для поддержки практической работы или диаграммы на уровне частиц, которые помогут учащимся связать макроскопические и субмикроскопические области.
Источник: © Любава Матвеева/500px/Getty Images
Понимают ли ваши ученики водородные связи в снежинке? Почему бы не заставить их рисовать, чтобы узнать
Когда учащиеся сами создают диаграммы, это способствует развитию навыков наблюдения и рассуждения.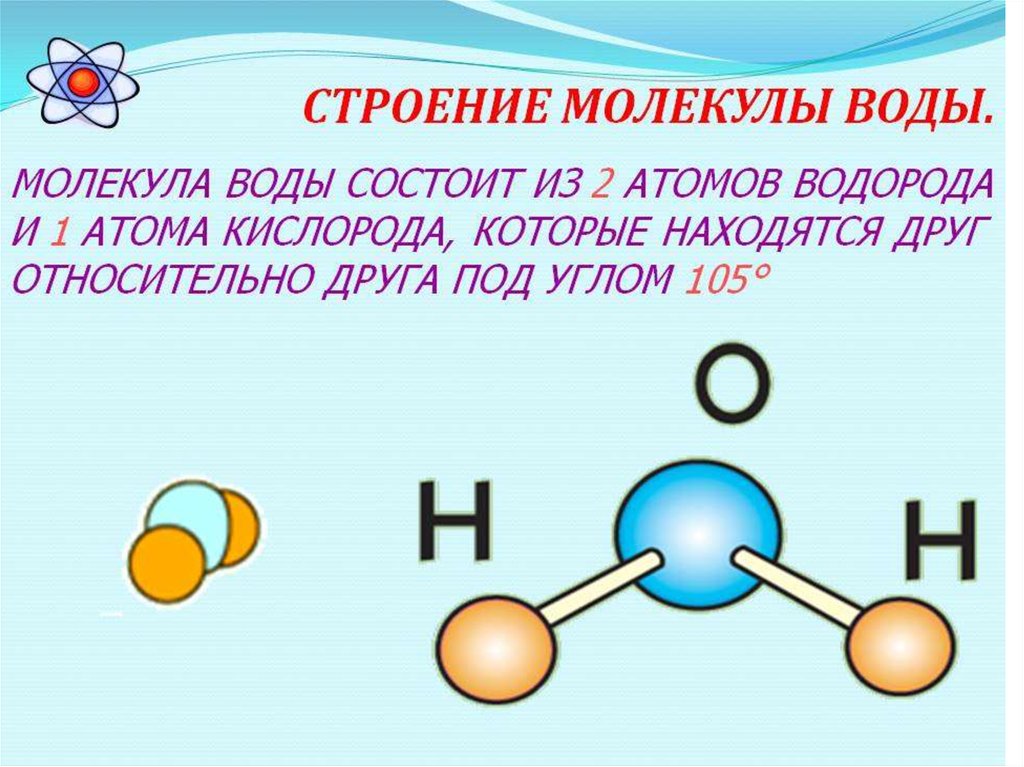 Это может развить их ментальные модели научных явлений, поскольку им необходимо выбрать ключевые пространственные особенности и представить их в визуальной форме. Развитие этих навыков можно использовать в качестве средства оценки.
Это может развить их ментальные модели научных явлений, поскольку им необходимо выбрать ключевые пространственные особенности и представить их в визуальной форме. Развитие этих навыков можно использовать в качестве средства оценки.
Несмотря на сложность, использование нескольких представлений полезно для учащихся. Каждая форма имеет различные характеристики, которые передают дополнительную информацию о понятии. Рисование диаграмм помогает учащимся конструировать, систематизировать и сообщать о своем понимании этих концепций. Затем они могут справиться с проблемой накопления разрозненных знаний, разработать стратегии решения проблем и добиться более глубокого понимания сложных научных концепций.
Проблема множественных представлений значительно усложняется, когда требуется множество различных фундаментальных химических понятий, необходимых для объяснения другого — например, понятия водородных связей в воде. Как вы кодируете информацию об электроотрицательности, молекулярной форме, молекулярной ориентации и неподеленных парах электронов в единую диаграмму, которая формирует последовательное объяснение?
Новое исследование ученых из Австралии и Тайваня дает ответ на этот вопрос. В нем они используют созданные учащимися диаграммы для изучения концептуального понимания учащимися природы водородных связей между молекулами воды в снежинках.
В нем они используют созданные учащимися диаграммы для изучения концептуального понимания учащимися природы водородных связей между молекулами воды в снежинках.
Советы преподавателям
- Учащимся следует чаще рисовать диаграммы. Это может выявить ментальные модели учащихся и потенциальные альтернативные концепции.
- Диаграммы могут быть особенно полезны для учащихся, которые не освоили правильную научную терминологию, поскольку они предоставляют им еще один способ сообщить о своем понимании.
- Вы можете использовать подсказки для интервью из опубликованной статьи в своей практике, чтобы оценить понимание учащимися водородных связей. Вы также можете использовать их в качестве руководства для разработки собственных подсказок для других понятий химии.
- Это исследование предполагает, что преподаватели должны знать о проблемах, связанных с пониманием направленности водородных связей из-за положения неподеленных пар электронов и положения атома водорода.
 Вы можете найти больше представлений о водородных связях в статье.
Вы можете найти больше представлений о водородных связях в статье.
Межмолекулярный вызов
Исследователи использовали серию подсказок в виде лесов для опроса студентов первого и второго курсов университета. Эти подсказки постепенно напоминали учащимся об идее водородных связей в снежинке и превращались в явную подсказку, иллюстрирующую систему из нескольких молекул воды, связанных водородными связями, на диаграмме.
Диаграммы 60 из этих интервью и стенограммы интервью были проанализированы с использованием индуктивного подхода, в результате чего были созданы различные категории, относящиеся к представлениям учащихся о водородных связях в снежинке. Анализ выявил несколько трудностей, с которыми сталкиваются студенты, и новые альтернативные концепции водородных связей.
Большинство учащихся смогли адекватно представить изогнутую структуру молекулы воды на своих диаграммах и указать ковалентный характер внутримолекулярных связей. Однако диаграммы показали, что студенты по-разному представляли себе межмолекулярные водородные связи.
Рисунки, созданные учащимися, были успешно использованы для проверки их концептуального понимания
Половина диаграмм учащихся правильно иллюстрирует концепцию водородной связи, включая свидетельства того, что она является межмолекулярной, электростатической и направленной. Однако другая половина выявила альтернативные представления о строении воды, природе межмолекулярных взаимодействий и специфическом участии неподеленных пар электронов. Например, на диаграммах некоторых студентов предполагалось, что атомы кислорода двух разных молекул воды могут водородно связываться с одним и тем же водородом.
Диаграммы других студентов предполагали, что обе неподеленные пары электронов на кислороде могут совместно участвовать в одиночной водородной связи без необходимости точного направления.
Даже диаграммы, которые иллюстрировали правильное понимание водородных связей, показали, что учащиеся изо всех сил пытаются представить молекулярные взаимодействия в 3D.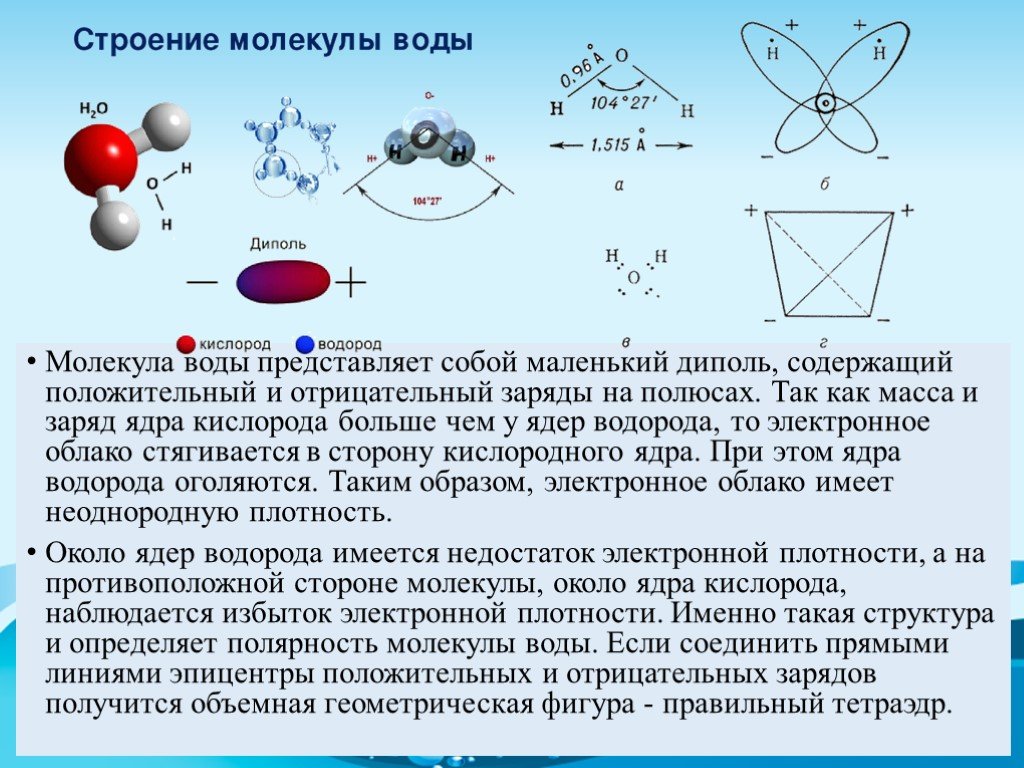 Водородная связь является абстрактным понятием, которое является фундаментальным в химии. Согласованное понимание зависит от хорошего понимания молекулярной формы, электроотрицательности и распределения электронов в молекулах. Таким образом, исследователи успешно использовали созданные студентами рисунки о водородных связях в снежинках, чтобы проверить их концептуальное понимание.
Водородная связь является абстрактным понятием, которое является фундаментальным в химии. Согласованное понимание зависит от хорошего понимания молекулярной формы, электроотрицательности и распределения электронов в молекулах. Таким образом, исследователи успешно использовали созданные студентами рисунки о водородных связях в снежинках, чтобы проверить их концептуальное понимание.
Задание для детей старше 16 лет с использованием мини-досок
Вы можете использовать методы, примененные в исследовании, в качестве занятий для детей старше 16 лет с мини-досками.
- Начните с показа учащимся увеличенных изображений снежинок и спросите, что они замечают в их форме.
- Предложите учащимся нарисовать одну молекулу воды в центре доски и показать ее вам.
- Обсудите неправильные представления, следя за тем, чтобы все учащиеся закончили с правильной V-образной геометрией.
- Попросите их добавить вторую молекулу воды, показав, как она взаимодействует с первой, включая использование неподеленных пар и диполей.
 Объясните причины, лежащие в основе взаимодействия.
Объясните причины, лежащие в основе взаимодействия. - Затем попросите учащихся нарисовать как можно больше молекул воды, взаимодействующих с исходной молекулой. Когда они выполнили задание, у каждого из них должно быть в общей сложности четыре молекулы с водородными связями. Особо хвалите тех, кто передает трехмерную информацию в своем рисунке.
- Распространенным заблуждением является то, что водородные связи являются внутримолекулярными связями с атомами водорода. Попросите студентов четко обозначить водородные связи на своих диаграммах, чтобы исключить это заблуждение.
- Трудно передать трехмерное расположение молекул воды на чертеже, поэтому постарайтесь использовать модель в качестве эталона для иллюстрации решетки.
- По завершении задания учащиеся должны быть в состоянии связать кристаллическую природу снежинок с субмикроскопическим расположением молекул воды.
Ссылка
H Matovu и др. , Chem.


 Число электронов в каждой оболочке
для атома каждого элемента строго определенное.
Так, у атома водорода лишь одна оболочка
с единственным электроном, а у атома кислорода
две оболочки: внутренняя с двумя электронами
и внешняя с шестью. Образование молекулы воды
из двух атомов водорода и одного атома
кислорода показано на рис. 1.
Число электронов в каждой оболочке
для атома каждого элемента строго определенное.
Так, у атома водорода лишь одна оболочка
с единственным электроном, а у атома кислорода
две оболочки: внутренняя с двумя электронами
и внешняя с шестью. Образование молекулы воды
из двух атомов водорода и одного атома
кислорода показано на рис. 1. 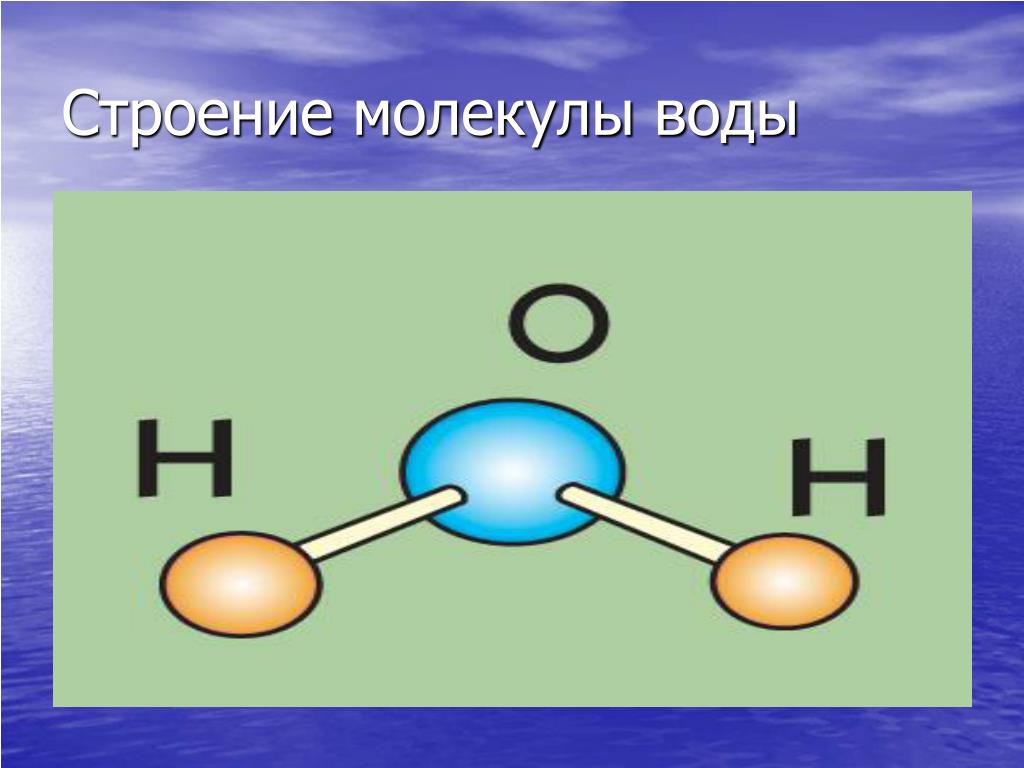 Последняя у воды весьма
велика и определяет интенсивность растворения
водой различных веществ. При 0 °С диэлектрическая
проницаемость воды (в твердой фазе) составляет
74,6; с повышением температуры она падает.
Последняя у воды весьма
велика и определяет интенсивность растворения
водой различных веществ. При 0 °С диэлектрическая
проницаемость воды (в твердой фазе) составляет
74,6; с повышением температуры она падает.  3). Последнее может быть спокойным
или возбужденным, что зависит, в частности,
и от температуры. Отсюда разнобой в значениях
вычисленных радиусов, а также схематичность
гипотетических моделей атомов и молекул.
3). Последнее может быть спокойным
или возбужденным, что зависит, в частности,
и от температуры. Отсюда разнобой в значениях
вычисленных радиусов, а также схематичность
гипотетических моделей атомов и молекул.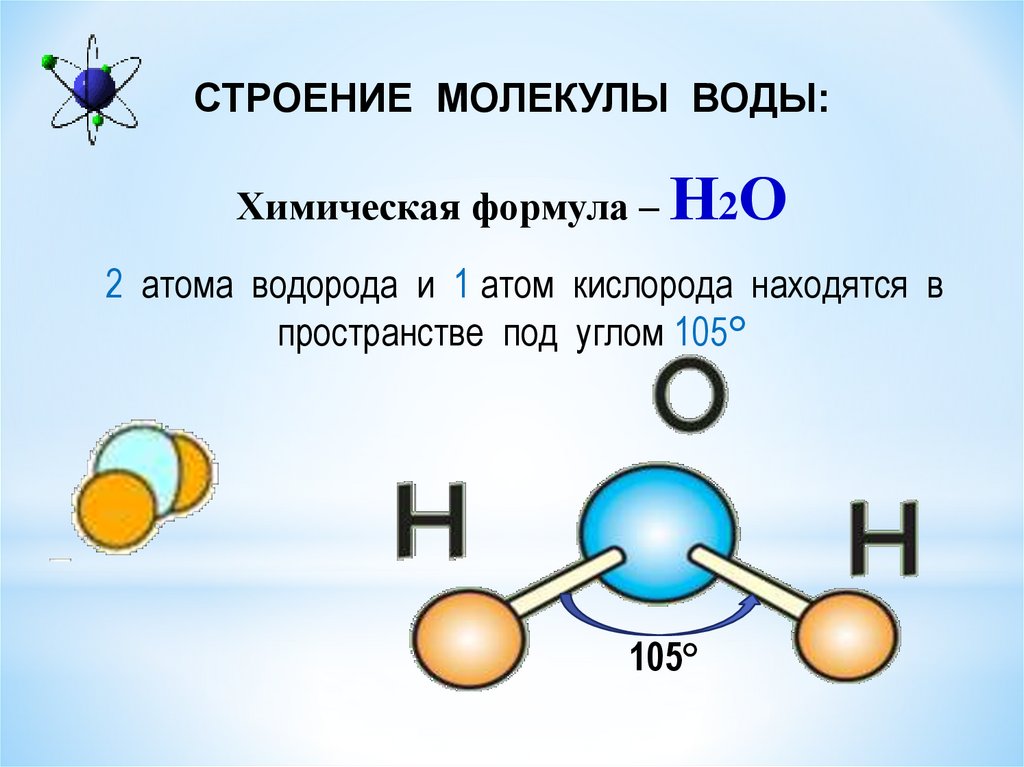 Вы можете найти больше представлений о водородных связях в статье.
Вы можете найти больше представлений о водородных связях в статье.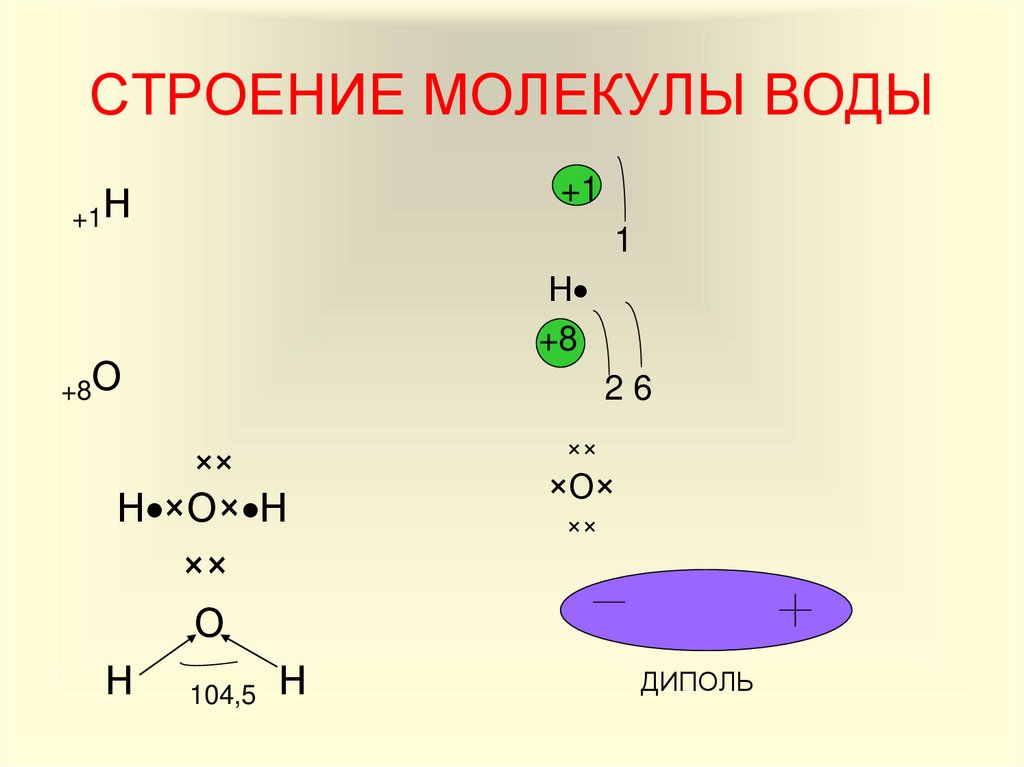 Объясните причины, лежащие в основе взаимодействия.
Объясните причины, лежащие в основе взаимодействия.