CHEM 245 — Вода
ТЕМЫ БИОХИМИИ
Вода
Вода 101. Дальнейшие последствия использования воды как биологического растворителя.
Вода (H 2 O) — знакомое, но увлекательное вещество. Это дает нам возможность рассмотреть свойства трех фаз материи — газообразная, жидкая и твердая фазы — на знакомом и важном примере. Вода является одновременно кислотой и основанием, и является эффективным катализатором реакций переноса протона. Вода играет центральную роль в жизни и биохимических процессах, происходящих в живых организмах. Поскольку большая часть земной поверхности покрыта водой, ее свойства оказывают огромное влияние. на планетарную среду, позволяющую и поддерживающую развитие биосферы.
Структура молекулы воды
Для начала давайте создадим структуру Льюиса для молекулы воды на основе ее молекулярного
формула, H 2 O. Символы Льюиса для элементов
показаны на панели (а) ниже: кислород имеет шесть валентных электронов, а водород только один.
На панели (b) показано, как соединить три атома вместе, чтобы сформировать полный октет для центрального
атом кислорода. Водород, как элемент с периодом 1, может разместить только два электрона в своей валентности.
оболочки и образует только одну связь. На панели (c) мы применили символическое соглашение, согласно которому два общих электрона, образующих химическую связь между атомами, могут быть представлены линией. Имея действительную структуру Льюиса, мы можем сделать вывод о молекулярной геометрии молекулы воды. Октет центрального кислорода можно рассматривать как состоящий из четырех электронных доменов, двух связывающих пар и двух несвязывающих «одиноких пар». Применение теории VSEPR к этой конфигурации приводит к выводу, что эти четыре электронных домена — в первом приближении — расположены вокруг центрального кислорода в виде тетраэдра. Основной вывод, который из этого следует, заключается в том, что расположение атомов в молекуле H-O-H не прямолинейное, а изогнутое, при этом валентный угол должен быть близок к тетраэдрическому значению, 1090,5°.
То, что мы называем «формой молекулы», — это то, что мы видим, когда смотрим только на атомы, из которых состоит молекула. Экспериментальные методы, такие как рентгеновская кристаллография, которые могут определить положение атомов в молекулах, позволяют определить форму молекулы воды. На приведенных ниже диаграммах представлена экспериментально определенная молекулярная форма.
В соответствии с нашим анализом с использованием формализма Льюиса, вода имеет угловатую или изогнутую форму с валентным углом HOH, равным 104,5 °. Это согласуется с примерно тетраэдрической ориентацией четырех электронных доменов вокруг центрального кислорода, двух связывающих пар и двух несвязывающих «неподвижных пар».
Длина связи HO составляет 0,958 Å (1 Å = 10 -10 м). Поскольку кислород значительно более электроотрицательный, чем водород, большая часть отрицательного заряда электронов в связывающей паре сосредоточена вблизи кислорода. Это небольшое разделение зарядов вдоль оси отдельной связи (обозначаемое обозначением δ) создает связь диполь . Диполи связи можно рассматривать как векторов
Выше : два изображения молекулярной формы молекулы воды: шарообразная (вверху) и заполняющая пространство (внизу). Кислород — это центральный атом, показанный красным цветом, а атомы водорода — светло-серым.
Если молекула имеет ненулевой дипольный момент. говорят, что это полярный или иметь полярность . Для геометрии молекулы воды компоненты диполя связи, параллельные линии, разделяющей пополам угол связи HO (пунктирная вертикальная линия на рисунке), складываются вместе, а перпендикулярные (горизонтальные) компоненты компенсируются.
Если показать на этих изображениях, неподеленные пары будут выступать вверх от кислорода. вперед из плоскости и назад за плоскость рисунка (см. следующий рисунок ниже).
Свойства воды
Наше рассмотрение свойств воды может служить парадигмой для достижения одной из самых фундаментальных целей изучения химии. То есть ответить на вопрос: как наноразмерные молекулярные свойства воды объясняют свойства, которые мы наблюдаем у вещества в целом, в макроскопическом масштабе? Чтобы ответить на этот вопрос, мы воспользуемся «расширенной» версией структуры Льюиса для молекулы воды, показанной ниже справа.
Учитывая структурную интерпретацию молекулы воды, что межмолекулярных сил могли бы мы предсказать, что они будут играть важную роль в определении
его объемные свойства?
Диаграмма справа показывает геометрию молекулы воды, полярность ее связей,
молекулярный дипольный момент и ориентация неподеленных пар.
Вода не только полярная молекула, но и может образовывать межмолекулярные соединения.
Фактически, вода является образцом в мире молекул с водородными связями. Каждая молекула воды имеет две неподеленные пары, которые служат акцепторами водородных связей, а две связи OH обеспечивают пару доноров водородных связей.
Структура льда
Структура льда показывает способность молекул воды образовывать межмолекулярные водородные связи или Н-связи (обозначены пунктирными линиями на рисунке справа) в ее максимуме. Каждая молекула воды внутри решетки (то есть не на поверхности) образует водородные связи с четырьмя соседями, принимая двух доноров водородных связей у своего центрального атома кислорода и отдавая две водородные связи через два своих атома водорода. Таким образом, каждая внутренняя вода полностью связана водородными связями, а общая структура образует трехмерную гексагональную решетку молекул воды. Обширные водородные связи придают прочность ледяной решетке, но в то же время дают относительно открытую структуру. Это объясняет тот факт, что при температуре плавления или около нее жидкая вода имеет большую плотность, чем лед.
Вода как растворитель
Способность воды действовать как растворитель связана с полярностью молекулы воды, а также с ее способностью образовывать водородные связи с растворенными веществами. Как мы видели, молекула воды полярна, и ее дипольный момент можно представить в виде вектора, делящего пополам валентный угол H-O-H. Дипольный момент молекулы действует аналогично стержневому магниту в магнитном поле. Отрицательный конец диполя будет иметь тенденцию ориентироваться на положительно заряженные частицы, в то время как наличие отрицательного заряда будет притягивать положительный конец диполя. Таким образом, выравнивание диполя с локальным электрическим полем снижает электростатическую потенциальную энергию, что делает выравнивание предпочтительным.
На рисунке справа показано, как это работает для ионов, образующихся в результате растворения хлорида натрия (NaCl) в воде.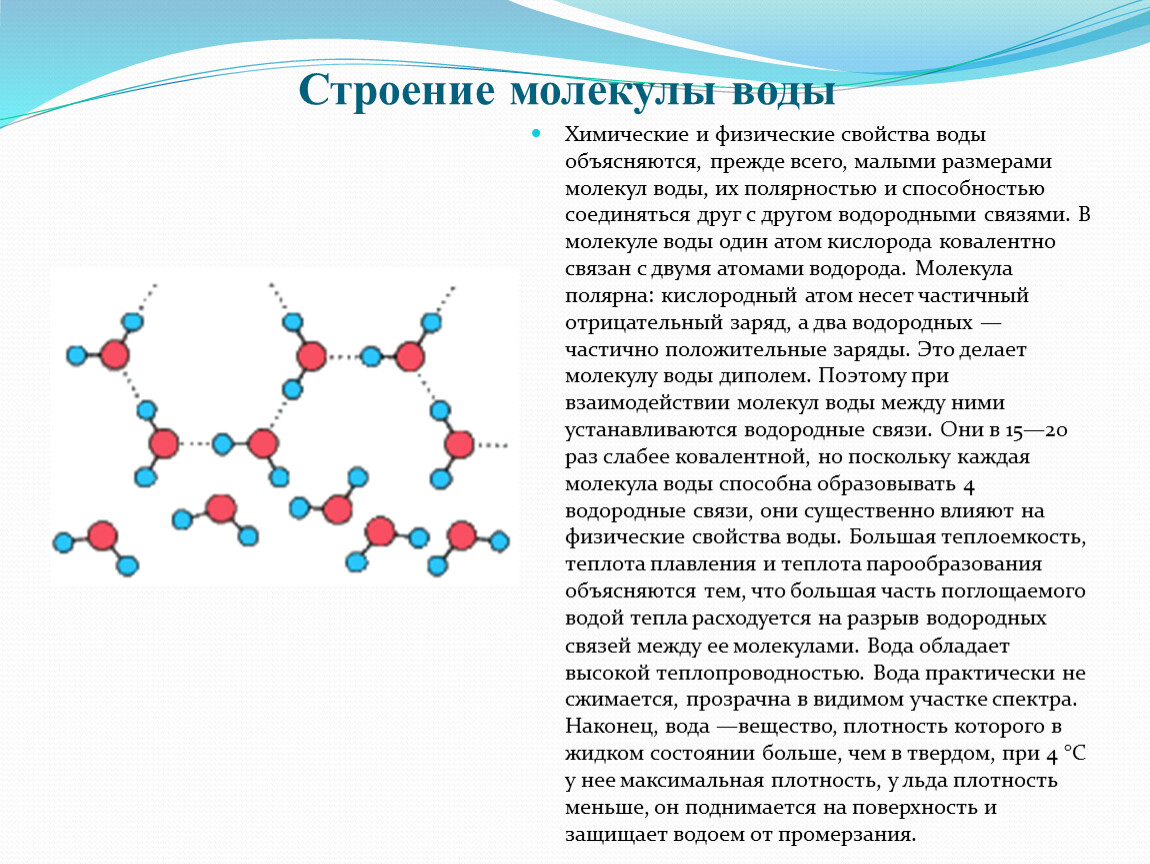 При растворении ионы, составляющие соль, диссоциируют от твердой кристаллической решетки. Благоприятные электростатические взаимодействия ионных связей решетки теряются, повышая потенциальную энергию, но диполь-ионные взаимодействия помогают компенсировать это. Молекулы воды вблизи ионов ориентируют свои дипольные моменты в соответствии с зарядами ионов — положительные концы их диполей в сторону хлорид-аниона; отрицательные концы диполя молекулы воды направлены в сторону катионов натрия. Это называется
При растворении ионы, составляющие соль, диссоциируют от твердой кристаллической решетки. Благоприятные электростатические взаимодействия ионных связей решетки теряются, повышая потенциальную энергию, но диполь-ионные взаимодействия помогают компенсировать это. Молекулы воды вблизи ионов ориентируют свои дипольные моменты в соответствии с зарядами ионов — положительные концы их диполей в сторону хлорид-аниона; отрицательные концы диполя молекулы воды направлены в сторону катионов натрия. Это называется
Растворимость данного ионного соединения в воде в значительной степени определяется
энергетический баланс между ионными связями в твердом состоянии
(плюс водородные связи между молекулами воды в жидком состоянии) по сравнению с ионно-дипольными взаимодействиями
между растворенными и растворяющими веществами в растворе. Мы знаем, что не все ионогенные соединения свободно растворимы в воде.
и мы можем полагаться на эмпирические правила разрешимости чтобы помочь нам ответить на вопрос, растворимо ли данное ионное соединение в воде. Но приведенные выше соображения об энергетике ионных связывающих и несвязывающих взаимодействий во многом определяют правила растворимости. Кроме того, по сравнению с менее полярным растворителем (таким как метанол) или растворителем, не обладающим плаарной активностью (таким как гексан или бензол), вода является гораздо более эффективным растворителем для ионных соединений. Неполярные или слабополярные растворители не так эффективны, как вода, при сольватации диссоциированных ионов, поэтому нам не нужны правила растворимости для ионных соединений в таких растворителях — мы бы однозначно предсказывали, что ионные соединения нерастворимы в неполярных растворителях.
Мы знаем, что не все ионогенные соединения свободно растворимы в воде.
и мы можем полагаться на эмпирические правила разрешимости чтобы помочь нам ответить на вопрос, растворимо ли данное ионное соединение в воде. Но приведенные выше соображения об энергетике ионных связывающих и несвязывающих взаимодействий во многом определяют правила растворимости. Кроме того, по сравнению с менее полярным растворителем (таким как метанол) или растворителем, не обладающим плаарной активностью (таким как гексан или бензол), вода является гораздо более эффективным растворителем для ионных соединений. Неполярные или слабополярные растворители не так эффективны, как вода, при сольватации диссоциированных ионов, поэтому нам не нужны правила растворимости для ионных соединений в таких растворителях — мы бы однозначно предсказывали, что ионные соединения нерастворимы в неполярных растворителях.
Для молекулярных соединений вода обычно является отличным растворителем для соединений с полярными молекулами. и тем более для полярных молекул, способных образовывать Н-связи с молекулами воды.
и тем более для полярных молекул, способных образовывать Н-связи с молекулами воды.
Вода и жизнь
Хотя они достаточно сложны и неоднородны по строению и составу, живые клетки в значительной степени представляют собой водные системы. Тот факт, что вода в основном является жидкостью в широком диапазоне температур, характерных для земной поверхности, и ее способность растворять самые разнообразные соединения, делает возможным существование таких сложных систем. Воду по праву можно назвать растворителем жизни. Конечно, если мы хотим понять биологическую химию, нам следует тщательно изучить свойства воды.
В связи с этим часто упоминается необычное свойство воды образовывать твердое тело с меньшей плотностью, чем в жидком состоянии. Относительно открытая структура льда максимизирует способность водородных связей составляющих его молекул воды, что делает эту открытую структуру энергетически выгодной. Когда лед тает, часть водородных связей разрывается, что позволяет молекулам воды в среднем приближаться друг к другу немного ближе. Таким образом, жидкая вода, находящаяся в равновесии со льдом при 0°С, более плотна, чем лед, который плавает. Вода имеет максимальную плотность в жидком состоянии при температуре 4°C. Это имеет огромные последствия для биосферы Земли. Озера и океаны замерзали бы снизу вверх, если бы лед был плотнее воды. Это привело бы к тому, что большая часть воды на Земле оказалась бы запертой в виде льда.
Таким образом, жидкая вода, находящаяся в равновесии со льдом при 0°С, более плотна, чем лед, который плавает. Вода имеет максимальную плотность в жидком состоянии при температуре 4°C. Это имеет огромные последствия для биосферы Земли. Озера и океаны замерзали бы снизу вверх, если бы лед был плотнее воды. Это привело бы к тому, что большая часть воды на Земле оказалась бы запертой в виде льда.
Среди химических свойств воды следует особо отметить то, что она является одновременно и очень слабой кислотой, и очень слабым основанием, и между молекулами воды происходят реакции переноса протона
H 2 O( l ) + H 2 O( l ) = H 3 O + ( aq ) + OH − ( aq ) К w = [ H + ][ OH — ] = 1,0 × 10 −14 (при 25°С).
Это так называемое автоионизация реакция происходит только в очень небольшой степени, о чем свидетельствует небольшая величина K w , но это равновесие составляет основу химии
водных смесей кислых и основных растворенных веществ.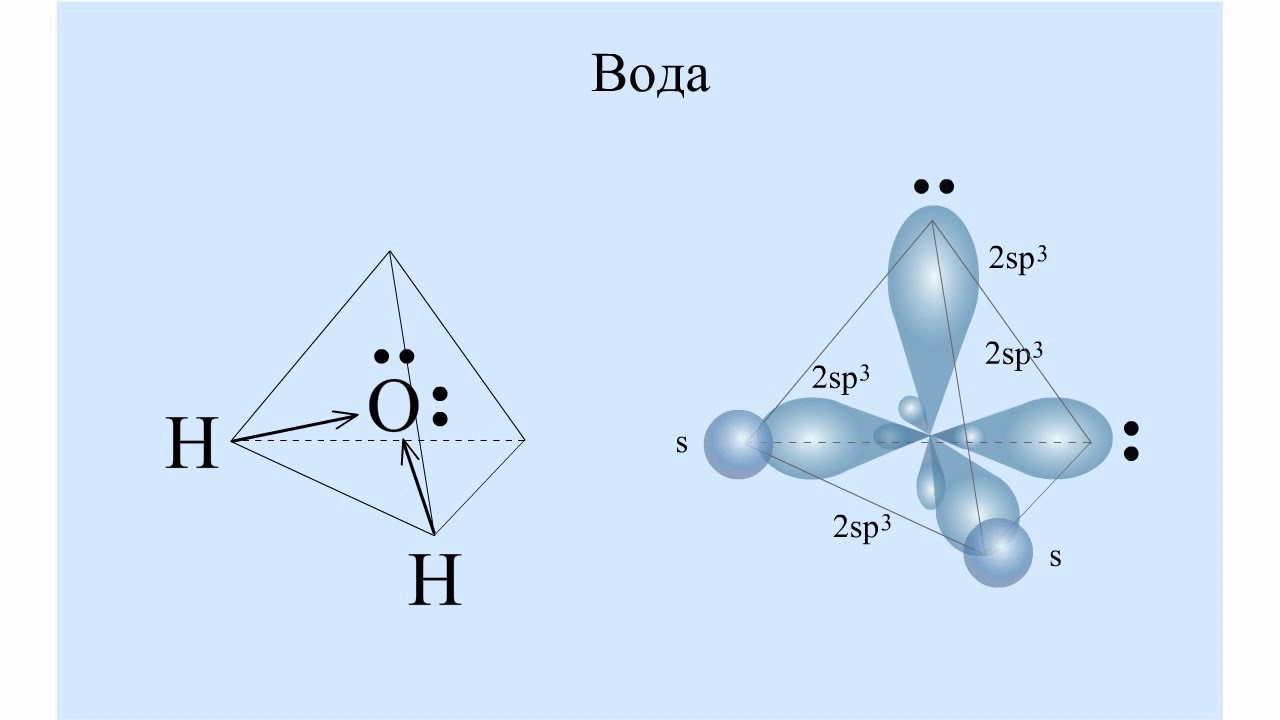 Вода действует как растворитель для многих полярных и ионных частиц, которые затем могут реагировать с водой.
как кислота, основание или и то, и другое. Применение химических концепций к таким водным системам,
трактуется в соответствии с формализмом Бренстеда-Лоури, обеспечивает важную основу для
биохимия и физиология. Свойства буфера в водных системах попадают в эту категорию.
Вода действует как растворитель для многих полярных и ионных частиц, которые затем могут реагировать с водой.
как кислота, основание или и то, и другое. Применение химических концепций к таким водным системам,
трактуется в соответствии с формализмом Бренстеда-Лоури, обеспечивает важную основу для
биохимия и физиология. Свойства буфера в водных системах попадают в эту категорию.
Энергия клеток, Функции клеток | Изучайте науку в Scitable
Конкретный энергетический путь, который использует клетка, во многом зависит от того, является ли эта клетка эукариотной или прокариотической. Эукариотические клетки используют три основных процесса для преобразования энергии, содержащейся в химических связях пищевых молекул, в более удобные для использования формы — часто богатые энергией молекулы-носители. Аденозин 5′-трифосфат, или АТФ, является наиболее распространенной молекулой переносчика энергии в клетках. Эта молекула состоит из азотистое основание (аденин), сахар рибозы и три фосфатные группы. Слово аденозин
относится к аденину плюс сахару рибозе. Связь между вторым и
третий фосфат представляет собой высокоэнергетическую связь (рис. 5).
Слово аденозин
относится к аденину плюс сахару рибозе. Связь между вторым и
третий фосфат представляет собой высокоэнергетическую связь (рис. 5).Первым процессом эукариотического энергетического пути является гликолиз , что буквально означает «расщепление сахара». Во время гликолиза отдельные молекулы глюкозы расщепляются и в конечном итоге превращаются в две молекулы вещества, называемого пируватом ; поскольку каждая глюкоза содержит шесть атомов углерода, каждый образующийся пируват содержит всего три атома углерода. Гликолиз на самом деле представляет собой серию из десяти химических реакций, которые требуют ввода двух молекул АТФ. Этот вход используется для создания четырех новых молекул АТФ, что означает, что гликолиз приводит к чистому приросту двух АТФ. Также образуются две молекулы НАДН; эти молекулы служат переносчиками электронов для других биохимических реакций в клетке.
Гликолиз — это древний основной путь образования АТФ, который наблюдается почти во всех клетках, как у эукариот, так и у прокариот. Этот процесс, также известный как ферментация , происходит в цитоплазме и не требует кислорода. Однако судьба пирувата, образующегося во время гликолиза, зависит от того, присутствует ли кислород. В отсутствие кислорода пируват не может полностью окислиться до углекислого газа, поэтому образуются различные промежуточные продукты. Например, когда уровень кислорода низкий, клетки скелетных мышц полагаются на гликолиз для удовлетворения своих интенсивных энергетических потребностей. Эта зависимость от гликолиза приводит к накоплению промежуточного продукта, известного как молочная кислота, из-за которого мышцы человека могут чувствовать себя «в огне». Точно так же дрожжи, одноклеточные эукариоты, производят спирт (вместо углекислого газа) в условиях дефицита кислорода.
Этот процесс, также известный как ферментация , происходит в цитоплазме и не требует кислорода. Однако судьба пирувата, образующегося во время гликолиза, зависит от того, присутствует ли кислород. В отсутствие кислорода пируват не может полностью окислиться до углекислого газа, поэтому образуются различные промежуточные продукты. Например, когда уровень кислорода низкий, клетки скелетных мышц полагаются на гликолиз для удовлетворения своих интенсивных энергетических потребностей. Эта зависимость от гликолиза приводит к накоплению промежуточного продукта, известного как молочная кислота, из-за которого мышцы человека могут чувствовать себя «в огне». Точно так же дрожжи, одноклеточные эукариоты, производят спирт (вместо углекислого газа) в условиях дефицита кислорода.
Напротив, при наличии кислорода пируваты, образующиеся в результате гликолиза, становятся исходными веществами для следующей части энергетического пути эукариот. На этом этапе каждая молекула пирувата в цитоплазме попадает в митохондрию, где превращается в ацетил-КоА , двухуглеродный энергоноситель, а его третий углерод соединяется с кислородом и высвобождается в виде углекислого газа. В то же время также образуется переносчик NADH. Затем ацетил-КоА поступает в путь, называемый 9-й.0145 цикл лимонной кислоты , который является вторым основным энергетическим процессом, используемым клетками. Восьмистадийный цикл лимонной кислоты генерирует еще три молекулы НАДН и две другие молекулы-носители: ФАДН 2 и ГТФ (рис. 6, в середине).
В то же время также образуется переносчик NADH. Затем ацетил-КоА поступает в путь, называемый 9-й.0145 цикл лимонной кислоты , который является вторым основным энергетическим процессом, используемым клетками. Восьмистадийный цикл лимонной кислоты генерирует еще три молекулы НАДН и две другие молекулы-носители: ФАДН 2 и ГТФ (рис. 6, в середине).
Третий основной процесс эукариотического энергетического пути включает электрон-транспортную цепь , катализируемую несколькими белковыми комплексами, расположенными во внутренней мембране митохондрий. Этот процесс, называемый 90–145 окислительным фосфорилированием, переносит электроны от NADH и FADH 2 через мембранные белковые комплексы и, в конечном счете, к кислороду, где они соединяются с образованием воды. Когда электроны проходят через белковые комплексы в цепи, через митохондриальную мембрану образуется градиент ионов водорода или протонов. Клетки используют энергию этого протонного градиента для создания трех дополнительных молекул АТФ на каждый электрон, перемещающийся по цепи.

