Химическое действие электрического тока
Электролиз
Растворы солей и кислот в воде или каком-либо другом растворе проводят электрический ток и называются электролитами, или проводниками второгорода, в отличие от металлических проводников, называемых проводниками первого рода.
Электрический ток может проходить через среды, имеющие электрически заряженные частицы, обладающие способностью перемещаться.
При растворении солей и кислот в воде или каком-либо ином растворителе (этиловый спирт, бензин, бензол и др.) часть молекул распадается на две части, называемые ионами, причем одна часть имеет положительный заряд, другая – отрицательный.
Таким образом, в отличие от металлических проводников, где переносчиками электричества являются электроны, в электролитах ими служат ионы. Ионы могут быть простыми и сложными. Простой ион образован одним атомом вещества. Ионы, состоящие из нескольких атомов, называются
Распад химических соединений на ионы под действием растворителя называется электролитической диссоциацией и выражается обычными химическими уравнениями, в левой части которых помещаются химические символы распадающихся веществ, а в правой образующиеся от этих веществ ионы. Например, уравнение диссоциации поваренной соли (хлористого натрия) записывается следующим образом: NaCl = Na+ + Cl—.
Для более сложных соединений процесс диссоциации может протекать в несколько стадий.
Если сосуд с электролитом погружены две металлические пластины, называемые электродами, которые с помощью проволочных проводников присоединены к источнику энергии постоянного тока, то вследствие разности потенциалов между электродами через электролит будет протекать ток. Прохождение тока через электролит сопровождается химическим процессом, называемым
Законы Фарадея
При прохождении электрического тока через электролит на электродах выделяется определенное количество веществ, содержащихся в виде химического соединения в электролите. Зависимость выделенного вещества от тока устанавливается законами Фарадея.
Первый закон Фарадея сформулирован так:
При прохождении одного кулона электричества из электролита выделяется определенное количество массы вещества, называемое электрохимическим эквивалентом данного вещества.
В практических расчетах для определения количества электричества удобнее пользоваться не кулонами, а ампер-часами (А*ч). Так как один кулон равен ампер-секунде, то между ампер-часом и кулоном имеет место следующее соотношение: 1 А * ч = 60 * 60 = 3600А * с = 3600 Кл.
Электрический эквивалент
Обозначив через I неизменный ток, протекающий через электролит в течении t (ч), а электрохимический эквивалент данного вещества – через К, определим количество массы данного вещества q (г), выделившегося за это время: q = KIt .
Например, если прохождении через медно-кислый электролит тока в 1 А в течении 1 ч на катоде выделяется 1,186 г меди, то при токе в 10 А из такого же раствора за 10 ч выделится 1,186 * 10 * 10 = 118,6 (г).
Второй закон Фарадея гласит: при одном и том же количестве электричества, протекающего через различные электролиты, количество массы веществ, выделившихся на электродах, пропорционально их химическим эквивалентам.
Одновалентный элемент имеет атомный вес, равный химическому эквиваленту, а n-валентный элемент обладает химическим эквивалентом в n раз меньше атомного веса, т.е.
а = А/n
где А – атомный вес;
n – валентность;
а – химический эквивалент вещества.
Например, атомный вес алюминия А = 27, валентность
Из сопоставления первого и второго законов Фарадея вытекает, что электрохимические эквиваленты пропорциональны их химическим эквивалентам, т.е. K1/a1 = K2/a2 = K3/a3 =…
Следовательно, отношение электрохимических эквивалентов к химическим эквивалентам является величиной постоянной, равной K/a = 3,72 * 10-2 = 0,0372 = 1/26,8.
Итак, второй закон Фарадея может быть выражен следующим образом:
K = a/26,8 = A/26,8 n.
Электролиз получил широкое применение в различных отраслях промышленности.
Впервые он был использован для гальванопластики, представляющий собой получение копий с рельефом. С этой целью гипсовый оттиск (негатив) со снимаемого рельефа покрывают слоем графита и погружают в раствор соли металла, который осаждается в оттиске, как на катоде. После удаления гипса получается металлическая копия рельефа.
С помощью электролиза наносят относительно тонкие покрытия одних металлов на другие (гальваностегия). Гальваностегия используется для придания изделиям декоративного вида и защиты от коррозии. Таким способом производят золочение, серебрение, никелирование и т.д.
Электролиз служит также для очистки (рафинирования) металлов, например меди. Пластины литой меди, полученной путем обжига руды, опускают в качестве анодов в ванны, содержащие раствор медного корпуса, подкисленной серной кислотойдляповышения проводимости электролита. Катодами в этих ваннах являются тонкие медные пластины, на которых отлагается электролитическая медь, а примеси осаждаются на дно ванны.
Весьма распространен электролитический способ получения едких щелочей натрия, калия и хлора, а также кислорода и водорода путем разложения воды, подкисленной серной кислотой.
Явление электролиза представляет опасность для ряда подземных сооружений.
Под действием электролиза блуждающими токами может быть разрушена броня кабелей, водопроводных и газовых труб и других металлических сооружений. Главнейшим источником этих токов является электрооборудование транспорта – трамваев и электрифицированных железных дорог. Особенно вредно действуют блуждающие токи на подземные телефонные кабели, которые покрыты незащищенной свинцовой оболочкой.
Приложение 9
Гальванические элементы.
В гальванических элементах во время работы происходит движение ионов и оседание на электродах элемента, выделившегося из электролита вещества. Простейшим гальваническим элементом является медно-цинковый. В стеклянный сосуд, наполненный раствором серной кислоты в воде, погружены медная и цинковая пластины, которые представляют собой положительный и отрицательный полюсы элемента. При замыкании цепи элемента каким-либо проводником внутри этого элемента будет протекать ток от цинковой отрицательной пластины к медной положительной, а во внешней цепи – от медной к цинковой. Под действием тока внутри элемента положительные ионы водорода движутся по направлению тока, отрицательные ионы кислотного остатка — в противоположном направлении. Соприкасаясь с медной пластиной, положительные ионы водорода отдают ей свои заряды, а водород в виде пузырьков газа скапливается на ее поверхности. В то же время отрицательные ионы остатка серной кислоты отдают свои заряды цинковой пластине. Таким образом, происходит непрерывный заряд пластин элемента, поддерживающий разность потенциалов (напряжение) на его зажимах.
Выделение водорода на медной пластине элемента ослабляет его действие – поляризует элемент. Явление поляризации состоит в том, что скапливающийся на положительном электроде водород создает в совокупности с металлом электрода дополнительную разность потенциалов, называемую электродвижущейсилой поляризации, которая направлена противоположно движущей силе элемента. Кроме того, пузырьки водорода, покрывающие часть медной пластины, уменьшают ее действующую поверхность, что увеличивает внутреннее сопротивление элемента.
Поляризация в рассмотренном элементе настолько значительна, что делает его непригодным для практических целей. Для устранения поляризации в состав элемента вводят поглотитель, носящий название деполяризатора,который предназначен для поглощения водорода и препятствия скапливанию его на положительном полюсе элемента. Деполяризаторами могут служить химические препараты, богатые водородом или хлором.
Электродвижущая сила гальванического элемента зависит от химических и физических свойств веществ, его составляющих, и не зависит ни от формы и размеров элемента, ни от его внутреннего устройства.
Но внутреннее устройство и размеры отдельных частей элемента оказывают большое влияние на его внутреннее сопротивление, так как оно зависит от расстояния между полюсами ( при уменьшении этого расстояния внутреннее сопротивление элемента уменьшается), размера погруженной в жидкость поверхности полюсов ( при увеличении этой поверхности внутреннее сопротивление уменьшается), химического состава жидкости элемента.
Внутреннее сопротивление гальванических элементов не является постоянным и по мере работы элемента постепенно возрастает.
В зависимости от способа деполяризации гальванические элементы могут быть подразделены на два типа: элементы, в которых в качестве деполяризатора применяют раствор какой – либо соли, например медно-цинковые, и элементы, в которых анод окружен перекисью марганца, например, угольно-цинковые. Гальванические элементы указанных типов широко применяют в электротехнике.
Электродвижущая сила медно- цинкового элемента равна 1,1 В, а внутренние сопротивление в зависимости от времени работы – 5-10 Ом.
В угольно-цинковом элементе положительным полюсом служит угольная пластина, а отрицательным – цинковый стержень. Деполяризатором в этом элементе является спрессованная под большим давлением смесь, называемая агломератом, которая состоит из перекиси марганца и графита. В качестве электролита в угольно-цинковом элементе применяют водный раствор хлористого аммония. Электродвижущая сила угольно-цинкового элемента – 1,4 – 1,5 B в начале разряда при среднем значении 0,9 – 1,1 B, а внутренние сопротивление в зависимости от конструкции элемента – 0,25- 0,7 Ом в начале разряда и 1,4 – 5 Ом – в конце.
Уголньно-цинковые элементы отечественная промышленность выпускает в виде так называемых сухих элементов стаканчиковогои галетного типов, весьма удобных для переноски и перевозки.
В сухих элементах стаканчикового типа положительный полюс 8 с алгоритмом 2 помещают внутри цинковой коробки 9, которая служит отрицательным полюсом элемента. Пространство между стенками цинковой коробки и алгоритмом заполняется пастой 1, состоящей из раствора хлористого аммония и картофельной муки. Над алгоритмом укладывают картонную прокладку 3, на которую насыпают прослойку 4 из опилок, сверху опилки закрывают прокладкой 5. Затем элемент заливают смолой 7, в которую вставляют трубку 6. Назначение этой трубки – удалять образующиеся внутри элемента газы.
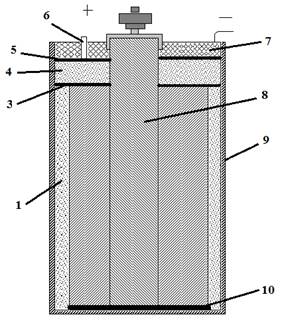
Сухой гальванический элемент
На выходящей из смолы угольный электрод насаживают медный колпачок с винтом и гайкой для присоединения проводника. К верхней части цинковой коробки (отрицательному полюсу) припаивают изолированный гибкий проводник. На дно коробки укладывают изолирующую прокладку 10.
В галетном элементе отрицательным электродом является цинковая пластина, положительным – спрессованный в виде галеты порошок диоксида марганца с углем. Между электродами помещают картонную пластинку, пропитанную раствором нашатырного спирта. Наружная поверхность цинковой пластины покрыта слоем канифоли с частицами графита для электропроводности. В качестве изоляции используют хлорвиниловые пленки. Галетные элементы компактны, а их активные материалы (уголособенно цинк) используются лучше, чем в стаканчиковых элементах.
Приложение 10
Аккумуляторы
Аккумулятором называется прибор, обладающий способностью накапливать и сохранять в течение некоторого времени электрическую энергию в результате химических процессов. В аккумуляторе, как и в гальваническом элементе, электрический ток является следствием химических процессов. Но в отличие от аккумулятора в гальваническом элементе получающиеся химические соединения не могут быть вторично разложены и приведены в первоначальное состояние током постороннего источника. Поэтому гальванические элементы называются первичными, а аккумуляторы – вторичными, или обратными. Повторные заряд и разряд не только не вредят аккумулятору, но даже улучшают его свойства, так как в работе учувствуют все более глубокие слои пластин электродов.
В зависимости от состава электролита и материала пластин аккумуляторы могут быть кислотными и щелочными.
Простейший кислотный аккумулятор состоит из двух свинцовых пластин (электродов), погруженных в электролит, которым служит вода с небольшим добавлением серной кислоты. Постоянный ток постороннего источника, проходя через электролит, разлагает его на составные части. Внутри электролита возникает движение положительных ионов водорода к пластине, соединенной с отрицательным зажимом источника тока, и отрицательных ионов кислорода к пластине, соединенной с положительным зажимом источника тока. В результате электролиза окисляется свинец на положительном электроде и образуется губчатый свинец на отрицательном электроде. Таким образом, электрическая энергия преобразовывается в химическую, и аккумулятор становится заряженным. Химическая энергия может сохраняться определенное время и при необходимости легко переходит в электрическую.
Если аккумулятор отключить от источника тока и замкнуть на какой-либо приемник энергии, то он станет источником тока подобно гальваническому элементу, у которого электродами сложат пластины, отличающиеся по химическому составу.
Электролитом в кислотных аккумуляторах служит раствор серной кислоты определенной плотности. Плотностью раствора, называется число, показывающие во сколько раз масса этого раствора больше массы воды того же объема.
Для наполнения стационарных аккумуляторов употребляют раствор серной кислоты плотностью 1,21 при 15 °C , переносных аккумуляторов – раствор плотностью 1,26.
Плотность электролита определяют ареометром, который представляет собой стеклянную трубку, запаянную с обоих концов и имеющую внутри шкалу с делениями.
В нижней расширенной части ареометра находится ртуть или дробь, в результате чего трубка плавает вертикально. Ареометр опускают в сосуд с электролитом. Чем больше плотность электролита, тем выше поднимается ареометр из жидкости. Деление ареометра, совпадающие с уровнем раствора, показывает плотность электролита.
При составлении раствора для аккумуляторов серную кислоту тонкой струей наливают в воду. Нельзя вливать в серную кислоту воду, так как произойдет бурное разбрызгивание кислоты, которая может причинить ожоги. Вода для электролита должна быть дистиллированной.
Внутреннее сопротивление аккумуляторов очень мало по сравнению с внутренним сопротивлением гальванических элементов. Это дает возможность считать напряжение на зажимах аккумуляторной батареи примерно равным ее ЭДС. Однако внутреннее сопротивление не является постоянной величиной. Оно определяется составом пластин, расстоянием между ними, плотностью и температурой электролита, степенью заряженности аккумулятора. Так, сопротивление разряженного аккумулятора примерно в 1,5 – 2 раза больше, чем заряженного.
Электродвижущая сила аккумулятора зависит от плотности электролита, а не от его размеров и номинальной емкости. При плотностях электролита d в пределах 1,1 – 1,35 ЭДС аккумулятора E = 0,85 + d.
В процессе заряда и разряда аккумулятора плотность электролита не остается постоянной, в связи с чем изменяется как его ЭДС, так и напряжение на его зажимах.
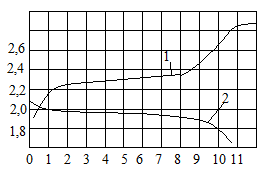
График изменения напряжения кислотного
аккумулятора: 1 – при заряде; 2 – при разряде
При заряде аккумулятора увеличивается плотность электролита, вследствие чего напряжение на зажимах аккумулятора повышается (кривая 1). При разряде кислотного аккумулятора напряжение на его зажимах быстро падает до 1,85 – 1,8 В и после этого быстро уменьшается до нуля (кривая2). Понижение напряжения при заряде аккумулятора объясняется тем, что при разряде плотность его электролита уменьшается. Когда напряжение на аккумуляторе достигает значения 1,8 В (при кратковременном разряде 1,75В)
Это значит, что вся запасенная в нем энергия израсходована (на обеих пластинах образуется сульфат свинца, являющийся плохим проводником тока).
При дальнейшим разряде напряжения быстро уменьшается до нуля. Если аккумулятор отключить от нагрузки, то его напряжение вновь увеличится примерно до 2 В, так как электролит проникает вглубь пластин в поры активной массы. Однако при включении такого аккумулятора вновь на нагрузку напряжение на его зажимах снова быстро уменьшается до нуля.
Практически разряд доводят до 1,8 В, так как при разряде ниже 1,8 В аккумулятор приходит в негодность – пластины его частично покрываются белым налетом крупнокристаллического сульфата свинца, который представляет собой настолько плохой проводник, что заряд аккумуляторов до номинальной емкости становится невозможным. Это явление называется сульфитацией пластин аккумулятора.
Количество электричества, которое аккумулятор может отдать при разряде определенным током до низкого допустимого напряжения, называется емкостью. Она равна произведению разрядного тока в амперах на продолжительность времени разряда в часах и выражается а ампер-часах. Емкость аккумулятора зависит от количества активной массы, разрядного тока и температуры. Под номинальной емкостью понимают то количество электричества, которое отдает полностью заряженный аккумулятор при 10-часовом режиме разряда и температуре 25 °C. Таким образом, аккумулятор отдает номинальную емкость, разряжаясь в течении 10 ч током, численно равным 0,1 значение его номинальной емкости. При увеличении разрядного тока емкость аккумулятора уменьшается, так как поверхность пластин покрывается сульфатом свинца и затрудняет доступ электролита к внутренним слоям активной массы. При понижении температуры увеличивается вязкость электролита, что также затрудняет его доступ к внутренним слоям активной массы и уменьшает емкость аккумулятора.
В отключенном состоянии заряженный аккумулятор теряет часть запасенной им емкости. Это явление носит название саморазряда. Саморазряд аккумулятора увеличивается с повышением температуры и плотности электролита.
Для увеличения емкости аккумулятора несколько одноименных пластин соединяют параллельно. Каждая группа положительных и отрицательных пластин работает как одна большая пластина, площадь которой равна сумме их площадей. Так как положительные пластины должны находиться между отрицательными, число отрицательных пластин всегда на одну больше числа положительных. При этом условии обе стороны положительных пластин вступают во взаимодействие с электролитом (при односторонней работе положительные пластины коробятся и при соприкосновении с отрицательными пластинами может произойти короткое замыкание)
Стационарные кислотные аккумуляторы изготовляют в стеклянных или керамических сосудах. Аккумуляторы больших емкостей имеют деревянные сосуды, выложенные внутри свинцом или кислотостойким изоляционным материалом. Кислотные аккумуляторы применяют на электротехнических установках стационарного типа и автотранспорте. В качестве переносных аккумуляторов используют преимущественно щелочные.

Схема соединения пластин кислотного
аккумулятора
Сосуды щелочных аккумуляторов сваривают из тонкой листовой стали и с наружной стороны никелируют. В центре крышки сосуда имеется отверстие для заливки аккумуляторов электролитом.
Электродвижущая сила щелочных аккумуляторов зависит от состояния активной массы пластин. От температуры и плотности электролита ЭДС зависит незначительно, и только при низких температурах, близких к нулю, она резко уменьшается. Напряжение в конце заряда аккумулятора равно
1,8 В, по окончанию заряда – 1,5-1,55В, ЭДС разряженного аккумулятора – 1,3 В.
Внутренние сопротивление щелочного аккумулятора значительно больше внутреннего сопротивления кислотного.
Достоинства щелочных аккумуляторов: не требуют тщательного ухода, не боятся сотрясений, могут длительно оставаться в разряженном состоянии, выносят короткие замыкания, которые для кислотных аккумуляторов представляют большую опасность. Саморазряд у щелочных аккумуляторов меньше, чем у кислотных.
Работу аккумулятора характеризуют отдачи по емкости энергии.
Количество Q, полученное аккумулятором во время заряда, называется емкостью аккумулятора при заряде:
Q = I3T,
где I3 –токпри заряде, А;
T – продолжительность заряда, ч.
Количество электричества q, отданное аккумулятором во время разряда, называется емкостью аккумулятора при разряде. Если обозначить разрядный ток Iр , а продолжительность заряда – t, то емкость аккумулятора при разряде q = Iр t.
Отношение емкости при разряде к емкости при заряде называется отдачей аккумулятора по емкости ή1 или поколичеству электричества
ή1 = q/ Q= Iр t / (I3T)
Среднее значение ή1 для кислотных аккумуляторов – 0,85, для щелочных – 0,65.
Если обозначить среднее значение напряжения аккумулятора при его заряде – U3 и время заряда – T, то при зарядном токе I3 электрическая энергия, или работа, затраченная на заряд аккумулятора, A1 = U3I3T (Вт * ч).
Соответственно электрическая энергия, полученная от разряда аккумулятора при среднем напряжении Uи разрядом тока Iр в теченииt, составит A1 = UрIрt.
Отношение энергии, полученной от аккумулятора при его разряде, к энергии, затраченной на его заряд, называется отдачей аккумулятора по энергии
ή2: ή 2 A2/A1 =UрIрt / (U3I3T).
Среднее значение ή 2для кислотных аккумуляторов –0,65,а для щелочных – 0,45.
В зависимости от материала электродов щелочные аккумуляторы разделяют на кадмиево-никеливые, железоникелевые, серебряно-цинковые, золото-цинковые и газовые.
Применение в массовом масштабе золото-цинковых аккумуляторов ограничивается высокой стоимостью.
Наиболее широко распространение получили кадмиево-никеливые и железоникелевые аккумуляторы, электролитом в которых служит раствор едкого калия в воде; плотность электролита 1,2. По своему устройству и электрическим данным аккумуляторы этих типов незначительно отличаются друг от друга. Активную массу запрессовывают в брикеты (пакеты), а затем собирают в отдельные пластины. У железоникелевых аккумуляторов отрицательных пластин на одну больше, чем положительных, у кадмиево-никелевых положительных пластин на одну больше, чем отрицательных. Один из полюсов аккумулятора соединяется с сосудом (у железоникелевых – отрицательный, кадмиево-никелевых – положительный).
В кадмиево-никелевых аккумуляторах активная масса положительных пластин состоит из гидрата оксида никеля, который для лучшей проводимости смешивают с графитом. Активная масса отрицательных пластин представляет собой гидрат оксида кадмия и железа.
В железоникелевых аккумуляторах активной массой положительных пластин является гидрат закиси никеля, смешанный с графитом, а отрицательных пластин – специально приготовленный железный порошок.
Благодаря высоким эксплуатационным показателям за последние годы нашли широкое применение серебряно-цинковые аккумуляторы.
Серебряно-цинковый аккумулятор представляет собой пластмассовый сосуд, в котором помещены положительные и отрицательные электроды, составленные из отдельных пластин. Отрицательные электроды, изготовленные из пластин оксида цинка, заключены в защитные пакеты из материала, который хорошо пропускает электролит, но задерживает металлические частицы. Положительные пластины изготовлены из серебра.
Электролитом серебряно-цинковых аккумуляторов служит водный раствор едкого калия. Для нормальной работы аккумулятора необходимо небольшое количество электролита, что позволяет использовать аккумулятор полусухим и эксплуатировать его в любом положении (вертикально и горизонтально). Трубка, которой закрывается сосуд, водонепроницаема и открывается только на время заряда. При заряде аккумулятор должен находиться в вертикальном положении, ЭДС полностью заряженного аккумулятора равна 1,82 – 1,86 В, напряжение при разряде — ≈ 1,5 В.
Достоинства серебряно-цинковых аккумуляторов: малое внутреннее сопротивление и масса.
Серебряно-цинковые аккумуляторы работают при температуре до -59 °C, т.е. до замерзания электролита. Верхний предел температуры +80 °C. Они переносят относительно большие перепады давления окружающей среды.
Для составления аккумуляторной батареи или батареи гальванических элементов несколько элементов соединяют последовательно, т.е. катод первого аккумулятора соединяют с анодом второго, катод второго – с анодом третьего и т.д. Получившиеся таким образом свободные электроды, а именно, анод первого элемента и катод последнего, являются соответственно положительным и отрицательным полюсами аккумуляторной батареи. При определении ЭДС аккумуляторной батареи из n аккумуляторов или гальванических элементов с ЭДС одного элемента E0 и внутренним сопротивлением R0 ЭДС батареи будет E = nE0 и внутреннее сопротивление
R = nR0.
Последовательное соединение элементов используется для увеличения напряжения. Чтобы получить при малом напряжении ток, применяют несколько параллельно соединенных аккумуляторов или элементов.
Для этого положительные и отрицательные полюсы всех элементов соединяют между собой отдельно и полученные общие положительные и отрицательные полюсы являются полюсами батареи. Если батарея состоит из m параллельно соединенных элементов, то ее ЭДС E = E0 , а внутреннее сопротивление R = R0/m. Если n – число групп или элементов в группе, соединенных последовательно, m – число групп или элементов в группе, соединенных параллельно, то ЭДС батареи E = nE0, а ее внутреннее сопротивление
R = R0/m.
Приложение 11
Химическое действие электрического тока — fiziku5.ru
· Такие специальные стали, как инструментальная, нержавеющая, жаростойкая и жаропрочная, выплавляют в настоящее время только в электрических печах.
· § 27. ХИМИЧЕСКОЕ ДЕЙСТВИЕ ЭЛЕКТРИЧЕСКОГО ТОКА
·
· Растворы солей и кислот в воде или в каком-либо другом растворителе проводят электрический ток и называются электролитами или проводниками второго рода в отличие от металлических проводников, называемых проводниками первого рода.
· Электрический ток может проходить через среды, имеющие электрически заряженные частицы, обладающие способностью перемещаться.
· При растворении солей и кислот в воде или в каком-либо ином растворителе (этиловый спирт, бензин, бензол и др.) часть молекул распадается на две части, называемые ионами, причем одна часть имеет положительный заряд, другая — отрицательный заряд.
· Таким образом, в отличие от металлических проводников, где переносчиками электричества являются электроны, в электролитам ими служат ионы. Ионы могут быть простыми и сложными. Простой ион образован одним атомом вещества. Ионы, состоящие из нескольких атомов, называются сложными.
· Распад химических соединений на ионы под действием растворителя называется электролитической диссоциацией и выражается обычными химическими уравнениями, в левой части которых помещаются химические символы распадающихся веществ, а в правой — образующиеся из этих веществ ионы. Например, уравнение диссоциации поваренной соли (хлористого натрия) записывается следующим образом:
·
· Для более сложных соединений процесс диссоциации может протекать в несколько стадий.
· Если в сосуд с электролитом погружены две металлические пластины, называемые электродами, которые при помощи проволочных проводников присоединены к источнику энергии постоянного тока, то вследствие разности потенциалов между электродами, через электролит будет протекать ток. Прохождение тока через электролит сопровождается химическим процессом, называемым электролизом. Находящиеся в электролите ионы, притягиваясь к электродам, двигаются в противоположных направлениях: положительные ионы — к катоду, а отрицательные ионы — к аноду. Подойдя к катоду, положительные ионы получают от него недостающие им электроны и образуют электрически нейтральные атомы. На аноде происходит обратный процесс: отрицательные ионы отдают аноду свои избыточные электроны. Например, при электролизе раствора поваренной соли на катоде отлагаются положительные ионы натрия, а на аноде — отрицательные ионы хлора.
· В результате непрерывного перехода электронов с катода на ионы и поступления их на анод поддерживается движение электронов в проводах, соединяющих источник электрической энергии с электродами.
· При прохождении электрического тока через электролит на электродах выделяются определенные количества веществ, содержащихся в виде химического соединения в электролите. Зависимость выделенного вещества от силы тока устанавливается двумя законами Фарадея.
· Первый закон Фарадея сформулирован так: количество вещества, выделившегося на электродах при прохождении тока через электролит, прямо пропорционально количеству электричества, прошедшему через электролит. При прохождении одного кулона электричества из электролита выделяется определенное весовое количество вещества, которое называется электрохимическим эквивалентом данного вещества.
· В практических расчетах для определения количества электричества удобнее пользоваться не кулонами, а ампер-часами (ач). Так как один кулон равен ампер-секунде, то между ампер-часом и рулоном имеет место следующее соотношение:
· 1 ач = 60х60 = 3600 асек = 3600 к.
· Электрохимический эквивалент выражается в граммах, отнесенных к одному ампер-часу количества электричества (г/а-ч), т. е. это весовое количество вещества, выделившегося из электролита и выраженное в граммах, при прохождении через электролит одного ампер-часа количества электричества.
· Обозначив через I неизменную силу тока, протекающего через электролит в течение t (ч), а электрохимический эквивалент данного вещества через К, определим весовое количество данного вещества q (r), выделившегося за это время:
·
· Например, если при прохождении через меднокислый электролит тока в 1 а в течение одного часа на катоде выделяется 1,186 г меди, то при силе тока в 10 а из такого же раствора за 10 ч выделится
· 1,1861010= 118,6 г.
· Второй закон Фарадея гласит: при одном и том же количестве электричества, протекающего через различные электролиты, весовые количества веществ, выделившихся на электродах, пропорциональны их химическим эквивалентам.
· Из курса химии известно, что одновалентный элемент имеет атомный вес, равный химическому эквиваленту, а n-валентный элемент обладает химическим эквивалентом, в n раз меньшим атомного веса, т. е.
·
· где A-атомный вес, n — валентность, а-химический эквивалент
· Например, атомный вес алюминия А=27, валентность n = 3, следовательно, его химический эквивалент
·
· Из сопоставления 1-го и 2-го законов Фарадея вытекает, что электрохимические эквиваленты пропорциональны их химическим эквивалентам, т. е.
·
· Следовательно, отношение электрохимических эквивалентов к их химическим эквивалентам является величиной постоянной и равно
·
· Итак, второй закон Фарадея может быть выражен следующим образом:
·
· Пример. Из электролита в течение 10 ч выделилось 50 г цинка. Определить ток, протекающий через электролит. Электрохимический эквивалент цинка К= 1,22 г/а ч.
· Решение, Согласно первому закону Фарадея имеем:
·
· откуда
·
· Электролиз получил широкое применение в различных отраслях промышленности. Впервые он был использован для гальванопластики, представляющей собой получение копий с рельефов. С этой целью гипсовый оттиск (негатив) со снимаемого рельефа покрывают слоем графита и погружают в раствор соли металла, который осаждается на оттиске, как на катоде. После удаления гипса получается металлическая копия рельефа.
· С помощью электролиза наносят относительно тонкие покрытия одних металлов на другие (гальваностегия). Гальваностегия используется для придания изделиям декоративного вида и для защиты от коррозии. Таким способом производят золочение, серебрение, никелирование и т. д.
· Электролиз служит также для очистки (рафинирования) металлов, например меди. Пластины литой меди, полученной путем обжига руды, опускают в качестве анодов в ванны, содержащие раствор медного купороса, подкисленный серной кислотой для повышения проводимости электролита. Катодами в этих ваннах являются тонкие медные кисти, на которых отлагается электролитическая медь, а примеси осаждаются на дно ванны.
· Весьма распространен электролитический способ получения едких щелочей натрия, калия и хлора, а также кислорода и водорода путем разложения воды, подкисленной серной кислотой.
· Явление электролиза представляет опасность для ряда подземных сооружений. Под действием электролиза блуждающими токами могут быть разрушены броня кабелей, водопроводных и газовых труб и других металлических сооружений. Главнейшим источником этих токов является электрооборудование транспорта — трамваев и электрифицированных железных дорог. Особенно вредно действуют блуждающие, токи на подземные телефонные кабели, покровом которых является голая свинцовая оболочка.
Химическое и магнитное действие тока (в день науки)
Химическое и магнитное действие тока (в день науки)
Химическое действие электрического тока
Электролиты, содержащие ионы, под действием постоянного электрического тока подвергаются электролизу — это и есть химическое действие тока. К положительному электроду (аноду) в процессе электролиза притягиваются отрицательные ионы (анионы), а к отрицательному электроду (катоду) — положительные ионы (катионы). То есть вещества, содержащиеся в электролите, в процессе электролиза выделяются на электродах источника тока.
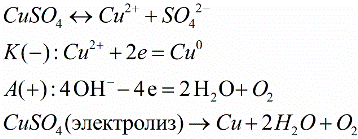
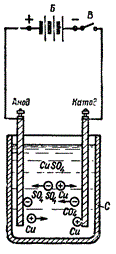
Например, в раствор определенной кислоты, щелочи или соли погружают пару электродов, и при пропускании электрического тока по цепи на одном электроде создается положительный заряд, на другом — отрицательный. Ионы содержащиеся в растворе начинают откладываться на электроде с противоположным зарядом.
Скажем, при электролизе медного купороса (CuSO4), катионы меди Cu2+ с положительным зарядом движутся к отрицательно заряженному катоду, где они получают недостающий заряд, и становятся нейтральными атомами меди, оседая на поверхности электрода. Гидроксильная группа -OH отдаст электроны на аноде, и в результате выделится кислород. Положительно заряженные катионы водорода H+ и отрицательно заряженные анионы SO42- останутся в растворе.
Химическое действие электрического тока используется в промышленности, например, для разложения воды на составляющие ее части (водород и кислород). Также электролиз позволяет получать некоторые металлы в чистом виде. С помощью электролиза покрывают тонким слоем определенного металла (никеля, хрома) поверхности — это нанесение гальванических покрытий и т.д.
В 1832 году Майкл Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит. Если через электролит пропускается в течение времени t постоянный ток I, то справедлив первый закон электролиза Фарадея:
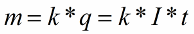
Здесь коэффициент пропорциональности k называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Магнитное действие электрического тока
При наличии электрического тока в любом проводнике (в твердом, жидком или газообразном) наблюдается магнитное поле вокруг проводника, то есть проводник с током приобретает магнитные свойства.
Так, если к проводнику, по которому течет ток, поднести магнит, например в виде магнитной стрелки компаса, то стрелка повернется перпендикулярно проводнику, а если намотать проводник на железный сердечник, и пропустить по проводнику постоянный ток, то сердечник станет электромагнитом.
В 1820 году Эрстед открыл магнитное действие тока на магнитную стрелку, а Ампер установил количественные закономерности магнитного взаимодействия проводников с током.
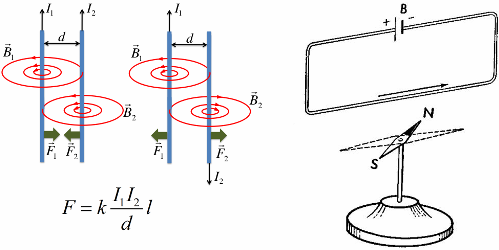
Магнитное поле всегда порождается током, то есть движущимися электрическими зарядами, в частности — заряженными частицами (электронами, ионами). Противоположно направленные токи взаимно отталкиваются, однонаправленные токи взаимно притягиваются.
Такое механическое взаимодействие происходит благодаря взаимодействию магнитных полей токов, то есть это, в первую очередь, — магнитное взаимодействие, а уж потом — механическое. Таким образом, магнитное взаимодействие токов первично.
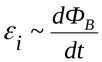
В 1831 году, Фарадей установил, что изменяющееся магнитное поле от одного контура порождает ток в другом контуре: генерируемая ЭДС пропорциональна скорости изменения магнитного потока. Логично, что именно магнитное действие токов используется по сей день и во всех трансформаторах, а не только в электромагнитах ( например, в промышленных).
Слободянюк А.И. Физика 10/11.0 — PhysBook
Содержание книги
Предыдующая страница
§11. Постоянный электрический ток
Мы подробно рассмотрели свойства электростатического поля, порождаемого неподвижными электрическими зарядами. При движении электрических зарядов возникает целый ряд новых физических явлений, к изучению которых мы приступаем.
В настоящее время широко известно, что электрические заряды имеют дискретную структуру, то есть носителями зарядов являются элементарные частицы – электроны, протоны и т.д. Однако в большинстве практически значимых случаев эта дискретность зарядов не проявляется, поэтому модель сплошной электрически заряженной среды хорошо описывает явления, связанные с движением заряженных частиц, то есть с электрическим током.
Электрическим током называется направленное движение заряженных частиц.
С использованием электрического тока вы хорошо знакомы, так как электрический ток чрезвычайно широко используется в нашей жизни. Не секрет, что наша нынешняя цивилизация в основном базируется на производстве и использовании электрической энергии. Электрическую энергию достаточно просто производить, предавать на большие расстояния, преобразовывать в другие требуемые формы.
Кратко остановимся на возможных проявлениях действия электрического тока.
Тепловое действие электрического тока проявляется практически во всех случаях протекания тока. Благодаря наличию электрического сопротивления при протекании тока выделяется теплота, количество которой определяется законом Джоуля-Ленца, с которым вы должны быть знакомы. В некоторых случаях выделяемая теплота полезна (в разнообразных электронагревательных приборах), часто выделение теплоты приводит к бесполезным потерям энергии при передаче электроэнергии.
Магнитное действие тока проявляется в создании магнитного поля, приводящего к появлению взаимодействия между электрическими токами и движущимися заряженными частицами.
Механическое действие тока используется в разнообразных электродвигателях, преобразующих энергию электрического тока в механическую энергию.
Химическое действие проявляется в том, что протекающий электрический ток, может инициировать различные химические реакции. Так, например, процесс производства алюминия и ряда других металлов основан на явлении электролиза – реакции разложения расплавов оксидов металлов под действием электрического тока.
Световое действие электрического тока проявляется в появлении светового излучения при прохождении электрического тока. В некоторых случаях свечение является следствие теплового разогрева (например, в лампочках накаливания), в других движущиеся заряженные частицы непосредственно вызывают появление светового излучения.
В самом названии явления (электрический ток) слышны отголоски старых физических воззрений, когда все электрические свойства приписывались гипотетическое электрической жидкости, заполняющей все тела. Поэтому при описании движения заряженных частиц используется терминология аналогичная используемой при описании движения обычных жидкостей. Указанная аналогия простирается дальше простого совпадения терминов, многие законы движения «электрической жидкости аналогичны законам движения обычных жидкостей, а частично знакомые вам законы постоянного электрического тока по проводам аналогичны законам движения жидкости по трубам. Поэтому настоятельно рекомендуем вам повторить раздел, в котором описаны эти явления – гидродинамику.
Следующая страница
Химические источники тока — это… Что такое Химические источники тока?
Химические источники тока
Хими́ческие исто́чники то́ка (аббр. ХИТ) — устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию.
История создания
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Принцип действия
Основу химических источников тока составляют два электрода (катод, содержащий окислитель и анод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В современных химических источниках тока используются:
- в качестве восстановителя (на аноде) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (на катоде) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
Классификация
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Некоторые виды химических источников тока
Гальванические элементы
- Смотри также Категория:Гальванические элементы.
Другие типы:
Аккумуляторы
- Смотри также Категория:Аккумуляторы.
Топливные элементы
- Смотри также Категория:Топливные элементы.
Ссылки
Презентация по физике «Действия электрического тока»(8 класс)
Инфоурок › Физика ›Презентации›Презентация по физике «Действия электрического тока»(8 класс)Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:…Пора чудес прошла, и нам подыскивать приходится причины всему, что совершается на свете.
2 слайд Описание слайда:
Описание слайда:Тема: «Действия электрического тока»
3 слайд Описание слайда:
Описание слайда:Повторение
4 слайд Описание слайда:
Описание слайда:1. Дайте определение электрического тока. 2. На какие виды делятся все вещества по проводимости? 3. Приведите примеры проводников и диэлектриков. 4. Как образуются положительные и отрицательные ионы? 5. Каково строение металлов в твёрдом состоянии? 6. Что находится в узлах кристаллической решётки? 7. Что происходит со свободными электронами в металле при помещении его в электрическое поле?
5 слайд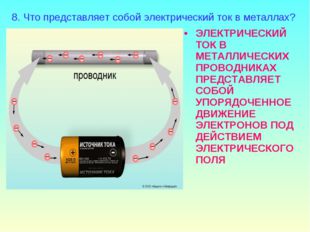 Описание слайда:
Описание слайда:ЭЛЕКТРИЧЕСКИЙ ТОК В МЕТАЛЛИЧЕСКИХ ПРОВОДНИКАХ ПРЕДСТАВЛЯЕТ СОБОЙ УПОРЯДОЧЕННОЕ ДВИЖЕНИЕ ЭЛЕКТРОНОВ ПОД ДЕЙСТВИЕМ ЭЛЕКТРИЧЕСКОГО ПОЛЯ 8. Что представляет собой электрический ток в металлах?
6 слайд Описание слайда:
Описание слайда:9. Проводят ли жидкости электрический ток? Электрический ток электролите (жидкости) – это направленное движение ионов в электрическом поле. Электролиты — растворы солей, щелочей или кислот способных проводить электрический ток.
7 слайд Описание слайда:
Описание слайда:10. Является ли электрическим током молния?
8 слайд Описание слайда:
Описание слайда:Без сомнения, всё наше знание начинается с опыта. (Кант Иммануил немецкий философ, 1724 — 1804 г.г.)
9 слайд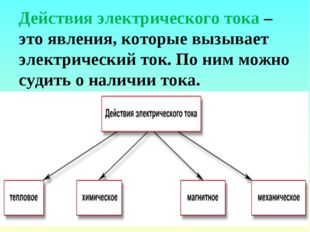 Описание слайда:
Описание слайда:Действия электрического тока – это явления, которые вызывает электрический ток. По ним можно судить о наличии тока.
10 слайд Описание слайда:
Описание слайда:Тепловое действие тока
11 слайд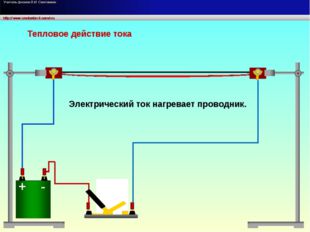 Описание слайда:
Описание слайда:Тепловое действие тока Электрический ток нагревает проводник.
12 слайд Описание слайда:
Описание слайда:Химическое действие электрического тока Впервые было открыто в 1800г.
13 слайд Описание слайда:
Описание слайда:Кинофрагмент «Электролиз»
14 слайд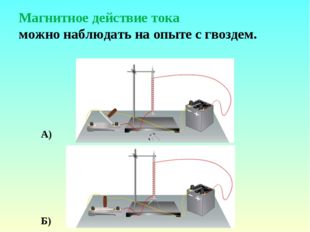 Описание слайда:
Описание слайда:Магнитное действие тока можно наблюдать на опыте с гвоздем. А) Б)
15 слайд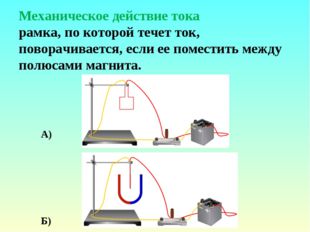 Описание слайда:
Описание слайда:Механическое действие тока рамка, по которой течет ток, поворачивается, если ее поместить между полюсами магнита. А) Б)
16 слайд Описание слайда:
Описание слайда:Явление взаимодействия катушки с током и магнита используются в устройстве прибора, называемого гальванометром
17 слайд Описание слайда:
Описание слайда:Гальванометр – прибор, в котором используется явление взаимодействия катушки с током и магнита. Гальванометр показывает наличие тока и его направление.
18 слайд Описание слайда:
Описание слайда:Обозначение на схеме гальванометра
19 слайд Описание слайда:
Описание слайда:За направление электрического тока условно приняли то направление по которому движутся ( или могли бы двигаться) в проводнике положительные заряды, т.е. направление от положительного полюса источника тока к отрицательному.
20 слайд Описание слайда:
Описание слайда:МИНУТКА ОТДЫХА «ЛЛЛ» — ХУДОЖНИКИ «ППП» — МЫСЛИТЕЛИ
21 слайд Описание слайда:
Описание слайда:С каким действием электрического тока мы сталкиваемся, когда при грозовых разрядах в воздухе образуется озон? Какое действие тока используется в электрическом паяльнике? Как по химическому действию тока можно судить о количестве прошедшего электричества? «ПОРЕШАЕМ»
22 слайд Описание слайда:
Описание слайда:Почему компас дает неправильные показания, если неподалеку от него находится провод с электрическим током? На каком действии электрического тока основано получение химически чистых металлов? Почему горизонтально натянутая проволока заметно провисает при наличии в ней электрического тока? «ПОРЕШАЕМ»
23 слайд Описание слайда:
Описание слайда:Какие действия электрического тока, проявляются в вашей квартире? А химическое? Открытие физика Араго в 1820 г. заключалось в следующем: когда тонкая медная проволока, соединенная с источником тока, погружалась в железные опилки, то они приставали к ней. Объясните это явление. Годность батарейки для карманного фонаря можно проверить, прикоснувшись кончиком языка одновременно к обоим полюсам: если ощущается кисловатый вкус, то батарейка хорошая. Какое действие тока используется при этом? «ПОРЕШАЕМ»
24 слайд Описание слайда:
Описание слайда:Вам нужно сделать точный слепок с некоторого деревянного рельефа. Не поможет ли в этом электрический ток? Как изготовить посеребрённые или позолоченные ювелирные изделия? Что является источником магнитного поля Земли? «ПОДУМАЕМ»
25 слайд Описание слайда:
Описание слайда:1. Электрический ток представляет собой упорядоченное движение ……… частиц, в металлах это …….., в растворах солей …….. 2. Чтобы по цепи протекал электрический ток, цепь должна быть …. 3. Чистая соль и дистиллированная вода не проводят электрический ток, т. к. ……… 4. Раствор соли проводит электрический ток, т.к. …….. 5. О наличии электрического тока можно судить по ……… электрического тока. 6. Мы узнали о 4 действиях электрического тока: …….. План: «ОТЧЕТ-РАССКАЗ»
26 слайд Описание слайда:
Описание слайда:1. Какое действие электрического тока используется для получения чистых металлов? А) тепловое, Б) химическое, В) магнитное 2. Какие действия электрического тока наблюдаются при пропускании тока через металлический проводник? А) тепловое, химическое и магнитное действия; Б) химическое и магнитное действия, теплового нет; В) тепловое и магнитное действия, химического действия нет; Г) тепловое и химическое действия, магнитного действия нет. «Быстро и в точку»
27 слайд Описание слайда:
Описание слайда:§ 35, 36 Приготовить примеры действий электрического тока, встречающихся в жизни. «Домашнее задание»

Курс профессиональной переподготовки
Учитель физики

Курс повышения квалификации

Курс повышения квалификации
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедия, ДефектологияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРодная литератураРодной языкРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:

Общая информация
Номер материала: ДВ-481009
Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарийФизика 8 класс. Действия электрического тока :: Класс!ная физика
Физика 8 класс. ДЕЙСТВИЯ ЭЛЕКТРИЧЕСКОГО ТОКА
Действия электрического тока — это те явления, которые вызывает электрический ток.
По этим явлениям можно судить «есть» или «нет» в электрической цепи ток.
Тепловое действие тока.
— электрический ток вызывает разогревание металлических проводников (вплоть до свечения).
Химическое действие тока.
— при прохождении электрического тока через электролит возможно выделение веществ,
содержащихся в растворе, на электродах..
— наблюдается в жидких проводниках.
Магнитное действие тока.
— проводник с током приобретает магнитные свойства.
— наблюдается при наличии электрического тока в любых проводниках (твердых, жидких, газообразных).
А СМОЖЕШЬ ЛИ ТЫ СООБРАЗИТЬ ?
Открытие физика Араго в 1820 г. заключалось в следующем: когда тонкая медная проволока,
соединенная с источником тока, погружалась в железные опилки, то они приставали к ней.
Объясните это явление.
В коробке перемешаны медные винты и железные шурупы.
Каким образом можно быстро рассортировать их, имея аккумулятор, достаточно длинный
медный изолированный провод и железный стержень?
КНИЖНАЯ ПОЛКА
ДЕЙСТВИЕ ЭЛЕКТРИЧЕСКОГО ТОКА НА ОРГАНИЗМ ЧЕЛОВЕКА.
Физиологическое действие тока на ранней стадии развития науки об электричестве было единственным,
о котором было известно ученым, и было основано на собственных ощущениях экспериментаторов.
Одним из первых, кто ощутил на себе действие тока, был голландский физик П.Мушенбрук,
живший в 18 веке. Получив удар током он заявил, что «не согласился бы подвергнуться
ещё раз такому испытанию даже за королевский трон Франции.»
отрицательное действие :
Электрический ток вызывает изменения в нервной системе, выражающиеся в ее раздражении
или параличе. При воздействии электрического тока возникают судорожные спазмы мышц.
Принято говорить, что электрический ток человека «держит»: пострадавший не в состоянии
выпустить из рук предмет — источник электричества.
___
При поражении достаточно сильным электрическим током происходит
судорожный спазм диафрагмы — главной дыхательной мышцы в организме — и сердца.
Это вызывает моментальную остановку дыхания и сердечной деятельности. Действие электрического тока на мозг вызывает потерю сознания. Соприкасаясь с телом человека, электрический ток
оказывает также тепловое действие, причем в месте контакта возникают ожоги III степени.
___
Постоянный ток менее опасен, чем переменный в электросети, который даже под напряжением 220В может вызвать очень тяжелое поражение организма. Действие электрического тока на человека усиливается при наличии промокшей обуви, мокрых рук, которым свойственна
повышенная электропроводность.

