Биология и квантовая механика
Биология и квантовая механика
ОглавлениеПРЕДИСЛОВИЕГЛАВА I. СВЯЗЬ БИОЛОГИИ И ФИЗИКИ § 2. Возможность описания биологических явлений на молекулярном уровне ГЛАВА II. ВЗАИМОДЕЙСТВИЕ АТОМОВ В МОЛЕКУЛАХ И МОЛЕКУЛ МЕЖДУ СОБОЙ § 4. Электронное строение основных атомов биомолекул § 5. Взаимодействие между атомами Направленные валентности атомов. Кратные связи между атомами. § 6. Взаимодействие между молекулами 6.2. Водородные связи между молекулами § 7. Взаимодействие ионов и молекул с водой 7.2. Гидрофобные и гидрофильные взаимодействия ГЛАВА III. БЕЛКИ И ИХ БИОЛОГИЧЕСКИЕ ФУНКЦИИ § 8. Структура белков 8.2. Первичная структура белков 8.3. Вторичная и более высокого порядка структуры белковых молекул § 9. 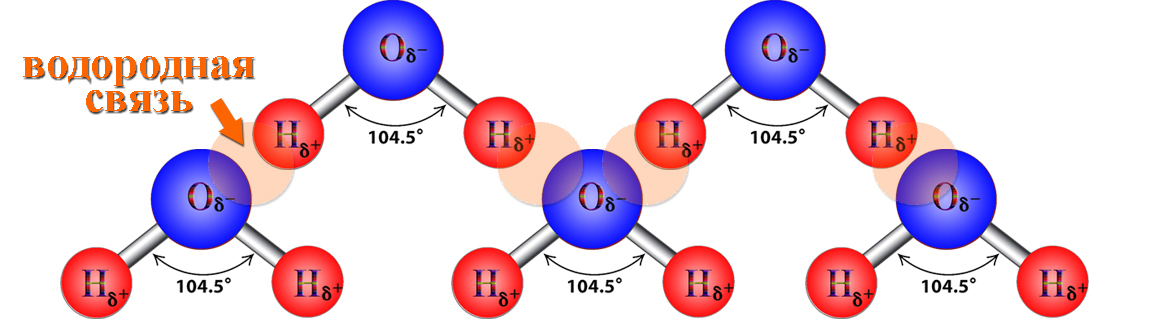 Некоторые биологические функции белков Некоторые биологические функции белков9.2. Биокатализаторы — ферменты 9.3. Аллостерические ферменты. Кооперативность 9.4. Контроль биохимических реакций § 10. Ферменты с известной пространственной структурой ГЛАВА IV. КЛЕТОЧНЫЕ МЕМБРАНЫ 11.1. Узнавание клетками друг друга § 12. Состав и структура клеточных мембран 12.1. Внутренние мембранные белки 12.2. Динамические модели клеточных мембран 12.3. Кооперативные явления в мембранах § 13. Пассивный транспорт ионов и молекул через мембраны 13.1. Транспорт молекул и ионов через мембраны, разделяющие электролиты 13.2. Пассивный транспорт при участии переносчиков 13.3. Молекулярный механизм мембранной активности валиномицина 13.4. Трансмембранная разность потенциалов § 14. Принудительный транспорт молекул и ионов через биологические мембраны 14.3. Окислительное фосфорилирование 14.  4. Активный транспорт в мембранах бактерий 4. Активный транспорт в мембранах бактерийГЛАВА V. БИОЭНЕРГЕТИКА 15.1. Молекула АТФ как универсальный аккумулятор энергии в клетке § 16. Митохондрии — энергетические фабрики клеток 16.1. Цепь электронного транспорта в митохондриях 16.2. Гипотезы о механизме фосфорилирования во внутренних мембранах митохондрий 16.3. Хемиосмотическая гипотеза о сопряжении процессов дыхания и фосфорилирования § 17. Механизм фотосинтеза 17.1. Хлорофилл и другие светочувствительные пигменты 17.3. Фотосинтезирующие системы бактерий и синезеленых водорослей 17.4. Две фотосинтезирующие системы у растений 17.5. Механизм сопряжения реакций разделения электрических зарядов квантами света и фотофосфорилирования 17.6. Темновая фаза фотосинтеза 17.7. Фотосинтезирующий механизм без молекул хлорофилла § 18. Передача нервного импупьса 18.1. Немиелинизированные нервные волокна 18.2. Потенциал действия 18. 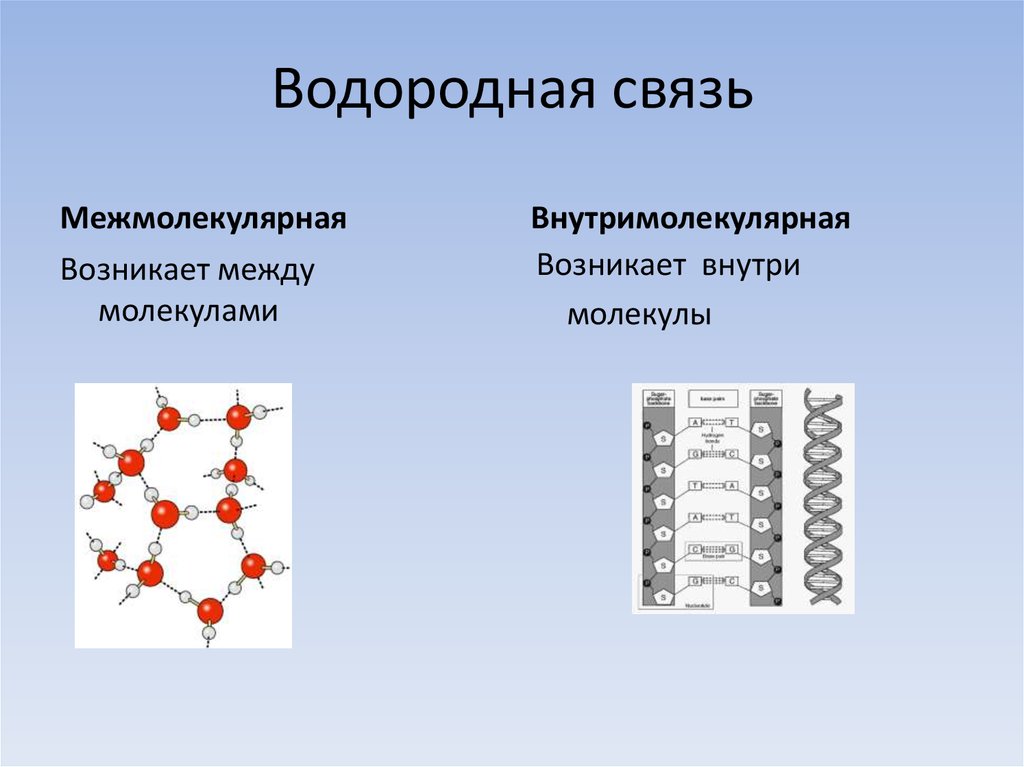 3. Уравнения Ходжкина — Хаксли 3. Уравнения Ходжкина — Хаксли18.4. Распространение импульсов по нервным волокнам 18.6. Нервно-мышечные синапсы ГЛАВА VI. МОЛЕКУЛЯРНЫЙ МЕХАНИЗМ МЫШЕЧНОГО СОКРАЩЕНИЯ 19.1. Саркоплазматическая сеть поперечнополосатых мышц 19.2. Микроструктура миофибрилл 19.3. Биохимия процесса мышечного сокращения § 20. Современные представления о механизме сокращения мышц 20.2. Феноменологические теории механизма сокращения поперечнополосатых мышц 20.3. Молекулярная теория мышечного сокращения § 21. Сократительные системы нескелетных мышц 21.2. Асинхронные мышцы насекомых 21.3. Движение с помощью ресничек и жгутиков 21.4. Специализированные мышечные клетки ГЛАВА VII. МИГРАЦИЯ ЭНЕРГИИ И ЭЛЕКТРОНОВ В БИОЛОГИЧЕСКИХ СИСТЕМАХ § 22. Миграция энергии в одномерных молекулярных системах 22.3. Сравнение свойств солитонов и экситонов 22.4. Солитоны в а-спиральных белковых молекулах § 23.  Транспорт электронов в биологических системах Транспорт электронов в биологических системах23.1. Туннельный перенос электронов 23.2. Роль белков в процессе электронного транспорта на большие расстояния СПИСОК ЛИТЕРАТУРЫ |
Понятие о водородной связи — Химия. 9 класс. Григорович
Химия. 9 класс. Григорович
Вспомните: как образуется ковалентная связь.
Понятие о водородной связи
Благодаря полярности и электронному строению молекул воды между ними образуется особый тип химической связи — водородная связь. В отличие от уже известных вам типов химической связи, водородная связь является межмолекулярной, то есть образуется между молекулами.
Вспомним электронное строение молекулы воды, которое мы рассматривали еще в 8 классе: при образовании молекулы воды между атомами Оксигена и Гидрогена возникают две общие электронные пары, определяющие ковалентную связь в молекуле воды. При этом у атома Оксигена еще остаются две неподеленные электронные пары:
Эти электронные пары образуют повышенную электронную плотность вокруг атома Оксигена и позволяют ему взаимодействовать с другими частицами (ионами или молекулами), у которых «дефицит» электронной плотности.
Значит, между атомом Оксигена одной молекулы воды и атомом Гидрогена другой молекулы возникает дополнительное взаимодействие:
Такое взаимодействие называют водородной связью и обозначают рядом точек (рис. 5.1). Эта связь не так сильна, как ковалентная, но ее достаточно, чтобы удерживать молекулы воды вместе.
Рис. 5.1. Атомы Гидрогена и Оксигена в молекуле воды образуют водородные связи с соседними молекулами
• Водородная связь — это взаимодействие атома Гидрогена, соединенного с электроотрицательным атомом (Оксигена, Нитрогена или Флуора), одной молекулы со значительно более электроотрицательным атомом другой молекулы.
Влияние водородной связи на физические свойства веществ
В воде атом Оксигена благодаря двум неподеленным электронным парам образует связи с атомами Гидрогена двух соседних молекул воды.
Рис. 5.2. Кристаллические решетки твердой воды: каждая молекула образует по четыре водородные связи с соседними молекулами
Рис. 5.3. В жидкой воде молекулы расположены неупорядоченно и близко друг к другу; во льду молекулы расположены упорядоченно и на большем расстоянии, поэтому лед легче воды (а). При замерзании вода расширяется, в результате чего закрытая стеклянная бутылка, полная воды, в морозилке лопается (б)
Благодаря дополнительному связыванию молекул водородными связями вода обладает аномальными физическими свойствами. Так, молекулярные вещества с небольшими молекулярными массами имеют низкие температуры кипения и плавления.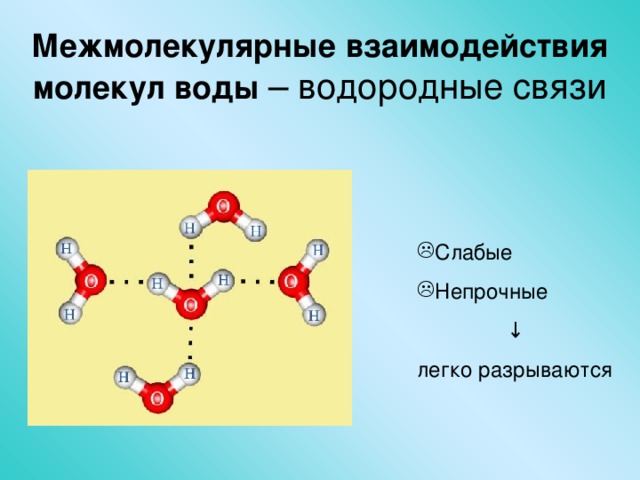 Но благодаря водородным связям у воды аномально высокая температура кипения (Mr = 18, tкип. = +100 °С) по сравнению, например, с кислородом (M
Но благодаря водородным связям у воды аномально высокая температура кипения (Mr = 18, tкип. = +100 °С) по сравнению, например, с кислородом (M
Возможностью образования водородных связей с молекулами других веществ, которые также способны образовывать такие связи, объясняется хорошая растворимость многих веществ в воде: спирта, сахара, ацетона, уксусной кислоты и др.
Наличие дополнительного связывания молекул водородными связями также приводит к аномально высокой теплоемкости воды: чтобы ускорить тепловое движение, молекулам необходимо значительно больше теплоты. Такая особенность воды имеет большое значение для формирования климата Земли. Вблизи морей и океанов климат мягче, чем в центре континентов.
Такая особенность воды имеет большое значение для формирования климата Земли. Вблизи морей и океанов климат мягче, чем в центре континентов.
Водородную связь могут образовывать не только молекулы воды, но и молекулы других веществ: неорганических (гидроген флуорида HF, аммиака NH3 и др.) и органических (этилового спирта, ацетона, уксусной кислоты и др.), что объясняет их хорошую растворимость в воде.
Благодаря водородным связям молекулы белков и нуклеиновых кислот имеют спиральное строение, о чем вы подробнее узнаете на уроках биологии и при изучении органической химии.
Ключевая идея
Водородная связь — особый тип межмолекулярного взаимодействия. Наличие водородных связей обусловливает аномальные физические свойства воды, а также растворимость многих веществ.
Контрольные вопросы
- 54. Какую связь называют водородной? Благодаря чему она образуется?
- 55. Как влияет наличие водородной связи на физические свойства воды?
- 56.
 Сравните приведенные в тексте параграфа молекулярные массы соединений и их температуры кипения. Какой факт свидетельствует о наличии водородной связи между молекулами воды?
Сравните приведенные в тексте параграфа молекулярные массы соединений и их температуры кипения. Какой факт свидетельствует о наличии водородной связи между молекулами воды? - 57. Почему возможность образования водородной связи влияет на растворимость веществ, теплоемкость и поверхностное натяжение воды?
Задания для усвоения материала
58*. Используя пластилин или другой материал, изготовьте модели молекул воды и соедините их водородными связями, как показано на рисунке 5.2. По возможности создайте компьютерную модель.
59*. В дополнительных источниках найдите информацию о влиянии водородной связи на физические свойства веществ и ее роль в биологических системах.
ГДЗ к учебнику можно найти тут.
Попередня
СторінкаНаступна
СторінкаЗміст
более слабых связей в биологии | Биология для неспециалистов I
Результаты обучения
- Моделирование водородной связи и выявление ее уникальных качеств
- Моделирование ван-дер-ваальсовых взаимодействий и выявление их уникальных качеств
Водородные связи
Ионные и ковалентные связи между элементами требуют энергии для разрыва.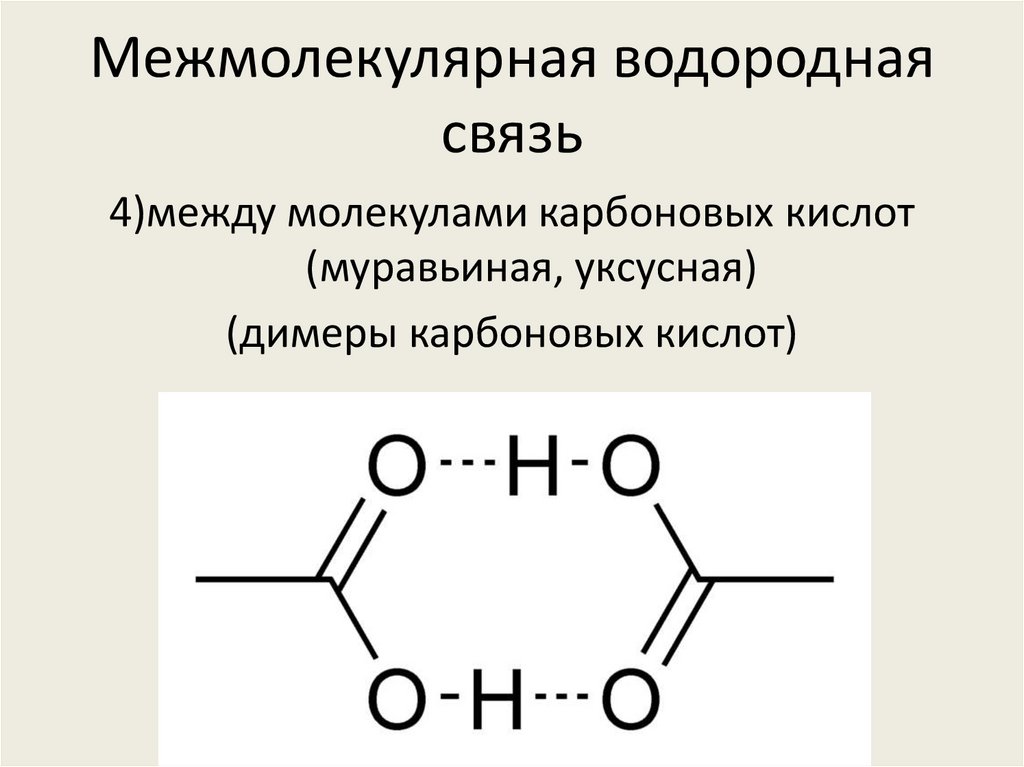 Ионные связи не так прочны, как ковалентные, что определяет их поведение в биологических системах. Однако не все связи являются ионными или ковалентными. Более слабые связи могут также образовываться между молекулами. Часто встречаются две слабые связи: водородные связи и ван-дер-ваальсовы взаимодействия. Без этих двух типов связей жизнь, какой мы ее знаем, не существовала бы. Водородные связи обеспечивают многие важные для поддержания жизни свойства воды, а также стабилизируют структуры белков и ДНК, строительных блоков клеток.
Ионные связи не так прочны, как ковалентные, что определяет их поведение в биологических системах. Однако не все связи являются ионными или ковалентными. Более слабые связи могут также образовываться между молекулами. Часто встречаются две слабые связи: водородные связи и ван-дер-ваальсовы взаимодействия. Без этих двух типов связей жизнь, какой мы ее знаем, не существовала бы. Водородные связи обеспечивают многие важные для поддержания жизни свойства воды, а также стабилизируют структуры белков и ДНК, строительных блоков клеток.
Когда образуются полярные ковалентные связи, содержащие водород, водород в этой связи имеет слегка положительный заряд, потому что электрон водорода сильнее притягивается к другому элементу и от водорода. Поскольку водород слегка положителен, он будет притягиваться к соседним отрицательным зарядам. Когда это происходит, происходит слабое взаимодействие между зарядом δ + водорода одной молекулы и зарядом δ – на более электроотрицательных атомах другой молекулы, обычно кислорода или азота, или внутри той же молекулы.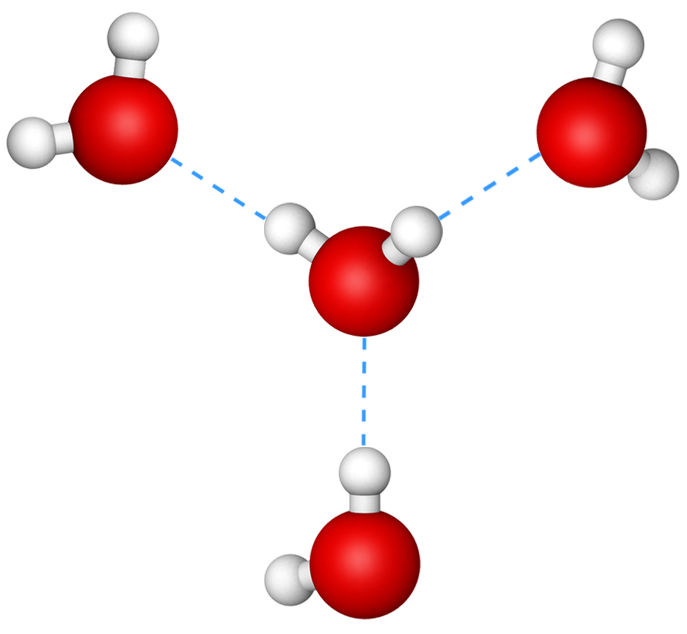
Водородная связь между молекулами воды
Рис. 1. Водородные связи образуются между слегка положительным (δ+) и слегка отрицательным (δ–) зарядами полярных ковалентных молекул, таких как вода.
Это взаимодействие называется водородной связью . Этот тип связи распространен и регулярно возникает между молекулами воды. Индивидуальные водородные связи слабы и легко рвутся; однако они встречаются в очень больших количествах в воде и органических полимерах, создавая вместе большую силу. Водородные связи также ответственны за скрепление двойной спирали ДНК.
Видеообзор
Взаимодействия Ван-дер-Ваальса
Подобно водородным связям, взаимодействия Ван-дер-Ваальса представляют собой слабое притяжение или взаимодействие между молекулами. Их также называют межмолекулярными силами. Они возникают между полярными, ковалентно связанными атомами в разных молекулах. Некоторые из этих слабых притяжений вызваны временными частичными зарядами, образующимися при движении электронов вокруг ядра. Эти слабые взаимодействия между молекулами важны в биологических системах и происходят на основе физической близости.
Их также называют межмолекулярными силами. Они возникают между полярными, ковалентно связанными атомами в разных молекулах. Некоторые из этих слабых притяжений вызваны временными частичными зарядами, образующимися при движении электронов вокруг ядра. Эти слабые взаимодействия между молекулами важны в биологических системах и происходят на основе физической близости.
Техник-радиолог
Рисунок 2. Спец. Арбор Л. Лаклав практикует рентгенографию позвоночника, используя Spc. Джастин Дж. Райхельт, техник-рентгенолог, в образе своего фиктивного пациента, который отрабатывает свои навыки в поликлинике в учебной зоне Графенвер.
Делали ли вы или кто-либо из ваших знакомых магнитно-резонансную томографию (МРТ), маммографию или рентген? Эти тесты производят изображения ваших мягких тканей и органов (как при МРТ или маммографии) или ваших костей (как это происходит при рентгене) с использованием либо радиоволн, либо специальных изотопов (помеченных радиоактивным или флуоресцентным маркером), которые проглатываются или вводятся внутрь. тело. Эти тесты предоставляют данные для диагностики заболеваний путем создания изображений ваших органов или скелетной системы.
тело. Эти тесты предоставляют данные для диагностики заболеваний путем создания изображений ваших органов или скелетной системы.
МРТ работает, подвергая ядра водорода, которых много в воде в мягких тканях, флуктуирующим магнитным полям, которые заставляют их излучать собственное магнитное поле. Затем этот сигнал считывается датчиками машины и интерпретируется компьютером для формирования подробного изображения.
Некоторые технологи и техники рентгенографии специализируются на компьютерной томографии, МРТ и маммографии. Они производят фильмы или изображения тела, которые помогают медицинским работникам исследовать и ставить диагноз. Рентгенологи работают непосредственно с пациентами, объясняя работу механизмов, готовя их к обследованиям и следя за тем, чтобы их тело или части тела располагались правильно для получения необходимых изображений. Затем врачи или рентгенологи анализируют результаты теста.
Специалисты по рентгенографии могут работать в больницах, кабинетах врачей или специализированных центрах визуализации.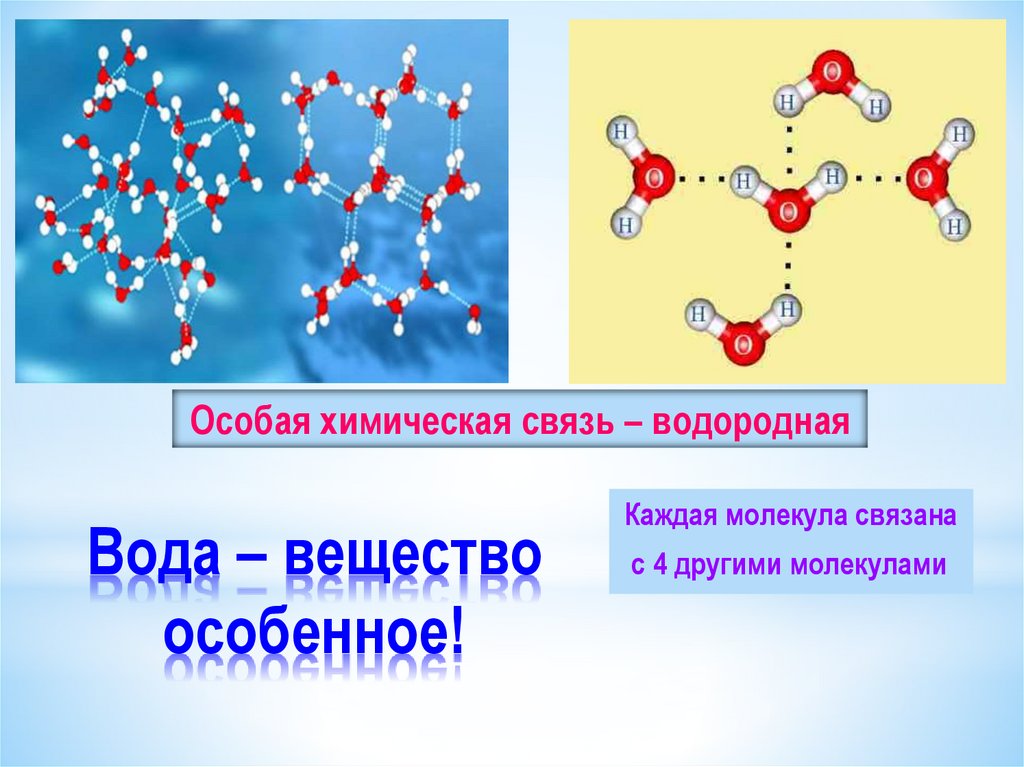 Обучение на техника-рентгенолога происходит в больницах, колледжах и университетах, которые предлагают сертификаты, степени младшего специалиста или бакалавра в области рентгенографии.
Обучение на техника-рентгенолога происходит в больницах, колледжах и университетах, которые предлагают сертификаты, степени младшего специалиста или бакалавра в области рентгенографии.
Попробуйте
Попробуйте
Внесите свой вклад!
У вас есть идеи по улучшению этого контента? Мы будем признательны за ваш вклад.
Улучшить эту страницуПодробнее
Связывание — водородное связывание в воде (химия уровня A)
Изучение разума
5 минут чтения
Водородная связь в воде Как мы говорили в предыдущей главе, водородные связи представляют собой особый тип постоянных диполь-дипольных сил, которые образуются, когда водород образует ковалентную связь с очень электроотрицательным элементом: либо азот , кислород или фтор . Они представляют собой сильнейший тип межмолекулярной силы.
Они представляют собой сильнейший тип межмолекулярной силы.
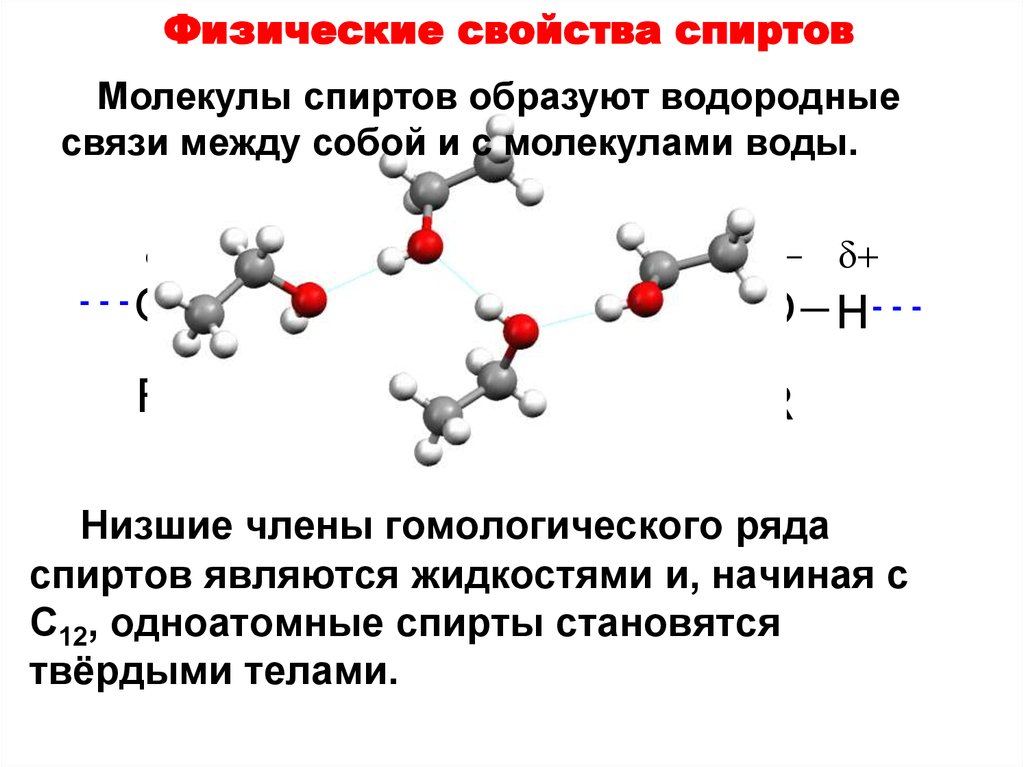
Молекулы воды представляют собой сильно поляризованные молекулы, способные образовывать разветвленную сеть водородных связей. Неподеленные пары электронов на атомах кислорода притягиваются к δ+ водорода в соседних молекулах воды . Каждая молекула воды может образовывать всего 4 водородные связи.
Склеивание – водородная связь в воде
Обширные водородные связи, возникающие в воде, объясняют ее аномальные физические свойства .
Точка кипения
Если мы сравним температуры кипения гидридов группы 6, мы увидим, что температуры кипения воды значительно выше, чем можно было бы ожидать.
Склеивание – водородная связь в воде
По мере того, как мы спускаемся вниз, увеличивается группа и число электронов, увеличивается и сила лондоновских сил между молекулами, так что температура кипения увеличивается.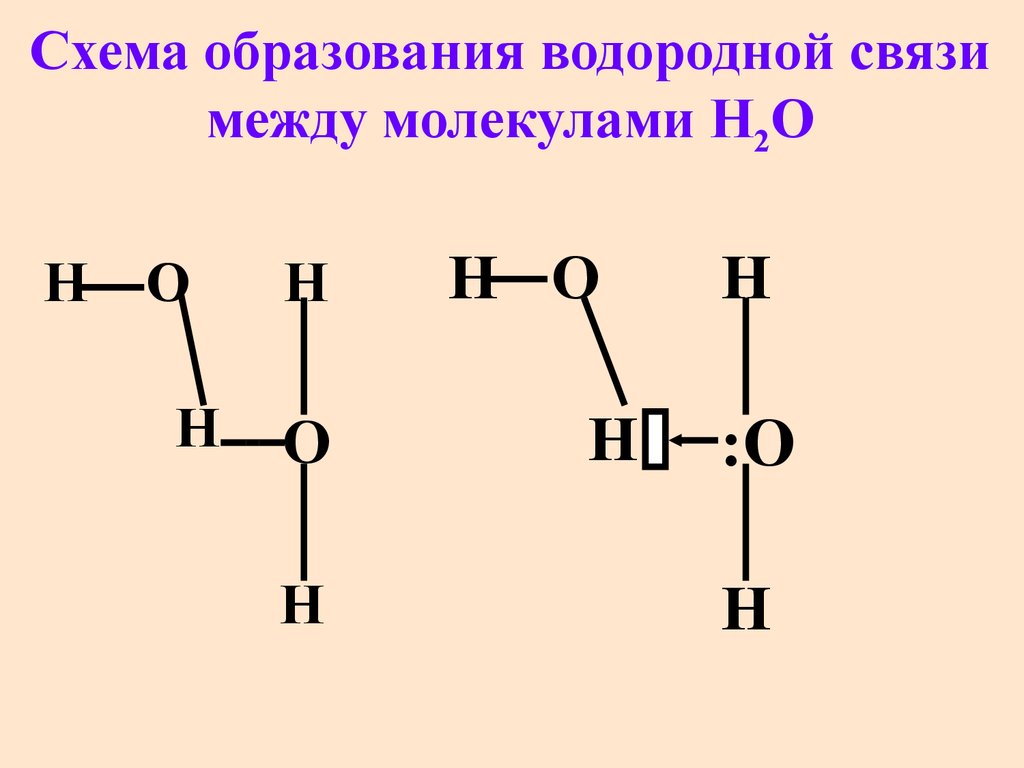 Однако сильных водородных связей , которые образуются между молекулами воды, подавляют влияние их более слабых лондонских сил. Тот же принцип применим к точкам плавления .
Однако сильных водородных связей , которые образуются между молекулами воды, подавляют влияние их более слабых лондонских сил. Тот же принцип применим к точкам плавления .
Поверхностное натяжение
Поверхностное натяжение относится к тому, насколько сильно молекулы удерживаются на поверхности жидкости. В результате водородных связей, которые оказывают сильное направленная вниз сила на молекулы воды на поверхности, у воды поверхностное натяжение выше, чем у большинства других жидкостей.
Вязкость
Вязкость является мерой сопротивления течению жидкости в результате трения между ее молекулами. Из-за водородных связей между молекулами воды меньше способность скользить друг по другу, так что вода имеет высокую вязкость .
Плотность
В общем, твердые тела плотнее их жидкостей, но для воды плотность твердого льда на ниже плотности жидкой воды.
Склеивание – водородная связь в воде
Когда вода замерзает и превращается в лед, молекулы воды выстраиваются в трехмерную сеть, где каждая молекула воды связана с четырьмя другими молекулами воды молекул водородными связями. В результате этой регулярной решетки структуры молекулы воды в твердом льду находятся дальше друг от друга, чем молекулы в жидкой воде. Структура во льду более открыта, что делает его менее плотным , чем вода.
Вода как растворитель
Растворитель представляет собой жидкую среду для реакции.
Растворители с постоянным дипольным моментом, такие как вода, называются полярными , а растворители без него называются неполярными .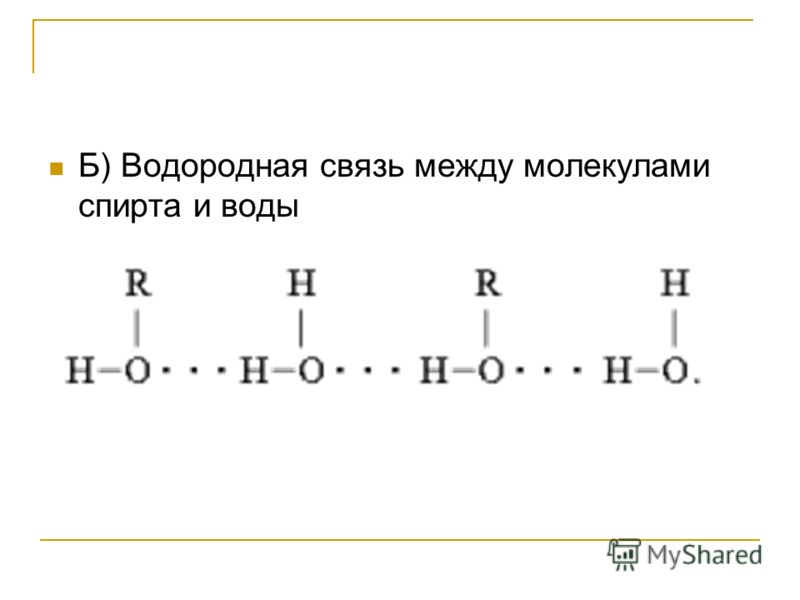
Когда соединение растворяется в растворителе:
1) Межмолекулярные силы внутри соединения разрушаются
2) Образуются новые связи с молекулами растворителя
Следовательно, чтобы растворитель мог растворять соединение, оба должны быть способны образовывать аналогичны межмолекулярным силам.
- Вода может растворять ионные соединения. Частичные заряды молекул воды притягиваются к заряженным ионам в ионной решетке, образуя ион-дипольные взаимодействия . Общая сила большого количества образующихся ион-дипольных взаимодействий достаточна для преодоления электростатических сил между противоположно заряженными ионами в решетке и разбить его на части. Ионы диссоциируют и окружаются молекулами воды в результате процесса, известного как гидратация , так что они могут свободно перемещаться в растворе.

- Вода может растворять простые спирты. Спирты представляют собой соединения с гидроксильной группой и в результате могут образовывать водородные связи с водой. Однако спирты с длинной цепью менее растворимы в воде, поскольку более связи должны быть разрушены, чем те, которые образуются. В результате энергия, выделяющаяся при образовании связи , не компенсирует энергии, потерянной при разрыве связи, так что спирт плохо растворяется в воде.
- Не все полярные молекулы хорошо растворяются в воде . Галогеналканы например, не растворяются в воде. Это потому, что их диполь момент слишком слаб для образования водородных связей с молекулами воды.
 Водородные связи между молекулами воды сильнее, чем дипольные взаимодействия , которые могут образовываться между молекулами воды и галогеналканом , поэтому соединение не растворяется.
Водородные связи между молекулами воды сильнее, чем дипольные взаимодействия , которые могут образовываться между молекулами воды и галогеналканом , поэтому соединение не растворяется.
- Неполярные соединения не растворяются в воде . Неполярные соединения , такие как йод, полностью нерастворимы в воде. № на полярных растворителях таких как диэтиловый эфир, который может образовывать сил Лондона с неполярными соединениями.
Доступ к 20 БЕСПЛАТНЫМ учебникам по химии
Выберите свою экзаменационную доску из раскрывающегося списка, и инструкции о том, как получить доступ, будут отправлены на ваш почтовый ящик.
Ваш адрес электронной почты
Выберите опцию Учебники по общей химии уровня AУчебники по химии уровня CIEУровень A Учебники по химии в EdexcelУчебники по химии уровня A OCRУчебники по химии уровня AQA
Давайте знакомиться?
Как тебя зовут?
Далее
Приятно познакомиться, {{name}}!
Какой предпочитаемый номер телефона?
Какой предпочитаемый номер телефона?
Далее
Просто проверить, что вас интересует?
1-1 Репетиторство Онлайн-курс Стипендии/Ресурсы Другое
Когда мы должны вам позвонить?
Было бы здорово провести 15-минутный чат, чтобы обсудить индивидуальный план и ответить на любые вопросы
Другой день
Пропустить звонок
Какое время вам больше всего подходит? (британское время)
Выберите наиболее удобный для вас временной интервал?
8:00-14:00 14:00–22:00
10:00–22:30 10:30-11:00 11:00-11:30 11:30-12:00 12:00-12:30 12:30-13:00
15:00-15:30 15:30-16:00 16:00-16:30 16:30-17:00 17:00-17:30 17:30-18:00 18:00-18:30 18:30-19:00 19:00-19:30 19:30-20:00
Сколько часов индивидуальных занятий вы ищете?
0-5 10 20-30 40+
Мой номер WhatsApp.
 ..
..Такой же, как тот, который я ввел Отличается от того, который я ввел Следующие
Пожалуйста, подтвердите нашу политику безопасности…
мне нет 18 Я старше 18
Представлять на рассмотрение
Какой онлайн-курс вас интересует?
ДалееКаков ваш вопрос?
ОтправитьВы можете подать заявку на получение стипендии, нажав на эту ссылку
https://www.medicmind.co.uk/medic-mind-foundation/Конечно, какой у вас вопрос?
ОтправитьИдет загрузка…
Спасибо за ответ.
Мы постараемся ответить вам в течение 12-24 часов.
Запишитесь на 2-часовой урок 1-1 с репетитором прямо сейчас
Если вы готовы и хотите начать, нажмите кнопку ниже, чтобы забронировать свой первый 2-часовой урок с репетиторством 1-1 у нас.



 Сравните приведенные в тексте параграфа молекулярные массы соединений и их температуры кипения. Какой факт свидетельствует о наличии водородной связи между молекулами воды?
Сравните приведенные в тексте параграфа молекулярные массы соединений и их температуры кипения. Какой факт свидетельствует о наличии водородной связи между молекулами воды?
 Водородные связи между молекулами воды сильнее, чем дипольные взаимодействия , которые могут образовываться между молекулами воды и галогеналканом , поэтому соединение не растворяется.
Водородные связи между молекулами воды сильнее, чем дипольные взаимодействия , которые могут образовываться между молекулами воды и галогеналканом , поэтому соединение не растворяется.