строение в различных агрегатных состояниях
Автор Исаев Виктор Алексеевич На чтение 7 мин Опубликовано
Вода является источником жизни для всех живых организмов.
Молекула воды имеет уникальное строение. В ней удивительным образом сочетаются прочность и устойчивость кристаллической структуры (льда), и подвижность жидкого вещества.
В статье мы подробно рассмотрим особенности строения молекулы воды в различных агрегатных состояниях: жидком, твердом, газообразном.
Содержание
- Какое строение имеет молекула воды
- Водородная связь
- Строение молекулы в различных агрегатных состояниях
- Лед
- Жидкая вода
- Водяной пар
- Из чего состоит вода
- Элементы
- Подводим итоги
Какое строение имеет молекула воды
Долгое время химики считали воду простым соединением, не вступающим в сложные реакции.
Состав воды как сложного вещества был установлен Лавуазье в 1783 г.
Одна молекула воды состоит из трех атомов: двух атомов водорода и одного атома кислорода, которые соединены между собой ковалентной связью. Химическая формула: H₂O
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость. Они определяют химические и физические свойства соединений.
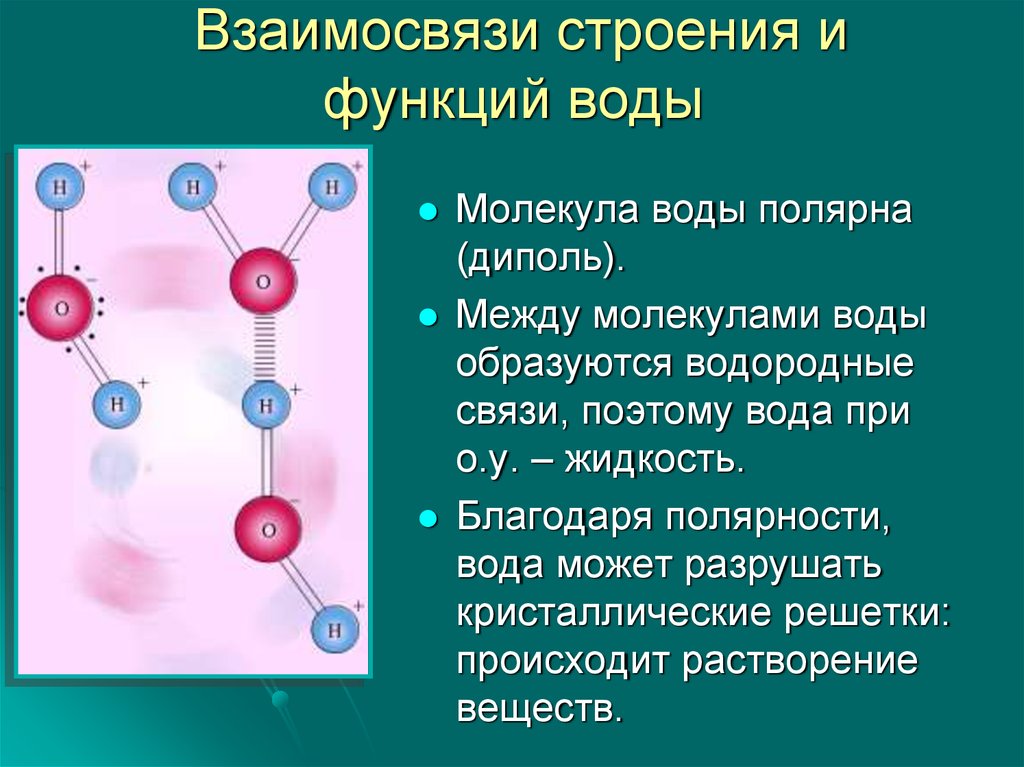
Молекула воды, картинка № 1По форме молекула воды напоминает равнобедренный треугольник, в основании которого находятся два атома водорода.Связь между атомом кислорода и атомами водорода полярная, т.к. кислород притягивает электроны сильнее, чем водород.
Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°.
Молекула воды имеет два положительных и два отрицательных полюса и поэтому в большинстве случаев ведёт себя как диполь (т.е. на одной стороне – положительный заряд, на другой – отрицательный)
Значения эффективных зарядов на атомах составляет ±0,17 от заряда электрона.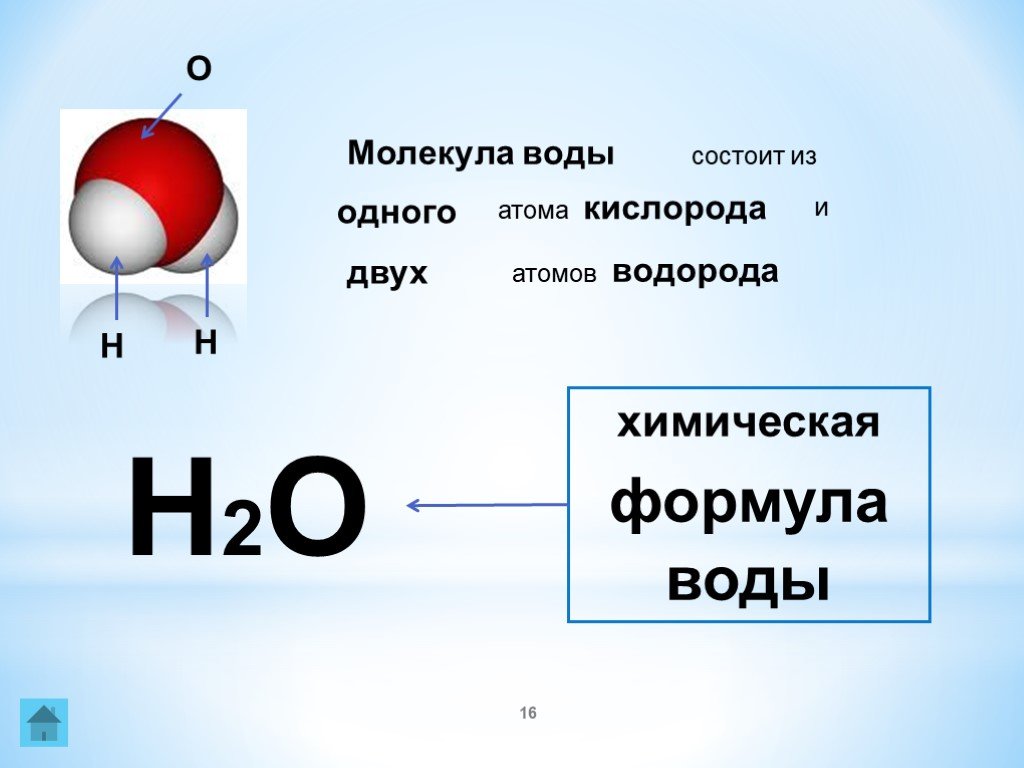
Водородная связь
В жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты за счёт особой химической связи, которая называется водородной.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость зависит и от способности соединения давать водородные связи с растворителем. В результате содержащие ОН-группы такие вещества, как сахар, глюкоза, спирты, карбоновые кислоты, как правило, хорошо растворимы в воде.
На картинке № 2 показано образование димера воды с одной водородной связью.Димер — это две молекулы Н2О, соединенные водородной связью. Связь между молекулами воды водородная.
Каждая молекула способна образовать четыре водородные связи: две между неподеленными электронными парами её атома кислорода и атомами водорода соседних молекул и ещё две – между атомами водорода и атомами кислорода двух других молекул.
Энергия водородной связи может изменяться от 17 до 33 кДж/моль.
Строение молекулы в различных агрегатных состояниях
Вода может быть в нескольких состояниях:
- Жидком. Это ее преимущественное состояние в нормальных условиях. Жидкая вода образует многочисленные реки, ручьи, озёра, Мировой океан.
- Твердом – это лед, а его кристаллы часто образуют иней или снег.
- Газообразном — водяной пар.
Существуют также и переходные состояния жидкости, которые возникают при замерзании или испарении.
Примечательно, что различные формы воды могут одновременно находиться рядом и даже взаимодействовать, например реки с ледниками, айсберги с морской водой, облака на небе с водяным паром.
Строение молекулы воды, водородная связь способствует расположению молекул воды. Рассмотрим особенности каждого агрегатного состояния по отдельности.
Лед
Представляет собой твердое состояние воды.
Молекулы воды образуют слои, причём каждая молекула связана с тремя молекулами в своём слое и с одной молекулой соседнего слоя. Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Атом кислорода связан с четырьмя атомами водорода: с двумя, расположенными на расстоянии 0,096 — 0,102 нм посредством валентных связей, и с двумя другими, находящимися на расстоянии 0,174 — 0,180 нм посредством водородных связей.
Жидкая вода
В отличие от структуры льда структура жидкой воды исследована ещё недостаточно.
Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
В результате изучения молекулы воды с помощью инфракрасных и рентгеновых лучей было видно, что при температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах.
При температуре близкой к точке кипения они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
При данном состоянии молекула воды не имеет структуры и состоит преимущественно из мономерных молекул воды, которые находятся на расстояние относительно друг друга.
Из чего состоит вода
При обычных условиях вода выглядит как прозрачная жидкость. У нее отсутствуют вкус и запах. При небольшой толщине слоя не наблюдается даже цвета.
Вода является отличным растворителем. В природе в ней постоянно находятся растворенные газы и соли. При соединении атомов кислорода с водородом получается молекула воды. Поскольку более сильными являются водородные соединения, то, когда происходит их разрыв, они прикрепляются к иным веществам, помогая тем растворяться.
Из-за своего малого размера каждую молекулу растворенного вещества окружают очень много молекул воды. Благодаря этому в ней присутствуют отрицательные и положительные ионы.
Чистая вода является еще и хорошим изолятором с концентрацией протонов и гидроксильных ионов в количестве 10-7 моль/л, это позволяет ей проводить электричество. Именно по ее электропроводности можно оценивать чистоту жидкости.
При взаимодействии с другими веществами состав воды не изменяется, что играет особую роль в жизни любого живого организма.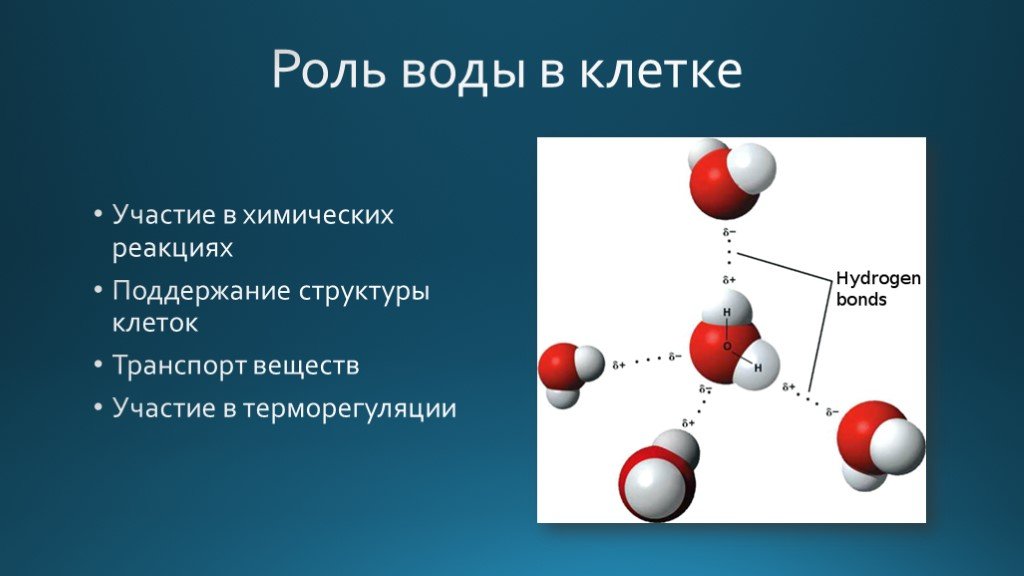 Ведь очень важно, чтобы жидкостные растворы, через которые в организм поступают полезные вещества, не изменялись.
Ведь очень важно, чтобы жидкостные растворы, через которые в организм поступают полезные вещества, не изменялись.
Кроме того, вода хорошо поглощает инфракрасное и микроволновое излучение, а также способна хранить в себе память о веществах, которые были в ней растворены.
Элементы
Проходя гидрологический цикл: испарение, конденсацию и выпадение в виде осадков вода может дополняться разными химическими элементами, которые можно разделить на 6 категорий. Рассмотрим информацию в таблице № 1.
Таблица № 1 «Элементы, которые могут входить в состав воды».
| Ионы | Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты находятся в воде в наибольшем, по сравнению с другими, количестве. |
| Растворенные газы | Кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры. |
| Биогенные элементы | Главными из них являются фосфор и азот, которые поступают в жидкость из осадков |
| Микроэлементы | Их насчитывается около 30 видов: бром, селен, медь, цинк и т. |
| Органические вещества | Спирты, углеводы, альдегиды, фенолы, пептиды и прочее. |
| Токсины | Тяжелые металлы и продукты нефтепереработки. |
В настоящий момент доступны специальные методы очистки, которые эффективно борются с вредными химическими соединениями.
Вода также может содержать в себе магний и катионы кальция. В зависимости от этого ее подразделяют на мягкую и жесткую.
По изотопам водорода в молекуле воды можно говорить о легкой воде, тяжелой и сверхтяжелой воде.
Подводим итоги
Вода необходима для жизни всего живого на Земле. Она участвует в мировом круговороте воды в природе. Благодаря испарению с поверхности водоемов, почвы, растений образуются облака. Затем они выпадают в виде дождя, снега, града, питая собой подземные воды и родники. Родниковые воды по рекам попадает в море.
Таким образом, количество воды на Земле не изменяется, она только меняет свои формы — это и есть круговорот воды в природе.
Уникальное строение молекулы воды помогает ей трансформироваться в три агрегатных состояния.
При замерзании воды ее молекулы собираются в небольшие группы. При испарении находится на расстоянии относительно друг друга. Жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
Список литературы
- Химия и микробиология воды. Учебное пособие В. В. Котов, Г.А. Нетесова
- Конспект лекций ГИДРОГЕОХИМИЯ. Киреева Т.А., МГУ им. М.В. Ломоносова, 2016
1. Особенности молекулярного строения жидкостей.
Обычные жидкости
изотропны, структурно они являются
аморфными телами. Для жидкостей характерен
ближний порядок в расположении молекул.
Расстояния между молекулами невелики,
силы взаимодействия значительны, что
приводит к 1 малой сжимаемости жидкостей:
небольшое уменьшение расстоя ния между
молекулами вызывает появление больших
сил межмолекулярного отталкивания.Жидкости
мало сжимаемы и обладают большой
плотностью, подобно газам, принимают
форму сосуда, в котором находятся.
Вычислим
среднее расстояние между молекулами
жидкости. Можно мысленно представить
весь объем жидкости разделенным на
небольшие одинаковые кубики с ребром
8. Пусть в среднем в каждом кубике
находится одна молекула. В этом случае
5 можно рассматривать как среднее
расстояние между молекулами жидкости.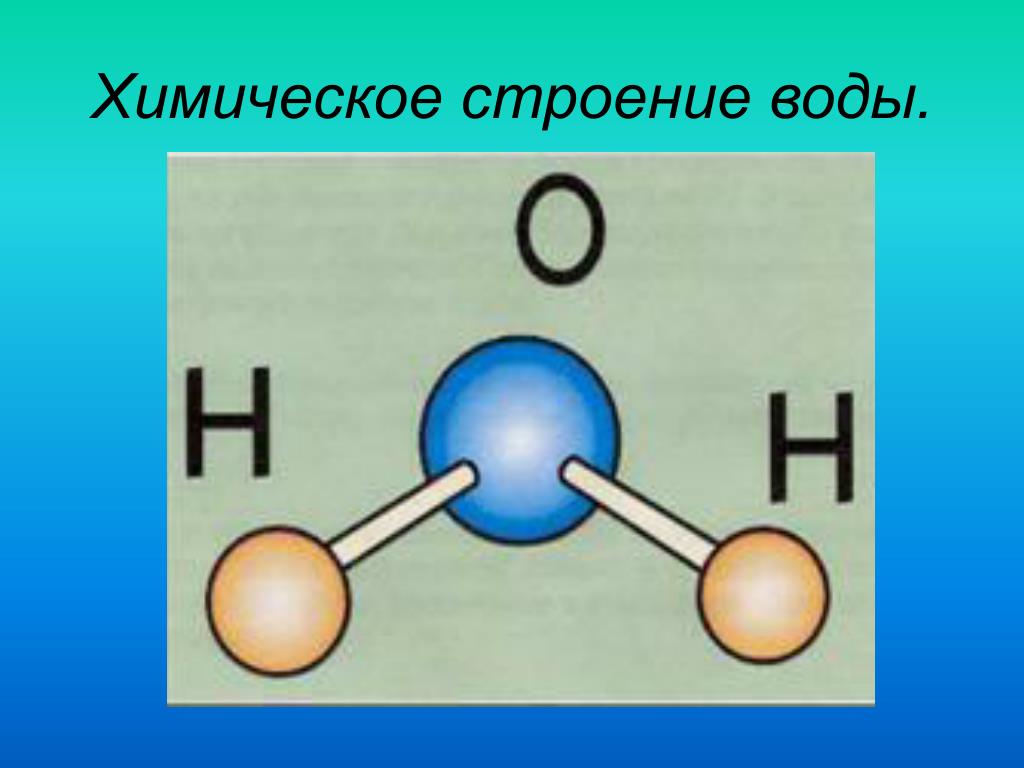 -10 м.
-10 м.
Для того чтобы молекула жидкости перескочила из одного по ложения равновесия в другое, должны нарушиться связи с окру жавшими ее молекулами и образоваться связи с новыми соседя ми. Процесс разрыва связей требует затраты энергии Еа (энергии активации), выделяемой при образовании новых связей. Такой переход молекулы из одного положения равновесия в другое яв ляется переходом через потенциальный барьер высотой Еа. Энергию для преодоления потенциального барьера молекула по лучает за счет энергии теплового движения соседних молекул. За висимость времени релаксации от температуры жидкости и энер гии активации выражается формулой, вытекающей из распреде ления Больцмана.
Где
τ0
— средний период колебаний молекулы
около положения равновесия.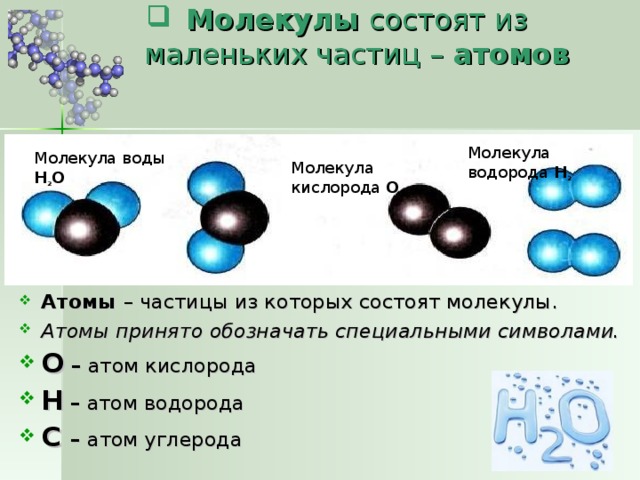
Зная среднее перемещение молекулы, равное расстоянию меж ду молекулами δ, и среднее время τ, можно определить средню юскорость движения молекул в жидкости:
Эта скорость мала по сравнению со средней скоростью движе ния молекул в газе. Так, например, для молекул воды она в 20 раз меньше, чем для молекул пара при той же температуре.
Химические характеристики и функции воды в физиологии
Если бы кто-то спросил, какая молекула самая важная в вашем теле, большинство из нас ответило бы, что это вода. Он составляет примерно 2/3 веса нашего тела! Вот почему борец, пытающийся «набрать вес» для матча, может сбросить несколько фунтов, просто потея от воды (кстати, не очень хорошая идея). Всякий раз, когда возникают предположения о жизни на других планетах, всегда возникает вопрос, есть ли на планете вода? Что такого особенного в воде, что делает ее незаменимой для жизни? Не подойдет ли и другая жидкость? Вот некоторые из вопросов, на которые мы попытаемся ответить в этом блоке.
Химические характеристики воды
Напомним, что молекула воды H 2 O удерживается вместе полярными ковалентными связями . Поскольку кислород притягивает электроны в ковалентных связях сильнее, чем водород, кислородный конец молекулы имеет небольшой отрицательный заряд, а водородный конец молекулы имеет небольшой положительный заряд. Также вспомните, что молекулы, состоящие из полярных ковалентных связей, могут участвовать в слабых взаимодействиях с другими полярными молекулами, называемых водородными связями. На рисунке ниже показано, как молекулы воды образуют водородные связи друг с другом. Каждая молекула воды может образовать максимум 4 водородные связи с другими молекулами воды. Большинство характеристик воды, о которых мы будем говорить, являются результатом полярной природы молекулы воды и ее способности образовывать водородные связи с собой и другими полярными молекулами. Помните, что водородные связи являются очень слабыми взаимодействиями и могут образовываться и разрываться относительно легко. Однако, как и в случае со всеми связями, для их разрыва требуется энергия, а энергия высвобождается при образовании новых связей. Именно количество этих связей определяет физическое состояние воды. Например, в твердом состоянии каждая молекула воды образует водородные связи с четырьмя другими молекулами, что приводит к образованию стабильной кристаллической структуры, известной как лед. В жидком состоянии каждая молекула воды образует менее четырех связей (в среднем 3,4), которые постоянно перестраиваются. Вода становится паром, когда энергии достаточно, чтобы разорвать все водородные связи между молекулами воды, и они могут выйти в виде газа.
Однако, как и в случае со всеми связями, для их разрыва требуется энергия, а энергия высвобождается при образовании новых связей. Именно количество этих связей определяет физическое состояние воды. Например, в твердом состоянии каждая молекула воды образует водородные связи с четырьмя другими молекулами, что приводит к образованию стабильной кристаллической структуры, известной как лед. В жидком состоянии каждая молекула воды образует менее четырех связей (в среднем 3,4), которые постоянно перестраиваются. Вода становится паром, когда энергии достаточно, чтобы разорвать все водородные связи между молекулами воды, и они могут выйти в виде газа.
изображение создано студенткой BYU-I Ханной Краудер, осень 2013 г.
На изображении выше показаны водородные связи между молекулами воды.
Стабилизация температуры тела
Количество энергии в виде тепла, которое необходимо добавить к веществу или отнять от него, чтобы изменить его температуру, называется теплоемкостью вещества.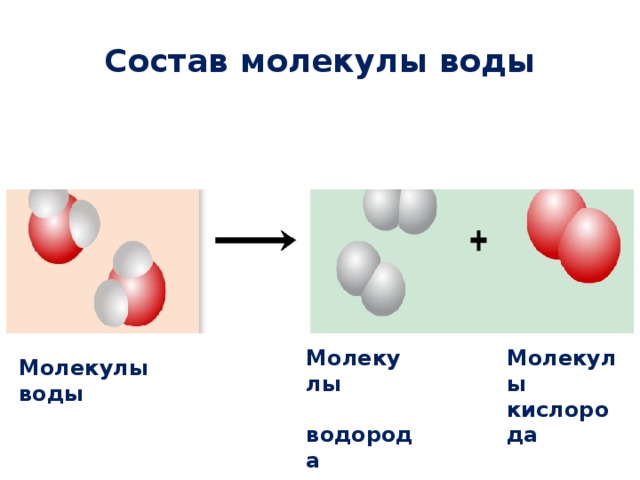 Вода обладает очень высокой теплоемкостью. Для повышения температуры одного грамма воды на один градус Цельсия требуется одна калория энергии. На самом деле, мы определяем калорию на основе теплоемкости воды (Одна калория — это количество тепловой энергии, необходимое для повышения температуры 1 грамма воды на 1° Цельсия. Примечание: при указании калорийности пищи калорией является пишется с большой буквы. Эти «большие» калории на самом деле составляют килокалории или 1000 калорий). Точно так же 1 калория энергии должна быть изъята из воды, чтобы понизить температуру 1 грамма воды на 1 градус Цельсия. Сравните это с теплоемкостью воздуха, которая составляет 0,24 калории на грамм. Высокая теплоемкость обусловлена водородными связями между молекулами воды. Температура является мерой полной кинетической энергии (движения) материала. Прежде чем молекулы воды смогут начать двигаться быстрее, водородные связи между молекулами должны быть разрушены, что требует затрат энергии. Следовательно, большая часть энергии (тепла) используется для разрыва связей, а не для повышения температуры (движения) молекул воды.
Вода обладает очень высокой теплоемкостью. Для повышения температуры одного грамма воды на один градус Цельсия требуется одна калория энергии. На самом деле, мы определяем калорию на основе теплоемкости воды (Одна калория — это количество тепловой энергии, необходимое для повышения температуры 1 грамма воды на 1° Цельсия. Примечание: при указании калорийности пищи калорией является пишется с большой буквы. Эти «большие» калории на самом деле составляют килокалории или 1000 калорий). Точно так же 1 калория энергии должна быть изъята из воды, чтобы понизить температуру 1 грамма воды на 1 градус Цельсия. Сравните это с теплоемкостью воздуха, которая составляет 0,24 калории на грамм. Высокая теплоемкость обусловлена водородными связями между молекулами воды. Температура является мерой полной кинетической энергии (движения) материала. Прежде чем молекулы воды смогут начать двигаться быстрее, водородные связи между молекулами должны быть разрушены, что требует затрат энергии. Следовательно, большая часть энергии (тепла) используется для разрыва связей, а не для повышения температуры (движения) молекул воды.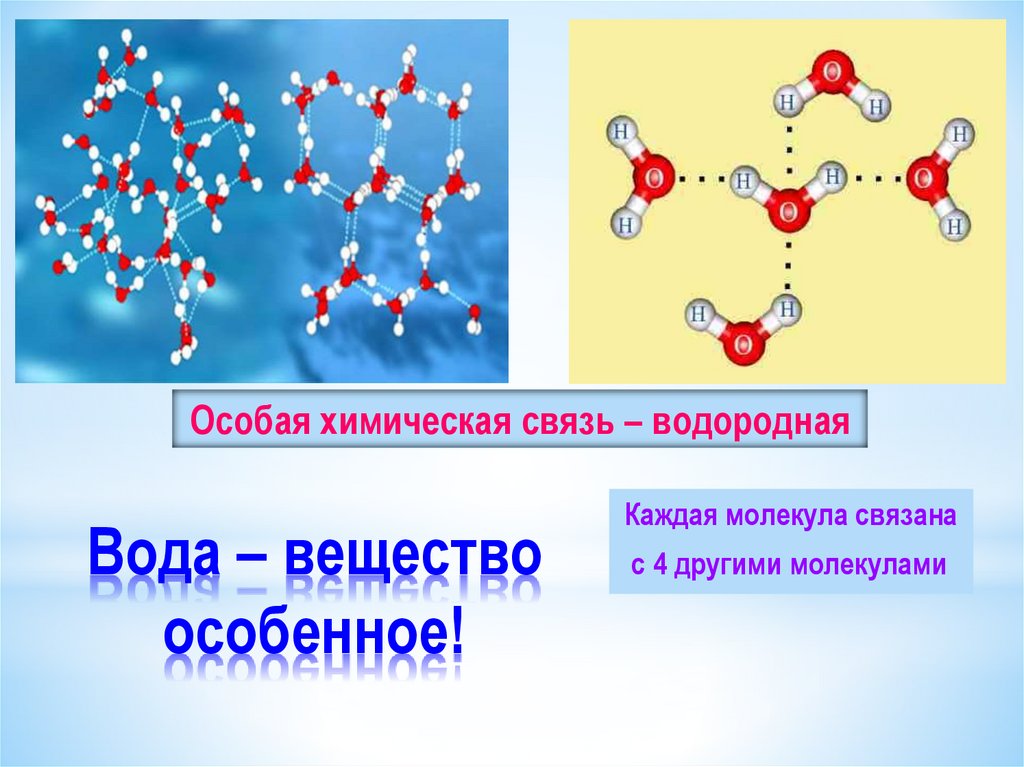 Точно так же, когда тепло отводится и молекулы воды начинают замедляться, образуются новые водородные связи, высвобождая энергию, что помогает предотвратить сильное падение температуры. Поскольку тело человека примерно на 2/3 состоит из воды, это помогает предотвратить резкие изменения температуры тела.
Точно так же, когда тепло отводится и молекулы воды начинают замедляться, образуются новые водородные связи, высвобождая энергию, что помогает предотвратить сильное падение температуры. Поскольку тело человека примерно на 2/3 состоит из воды, это помогает предотвратить резкие изменения температуры тела.
Еще одним свойством воды, помогающим стабилизировать температуру тела, является ее высокая теплота парообразования . Это означает, что для превращения воды из жидкости в газ требуется затратить относительно большое количество энергии, чтобы увеличить движение молекул воды, достаточное для того, чтобы они освободились от молекул воды вокруг них. Поскольку эти молекулы воды движутся все быстрее и быстрее, у них в конечном итоге будет достаточно энергии, чтобы полностью отделиться от жидкости и превратиться в газ (водяной пар). Когда самые быстро движущиеся молекулы вырываются на свободу, их кинетическая энергия уходит вместе с ними, отводя тепло. На этом основан охлаждающий эффект испарения пота с нашей кожи.
Адгезия, когезия и смазка
Вода способна прилипать к другим полярным веществам. Это свойство обозначается как адгезия . Отличным примером важности этого свойства для организма являются легкие. Тонкая прослойка воды между наружной поверхностью легких и стенками грудной полости «приклеивает» легкие к стенкам и препятствует их коллапсу. Когезия — это слипание молекул воды. Это свойство препятствует отделению крови при движении по кровеносным сосудам. Наконец, вода может действовать как смазка и находится в тех частях тела, где структуры должны скользить друг относительно друга. Например, синовиальные суставы (колено, плечо, лодыжка и т. д.) имеют тонкий слой воды (синовиальной жидкости) между противолежащими структурами, что позволяет им легко скользить друг относительно друга при движении сустава.
Химические реакции
Все тысячи химических реакций, протекающих в нашем организме, требуют воды. Это связано с тем, что для реакции химические вещества должны находиться в водном растворе. Также вода принимает непосредственное участие во многих важных реакциях, протекающих в организме.
Также вода принимает непосредственное участие во многих важных реакциях, протекающих в организме.
**Вы можете использовать кнопки ниже, чтобы перейти к следующему или предыдущему чтению в этом модуле**
Свойства воды: объяснение, когезия и адгезия
Знаете ли вы, что вода — единственное вещество на Земле, которое в природе встречается во всех трех агрегатных состояниях? Несмотря на то, что вода не имеет запаха, вкуса и не имеет калорийности, она необходима для жизни, и мы не можем жить без нее. Он играет роль в фотосинтезе и дыхании, растворяет многие растворенные вещества в организме, обеспечивает сотни химических реакций и необходим для метаболизма и функции ферментов.
Однако это тоже необычная молекула. Несмотря на свой небольшой размер, он имеет странно высокие температуры плавления и кипения и образует прочные связи со многими другими молекулами, включая саму себя.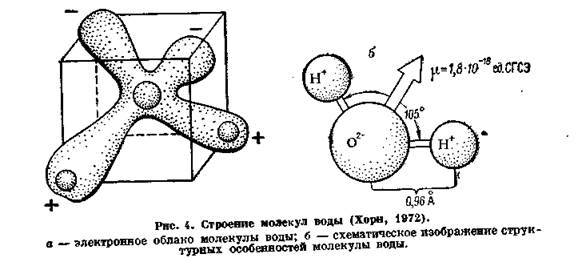 В этой статье мы рассмотрим, почему это так, наряду с некоторыми другими свойствами воды .
В этой статье мы рассмотрим, почему это так, наряду с некоторыми другими свойствами воды .
- Эта статья представляет собой сфокусированный на химии обзор свойств воды .
- Начнем со структуры воды.
- Затем мы увидим, как это соотносится с его физическими свойствами, включая когезия , адгезия и поверхностное натяжение .
- Мы также исследуем воду с высокой удельной теплоемкостью и температурами плавления и кипения .
- После этого мы рассмотрим почему лед менее плотный, чем вода и почему воду часто называют универсальным растворителем .
- Наконец, мы исследуем некоторые химические свойства воды: то, как она самоионизируется , и ее амфотерная природа .
Структура воды
Официальное название воды дигидрогенмоноксид .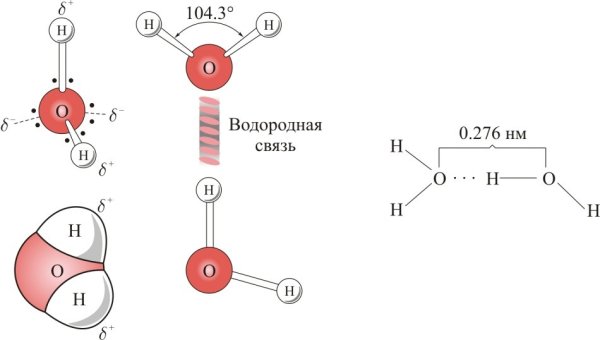 Более внимательное изучение этого имени дает нам представление о его структуре. -водород говорит нам, что он содержит атомы водорода, а ди- указывает на то, что их два. -оксид относится к атомам кислорода, а моно- говорит нам, что он имеет только один. Соедините все вместе, и у нас останется вода: H 2 O. Вот она, показанная ниже:
Более внимательное изучение этого имени дает нам представление о его структуре. -водород говорит нам, что он содержит атомы водорода, а ди- указывает на то, что их два. -оксид относится к атомам кислорода, а моно- говорит нам, что он имеет только один. Соедините все вместе, и у нас останется вода: H 2 O. Вот она, показанная ниже:
Рис. 1 – Молекула воды
Вода состоит из двух атомов водорода, соединенных с центральным атомом кислорода одинарными ковалентными связями . Атом кислорода имеет две неподеленных пар электронов . Они плотно сжимают две ковалентные связи, уменьшая валентный угол до 104,5° и превращая воду в молекулу v-образной формы .
Рис. 2. Валентный угол в воде
Для получения дополнительной информации о различных формах молекул и влиянии неподеленных пар электронов на валентные углы см. Формы молекул .
Связь в воде
Давайте теперь посмотрим, как структура воды влияет на ее связь.
Водородные связи являются типом межмолекулярных сил . Они возникают из-за разницы в электроотрицательности между водородом и чрезвычайно электроотрицательным атомом, таким как кислород.
Электроотрицательность — это способность атома притягивать связанную пару электронов. Это приводит к тому, что связывающие электроны находятся ближе к одному атому в ковалентной связи, чем к другому.
Если вы еще этого не сделали, рекомендуем прочитать Межмолекулярные силы . Он объяснит некоторые концепции, которые мы упоминаем здесь, более подробно.
Как известно, вода содержит два атома водорода, связанных с центральным атомом кислорода ковалентными связями . Благодаря этому вы обнаружите водородных связей между соседними молекулами воды.
В случае воды кислород намного более электроотрицательный, чем водород. Это означает, что кислород притягивает связанную пару электронов, обнаруженную в каждой из связей кислород-водород, к себе и от водорода. Водород становится электрон-дефицитная и мы говорим, что в целом молекула полярная .
Водород становится электрон-дефицитная и мы говорим, что в целом молекула полярная .
Поскольку электроны имеют отрицательный заряд, кислород теперь слегка заряжен отрицательно, а водород — слегка положительно. Мы представляем эти частичные заряды дельта-символом , δ .
Рис. 3 – Полярность воды
Но как это приводит к образованию водородных связей? Ну, водород — это маленький атом. Фактически, это самый маленький атом во всей таблице Менделеева! Это означает, что его частичный положительный заряд плотно упакован в одно крошечное пространство. Мы говорим, что он имеет высокая плотность заряда . Поскольку он настолько положительно заряжен, его особенно притягивают отрицательно заряженные частицы, такие как другие электроны.
Что мы знаем об атоме кислорода в воде? Он содержит две неподеленные пары электронов! Это означает, что атомы водорода в молекулах воды притягиваются к неподеленным парам электронов в атомах кислорода в других молекулах воды.
Притяжение между плотно заряженным атомом водорода и неподеленной парой электронов кислорода известно как водородная связь .
Рис. 4 – Водородная связь между молекулами воды
Подводя итог, мы обнаруживаем водородную связь, когда имеем атомов водорода, ковалентно связанных с чрезвычайно электроотрицательным атомом с неподеленной парой электронов . Атом водорода становится электронодефицитным и притягивается к неподеленной паре электронов другого атома. Это водородная связь .
Только некоторые элементы обладают достаточной электроотрицательностью для образования водородных связей. Этими элементами являются кислород, азот и фтор. Хлор также теоретически достаточно электроотрицателен, но не образует водородных связей. Это потому, что это более крупный атом, и отрицательный заряд его неподеленных пар электронов распределен по большей площади. Плотность заряда недостаточно велика, чтобы должным образом притянуть частично заряженный атом водорода, поэтому он не образует водородных связей. Однако хлор испытывает постоянные диполь-дипольные силы.
Однако хлор испытывает постоянные диполь-дипольные силы.
Еще одно напоминание — мы более подробно рассмотрим эту тему в Межмолекулярные силы .
Физические свойства воды
Теперь, когда мы рассмотрели структуру и связь воды, мы можем исследовать, как это влияет на ее физические свойства. В следующем разделе мы рассмотрим следующие свойства:
- Когезия
- Адгезия
- Поверхностное натяжение
- Удельная теплоемкость
- Температуры плавления и кипения
- Плотность
- Способность растворять
Когезионные свойства воды
Когезия — это способность частиц вещества прилипать друг к другу.
Если вы плеснете небольшое количество воды на поверхность, вы заметите, что она образует капли. Это пример сплоченности . Вместо того, чтобы распространяться равномерно, молекулы воды прилипают друг к другу в виде кластеров. Это связано с водородными связями между соседними молекулами воды.
Адгезионные свойства воды
Адгезия — это способность частиц одного вещества прилипать к другому веществу.
Когда вы наливаете воду в пробирку, вы заметите, что вода поднимается по краям сосуда. Он образует так называемый мениск . Когда вы измеряете объем воды, вы должны измерять от нижней части мениска, чтобы ваши измерения были полностью точными. это пример адгезия . Это происходит, когда вода образует водородные связи с другим веществом, например со стенками пробирки в данном случае.
Рис. 5 — Мениск
Не путайте когезию и адгезию. Когезия — это способность вещества прилипать к самому себе, тогда как адгезия — это способность вещества прилипать к другому веществу.
Поверхностное натяжение воды
Вы когда-нибудь задумывались, как насекомые могут ходить по поверхности луж и озер? Это из-за поверхностное натяжение .
Поверхностное натяжение описывает, как молекулы на поверхности жидкости действуют как эластичный лист и пытаются занять наименьшую возможную площадь поверхности.
Здесь частицы на поверхности жидкости сильно притягиваются к другим частицам в жидкости. Эти внешние частицы втягиваются в объем жидкости, заставляя жидкость принимать форму с наименьшей возможной площадью поверхности. Благодаря этому притяжению поверхность жидкости способна противостоять внешним силам, например весу насекомого. Вода имеет особенно высокое поверхностное натяжение из-за водородных связей между его молекулами. Это еще один пример связной природы воды.
Удельная теплоемкость воды
Удельная теплоемкость – это энергия, необходимая для повышения температуры одного грамма вещества на один градус Кельвина или один градус Цельсия.
Помните, что изменение на один градус Кельвина равносильно изменению на один градус Цельсия.
Изменение температуры вещества приводит к разрыву некоторых связей внутри него. Водородные связи между молекулами воды очень прочны, поэтому для их разрыва требуется много энергии. Это означает, что вода имеет высокая удельная теплоемкость .
Это означает, что вода имеет высокая удельная теплоемкость .
Высокая удельная теплоемкость воды означает, что она дает много преимуществ живым организмам, поскольку вода сопротивляется резким колебаниям температуры. Это помогает им поддерживать постоянную внутреннюю температуру, оптимизируя активность ферментов.
Температура плавления и кипения воды
Вода имеет высокие температуры плавления и кипения из-за сильных водородных связей между ее молекулами, для преодоления которых требуется много энергии. Это становится очевидным, когда вы сравниваете воду с молекулами аналогичного размера, которые не имеют водородных связей. Например, метан (СН 4 ) имеет молекулярную массу 16 и температуру кипения -161,5 ℃, в то время как вода имеет аналогичную молекулярную массу 18, но гораздо более высокую температуру кипения — ровно 100,0 ℃!
Плотность воды
Возможно, вы знаете, что большинство твердых тел более плотные, чем их жидкости.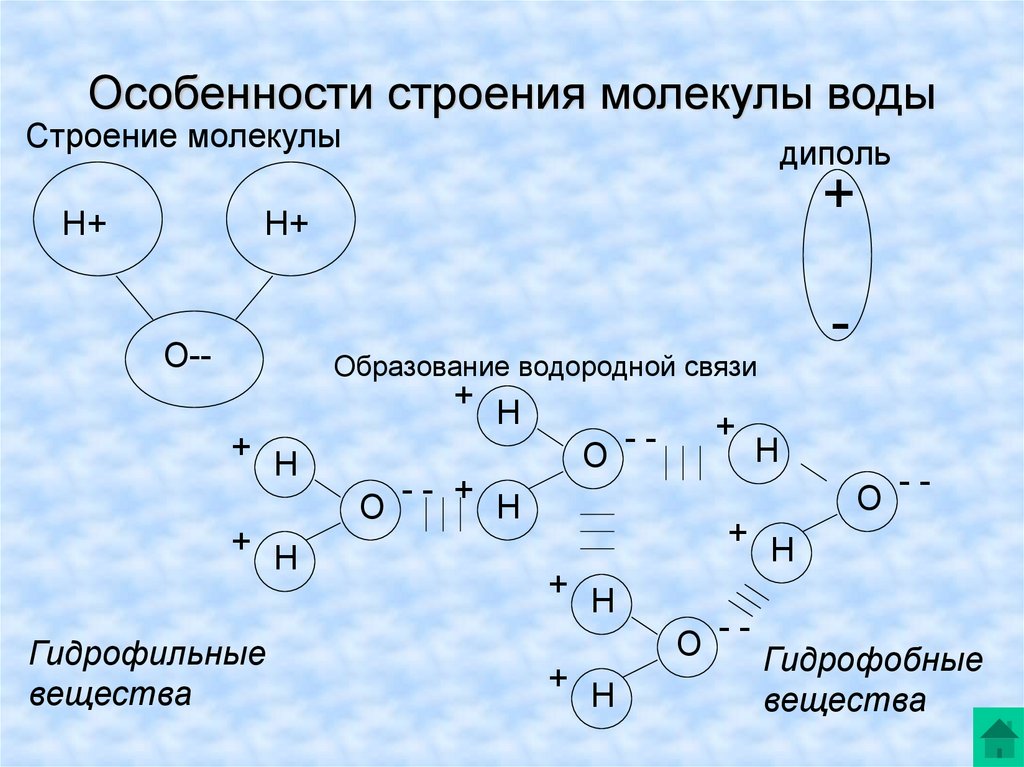 А вот с водой немного необычно — все наоборот. Твердый лед намного менее плотный, чем жидкая вода , поэтому айсберги плавают на поверхности моря, а не тонут на дне океана. Чтобы понять почему, нам нужно более внимательно изучить структуру воды в двух состояниях.
А вот с водой немного необычно — все наоборот. Твердый лед намного менее плотный, чем жидкая вода , поэтому айсберги плавают на поверхности моря, а не тонут на дне океана. Чтобы понять почему, нам нужно более внимательно изучить структуру воды в двух состояниях.
Жидкая вода
Как жидкость молекулы воды постоянно движутся . Это означает, что водородные связи между молекулами постоянно разрываются и снова восстанавливаются. Некоторые молекулы воды расположены очень близко друг к другу, а другие далеко друг от друга.
Твердый лед
В твердом состоянии молекулы воды фиксируются в положении . Каждая молекула воды связана с четырьмя соседними молекулами воды водородными связями, удерживая ее в решетчатой структуре. Четыре водородные связи означают, что молекулы воды удерживаются на фиксированном расстоянии друг от друга. На самом деле, в этом твердом состоянии они находятся дальше друг от друга, чем в жидкой форме.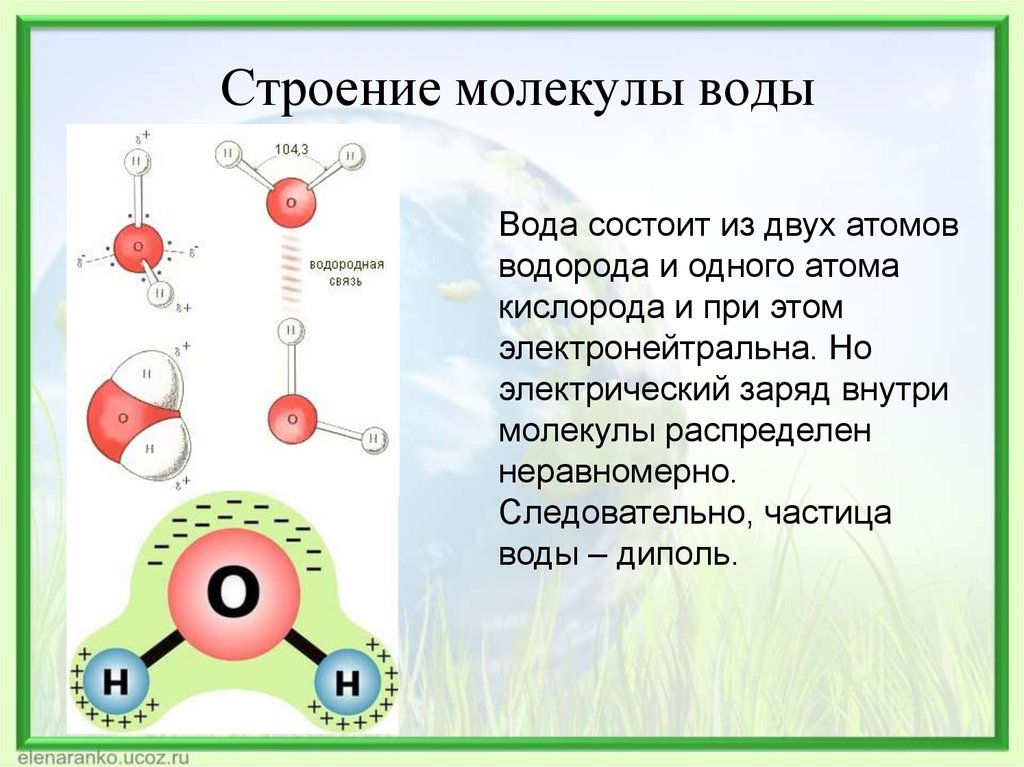 Это делает твердый лед менее плотным, чем жидкая вода.
Это делает твердый лед менее плотным, чем жидкая вода.
Рис. 6. Ледяная решетка
Вода как растворитель
Последнее физическое свойство, которое мы сегодня рассмотрим, — это способность воды как растворителя .
Растворитель — это вещество, которое растворяет второе вещество, называемое растворенным веществом , с образованием раствора .
Воду часто называют универсальным растворителем . Это потому, что он может растворять широкий спектр различных веществ. На самом деле почти все полярные вещества растворяются в воде . Это потому, что молекулы воды также полярны. Вещества растворяются, когда притяжение между ними и растворителем сильнее, чем притяжение между молекулой растворителя и молекулой растворителя, молекулой растворенного вещества и молекулой растворенного вещества.
В случае воды отрицательный атом кислорода притягивается к любым положительно заряженным молекулам растворенного вещества, а положительные атомы водорода притягиваются к любым отрицательно заряженным молекулам растворенного вещества.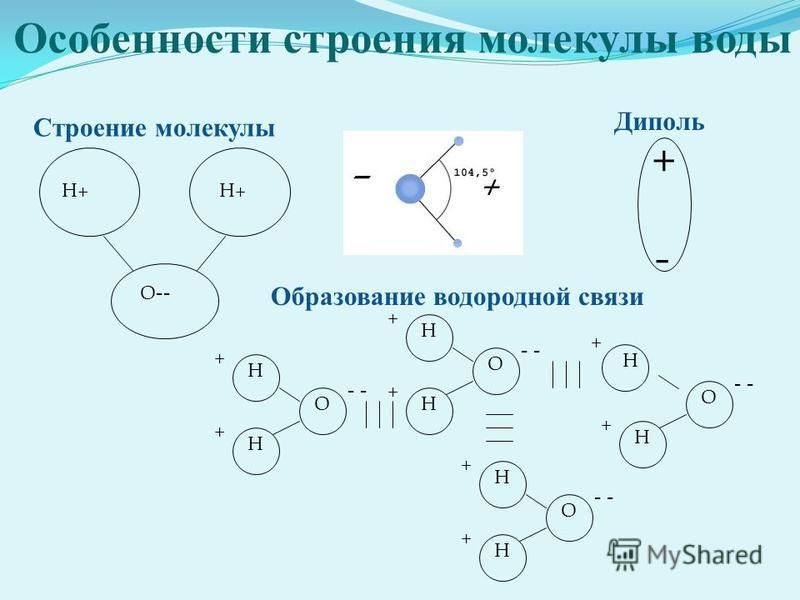 Это притяжение сильнее, чем силы, удерживающие растворенное вещество вместе, поэтому растворенное вещество растворяется.
Это притяжение сильнее, чем силы, удерживающие растворенное вещество вместе, поэтому растворенное вещество растворяется.
Химические свойства воды
Все рассмотренные выше идеи были примерами физических свойств . Это свойства, которые можно наблюдать и измерять без изменения химического состава вещества. Например, молекулы воды в паре имеют ту же химическую идентичность, что и молекулы воды во льду, с той лишь разницей, что они состоят из вещества. Однако химических свойств — это свойства, которые мы наблюдаем, когда вещество подвергается химической реакции. В частности, мы собираемся сосредоточиться на двух химических свойствах воды.
- Способность к самоионизации
- Амфотерность
Самоионизация воды
Как жидкость вода существует в равновесии . Большинство его молекул находятся в виде нейтральных молекул H 2 O, но некоторые ионизируются в ионы гидроксония, H 3 O + , и ионы гидроксида, OH — .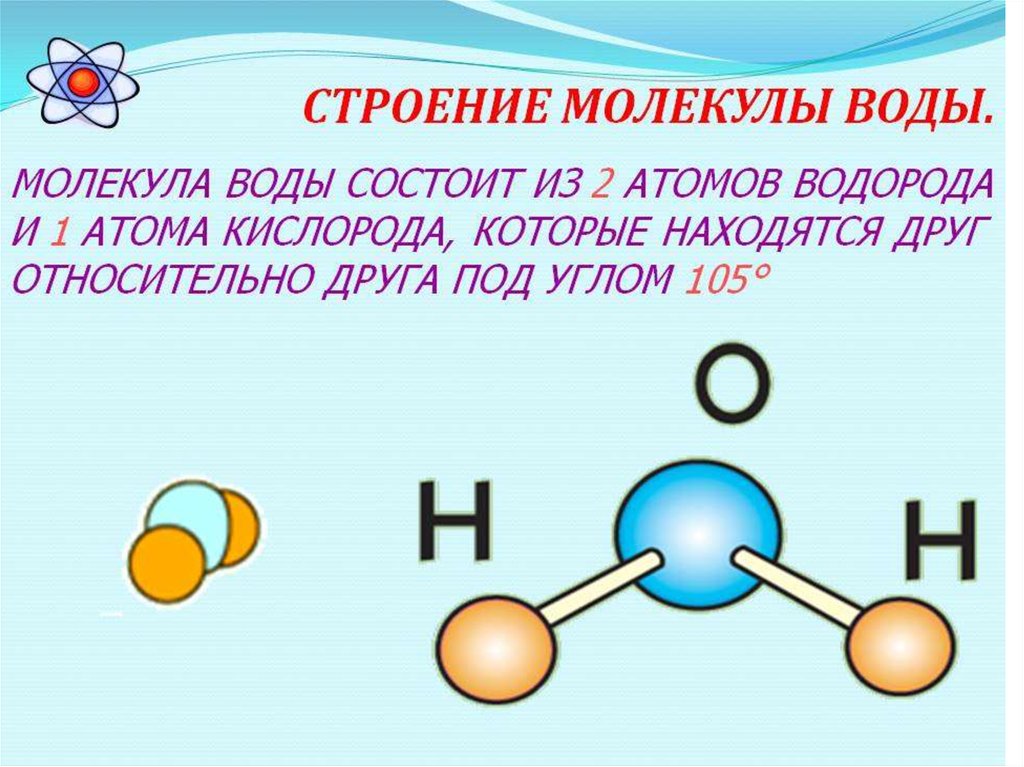 Молекулы постоянно переключаются между этими двумя состояниями вперед и назад, как показано в приведенном ниже уравнении:
Молекулы постоянно переключаются между этими двумя состояниями вперед и назад, как показано в приведенном ниже уравнении:
2H 2 O ⇋ H 3 O + + OH —
Это известно как самоионизация . Вода делает это сама по себе — ей не нужно другое вещество для реакции.
Амфотерная природа воды
Поскольку вода самоионизируется, как мы видели выше, она может действовать амфотерно .
Амфотерное вещество может действовать как кислота и как основание.
Помните, что кислота является донором протонов, тогда как основание является акцептором протонов. Протон — это просто ион водорода, H + .
Как это делает вода? Что ж, посмотрите на ионы, которые он образует при самоионизации: H 3 O + и OH — . Ион гидроксония H 3 O + может действовать как кислота, теряя протон с образованием H 2 O и H + .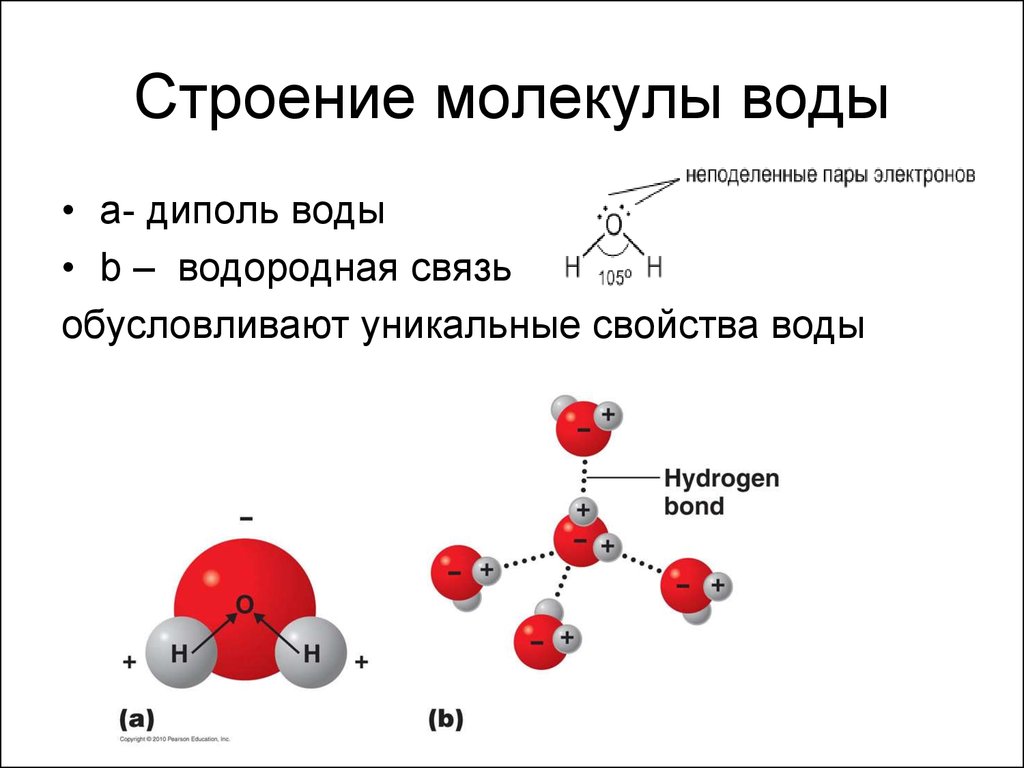 Ион гидроксида, OH — , может действовать как основание, принимая протон, снова образуя H 2 O.
Ион гидроксида, OH — , может действовать как основание, принимая протон, снова образуя H 2 O.
H 3 O + → H 2 O + H +
OH — + H + → H 2
, если вода отреагирует с другими базами, а также а турнир. кислоты, отдавая протон. Если он реагирует с другими кислотами, он действует как основание, принимая протон. Можно сказать, что вода не привередлива — она просто хочет со всеми реагировать!
Свойства воды – Основные выводы
- Вода
- Вода испытывает водородных связей между молекулами. Это влияет на его свойства.
- Вода когезивная , клейкая и имеет высокое поверхностное натяжение .