Готовимся к углубленному изучению химии : 2.3 Молекулы. Химические формулы
2.3. Молекулы. Химические формулы. Молекулярные массы. Элементный состав веществ
Атомы могут соединяться друг с другом. В результате этого соединения обычно образуются более сложные частицы – молекулы. Например:
Эти примеры показывают, что соединяться друг с другом могут атомы одного элемента и атомы разных элементов. Число атомов, которые соединяются друг с другом, может быть различным.
Состав любой молекулы можно выразить химической формулой.
Так, молекула водорода имеет формулу Н2 . Число «2» в этой формуле показывает число атомов водорода в молекуле водорода.
Числа
в химических формулах, которые показывают, сколько атомов данного элемента
входит в состав молекулы, называются индексами.
Молекула хлороводорода имеет формулу НСl, так как она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет формулу Н2О. Эта формула показывает, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Таким образом, химические формулы показывают качественный и количественный состав молекулы.
Согласно закону постоянства состава (Ж. Пруст, Франция, 1808 г.):
Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Так
как вещество состоит из одинаковых молекул, то состав молекулы определяет
состав всего вещества. Различия в химических свойствах веществ обусловлены
различиями в составе и строении молекул, из которых состоят эти вещества. Поэтому можно сделать вывод:
Поэтому можно сделать вывод:
Молекула – это наименьшая частица вещества, которая сохраняет его химические свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается
Например, относительная молекулярная масса воды Н2О равна:
Относительная молекулярная масса сульфата железа (III)равна:
Относительная молекулярная масса вещества Мr – это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода С.
Например,
относительная молекулярная масса воды Мr
(Н2О)= 18.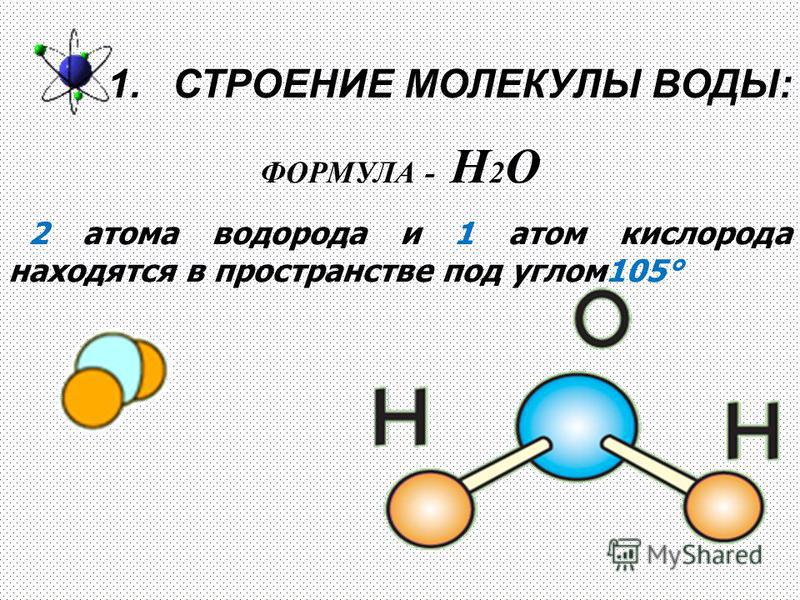
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля (w) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:
Массовые доли обычно выражаются в процентах:
Рассчитаем, например, массовые доли водорода и кислорода в воде Н2О:
УПРАЖНЕНИЯ
1.
Рассчитайте
массовую долю марганца в оксиде марганца (VII).
Решение: Молярные массы веществ равны: М(Mn) = 55
г/моль, М(О) = 16 г/моль, M(Mn2O7)=2М(Mn)+7М(О)= 222
г/моль. Следовательно, масса Mn
m(Mn2O7) = M(Mn2O7)·n(Mn2O7) = 222·1= 222 г.
Из формулы Mn2O7следует, что количество вещества атомов марганца в два раза больше количества вещества оксида марганца (VII). Значит,
n(Mn) = 2n(Mn2O7) = 2 моль,
m(Mn)= n(Mn)·M(Mn) = 2·55 = 110 г.
Таким образом, массовая доля марганца в оксиде марганца(VII) равна:
ω(X)=m(Mn) : m(Mn2O7)
= 110:222 = 0,495 или 49,5%.
_______________________________________________________________
2.
Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2h3O.
Решение: Молярная масса BaCl2 • 2h3O составляет: М(BaCl2 • 2h3O) = 137+ 2 • 35,5 + 2 • 18 =244 г/моль.
Из формулы BaCl2 • 2h3O следует, что 1 моль дигидрата хлорида бария содержит 2 моль Н2О. Отсюда можно определить массу воды, содержащейся в BaCl2 • 2h3O: m(h3O) = 2 • 18 = 36 г. Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2h3O. ω(h3O) = m(h3O)/ m(BaCl2 • 2h3O) = 36/244 = 0,1475 = 14,75%.
_______________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Какие частицы обычно образуются в результате соединения атомов.
2.
Чем можно выразить состав любой молекулы.
3.
Что показывают химические формулы
4.
Чему равна масса молекулы
5.
Чему равна массовая доля данного элемента в данном веществе.
6.
Опишите качественный м
количественный состав молекул следующих веществ: метан СН
7.
Молекула фосгена состоит из одного атома углерода, одного атома кислорода и двух атомов хлора. Молекула мочевины состоит из одного атома углерода, одного атома кислорода и двух атомных групп NH2. Напишите формулы фосгена и мочевины.
8.
Рассчитайте относительные молекулярные массы веществ, которые указаны в упражнении 6.
.
Чему равны массовые доли элементов в следующих веществах:
В каком из этих веществ массовая доля азота наибольшая и в каком – наименьшая.
 Про молекулу нельзя сказать, что она: | |
а) сохраняется в химических реакциях | б) носитель химических свойств вещества |
в) разрушается в химических реакциях | г) имеет тот же качественный состав, что и вещество, состоящее из данных молекул |
2. Нельзя утверждать, что в состав молекулы воды входят: | |
а) два атома Н и один атом О | б) молекула Н2 и один атом О |
в) атомы различных химических элементов | г) атомы Н и О в массовом соотношении 1:8 соответственно |
3. Какими свойствами не характеризуется молекула: | |
а) качественным составом | б) строением |
в) количественным составом | г) электрической проводимостью |
4. Что одинакового для молекул НСl и HBr: | |
а) масса | б) массовая доля водорода |
в) качественный состав | г) число атомов в молекуле |
5. Что показывает химическая формула H2SO4: | |
а) одну молекулу серной кислоты | б) относительную атомную массу серной кислоты |
в) нет верного ответа | г) пространственное строение молекулы серной кислоты |
6. Какие свойства характеризуют и молекулу, и вещество, состоящее из этих молекул: | |
а) качественный состав | б) электрическая проводимость |
в) физические свойства | г) агрегатное состояние |
7. Массовая доля хлора в его оксиде равна 59,66 %. Укажите формулу оксида: | |
а) Cl2O | б) Cl2O3 |
в) Cl2O5 | г) Cl2O7 |
8. Какова формула оксида железа, в котором массовая доля железа в 2,333 раза больше массовой доля кислорода: | |
а) FeO | б) Fe2O3 |
в) Fe3O4 | г) FeO3 |
9. Какова массовая доля водорода в воде Н2О: | |
а) 11 | б) 10 |
в) 15 | г)12 |
10. Рассчитайте массовую долю фосфора в веществе H3PO4: | |
а) 32 | б) 65 |
в) 36 | г) 17 |
Ответы:
1 | а |
2 | б |
3 | г |
4 | г |
5 | а |
6 | а |
7 | б |
8 | б |
9 | а |
10 | а |
Глава 12.
 Основные понятия и принципы молекулярно-кинетической теории
Основные понятия и принципы молекулярно-кинетической теорииВ задания ЕГЭ по физике всегда включаются задачи, касающиеся основных принципов молекулярно-кинетической теории. Это задачи, связанные с молекулярной структурой газов, жидкостей и твердых тел, с определением температуры, с методами подсчета числа составляющих тело молекул. В этой главе собраны задачи, связанные с понятиями моля и температуры.
Молем вещества называется такое количество этого вещества, которое содержит приблизительно молекул, причем независимо от того, какое это вещество (точнее ). Приведенное выше число молекул в моле называется числом Авогадро и обозначается как . Как правило, при решении задач считают, что
(12.1) |
Обратим внимание читателя на то, что моль — макроскопическое количество вещества (в переводе с латинского языка — языка средневековой науки — слово moles означает толпа).
Масса одного моля вещества называется молярной массой этого вещества. И поскольку массы молекул разных веществ — разные, а число молекул в моле разных веществ одинаковое, то молярные массы веществ различны. При этом отношение молярных масс двух веществ равно отношению масс их молекул. Поэтому массы молей пропорциональны массам молекул. Число Авогадро (12.1) было подобрано так, чтобы масса моля, выраженная в граммах, численно совпадала с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Поэтому массы молей различных веществ легко найти из периодической системы химических элементов. Например, в таблице находим, что масса молекулы гелия — 4,0026 а.е.м., следовательно, масса моля гелия — 4,0026 4 г, масса двухатомной молекулы кислорода — 31,986 а.е.м., следовательно, масса моля кислорода — 31,986 32 г.
Необходимо также знать определение температуры. Температура тела — величина, пропорциональная средней кинетической энергии молекулы
(12. |
где — средняя кинетическая энергия молекулы, — абсолютная температура (ее называют также температурой в шкале Кельвина), — постоянная, которая называется постоянной Больцмана. Из формулы (12.2) следует, что температура по шкале Кельвина не может быть отрицательна, ее минимальное значение (абсолютный нуль температуры) достигается, когда все молекулы имеют нулевые кинетические энергии. 1 градус шкалы Кельвина (или просто один Кельвин) совпадает с градусом более привычной в быту шкалы Цельсия, нуль которой определяется как температура плавления льда, а температура 100 отвечает температуре кипения воды при атмосферном давлении. Как показывает опыт, абсолютному нулю температуры отвечает температура . Важнейшее свойство температуры заключается в том, что при приведении тел в тепловой контакт их температуры через некоторое время выровняются и далее (в отсутствие теплообмена с окружающими телами) не будут изменяться. Рассмотрим теперь задачи.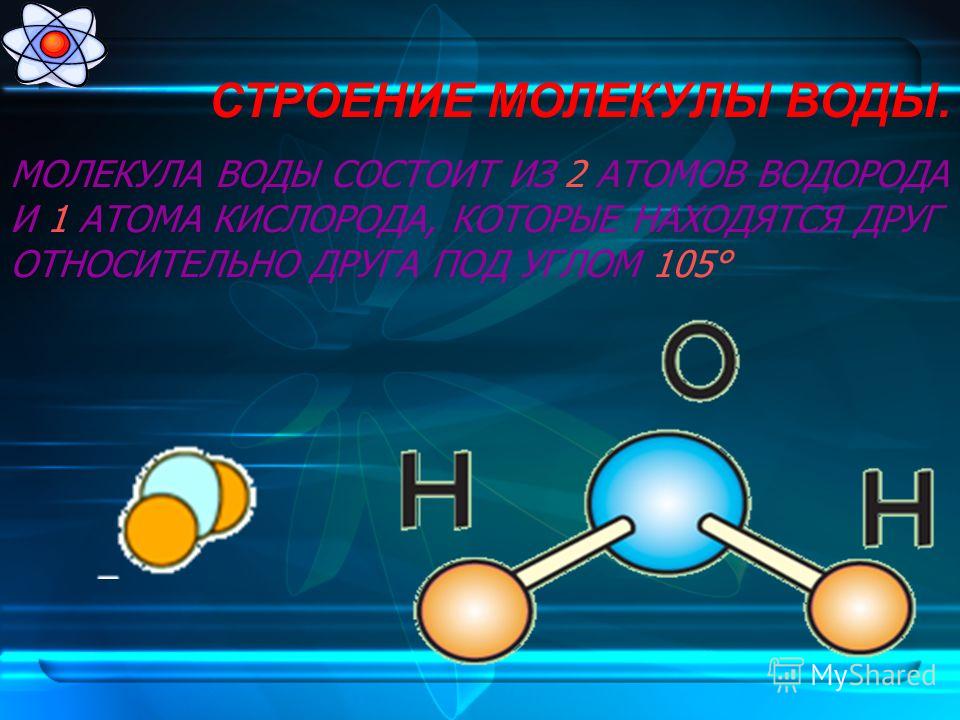
В задаче 12.1.1 правильным ответом правильным ответом является ответ 3, поскольку число молекул в моле не зависит от того, какое это вещество, и равно числу Авогадро.
Поскольку массы молекул разных веществ — разные, одинаковые массы разных веществ содержат различные количества молекул. Найти эти количества можно, зная молярные массы и число Авогадро. Например, в задаче 12.1.2 можно провести такие рассуждения. Водород массой 1 г составляет половину моля, и, следовательно, содержит молекул. Кислород массой 1 г составляет 1/32 часть моля, и, следовательно, содержит молекул. Отсюда находим отношение числа молекул в 1 г водорода к числу молекул в 1 г кислорода: (ответ 1).
Согласно определению число молекул в моле одинаково для любого вещества, причем независимо от того, сколько атомов входят в состав одной молекулы этого вещества. Другими словами, это число не зависит от того, являются ли молекулы одно-, двух-, и т. д. атомными. Поэтому правильный ответ в задаче 12.1.3 — 4.
д. атомными. Поэтому правильный ответ в задаче 12.1.3 — 4.
Поскольку число молекул в моле любого вещества равно числу Авогадро, то для молярной массы любого вещества справедливо соотношение: , где — масса одной молекулы. Отсюда находим в задаче 12.1.4, что (ответ 1).
Чтобы понять, сколько молей содержит та или иная масса вещества, нужно разделить эту массу на молярную массу данного вещества (или число содержащихся в ней молекул на число Авогадро). Поскольку молярная масса гелия равна 4 г/моль, то 10 г гелия в задаче 12.1.5 составляют 4/10 = 2,5 моль (ответ 1).
Для характеристики числа молекул в некоторой массе вещества принято использовать величину, которая называется количество вещества. Эта величина определяется как число молей, составляющих данную массу. Для нахождения количества вещества нужно разделить число молекул этой массы вещества на число Авогадро, (или саму массу на молярную массу данного вещества). Поскольку в задаче 12.1.6 газ в сосуде содержит молекул, то количество вещества газа составляет 0,5 моль (ответ 2).
Поскольку в задаче 12.1.6 газ в сосуде содержит молекул, то количество вещества газа составляет 0,5 моль (ответ 2).
Как указывалась во введении к настоящей главе, молярные массы веществ можно найти по периодической таблице элементов. Масса моля, выраженная в граммах, численно совпадает с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Из приведенной в условии задачи 12.1.7 клетки таблицы, отвечающей рутению, находим массу молекулы рутения = 101,07 а.е.м. (второе число в клетке, которое для всех элементов является обязательно целым, представляет собой порядковый номер элемента). Поэтому для рутения находим: = 101,07 ≈ 101 г/моль (ответ 2).
Связь температуры и средней кинетической энергии молекул определяется формулой (12.2) (задача 12.1.8 – ответ 2).
Температурой плавления льда (и замерзания воды) является температура 0 . Поскольку нуль шкалы Кельвина (абсолютный нуль температуры) в шкале Цельсия составляет –273 (см. введение к настоящей главе), то температура плавления льда по абсолютной шкале равна 273 (задача 12.1.9 — ответ 3).
введение к настоящей главе), то температура плавления льда по абсолютной шкале равна 273 (задача 12.1.9 — ответ 3).
Изменением температуры тела в некотором процессе называется разность его конечной и начальной температур тела . Так как температуры в шкале Цельсия и Кельвина связаны «сдвигом»: , то разность температур в градусах Кельвина и в градусах Цельсия совпадает:
Другими словами, изменение температуры тела одинаково при задании температуры как в шкале Кельвина, так и в шкале Цельсия. Поэтому правильный ответ в задаче 12.1.10 — 2.
В задаче 12.2.1 нужно снова использовать определение количества вещества. Напоминаем, что количеством вещества называется число молей, составляющих данную порцию вещества. Отсюда находим количество вещества водорода моль и количество кислорода моль в сосудах. Поэтому (ответ 1).
Из периодической таблицы элементов имеем для масс атомов: = 1 а.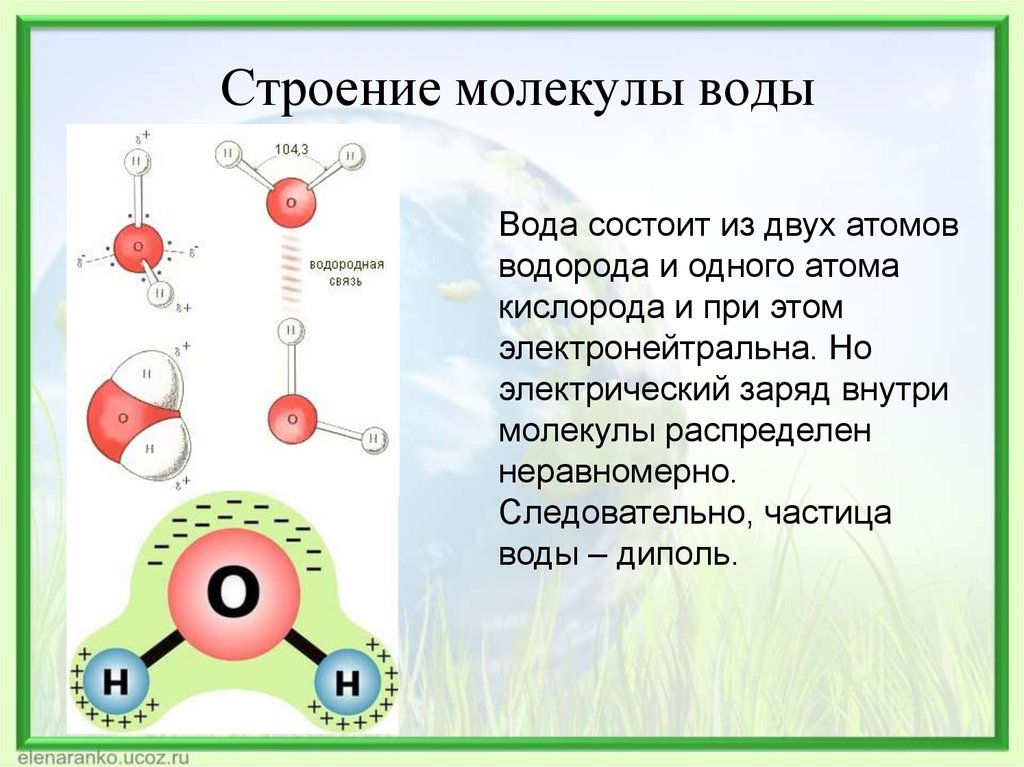 е.м., = 14 а.е.м., = 16 а.е.м. (задача 12.2.2). Отсюда находим массу молекулы азотной кислоты
е.м., = 14 а.е.м., = 16 а.е.м. (задача 12.2.2). Отсюда находим массу молекулы азотной кислоты
Поэтому = 63 г/моль (ответ 4).
Масса одной молекулы углерода = 12 а.е.м. А поскольку моль углерода содержит , то масса моля углерода равна а.е.м. (задача 12.2.3 – ответ 1).
Поскольку молярная масса — это характеристика вещества, то, находя эту величину, можно определить вещество. Например, в задаче 12.2.4 плотность газа (масса единицы объема) и концентрация молекул (число молекул в единице объема), очевидно, связаны друг с другом через массу одной молекулы . Умножая правую и левую часть этой формулы на число Авогадро и учитывая, что , получим = 4 г/моль. Поэтому неизвестный газ — гелий (ответ 2).
Используя определение температуры (12.2), получим для средней скорости молекул водорода в задаче 12.2.5
(ответ 3).
Из определения температуры (12. 2) следует, что при повышении температуры в 2 раза средняя скорость молекул увеличивается в раз (задача 12.2.6 – ответ 3).
2) следует, что при повышении температуры в 2 раза средняя скорость молекул увеличивается в раз (задача 12.2.6 – ответ 3).
При приведении газов в тепловой контакт их температуры выровняются (задача 12.2.7). Отсюда согласно определению температуры следует, что средние кинетические энергии молекул газов станут равными:
или (ответ 3).
Задача 12.2.8 аналогична предыдущей. Используя определение температуры (12.2) для каждого газа и учитывая, что независимо от того, сколько атомов входит в состав молекулы, в правую часть определения температуры (12.2) входит коэффициент 3/2, получим
где — средняя скорость молекул водорода, — средняя скорость молекул гелия. Поскольку масса молекулы гелия в два раза больше массы молекулы водорода, то
(ответ 2).
Поскольку моль любого вещества содержит одинаковое количество молекул, то для сравнения числа молекул воды и ртути в стакане (задача 12. 2.9) можно сравнить число молей. Число молей воды и ртути в стакане найдем из следующих цепочек формул. Воды:
2.9) можно сравнить число молей. Число молей воды и ртути в стакане найдем из следующих цепочек формул. Воды:
(1) |
Ртути:
(2) |
где и — массы и плотности веществ, — молярные массы, — объем стакана. Сравнивая величины (1) и (2), заключаем
(здесь использованы плотности и молярные массы воды и ртути). Поэтому в стакане ртути больше молекул, чем в стакане воды (ответ 2), причем в 67/55 =1,2 раза.
Сначала обратим внимание читателя, что предложенные в задаче 12.2.10 значения температур и варианты ответов «подталкивают» к выбору ответа , поскольку конечная температура в 5 раз больше начальной. Тем не менее это неправильно, поскольку температуры заданы в градусах Цельсия, а в формулу (12.2), связывающую температуру и среднюю кинетическую энергию молекул, входит абсолютная температура. Поэтому
Поэтому
(ответ 4).
Атомы и Молекулы | Химия
связь: [email protected]
Что такое химия
Атомы и Молекулы
Химические формулы
Химический язык
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все — от песчинок малых до планет —
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева»
Древнегреческий философ Демокрит 2500 лет назад высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Слово “атом” в переводе означает “неделимый”. Позднее, в средние века, учение об атомах преследовалось религией, которая тормозила развитие науки в целом, и химии в частности.
Учение о молекулах и атомах было разработано в середине 18 века великим русским ученым Михаилом Васильевичем Ломоносовым (1711 – 1765 гг.) Он утверждал, что тела в природе состоят из корпускл (молекул), в состав которых входят элементы (атомы).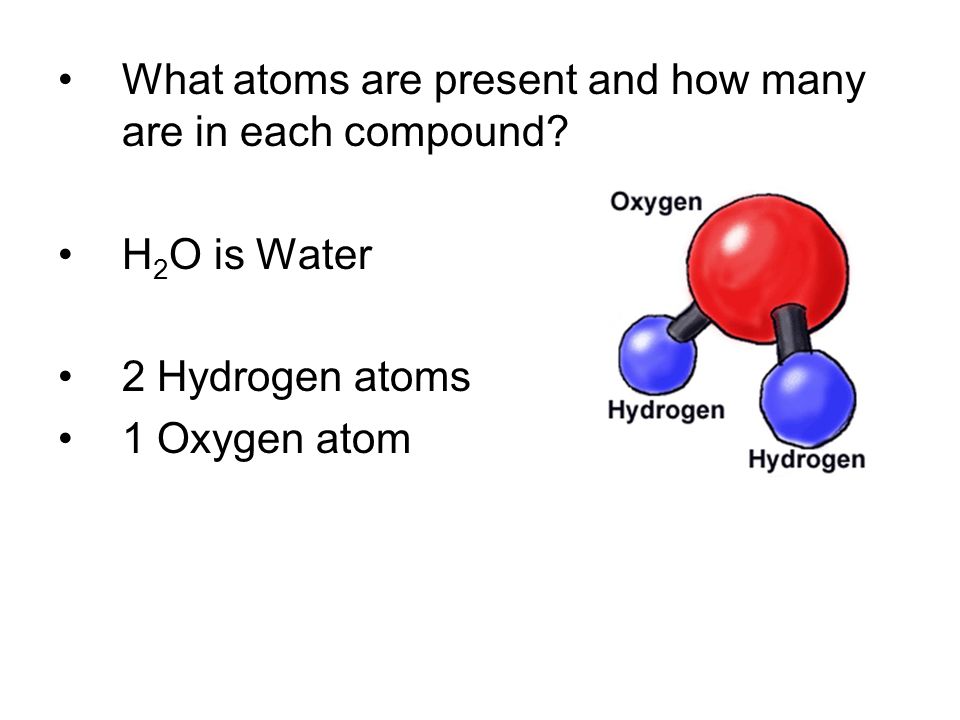 Многообразие веществ ученый прозорливо объяснял соединением разных атомов в молекулах и различным расположением атомов в них. Удивительно верной и смелой для того времени была мысль М. В. Ломоносова о том, что некоторые корпускулы (молекулы) могут состоять из одинаковых элементов (атомов).
Многообразие веществ ученый прозорливо объяснял соединением разных атомов в молекулах и различным расположением атомов в них. Удивительно верной и смелой для того времени была мысль М. В. Ломоносова о том, что некоторые корпускулы (молекулы) могут состоять из одинаковых элементов (атомов).
Термин «атом» предложил Дж. Дальтон в начале 19 века. Он назвал атомами мельчайшие частицы, не изменяющиеся в химических реакциях.
Атомы — мельчайшие химически неделимые частицы, из которых состоят вещества.
Атомно-молекулярное учение
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
На сегодняшний день известно 118 видов атомов. Более 90 из них существуют в природе, а остальные получены искусственно.
Атомы характеризуются:
определёнными очень малыми размерами;
определённой, тоже очень малой, массой;
определённым строением.
Размеры атомов настолько малы, что увидеть их невозможно даже в самый мощный микроскоп. Радиусы атомов составляют 0,046–0,25 нм (1 нм = 10−9 м). Самый маленький — атом гелия, а самый большой — франция.
Атомы редко встречаются в изолированном виде. Обычно они соединяются друг с другом в молекулы или более крупные структуры. Число вариантов соединения атомов практически бесконечно, и их относительно небольшое число приводит к образованию огромного количества разнообразных веществ.
Пример:
атомы кислорода образуют два вещества. Когда они соединяются попарно, то образуется кислород. Если же три атома кислорода образуют молекулу, то образуется озон.
Когда они соединяются попарно, то образуется кислород. Если же три атома кислорода образуют молекулу, то образуется озон.
Молекула — мельчайшая частица вещества, способная существовать самостоятельно, сохраняющая его состав и химические свойства.
Молекулы характеризуются качественным и количественным составом.
Качественный состав показывает, из каких атомов состоит молекула.
Пример:
молекулы воды и пероксида водорода состоят из атомов водорода и кислорода, а молекула углекислого газа — из атомов углерода и кислорода.
Количественный состав показывает, сколько атомов каждого вида содержится в молекуле.
Пример:
молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула пероксида водорода — из двух атомов водорода и двух атомов кислорода. В молекулах может быть разное число атомов.
Химические формулы
Химическая формула — условная запись, отражающая качественный и количественный состав вещества.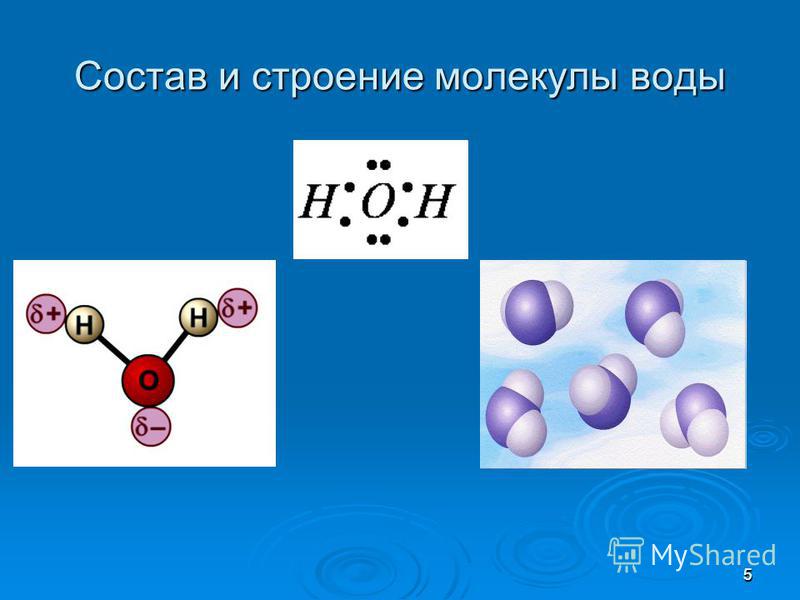
Качественный состав показывают с помощью символов химических элементов, а количественный — с помощью индексов.
Индекс — цифра в химической формуле, которая ставится справа внизу от химического знака и обозначает число атомов данного элемента.
Обрати внимание!
Индекс «1» в химической формуле опускается.
Если в формуле записан знак химического элемента без индекса, значит, в частице вещества содержится один атом данного элемента.
Химические формулы веществ молекулярного строения показывают состав молекул. Это молекулярные формулы.
Пример:
O2 («о-два») — молекулярная формула кислорода. В молекуле кислорода содержатся два атома химического элемента кислорода.
He («гелий») — молекулярная формула инертного (благородного) газа гелия. Молекулы благородных газов одноатомные.
h3SO4 («аш-два-эс-о-четыре») — молекулярная формула серной кислоты. Молекула серной кислоты содержит два атома водорода, один атом серы и четыре атома кислорода.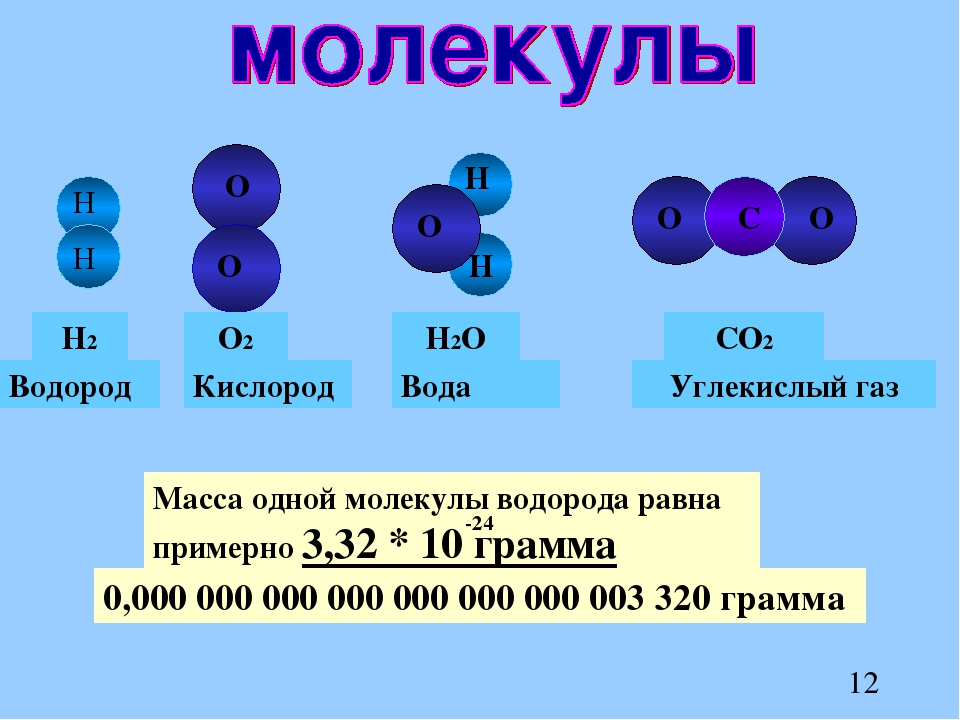
Химические формулы веществ немолекулярного строения показывают простейшее соотношение числа атомов химических элементов в веществе. Такие формулы называют простейшими формулами.
Группа атомов, состав которой соответствует простейшей формуле вещества, называется формульной единицей.
Для простых веществ немолекулярного строения формульной единицей является атом, поэтому их формулы записывают просто знаками химических элементов без индексов.
Пример:
Cu («купрум»)— формула меди, которая показывает, что её формульной единицей является атом.
Fe2O3 («феррум-два-о-три») — простейшая формула оксида железа(III). В этом веществе на два атома железа приходится три атома кислорода.
Обрати внимание!
Повторяющиеся группы атомов в формуле заключают в скобки.
Пример:
Mg(OH)2 («магний-о-аш-дважды»)— в гидроксиде магния на один атом магния приходится два атома кислорода и два атома водорода.
Ca3(PO4)2 («кальций-три-пэ-о-четыре-дважды»)— в фосфате кальция на три атома кальция приходится два атома фосфора и восемь атомов кислорода.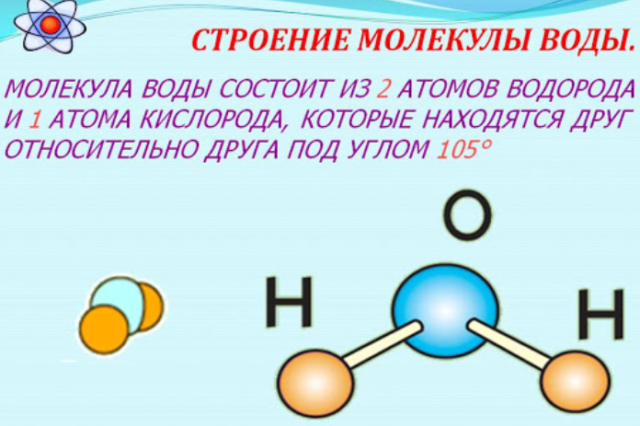
В химических записях используются коэффициенты.
Коэффициент — цифра в химической записи, которая ставится перед формулой и показывает число отдельных атомов, молекул или формульных единиц.
Обрати внимание!
Коэффициент «1» не записывается.
Пример:
O — один атом кислорода.
3h3 — три молекулы водорода, каждая из которых состоит из двух атомов химического элемента водорода.
10h3SO4 — десять молекул серной кислоты, содержащих по два атома водорода, одному атому серы и по четыре атома кислорода.
2Mg(OH)2 — две формульные единицы гидроксида магния, состоящие из одного атома магния, двух атомов кислорода и двух атомов водорода.
екст. Нажмите, чтобы отредактировать и добавить что-нибудь интересное.
Простые и сложные вещества
По элементному составу различают:
Простые вещества, состоят из атомов одного элемента (h3, O2,Cl2, P4, Na, Cu, Au).
Сложные вещества, состоят из атомов разных элементов (h3O,Nh4, OF2, h3SO4, MgCl2,K2SO4).
Атомы химических элементов различаются своими массами. Масса атома обозначается символом ma и выражается в единицах массы кг или г.
Массы атомов малы. Так, масса атома водорода равна ma(H)=1,67⋅10−24 г, а масса атома углерода — ma(C)=19,94⋅10−24 г.
Использовать такие числа неудобно. Поэтому в химии применяется относительная атомная масса Ar.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
За атомную единицу массы выбрана 1/12 часть массы атома углерода.
Относительные атомные массы химических элементов приведены в периодической таблице. В расчётах обычно используют их значения, округлённые до целых. Исключение — Ar(Cl)= 35,5.
Для изучения химических элементов, разработано не мало приложений. Мы их протестировали и выбрали вот эти:
Тренажёр №1 Химические элементы и Периодическая таблица — Тест (приложение для Android)
Тренажёр №2 Игра «Таблица Менделеева» ( можно играть в браузере)
Что такое химия
Атомы и Молекулы
Химические формулы
Атомы и молекулы
Атомы — это маленькие частицы, из которых состоит вещество. Невозможно даже представить себе, насколько они малы. Если сложить в цепочку сто миллионов атомов, у нас получится ниточка длиной всего лишь в 1 см. В тонком листе бумаги, наверное, не меньше миллиона слоев атомов. Науке известно более ста видов атомов; соединяясь друг с другом, они образуют все окружающие нас вещества.
Невозможно даже представить себе, насколько они малы. Если сложить в цепочку сто миллионов атомов, у нас получится ниточка длиной всего лишь в 1 см. В тонком листе бумаги, наверное, не меньше миллиона слоев атомов. Науке известно более ста видов атомов; соединяясь друг с другом, они образуют все окружающие нас вещества.
Мысль о том, что всё в природе состоит из атомов, возникла давно. Еще 2500 лет назад древнегреческие философы полагали, что вещество состоит из таких частиц, которые нельзя разделить. Само слово «атом» восходит к греческому слову «атомос», что значит «неделимый». В Древней Греции (см. статью «Загадочные жители Греции«) философы обсуждали гипотезу о том, что всё вещество в мире состоит из неделимых частиц. Правда, Аристотель в этом сомневался.
Термин «атом» был впервые использован английским химиком Джоном Дальтоном (1766- 1844). В 1807 г. Дальтон выдвинул свою атомную теорию. Атомами он назвал составляющие всякое вещество малые частицы, которые не изменяются входе химических реакций. Согласно Дальтону, химическая реакция — это процесс, при котором атомы соединяются вместе или отделяются друг от друга. Атомная теория Дальтона лежит в основе представлений современных ученых.
Согласно Дальтону, химическая реакция — это процесс, при котором атомы соединяются вместе или отделяются друг от друга. Атомная теория Дальтона лежит в основе представлений современных ученых.
В начале нашего столетия ученые начали строить модели атомов. Эрнест Резерфорд (1871 — 1937) показал, что отрицательно заряженные электроны обращаются вокруг положительно заряженного ядра. Нильс Бор (1885 — 1962) утверждал, что электроны обращаются по определенным орбитам. В 1932 г. Джеймс Чедвик (1891 — 1974) установил, что ядро атома состоит из частиц, которые он назвал протонами и нейтронами.
Структура атомаАтомы состоят из еще меньших, чем они сами, частиц, называемых элементарными. Центром атома является его ядро. Оно состоит из элементарных частиц двух видов — протонов и нейтронов. Есть в атоме также другие элементарные частицы — электроны; они вращаются вокруг ядра. Существует множество разных элементарных частиц.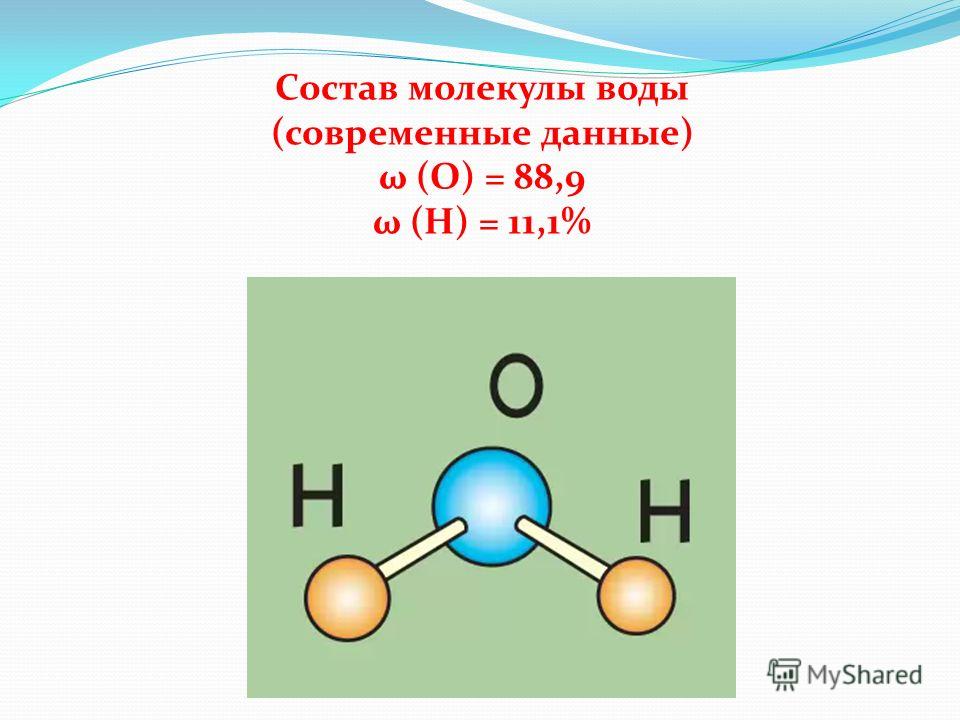 Ученые считают, что протоны и нейтроны состоят из кварков. Элементарные частицы, входящие в состав атома, удерживаются вместе благодаря своим электрическим зарядам. Протоны заряжены положительно, а электроны — отрицательно. Нейтроны заряда не имеют, т.е. являются электрически нейтральными. Частицы, несущие противоположные электрические заряды, притягиваются друг к другу. Притяжение отрицательно заряженных электронов к положительно заряженным протонам, находящимся в атомном ядре, удерживает электроны на орбитах около этого ядра. В состав атома входит одинаковое число положительно заряженных протонов и отрицательно заряженных электронов, и атом электрически нейтрален.
Ученые считают, что протоны и нейтроны состоят из кварков. Элементарные частицы, входящие в состав атома, удерживаются вместе благодаря своим электрическим зарядам. Протоны заряжены положительно, а электроны — отрицательно. Нейтроны заряда не имеют, т.е. являются электрически нейтральными. Частицы, несущие противоположные электрические заряды, притягиваются друг к другу. Притяжение отрицательно заряженных электронов к положительно заряженным протонам, находящимся в атомном ядре, удерживает электроны на орбитах около этого ядра. В состав атома входит одинаковое число положительно заряженных протонов и отрицательно заряженных электронов, и атом электрически нейтрален.
Электроны в атоме находятся на разных энергетических уровнях, или оболочках. Каждая оболочка состоит из определенного числа электронов. Когда очередная оболочка заполняется, новые электроны попадают на следующую оболочку. Большую часть объема атома занимает пустое пространство между элементарными частицами.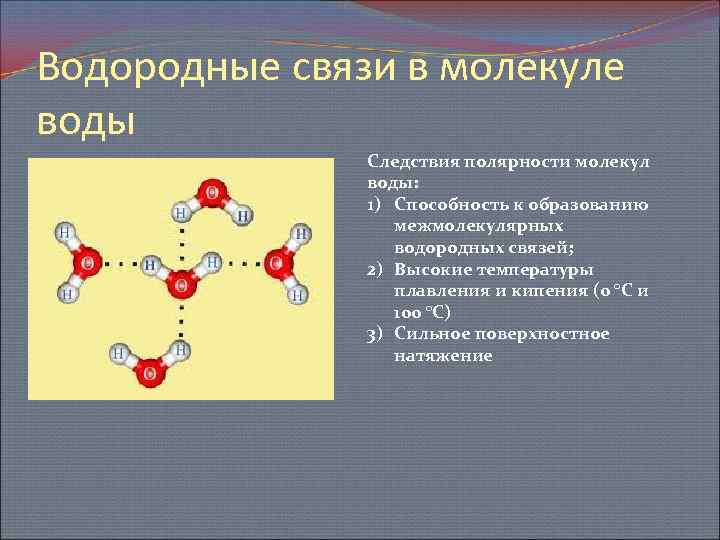 Отрицательно заряженные электроны удерживаются на своих энергетических уровнях силой притяжения к положительно заряженным протонам ядра.
Отрицательно заряженные электроны удерживаются на своих энергетических уровнях силой притяжения к положительно заряженным протонам ядра.
Строение атома часто описывают строгой диаграммой, однако сегодня ученые полагают, что электроны существуют на своих орбитах в размытом состоянии. Это представление отражено на рисунке, где электронные орбиты представлены в виде «облаков». Так вы бы увидели молекулу под электронным микроскопом. Равными цветами показаны разные уровни плотности электронов. Бирюзовым цветом отмечена область наибольшей плотности.
Атомный номер и атомная масса
Атомный номер — это число протонов в атомном ядре. Как правило, в состав атома входит одинаковое число протонов и электронов, поэтому по атомному номеру можно судить и о том, сколько в атоме электронов. В разных атомах содержится разное количество протонов. В ядре атома фосфора 15 протонов и 16 нейтронов, значит, его атомный номер 15. В ядре атома золота 79 протонов и 118 нейтронов: следовательно, атомный номер золота 79.
Чем больше протонов и нейтронов имеет атом, тем больше его масса (величина, показывающая количество вещества в составе атома). Сумму числа протонов и числа нейтронов мы называем атомной массой. Атомная масса фосфора — 31. При исчислении атомной массы электроны в расчет не принимаются, так как их масса ничтожно мала по сравнению с массой атома. Существует особый прибор — масс-спектрометр. Он позволяет определить для каждого данного атома его массу.
ИзотопыУ большинства элементов существуют изотопы, атомы которых имеют несколько отличное строение. Количество протонов и электронов в атомах изотопов одного элемента всегда неизменно. Атомы изотопов различаются числом нейтронов в ядре. Следовательно, у всех изотопов одного элемента один и тот же атомный номер, но разная атомная масса. На этом рисунке вы видите три изотопа углерода. У изотопа С12 есть 6 нейтронов и 6 протонов. С13 имеет 7 нейтронов. В ядре изотопа С12 восемь нейтронов и 6 протонов.
Физические свойства изотопов различны, но они обладают одинаковыми химическими свойствами. Обычно большая часть атомов элемента (вещества, состоящего из атомов одного вида) принадлежит к одному изотопу, а другие изотопы встречаются в меньших количествах.
Молекулы
Атомы редко встречаются и свободном состоянии. Как правило, они связываются друг с другом и образуют молекулы либо другие, более массивные структуры. Молекула — это мельчайшая частица вещества, которая может существовать самостоятельно. Она состоит из атомов, удерживающихся вместе при помощи связей. Например, у молекулы воды два атома водорода связанны с атомом кислорода. Атомы удерживаются вместе благодаря электрическим зарядам частиц, из которых они состоят. Описывая строение молекул, ученые прибегают к помощи моделей. Как правило, они пользуются структурными и пространственными моделями. Структурные модели представляют связи, удерживающие атомы вместе, в виде палочек. В пространственных моделях атомы плотно соединены друг с другом.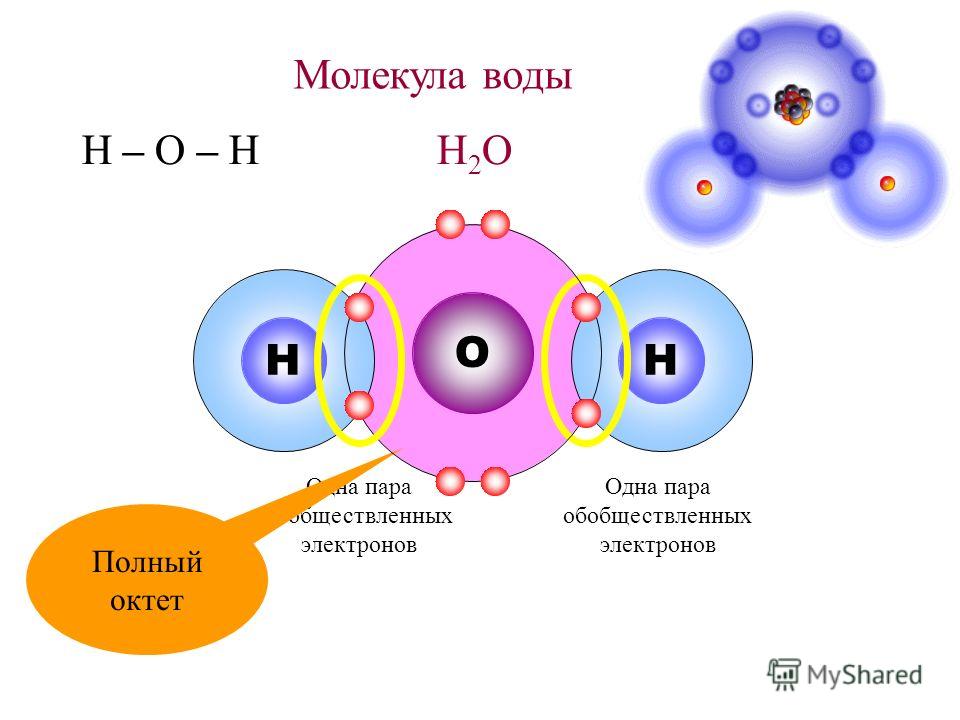 Конечно, модель не похожа на настоящую молекулу. Модели строятся для того, чтобы показать, из каких атомов та или иная молекула состоит.
Конечно, модель не похожа на настоящую молекулу. Модели строятся для того, чтобы показать, из каких атомов та или иная молекула состоит.
Химические формулы
Химическая формула вещества показывает, сколько атомов каких элементов входит в состав одной молекулы. Каждый атом обозначается символом. Как правило, в качестве символа выбирается первая буква английского, латинского или арабского названия элемента. Например, молекула углекислою газа состоит из двух атомов кислорода и одного атома углерода, поэтому формула углекислого газа СО2. Двойка Атомы обозначает число атомов кислорода в молекуле.
Этот опыт продемонстрирует вам, что молекулы вещества удерживаются вместе силами притяжения. Наполните стакан водой до краев. Осторожно опустите в стакан несколько монет. Вы увидите, что над краями стакана приподнялся водяной купол. Сила, притягивающая молекулы воды друг к другу, может удержать некоторое количество воды над краями стакана. Эта сила называется силой поверхностного натяжения.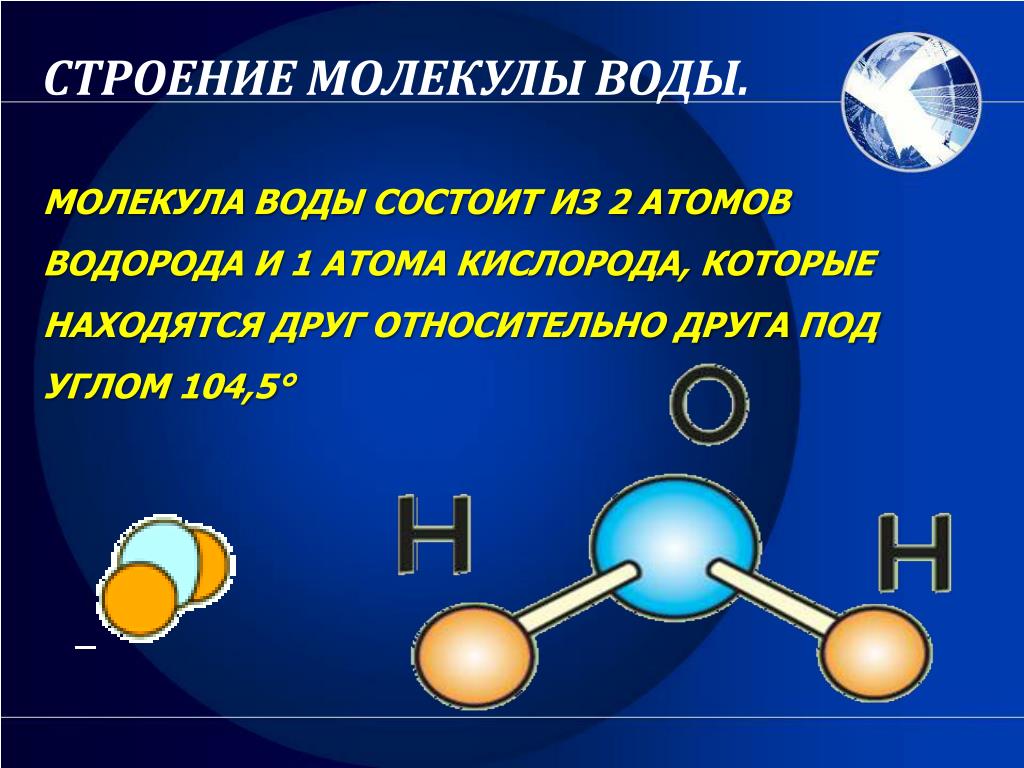
Химические формулы. Относительные атомная и молекулярная массы
Химические формулы. Относительные атомная и молекулярная массы
Урок посвящен изучению правил составления и чтения химических формул веществ. Вы узнаете, какую информацию дает химическая формула вещества и как на основании данных о массовых долях химических элементов составить химическую формулу. Из материалов урока вы узнаете, как и в чем измеряют массы молекул, как определить порции твердых и жидких веществ, имеющие равное число молекул.
I. Химические формулы
Химическая формула — это условная запись качественного и количественного состава вещества при помощи химических знаков и индексов.
Индекс — это цифра в химической формуле, которая ставится внизу после химического знака и обозначает число атомов данного вида.
Качественный состав молекулы показывает какие виды атомов входят в состав вещества.
Количественный состав показывает сколько атомов определённого вида входит в состав молекулы вещества.
Числа стоящие перед химическими формулами или химическими знаками называются коэффициентами. Коэффициенты показывают число атомов или молекул определённого вида.
Что обозначают записи?
h3— это одна молекула водорода (аш-два), в её состав входят два атома водорода.
5O2 — это пять молекул кислорода (пять-о-два), в состав одной молекулы входят два атома кислорода.
6Fe — это шесть атомов железа (шесть-феррум).
3h3SO4 — это три молекулы серной кислоты (три-аш-два-эс-о-четыре), в состав одной молекулы серной кислоты входят два атома водорода, один атом серы, четыре атома кислорода.
II. Относительная атомная масса
Посмотрите презентацию:
Модель Дж. Дальтона и Й.Я. Берцелиуса
В начале 19 в. (спустя 150 лет после работ Роберта Бойля) английский ученый Джон Дальтон предложил способ определения массы атомов химических элементов. Рассмотрим суть этого метода.
Дальтон предложил модель, в соответствии с которой в молекулу сложного вещества входит только по одному атому различных химических элементов. Например, он считал, что молекула воды состоит из 1 атома водорода и 1 атома кислорода. В состав простых веществ по Дальтону тоже входит только один атом химического элемента. Т.е. молекула кислорода должна состоять из одного атома кислорода.
И тогда, зная массовые доли элементов в веществе, легко определить во сколько раз масса атома одного элемента отличается от массы атома другого элемента. Таким образом, Дальтон считал, что массовая доля элемента в веществе определяется массой его атома.
Таким образом, Дальтон считал, что массовая доля элемента в веществе определяется массой его атома.
Ученый заметил, что масса атома водорода самая маленькая, т.к. нет сложного вещества, в котором бы массовая доля водорода была бы больше массовой доли другого элемента. Поэтому он предложил массы атомов элементов сравнивать с массой атома водорода. И таким путем вычислил первые значения относительных (относительно атома водорода) атомных масс химических элементов.
Атомная масса водорода была принята за единицу. А значение относительной массы серы получилось равным 17. Но все полученные значения были либо приблизительными, либо неверными, т.к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
В 1807 – 1817 гг. шведский химик Йёнс Якоб Берцелиус провел огромное исследование по уточнению относительных атомных масс элементов. Ему удалось получить результаты, близкие к современным.
Ему удалось получить результаты, близкие к современным.
Массы атомов очень малы.
Абсолютные массы некоторых атомов:
m(C) =1,99268 ∙ 10-23 г
m(H) =1,67375 ∙ 10-24 г
m(O) =2,656812 ∙ 10-23 г
В настоящее время в физике и химии принята единая система измерения.
Введена атомная единица массы (а.е.м.)
m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10-24 г.
· Ar(H) = m(атома) / m (а.е.м.) = 1,67375 ∙ 10-24 г/1,66057 ∙ 10-24 г = 1,0079 а.е.м.
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина.
Относительная атомная масса — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная атомная масса безразмерная величина
Например, относительная атомная масса атома кислорода равна 15,994 (используем значение из периодической системы химических элементов Д. И. Менделеева).
И. Менделеева).
Записать это следует так, Ar(O) = 16. Всегда используем округлённое значение, исключение представляет относительная атомная масса атома хлора:
Ar(Cl) = 35,5
Связь между абсолютной и относительной массами атома представлена формулой: m(атома) = Ar ∙ 1,66 ∙ 10 -27 кг
III. Относительная молекулярная масса
В химии не используют значения абсолютных масс молекул, а пользуются величиной относительная молекулярная масса. Она показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Эту величину обозначают Mr.
Относительная молекулярная масса равна сумме относительных атомных масс входящих в нее атомов. Вычислим относительную молекулярную массу воды.
Вы знаете, что в состав молекулы воды входят два атома водорода и один атом кислорода. Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
Посмотрите презентацию: “Вычисление относительной молекулярной массы серной кислоты”:
IV. Закрепление
Задание №1. Вычислите относительные молекулярные массы следующих веществ: NaOH, CuCl2, HNO3
Задание №2. Напишите, что обозначают следующие записи, в скобках указаны названия незнакомых веществ:
- 4S
- 7h3O
- 4O3 (озон)
- 2NaCl (поваренная соль)
- 3h3CO3 (угольная кислота)
- 6C12h32O11 (сахар)
№3. Тренажеры
Тренажер 1
Тренажер 2
Тренажер 3
Тренажер 4
Молекулы.
 Движение. Теплота
Движение. ТеплотаМолекулы
Молекулы состоят из атомов. Атомы связаны в молекулы силами, которые называют химическими силами.
Существуют молекулы, состоящие из двух, трех, четырех атомов. Крупнейшие молекулы – молекулы белков – состоят из десятков и даже сотен тысяч атомов.
Царство молекул исключительно разнообразно. Уже сейчас химики выделили из природных веществ и создали в лабораториях миллионы веществ, построенных из разных молекул.
Свойства молекул определяются не только тем, сколько атомов того или иного сорта участвует в их постройке, но и тем, в каком порядке и в какой конфигурации они соединены. Молекула – это не груда кирпичей, а сложная архитектурная постройка, где каждый кирпич имеет свое место и своих вполне определенных соседей. Атомная постройка, образующая молекулу, может быть в большей или меньшей степени жесткой. Во всяком случае, каждый из атомов совершает колебание около своего положения равновесия. В некоторых же случаях одни части молекулы могут вращаться по отношению к другим частям, придавая свободной молекуле в процессе ее теплового движения различные и самые причудливые конфигурации.
Разберем подробнее взаимодействие атомов. На рис. 86 изображена кривая потенциальной энергии двухатомной молекулы. Она имеет характерный вид – сначала идет вниз, затем загибается, образуя «яму», и потом более медленно приближается к горизонтальной оси, по которой отложено расстояние между атомами.
Мы знаем, что устойчиво состояние, в котором потенциальная энергия имеет наименьшее значение. Когда атом входит в состав молекулы, он «сидит» в потенциальной яме, совершая небольшие тепловые колебания около положения равновесия.
Расстояние от вертикальной оси до дна ямы можно назвать равновесным. На этом расстоянии расположились бы атомы, если бы прекратилось тепловое движение.
Кривая потенциальной энергии рассказывает о всех деталях взаимодействия между атомами. Притягиваются или отталкиваются частицы на том или ином расстоянии, возрастает или убывает сила взаимодействия при отдалении или сближении частиц – все эти сведения можно получить из анализа кривой потенциальной энергии. Точки левее «дна» соответствуют отталкиванию. Напротив, участки кривой правее дна ямы характеризуют притяжение.
Точки левее «дна» соответствуют отталкиванию. Напротив, участки кривой правее дна ямы характеризуют притяжение.
Важные сведения сообщает и крутизна кривой: чем круче идет кривая, тем больше сила.
Находясь на больших расстояниях, атомы притягиваются один к другому; эта сила весьма быстро уменьшается с увеличением расстояния между ними. При сближении сила притяжения возрастает и достигает наибольшего значения уже тогда, когда атомы подойдут один к другому очень близко. При еще большем сближении притяжение ослабевает и, наконец, на равновесном расстоянии сила взаимодействия обращается в нуль. При сближении атомов на расстояние, меньшее равновесного, возникают силы отталкивания, которые очень резко нарастают и быстро делают практически невозможным дальнейшее уменьшение расстояния.
Равновесные расстояния (ниже мы будем говорить короче – расстояния) между атомами различны для разных сортов атомов.
Для разных пар атомов различны не только расстояния от вертикальной оси до дна ямы, но и глубина ям.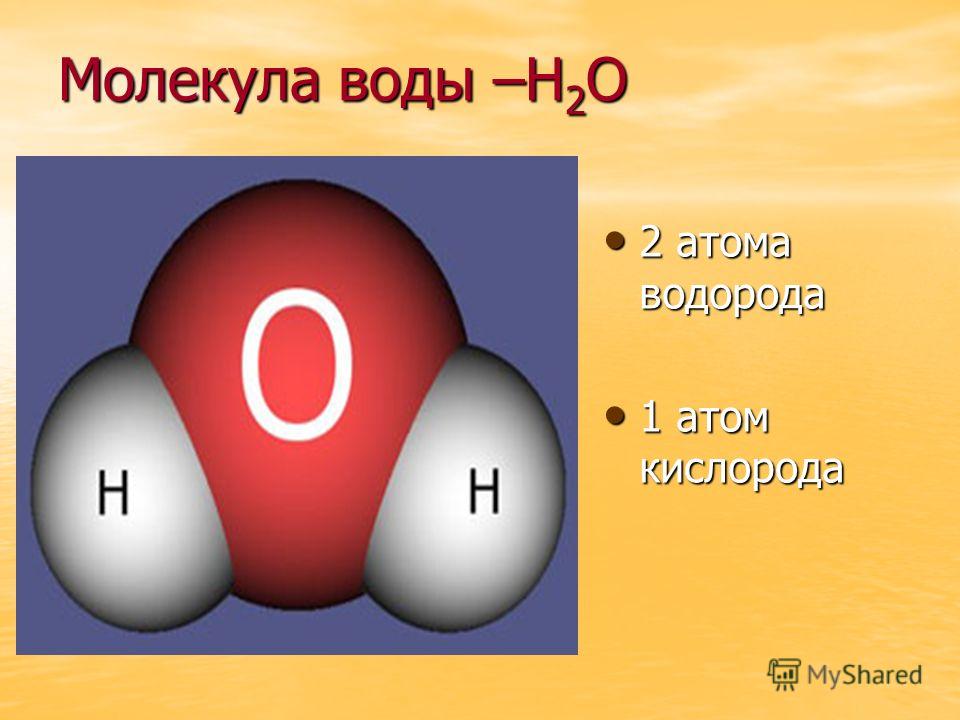
Глубина ямы имеет простой смысл – чтобы выкатиться из ямы, нужна энергия, как раз равная глубине. Поэтому глубину ямы можно назвать энергией связи частиц.
Расстояния между атомами молекул столь малы, что для их измерения надо выбрать подходящие единицы, иначе пришлось бы выражать их значения, например, в таком виде: 0,000000012 см. Это цифра для молекулы кислорода.
Единицы, особенно удобные для описания атомного мира, называются ангстремами (правда, фамилия шведского ученого, именем которого названы эти единицы, правильно читается Онгстрем; для напоминания об этом над буквой А ставят кружок).
1 ? = 10?8 см,
т.е. одной стомиллионной доле сантиметра.
Расстояния между атомами молекул лежат в пределах от 1 до 4 ангстрем. Написанное выше равновесное расстояние для кислорода равно 1,2 ?.
Межатомные расстояния, как вы видите, очень малы. Если опоясать земной шар веревкой у экватора, то длина «пояса» во столько же раз будет больше ширины вашей ладони, во сколько раз ширина ладони больше расстояния между атомами молекулы.
Для измерения энергии связи пользуются обычно калориями, но относят их не к одной молекуле, что дало бы, разумеется, ничтожную цифру, а к грамм-молекуле, т.е. к числу граммов, равному относительному молекулярному весу.
Ясно, что энергия связи на грамм-молекулу, если ее поделить на число Авогадро N = 6,023·1023, даст энергию связи одной молекулы.
Энергия связи атомов в молекуле, как и межатомные расстояния, колеблется в незначительных пределах.
Для того же кислорода энергия связи равна 116 000 калорий на грамм-молекулу, для водорода – 103 000 калорий и т.д.
Мы уже говорили, что атомы в молекулах располагаются вполне определенным образом одни по отношению к другим, образуя в сложных случаях весьма замысловатые постройки.
Приведем несколько простых примеров. В молекуле СO2 (углекислый газ) все три атома расположены в ряд – атом углерода посередине. Молекула воды Н2O имеет уголковую форму, вершиной угла (он равен 105°) является атом кислорода.
В молекуле аммиака NH3 атом азота находится в вершине трехгранной пирамиды; в молекуле метана СН4 атом углерода находится в центре четырехгранной фигуры с равными сторонами, которая называется тетраэдром.
Атомы углерода бензола С6Н6 образуют правильный шестиугольник. Связи атомов углерода с водородом идут от всех вершин шестиугольника. Все атомы расположены в одной плоскости.
Схемы расположения центров атомов этих молекул показаны на рис. 87 и 88. Линии символизируют связи.
Прошла химическая реакция; были молекулы одного сорта, образовались другие. Одни связи порваны; другие созданы вновь. Для разрыва связей между атомами – вспомните рисунок – нужно затратить такую же работу, как при выкатывании шара из ямы. Напротив, при образовании новых связей энергия выделяется – шар скатывается в яму.
Что больше, работа разрыва или работа созидания? В природе мы сталкиваемся с реакциями обоих типов.
Излишек энергии называется тепловым эффектом, или короче – теплотой превращения (реакции). Тепловые эффекты реакций – это большей частью величины порядка десятков тысяч калорий при расчете на моль. Очень часто тепловой эффект включают в качестве слагаемого в формулу реакции.
Тепловые эффекты реакций – это большей частью величины порядка десятков тысяч калорий при расчете на моль. Очень часто тепловой эффект включают в качестве слагаемого в формулу реакции.
Например, реакция сгорания углерода в виде графита, т.е. соединения его с кислородом, пишется так:
С + О2 = СO2 + 94 250 кал.
Это значит, что при соединении С с O2 выделяется энергия 94 250 калорий.
Сумма внутренних энергий грамм-атома углерода в графите и грамм-молекулы кислорода равняется внутренней энергии грамм-молекулы углекислого газа плюс 94 250 калорий.
Таким образом, подобные записи имеют ясный смысл алгебраических равенств, записанных для величин внутренней энергии.
С помощью таких уравнений можно найти тепловые эффекты превращений, для которых не годятся по тем или иным причинам прямые способы измерения. Вот пример: если бы углерод (графит) соединить с водородом, то образовался бы газ ацетилен:
2С + Н2 = С2Н2.
Реакция не идет таким путем. Тем не менее можно найти ее тепловой эффект. Запишем три известные реакции –
окисление углерода:
2С + 2О2 = 2СО2 + 188 000,
окисление водорода:
Н2 + (1/2)О2 = Н2О + 68 000,
окисление ацетилена:
С2Н2 + (5/2)O2 = 2СО2 + Н2О + 312 000.
Все эти равенства можно рассматривать как уравнения для энергий связи молекул. Если так, то ими можно оперировать как с алгебраическими равенствами. Вычитая из нижнего два верхних, получим:
2С + H2 = С2Н2 ? 56 000.
Значит, интересующее нас превращение сопровождается поглощением 56 000 калорий на одну грамм-молекулу.
Количество атомов в капле воды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 50702
- Эд Витц, Джон В.
 Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан - Цифровая библиотека химического образования (ChemEd DL)
Поскольку атомы и молекулы чрезвычайно малы, в любом макроскопическом образце их очень много. 15,9994 г кислорода, выраженного в молях: количество молекул воды, будет содержать, например, 6,022 × 10 23 атомов кислорода, а 2,016 г водорода, вступившего в реакцию с ним, будут содержать в два раза больше (12,044 × 10 23 ) атомов водорода. Очень большие числа, связанные с подсчетом микроскопических частиц, неудобно обдумывать или записывать. Поэтому химики выбрали для подсчета атомов и молекул единицу измерения, называемую моль. Один моль (сокращенно моль) составляет 6,022 × 10 23 микроскопических частиц, из которых состоит рассматриваемое вещество. Таким образом, 6,022 × 10 23 атомов O относятся к 1 моль O.
Идея использования большого числа в качестве единицы измерения количества имеющихся у нас объектов не является уникальной для химиков.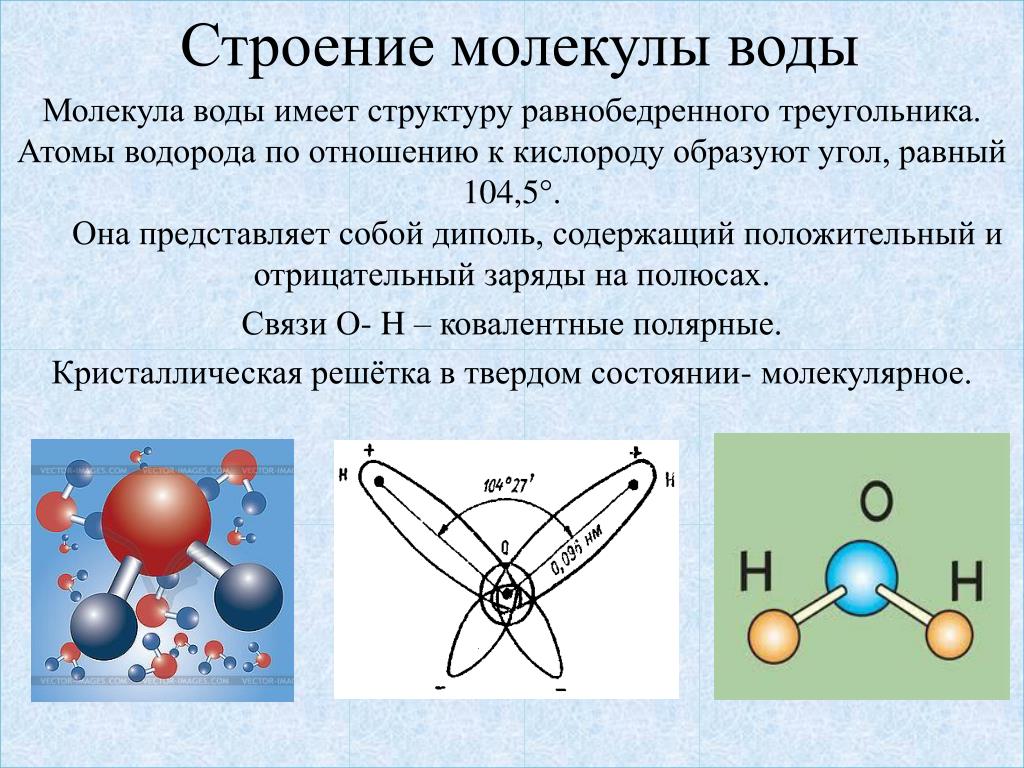 Яйца, пончики и многое другое продается дюжинами — единицей из двенадцати штук. Предметы меньшего размера, такие как карандаши, можно заказать по 144 штуки, то есть оптом, а бумага упакована в пачки, каждая из которых содержит 500 листов. Химик, ссылающийся на 1 моль O, очень похож на управляющего книжным магазином, который заказывает 2,5 дюжины спортивных рубашек, 20 брутто карандашей или 62 пачки бумаги.
Яйца, пончики и многое другое продается дюжинами — единицей из двенадцати штук. Предметы меньшего размера, такие как карандаши, можно заказать по 144 штуки, то есть оптом, а бумага упакована в пачки, каждая из которых содержит 500 листов. Химик, ссылающийся на 1 моль O, очень похож на управляющего книжным магазином, который заказывает 2,5 дюжины спортивных рубашек, 20 брутто карандашей или 62 пачки бумаги.
Однако существует разница в степени, потому что химическая единица 6,022 × 10 23 очень велика. Стопка бумаги, содержащая моль листов, простиралась бы более чем в миллион раз на расстояние от земли до солнца, а 6,022 × 10 23 песчинок покрыли бы всю землю в мире на глубину почти 2 фута. У студента может быть 10 27 молекул воды (около 10 4 моль), и ему необходимо накопить около 10 18 (десять миллионов миллионов миллионов, но только 0,00001 моль) молекул воды в секунду за 18 лет, чтобы достичь этого количества.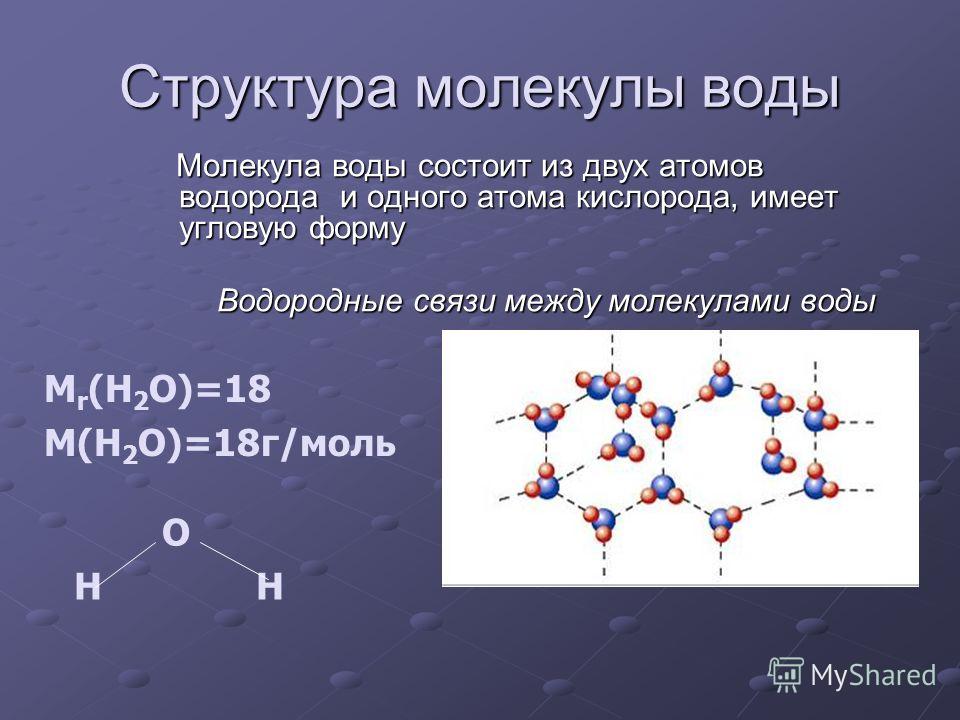 Доказательство будет дано вскоре в разделе «Использование молярной массы воды». Очевидно, что в моле чего-либо содержится очень много частиц.
Доказательство будет дано вскоре в разделе «Использование молярной массы воды». Очевидно, что в моле чего-либо содержится очень много частиц.
Почему химики выбрали такое необычное число, как 6,022 × 10 23 , в качестве единицы для подсчета количества атомов или молекул? Наверняка какое-нибудь красивое круглое число было бы легче запомнить. Ответ состоит в том, что число граммов в массе 1 моль атомов любого элемента равно атомному весу этого элемента . Например, 1 моль атомов кислорода не только содержит 6,022 × 10 23 атомов, но его массу 15,9994 г удобно получить, прибавив единицу грамм к таблице атомных весов. Некоторые другие примеры:
.1 моль H содержит 6,022 × 10 23 атомов H; его масса 1,008 г.
1 моль C содержит 6,022 × 10 23 атомов C; его масса 12,01 г.
1 моль О содержит 6,022 × 10 23 атомов О; его масса 15,994 или 16,00 г.
1 моль Br содержит 6,022 × 10 23 атомов Br; его масса 79,90 г.
(Здесь и в последующих расчетах атомные массы округляются до двух знаков после запятой, если только, как в случае H, не останется менее четырех значащих цифр.)
Масса моля из молекул также может быть получена из атомных весов. Подобно тому, как в дюжине яиц будет дюжина белков и дюжина желтков, моль молекул CO будет содержать моль атомов C и моль атомов O.
Таким образом, масса моля СО равна
.\[\text{Масса 1 моль C} + \text{масса 1 моль O} = \text{масса 1 моль CO}\nonumber\]
\[\text{12,01 г} + \text{16,00 г} = \text{28,01 г}\номер\]
Молекулярная масса CO (28,01), выраженная в граммах, представляет собой массу моля CO. Некоторые другие примеры:
.Таблица \(\PageIndex{1}\) Молекулярные веса
| Молекула | Молекулярный вес | Масса 1 моль молекул |
| Бр 2 | 2 (79,90) = 159,80 | 159,80 г |
| О 2 | 2(16. 00) = 32.00 00) = 32.00 | 32,00 г |
| Н 2 О | 2(1,008) + 16 = 18,02 | 18,02 г |
| Н 2 О 2 | 2(1,008) + 2(16) = 34,016 | 34,016 г |
| HgBr 2 | 200,59 + 2(79,90) = 360,39 | 360,39 г |
Важно указать, к какому типу частиц относится моль. Моль атомов О, например, содержит вдвое меньше атомов (и вдвое меньше массы), чем моль молекул О 2 . Лучше не говорить о моле кислорода, не уточнив, имеете ли вы в виду 1 моль O или 1 моль O 2 .
От ChemPRIME: 2.7: Крот
Эд Витц (Университет Куцтауна), Джон В. Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан.
Эта страница под названием «Количество атомов в капле воды» распространяется по незаявленной лицензии, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон У. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф, и Адам Хан.
Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф, и Адам Хан.
- Вернуться к началу
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Теги
- Образец
Сколько молекул и атомов в капле воды?
Эта запись была опубликована автором Anne Helmenstine (обновлено )
В капле воды много молекул и атомов.
 (Джон Томас)
(Джон Томас)Вы когда-нибудь задумывались, сколько молекул или атомов содержится в капле воды? Это обычная проблема, которую решают учащиеся по химии, потому что она касается нескольких важных понятий, включая химические формулы, преобразование единиц измерения, объем, массу, плотность, использование периодической таблицы, моль и число Авогадро. Вот пошаговая инструкция по расчету.
- Используйте химическую формулу воды, чтобы найти массу одного моля воды.
- Используйте плотность воды, чтобы найти массу на единицу объема.
- Умножьте массу на единицу объема на объем капли воды, чтобы найти массу на каплю.
- Преобразуйте граммы в моли, чтобы получить моли воды на каплю.
- Используйте число Авогадро, чтобы найти количество молекул воды в капле.
- Умножьте количество молекул на количество атомов в каждой молекуле, чтобы найти количество атомов в капле воды.
Средний объем капли воды составляет 0,05 мл. В капле воды более 1,5 секстиллионов (10 21 ) молекул и более 5 секстиллионов атомов в капле.
Насколько велика капля воды?
Определение объема капли воды — первая часть задачи. Капли воды резко различаются по размеру. Медицинское и научное сообщество обычно определяет средний объем капли воды как ровно 0,05 мл, что означает, что на миллилитр приходится 20 капель воды. Это хорошая отправная точка для расчета молекул и атомов в капле воды.
Химическая формула воды
Используйте химическую формулу воды для определения массы отдельной молекулы. Формула воды H 2 O означает, что в каждой молекуле воды два атома водорода и один атом кислорода. Каждая молекула воды содержит в общей сложности 3 атома.
Молярная масса воды
Найдите молярную массу воды. Сделайте это, найдя атомные массы водорода и кислорода в периодической таблице. Затем прибавьте массы атомов водорода и атомов кислорода в молекуле воды. Масса водорода 1,008 г/моль, а масса кислорода 16,00 г/моль. Масса одного моля воды:
масса воды = 2 x масса водорода + масса кислорода
масса воды = 2 x 1,008 + 16,00
масса воды = 18,016 г/моль
Масса одного моля воды составляет 18,016 грамма.
Плотность воды
Используйте плотность воды, чтобы найти массу воды на единицу объема. Значение плотности воды зависит от ее температуры (холодная вода более плотная, чем теплая), но типичное значение составляет 1,00 грамма на миллилитр (1 г/мл). Один миллилитр воды имеет массу 1 грамм, но капля воды имеет меньший объем, чем миллилитр. Умножьте массу единицы объема на объем капли, чтобы найти массу капли:
масса капли воды = 1 г/мл x 0,05 мл
масса капли воды = 0,05 грамма
Затем найдите количество молей воды в капле. Это базовое преобразование граммов в моли с использованием молярной массы воды:
моль в капле воды = 0,05 грамма x (1 моль / 18,016 грамма)
моль в капле воды = 0,002775 моль
Одна капля воды 0,002775 моль воды.
Использование числа Авогадро
Число Авогадро — это количество молекул в моле. Есть 6,022 х 10 23 молекул воды на моль воды. Используйте число Авогадро, чтобы найти количество молекул в капле воды. Умножьте число Авогадро на количество молей в капле воды:
Умножьте число Авогадро на количество молей в капле воды:
молекул в капле воды = (6,022 x 10 23 молекул/моль) x 0,002275 молей
молекул в капле воды = 1,67 x 10 21 молекул воды
В капле воды содержится 1,67 x 10 21 или 1,67 секстиллиона молекул воды.
На одну молекулу воды приходится три атома. Найдите количество атомов в капле воды, умножив это количество молекул на 3.
атом в капле воды = 3 атома/молекула x 1,67 x 10 21 молекул
атомов в капле воды = 5,01 x 10 21 атомов
В капле воды 5,01 x 10 21 или около 5 секстиллионов атомов.
Капли воды в океане
Вариант этой задачи состоит в том, чтобы определить, больше ли атомов в капле воды, чем капель воды в океане. Существуют разные оценки объема земных океанов, которые варьируются от 1,3 млрд км 3 и 1,5 км 3 . Геологическая служба США использует значение 1,338 миллиарда км 3 , что составляет 1,338 x 10 21 литров морской воды.
Чтобы ответить на вопрос, разделите это число на объем капли, чтобы получить количество капель воды в море.
количество капель воды в океане = 1,338 x 10 21 литров общего объема / 5,0 x 10 -5 литров на каплю
количество капель воды в океане = 2,676 x 10 26 капли
Поскольку 10 26 больше, чем 10 21 , в океане больше капель воды, чем молекул или атомов в капле воды . Размер капли имеет значение, но в океане на 1000–100 000 капель воды больше, чем атомов в капле воды.
Ссылка
- Gleick, P.H. (28 августа 2006 г.). «Где вода Земли». Распределение воды на Земле . Геологическая служба США.
Сколько атомов в моей чашке чая?
Пришествие бума #1 – Глупый вопрос
Я и дня не протяну без хорошей чашки чая. Вы можете размышлять о тайнах вселенной, потягивая освежающую кружку комфорта. Но в этом пришествии давайте будем глупыми и зададим несколько глупых вопросов — первый из них: сколько атомов в моей чашке чая?
Ведение счета
Некоторые вещи действительно легко сосчитать. Сколько у тебя пальцев? Вы, вероятно, не можете сосчитать это по пальцам одной руки, но это все еще довольно просто.
Сколько у тебя пальцев? Вы, вероятно, не можете сосчитать это по пальцам одной руки, но это все еще довольно просто.
Давайте немного усложним задачу: сколько у вас зубов?
Бьюсь об заклад, у вас странное выражение лица, когда вы пытаетесь провести языком по каждому зубу и вести счет.
Еще сложнее – сколько у тебя ресниц?
Невозможно сосчитать?
А вот эти:
- Сколько у тебя волос?
- Подсчитайте, сколько крупинок соли вы добавили в свой обед?
- Сколько капель воды вы выпиваете в день?
У нас закончились номера!
Рано или поздно числа становятся настолько большими, что вы не можете начать их считать. Есть несколько трюков, которые мы могли бы сделать — мы могли бы сказать, сколько граммов соли вы добавили в свой ужин или сколько стаканов воды вы выпиваете в день? Измерение вещей в правильных единицах помогает сделать эти вещи возможными. Некоторые приемы очень эффективны для измерения – отрежьте все волосы и посмотрите, сколько мешков они заполняют, – но они могут быть совершенно непрактичными!
Вернемся к атомам в нашей чашке чая
Как это оставляет нас с вопросом сколько атомов в моей чашке чая ? up…
Начнем с отдельных компонентов. Мы не можем просто сосчитать атомы, потому что они настолько крошечные, что мы не можем их увидеть — даже в самые мощные микроскопы, использующие свет, , потому что свет, используемый микроскопами, буквально больше, чем атомы… Было бы намного проще, если бы мы могли просто брать атомы и считать их, не так ли? На самом деле, некоторые ученые могут собирать отдельные атомы с помощью специальных «пинцетов», сделанных из света, но это совсем другая история!
Мы не можем просто сосчитать атомы, потому что они настолько крошечные, что мы не можем их увидеть — даже в самые мощные микроскопы, использующие свет, , потому что свет, используемый микроскопами, буквально больше, чем атомы… Было бы намного проще, если бы мы могли просто брать атомы и считать их, не так ли? На самом деле, некоторые ученые могут собирать отдельные атомы с помощью специальных «пинцетов», сделанных из света, но это совсем другая история!
Давайте начнем с некоторых хитростей
Если мы не можем сосчитать атомы, давайте взвесим воду, которую мы наливаем в нашу чашку чая – я использовал 329 г воды или 0,329 кг. Так сколько же весит одна молекула воды?
Мы рассчитаем вес одной молекулы воды и используем его, а также общий вес воды в чашке, чтобы определить, сколько молекул воды содержится в нашей чашке чая. Если вы не помешаны на числах, пропустите пару абзацев вперед и предположите, что число смехотворно велико, хорошо?
Для начала мы можем посмотреть структуру воды — это H 2 O. У нас есть молекула, состоящая из трех атомов.
У нас есть молекула, состоящая из трех атомов.
Мы можем узнать числа рядом с Н и О в их ячейках в таблице Менделеева — спасибо Менделеев! Возможно, вы помните его по публикациям в Periodic Drama!
В периодической таблице указано количество протонов, электронов и нейтронов в каждом атоме H (1 протон, 1 электрон) и O (8 протонов, 8 электронов и 8 нейтронов).
Время подсчитать некоторые цифры
Затем мы можем найти вес протона (1,672 × 10 -27 кг), электрона (9,109 × 10 -31 ) и нейтрона (1,674 × 10 -27 кг), поэтому мы можно вставить это в калькулятор и получить массу молекулы воды, которая, как мы говорили, будет такой простой… 3,01 × 10 -26 кг [1].
Итак, это 0,00000000000000000000000000301 кг. 25 нулей. Это действительно глупая цифра.
Вернемся к подсчету атомов в нашей чашке чая
Но сколько у нас молекул воды? Назад к 329г воды у нас было в чашке. 0,329 кг / 3,01 × 10 -26 кг на молекулу воды дает нам легко считать 10
000000000000000000000 Молекулы воды .
 .. но, так как мы хотели, чтобы атомы, так что, чтобы получить 32700000000000000000.
.. но, так как мы хотели, чтобы атомы, так что, чтобы получить 32700000000000000000., я был на 32700000000000000000.
Я был в шутку, когда я сказал, что он будет быть простым…
Проблема очевидна. Эти цифры смешны! Это та же проблема, что и раньше, с попыткой подсчитать количество капель воды, которые вы выпиваете в день, — просто есть лучшие единицы измерения, которые мы могли бы использовать для этого.
Единицы чая в единстве
Возьмем в качестве примера чай в вашей чашке. Как узнать, сколько чая использовать в каждой чашке?
Это просто, потому что чай находится в пакетиках, и в каждом из них есть нужная порция. Вам нужен 1 чайный пакетик на чашку для хорошей чашки чая! Вот наша единица – чайные пакетики на чашку.
Конечно, если вам нужна действительно крепкая чашка, вы можете приготовить 2 пакетика на чашку, а если вы не очень любите чай или ваши друзья, вы можете приготовить две чашки из одного чайного пакетика (полпакетика на чашку).
Какая здесь альтернатива? Вы можете пересчитать каждую высушенную шелуху чайного листа и в итоге получить число в сотнях и получить «631 чайное зерно» на чашку.
Вы могли бы попытаться вернуться к растению, из которого оно происходит, и посчитать, сколько листьев составляет ваша чашка…
Видите, насколько лучше единицы делают вещи? На самом деле, есть даже стандартная чашка чая, приготовленная путем помещения 2,0 грамма чая в 100 мл воды при 100 ° C на 6 минут.
Итак, для чая все просто, в основе лежит чайный пакетик, который является удобным способом получить нужное количество чая, чтобы сделать что-то полезное. Как вы думаете, с какой единицей можно работать, чтобы сделать наши 10
0000000000000000000 молекул воды более управляемы?
Химики пьют чай молари
К счастью, у химиков есть способ превратить эти нелепые цифры в то, что мы можем посчитать, увидеть и использовать. Есть число, называемое числом Авагадро, и это огромное число. Это 6,022 × 10 23 или 602200000000000000000000 (или около того). Это число особенное, потому что оно берет числа из периодической таблицы и связывает их с весами, которые мы можем себе представить!
Это 6,022 × 10 23 или 602200000000000000000000 (или около того). Это число особенное, потому что оно берет числа из периодической таблицы и связывает их с весами, которые мы можем себе представить!
Водород в периодической таблице имеет массовое число 1. Если бы мы взяли количество атомов водорода по Аваградро — то есть 6022000000000000000000000 атомов — у нас был бы почти ровно 1 грамм водорода.
Если бы у нас было число атомов кислорода Авагадро – массовое число – 16 – вся связка вместе весила бы 16 граммов! Теперь мы говорим. Мы можем взвесить граммы и понять, как это может выглядеть.
Молекулярная масса, проблемы с кротами
Сколько будут весить 60220000000000000000000000000 молекул воды? Поскольку в каждой молекуле воды (молекулярная масса = 2 × 1 + 16 = 18) есть 2 атома водорода (массовое число = 1) и один атом кислорода (массовое число = 16) (молекулярная масса = 2 × 1 + 16 = 18), при добавлении все эти молекулы. 18 граммов воды — это что-то среднее между большим глотком и маленьким глотком.
Мои пальцы, моя клавиатура, и вы, вероятно, ненавидите меня за то, что я так много раз набирал это глупо длинное число, и это не помогло бы нам упростить вещи, если бы нам приходилось продолжать вводить это число, не так ли? Для простоты мы называем это число «кротом» .
Если бы мы сказали, что у нас есть моль атомов водорода – 1 грамм. Моль атомов кислорода – 16 грамм. Моль воды – 18 грамм. Это все числа, которые мы можем сосчитать и понять, а также веса, которые мы действительно можем измерить.
Какой ответ – сколько атомов в моей чашке чая?
Когда мы говорим о том, сколько весит молекула или атом, мы не говорим о массе в килограммах. Как мы видели, это число невероятно маленькое! Вместо этого мы используем массу одного моля молекул или атомов, чтобы сделать его весом, который мы можем измерить. Атомная масса дается в граммах на моль — если у вас есть моль этих атомов, сколько у вас граммов этого вещества? То же самое и для молекул — молекулярная масса указана в граммах на моль.
В нашей чашке чая, в которой, как мы сказали, было глупое количество молекул воды, на самом деле содержится 18,28 молей молекул (329 граммов, разделенных на 18 граммов на моль). Гораздо проще сказать 18 молей, чем 11 септиллионов атомов!
Вот ваш ответ — вы можете рассказать кому-нибудь обо всем этом, когда в следующий раз заварите чашку чая. Включая считывание количества атомов….
[1] Здесь мы немного упростили, потому что, как это всегда бывает с наукой, мы что-то упустили. Масса протонов, нейтронов и электронов не совсем складывается, чтобы составить массу атома, потому что, когда все эти частицы собираются вместе, они высвобождают энергию, а это эквивалентно крошечной частичке массы. Мы можем связать массу и энергию, используя знаменитое уравнение Эйнштейна E = mc 2 ВЕРНУТЬСЯ К СООБЩЕНИЮ
Нравится:
Нравится Загрузка…
Сколько атомов и молекул в капле воды? ~ БЗУ НАУКА
Сколько атомов и молекул в капле воды?
Вода – это
важным компонентом в нашей повседневной жизни, потому что мы должны использовать его для различных
целей. При использовании воды вам придется столкнуться с каплями
вода. Теперь мой вопрос: «Задумывались ли вы когда-нибудь, сколько атомов и молекул содержится в капле воды?» ’. Если
вы когда-нибудь думали об этом, вы должны сказать мне первый ответ, который приходит на ум
ваше мнение в поле для комментариев. Теперь мы пытаемся получить возможный ответ на этот
вопрос. Чтобы получить возможный ответ на этот вопрос, мы должны сделать простой
расчет хим. Перед выполнением этого расчета необходимо также
нам, чтобы получить представление о капле воды, потому что у разных людей есть
различные капли воды. По мнению медицинского и научного сообщества,
средний объем капли воды составляет почти 0,05 мл.
При использовании воды вам придется столкнуться с каплями
вода. Теперь мой вопрос: «Задумывались ли вы когда-нибудь, сколько атомов и молекул содержится в капле воды?» ’. Если
вы когда-нибудь думали об этом, вы должны сказать мне первый ответ, который приходит на ум
ваше мнение в поле для комментариев. Теперь мы пытаемся получить возможный ответ на этот
вопрос. Чтобы получить возможный ответ на этот вопрос, мы должны сделать простой
расчет хим. Перед выполнением этого расчета необходимо также
нам, чтобы получить представление о капле воды, потому что у разных людей есть
различные капли воды. По мнению медицинского и научного сообщества,
средний объем капли воды составляет почти 0,05 мл.
После
получив представление о среднем объеме капли воды, мы должны получить
представление о химической формуле воды. Как мы знаем, h3O
химическая формула воды. Если мы рассмотрим химическую формулу
воды, мы узнаем, что есть два атома водорода и один атом кислорода
атома в каждой молекуле воды. Следовательно, общее число атомов в воде
молекула три.
Следовательно, общее число атомов в воде
молекула три.
Для расчета количество атомов в одной капле воды, нам также необходимо получить представление о молярной массе воды. Мы можем легко найти моляр массу воды, выполнив следующие простые шаги;
· Первый прежде всего, мы должны знать массу одного атома водорода из таблицы Менделеева. масса одного атома водорода 1,008 г/моль.
· В аналогичным образом, мы должны знать массу одного атома кислорода из периодического стол. Масса одного атома кислорода составляет 16,0 г/моль.
· Сейчас, мы должны вычислить общую массу одной молекулы воды. Чтобы рассчитать общую масса одной молекулы воды, мы должны сделать следующий расчет;
Масса кислорода + 2 (масса водорода)
· После делая этот расчет, мы получаем новое значение, которое говорит нам об общей массе воды и составляет 18,016 г/моль.
Вы также можете люблю читать: Как сбалансировать химические уравнения?
Вместе с
получить представление о химической формуле воды и молярной массе воды, это
также необходимо нам знать о плотности воды. Плотность
воды означает, что мы должны знать массу единицы объема воды.
плотность воды также меняется, потому что плотность холодной воды больше, чем
плотность теплой воды. Во всяком случае, плотность воды, которую мы используем в
по разным расчетам составляет 1 г/мл. Это означает, что если у вас есть один миллилитр
воды, масса этой воды будет равна одному грамму. Как мы знаем, молярная масса
одна капля воды составляет 0,05 г/мл, значит, масса одной капли
вода равна 0,05 гр. Теперь нам легко получить представление об общем
числа молей в одной капле воды, используя следующий расчет; 921 атом в одной капле
воды. Следовательно, мы также можем сказать, что в атоме содержится 5 секстиллионов атомов.
одна капля воды.
Плотность
воды означает, что мы должны знать массу единицы объема воды.
плотность воды также меняется, потому что плотность холодной воды больше, чем
плотность теплой воды. Во всяком случае, плотность воды, которую мы используем в
по разным расчетам составляет 1 г/мл. Это означает, что если у вас есть один миллилитр
воды, масса этой воды будет равна одному грамму. Как мы знаем, молярная масса
одна капля воды составляет 0,05 г/мл, значит, масса одной капли
вода равна 0,05 гр. Теперь нам легко получить представление об общем
числа молей в одной капле воды, используя следующий расчет; 921 атом в одной капле
воды. Следовательно, мы также можем сказать, что в атоме содержится 5 секстиллионов атомов.
одна капля воды.
Мы можем легко завершить эту статью в этих пунктах;
·
объем одной капли воды 0,05мл.
·
Итого
число атомов в одной молекуле воды равно 3.
·
общая масса молекулы воды составляет 18,016 г/моль.
·
плотность молекулы воды 1 г/мл. 921.
CHEM 245 — Вода
ТЕМЫ БИОХИМИИ
Вода
Вода 101. Дальнейшие последствия использования воды как биологического растворителя.
Вода (H 2 O) — знакомое, но увлекательное вещество.
Это дает нам возможность рассмотреть свойства трех фаз материи —
газообразная, жидкая и твердая фазы — на знакомом и важном примере.
Вода является одновременно кислотой и основанием, и является эффективным катализатором реакций переноса протона.
Вода играет центральную роль в жизни и биохимических процессах, происходящих в живых организмах.
Поскольку большая часть земной поверхности покрыта водой, ее свойства оказывают огромное влияние. на планетарную среду, позволяющую и поддерживающую развитие биосферы.
на планетарную среду, позволяющую и поддерживающую развитие биосферы.
Структура молекулы воды
Для начала давайте создадим структуру Льюиса для молекулы воды на основе ее молекулярного формула, H 2 O. Символы Льюиса для элементов показаны на панели (а) ниже: кислород имеет шесть валентных электронов, а водород только один.
На панели (b) показано, как соединить три атома вместе, чтобы сформировать полный октет для центрального
атом кислорода. Водород, как элемент с периодом 1, может разместить только два электрона в своей валентности.
оболочки и образует только одну связь. На панели (c) мы применили условное обозначение, согласно которому два общих электрона, образующих химическую связь между атомами, могут быть представлены линией. Имея действительную структуру Льюиса, мы можем сделать вывод о молекулярной геометрии молекулы воды. Октет центрального кислорода можно рассматривать как состоящий из четырех электронных доменов, двух связывающих пар и двух несвязывающих «одиноких пар». Применение теории VSEPR к этой конфигурации приводит к выводу, что эти четыре электронных домена — в первом приближении — расположены вокруг центрального кислорода в виде тетраэдра. Основной вывод, который из этого следует, заключается в том, что расположение атомов в молекуле H-O-H не прямолинейное, а изогнутое, при этом валентный угол должен быть близок к тетраэдрическому значению, 1090,5°. Поскольку неподеленные пары распределяют отрицательный заряд по большему объему, чем связывающие пары, электростатическое отталкивание сближает связующие пары, поэтому фактический угол связи должен быть немного меньше 109,5 °. Как мы покажем ниже, мы также можем использовать структуру Льюиса, чтобы проанализировать, имеет ли молекула воды полярность.
Применение теории VSEPR к этой конфигурации приводит к выводу, что эти четыре электронных домена — в первом приближении — расположены вокруг центрального кислорода в виде тетраэдра. Основной вывод, который из этого следует, заключается в том, что расположение атомов в молекуле H-O-H не прямолинейное, а изогнутое, при этом валентный угол должен быть близок к тетраэдрическому значению, 1090,5°. Поскольку неподеленные пары распределяют отрицательный заряд по большему объему, чем связывающие пары, электростатическое отталкивание сближает связующие пары, поэтому фактический угол связи должен быть немного меньше 109,5 °. Как мы покажем ниже, мы также можем использовать структуру Льюиса, чтобы проанализировать, имеет ли молекула воды полярность.
То, что мы называем «формой молекулы», — это то, что мы видим, когда смотрим только на атомы, составляющие молекулу. Экспериментальные методы, такие как рентгеновская кристаллография, которые могут определить положение атомов в молекулах, позволяют определить форму молекулы воды. На приведенных ниже диаграммах представлена экспериментально определенная молекулярная форма.
На приведенных ниже диаграммах представлена экспериментально определенная молекулярная форма.
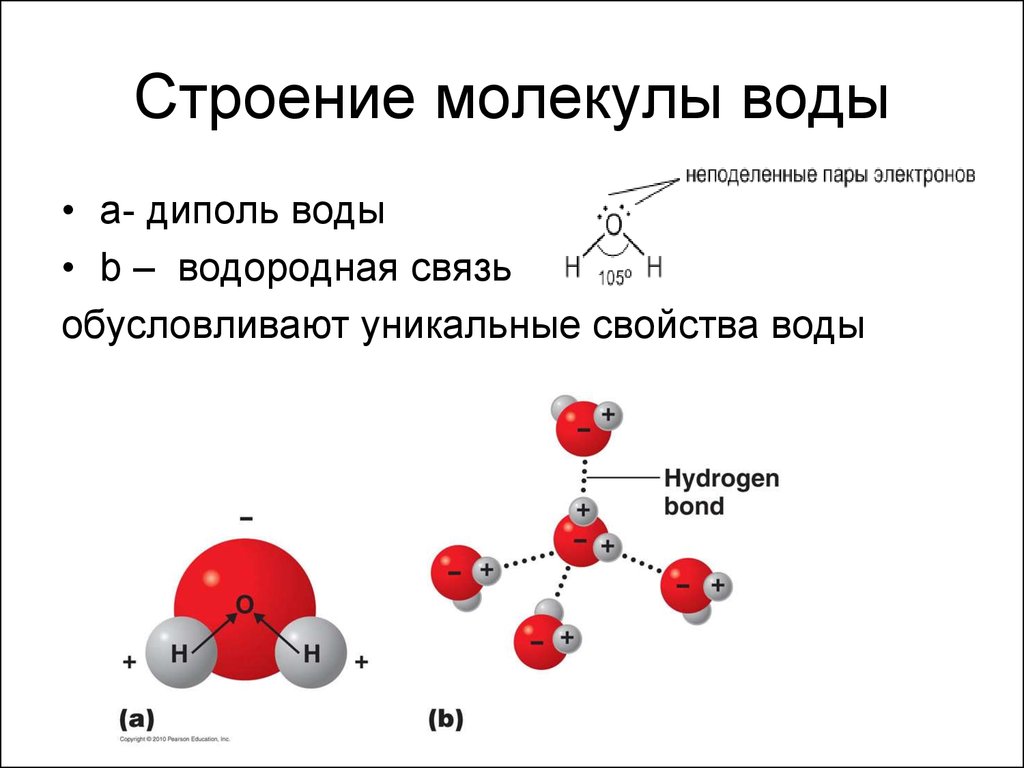
В соответствии с нашим анализом с использованием формализма Льюиса, вода имеет угловатую или изогнутую форму с валентным углом HOH, равным 104,5 °. Это согласуется с примерно тетраэдрической ориентацией четырех электронных доменов вокруг центрального кислорода, двух связывающих пар и двух несвязывающих «неподвижных пар».
Длина связи Н-О составляет 0,958 Å (1 Å = 10 -10 м). Поскольку кислород значительно более электроотрицательный, чем водород, большая часть отрицательного заряда электронов в связывающей паре сосредоточена вблизи кислорода. Это небольшое разделение зарядов вдоль оси отдельной связи (обозначаемое обозначением δ) создает связь диполь . Диполи связи можно рассматривать как векторов и суммировать, чтобы получить другой вектор, молекулярный дипольный момент .
Выше : два изображения молекулярной формы молекулы воды: шарообразная (вверху) и заполняющая пространство (внизу). Кислород — это центральный атом, показанный красным цветом, а атомы водорода — светло-серым.
Кислород — это центральный атом, показанный красным цветом, а атомы водорода — светло-серым.
Если молекула имеет ненулевой дипольный момент. говорят, что это полярный или иметь полярность . Для геометрии молекулы воды компоненты диполя связи, параллельные линии, разделяющей пополам угол связи HO (пунктирная вертикальная линия на рисунке), складываются вместе, а перпендикулярные (горизонтальные) компоненты компенсируются. Это приводит к тому, что чистый дипольный момент выровнен с биссектрисой валентного угла с отрицательным концом, направленным вверх (стрелка на правой панели выше). Таким образом, молекула воды обладает значительным дипольным моментом, который можно смоделировать как вертикально ориентированное частичное разделение зарядов (обозначено на рисунке знаком ξ). Другими словами, молекула воды полярна.
Если показать на этом изображении, неподеленные пары будут выступать вверх от кислорода.
вперед из плоскости и назад за плоскость рисунка (см. следующий рисунок ниже).
следующий рисунок ниже).
Свойства воды
Наше рассмотрение свойств воды может служить парадигмой для достижения одной из самых фундаментальных целей изучения химии. То есть ответить на вопрос: как наноразмерные молекулярные свойства воды объясняют свойства, которые мы наблюдаем у вещества в целом, в макроскопическом масштабе? Чтобы ответить на этот вопрос, мы воспользуемся «расширенной» версией структуры Льюиса для молекулы воды, показанной ниже справа.
Учитывая структурную интерпретацию молекулы воды, что межмолекулярных сил могли бы мы предсказать, что они будут играть важную роль в определении
его объемные свойства?
Диаграмма справа показывает геометрию молекулы воды, полярность ее связей,
молекулярный дипольный момент и ориентация неподеленных пар.
Вода не только полярная молекула, но и может образовывать межмолекулярные соединения. водородные связи (Н-связи).
Относительно сильные межмолекулярные силы, возникающие в результате диполь-дипольных взаимодействий и взаимодействий Н-связей. учитывать такие свойства, как высокая температура кипения для небольшой молекулы,
высокая энтальпия парообразования , большая теплоемкость ,
способность растворять полярные и многие ионные соединения.
учитывать такие свойства, как высокая температура кипения для небольшой молекулы,
высокая энтальпия парообразования , большая теплоемкость ,
способность растворять полярные и многие ионные соединения.
Фактически, вода является образцом в мире молекул с водородными связями. Каждая молекула воды имеет две неподеленные пары, которые служат акцепторами водородных связей, а две связи OH обеспечивают пару доноров водородных связей. На рисунке слева изображена одна Н-связь между двумя молекулами воды. Крайняя левая молекула воды является донором водородной связи, а молекула воды справа является акцептором водородной связи.
Структура льда
Структура льда показывает способность молекул воды образовывать межмолекулярные водородные связи или Н-связи (обозначены пунктирными линиями на рисунке справа) в ее максимуме. Каждая молекула воды внутри решетки (то есть не на поверхности) образует водородные связи с четырьмя соседями, принимая двух доноров водородных связей у своего центрального атома кислорода и отдавая две водородные связи через два своих атома водорода. Таким образом, каждая внутренняя вода полностью связана водородными связями, а общая структура образует трехмерную гексагональную решетку молекул воды. Обширные водородные связи придают прочность ледяной решетке, но в то же время дают относительно открытую структуру. Это объясняет тот факт, что при температуре плавления или около нее жидкая вода имеет большую плотность, чем лед. Когда структура льда тает, некоторые водородные связи разрываются, и менее жестко связанные молекулы воды могут приблизиться друг к другу в среднем немного ближе.
Таким образом, каждая внутренняя вода полностью связана водородными связями, а общая структура образует трехмерную гексагональную решетку молекул воды. Обширные водородные связи придают прочность ледяной решетке, но в то же время дают относительно открытую структуру. Это объясняет тот факт, что при температуре плавления или около нее жидкая вода имеет большую плотность, чем лед. Когда структура льда тает, некоторые водородные связи разрываются, и менее жестко связанные молекулы воды могут приблизиться друг к другу в среднем немного ближе.
Вода как растворитель
Способность воды действовать как растворитель связана с полярностью молекулы воды, а также с ее способностью образовывать водородные связи с растворенными веществами. Как мы видели, молекула воды полярна, и ее дипольный момент можно представить в виде вектора, делящего пополам валентный угол H-O-H. Дипольный момент молекулы действует аналогично стержневому магниту в магнитном поле. Отрицательный конец диполя будет иметь тенденцию ориентироваться на положительно заряженные частицы, в то время как наличие отрицательного заряда будет притягивать положительный конец диполя. Таким образом, выравнивание диполя с локальным электрическим полем снижает электростатическую потенциальную энергию, что делает выравнивание предпочтительным.
Таким образом, выравнивание диполя с локальным электрическим полем снижает электростатическую потенциальную энергию, что делает выравнивание предпочтительным.
На рисунке справа показано, как это работает для ионов, образующихся в результате растворения хлорида натрия (NaCl) в воде. При растворении ионы, составляющие соль, диссоциируют от твердой кристаллической решетки. Благоприятные электростатические взаимодействия ионных связей решетки теряются, повышая потенциальную энергию, но диполь-ионные взаимодействия помогают компенсировать это. Молекулы воды вблизи ионов ориентируют свои дипольные моменты в соответствии с зарядами ионов — положительные концы их диполей в сторону хлорид-аниона; отрицательные концы диполя молекулы воды направлены в сторону катионов натрия. Это называется гидратация или вода , а вовлеченные молекулы воды называются водой гидратации (или аквацией).
Растворимость данного ионного соединения в воде в значительной степени определяется
энергетический баланс между ионными связями в твердом состоянии
(плюс водородные связи между молекулами воды в жидком состоянии) по сравнению с ионно-дипольными взаимодействиями
между растворенными и растворяющими веществами в растворе. Мы знаем, что не все ионогенные соединения свободно растворимы в воде.
и мы можем полагаться на эмпирические правила разрешимости чтобы помочь нам ответить на вопрос, растворимо ли данное ионное соединение в воде. Но приведенные выше соображения об энергетике ионных связывающих и несвязывающих взаимодействий во многом определяют правила растворимости. Кроме того, по сравнению с менее полярным растворителем (таким как метанол) или растворителем, не обладающим плаарной активностью (таким как гексан или бензол), вода является гораздо более эффективным растворителем для ионных соединений. Неполярные или слабополярные растворители далеко не так эффективны при сольватации диссоциированных ионов, как вода, поэтому нам не нужны правила растворимости ионных соединений в таких растворителях — мы бы однозначно предсказывали, что ионные соединения нерастворимы в неполярных растворителях.
Мы знаем, что не все ионогенные соединения свободно растворимы в воде.
и мы можем полагаться на эмпирические правила разрешимости чтобы помочь нам ответить на вопрос, растворимо ли данное ионное соединение в воде. Но приведенные выше соображения об энергетике ионных связывающих и несвязывающих взаимодействий во многом определяют правила растворимости. Кроме того, по сравнению с менее полярным растворителем (таким как метанол) или растворителем, не обладающим плаарной активностью (таким как гексан или бензол), вода является гораздо более эффективным растворителем для ионных соединений. Неполярные или слабополярные растворители далеко не так эффективны при сольватации диссоциированных ионов, как вода, поэтому нам не нужны правила растворимости ионных соединений в таких растворителях — мы бы однозначно предсказывали, что ионные соединения нерастворимы в неполярных растворителях.
Для молекулярных соединений вода обычно является отличным растворителем для соединений с полярными молекулами. и тем более для полярных молекул, способных образовывать Н-связи с молекулами воды.
и тем более для полярных молекул, способных образовывать Н-связи с молекулами воды.
Вода и жизнь
Хотя они достаточно сложны и неоднородны по строению и составу, живые клетки в значительной степени представляют собой водные системы. Тот факт, что вода в основном является жидкостью в широком диапазоне температур, характерных для земной поверхности, и ее способность растворять самые разнообразные соединения, делает возможным существование таких сложных систем. Воду по праву можно назвать растворителем жизни. Конечно, если мы хотим понять биологическую химию, нам следует тщательно изучить свойства воды.
В связи с этим часто упоминается необычное свойство воды образовывать твердое тело с меньшей плотностью, чем в жидком состоянии. Относительно открытая структура льда максимизирует способность водородных связей составляющих его молекул воды, что делает эту открытую структуру энергетически выгодной. Когда лед тает, часть водородных связей разрывается, что позволяет молекулам воды в среднем приближаться друг к другу немного ближе. Таким образом, жидкая вода, находящаяся в равновесии со льдом при 0°С, более плотна, чем лед, который плавает. Вода имеет максимальную плотность в жидком состоянии при температуре 4°C. Это имеет огромные последствия для биосферы Земли. Озера и океаны замерзали бы снизу вверх, если бы лед был плотнее воды. Это привело бы к тому, что большая часть воды на Земле оказалась бы запертой в виде льда.
Таким образом, жидкая вода, находящаяся в равновесии со льдом при 0°С, более плотна, чем лед, который плавает. Вода имеет максимальную плотность в жидком состоянии при температуре 4°C. Это имеет огромные последствия для биосферы Земли. Озера и океаны замерзали бы снизу вверх, если бы лед был плотнее воды. Это привело бы к тому, что большая часть воды на Земле оказалась бы запертой в виде льда.
Среди химических свойств воды следует особо отметить то, что она является одновременно и очень слабой кислотой, и очень слабым основанием, и между молекулами воды происходят реакции переноса протона
H 2 O( l ) + H 2 O( l ) = H 3 O + ( aq ) + OH − ( aq ) K w = [ H + ][ OH — ] = 1,0 × 10 −14 (при 25°С).
Это так называемое автоионизация реакция происходит только в очень небольшой степени, о чем свидетельствует небольшая величина K w , но это равновесие составляет основу химии
водных смесей кислых и основных растворенных веществ. Вода действует как растворитель для многих полярных и ионных частиц, которые затем могут реагировать с водой.
как кислота, основание или и то, и другое. Применение химических концепций к таким водным системам,
трактуется в соответствии с формализмом Бренстеда-Лоури, обеспечивает важную основу для
биохимия и физиология. Свойства буферов в водных системах попадают в эту категорию.
Вода действует как растворитель для многих полярных и ионных частиц, которые затем могут реагировать с водой.
как кислота, основание или и то, и другое. Применение химических концепций к таким водным системам,
трактуется в соответствии с формализмом Бренстеда-Лоури, обеспечивает важную основу для
биохимия и физиология. Свойства буферов в водных системах попадают в эту категорию.
Сколько атомов в молекуле воды
от Admin
Содержание
Сколько атомов в молекуле воды?
три атома
Сколько атомов в Н3О?
три атома
В молекуле воды три атома : атом кислорода и два атома водорода, которые связаны вместе, как маленькие магниты.
Сколько атомов в 2 молекулах воды?
Две молекулы воды содержат 4 атома водорода и 2 атома кислорода .
Является ли вода атомом молекулы?
Вода представляет собой молекулу , потому что она содержит молекулярные связи. Вода также является соединением, поскольку состоит из более чем одного элемента (кислорода и водорода). … Этот тип молекулы называется двухатомной молекулой, молекулой, состоящей из двух атомов одного и того же типа.
Вода также является соединением, поскольку состоит из более чем одного элемента (кислорода и водорода). … Этот тип молекулы называется двухатомной молекулой, молекулой, состоящей из двух атомов одного и того же типа.
Как найти количество атомов? 923.
Сколько молекул 3NaCl?
Есть 3NaCl, как указано в вопросе. Это указывает на то, что существует три молекулы NaCl . Теперь в каждой молекуле NaCl два атома. Один атом натрия и один атом хлора.
Сколько атомов в 2 молекулах воды h3O?
Если мы хотим сделать 2 молекулы воды, нам понадобится 4 атома водорода и 2 атома кислорода .
Сколько атомов в молекуле?
две молекулы
группа из двух или более атомов, которые образуют наименьшую идентифицируемую единицу, на которую можно разделить чистое вещество, сохраняя при этом состав и химические свойства этого вещества. 924 атома водорода .
Что такое молекулы воды?
Молекула воды состоит из двух атомов водорода, связанных ковалентными связями с одним и тем же атомом кислорода . Атомы кислорода электроотрицательны и притягивают общие электроны в своих ковалентных связях.
Атомы кислорода электроотрицательны и притягивают общие электроны в своих ковалентных связях.
Сколько молекул воды содержится в 1 г воды?
Ответы (1)
или 1 г воды содержит (6,022 x 10 23 )/ 18 молекул воды и получается число 3,3455 х 10 22 . Таким образом, количество молекул воды, присутствующих в 1 г воды, равно 3,3455 х 10 22 .
Вода мокрая?
Если мы определим «мокрый» как ощущение, которое мы получаем, когда жидкость вступает с нами в контакт, тогда да вода для нас мокрая . Если мы определим «мокрый» как «состоящий из жидкости или влаги», тогда вода определенно будет влажной, потому что она состоит из жидкости, и в этом смысле все жидкости мокрые, потому что все они состоят из жидкостей.
Как найти атомы в молекуле?
Как рассчитать количество атомов в молекуле?
Шаг 1: Найдите молярную массу формулы
- 1 моль атомов Cu = 6,022 × 10 23 атомов Cu.

- 1 моль атомов S = 6,022 × 10 23 атомов S.
- 1 моль Cu 2 молекул S = 6,022 × 10 23 Cu 2 молекул S.
- 1 моль пенсов = 6,022 × 10 23 пенсов.
Сколько молекул воды содержится в 18 граммах воды?
— Мы можем сказать, что 18 граммов воды означают то же, что и 1 моль воды, и в этом NA Avogadro присутствует количество молекул воды, что означает 6,02×1023 молекул .
Сколько молекул в Naci?
Моль NaCl также будет 6,022 x 10 23 молекул NaCl.
Сколько атомов цинка и хлорида в znc12?
1 молекула zncl2 содержит один атом цинка и два атома хлора связанных между собой электростатической силой.
Сколько частиц содержится в 7,5 молях?
Пояснение: А число Авогадро 6,022×1023⋅моль−1 определяет молярное количество…… Таким образом, 7,5×моль×6,022×1023⋅моль−1≅ 4,5×1024 атома серы .
Сколько атомов кислорода содержится в 5h3O?
5h3O= 5 кислород . Итак, у вас есть пять молекул воды с двумя атомами водорода и одним атомом кислорода на молекулу. Химия. Поэтому вы должны либо сделать свой ответ 6,5 в качестве коэффициента, чтобы сбалансировать свой ответ, либо . 923 атома водорода в одном моле воды.
Итак, у вас есть пять молекул воды с двумя атомами водорода и одним атомом кислорода на молекулу. Химия. Поэтому вы должны либо сделать свой ответ 6,5 в качестве коэффициента, чтобы сбалансировать свой ответ, либо . 923 атома водорода в одном моле воды.
Сколько атомов содержится в 3 молях воды?
Рассчитайте количество атомов в граммах в 100 мл ртути. Дано: плотность Hg=13. 6 г·мл–1 и молярная масса Hg=200 г·моль–1.
Сколько молекул воды содержится в 10 молях воды?
= 6,022×1024 отдельных молекул воды.
Все ли молекулы воды одинаковы?
Молекулы одного типа все одинаковые . Например, молекулы воды одинаковы. Все они имеют два атома водорода и один атом кислорода. Атомы должны быть соединены таким образом, чтобы образовалась молекула воды.
Каков размер молекулы воды?
около 0,27 нанометра
Глюкоза имеет молекулярную массу 180. Очень длинная ДНК может иметь молекулярную массу около 1010 (около веса одной человеческой хромосомы).


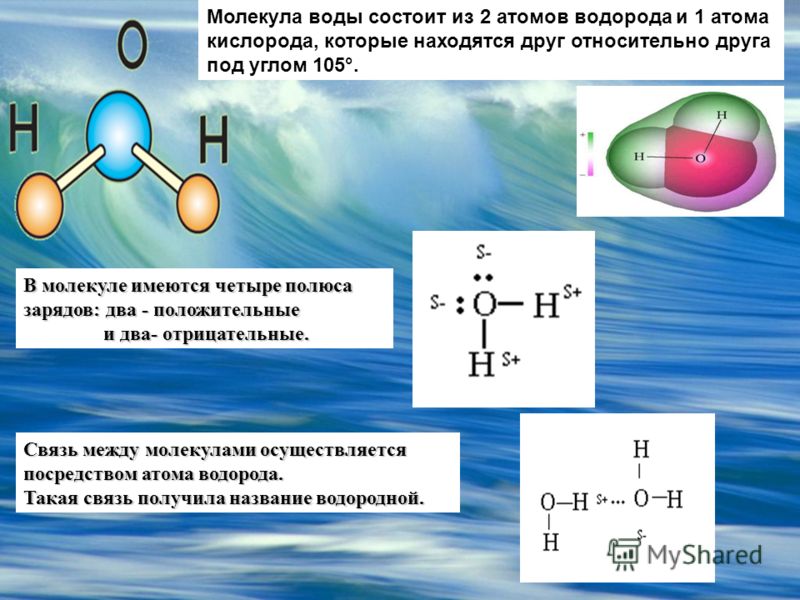
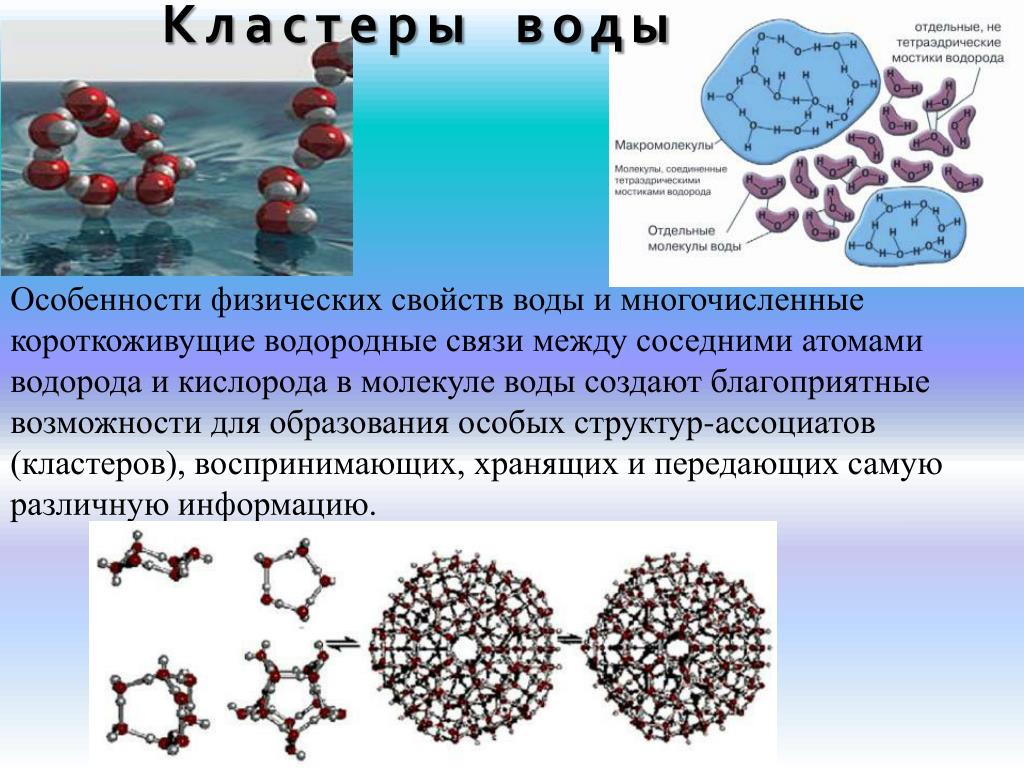
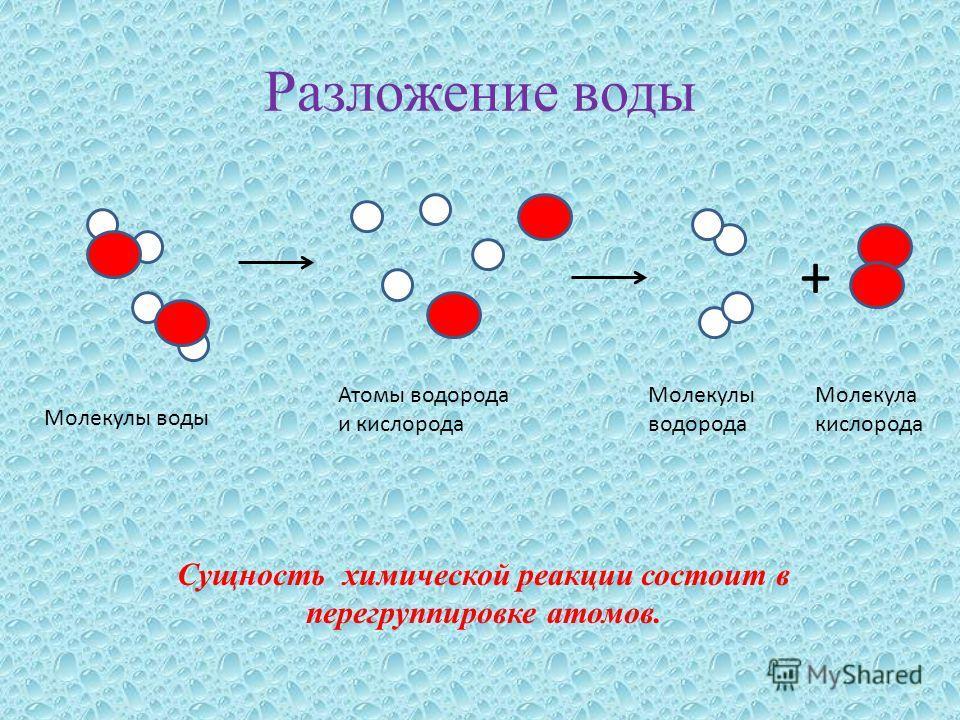

 2)
2)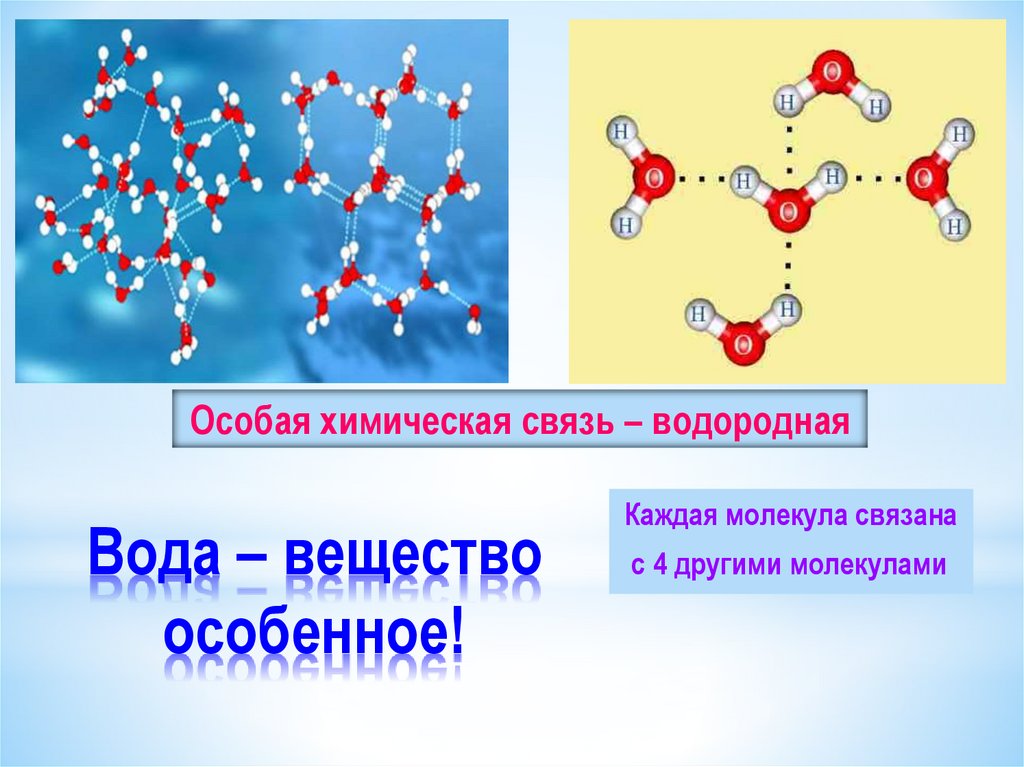 Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан