Химики создали устойчивый к хлоридной коррозии анод для электролиза воды
Ученые из Китая и США создали электрод, покрытый слоями из сульфида никеля и соединения никеля с железом, с высокой эффективностью разложения морской воды и устойчивостью к хлоридной коррозии. Соединив его с катодом, ученые создали устройство для генерации водородного топлива из морской воды, способное работать более тысячи часов. Исследование опубликовано в Proceedings of the National Academy of Sciences.
Водород считается одним из самых перспективных носителей чистой энергии, так как способен запасать ее в малых объемах (142 мегаджоуля на килограмм, почти в три раза больше, чем бензин) и не образует загрязняющих отходов при использовании.
Наиболее эффективным методом получения водородного топлива по сравнению с конверсией природного газа является электролиз воды (разложение под действием электрического тока). Использование пресной воды в качестве сырья нежелательно для этих целей, так как ее на Земле меньше трех процентов, а обессоливание морской воды весьма дорогостоящий процесс. Поэтому инженеры ищут способы получения водорода напрямую из морской воды.
Поэтому инженеры ищут способы получения водорода напрямую из морской воды.
Основная проблема, возникающая при продолжительном электролизе соленой воды, заключается в том, что хлориды, которые в ней содержатся, взаимодействуют с материалом анода. Сначала они адсорбируются на положительно заряженной поверхности электрода, образуя полианионы, затем хлорид заменяется на гидроксид и материал электрода разрушается. Помимо этого, в щелочной среде хлорид окисляется до гипохлорида легче, чем гидроксид-ион до кислорода. Поэтому последнюю реакцию необходимо катализировать, чтобы не расходовать энергию электролиза на побочные процессы.
Юнь Куан (Yun Kuang) с коллегами из Стэнфордского университета создали и протестировали устойчивый к хлоридной коррозии анод, покрытый проводящим слоем сульфида никеля и слоем катализатора из железа и никеля. Небольшую пористую пластинку из никеля (1×3,5 сантиметра) кипятили в растворе серы в толуоле, а на полученный слой сульфида никеля (NiSx) путем электрохимического восстановления нанесли каталитический слой интерметаллического соединения железа с никелем (FeNi). Для того, чтобы проверить элеткролитические способности анода, ученые соединили двуслойный анод с катодом и провели электролиз модельных щелочных растворов хлорида натрия и морской воды из залива Сан-Франциско.
Для того, чтобы проверить элеткролитические способности анода, ученые соединили двуслойный анод с катодом и провели электролиз модельных щелочных растворов хлорида натрия и морской воды из залива Сан-Франциско.
Исследователи учли и тот факт, что по мере прохождения электролиза концентрация соли будет увеличиваться, и протестировали систему на растворах с бóльшим содержанием хлорида натрия, чем в морской воде, а также в промышленных условиях (сильнощелочной среде и повышенных температурах). В паре с никелевым катодом, покрытым оксидами никеля и хрома, анод функционировал без видимых разрушений более тысячи часов.
Проанализировав газы после электролиза, авторы исследования не обнаружили следов хлора, что свидетельствует о том, что анод селективно окислял только кислород. Проводящий сульфидный слой обеспечивал наличие анионных групп, которые, как предполагают химики, отталкивали хлорид-ионы, не позволяя им сорбироваться на материале анода и разрушать его. Чистые никелевые пористые пластинки или пластинки только с сульфидным слоем функционировали меньше 20 минут, а никелевый анод, покрытый интерметаллидом железа с никелем продержался 12 часов.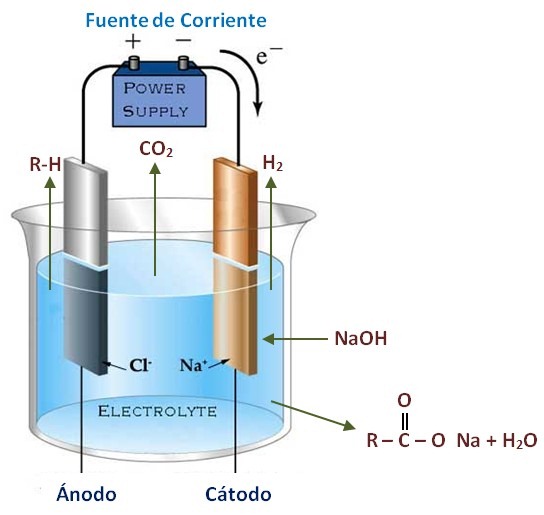 Эти эксперименты демонстрируют ключевую роль наличия обоих слоев (NiSx и FeNi) для того, чтобы анод долгое время не подвергался коррозии.
Эти эксперименты демонстрируют ключевую роль наличия обоих слоев (NiSx и FeNi) для того, чтобы анод долгое время не подвергался коррозии.
Для стабильной работы такой электролитической ячейки в морской воде с плотностью тока 800 миллиампер на квадратный сантиметр оказалось достаточно наложить напряжение в два-три вольта. Такое значение разности потенциалов смогла обеспечить относительно небольшая панель солнечной батареи.
Ранее уже создавали устройства для электролиза, которые работают на энергии солнца. Американские ученые предложили автоматизировать процесс электролиза воды и создали плавучую электролитическую ячейку для генерации водородного топлива со встроенной солнечной батареей.
Алина Кротова
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Ученые сделали катализатор для водородной энергетики устойчивее к высоким температурам
3 февраля, 2023 12:51
Источник: Пресс-служба РНФ
Химики усовершенствовали гибридные слоистые соединения дисульфида молибдена — перспективные катализаторы для производства водорода. Исследования показали, что в них каталитически активная форма дисульфида молибдена стала гораздо устойчивее и сохраняет свойства при повышенной температуре. Это поможет улучшить эффективность выделения водорода из воды и будет способствовать продвижению водородной энергетики. Результаты исследования, поддержанного грантом Российского научного фонда (РНФ), опубликованы в International Journal of Hydrogen Energy.
Исследования показали, что в них каталитически активная форма дисульфида молибдена стала гораздо устойчивее и сохраняет свойства при повышенной температуре. Это поможет улучшить эффективность выделения водорода из воды и будет способствовать продвижению водородной энергетики. Результаты исследования, поддержанного грантом Российского научного фонда (РНФ), опубликованы в International Journal of Hydrogen Energy.
Водород — это возобновляемый и чистый источник энергии, который рассматривают как основу перспективных технологических процессов. Наиболее экологичный способ его получения, не вызывающий выделения углекислого газа в атмосферу, — электролиз, то есть разложение молекул воды под действием электрического тока. Для его проведения требуются электрокатализаторы, значительно ускоряющие химические процессы. Лучший из них — достаточно дорогая металлическая платина. В настоящее время в мире идет интенсивный поиск более дешевых альтернатив, и один из самых активных и доступных материалов — дисульфид молибдена MoS2, однако высокую каталитическую активность проявляет только одна из его структурных модификаций. Проблема в том, что даже при нагреве до 80°С, практически неизбежном в промышленных условиях, она переходит в малоактивную. Поэтому ученые ищут способы повышения устойчивости активной формы дисульфида молибдена для улучшения его каталитических свойств.
Лучший из них — достаточно дорогая металлическая платина. В настоящее время в мире идет интенсивный поиск более дешевых альтернатив, и один из самых активных и доступных материалов — дисульфид молибдена MoS2, однако высокую каталитическую активность проявляет только одна из его структурных модификаций. Проблема в том, что даже при нагреве до 80°С, практически неизбежном в промышленных условиях, она переходит в малоактивную. Поэтому ученые ищут способы повышения устойчивости активной формы дисульфида молибдена для улучшения его каталитических свойств.
Ученые из Института элементоорганических соединений имени А. Н. Несмеянова Российской академии наук (Москва) совместно с коллегами из Новосибирского государственного университета и Института катализа имени Г. К. Борескова Сибирского отделения Российской академии наук (Новосибирск) приблизились к решению проблемы и показали, что можно существенно увеличить устойчивость нужной структурной модификации, обеспечив присутствие на монослоях материала отрицательного заряда.
Процесс получения катализатора. Источник: Goloveshkin et al. / Int. J.
Эксперименты продемонстрировали, что встроенные органические прослойки обеспечивали длительную активность катализатора за счет сохранения нужной структуры. Испытание образцов катализаторов показало почти неизменную активность при разложении воды как минимум в течение 1000 циклов при непрерывной работе. Некоторые образцы были устойчивы даже при температурах 150-200°С. Исследование позволит улучшить эффективность катализа получения водорода.
«Мы надеемся, что данные, полученные в этом исследовании, помогут найти новый подход к дизайну катализаторов на основе MoS2 для производства водорода без выброса углекислого газа», — рассказывает руководитель проекта, поддержанного грантом РНФ, Александр Голубь, кандидат химических наук, старший научный сотрудник лаборатории рентгеноструктурных исследований ИНЭОС РАН.
Если вы хотите стать героем публикации и рассказать о своем исследовании, заполните форму на сайте РНФ
Теги
Пресс-релизы
Electrolysis of Water: Definition and Equation
- Equation
- Alkaline Water Electrolysis
- FAQs
The process of decomposing water (H 2 O) into hydrogen (H + ) and hydroxide (OH – ) ионов при пропускании через них электрического тока называется электролизом. Ионы движутся к противоположным электродам, высвобождая чистый водород (H 2 ) и кислород (O 2 ). Это несамопроизвольная окислительно-восстановительная (окислительно-восстановительная) реакция. Поскольку тепло в виде электричества поступает в электролизер, это эндотермическая реакция [1-4] .
Ионы движутся к противоположным электродам, высвобождая чистый водород (H 2 ) и кислород (O 2 ). Это несамопроизвольная окислительно-восстановительная (окислительно-восстановительная) реакция. Поскольку тепло в виде электричества поступает в электролизер, это эндотермическая реакция [1-4] .
Чистая вода не проводит электричество и требует избыточной энергии для преодоления барьера активации. Поэтому электролиз проводят в присутствии кислоты для улучшения электропроводности за счет увеличения концентрации ионов водорода (H + ). Такими электролитами являются серная кислота (H 2 SO 4 ) и нитрат натрия (NaNO 3 ).
Уравнение
Электролиз происходит в электролитической ячейке, состоящей из положительно заряженного анода и отрицательно заряженного катода, обычно из платины. Химическую реакцию электролиза воды можно разделить на две полуреакции, происходящие на катоде и аноде 9.0013 [1,2] .
Реакция восстановления происходит на катоде, когда ионы водорода приобретают электроны и превращаются в газообразный водород. Полуреакция выглядит следующим образом:
2 H + (водн.) + 2 e – → H 2 (г)
Реакция окисления происходит, когда молекулы воды отдают электроны аноду и выделяют кислород газа на аноде. Половина реакции показана ниже.
2 H 2 O (л) → O 2 (g) + 4 H + (водн.) + 4 e –
Суммарная химическая реакция:
Таким образом, реакция электролиза воды показывает выделение водорода и кислорода из воды. На два моля воды выделяется два моля водорода и один моль кислорода. Количество образующихся молей водорода в два раза превышает количество кислорода. Также заряды передаются между электродами и электролитом. На каждый моль водорода с катода в электролит переносится 2 электрона. На каждый моль кислорода из электролита на анод переносится 4 электрона.
Электролиз водыЭлектролиз щелочной воды
Электролиз воды можно также проводить в щелочной среде. В этом случае полуреакции следующие [5]:
В этом случае полуреакции следующие [5]:
Катод (восстановление): 2 H 2 O (ж) + 2e – → H 2 (г) + 2 OH – (водн.)
Анод (окисление): 4 OH – (водн.) → O 2 (г) + 2 H 2 O (л) + 4 e –
Объединение двух половин -реакции дает уравнение электролиза воды.
2 H 2 O (л) + электрическая энергия → 2 H 2 (g) + O 2 (g)
Часто задаваемые вопросы
Q.1. Опасен ли электролиз соленой воды?
Ответ. Да, электролиз соленой воды опасен. Он производит газообразный хлор, который ядовит.
Q.2. Сколько энергии требуется для электролиза воды?
Ответ. Теоретически для диссоциации одной молекулы воды требуется минимум 237 кДж энергии.
Q.3. Каков стандартный потенциал водного электролизера?
Ответ. Стандартный потенциал водного электролизера составляет -1,229 В при 25 °C и pH = 0. edu
Электролиз | Encyclopedia.com
Электролиз воды
Производство натрия и хлора
Производство магния
Производство гидроксида натрия, хлора и водорода
Производство алюминия
Рафинирование меди
Гальваника
Ресурсы, вызывающие химическую реакцию в процессе электролиза возникают при пропускании электрического тока через вещество или смесь веществ, чаще всего в жидком виде. Электролиз часто приводит к разложению соединения на его элементы. Для проведения электролиза два электрода, положительный электрод (анод) и отрицательный электрод (катод), погружаются в электролизуемый материал и подключаются к источнику постоянного (постоянного) электрического тока.
Аппарат, в котором проводится электролиз, называется электролитической ячейкой . Корни -lys и -lyt происходят от греческих lysis и lytos , что означает резать или разлагать; электролиз в электролизере – это процесс, который может разлагать вещество.
Электролизуемое вещество должно быть электролитом, жидкостью, содержащей положительные и отрицательные ионы и поэтому способной проводить электричество. Существует два вида электролитов. Один вид представляет собой раствор ионного соединения любого соединения, которое образует ионы при растворении в воде, такого как неорганическая кислота, основание или соль. Другой вид представляет собой жидкое ионное соединение, такое как расплавленная соль.
В любом типе электролита жидкость проводит электричество, потому что ее положительные и отрицательные ионы могут свободно двигаться к электродам с противоположным зарядом — положительные ионы к катоду, а отрицательные ионы к аноду. Этот перенос положительного заряда в одном направлении и отрицательного заряда в противоположном направлении составляет электрический ток, потому что электрический ток, в конце концов, есть только поток заряда, и не имеет значения, являются ли носители заряда ионами или электронами. В ионном твердом веществе, таком как, например, хлорид натрия, обычно фиксированные ионы становятся свободными для движения, как только твердое вещество растворяется в воде или как только оно расплавляется.
Этот перенос положительного заряда в одном направлении и отрицательного заряда в противоположном направлении составляет электрический ток, потому что электрический ток, в конце концов, есть только поток заряда, и не имеет значения, являются ли носители заряда ионами или электронами. В ионном твердом веществе, таком как, например, хлорид натрия, обычно фиксированные ионы становятся свободными для движения, как только твердое вещество растворяется в воде или как только оно расплавляется.
Во время электролиза ионы движутся к электродам с противоположным зарядом. Когда они достигают соответствующих электродов, они подвергаются химическим окислительно-восстановительным реакциям. На катоде, перекачивающем электроны в электролит, происходит химическое восстановление — захват электронов положительными ионами. На аноде, удаляющем электроны из электролита, происходит химическое окисление — потеря электронов отрицательными ионами.
В электролизе существует прямая зависимость между количеством электричества, протекающего через ячейку, и количеством протекающей химической реакции. Чем больше электронов прокачивается аккумулятором через электролит, тем больше ионов будет вынуждено отдавать или принимать электроны, тем самым окисляясь или восстанавливаясь. Чтобы произвести один моль химической реакции, через клетку должен пройти один моль электронов. Моль электронов, то есть 6,02 ←× 10 23 электронов называется фарадеев . Единица названа в честь Майкла Фарадея (1791–1867), английского химика и физика, открывшего взаимосвязь между электричеством и химическими изменениями. Ему также приписывают первое использование слов анод , катод , электрод , электролит и электролиз .
Чем больше электронов прокачивается аккумулятором через электролит, тем больше ионов будет вынуждено отдавать или принимать электроны, тем самым окисляясь или восстанавливаясь. Чтобы произвести один моль химической реакции, через клетку должен пройти один моль электронов. Моль электронов, то есть 6,02 ←× 10 23 электронов называется фарадеев . Единица названа в честь Майкла Фарадея (1791–1867), английского химика и физика, открывшего взаимосвязь между электричеством и химическими изменениями. Ему также приписывают первое использование слов анод , катод , электрод , электролит и электролиз .
Различные типы электролитических ячеек могут быть разработаны для достижения определенных химических целей.
Возможно, наиболее известным примером электролиза является электролитическое разложение воды с образованием водорода и кислорода:
Поскольку вода является таким стабильным соединением, ученые могут запустить эту реакцию, только накачивая ее энергией — в данном случае в форма электрического тока. Чистую воду, которая плохо проводит электричество, нужно сначала превратить в электролит, растворив в ней кислоту, основание или соль. Затем можно вставить анод и катод, обычно сделанные из графита или какого-либо нереагирующего металла, такого как платина, и подключить их к батарее или другому источнику постоянного тока.
Чистую воду, которая плохо проводит электричество, нужно сначала превратить в электролит, растворив в ней кислоту, основание или соль. Затем можно вставить анод и катод, обычно сделанные из графита или какого-либо нереагирующего металла, такого как платина, и подключить их к батарее или другому источнику постоянного тока.
На катоде, где электроны перекачиваются в воду батареей, они поглощаются молекулами воды с образованием газообразного водорода:
На аноде электроны удаляются из молекул воды:
Итоговый результат суммирование этих двух электродных реакций равно
(Обратите внимание, что при сложении этих двух уравнений четыре иона H + и четыре иона OH — в правой части объединяются, образуя четыре H 2 O молекулы, которые затем отменяют четыре из H 2 молекул O в левой части.) Таким образом, каждые две молекулы воды распались на две молекулы водорода и одну молекулу кислорода.
Кислота, основание или соль, превратившие воду в электролит, были выбраны таким образом, чтобы их конкретные ионы не могли окисляться или восстанавливаться (по крайней мере, при напряжении батареи), чтобы они не вступали в химические реакции и служили только для проведения течение через воду.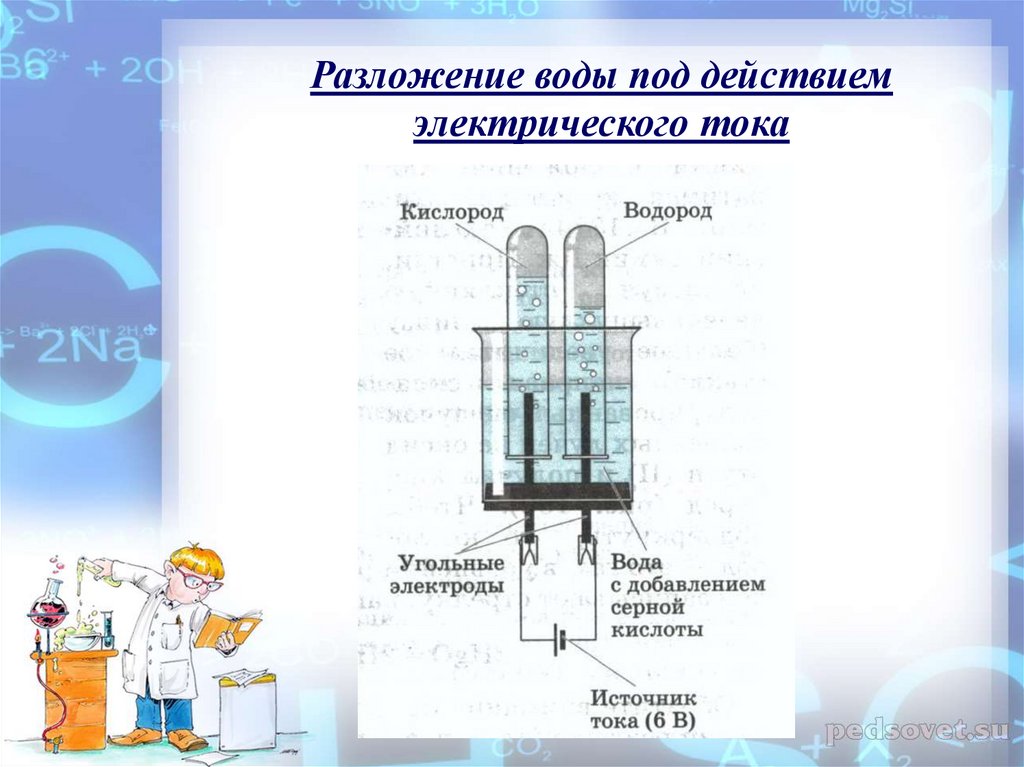 Обычно используется серная кислота H 2 SO 4 .
Обычно используется серная кислота H 2 SO 4 .
С помощью электролиза поваренная соль, хлорид натрия, NaCl, может быть разложена на его элементы, натрий и хлор. Это важный метод производства натрия. Он также используется для получения других щелочных металлов и щелочноземельных металлов из их солей.
Чтобы получить натрий электролизом, ученые сначала расплавят немного хлорида натрия, нагрев его выше температуры плавления 1474°F (801°C). Затем в расплавленную соль вставят два инертных (не реагирующих) электрода. Хлорид натрия должен быть расплавлен, чтобы позволить Na 9ионы 0013 + и Cl — свободно перемещаются между электродами; в твердом хлориде натрия ионы замерзают на месте. Наконец, ученые пропустят постоянный электрический ток (DC) через расплавленную соль.
Отрицательный электрод (катод) притягивает ионы Na + , а положительный электрод (анод) притягивает ионы Cl — , после чего происходят следующие химические реакции.
На катоде, куда закачиваются электроны, они захватываются положительными ионами натрия:
На аноде, где происходит откачка электронов, они отрываются от ионов хлора:
(Атомы хлора сразу объединяются в двухатомные молекулы, Cl 2 .) В результате расщепляется поваренная соль на его элементы электричеством.
Еще одним важным применением электролиза является производство магния из морской воды. Морская вода является основным источником этого металла, так как она содержит больше ионов магния, чем любого другого металла, кроме натрия. Во-первых, хлорид магния, MgCl 2 , получают осаждением гидроксида магния из морской воды и растворением его в соляной кислоте. Затем хлорид магния расплавляют и подвергают электролизу. Подобно производству натрия из расплавленного хлорида натрия, расплавленный магний осаждается на катоде, а газообразный хлор выделяется на аноде. Общая реакция представляет собой MgCl 2 → Mg + Cl 2 .
Гидроксид натрия, NaOH, также известный как щелочь и каустическая сода, является одним из наиболее важных промышленных химикатов. По состоянию на 2004 год только в Соединенных Штатах его ежегодно производится более 25 миллиардов фунтов (11 миллиардов килограммов). Мировое производство в том же году составило более 100 миллиардов фунтов (44 миллиарда килограммов). Основным способом его получения является электролиз рапы или соленой воды, раствора поваренной соли, хлорида натрия в воде. В качестве ценных побочных продуктов образуются газообразные хлор и водород.
Когда электрический ток проходит через соленую воду, отрицательные ионы хлора, Cl — , мигрируют к положительному аноду и теряют свои электроны, превращаясь в газообразный хлор.
(Затем атомы хлора объединяются в пары, образуя молекулы Cl 2 .) Тем временем ионы натрия Na + притягиваются к отрицательному катоду. Однако они не захватывают электроны, превращаясь в атомы металлического натрия, как это происходит в расплавленной соли.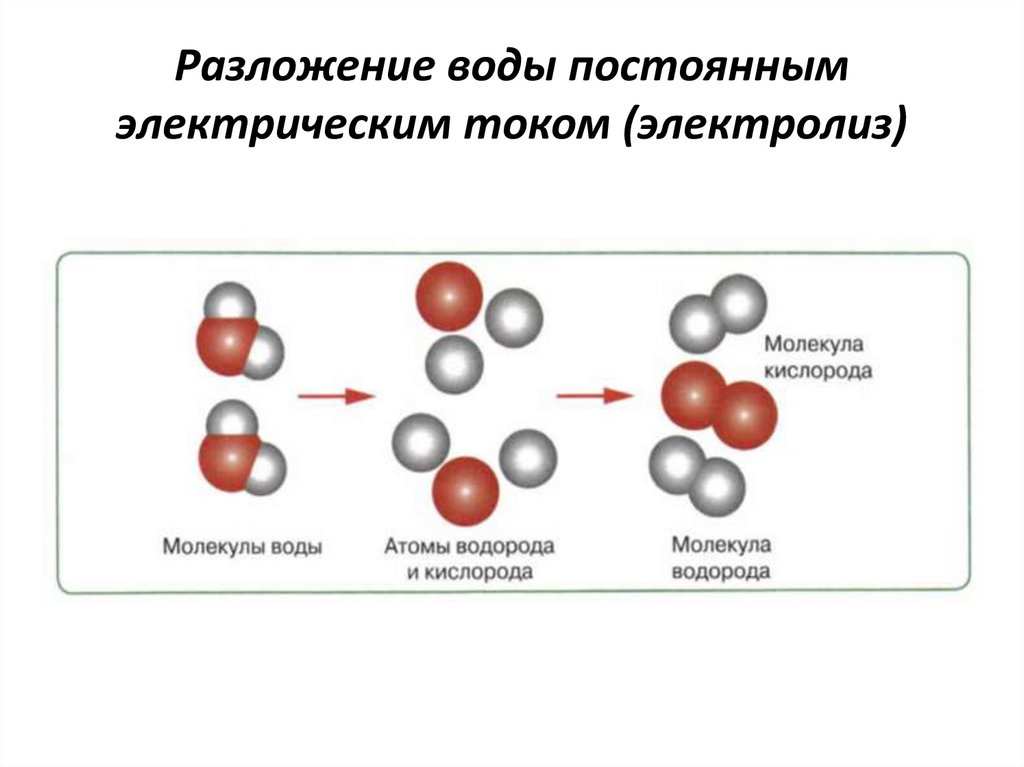 Это связано с тем, что в водном растворе сами молекулы воды захватывают электроны легче, чем ионы натрия. Тогда на катоде происходит
Это связано с тем, что в водном растворе сами молекулы воды захватывают электроны легче, чем ионы натрия. Тогда на катоде происходит
Ионы гидроксида вместе с ионами натрия, уже находящимися в растворе, составляют гидроксид натрия, который можно восстановить выпариванием.
Этот так называемый хлор-щелочной процесс является основой отрасли, которая существует уже более ста лет. С помощью электричества он превращает дешевую соль в ценный хлор, водород и гидроксид натрия. Среди прочего, хлор используется для очистки воды, водород используется для гидрогенизации масел, а щелочь используется для изготовления мыла, средств для очистки промышленных стоков и духовок, а также бумаги.
Производство алюминия методом Холла было одним из первых крупномасштабных применений электролиза и до сих пор остается основным методом получения этого очень полезного металла. Чарльз М. Холл, 21-летний студент Оберлинского колледжа в Огайо, который искал способ восстановить оксид алюминия до металла, открыл этот процесс в 1886 году. В то время алюминий был редкой и дорогой роскошью. потому что металл очень реакционноспособен и поэтому его трудно восстановить из его соединений химическими средствами. С другой стороны, электролиз расплавленной соли или оксида алюминия затруднен, поскольку соли трудно получить в безводной (сухой) форме, а оксид Al 2 O 3 , не плавится до 3 762°F (2 072°C).
В то время алюминий был редкой и дорогой роскошью. потому что металл очень реакционноспособен и поэтому его трудно восстановить из его соединений химическими средствами. С другой стороны, электролиз расплавленной соли или оксида алюминия затруднен, поскольку соли трудно получить в безводной (сухой) форме, а оксид Al 2 O 3 , не плавится до 3 762°F (2 072°C).
Холл обнаружил, что Al 2 O 3 в форме минерала боксита растворяется в другом алюминиевом минерале, называемом криолитом, Na 3 AlF 6 , и что полученную смесь можно легко расплавить. Когда через эту расплавленную смесь пропускают электрический ток, ионы алюминия мигрируют к катоду, где они восстанавливаются до металла:
На аноде ионы оксида окисляются до газообразного кислорода:
Расплавленный металлический алюминий опускается на дно электролизера и может быть удален.
Обратите внимание, что для производства каждого моля алюминия требуется три моля электронов (три фарадея электричества), потому что на каждом ионе алюминия есть три положительных заряда, которые должны быть нейтрализованы электронами. Таким образом, производство алюминия методом Холла потребляет огромное количество электроэнергии. Переработка банок из-под напитков и других алюминиевых предметов стала важной мерой по энергосбережению.
Таким образом, производство алюминия методом Холла потребляет огромное количество электроэнергии. Переработка банок из-под напитков и других алюминиевых предметов стала важной мерой по энергосбережению.
В отличие от алюминия, металлическую медь довольно легко получить химическим путем из его руд. Но с помощью электролиза его можно очистить и сделать очень чистым — до 99,999%. Чистая медь важна для изготовления электрических проводов, потому что электропроводность меди снижается из-за примесей. К таким примесям относятся такие ценные металлы, как серебро, золото, платина; когда они удаляются электролизом и восстанавливаются, они имеют большое значение для оплаты счетов за электроэнергию.
При электролитическом рафинировании меди неочищенную медь получают из анода в ванне электролита с сульфатом меди, CuSO 4 и серная кислота H 2 SO 4 . Катод представляет собой лист чистой меди. Когда через раствор пропускают ток, положительные ионы меди, Cu 2+ , в растворе притягиваются к отрицательному катоду, где они принимают электроны и осаждаются в виде нейтральных атомов меди, тем самым создавая все больше и больше чистой меди на катод. Тем временем атомы меди в положительном аноде отдают электроны и растворяются в растворе электролита в виде ионов меди. Однако примеси в аноде не переходят в раствор, потому что атомы серебра, золота и платины не так легко окисляются (превращаются в положительные ионы), как окисляется медь. Таким образом, серебро, золото и платина просто падают с анода на дно резервуара, где их можно соскребать.
Тем временем атомы меди в положительном аноде отдают электроны и растворяются в растворе электролита в виде ионов меди. Однако примеси в аноде не переходят в раствор, потому что атомы серебра, золота и платины не так легко окисляются (превращаются в положительные ионы), как окисляется медь. Таким образом, серебро, золото и платина просто падают с анода на дно резервуара, где их можно соскребать.
Еще одним важным применением электролитических элементов является гальваническое покрытие серебра, золота, хрома и никеля. Гальваностегия производит тонкое покрытие этих дорогих металлов на поверхности более дешевых металлов, чтобы придать им внешний вид и химическую стойкость дорогих.
При серебрении покрываемый предмет (например, ложка) изготавливается из катода электролитической ячейки. Анод представляет собой брусок металлического серебра, а электролит (жидкость между электродами) представляет собой раствор цианида серебра AgCN в воде. Когда через ячейку пропускают постоянный ток, положительные ионы серебра (Ag + ) из цианида серебра мигрируют к отрицательному аноду (ложке), где они нейтрализуются электронами и прилипают к ложке в виде металлического серебра:
Тем временем стержень серебряного анода отдает электроны, превращаясь в ионы серебра:
Таким образом, анодный стержень постепенно растворяется, восполняя ионы серебра в растворе. Конечным результатом является перенос металлического серебра с анода на катод, в данном случае на ложку. Этот процесс продолжается до тех пор, пока на ложке не будет достигнута желаемая толщина покрытия — обычно всего несколько тысячных дюйма — или пока серебряный слиток полностью не растворится.
Конечным результатом является перенос металлического серебра с анода на катод, в данном случае на ложку. Этот процесс продолжается до тех пор, пока на ложке не будет достигнута желаемая толщина покрытия — обычно всего несколько тысячных дюйма — или пока серебряный слиток полностью не растворится.
При гальванопокрытии серебром в электролите используется цианид серебра, а не другие соединения серебра, такие как нитрат серебра, AgNO 3 , поскольку ион цианида, CN –, реагирует с ионом серебра, Ag + , с образованием комплексного иона Ag(CN) 2 — . Это ограничивает поступление свободных ионов Ag + в раствор, поэтому они могут лишь постепенно осаждаться на катоде. Это дает более блестящее и прочное серебряное покрытие. Золотое покрытие
КЛЮЧЕВЫЕ ТЕРМИНЫ
Комплексный ион — Большой ион, состоящий из более мелких ионов, объединенных друг с другом или с другими атомами или молекулами
Фарадей — Единица электрического заряда, равная количеству переносимого заряда на один моль электронов.

