Агрегатные состояния вещества | 7 класс
Содержание
Чтобы подробнее рассмотреть свойства веществ, нам необходимо разобраться в их молекулярном строении.
Рассмотрим пример. После дождя появилась лужа. Если ударит мороз, и лужа замерзнет, то по ней уже можно будет проехаться. В жару вода из лужи быстро испарится, превратившись в пар. Но разве в этих случаях лужа будет состоять из другого вещества?
Нет, она все так же состоит из одних и тех же молекул. Лед, пар и вода — это одно и то же вещество, но молекулы в нем могут по-разному располагаться и взаимодействовать.
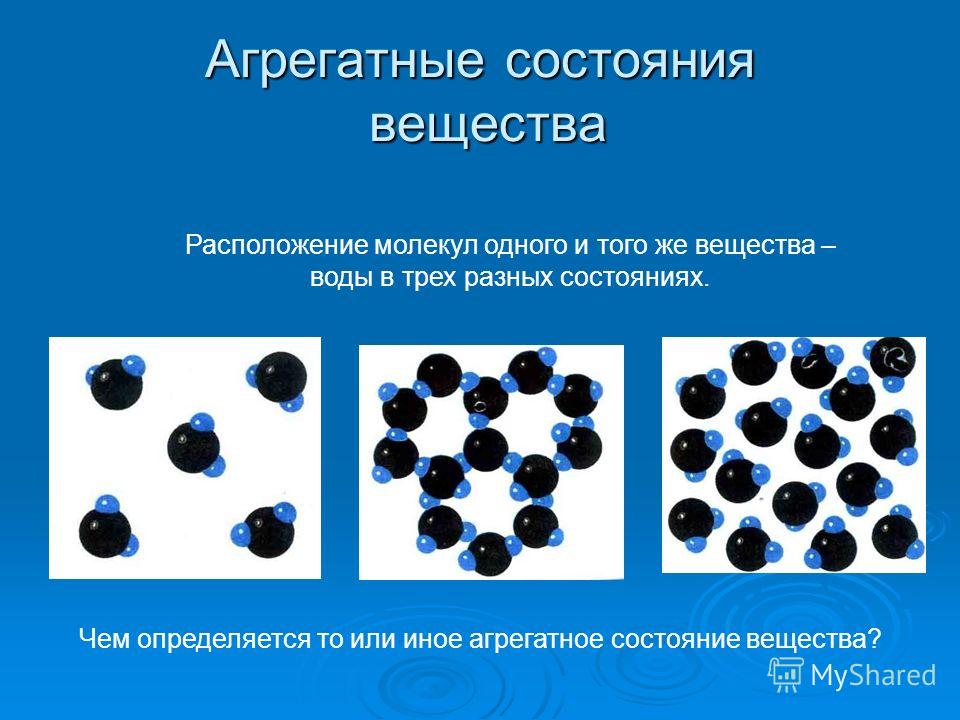
В таких случаях говорят, что вещество способно пребывать в разных состояниях или переходить из одного в другое (рисунок 1).
Рисунок 1. Расположение молекул воды в трех разных состояниях: твердом — лед, жидком — вода и газообразном — водяной парАгрегатные состояние вещества
Агрегатные состояния — это состояния одного вещества, при которых его свойства значительно различаются.
Оно определяется расположением молекул вещества и характером их движения.
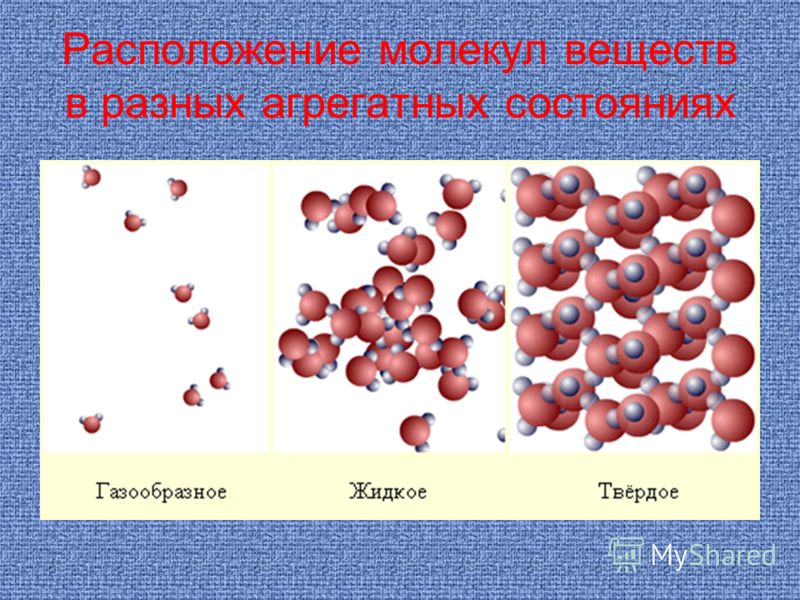
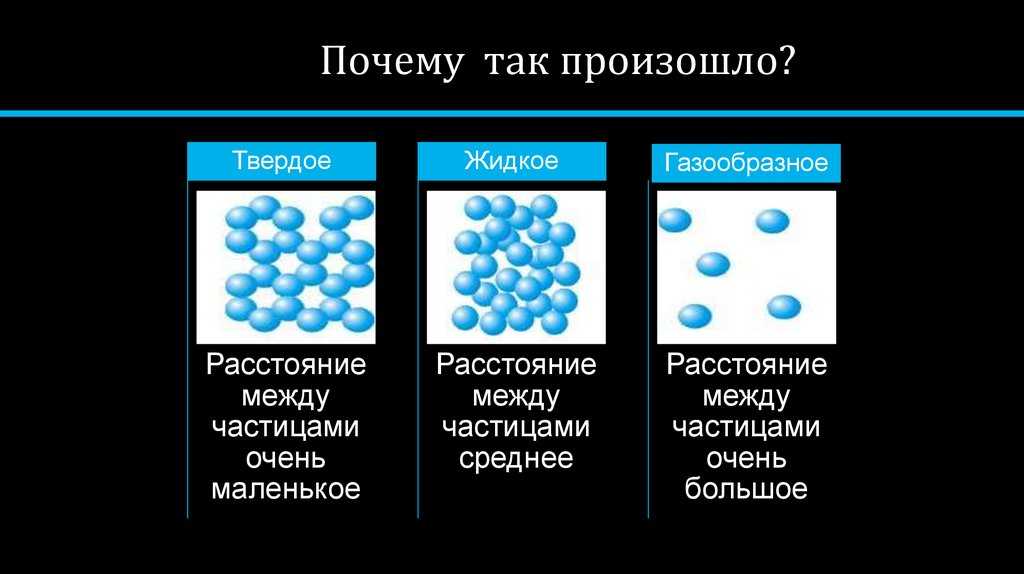
Какие три состояния вещества вам известны? Различают 3 основных агрегатных состояния: твердое, жидкое и газообразное.
Но у веществ существуют и другие состояния. При очень больших температурах молекулы склонны распадаться на составляющие их атомы, ионы и электроны, о которых пойдет речь позже. Из этих частиц состоит плазма — одно из состояний вещества.
Мы можем ее наблюдать в виде пламени костра или свечи. Вещества, из которых состоит Солнце, тоже пребывают в плазменном состоянии, плазма в атмосфере вызывает полярное сияние. На свойствах плазмы базируется принцип работы плазменных телевизоров.
Бывают неустойчивые состояния веществ: переохлажденные или перегретые жидкости. Они достигаются охлаждением жидкости ниже температуры кристаллизации либо нагревом ее выше температуры испарения при определенных условиях. При этом, незначительное внешнее воздействие на такую жидкость вызывает ее резкий переход в твердое либо газообразное состояние.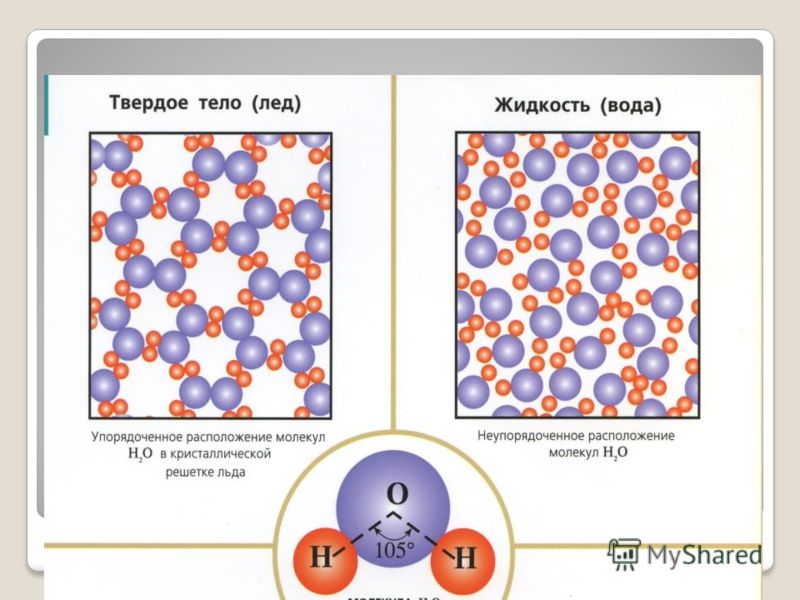
Но сейчас мы рассмотрим подробнее основные агрегатные состояния.
Твердое агрегатное состояние
Твердым можно назвать любой предмет, сохраняющий свою форму, если его специально не разрушать. Другими словами — это такое агрегатное состояние вещества, при котором оно сохраняет свой объем и форму.
Молекулы/атомы в таком веществе находятся на определенных позициях, они могут колебаться на своих местах, но их положение по отношению к другим молекулам/атомам практически не меняется (рисунок 2).
Рисунок 2. Молекулярное строение твердого вещества (лед)В твердых кристаллических веществах атомы образуют кристаллическую решетку (лед, соль, металлы и др.) — рисунок 3.
Рисунок 3. Молекулярное строение твердого кристаллического вещества (поваренная соль: атомы натрия – красного цвета, атомы хлора – синего)В твердых телах притяжение между молекулами (атомами) намного больше, чем у жидкостей. Поэтому в обычных условиях твердые тела сохраняют свою форму и объем.
В твердых аморфных веществах атомы расположены беспорядочно, не имеют кристаллической структуры, но и не находятся в постоянном движении (смола, янтарь). Обычно характеризуются невысокой температурой плавления, из-за чего могут легко переходить в другое агрегатное состояние и обладать текучестью.
{"questions":[{"content":"Выберите правильное определение <b>твердого аморфного вещества</b>.[[choice-11]]","widgets":{"choice-11":{"type":"choice","options":["Вещество, в котором атомы расположены беспорядочно, не имеют кристаллической структуры, но и не находятся в постоянном движении.","Вещество, в котором атомы расположены беспорядочно, не имеют кристаллической структуры и находятся в постоянном движении.","Вещество, в котором атомы образуют кристаллическую решетку."],"answer":[0]}}}]}Жидкое агрегатное состояние
К жидкостям относят тела, изменить форму которых очень легко, чего нельзя сказать про их объем.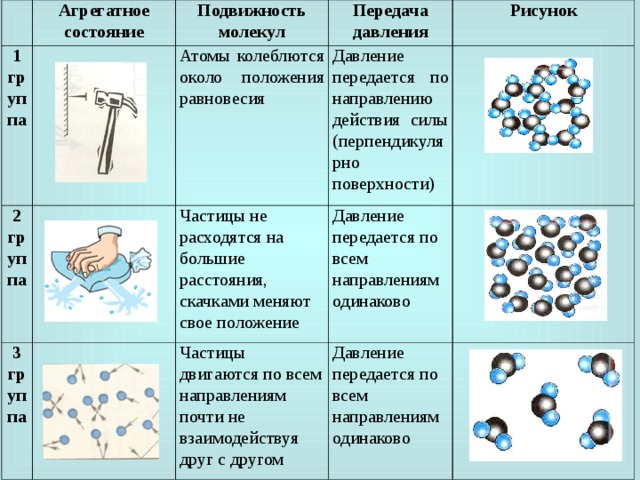
Например, налив воду из графина в стакан, жидкость примет форму сосуда, но её объем останется прежним (рисунок 4).
Рисунок 4. Изменение формы жидкого веществаНаполним шприц водой, закроем пальцем отверстие и попробуем сжать воду. У нас ничего не получится. Жидкость практически несжимаема. Это такое агрегатное состояние, в котором тело способно сохранять свой объем, но не сохраняет форму.
Молекулы жидкости находятся довольно близко (расстояние между каждыми двумя молекулами меньше размеров молекул) и их взаимодействие ощутимое. Молекулярное строение жидкости представлено на рисунке 5.
Рисунок 5. Молекулярное строение жидкого вещества (воды)Также на свойстве жидкости легко изменять свою форму основано изготовление предметов из расплавленного стекла (рисунок 6).
Рисунок 6. Выдувание из расплавленного (жидкого) стеклаМолекулы жидкости не расходятся на большие расстояния и жидкость в обычных условиях сохраняет свой объем, но не сохраняет форму.
В состоянии невесомости жидкость имеет форму шара, потому что внешние силы уравновешены и форма определяется только силами молекулярного взаимодействия. У последних нет единого направления, поэтому форма жидкости симметрична в любых направлениях.
{"questions":[{"content":"Какую форму принимает жидкость в <b>состоянии невесомости</b>?[[choice-26]]","widgets":{"choice-26":{"type":"choice","options":["Форму шара","Форма сосуда","Круглую форму","Газообразную форму"],"explanations":["Верно! В невесомости внешние силы уравновешены и форма определяется только силами молекулярного взаимодействия. У последних нет единого направления, поэтому форма жидкости симметрична в любых направлениях.","","",""],"answer":[0]}}}]}Газообразное агрегатное состояние
Большинство газов бесцветны и прозрачны, а потому невидимы. Его присутствие мы можем почувствовать при дуновении ветра, сквозняка в комнате или же на примере простых опытов (рисунок 7).
Рисунок 7. Иллюстрация опыта, подтверждающего наличие воздуха в окружающем нас пространстве
Иллюстрация опыта, подтверждающего наличие воздуха в окружающем нас пространствеОпустим в воду воронку, предварительно соединив ее резиновой трубкой со стеклянной трубочкой. Из трубочки начнут выходить пузырьки воздуха, которые до этого были в воронке и во всей системе в целом. Подобные простые опыты подтверждают наличие воздуха вокруг нас.
Каково расположение молекул газа? Молекулы газа находятся на больших расстояниях друг от друга и в постоянном хаотичном движении. Поэтому часто взаимодействие между молекулами газа не учитывается, и большое пространство между частицами позволяет сильно сжимать газы. Молекулярное строение газа представлено на рисунке 8.
Рисунок 8. Молекулярное строение газа (паров воды)Газы не имеют собственной формы и постоянного объема. Они принимают форму сосуда и полностью заполняют предоставленный им объем.
{"questions":[{"content":"Сопоставьте свойства объема и формы в соответствии с <b>агрегатными состояниями</b>. [[matcher-1]]","widgets":{"matcher-1":{"type":"matcher","labels":["Твердое","Жидкое","Газообразное"],"items":["вещество сохраняет объем и форму","вещество сохраняет объем, но не сохраняет форму","вещество не имеет собственной формы и постоянного объема","вещество не сохраняет объем, но сохраняет форму"]}}}]}
[[matcher-1]]","widgets":{"matcher-1":{"type":"matcher","labels":["Твердое","Жидкое","Газообразное"],"items":["вещество сохраняет объем и форму","вещество сохраняет объем, но не сохраняет форму","вещество не имеет собственной формы и постоянного объема","вещество не сохраняет объем, но сохраняет форму"]}}}]}Задания
Задание №1
Налейте в пластмассовую бутылку воды до верху и закройте крышкой. Попытайтесь сдать в ней воду. Затем вылейте воду, снова закройте бутылочку. Теперь попробуйте сжать воздух. Объясните результаты опыта.
Существенно сжать бутылку, наполненную водой, у нас не получится. Максимум, вы только помнете бутылку, но ее объем останется прежним. Связано это с тем, что в воде расстояние между молекулами небольшое, и она практически несжимаема.
Рисунок 9. Сжатие пустой бутылкиА вот когда мы выльем из бутылки воду, то сможем значительно деформировать бутылку и уменьшить ее объем. Почему? Теперь бутылку наполняет воздух. А его молекулы находятся на больших расстояниях друг от друга, поэтому нам было так легко сжать этот газ внутри бутылки.
Задание №2
На блюдце с холодной водой поставьте перевернутый очень теплый стакан. Через 15-20 минут проследите за уровнем воды в стакане и блюдце. Объясните результат опыта.
Через некоторое время вы увидите, что уровень воды в стакане поднялся. Он стал выше уровня воды в блюдце (рисунок 10).
Рисунок 10. Подъем уровня воды в стаканеПосле того, как мы поставили горячий стакан с таким же воздухом внутри на блюдце с холодной водой, между всеми этими телами начался теплообмен. Это означает, что вода начала нагреваться, а воздух в стакане, наоборот, начал охлаждаться.
А что происходит с телами при их охлаждении или нагревании? Они соответственно сжимаются или расширяются. Так, через 15 минут теплый воздух охладился и сжался, а вода, наоборот, расширилась и заняла место в стакане.
На самом деле, здесь большое значение имеет давление, которое оказывают те или иные тела, включая и воздух вокруг нас. Об этом понятии вы узнаете на следующих уроках.
Чем отличается молекулы воды льда и пара?
Статьи › Чем отличается › Чем отличаются молекулы воды от молекулы пара?
Сами молекулы льда, воды и ледяного пара не отличаются, отличаются другие параметры (Скорость движения, расположение). Внутреннее строения льда и воды отличается тем, как расположены молекулы воды в них.
- Чем отличаются друг от друга молекулы горячей и холодной воды водяного пара?
- Чем отличаются молекулы воды в разных агрегатных состояниях?
- Что такое молекула воды?
- Чем отличается молекулы воды и водяного пара?
- Почему две молекулы воды могут прилипать друг к другу?
- Как ведут себя молекулы воды?
- Какое строение имеют молекулы воды?
- Чем отличаются агрегатные состояния воды?
- Кто создал воду?
- В чем прикол духов молекула?
- Какая молекула у воды?
- Что такое пар простыми словами?
- Чем отличаются молекулы воды от молекулы?
- Как называется вода из пара?
- Какой воде горячей или холодной диффузия происходит быстрее?
- В чем особенность движения молекул в жидкости?
- Можно ли пить горячую воду из под крана в Москве?
- Чем отличается вещество в разных агрегатных состояния?
- В чем основное различие агрегатных состояний вещества?
- Что такое агрегатное состояние простыми словами?
- Что больше молекулы воды или кислорода?
- Как получается молекула воды?
- Какой формы молекула воды?
- Чем отличаются молекулы воды от молекул газа?
- Чем отличаются молекулы газа от молекул жидкости?
- Как определить состояние водяного пара?
- Как молекулы взаимодействуют друг с другом?
- Как молекулы действуют друг на друга?
Чем отличаются друг от друга молекулы горячей и холодной воды водяного пара?
Ответы1.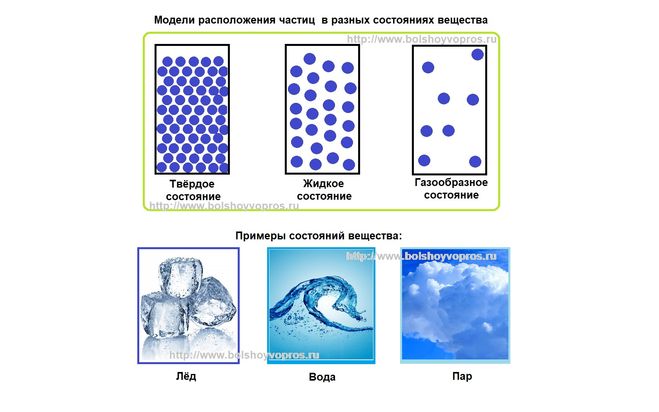 Молекула горячей воды не чем не отличается от молекулы холодной воды. Молекула горячей воды быстрее движется, чем молекула холодной воды. Согласно уравнению молекулярно-кинетической теории, средняя кинетическая энергия молекул Ек зависит от температуры следующим образом Ек= 3 *k *T/2.
Молекула горячей воды не чем не отличается от молекулы холодной воды. Молекула горячей воды быстрее движется, чем молекула холодной воды. Согласно уравнению молекулярно-кинетической теории, средняя кинетическая энергия молекул Ек зависит от температуры следующим образом Ек= 3 *k *T/2.
Чем отличаются молекулы воды в разных агрегатных состояниях?
В разных агрегатных состояниях между молекулами разная сила межмолекулярного взаимодействия и разный характер их движения. В твердом состоянии молекулы совершают только колебательное движение около положения равновесия.
Что такое молекула воды?
Вода́ (оксид водорода, гидроксид водорода, химическая формула — h3O) — бинарное неорганическое соединение, молекула которого состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
Чем отличается молекулы воды и водяного пара?
Молекулы воды идентичны во всех агрегатных состояниях. Разница свойств воды, пара и льда объясняется расстоянием и силой притяжения между молекулами вещества.
Почему две молекулы воды могут прилипать друг к другу?
Молекулы воды образуют друг с другом водородные связи. Частично отрицательный заряд на атоме кислорода одной молекулы притягивается к частично положительно заряженному водороду другой молекулы. Кроме того, молекулы воды также притягиваются к другим полярным молекулам и ионам.
Как ведут себя молекулы воды?
Молекулы в объеме воды сближаются противоположными зарядами, возникают межмолекулярные водородные связи между ядрами водорода и неподеленными электронами кислорода, насыщая электронную недостаточность водорода одной молекулы воды и фиксируя его по отношению к кислороду другой молекулы.
Какое строение имеют молекулы воды?
Молекула воды (h3O) состоит из двух атомов водорода (h2) и одного атома кислорода (O16). Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине. Расстояние O-H — 0,9568 Å; H-H — 1,54 Å.
Чем отличаются агрегатные состояния воды?
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества.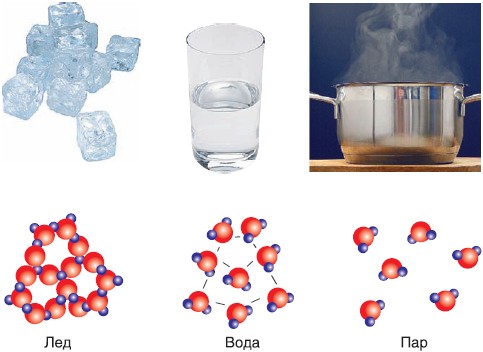 Лед — твердое состояние, вода — жидкая, пар — газообразное.
Лед — твердое состояние, вода — жидкая, пар — газообразное.
Кто создал воду?
Впервые состав воды открыл химик Генри Кавендиш (1731 — 1810), проводя эксперименты с водородом и кислородом и смешивая эти элементы с целью создать взрыв («гремучий эффект»).
В чем прикол духов молекула?
В чем же особенность духов-молекулы? В том, что благодаря Исо Е Супер нотки духов сливаются воедино и образуют уникальный аромат. Оттенки его нестабильны и постоянно видоизменяются в зависимости от того, кто вдыхает запах.
Какая молекула у воды?
Общепринято, что вода состоит из молекул Н2О, объединённых в группы так называемыми водородными связями. Их наличие обусловлено притяжением между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода.
Что такое пар простыми словами?
Пар — это газ, образованный при переходе воды из жидкого состояния в газообразное.
Чем отличаются молекулы воды от молекулы?
Сами молекулы ничем не отличаются, это по прежнему те же самые молекулы воды. Отличается то, как эти молекулы организованны друг относительно друга — межмолекулярное взаимодействие и порядок организации. Вы знаете ответ на этот вопрос?
Отличается то, как эти молекулы организованны друг относительно друга — межмолекулярное взаимодействие и порядок организации. Вы знаете ответ на этот вопрос?
Как называется вода из пара?
Водяной пар превращается в жидкую воду при температуре ниже \(100\) градусов. Процесс называется конденсация.
Какой воде горячей или холодной диффузия происходит быстрее?
Итог: Горячая вода окрашивается быстрее и равномернее холодной.
В чем особенность движения молекул в жидкости?
Молекулы жидкости совершают непрерывные и беспорядочные колебания около временных положений их равновесия. Средняя кинетическая энергия таких колебаний молекул определяет температуру жидкости.
Можно ли пить горячую воду из под крана в Москве?
Вода из крана
Поэтому ответ на вопрос о том — горячую воду можно пить из-под крана или нет, однозначный — нет. Ее нельзя использовать даже для приготовления первых блюд — супов и для кипячения чая.
Чем отличается вещество в разных агрегатных состояния?
Молекулы одного вещества, находящегося в разных агрегатных состояниях, не отличаются друг от друга.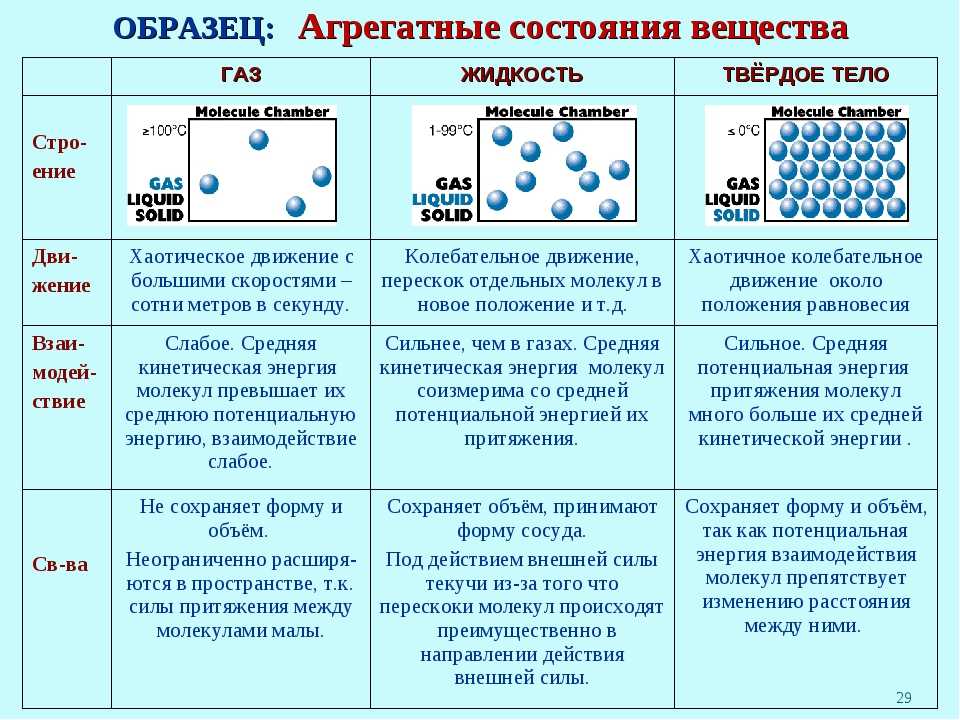 Различия заключаются в расположении, характере движения и взаимодействия молекул.
Различия заключаются в расположении, характере движения и взаимодействия молекул.
В чем основное различие агрегатных состояний вещества?
Основным термодинамическим (феноменологическим) признаком различия видов агрегатного состояния вещества является наличие энергетической границы между фазами: теплота испарения как граница между жидкостью и её паром и теплота плавления как граница между твёрдым веществом и жидкостью.
Что такое агрегатное состояние простыми словами?
Агрегатные состояния веществаw — состояние вещества, характеризующееся определенными свойствами (способность сохранять форму, объем). Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазмуw.
Что больше молекулы воды или кислорода?
Dh3O (O2) = Mr (O2): Mr (h3O) = 32: 18 = 1,78. Ответ: молекула воды в 9 раз тяжелее молекулы водорода, и в 1,78 раза легче молекулы кислорода.
Как получается молекула воды?
Итак, пространственная структура молекулы воды образуется благодаря существованию водородной пары (Н+Н) и благодаря валентной связи (как непосредственной электронной «магнитной» связи) между валентными электронами одного атома кислорода и двух атомов водорода.
Какой формы молекула воды?
Молекула воды имеет форму тетраэдра, в центре которого расположен атом кислорода. Две вершины тетраэдра заняты свободными электронными парами атома кислорода (зеленого цвета), а остальные две — атомами водорода. Поэтому связи H—О—H расположены под углом друг к другу.
Чем отличаются молекулы воды от молекул газа?
Молекулы воды и пероксида водорода состоят из атомов водорода и кислорода, а молекула углекислого газа — из атомов углерода и кислорода.
Чем отличаются молекулы газа от молекул жидкости?
В газах молекулы непрерывно и беспорядочно движутся с довольно большой скоростью, изменяя направление движения при столкновении друг с другом или с преградой, например, со стенками сосуда. В жидкостях молекулы ограничены в движении, но могут колебаться, вращаться и перемещаться относительно друг друга.
Как определить состояние водяного пара?
Точка, изображающая это состояние, находится на пересечении соответствующей изобары и изотермы. Состояние влажного насыщенного пара определяется давлением p и паросодержанием x. Точка, изображающее это состояние, определяется пересечением изобары и линии x = const.
Состояние влажного насыщенного пара определяется давлением p и паросодержанием x. Точка, изображающее это состояние, определяется пересечением изобары и линии x = const.
Как молекулы взаимодействуют друг с другом?
Атомы или молекулы взаимодействуют друг с другом силами притяжения и отталкивания, которые зависят от расстояний между частицами: при увеличении расстояний начинают преобладать силы притяжения, при уменьшении — силы отталкивания.
Как молекулы действуют друг на друга?
Молекулы вещества притягиваются друг к другу и отталкиваются друг от друга одновременно. Что действует сильнее притяжение или отталкивание, напрямую зависит от расстояния между молекулами.
Газы, жидкости и твердые вещества
Газы, жидкости и твердые вещества Газы, жидкости и твердые тела состоят из атомов, молекул и/или
ионы, но поведение этих частиц различается в трех фазах.
На следующем рисунке показаны микроскопические различия.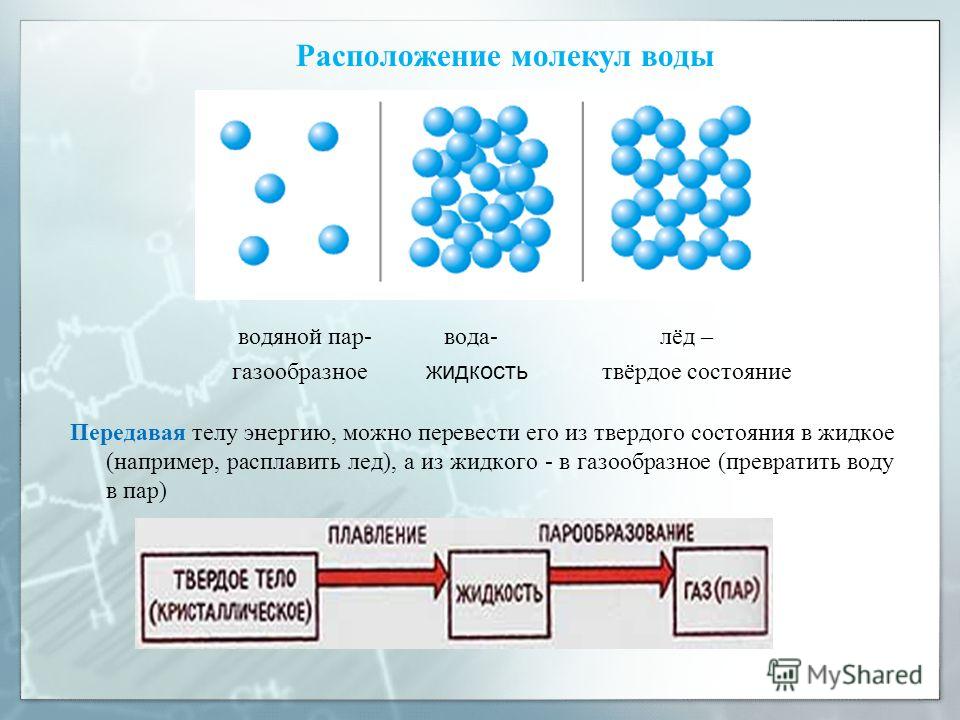
| Газ под микроскопом. | Микроскопический вид жидкости. | Твердое тело под микроскопом. |
Обратите внимание, что:
- Частиц в:
- газ хорошо разделены без регулярного расположения.
- жидкости расположены близко друг к другу без регулярного расположения.
- твердые тела плотно упакованы, обычно в правильном порядке.
- Частиц в:
- газ вибрирует и свободно перемещается на высоких скоростях.
- жидкости вибрируют, перемещаются и скользят друг мимо друга.

В следующей таблице приведены свойства газов, жидкостей и твердых тел. и определяет микроскопическое поведение, ответственное за каждое свойство.
| Некоторые характеристики газов, жидкостей и твердых тел и микроскопическое объяснение поведения | ||
|---|---|---|
| жидкость | твердый | |
| принимает форму и объем контейнера частицы могут двигаться мимо друг друга | принимает форму той части емкости, которую он
занимает частицы могут двигаться/скользить друг мимо друга | сохраняет фиксированный объем и форму жесткий — частицы зафиксированы на месте |
| сжимаемый много свободного пространства между частицами | плохо сжимается небольшое свободное пространство между частицами | плохо сжимается |
| легко течет частицы могут двигаться мимо друг друга | течет легко частицы могут двигаться/скользить друг мимо друга | не течет легко жёсткий — частицы не могут двигаться/скользить мимо одного еще |
2.
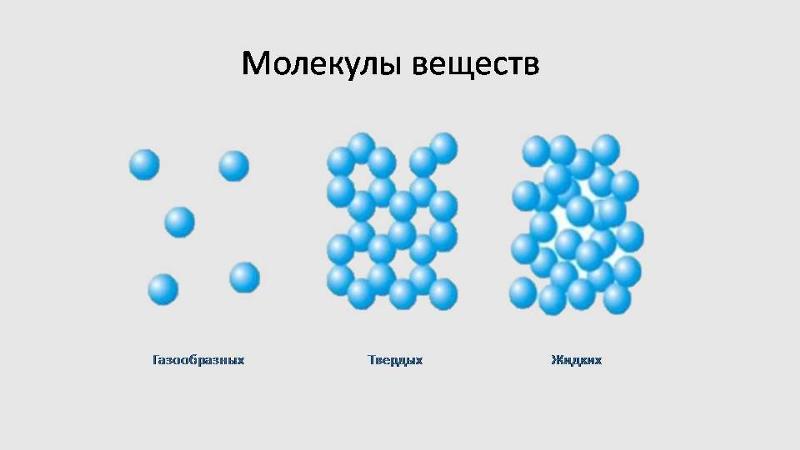 4.1: Состояние воды – газ, жидкость и твердое тело
4.1: Состояние воды – газ, жидкость и твердое тело- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 8794
- Boundless (теперь LumenLearning)
- Boundless
Ориентация водородных связей при изменении состояния воды определяет свойства воды в ее газообразной, жидкой и твердой формах.
Цели обучения
- Объяснить биологическое значение способности льда плавать на воде
Ключевые моменты
- При кипячении воды кинетическая энергия приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара).
- Когда вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями.

- Твердая вода или лед менее плотны, чем жидкая вода.
- Лед менее плотный, чем вода, потому что ориентация водородных связей заставляет молекулы отталкиваться дальше друг от друга, что снижает плотность.
- Для других жидкостей затвердевание при понижении температуры включает снижение кинетической энергии, что позволяет молекулам более плотно упаковываться и делает твердое тело более плотным, чем его жидкая форма.
- Поскольку лед менее плотный, чем вода, он может плавать на поверхности воды.
Ключевые термины
- плотность : Мера количества вещества, содержащегося в данном объеме.
Состояния воды: газообразное, жидкое и твердое
Образование водородных связей является важным качеством жидкой воды, которое имеет решающее значение для жизни, какой мы ее знаем. Поскольку молекулы воды образуют водородные связи друг с другом, вода приобретает некоторые уникальные химические характеристики по сравнению с другими жидкостями, а поскольку живые существа имеют высокое содержание воды, понимание этих химических свойств является ключом к пониманию жизни. В жидкой воде водородные связи постоянно образуются и разрываются, когда молекулы воды скользят друг относительно друга. Разрыв этих связей вызывается движением (кинетической энергией) молекул воды за счет тепла, содержащегося в системе. Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии для разрыва водородных связей недостаточно). Это делает лед менее плотным, чем жидкая вода, явление, не наблюдаемое при затвердевании других жидкостей.
В жидкой воде водородные связи постоянно образуются и разрываются, когда молекулы воды скользят друг относительно друга. Разрыв этих связей вызывается движением (кинетической энергией) молекул воды за счет тепла, содержащегося в системе. Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии для разрыва водородных связей недостаточно). Это делает лед менее плотным, чем жидкая вода, явление, не наблюдаемое при затвердевании других жидкостей.
Фазы вещества : Посмотрите, что происходит с межмолекулярными связями во время фазовых переходов в этом интерактивном режиме.
Более низкая плотность воды в ее твердом состоянии обусловлена тем, что водородные связи ориентируются при ее замерзании: молекулы воды отталкиваются дальше друг от друга по сравнению с жидкой водой. Для большинства других жидкостей затвердевание при понижении температуры включает снижение кинетической энергии между молекулами, что позволяет им упаковываться даже более плотно, чем в жидкой форме, и придает твердому телу большую плотность, чем жидкость.
Для большинства других жидкостей затвердевание при понижении температуры включает снижение кинетической энергии между молекулами, что позволяет им упаковываться даже более плотно, чем в жидкой форме, и придает твердому телу большую плотность, чем жидкость.
Низкая плотность льда, аномалия, заставляет его плавать на поверхности жидкой воды, такой как айсберг или кубики льда в стакане воды. В озерах и прудах лед образуется на поверхности воды, создавая изолирующий барьер, который защищает животных и растения в пруду от замерзания. Без этого слоя изолирующего льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.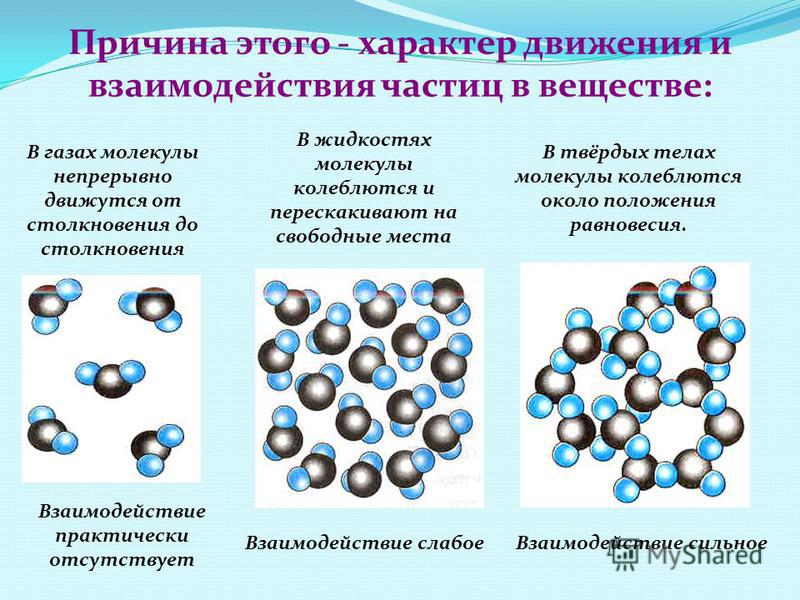
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Безграничный
- Лицензия
- СС BY-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Метки



 Оно определяется расположением молекул вещества и характером их движения.
Оно определяется расположением молекул вещества и характером их движения.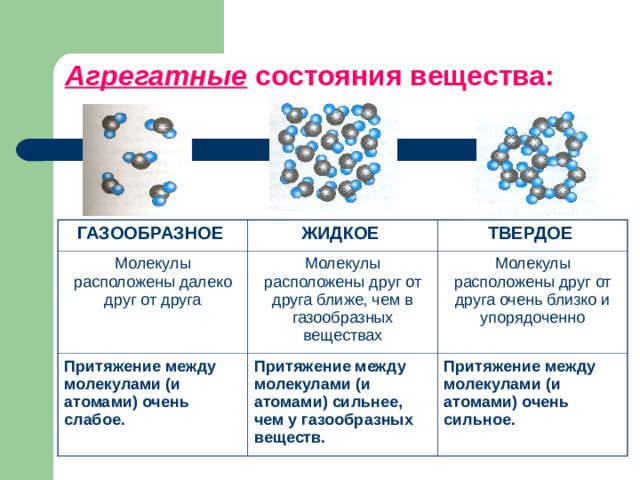

 [[matcher-1]]","widgets":{"matcher-1":{"type":"matcher","labels":["Твердое","Жидкое","Газообразное"],"items":["вещество сохраняет объем и форму","вещество сохраняет объем, но не сохраняет форму","вещество не имеет собственной формы и постоянного объема","вещество не сохраняет объем, но сохраняет форму"]}}}]}
[[matcher-1]]","widgets":{"matcher-1":{"type":"matcher","labels":["Твердое","Жидкое","Газообразное"],"items":["вещество сохраняет объем и форму","вещество сохраняет объем, но не сохраняет форму","вещество не имеет собственной формы и постоянного объема","вещество не сохраняет объем, но сохраняет форму"]}}}]}