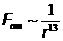ВЗАИМОДЕЙСТВИЕ МОЛЕКУЛ. | ||||||
Впервые подробно — Я.Д. Ван-дер-Ваальс (Голландия). Природа сил — электромагнитная. Силы короткодействующие |
| |||||
Зависимость от расстояния:
|
| |||||
Проекции На расстоянии r0 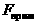 = = 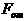 . При r<r0 — отталкивание, при r>r0 — притяжение. Утолщенный участок — выполнение закона Гука (малые деформации). . При r<r0 — отталкивание, при r>r0 — притяжение. Утолщенный участок — выполнение закона Гука (малые деформации). |
| |||||
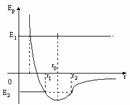
На рисунке — график зависимости потенциальной энергии от расстояния. При Eполн=E1: если частица движется справа налево из бесконечности, то в точке r0потенциальная энергия минимальна. В точке r1 полная энергия равна потенциальной энергии отталкивания, а кинетическая энергия равна нулю — точка поворота. Дальше молекула движется в положительном направлении оси |
| |||||
При Eполн=E2<0 молекула находится в потенциальной яме между точками поворота r2 и r3. Молекулы совершают колебания около друг друга. |
| |||||
СВОЙСТВА ТВЕРДЫХ, ЖИДКИХ И ГАЗООБРАЗНЫХ ТЕЛ. | ||||||
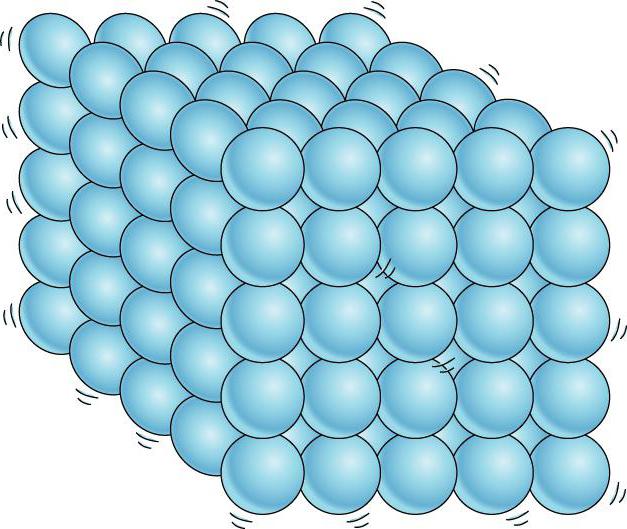
Состояние вещества. | Расположение частиц. | Характер движения частиц. | Соотношение между кинетической энергией молекул и потенциальной энергией межмолекулярного взаимодействия. | Некоторые свойства. | ||
Твердое. | Расстояния сравнимы с размерами частиц. Истинно твердые тела имеют кристаллическую структуру (дальний порядок упорядоченности). | Колебания около положения равновесия. | Потенциальная много больше кинетической. Силы взаимодействия большие. | Сохраняют форму и объем. Упругость. Прочность. Твердость. Имеют определенную точку плавления и кристаллизации. | ||
Жидкое | Расположены почти вплотную друг к другу. Наблюдается ближний порядок упорядоченности. | В основном колеблются около положения равновесия, изредка перескакивая в другое. С повышением температуры время оседлой жизни уменьшается. | Кинетическая энергия лишь незначительно меньше по модулю потенциальной энергии. | Сохраняют объем, но не сохраняют форму. Мало сжимаемы. Текучи. | ||
Газообраз-ное. | Расстояния много больше размеров частиц. Расположение совершенно хаотическое. | Хаотическое движение с многочисленными столкновениями. Скорости сравнительно большие. | Кинетическая энергия много большепотенциальной по модулю. | Не сохраняют ни форму, ни объем. Легко сжимаемы. Заполняют весь предоставленный им объем. | ||
Как расположены частицы в твердых телах, жидкостях и газах?
В этом материале не только рассказано о том, как расположены частицы в твердых телах, но и как движутся они в газах или в жидкостях. Также будут описаны виды кристаллических решеток в различных веществах.
Агрегатное состояние
Существуют определенные стандарты, указывающие на наличие трех типичных агрегатных состояний, а именно: твердое вещество, жидкость и газ.
Определим составляющие для каждого агрегатного состояния.
- Твердые вещества практически стабильны по объему и форме. Последнюю изменить крайне проблематично без дополнительных энергетических затрат.
- Жидкость может легко менять форму, но при этом сохраняет объем.
- Газообразные вещества не сохраняют ни форму, ни объем.
Главным критерием, по которому определяется агрегатное состояние, является расположение молекул и способы их движения. В газообразном веществе минимальное расстояние между отдельно взятыми молекулами значительно больше их самих. В свою очередь, молекулы жидких веществ не расходятся на большие расстояния в обычных для них условиях и сохраняют свой объем. Действующие частицы в твердых телах располагаются в строго определенном порядке, каждая из них, подобно маятнику часов, движется около определенной точки в кристаллической решетке. Это придает твердым веществам особенную прочность и жесткость.
Поэтому в данном случае наиболее актуален вопрос, как расположены действующие частицы в твердых телах. Во всех остальных случаях атомы (молекулы) не имеют настолько упорядоченной структуры.
Особенности жидкости
Необходимо обратить особое внимание на то, что жидкости являются своеобразным промежуточным звеном между твердыми состоянием тела и его газообразной фазой. Так, при понижении температуры жидкость затвердевает, а при повышении ее выше, чем точка кипения данного вещества, переходит в газообразное состояние. Однако жидкость имеет общие черты и с твердыми, и с газообразными веществами. Так, в 1860 году выдающийся отечественный ученый Д. И. Менделеев установил существование так называемой критической температуры – абсолютного кипения. Это такое значение, при котором исчезает тонкая граница между газом и веществом в твердом состоянии.
Следующий критерий, объединяющий два соседних агрегатных состояния, – изотропность. В данном случае их свойства одинаковы на всех направлениях. Кристаллы, в свою очередь, анизотропны. Подобно газам, жидкости не имеют фиксированной формы и занимают полностью объем сосуда, в котором находятся. То есть они обладают низкой вязкостью и высокой текучестью. Сталкиваясь между собой, микрочастицы жидкости или газа совершают свободные перемещения. Раньше считалось, что в объеме, занимаемом жидкостью, упорядоченного движения молекул нет. Таким образом, жидкость и газ противопоставлялись кристаллам. Но в результате последующих исследований было доказано сходство между твердыми и жидкими телами.
В жидкой фазе при температуре, близкой к затвердеванию, тепловое движение напоминает движение в твердых телах. В этом случае жидкость все же может иметь определенную структуру. Поэтому, давая ответ на такой вопрос, как расположены частицы в твердых телах в жидкостях и газах, можно сказать, что в последних движение молекул хаотичное, неупорядоченное. а вот в твердых веществах молекулы занимают в большинстве случаев определенное, фиксированное положение.
Жидкость при этом является своеобразным промежуточным звеном. Причем чем ближе ее температура к кипению, тем больше молекулы движутся как в газах. Если же температура ближе к переходу в твердую фазу, то микрочастицы начинают двигаться все более и более упорядоченно.
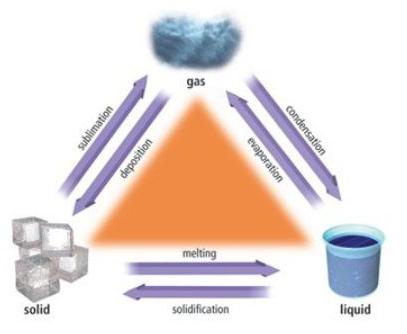
Изменение состояния веществ
Рассмотрим на самом простом примере изменение состояния воды. Лед – это твердая фаза воды. Температура его — ниже нуля. При температуре, равной нулю, лед начинает таять и превращается в воду. Это объясняется разрушением кристаллической решетки: при нагревании частицы начинают двигаться. Температура, при которой вещество изменяет агрегатное состояние, называется точкой плавления (в нашем случае у воды она равна 0). Заметим, что температура льда будет оставаться на одном уровне до полного его плавления. При этом атомы или молекулы жидкости будут двигаться так же, как в твердых телах.
После этого продолжим нагревать воду. Частицы при этом начинают двигаться интенсивнее до тех пор, пока наше вещество не достигнет следующей точки изменения агрегатного состояния – точки кипения. Такой момент наступает при разрыве связей между образующими ее молекулами за счет ускорения движения — тогда оно приобретает свободный характер, и рассматриваемая жидкость переходит в газообразную фазу. Процесс трансформации вещества (воды) из жидкой фазы в газообразную называется кипением.
Температуру, при которой вода закипает, называют точкой кипения. В нашем случае это значение равно 100 градусов по Цельсию (температура зависима от давления, нормальное давление составляет одну атмосферу). Заметим: пока существующая жидкость целиком и полностью не превратится в пар, температура ее остается постоянной.
Возможен и обратный процесс перехода воды из газообразного состояния (пара) в жидкость, который называется конденсация.
Далее можно наблюдать процесс замерзания — процесс перехода жидкости (воды) в твердую форму (исходное состояние описано выше – это лед). Описанные ранее процессы позволяют получить прямой ответ на то, как расположены частицы в твердых телах, в жидкостях и газах. Расположение и состояние молекул вещества зависит от его агрегатного состояния.
Что такое твердое тело? Как в нем ведут себя микрочастицы?
Твердое тело – это состояние материальной среды, отличительная особенность которого заключается в сохранении постоянной формы и постоянном характере теплового движения микрочастиц, совершающих незначительные колебания. Тела могут находиться в твердом, жидком и газообразном состоянии. Есть еще и четвертое состояние, которое современные ученые склонны относить к числу агрегатных — это так называемая плазма.
Итак, в первом случае любое вещество, как правило, имеет постоянную неизменную форму, и на это оказывает ключевое воздействие то, как расположены частицы в твердых телах. На микроскопическом уровне видно, что атомы, из которых состоит твердое тело, соединены друг с другом химическими связями и находятся в узлах кристаллической решетки.
Но есть и исключение — аморфные вещества, которые находятся в твердом состоянии, но наличием кристаллической решетки не могут похвастаться. Именно отталкиваясь от этого и можно дать ответ на то, как расположены частицы в твердых телах. Физика в первом случае указывает на то, что атомы или молекулы находятся в узлах решетки. А вот во втором случае подобной упорядоченности уж точно нет, и такое вещество более похоже на жидкость.
Физика и возможное строение твердого тела
В этом случае вещество стремится сохранить свой объем и, конечно же, форму. То есть для того, чтобы изменить последнюю, необходимо приложить усилия, и не имеет значения, металлический ли это предмет, кусок пластика или пластилин. Причина заключается в его молекулярном строении. А если точнее выразиться, во взаимодействии молекул, из которых состоит тело. Они в данном случае расположены наиболее близко. Такое расположение молекул носит повторяющийся характер. Именно поэтому силы взаимного притяжения между каждым из таких компонентов очень велики.
Взаимодействие микрочастиц объясняет характер их движения. Форму или объём подобного твердого тела скорректировать в ту или иную сторону очень трудно. Частицы твердого тела неспособны хаотично двигаться по всему объему твердого тела, а могут лишь колебаться возле определенной точки пространства. Молекулы твердого тела колеблются хаотично в разные стороны, но натыкаются на себе подобные, которые возвращают их в первоначальное состояние. Именно поэтому частицы в твердых телах располагаются, как правило, в строго определенном порядке.
Частицы и их расположение в твердом теле
Твердые тела могут быть трех видов: кристаллические, аморфные и композиты. Именно химический состав влияет на расположение частиц в твердых телах.
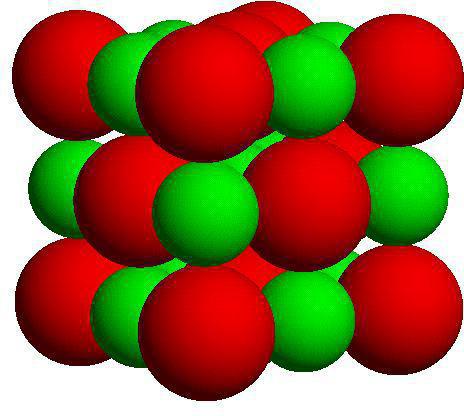
Кристаллические твердые тела обладают упорядоченной структурой. Их молекулы или атомы образуют кристаллическую пространственную решетку правильной формы. Таким образом, твердое тело, находящееся в кристаллическом состоянии, имеет определенную кристаллическую решетку, которая, в свою очередь, задает определенные физические свойства. Это и есть ответ на то, как расположены частицы в твердом теле.
Приведем пример: много лет назад в Петербурге на складе хранился запас белых блестящих оловянных пуговиц, которые при понижении температуры потеряли свой блеск и из белых стали серыми. Пуговицы рассыпались в серый порошок. «Оловянная чума» — так назвали эту «болезнь», но на самом деле это была перестройка структуры кристаллов под воздействием низкой температуры. Олово при переходе из белой разновидности в серую рассыпается в порошок. Кристаллы, в свою очередь, делятся на моно- и поликристаллы.
Монокристаллы и поликристаллы
Монокристаллы (поваренная соль) – это одиночные однородные кристаллы, представленные непрерывной кристаллической решеткой в форме правильных многоугольников. Поликристаллы (песок, сахар, металлы, камни) – это кристаллические тела, которые срослись из мелких, хаотично расположенных кристаллов. В кристаллах наблюдается такое явление, как анизотропия.
Аморфность: особый случай
Аморфные тела (смола, канифоль, стекло, янтарь) не имеют четкого строгого порядка в расположении частиц. Это нестандартный случай того, в каком порядке находятся частицы в твердых телах. В данном случае наблюдается явление изотропии, физические свойства аморфных тел одинаковы по всем направлениям. При высоких температурах они становятся подобны вязким жидкостям, а при низких — похожи на твердые тела. При внешнем воздействии одновременно обнаруживают упругие свойства, то есть при ударе раскалываются на миниатюрные частицы, как твердые тела, и текучесть: при длительном температурном воздействии начинают течь, как жидкости. Не имеют определенных температур плавления и кристаллизации. При нагревании аморфные тела размягчаются.
Примеры аморфных веществ
Возьмем, например, обыкновенный сахар и выясним расположение частиц в твердых телах в различных случаях на его примере. В этом случае один и тот же материал может встречаться в кристаллическом или аморфном виде. Если расплавленный сахар застывает медленно, молекулы образуют ровные ряды – кристаллы (кусковой сахар, или сахарный песок). Если расплавленный сахар, например, вылить в холодную воду, остывание произойдет очень быстро, и частицы не успеют сформировать правильные ряды — расплав затвердеет, не образуя кристаллов. Так получается сахарный леденец (это и есть некристаллический сахар).
Но через некоторое время такое вещество может перекристаллизоваться, частицы собираются в правильные ряды. Если сахарный леденец полежит несколько месяцев, он начнет покрываться рыхлым слоем. Так появляются на поверхности кристаллы. Для сахара сроком будет несколько месяцев, а для камня – миллионы лет. Уникальным примером может служить углерод. Графит – это кристаллический углерод, структура его слоистая. А алмаз – это самый твердый на земле минерал, способный резать стекло и распиливать камни, его применяют для бурения и полировки. В этом случаи вещество одно – углерод, но особенность заключается в способности образовывать разные кристаллическые формы. Это еще один вариант ответа на то, как расположены частицы в твердом теле.
Итоги. Заключение
Строение и расположение частиц в твердых телах зависит от того, к какому виду принадлежит рассматриваемое вещество. Если вещество кристаллическое, то расположение микрочастиц будет носить упорядоченный характер. Аморфные структуры такой особенностью не обладают. А вот композиты могут принадлежать как к первой, так и ко второй группе.
В одном случае жидкость себя ведет аналогично твердому веществу (при низкой температуре, которая близка к температуре кристаллизации), но может вести и как газ (при ее повышении). Поэтому в данном обзорном материале было рассмотрено, как расположены частицы не только в твердых телах, а и в прочих основных агрегатных состояниях вещества.
Жидкости ближний порядок расположения молекул
В жидком агрегатном состоянии, характеризующемся соизмеримостью энергии межмолекулярного взаимодействия и теплового движения молекул, наблюдается значительная плотность упаковки молекул, близкая к плотности упаковки молекул в твердых веществах, высокое сопротивление объемному сжатию и способность сохранять свою форму при определенных условиях, как, например, в условиях невесомости или при высокой дисперсности (каили тумана) и др. Жидкости легко принимают форму сосуда, в который их помещают. В пих наблюдается только ближний порядок расположения молекул.Ранее считалось, что молекулы в жидкости расположены беспорядочно по-отношению друг к другу. Однако рентгенографические исследования показали,, что в весьма малых областях жидкости имеется определенный порядок расположения молекул. Принято считать, что структура жидкости характеризуется ближним порядком в отличие от кристаллов, которым свойственен дальний порядок. При этом следует учитывать, что области с квазикристаллическим порядком в жидкости во времени не постоянны, — возникнув в одном месте и просуществовав очень недолго, они распадаются и образуются в другом месте.
Таким образом, особенность структуры жидкости состоит в том, что отсутствует дальний, но присутствует ближний порядок расположения частиц. Проявление ближнего порядка заключается в том, что молекулы, расположенные в первой сфере окружения данной молекулы, в большей мере задерживаются около нее и, таким образом, определяют некоторую упорядоченность.
Принимается, что дальнодействующих сил нет и, следовательно, можно ограничиться учетом взаимодействия между молекулами, расположенными в непосредственной близости друг от друга. Среднее состояние каждой молекулы считается зависящим только от состояния ближайших ее соседей. Тем самым в известной мере снимается необходимость учета различий в распределениях молекул, удаленных друг от друга. Отличия кристалла (дальний порядок) от жидкости (ближний порядок) в этой модели сравнительно несущественны. [c.317]
На рис. 1.2 приведен результат такой обработки. Резул >-таты математического эксперимента (кривая 1) для различных значений чисел контактов Мк = Ъ 6 7 8 9 10 и 11 дают наиболее вероятное и среднее значение Л7к = 8 оно оказывается таким же, как и для регулярной ромбоэдрической укладки с е = 0,395. По-видимому, аналогично тому, как в реальной жидкости имеется так называемый ближний порядок в расположении соседних молекул, так и в нерегулярно насыпанном
Жидкие и твердые вещества характеризуются определенной аморфной или кристаллической решеткой. Аморфная решетка характеризуется наличием близкого порядка в расположении атомов, ионов или молекул, а кристаллическая — близкого и дальнего порядка. Ближний порядок определяется тем, что в пределах радиуса ионов, атомов или молекул образуется устойчивая (для твердого тела) и малоустойчивая (жидкости), среднестатистического состава и строения пространственная фигура. В этой пространственной фигуре можно выделить центральную частицу (атом, ион, молекулу) и частицы из окружения, которые называют лигандами (ионы, атомы или молекулы).
Жидкости и жидкие растворы обладают элементами кристаллической структуры они имеют промежуточную структуру между газом и твердым веществом. В жидкостях сохраняется так называемый ближний порядок в расположении молекул, который имеет статистический характер. Молекулы в жидкости, как и в газе, находятся в хаотическом тепловом движении. Каждая молекула окружена другими молекулами, находящимися в среднем во времени, на некоторых преимущественных расстояниях от нее. Для более удаленных молекул эти преимущественные расстояния постепенно исчезают.
Подобно твердому телу жидкость обладает определенной структурой. Например, структура жидкой воды напоминает структуру льда. Молекулы НаО также соединены друг с другом посредством водородных связей, и для большинства молекул сохраняется тетраэдрическое окружение. Однако в отличие от льда в жидкой воде проявляется лишь ближний порядок — за счет изгиба и растяжения водородных связей относительное расположение тетраэдрических комплексов оказывается неупорядоченным. Кроме того, вследствие перемещения молекул часть водородных связей разрывается и состав комплексов постоянно меняется. Непрерывное перемещение частиц определяет сильно выраженную самодиффузию жидкости и ее текучесть.
Следует отметить, что дальний и ближний порядок существует не только во взаимном расположении молекул или атомов, но и в ориентации их. По этому признаку отличают координационный порядок от ориентационного порядка, характерного для некоторых жидкостей и твердых тел. [c.11]
Правильное расположение частиц в идеальном кристалле сохраняется во всей кристаллической решетке — в кристаллах существует дальний порядок. В жидкости упорядоченное расположение частиц в какой-то мере сохраняется только в ближайшем окружении рассматриваемой молекулы, т, е. для жидкостей характерен ближний порядок (более или менее нарушенный). В том случае, когда кристаллизация требует значительной переупаковки частиц, ее достижение затруднено. Это обусловливает возможность переохлаждения жидкости, т. е. охлаждения ее до температуры ниже температуры плавления.
В отличие от кристаллов, в жидкостях при практически той же средней плотности распределения вещества дальний порядок отсутствует. Есть только ближний порядок, т. е. правильность расположения молекул или атомов в непосредственной близости от данной центральной молекулы, резко нарушающаяся с расстоянием. Такой ближний порядок, как и дальний порядок в кристаллах, может быть количественно изучен с помощью современных методов структурного анализа — по дифракции рентгеновских лучей или электронных пучков с длиной волны, соизмеримой с межмолекулярными расстояниями. [c.171]
Первая, являясь скалярной величиной, представляет собой количество энергии, требующееся для получения единицы новой поверхности. Поверхностное натяжение численно равно силе, необходимой для образования единицы площади поверхности. Обе эти величины равны друг другу для жидкости, но не равны для твердого тела. Причина такого различия состоит в том, что в жидкости упорядоченность расположен
Модель соединения атомов в молекулы / Habr
Предыдущая публикация получила отрицательную оценку с формулировкой «зачем здесь размещать столь элементарные вещи». Поэтому я сразу предупреждаю, что данный материал предназначен, в первую очередь, для школьников, начинающих изучать химию. А также для тех, кому этот предмет был непонятен в школьные годы. Я бы поместил статью на популярном специализированном ресурсе для школьников, если бы он существовал.И да, я в курсе существования модели атома, в которой электрон представляет собой волну вероятности, расположенную вблизи ядра. Но школьнику, как правило, трудно представить себе то, как вероятность может соединять атомы в молекулы. Поэтому излагаю «на пальцах».
Соединение атомов в молекулы
Наш мир не существует в виде отдельных атомов, они каким-то образом соединяются друг с другом. Каким именно?
Возьмем два атома водорода. Каждый из них содержит по одному протону и по одному электрону, поэтому суммарный заряд каждого из этих атомов равен нулю.
Закон Кулона
F = k*q1*q2/r^2
говорит нам, что нейтральные тела не должны притягиваться друг к другу
(q1 = 0, q2 = 0).
А значит, водород (и любой другой химический элемент) должен существовать только в виде атомов, и никогда не соединяться в молекулы. На самом же деле атомы водорода всегда соединяются попарно. Почему?
Давайте возьмем два отрезка металла, и расположим их параллельно на небольшом расстоянии друг от друга.
Оба отрезка содержат одинаковое количество протонов и электронов, следовательно, суммарный заряд каждого из них равен нулю. А значит, они не имеют причин для взаимного притяжения.
Мы знаем, что в металлах часть внешних электронов покидает свои атомы и свободно гуляет между ионами (покинутыми атомами) кристаллической решетки металла. И распределены эти электроны, в среднем, равномерно.
Представьте себе, что нам удалось каким-то образом переместить часть этих свободных электронов в левую часть нижнего отрезка металла. При этом в его правой части окажется дефицит электронов.
Мы получили так называемый диполь: левая часть отрезка заряжена отрицательно, правая – положительно. Отлично. А что будет происходить в верхнем отрезке? Мы знаем, что одноименные заряды отталкиваются друг от друга, а противоположные — притягиваются. Следовательно, электроны верхнего отрезка, отталкиваясь от электрических полей электронов нижнего отрезка, уйдут в правую часть. То есть, картина распределения электронов в этих двух отрезках металлов станет зеркальной:
Такое влияние заряженных предметов на соседние предметы, приводящее к перераспределению зарядов в них, называется электростатической индукцией.
Теперь самое интересное: положительно заряженные ядра атомов в левой части верхнего отрезка оказались напротив электронов, собранных в левой части нижнего отрезка. А противоположные заряды притягиваются. Значит, левые части отрезков начнут притягиваться друг к другу!
То же самое будет происходить в правой части отрезков – только зеркально. И правые концы отрезков также будут притягиваться друг к другу. Чудесно, не так ли? Перераспределение зарядов внутри одного из отрезков проводников, привело к взаимному притяжению этих двух отрезков!
А что произойдет, если теперь переместить свободные электроны нижнего отрезка в его правый конец? Тогда свободные электроны верхнего отрезка переместятся в левый конец. То есть, перемещая электроны туда – сюда в одном из отрезков, мы заставляем перемещаться электроны соседнего отрезка, никак не связанного с первым! Такое влияние перемещения электронов в одном проводнике на перемещение электронов в соседнем проводнике называется электродинамической индукцией.
Хотя это и не относится к нашей теме, отметим, что мы с вами в несколько упрощенном виде изучили, как работает антенна и приемник при радиопередаче.
Мы можем расположить эти два отрезка металла иначе – торцами друг к другу:
Если мы сумеем переместить электроны, допустим, в правую часть левого отрезка, электроны правого отрезка, отталкиваясь от них, также переместятся в правую часть правого отрезка:
И в этом случае эти два отрезка металла начнут притягиваться друг к другу, так как их ближние концы имеют противоположный заряд. Следует особо обратить внимание на то, что во втором варианте расположения отрезков, сила их взаимного притяжения будет слабее, так как притягиваются только их встречные торцы, в то время, как при первом варианте расположения отрезков, притягивались друг к другу как левые, так и правые концы.
Но как это относится к соединению атомов? Давайте посмотрим на атом водорода. В нем имеется электрон, перемещающийся вокруг ядра. И если рядом окажется второй атом водорода, этот электрон заставит электрон соседа перемещаться примерно так же, как они перемещались в наших отрезках металла – пока электрон одного из атомов находится с одной стороны ядра своего атома, соседний будет вынужден находиться с противоположной стороны своего атома.
Здесь, разумеется, влияние не одностороннее, а взаимное – как первый электрон влияет на второй, так и второй влияет на первый. Но самое главное в том, что эти два атома будут притягиваться точно так же, как притягивались два куска металла во втором варианте их взаимного размещения (торцами друг к другу).
Суть такая же: электроны держатся подальше друг от друга, позволяя разноименным зарядам притягиваться друг к другу. Представьте себе, что электрон одного из атомов оказался между ядрами двух соседних атомов, в то время, когда электрон соседнего атома находился в противоположной, удаленной точке орбиты:
Теперь у нас есть отрицательно заряженный электрон, находящийся между двумя положительно заряженными ядрами атомов. Ядра обоих атомов притягиваются к этому электрону. Таким образом, электрон в данный момент связывает два атома.
Расстояние между ядрами атомов больше, чем расстояние от каждого из ядер до электрона, находящегося между ними. А мы помним, что сила взаимодействия зарядов обратно пропорциональна квадрату расстояния между ними. Поэтому, в данный момент, сила притяжения ядер к электрону больше, чем взаимное отталкивание ядер.
Но электроны постоянно перемещаются, и поэтому через некоторое время первый электрон покидает место между ядрами, зато туда перемещается второй электрон. В этот момент роль связующего переходит электрону второго атома (момент 3 на рисунке ниже).
Заметим, что в моменты времени, показанные на рисунках 2 и 4, между ядрами атомов нет электронов. В эти моменты ядра отталкиваются друг от друга. По этой причине расстояние между атомами колеблется — постоянно меняется в процессе вращения электронов вокруг ядер, но сохраняется ее средняя длина, называемая длиной связи. Длина связи – расстояние между ядрами атомов — индивидуальна для каждой пары видов атомов, объединенных в молекулу.
Электроны этих двух атомов в образовавшейся молекуле водорода стараются находиться как можно дальше друг от друга так же, как они делали это в отрезках металлов. За счет этого происходит их синхронизация – их расположение относительно друг друга на каждом обороте вокруг ядер примерно одинаково.
Это несколько напоминает коллективное исполнение вальса, когда пары вращаются с одинаковой скоростью таким образом, чтобы ни дамы, ни кавалеры никогда не оказывались рядом друг с другом, а всегда чередовались:
Данная статья — выдержка из книги «Понятная химия».
Святая Неопределенность и Святая Вероятность
Квантовая теория утверждает, что невозможно одновременно определить точное место электрона в пространстве и его импульс (направление и скорость его движения). Поэтому считается, что вокруг ядра атома существуют некие места (области), в которых вероятность обнаружить электрон высока. Эти области и называют орбиталями электронов.
Эту теорию нетрудно объяснить на бытовом примере. Допустим, вы живете в квартире, в которой есть спальня кухня и санузел. Если вы 90% времени проводите в спальне, 8% времени – на кухне, и 2% времени в санузле, то вашей орбиталью можно считать спальню и кухню, так как вероятность обнаружить вас в санузле очень низкая. Проведя 100 наблюдений за вами в разные моменты времени, наблюдатель, скорее всего, обнаружит вас в 90 случаях в спальне, и в 8 случаях – на кухне. И по этим цифрам придет к выводу об ареале вашего обитания.
Теперь о том, почему невозможно одновременно определить место электрона в пространстве и его скорость, и направление движения. Тут еще проще. Дело в том, что скорость можно измерить только на некотором отрезке пройденного пути. Разделив длину этого отрезка на время, за которое он пройден, мы можем узнать скорость движения. Но ведь мы не можем считать местом расположения тела отрезок пространства. Место – это точная координата тела.
Представьте себе, что в темной комнате летает муха. Осветив комнату очень короткой вспышкой света, мы можем увидеть место, в котором муха находится в данный момент. Но чтобы понять то, куда и с какой скоростью она летит, нам придется включить свет на более длительное время. Тогда мы увидим изменение положения мухи с течением времени и сможем оценить скорость этого изменения. Но в этом случае мы уже не можем указать точное место, в котором муха находилась во время измерения ее скорости, так как за это время она переместилась на некоторое расстояние. Вот и весь смысл принципа неопределенности.
Электроны, перемещающиеся вокруг ядер атомов, очень быстро меняют скорость и направление движения, поэтому невозможно сказать точно, где они находятся в данный момент времени и куда движутся.
А в модели, рассмотренной выше, электроны движутся, как стрелки в часах. И это не может не вызвать праведного гнева адептов Святой Неопределенности и Святой Вероятности.
Однако то, что мы не можем точно сказать, где именно находится тот или иной электрон, и какому из атомов он «принадлежит» нисколько не меняет электростатического механизма связывания атомов. Невозможно связать два протона иначе, как разместив между ними электрон. Никакая вероятность или неопределенность не может соединить атомы в молекулу. И это отлично демонстрирует молекулярный ион водорода h3+. В этом ионе нет ни дублета электронов, ни компенсации спинов спаренных электронов, ни перекрытия электронных облаков, тем не менее, данный ион существует и он устойчив.
К тому же, не стоит забывать то, что это всего лишь модель, и ее «объяснительные» возможности ограничены, как и возможности любых других моделей. Например, она (вроде бы) не объясняет, почему атомы водорода не могут соединяться в длинные цепи типа h4, h5 и т.д.
Впрочем, можно предположить, что из-за того, что электронные орбитали в молекулах водорода смещены к центру молекулы, они не «высовываются» из ее концов, и поэтому соседние молекулы водорода не имеют возможности прицепиться друг к другу, используя механизм синхронизации электронов.
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. Молекулярная физика.
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. Молекулярная физика.
Молекулярная физика — это просто!
Силы взаимодействия молекул
Все молекулы вещества взаимодействуют между собой силами притяжения и отталкивания.
Доказательство взаимодействия молекул: явление смачивания, сопротивление сжатию и растяжению, малая сжимаемость твердых тел и газов и др.
Причина взаимодействия молекул — это электромагнитные взаимодействия заряженных частиц в веществе.
Как это объяснить?
Атом состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Заряд ядра равен суммарному заряду всех электронов, поэтому в целом атом электрически нейтрален.
Молекула, состоящая из одного или нескольких атомов, тоже электрически нейтральна.
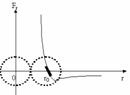
Рассмотрим взаимодействие между молекулами на примере двух неподвижных молекул.
Между телами в природе могут существовать гравитационные и электромагнитные силы.
Так как массы молекул крайне малы, ничтожно малые силы гравитационного взаимодействия между молекулами можно не рассматривать.
На очень больших расстояниях электромагнитного взаимодействия между молекулами тоже нет.
Но, при уменьшении расстояния между молекулами молекулы начинают ориентироваться так, что их обращенные друг к другу стороны будут иметь разные по знаку заряды (в целом молекулы остаются нейтральными), и между молекулами возникают силы притяжения.
При еще большем уменьшении расстояния между молекулами возникают силы отталкивания, как результат взаимодействия отрицательно заряженных электронных оболочек атомов молекул.
В итоге на молекулу действует сумма сил притяжения и отталкивания. На больших расстояниях преобладает сила притяжения (на расстоянии 2-3 диаметров молекулы притяжение максимально), на малых расстояниях сила отталкивания.
Существует такое расстояние между молекулами, на котором силы притяжения становятся равными силам отталкивания. Такое положение молекул называется положением устойчивого равновесия.
Находящиеся на расстоянии друг от друга и связанные электромагнитными силами молекулы обладают потенциальной энергией.
В положении устойчивого равновесия потенциальная энергия молекул минимальна.
В веществе каждая молекула взаимодействует одновременно со многими соседними молекулами, что также влияет на величину минимальной потенциальной энергии молекул.
Кроме того, все молекулы вещества находятся в непрерывном движении, т.е. обладают кинетической энергией.
Таким образом, структура вещества и его свойства (твердых, жидких и газообразных тел) определяются соотношением между минимальной потенциальной энергией взаимодействия молекул и запасом кинетической энергии теплового движения молекул.
Строение и свойства твердых, жидких и газообразных тел
Строение тел объясняется взаимодействием частиц тела и характером их теплового движения.
Твердое тело
Твердые тела имеют постоянную форму и объем, практически несжимаемы.
Минимальная потенциальная энергия взаимодействия молекул больше кинетической энергии молекул.
Сильное взаимодействие частиц.
Тепловое движение молекул в твердом теле выражается только лишь колебаниями частиц (атомов, молекул) около положения устойчивого равновесия.
Из-за больших сил притяжения молекулы практически не могут менять свое положение в веществе, этим и объясняется неизменность объема и формы твердых тел.
Большинство твердых тел имеет упорядоченное в пространстве расположение частиц, которые образуют правильную кристаллическую решетку.
Частицы вещества (атомы, молекулы, ионы) расположены в вершинах — узлах кристаллической решетки. Узлы кристаллической решетки совпадают с положением устойчивого равновесия частиц.
Такие твердые тела называются кристаллическими.
Жидкость
Жидкости имеют определенный объем, но не имеют своей формы, они принимают форму сосуда, в которой находятся.
Минимальная потенциальная энергия взаимодействия молекул сравнима с кинетической энергией молекул.
Слабое взаимодействие частиц.
Тепловое движение молекул в жидкости выражено колебаниями около положения устойчивого равновесия внутри объема, предоставленного молекуле ее соседями
Молекулы не могут свободно перемещаться по всему объему вещества, но возможны переходы молекул на соседние места. Этим объясняется текучесть жидкости, способность менять свою форму.
В жидкостях молекулы достаточно прочно связаны друг с другом силами притяжения, что объясняет неизменность объема жидкости.
В жидкости расстояние между молекулами равно приблизительно диаметру молекулы. При уменьшении расстояния между молекулами (сжимании жидкости) резко увеличиваются силы отталкивания, поэтому жидкости несжимаемы.
По своему строению и характеру теплового движения жидкости занимают промежуточное положение между твердыми телами и газами.
Хотя разница между жидкостью и газом значительно больше, чем между жидкостью и твердым телом. Например, при плавлении или кристаллизации объем тела изменяется во много раз меньше, чем при испарении или конденсации.
Газ
Газы не имеют постоянного объема и занимают весь объем сосуда, в котором они находятся.
Минимальная потенциальная энергия взаимодействия молекул меньше кинетической энергии молекул.
Частицы вещества практически не взаимодействуют.
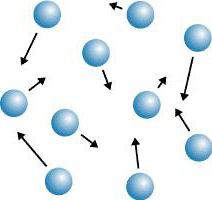
Газы характеризуются полной беспорядочностью расположения и движения молекул.
Расстояние между молекулами газа во много раз больше размеров молекул. Малые силы притяжения не могут удержать молекулы друг около друга, поэтому газы могут неограниченно расширяться.
Газы легко сжимаются под действием внешнего давления, т.к. расстояния между молекулами велики, а силы взаимодействия пренебрежимо малы.
Давление газа на стенки сосуда создается ударами движущихся молекул газа.
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. — Взаимодействие молекул. Строение твердых тел, жидкостей и газов. — Идеальный газ. Основное уравнение МКТ. — Температура. Тепловое равновесие. Абсолютная шкала температур. — Уравнение состояния идеального газа. — Изопроцессы. Газовые законы. — Взаимные превращения жидкостей и газов. Влажность воздуха. — Твердые тела. Кристаллические тела. Аморфные тела.
Молекулярная структура вещества. Основные положения
Все вещества состоят из движущихся и взаимодействующих между собой атомов и молекул.
Простые вещества состоят из одинаковых атомов, сложные — из атомов различных химических элементов. Атом — наименьшая часть химического элемента, являющаяся носителем его свойств.
В центре атома находится положительно заряженное ядро, вокруг которого движутся отрицательно заряженные электроны, притягивающиеся к положительно заряженному ядру силами электромагнитного взаимодействия.
Главной характеристикой химического элемента является заряд ядра атома.
Z — зарядовое число ядра, равное числу протонов в ядре, совпадает с порядковым номером химического элемента в периодической системе химических элементов Д. И. Менделеева.
Атом электронейтрален: положительный заряд (+Ze) ядра компенсируется отрицательным зарядом (-Ze) электронов.
Кроме протонов, в ядре атомов содержатся нейтроны, связанные с протонами сильным взаимодействием. Общее название протонов и нейтронов, входящих в состав ядра, — нуклоны.
Массовое число А равно числу нуклонов в ядре (суммарное число протонов Z и нейтронов N):
Изотоп — разновидность одного и того же химического элемента, атом которого содержит одинаковое число протонов в ядре и разное число нейтронов.
В условном обозначении изотопа химического элемента указываются массовое число А и зарядовое число Z:
Масса атома меньше суммарной массы частиц, входящих в его состав.
Дефект массы — разность суммарной массы отдельных частиц, входящих в состав атома (ядра), и полной массы атома (ядра):
Дефект массы обусловливается выделением энергии ΔЕ при образовании атома:
Атомная единица массы (а.е.м.) — средняя масса нуклона в атоме углерода 126С.
Атомная единица массы равна 1/12 массы атома углерода 126С.
Относительная масса атома Мr — число атомных единиц массы, содержащихся в массе атома:
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной массе атома.
Молярная масса — масса одного моля.
Единица молярной массы — килограмм на моль (кг/моль). Постоянная Авогадро — число атомов (или молекул) в одном моле любого вещества:
Молярная масса вещества
Существует четыре агрегатных состояния (или фазы) вещества: твердое, жидкое, газообразное, плазменное.
Фазовый переход — переход системы из одного агрегатного состояния в другое. При фазовом пере
ходе скачкообразно изменяется какая-либо физическая величина (например, плотность, внутренняя энергия) или симметрия системы. Вещество находится в твердом состоянии, если средняя потенциальная энергия притяжения молекул много больше их средней кинетической энергии.
Молекулы в твердом теле располагаются упорядоченно.
Жидкое состояние образуется, если средняя потенциальная энергия притяжения молекул соизмерима с их средней кинетической энергией. Упорядоченное расположение молекул наблюдается в жидкости лишь в пределах нескольких соседних молекулярных слоев.
Вещество находится в газообразном состоянии, если средняя кинетическая энергия молекул превышает среднюю потенциальную энергию их взаимодействия. Молекулы газа движутся хаотически. Условия идеальности газа:
1) диаметр молекул много меньше среднего расстояния между ними;
2) средняя кинетическая энергия молекул много больше средней потенциальной энергии их взаимодействия;
3) молекулы взаимодействуют между собой и со стенками упруго. Плазма — электронейтральная совокупность нейтральных и заряженных частиц.
Ионизация — процесс образования ионов из атомов.


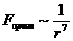 ;
;