Агрегатные состояния воды: лед, жидкость, газ, плазма
Вода — основа жизни и в природе она может находиться в трех основных состояниях: твёрдом, жидком и газообразном. Однако, искусственно можно создать условия, при которых вода переходит в состояние плазмы.

В этой статье мы разберем, почему вода может быть в жидком, твердом и газообразном состояниях, и при каких условиях меняются ее агрегатные состояния.
Жидкое состояние воды в природных условиях планеты Земля преобладает.
Твердое состояние воды
Вода в твердом состоянии – это лёд и снег. Некоторые не понимают, к какому агрегатному состоянию воды относится иней. Конечно, к твёрдому! Это мелкая ледяная крошка, замерзшие капли росы.
Твердая – это замороженная вода. Когда она замерзает, ее молекулы отодвигаются подальше друг от друга, делая лед менее плотным, чем жидкость, т.е. вода в твердом состоянии занимает больший объем, чем в жидком.
Большинство веществ при снижении температуры сжимается, а вода – расширяется, и в этом ее уникальная особенность.
Замерзает – это значит, что при 0 градусов Цельсия вода кристаллизуется и переходит из жидкого состояния в твердое. Наличие в воде солей снижает температуру замерзания.
На школьных олимпиадах встречается такой интересный вопрос: какой металл, находясь в расплавленном состоянии, может заморозить воду? Ответ – ртуть, которая начинает плавиться при температуре -39 градусов Цельсия. Понятно, что жидкая ртуть при температуре от -38 до 0 способна заморозить воду, отбирая у нее тепло.
Несмотря на то, что самое распространенное на нашей планете — жидкое состояние воды, значительная ее часть (2/3 всех пресноводных запасов) находится в замороженном виде. Площадь ледников – около 11% всей суши Земли.
Если жидкое состояние пресной воды переходит в твердое при 0 градусов Цельсия, то морская вода средней солености замерзает примерно при -1,8 градусах Цельсия.
Жидкое состояние воды
Вода в жидком состоянии встречается на нашей планете не только в реках и океанах. Облака состоят из крошечных капелек воды и кристалликов льда, и дождь – это тоже жидкая вода.
Также вода в жидком состоянии просачивается через почву и образует подземные водные горизонты, из которых черпается основная масса питьевой воды.

Вода в жидком состоянии отличается высокой прилипчивостью к различным твердым материям. Сама по себе она не является «влажной», но легко делает влажными большинство твердых материалов.
Жидкая вода легко переходит в твердое и газообразное состояние. Главным образом, это зависит от температуры. Но свою роль играет и давление.
Физический переход воды из жидкого состояния в газообразное называется испарением, потому что газообразное состояние воды называется паром.
Как жидкое состояние воды превращается в газообразное? Когда мы кипятим воду, она превращается из жидкости в газ, или водяной пар. Когда его часть остывает, мы видим небольшое облако, которое и называют паром. Хотя, если мы его видим, то это уже жидкое состояние воды, т.е. скопление ее микроскопических капелек.
Пар — это вода в газообразном состоянии, которое образуется, когда вода кипит или испаряется. Настоящий пар невидим; однако слово «пар» часто ошибочно относят к влажному пару, видимому туману, как аэрозолю водяных капель, образующихся при конденсации водяного пара.
И тут всплывает такое понятие, как «точка росы». Это температура воздуха, которая меняется в зависимости от давления и влажности, ниже которой водный пар начинает конденсироваться в водяные капли и образуется роса. Т.е. агрегатное состояние воды из газообразного состояния меняется на жидкое.
Закипает жидкая пресная вода при 100°C (градусах Цельсия) или 212°F (градусах Фарингейта), в условиях нормального атмосферного давления. Чем ниже давление (например, в горах), тем выше температура кипения.
Состояние газа
Итак, вода в газообразном состоянии – это пар. Утверждение, что большая часть воды в гидросфере находится в газообразном состоянии – не верно.
Не все хорошо себе представляют, в каком состоянии вода способна испаряться. Оказывается, вода в твердом состоянии испаряется так же, как и жидкая, только медленнее! Скорость испарения зависит от температуры. Т.е. в газообразное состояние вода может переходить прямо из твердого, минуя жидкое.

Испаренная с поверхности Земли вода в газообразном состоянии образует облака и тучи
Четвертое агрегатное состояние: плазма
Все знают, в каких трех состояниях вода находится в окружающей природе. Однако, ученые знают и четвертое состояние воды – плазму, которую называют гидроплазмой.
Водяной пар можно нагреть до такой температуры (2 200 -13 900°С, или 4 000- 25 000 ° F), что молекулы воды распадаются и получается просто смесь атомов водорода и кислорода в виде плазмы. Там динамически может присутствовать некоторое количество молекул воды, но всё равно эта смесь ионов и молекул будет водородно-кислородной плазмой.
Вообще плазма – это такое состояние вещества, которое настолько насыщено энергией, что от атомов отлетают электроны. Не говоря уже о разрушении молекулярных структур и кристаллических решеток.
Плазменное состояние воды в природе не встречается, однако оно всё больше интересует ученых в плане возобновляемых источников энергии. Очень заманчивая идея – получение из воды топлива в виде горючего водорода, который реагирует с кислородом и опять образует воду…
Как меняются агрегатные состояния
В принципе, агрегатное (физическое) состояние воды, как и любого другого вещества, зависит от температуры и давления. В природных условиях Земли возможны только три состояния веществ: твёрдое, жидкое и газообразное. Это и есть ответ на вопрос «в каких трех состояниях вода находится в природе».
Также теперь Вы знаете ответы на многие другие интересные вопросы типа «какой металл, находясь в расплавленном, т.е. жидком, состоянии, может заморозить воду, т.е. превратить ее в лёд» и т.п.
И Вы имеете понятие, в каком агрегатном состоянии может находиться вода в природе и в искусственных условиях.
«Почему вода жидкая?» – Яндекс.Кью
Сначала надо выяснить, что значит “жидкая”.
“Жидкий” — это состояние вещества, его ещё называют агрегатным. Жидкое вещество находится в состоянии, промежуточном между твёрдым и газообразным. Когда вещество жидкое, у него постоянный объём, но отсутствует постоянная форма (в твёрдом состоянии и объём, и форма постоянны, а в газообразном не постоянно ни то, ни другое).
Вода сразу приходит на ум, когда мы произносим слово “жидкость”, но мы прекрасно знаем, что вода может быть твёрдой (в виде льда) и газообразной (в виде пара). Когда вода тает, учёные говорят, что она переходит из твёрдого агрегатного состояния в жидкое. Мы знаем, что лед тает, когда становится теплее. Действительно, переход из одного агрегатного состояния в другое совершается под действием температуры. Для воды температура перехода из твёрдого состояния в жидкое (температура плавления) – это 0⁰С. Когда температура ниже нуля, вода существует в виде льда, когда выше – вода жидкая. Если температура достигнет +100⁰С , вода закипит и станет испаряться, то есть превратится в пар (иными словами, перейдёт в газообразное агрегатное состояние).
Как вода переходит из одного состояния в другое?
Всё дело в молекулах и их движении. Каждая молекула воды состоит из атомов (двух атомов водорода и одного атома кислорода). Ученые-химики договорились обозначать водород латинской буквой Н, а кислород – буквой О. Химическую формулу воды они записывают, соответственно, как Н2О.
Когда температура низкая, молекулы Н2О малоподвижны и организованы в строгом порядке, они находятся на равных расстояниях друг от друга, между ними существуют прочные связи и они не могут перемещаться, а только немного колеблются. Поэтому вода в твердом состоянии (то есть, лед) имеет определенную форму.
Но с повышением температуры до определенного уровня (до температуры плавления) подвижность молекул увеличивается, порядок нарушается. Молекулы в жидкости все так же связаны между собой, но не столь строго, как в твердом веществе, и они могут иногда перепрыгивать с места на место. Этим объясняются текучие свойства жидкости. На поверхности жидкости движущиеся молекулы иногда могут отрываться от неё., образуя пар. Этот процесс называется испарением, и он идёт тем быстрее, чем выше температура жидкости. Когда же температура достигнет точки кипения, связи между большинством молекул разорвутся, и уже не только единичные молекулы с поверхности, но постепенно вся жидкость перейдет в газообразное состояние.
Это может показаться удивительным, но плавиться и испаряться может не только вода, но и любое другое вещество. Только температура плавления и кипения у разных веществ разная. Например, при обычной температуре железо всегда твердое. Чтобы оно расплавилось (превратилось из твердого в жидкое), его нужно нагреть до температуры выше 1500 градусов. На заводах для этого устанавливают специальные огромные печи, которые очень долго разогревают, а потом никогда не тушат, чтобы температура в них не падала. Ну а чтобы железо стало из жидкого газообразным, понадобится почти 3000⁰С! Но при остывании до обычной температуры железо опять станет твердым.
Другой пример — кислород. В обычных условиях это газ, которым насыщен воздух. Но если температуру понизить до -183⁰, кислород станет жидким. А при температуре -219⁰ кислород станет твердым. Хорошо, что таких температур в обычных условиях на Земле не бывает, и кислород остается газом — ведь он так нужен всем живым существам для дыхания.
У воды в жидком состоянии есть две разные структуры | AB-NEWS
Ученые в Японии продемонстрировали, что вода в жидком состоянии имеет не одну, а две разные молекулярные структуры – одну тетраэдрическую и одну нететраэдрическую.
Это открытие, по их словам, может иметь значение для нашего понимания живых систем, которые полагаются на жидкую воду.
Вода является важнейшей жидкостью на Земле, поскольку она не только играет жизненно важную роль в живых системах, но также оказывает значительное влияние на нашу повседневную жизнь от различных промышленных применений до климатической системы Земли.
У нас очень насыщенная водой планета по сравнению с остальной частью Солнечной системы. Мы купаемся в воде, мы пьем воду и мы по большей части состоим из воды. Вся жизнь на Земле зависит от воды. Тем не менее, сама вода – старый добрый монооксид водорода – действительно необычный материал.
Например, у воды странная плотность. Большинство жидкостей становятся более плотными при охлаждении, в результате чего в твердом состоянии они более плотные, чем в жидком. Однако максимальную плотность вода достигает при температуре примерно 4 градуса по Цельсию.
По мере дальнейшего снижения температуры она становится менее плотной, поэтому в точке замерзания – около 0 градусов Цельсия – лед менее плотный, чем жидкая вода, и будет плавать на поверхности.
Кроме того, вода обладает необычно высоким поверхностным натяжением, уступая только жидкой ртути; ее точки плавления и кипения необычно высоки; и то, что в ней растворяется так много других химических веществ, также очень странно.
В 2018 году ученые из Великобритании и Японии продемонстрировали, что эти специфические свойства связаны с тетраэдрическим расположением молекул воды в жидкой форме. Это означает, что каждая молекула воды связана водородом с четырьмя другими в форме грубой пирамиды.
Смотрите также
Но все же, как упорядочена структура, она остается предметом обсуждения. Одна модель предполагает, что молекулярная структура воды является унимодальной – это тетраэдры по всей структуре. Другой предлагает, что структура может быть бимодальной, состоящей из двух фигур – тетраэдров и чего-то еще.
Чтобы попытаться решить эту проблему, ученые из Токийского Университета провели компьютерное моделирование, а также провели эксперименты с жидким кремнеземом, одной из немногих жидкостей, о которой известно, что она также имеет тетраэдрическую молекулярную структуру.
Эти эксперименты были основаны на дифракции рентгеновских лучей. То, как эти короткие волны рассеивают атомы в молекулах в жидкости, можно использовать для определения расположения этих молекул.
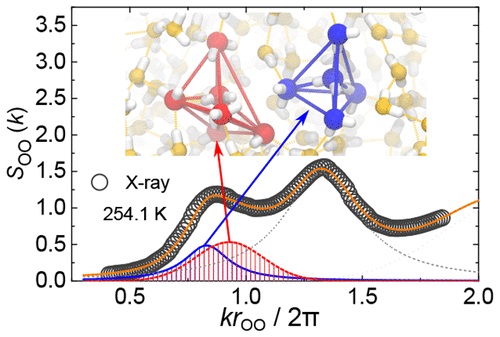 © University of Tokyo
© University of TokyoВ частности, ученые смотрели на пики в дифракции. И они обнаружили, что два перекрывающихся дифракционных пика были скрыты в том, что было похоже на первый дифракционный пик.
Один из этих пиков соответствовал расстоянию между атомами кислорода в обычных жидкостях. Исследователи смогли показать, что другой метод был более последовательным, поскольку в тетраэдрических молекулярных структурах расстояние между атомами кислорода больше
«Мы показываем первые четкие численные доказательства в структурном факторе динамического сосуществования двух типов локальных структур … подтверждающих описание жидкой воды в двух состояниях», – пишут исследователи в своей статье.
Полученные результаты не только дают жизненно важные подсказки для урегулирования давней полемики о структуре воды, но также позволяют прямой экспериментальный доступ к фракции тетраэдрических структур в жидкой воде.
Ученые считают, что открытие может иметь значение для молекулярной биологии, химии и фармакологии, а также для промышленного применения. Исследование было опубликовано в журнале Journal of the American Chemical Society.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
«Почему вода жидкая?» – Яндекс.Знатоки
Сначала надо выяснить, что значит “жидкая”.
“Жидкий” — это состояние вещества, его ещё называют агрегатным. Жидкое вещество находится в состоянии, промежуточном между твёрдым и газообразным. Когда вещество жидкое, у него постоянный объём, но отсутствует постоянная форма (в твёрдом состоянии и объём, и форма постоянны, а в газообразном не постоянно ни то, ни другое).
Вода сразу приходит на ум, когда мы произносим слово “жидкость”, но мы прекрасно знаем, что вода может быть твёрдой (в виде льда) и газообразной (в виде пара). Когда вода тает, учёные говорят, что она переходит из твёрдого агрегатного состояния в жидкое. Мы знаем, что лед тает, когда становится теплее. Действительно, переход из одного агрегатного состояния в другое совершается под действием температуры. Для воды температура перехода из твёрдого состояния в жидкое (температура плавления) – это 0⁰С. Когда температура ниже нуля, вода существует в виде льда, когда выше – вода жидкая. Если температура достигнет +100⁰С , вода закипит и станет испаряться, то есть превратится в пар (иными словами, перейдёт в газообразное агрегатное состояние).
Как вода переходит из одного состояния в другое?
Всё дело в молекулах и их движении. Каждая молекула воды состоит из атомов (двух атомов водорода и одного атома кислорода). Ученые-химики договорились обозначать водород латинской буквой Н, а кислород – буквой О. Химическую формулу воды они записывают, соответственно, как Н2О.
Когда температура низкая, молекулы Н2О малоподвижны и организованы в строгом порядке, они находятся на равных расстояниях друг от друга, между ними существуют прочные связи и они не могут перемещаться, а только немного колеблются. Поэтому вода в твердом состоянии (то есть, лед) имеет определенную форму.
Но с повышением температуры до определенного уровня (до температуры плавления) подвижность молекул увеличивается, порядок нарушается. Молекулы в жидкости все так же связаны между собой, но не столь строго, как в твердом веществе, и они могут иногда перепрыгивать с места на место. Этим объясняются текучие свойства жидкости. На поверхности жидкости движущиеся молекулы иногда могут отрываться от неё., образуя пар. Этот процесс называется испарением, и он идёт тем быстрее, чем выше температура жидкости. Когда же температура достигнет точки кипения, связи между большинством молекул разорвутся, и уже не только единичные молекулы с поверхности, но постепенно вся жидкость перейдет в газообразное состояние.
Это может показаться удивительным, но плавиться и испаряться может не только вода, но и любое другое вещество. Только температура плавления и кипения у разных веществ разная. Например, при обычной температуре железо всегда твердое. Чтобы оно расплавилось (превратилось из твердого в жидкое), его нужно нагреть до температуры выше 1500 градусов. На заводах для этого устанавливают специальные огромные печи, которые очень долго разогревают, а потом никогда не тушат, чтобы температура в них не падала. Ну а чтобы железо стало из жидкого газообразным, понадобится почти 3000⁰С! Но при остывании до обычной температуры железо опять станет твердым.
Другой пример — кислород. В обычных условиях это газ, которым насыщен воздух. Но если температуру понизить до -183⁰, кислород станет жидким. А при температуре -219⁰ кислород станет твердым. Хорошо, что таких температур в обычных условиях на Земле не бывает, и кислород остается газом — ведь он так нужен всем живым существам для дыхания.
Открыто новое состояние молекул воды / Habr
Нейтронография и компьютерное моделирование показали уникальное и неожиданное поведение молекул воды в условиях экстремального конфайнмента, сообщает phys.org.
Исследователи из Национальной лаборатории в Оук-Ридж совместно с лабораторией Резерфорда-Эплтона провели эксперимент, чтобы выяснить, что происходит с водой, когда она находится внутри минералов. Таким образом они хотели понять, какое состояние принимает жидкость в микротрещинах горных пород, почве, а также в ходе диффузии через клеточные мембраны.
В ходе эксперимента воду помещали в шестиугольные сверхмалые каналы в минерале берилл. Диаметр этих каналов составляет всего 5 ангстрем, то есть 10-10 метра (отдельные атомы, как правило, около 1 ангстрем в диаметре). Подвергая молекулы воды процессу туннелирования — помещения в эти емкости — исследователи обнаружили, что частицы демонстрируют довольно странное поведение, преодолевая потенциальный барьер и начиная квантовое движение. Такое состояние H2O наблюдалось учеными впервые и не соответствовало типичным формам вещества.
Ранее считалось, что такое явление существует только в квантовой механике. «В этом случае атомы кислорода и водорода являются „делокализоваными“ и, значит, одновременно присутствуют в шести симметричных позициях канала», сказал ведущий автор исследования Александр Колесников.
Водные кольца. Одна молекула воды может быть ограничена внутри канала берилла шестиугольной формы (слева). Светло-голубые сферы показывают позиции одного атома водорода в молекуле воды, как это происходит одновременно в шести симметричных позициях канала. Туннелирование между этими ориентациями означает, что атом водорода не находится в одном положении, а «размазывается» в форме кольца. Правый рисунок в пространственном масштабе показывает распределение электронной плотности водорода, от синего (низкое) до желтого (самое высокое).
Открытие этого «квантового туннелирования» состояния молекул воды в берилле, как ожидается, поможет ученым понять термодинамические свойства воды в замкнутых средах, таких как углеродные нанотрубки, а также в различных геологических условиях.
Сотрудник Лаборатории Резерфорда-Эплтона Лоуренс Ановитц отметил, что открытие вызовет дискуссию в биологических, геологических и физико-математических кругах, поскольку ученые попытаются объяснить механизм этого явления и понять, как он действует на их сферы.
Исследователи также сообщили, что средняя кинетическая энергия протонов воды, полученных непосредственно из нейтронного эксперимента, определяет скорость их движения при нуле градусов по шкале Цельсия и демонстрирует показатели на 30% меньше, чем в жидкой и твёрдой форме.
Структура воды в жидком состоянии
Особенности жидкой воды как растворителя зависят от строения ее молекул. Структуры льда и воды в значительной степени определяются водородными связями. В жидком состоянии вода ассоциирована в большей степени, чем другие гидриды, например, аммиак, фторово-дород, сероводород. Жидкая вода имеет квазикристаллическую структуру. Каждая молекула воды окружена четырьмя другими молекулами, располагающимися по вершинам тетраэдра. Ядра кислорода находятся в центрах этих тетраэдров. Расстояния между ближайшими молекулами 2,76 А. Образование водородных связей объясняет аномальные свойства воды. [c.38]Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар от атомов водорода к атому кислорода обусловливает образование водородных связей между кислородом и водородом. Водородные связи обусловливают ассоциацию молекул воды в жидком состоянии и некоторые ее аномальные свойства, в частности, высокие температуры плавления и парообразования, высокую диэлектрическую проницаемость, максимальную плотность при 4°С, а также особую структуру льда. В кристаллах льда молекула воды образует четыре водородные связи с соседними молекулами, что приводит к возникновению тетраэдрической кристаллической структуры. Расположение молекул в таком кристалле отличается от плотной упаковки молекул, в решетке много свободных мест, поэтому лед имеет относительно невысокую плотность. [c.83]
Жидкое состояние характеризуется плотной молекулярной упаковкой. Свободный объем в жидкости много меньше свободного объема в газах. Для многих жидкостей характерно наличие областей упорядоченной структуры. Так, для воды характерным является наличие областей с льдоподобным каркасом, пустоты которого заполнены молекулами воды. Области упорядоченной структуры возникают и разрушаются в результате теплового движения молекул. Средняя кинетическая энергия поступательного движения молекул в жидкости, как и в газах, равна ЯТ, следовательно, и средние скорости поступательного движения молекул в жидкости равны средним скоростям движения таких же молекул в газовом состоянии при той же температуре. [c.592]
Структура жидкой воды. Для объяснения аномальных свойств воды в жидком состоянии учеными созданы различные модели ее структуры. В основе многочисленных моделей жидкая вода рассматривается как кристаллическое вещество (жидкие кристаллы). Упорядоченное (кристаллическое) расположение частиц воды в жидком состоянии доказано экспериментально. Полагают, что прн плавлении льда его решетка частично разрушается и эти пустоты и ажурная структура льда заполняются освободившимися молекулами воды. Плотность жидкой воды вследствие этого увеличивается. Учеными подсчитано, что в жидкой фазе при 0°С несвязанные, заполняющие пустоты молекулы составляют около 16% от их общего количества. [c.9]
Углеводородные химические структуры, накапливающиеся в составе органического вещества, наиболее подвижны по сравнению с другими структурами, наиболее способны к переходу в жидкое состояние, а следовательно, к перемещениям, пли миграции в горных породах. Поэтому при первой же возможности начинается их отщепление, отделение от остальной части органического вещества с образованием уже самостоятельных молекул углеводородов и уход, или эмиграция этих углеводородов из мест их первоначального образования. Эмиграция (эвакуация) в основном идет параллельно с элизионным процессом, а углеводороды и другие вещества частично растворяются в воде и дальше перемещаются вместе с ней. Таким образом, и здесь вода играет важнейшую роль в судьбе нефти, так как без эмиграции углеводородов из мест их первоначального залегания нефть вообще ие может возникнуть. [c.38]
Эти свойства жидкой воды связаны с необычайностью ее структуры, которая и заключается в наличии водородной связи, образующейся в молекулах воды вследствие существования неподелен-ных электронных пар. Электронные пары расположены на двух орбиталях, лежащих в плоскости, перпендикулярной к плоскости НОН (рис. 1.5). За счет неподеленных пар электронов в каждой молекуле воды могут возникнуть две водородные связи. Еще две связи могут обеспечить два водородных атома. Таким образом, только одна молекула воды в состоянии образовать четыре водородных связи. Благодаря этому результирующее распределение зарядов в молекуле воды напоминает тетраэдр, два угла которого заряжены положительно, а два — отрицательно. Результирующий центр положительных зарядов находится посредине между протонами. Он отделен от результирующего центра отрицательных зарядов, расположенного вблизи атома кислорода с противоположной Т5Т протона стороны. Вследствие этого молекула воды оказывается электрическим диполем с дипольным моментом, равным Кл-м (отсюда и высокая диэлектрическая проницаемость воды, и связанная с ней способность растворять ионные вещества). [c.23]
КОМ. в случае воды это связано с рыхлой гексагональной структурой кристаллов обычного льда. Приближенное представление о такой структуре может дать рис. (У.б, а). Однако онО все-таки дает представление о наличии больших пустот при правильном расположении молекул воды в гексагональной решетке. При плавлении решетка разрушается и становится возможным более тесное расположение молекул (рис. У.б, б). Тем не менее элементы упорядоченной гексагональной структуры в непосредственной близости температуры плавления и в жидком состоянии еще сохраняются. С этим, по-видимому, связано другое уникальное свойство воды — уменьшение объема при нагревании от О до 4° С. [c.110]
Свойства воды интересуют научных работников различных специальностей — физиков, химиков, биологов, геологов До настоящего времени не разработана теория жидкого состояния II нет теории, объясняющей удивительные свойства воды, которые обычно классифицируются как аномальные по сравнению с аналогичными свойствами простых жидкостей. Именно этим свойствам обязаны многие геологические особенности Земли и сама жизнь Настоящая монография является первой книгой на русском языке, где систематически рассмотрены свойства молекулы Н2О, свойства пара, свойства различных кристаллов Н2О и свойства воды в жидком состоянии. Одна на глав книги посвящена природе водородной связи, которая наряду с особенностями структуры молекулы воды определяет свойства этой жидкости. [c.2]
Для многих жидкостей изменение энтропии испарения при температуре кипения равно 84—92 Дж/(К-моль) (правило Тру-тона). Это означает, что изменение степени порядка структур при переходе жидкого состояния в газообразное у многих ве ществ примерно одинаковое. Правило Трутона соблюдается, если состав жидкой фазы одинаков с составом пара вещества. У жидкостей, молекулы которых ассоциированы, Д5°исп больше, чем требуется по правилу Трутона, так как в теплоту испарения включается теплота, затрачиваемая на разрушение групп молекул. Та
Свойства воды
Вода в природе существует в твердом, жидком и парообразном состоянии. Это единственное вещество, которое мы можем наблюдать в трех агрегатных состояниях.
При переходе из жидкого состояния в твердое другие вещества сжимаются, так как уменьшается расстояние между молекулами; вода же ведет себя совсем наоборот.
Она при замерзании теряет плотность и поднимается на поверхность вместо того, чтобы идти на дно. Образовавшийся слой льда препятствует проникновению холодного воздуха. В результате вода подо льдом получает возможность сохранять тепло и не превращаться в лед. Поэтому даже если температура воздуха достигла отметки — 50 градусов по Цельсию, подо льдом все равно всегда около нуля. И жизнь продолжается!
Значение поверхностного натяжения воды больше, чем у любой другой жидкости. Именно это свойство влияет на процесс образования дождевых капель, а, стало быть, и на круговорот воды в природе. В противном случае пары воды, поднявшись в небо и обратившись в облака, не смогли бы так легко и просто превратиться в капли, чтобы затем пролиться дождем на землю.
Наибольшая температура кипения среди всех веществ, встречающихся в природе в жидком виде — опять у воды: около ста градусов по Цельсию. Это обстоятельство способствует замедлению процессов испарения и помогает избежать больших потерь воды.
Молекула воды не может возникнуть так, чтобы к атому кислорода прицепилось с двух противоположных сторон по атому водорода. Напротив, атом кислорода присоединяется к двум атомам водорода, в результате чего последние составляют положительно заряженный полюс молекулы, а атом кислорода, находясь на противоположной стороне, составляет отрицательно заряженный полюс. Образуются двухполюсные молекулы воды, которые начинают группироваться друг с другом, притягиваясь разными полюсами.
Еще одно удивительное свойство воды заключается в следующем. В одной группе с кислородом в периодической системе химических элементов находятся сера (S), селен (Se) и теллурий (Te). Тем не менее, соединения этих элементов с водородом даже близко не напоминают воду. Например, сероводород — H2S — это газ с неприятным запахом тухлых яиц. Да и другие соединения в нормальных условиях находятся в газообразном состоянии. Их молекулы тяжелее молекулы воды: у H2S молекулярный вес — 34, у H2Sе — 81, у H2Те — 130. Вода же обладает молекулярным весом 18, а при этом не газ, а жидкость.
По сравнению с другими жидкостями вода обладает наивысшим показателем электрического сопротивления. В водной среде сила притяжения наэлектризованных частиц друг к другу достаточно слаба, поэтому ионизированные частицы солей прекрасно растворяются в воде, хотя большинство этих солей имеет слабую растворимость в органических жидкостях.
Образовавшиеся в атмосфере дождевые капли, начав свое движение, приходят в соприкосновение с кислородом, азотом и углекислым газом, которые растворяются в них. Мельчайшие твердые частички, находящиеся в атмосфере, также оказываются в плену у дождевых капель.
В воде повышается кислотность при смешивании с углекислым газом: она становится более сильным растворителем. А когда в атмосфере становится много оксида серы и азота (эти соединения образуются в результате сжигания топлива), кислотность воды растет еще больше. В итоге месте с дождевыми каплями на землю попадают растворы кислот. В такой среде растворяются и те вредные вещества, которые раньше не могли смешаться с дождевыми каплями. А значит, возникает опасность отравления и растений, и животных, и человека.
Кислотные дожди опасны и для водоемов. От них гибнут обитатели рек и озер, а вода становится непригодной для питья. В местах с очень плохой экологической обстановкой уничтожаются целые леса. Так, например, произошло в Карабаше, городе на Урале, который по праву считают самым грязным населенным пунктом планеты.
Самые главные свойства воды в картинках

