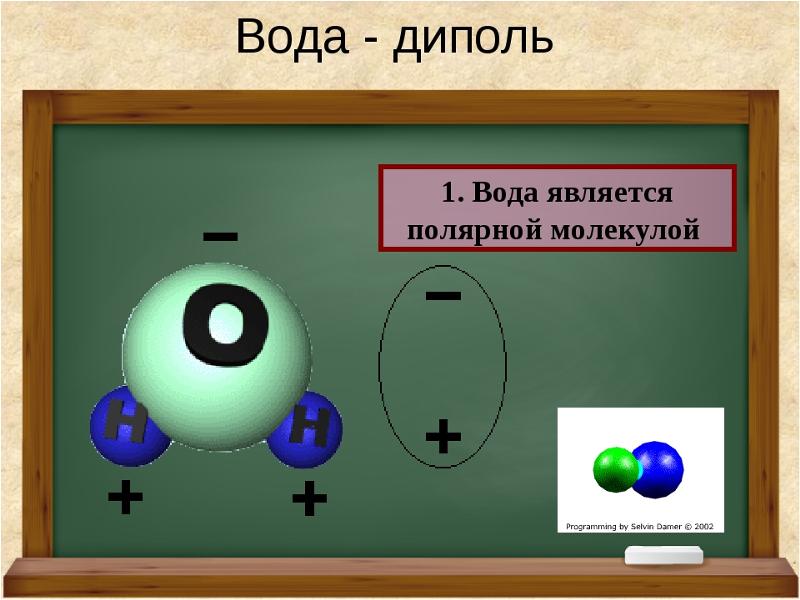
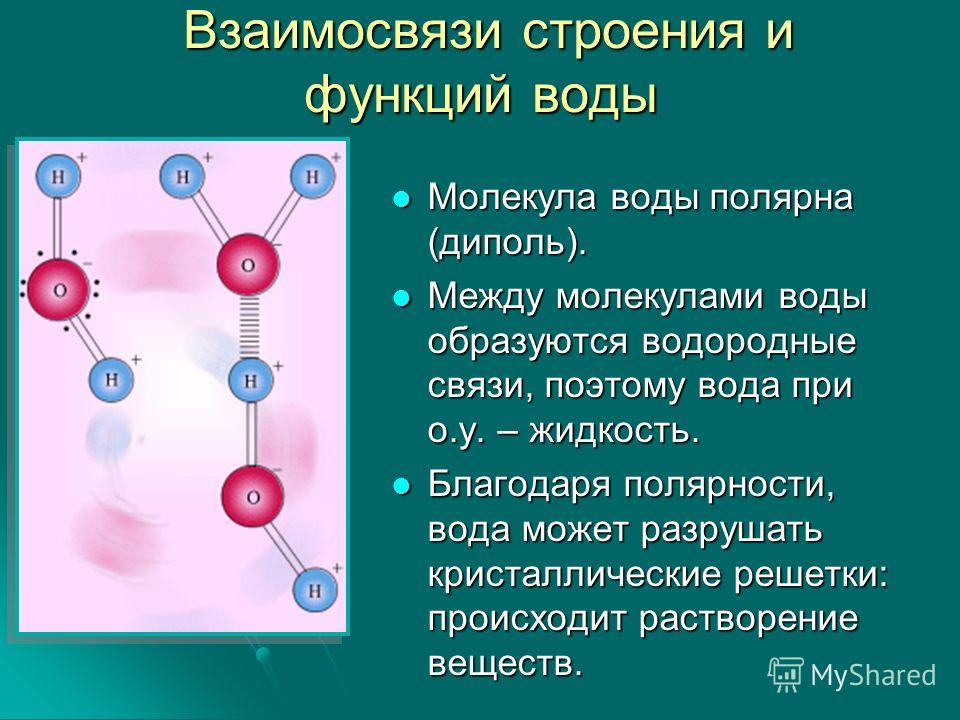
Свойства молекулы воды
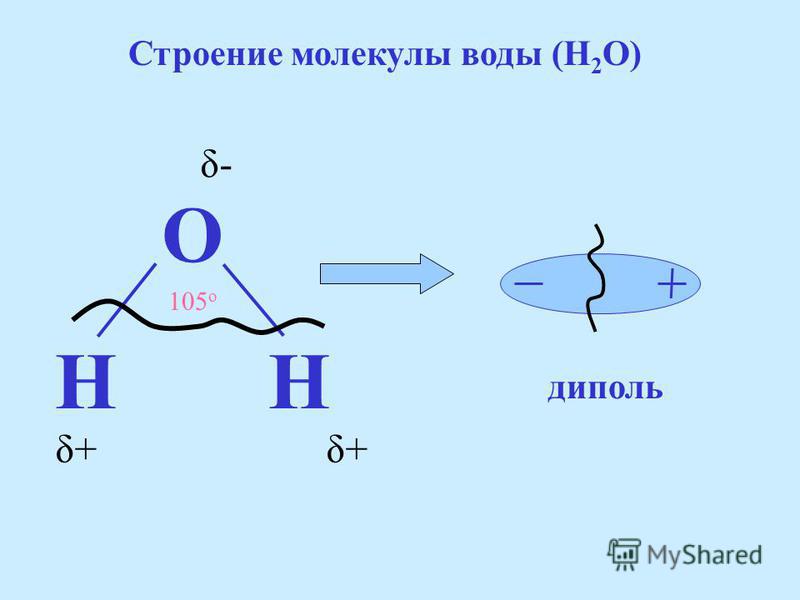
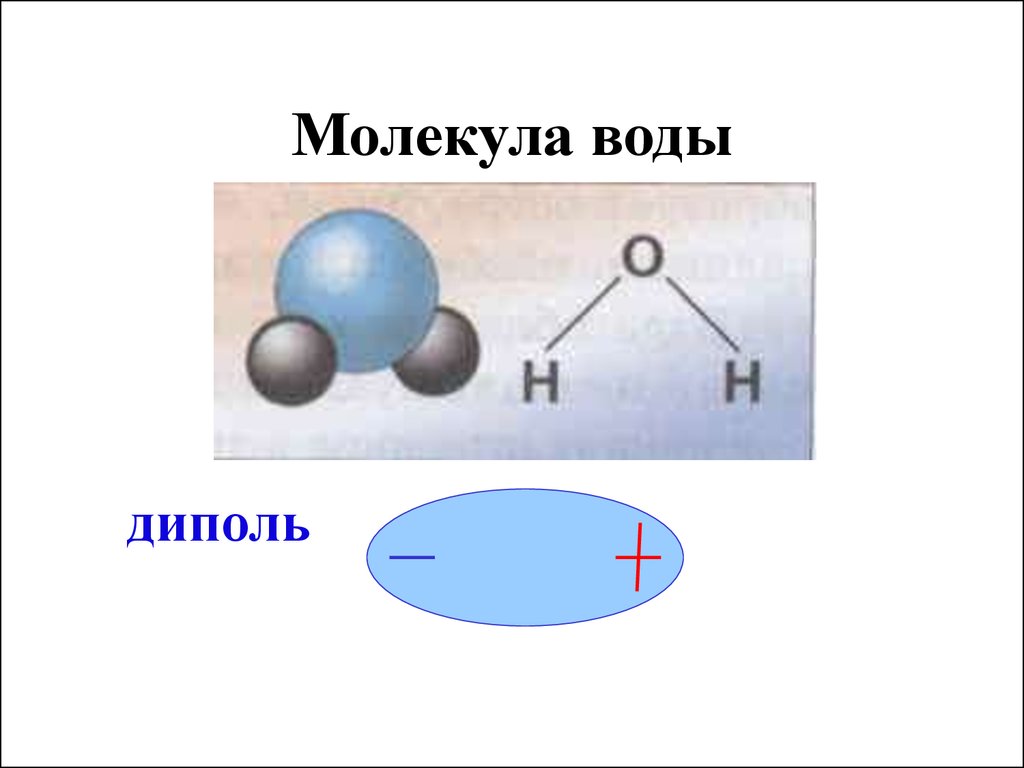
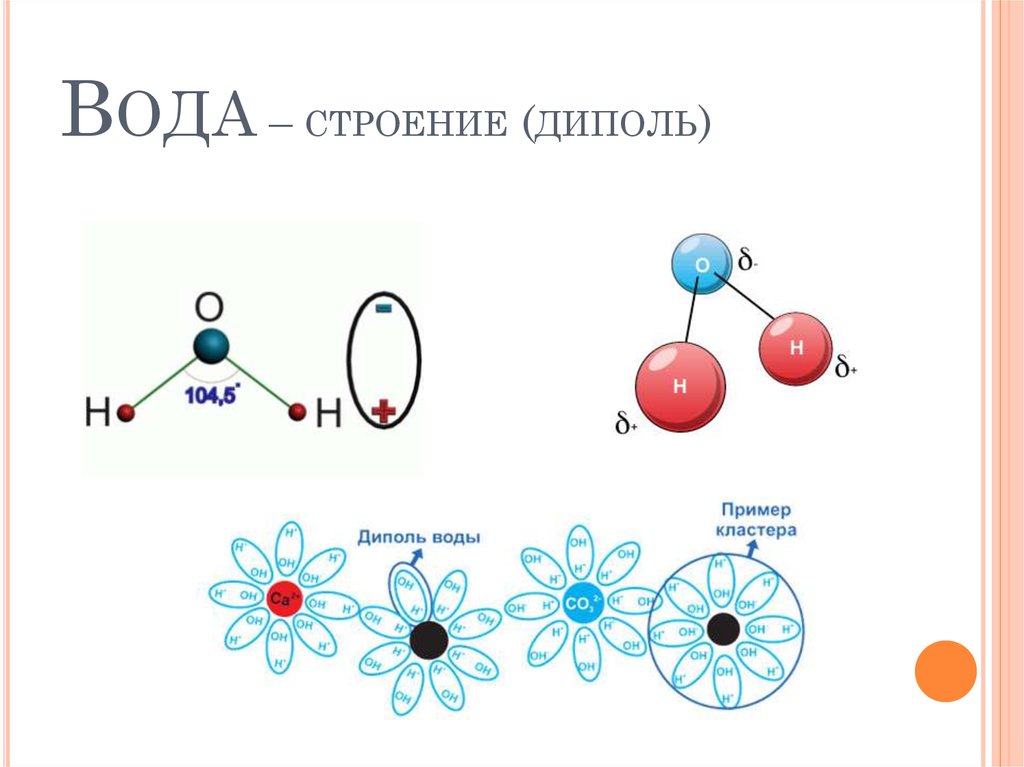
Вода, встречающаяся на Земле, возникла при дегазации магмы. Она может выделяться биохимическим путем при минерализации органических веществ, а также в процессах фотосинтеза и окислительно-восстановительных реакций. Вода состоит из молекул, в которых оба атома водорода соединены с одним атомом кислорода ковалентной связью и находятся в углах 104°27′. (Рисунок. Строение молекулы, Образование диполя)
Рисунок. Строение молекулы.
Рисунок. Образование диполя.
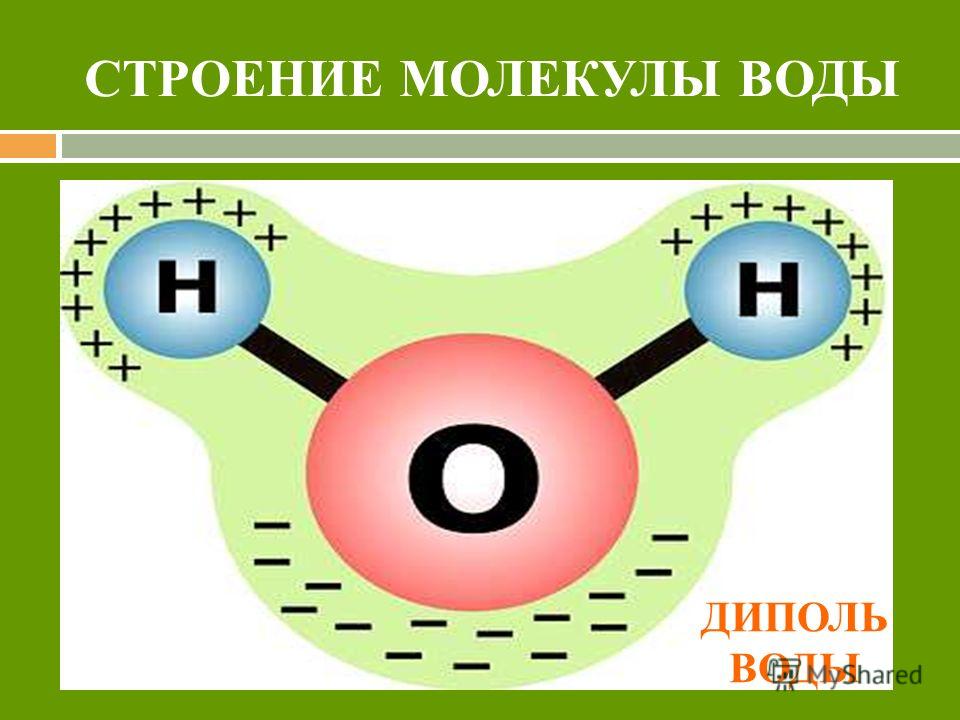
Благодаря высокому, по сравнению с водородом (+1), заряду ядра кислорода (+8) электроны притягиваются к ЯДРУ атома О сильнее, чем к ядрам атома Н (молекулярная теория): центры масс зарядов не совпадают между собой, молекула представляет собой постоянный диполь, который может взаимодействовать с носителями положительных и отрицательных зарядов.
Диполи молекул воды могут соединяться между собой водородными связями, на разрыв которых (диссоциацию) требуется затратить около 20 — 42 ккал/моль (энтальпия диссоциации). Молекулы воды могут неструктурированно объединяться в кластеры (жидкая вода) или образовывать тетраэдрические или кольцевидные кристаллические структуры льда (Рисунок. Агрегатные состояния воды). При 0 — 4 °С кластеры состоят приблизительно из 90 молекул, при 70 °С — из 25 молекул, постоянно объединяющихся и распадающихся.
Молекулы воды могут неструктурированно объединяться в кластеры (жидкая вода) или образовывать тетраэдрические или кольцевидные кристаллические структуры льда (Рисунок. Агрегатные состояния воды). При 0 — 4 °С кластеры состоят приблизительно из 90 молекул, при 70 °С — из 25 молекул, постоянно объединяющихся и распадающихся.
Рисунок. Водородные связи.
Благодаря кластерам теоретическая точка плавления воды повышается от — 100 °С до 0 °С, а точка кипения — от — 70 °С до + 100 °С, вследствие чего в температурных условиях земной поверхности вода находится в жидком, а не в газообразном агрегатном состоянии.
Рисунок. Агрегатные состояния воды.
Жидкая вода используется живыми существами как средство транспортирования тепла и питательных веществ в кровеносных сосудах животных и в капиллярах растений; она образует водную среду обитания. Подобно тому как концентрация СО2 в водоемах часто является ограничивающим фактором, так и вода определяет земную био производительность.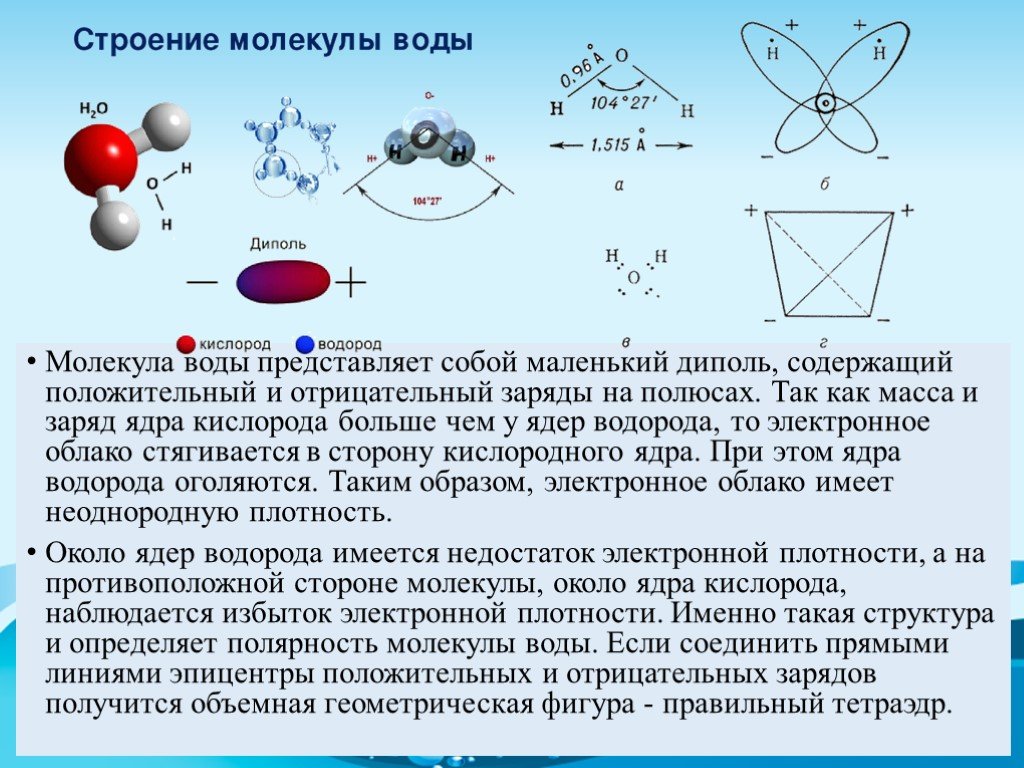 Вследствие своего дипольного характера вода является универсальным растворителем для многих групп веществ. Растворительная способность воды зависит от ее способности диссоциировать:
Вследствие своего дипольного характера вода является универсальным растворителем для многих групп веществ. Растворительная способность воды зависит от ее способности диссоциировать:
2Н2О ⇔ Н3О+ 4- ОН— (амфолит).
Концентрация ионов гидроксония (Н3O+) и, соответственно, гидроксил-ионов (ОН—) показывает, насколько кислый или щелочной раствор. Если Н2O отдает протоны, например:
Н2О + NH3 ⇔ NH4+ + ОН—,
то она вступает в химическую реакцию как кислота (донор протонов), а если принимает протоны, например
Н2О + НСI ⇔ Н3О+ + СI,
то как акцептор протонов; если молекула может реагировать и как кислота, и как основание, ее называют амфотерной.
Оксиды неметаллов образуют с водой кислоты, например
SO2 + Н2О ⇔ 2Н+ + SO32-
(проблема — SO2,).
отдельные оксиды металлов — щелочи, например
СаО + Н2О ⇔ Са2+ + 2ОН—.
Соли металлов, диссоциируя, разлагаются, а как соли слабых кислот и щелочей разделяются при гидролизе, например:
Na2CO3 + Н2О ⇔ 2Na+ + НСО3— + ОН—.
Рисунок. Растворы: ионный кристалл, Газы.
Вода может внедрять я в кристаллическую решетку (образование гидратов).
Таблица. Растворимость газов в Н2O.
Газы | Растворимость при | ||
О °С | 10 °С | 20 °C | |
Воздух |
|
|
|
(78%) N2 | 22,4 | 1745 | 14,2 |
(20,1%) О2 | 14,5 | 11,1 | 8,9 |
(0,03%) СО2 | 1,0 | 0,7 | 0,51 |
Азот (N2) | 28,8 | 22,6 | 18,6 |
Кислород (О2) | 69,5 | 53,7 | 43,3 |
Диоксид углерода (СО2) | 3350 | 2320 | 1690 |
Аммиак (NH3) | 1000 | 690 | 540 |
Сероводород(H2S) | 7100 | 5300 | 4000 |
Хлор (Cl2) | 14 600 | 9700 | 7000 |
Озон (О3) | 1360 | 1100 | 7700 |
Вода очень хорошо растворяет полярные вещества, например соли (гидрофильное действие), чаще с образованием ионов, неполярные — хуже или как жиры, не растворяет совсем (гидрофобное действие).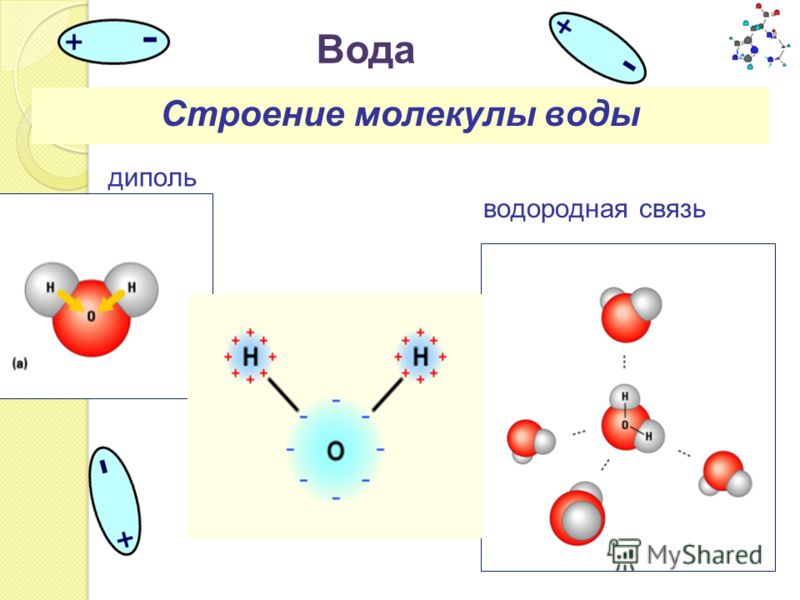 Растворимость газов, химических не реагирующих с водой, зависит от температуры и давления (Таблица. Растворимость газов в Н2O (мг/л)), например в озере содержание кислорода изменяется сверху вниз. В непроточных стоячих водоемах большую роль играет аномалия плотности (Рисунок. Аномалия плотности).
Растворимость газов, химических не реагирующих с водой, зависит от температуры и давления (Таблица. Растворимость газов в Н2O (мг/л)), например в озере содержание кислорода изменяется сверху вниз. В непроточных стоячих водоемах большую роль играет аномалия плотности (Рисунок. Аномалия плотности).
Рисунок. Аномалия плотности.
При 4 °С вода имеет наибольшую плотность, при более низкой температуре плотность уменьшается. Наиболее холодный слой (0 — 4 °С) воды находится у ее поверхности, где при дальнейшем охлаждении образуется лед, который плавает благодаря еще меньшей плотности кристаллической решетки (Рисунок. Агрегатные состояния воды).
Замерзание сверху вниз позволяет рыбам в достаточно глубоких озерах выжить в нижних слоях воды. Плотность воды зависит также от содержания солей и давления. Так, в более плотной соленой воде планктон имеет лучшие условия для пребывания во взвешенном состоянии, чем в бедной ионами воде олиготрофных озер. У воды большая удельная теплоемкость: 4,187 кДж • К-1 • кг-1; это означает, что необходимо затратить 4,187 кДж, чтобы нагреть 1 кг воды на 1 °К 1 °С) при нормальном давлении.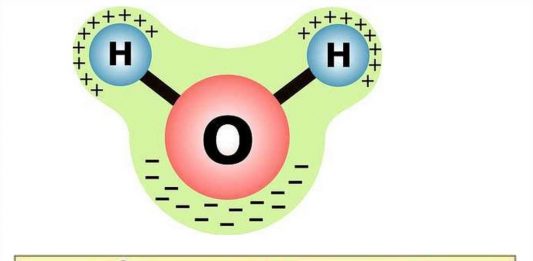 Теплота плавления льда составляет 333,7 кДж/кг, теплота испарения воды — 2255 кДж/кг; она высвобождается как тепло конденсации при сжижении водяного пара. Благодаря высокой теплоемкости вода может накапливать большие количества тепла и в сравнении с сушей представляет собой относительно более стабильную среду обитания.
Теплота плавления льда составляет 333,7 кДж/кг, теплота испарения воды — 2255 кДж/кг; она высвобождается как тепло конденсации при сжижении водяного пара. Благодаря высокой теплоемкости вода может накапливать большие количества тепла и в сравнении с сушей представляет собой относительно более стабильную среду обитания.
У воды высокая вязкость и поверхностное натяжение, зависящие от температуры и давления.
Вязкость противодействует движению в воде, поддерживает планктон во взвешенном состоянии. Поверхностное натяжение возникает благодаря силам когезии, действующим на молекулы воды на границе раздела с воздухом (нейстон), возникает так называемая поверхностная пленка. Важным свойством воды для биоценозов водоемов является прозрачность воды.
Поделиться:
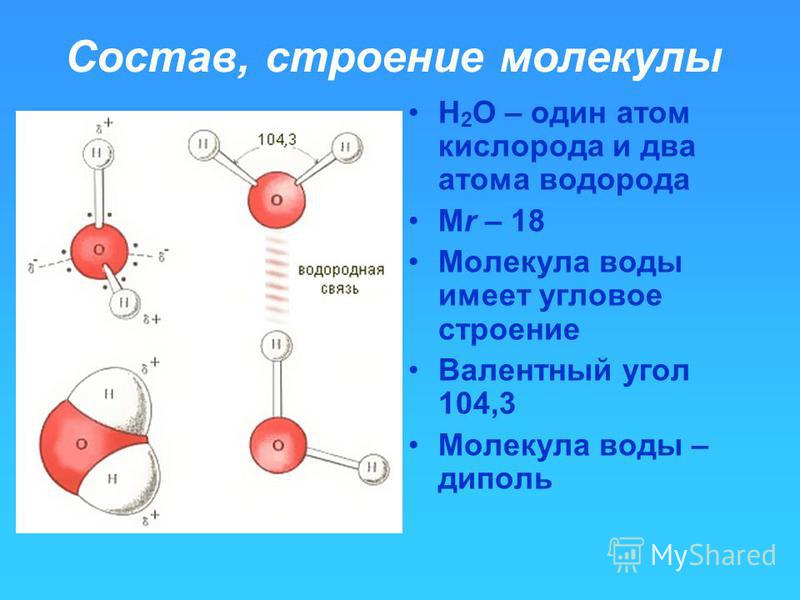
2. Строение молекул воды
В
молекулах воды ядра атомов образуют
равнобедренный треугольник с протонами
в основании и ядром атома кислорода в
вершине. В свободных молекулах воды (в
парах) межъядерные расстояния О–Н равны
0,09568 нм.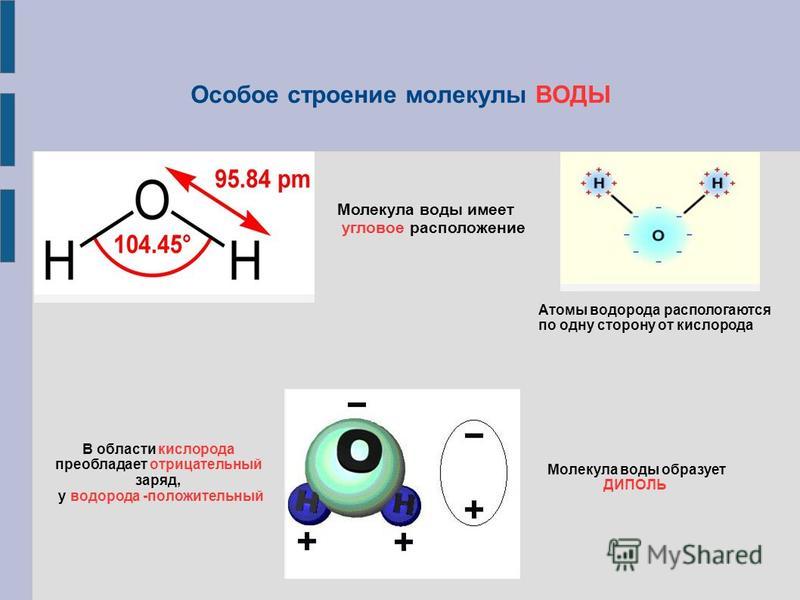 Угол между направлениями связей
составляет 104о27’,
а расстояние между протонами 0,1515 нм
(рис. 1).
Угол между направлениями связей
составляет 104о27’,
а расстояние между протонами 0,1515 нм
(рис. 1).
Рис. 1. Модель молекулы воды (по Н.Бьерруму)
Под влиянием электростатического поля соседних молекул или ионов указанные параметры могут несколько изменяться. Это происходит при изменении агрегатного состояния воды, растворении в ней других веществ или под влиянием поверхностного слоя кристаллов твердого тела, с которым соприкасается вода.
При образовании молекулы воды происходит sp3-гибридизация орбиталей атома кислорода и возникают четыре гибридные электронные орбитали. При этом два гибридных облака, участвующие в образовании ковалентной связи, вытягиваются в направлении атома водорода. Электроны, образующие связи
 Неподелённые
пары электронов, находящиеся на гибридных
орбиталях, не участвующих в образовании
связи, удаляются от ядра атома кислорода
в сторону, противоположную связям О–Н.
Это способствует появлению двух полюсов
отрицательных зарядов. Таким о
Неподелённые
пары электронов, находящиеся на гибридных
орбиталях, не участвующих в образовании
связи, удаляются от ядра атома кислорода
в сторону, противоположную связям О–Н.
Это способствует появлению двух полюсов
отрицательных зарядов. Таким оРис. 2. Схема перекрывания электронных орбиталей атомов кислорода и водорода в молекуле воды
бразом, в молекуле воды образуются четыре полюса зарядов, расположенных в вершинах неправильного тетраэдра (рис. 2).
Вследствие такого несимметричного строения вода обладает высоким дипольным моментом (1,84 Д) или 5,52∙10–3 Кл∙м. Это один из самых больших электрических дипольных моментов молекул с небольшим числом атомов. Эти особенности строения молекулы Н2О имеют очень важные следствия:
большой электрический дипольный момент молекулы воды является причиной возникновения диполь-дипольных и ион-дипольных взаимодействий в водных растворах;
молекула воды образует водородные связи с электроотрицательными атомами других молекул, в том числе других молекул воды;
неподеленные электронные пары позволяют молекуле Н2О образовывать комплексные соединения по донорно-акцепторному механизму с катионами металлов.

Два
первых следствия являются причиной
того, что вода имеет высокие температуры
кипения и плавления. Отсюда же широкий
температурный интервал существования
жидкого состояния воды (0…100
Высокая полярность является также причиной диссоциации в воде электролитов. Значительное влияние на строение и свойства воды и её растворов оказывает способность молекул воды образовывать водородные связи. Каждая молекула воды способна образовать четыре водородные связи с соседними молекулами по схеме (рис.3):
а)
б)
Рис. 3. Структура воды
а) образование водородных связей между молекулами воды;
б) гексагональная структура льда
Количество
связей зависит от температуры.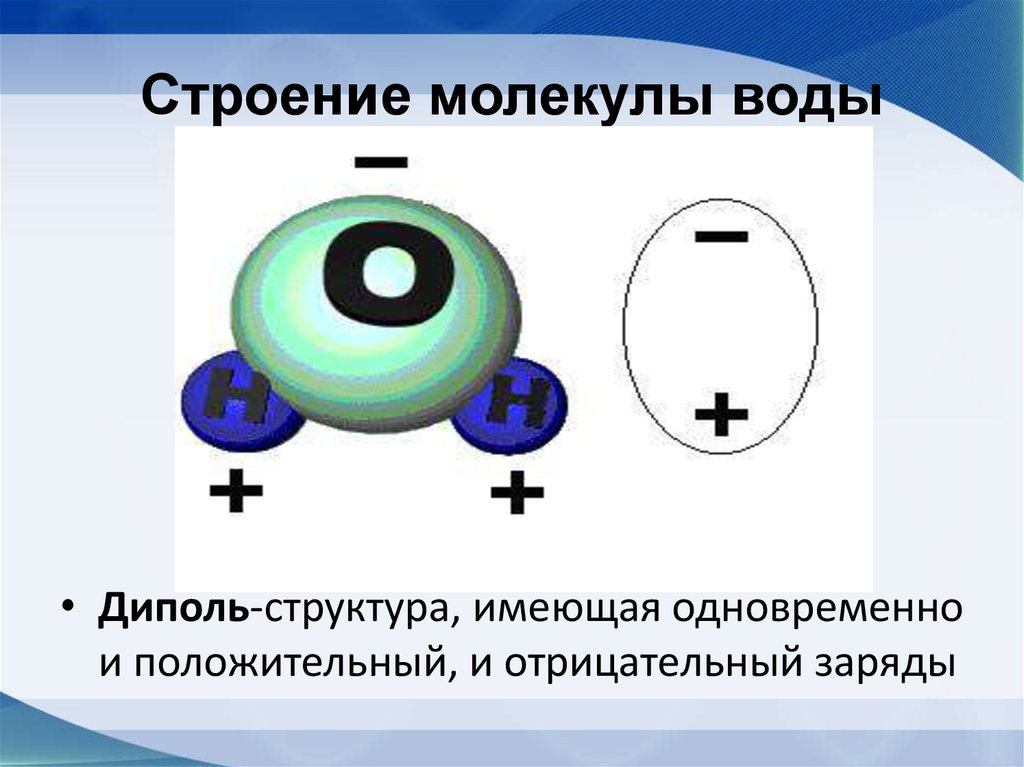 Но
взаимодействие между молекулами воды
оказывается достаточно сильным, что
даже в парах воды присутствуют димеры
и тримеры состава (Н2О)2 и (Н2О)3.
В растворах же могут возникать длинные цепи ассоциатов (Н2О)n.
Длина водородной связи
Но
взаимодействие между молекулами воды
оказывается достаточно сильным, что
даже в парах воды присутствуют димеры
и тримеры состава (Н2О)2 и (Н2О)3.
В растворах же могут возникать длинные цепи ассоциатов (Н2О)n.
Длина водородной связи
межмолекулярных сил
межмолекулярных силМежмолекулярные силы
| Введение. Введение Вода — единственное вещество, с которым мы обычно сталкиваемся в твердом, жидком,
и газ. При низких температурах это твердое тело, в котором отдельные молекулы
замыкаются в жесткой структуре. При повышении температуры средняя
кинетическая энергия молекул увеличивается, что увеличивает скорость, с которой
эти молекулы движутся. Молекула воды движется тремя способами: (1) вибрация, (2) вращение и (3) перенос. Молекулы воды колеблются , когда связи Н-О растягиваются или изгибаются. Вращение включает в себя движение молекулы вокруг ее центра тяжести. Перевод буквально означает переход из одного места в другое. Поэтому он описывает движение молекул в пространстве. Чтобы понять эффект этого движения, нам нужно различать внутримолекулярные и межмолекулярные связи. Ковалентные связи между атомами водорода и кислорода в воде
молекулы называются Внутримолекулярные связи , которые удерживают вместе атомы в молекулах H Все три режима движения разрушают связи между молекулами воды. В качестве
система становится теплее, тепловая энергия молекул воды со временем
становится слишком большим, чтобы позволить этим молекулам быть запертыми в жесткой структуре
льда. В этот момент твердое тело плавится, образуя жидкость, в которой межмолекулярные
связи постоянно разрываются и восстанавливаются, когда молекулы движутся через
жидкость. В конце концов, тепловая энергия молекул воды становится такой
велики, что они движутся слишком быстро, чтобы образовать межмолекулярные связи, и жидкая
кипит, образуя газ, в котором каждая частица движется более или менее беспорядочно через
пространство. Таким образом, разница между твердыми телами и жидкостями или жидкостями и газами заключается в на основе конкуренции между прочностью межмолекулярных связей и тепловая энергия системы. При данной температуре вещества, содержат прочные межмолекулярные связи, скорее всего, являются твердыми телами. Для Учитывая прочность межмолекулярных связей, чем выше температура, тем больше вероятно, вещество будет газом. Кинетическая теория предполагает отсутствие силы притяжения между частицы в газе. Если бы это предположение было верным, газы никогда бы не конденсируются с образованием жидкостей и твердых тел при низких температурах. В 1873 году голландцы физик Йоханнес ван дер Ваальс вывел уравнение, которое не только включало силы притяжения между частицами газа, но и с поправкой на тот факт, что объем этих частиц составляет значительную долю общий объем газа при высоких давлениях. Уравнение Ван-дер-Ваальса сегодня используется для лучшего соответствия экспериментальным
данные о реальных газах, чем можно получить с помощью уравнения идеального газа. Силы диполя-диполя Многие молекулы содержат связи, находящиеся между крайними ионными и
ковалентные связи. Разница между электроотрицательностями атомов
в этих молекулах достаточно велик, чтобы электроны не были разделены поровну,
и все же достаточно малы, чтобы электроны не притягивались исключительно к одному
атомов с образованием положительных и отрицательных ионов. Связи в этих молекулах
говорят, что молекул HCl, например, имеют дипольный момент, потому что атом водорода имеет небольшой положительный заряд, а атом хлора — небольшой отрицательный обвинение. Из-за силы притяжения между противоположно заряженными частицами существует небольшая диполь-дипольная сила притяжения между соседними HCl молекулы. Диполь-дипольное взаимодействие в HCl относительно слабое; всего 3,3 кДж/моль. (Ковалентные связи между атомами водорода и хлора в HCl равны 130 раз сильнее.) Сила притяжения между молекулами HCl настолько мала что хлористый водород кипит при -85,0 o C. Дипольные силы, индуцированные диполем Что произойдет, если мы смешаем HCl с аргоном, у которого нет дипольного момента?
Электроны на атоме аргона равномерно распределены вокруг
ядро атома. Но эти электроны находятся в постоянном движении. Искажая распределение электронов вокруг атома аргона, полярный Молекула HCl индуцирует небольшой дипольный момент на этом атоме, который создает слабая дипольно-индуцированная дипольная сила притяжения между молекулой HCl и атом Ar. Эта сила очень слабая, с энергией связи около 1 кДж/моль. Индуцированные дипольные силы Ни диполь-дипольные, ни дипольно-индуцированные силы не могут объяснить тот факт, что
гелий становится жидкостью при температуре ниже 4,2 К. Сам по себе гелий
атом совершенно симметричен. Но движение электронов вокруг
ядра пары соседних атомов гелия могут синхронизироваться так,
что каждый атом одновременно получает индуцированный дипольный момент. Эти флуктуации электронной плотности происходят постоянно, создавая индуцированный дипольно-индуцированная дипольная сила притяжения между парами атомов. Как мог бы Как и следовало ожидать, эта сила относительно слаба в гелии — всего 0,076 кДж/моль. Но атомы или молекулы становятся более поляризуемыми по мере того, как они становятся больше, потому что есть больше электронов, которые нужно поляризовать. Утверждается, что первичный сила притяжения между молекулами в твердом I 2 и в замороженном CCl 4 — индуцированное дипольным дипольным притяжением.
Кубическая дипольная решетка молекул воды, запертых внутри углеродных клетокШинобу Аояги* и Норихиса Хосино, б Томоюки Акутагава, б Юки Садо, с Ре Китаура, c Хисанори Шинохара, c Кунихиса Сугимото, д Руи Чжан и а также Ясудзиро Мурата и Принадлежности автора * Соответствующие авторы и Департамент информационных и биологических наук, Городской университет Нагоя, Нагоя 467-8501, Япония |


 (Этот гораздо более распространенный префикс
используется в таких словах, как интерфейс , межвузовский и международный .)
(Этот гораздо более распространенный префикс
используется в таких словах, как интерфейс , межвузовский и международный .)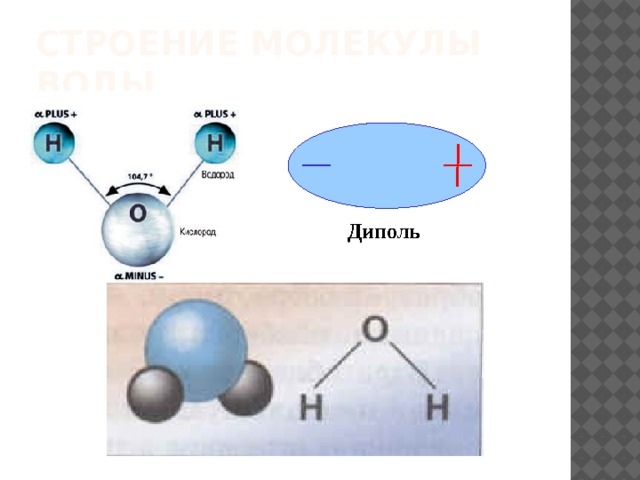

 Когда
атом аргона приближается к полярной молекуле HCl, электроны могут сдвигаться
к одной стороне ядра, чтобы создать очень маленький дипольный момент, который длится
только на мгновение.
Когда
атом аргона приближается к полярной молекуле HCl, электроны могут сдвигаться
к одной стороне ядра, чтобы создать очень маленький дипольный момент, который длится
только на мгновение.