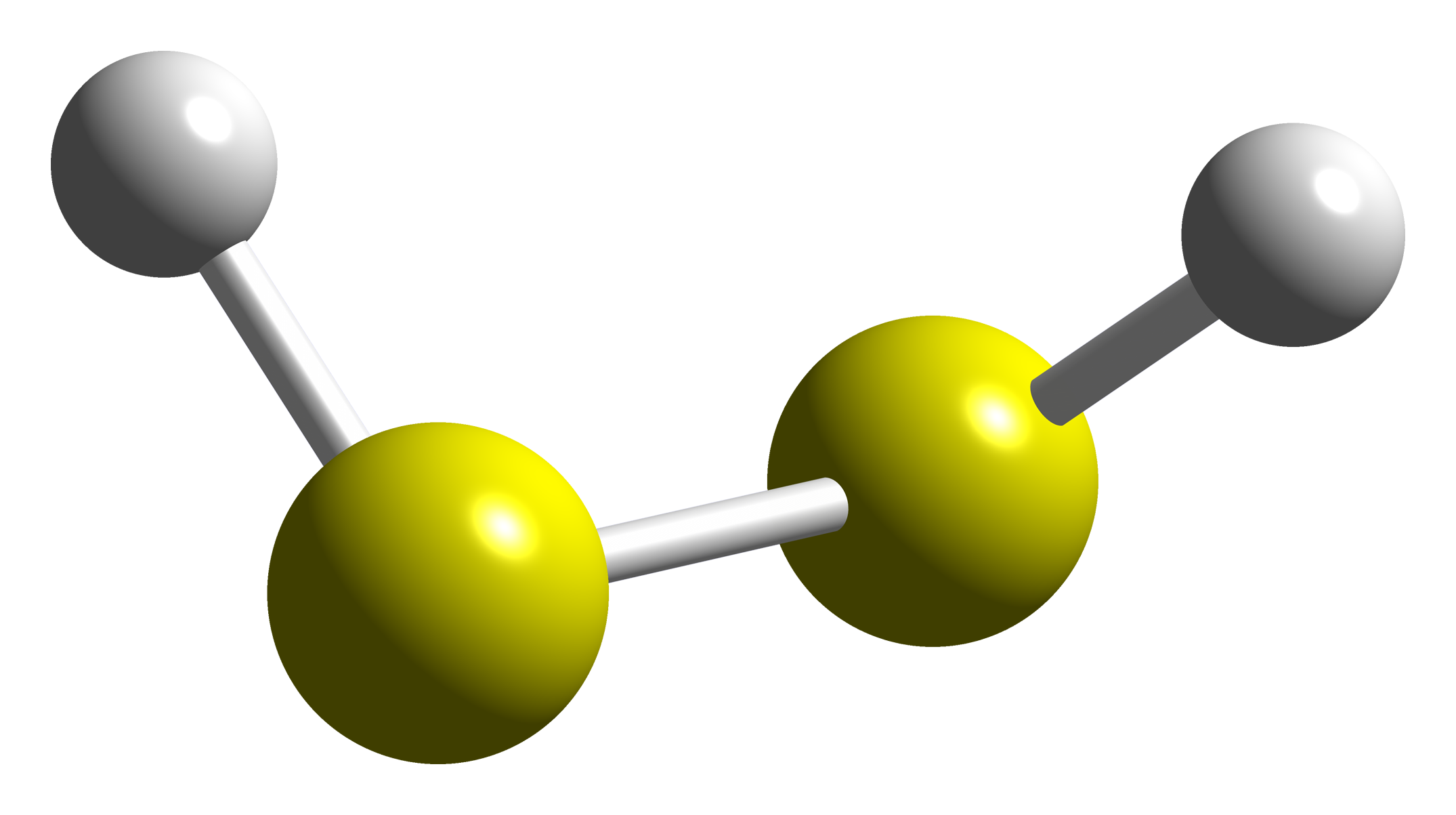
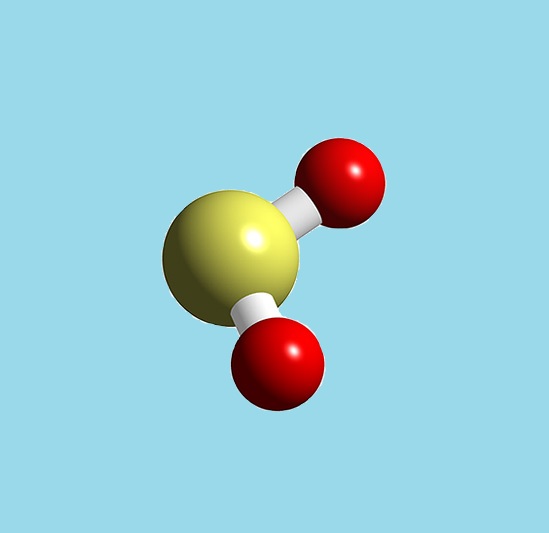
Постройте модели молекул водорода, кислорода, углекислого газа, азота, хлора, воды, серы
1. Шары (42 шт.), представляющие собой модели атомов различных элементов. Определенный вид атомов (химический элемент) имеет соответствующую окраску. Отверстия в шарах соответствуют валентности элементов. Некоторые элементы, например азот, сера, в различных соединениях проявляют переменную валентность.
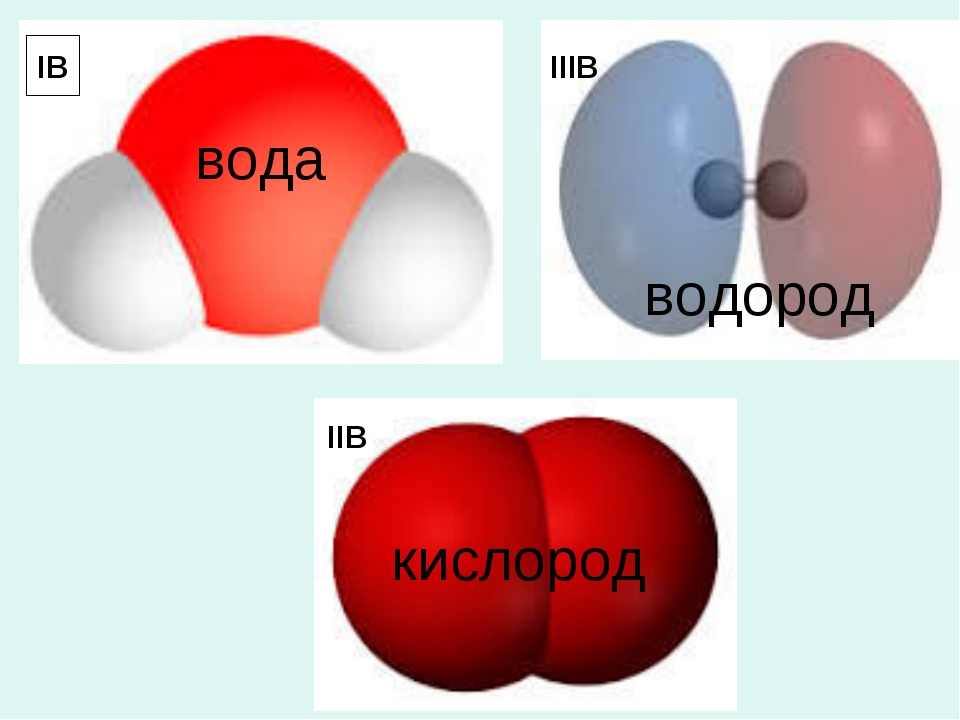
Водород — белые шарики
Углерод — черные шарики
Кислород- красные шарики
Азот — голубые шарики
Сера — желтые шарики
Хлор (бром, йод) — зеленыые шарики
Натрий (калий, серебро) — серые шарики
Кальций (медь, железо, цинк) — серые шарики
Алюминий (железо) — серые шарики
2. Стержни – используются для моделирования связей.
Набор может быть использован при изучении различных тем курса неорганической и органической химии.
Неорганическая химия
Тема: Первоначальные химические понятия: простые и сложные вещества, валентность.
Задание №1. Постройте модели молекул водорода, кислорода, углекислого газа, азота, хлора, воды, серы (учитывая, что молекула серы состоит из 8 атомов).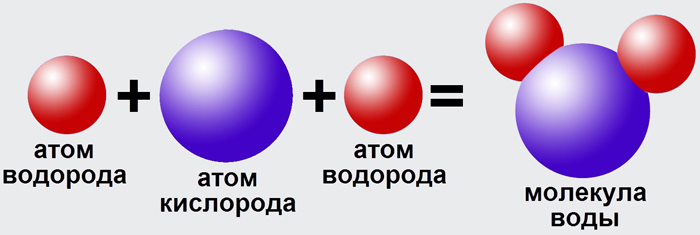
Задание №2. Постройте модели молекул:
-аммиака (состоит из 1 атома азота и 3 атомов водорода)
-метана (состоит из 1 атома углерода и 4 атомов водорода)
-сероводорода (состоит из 1 атома серы и 2 атомов водорода)
Определите валентность каждого элемента в построенных соединениях.
Тема: Кислород. Оксиды. Горение.
Задание №3. Постройте модели молекул:
-оксида меди (валентности меди и кислорода =2)
-оксида натрия (валентность натрия =1)
Запишите в тетради названия и формулы веществ.
Тема: Водород. Кислоты. Соли.
Задание №4. Постройте модели молекул кислот: соляной, серной, азотной.
Постройте модели молекул солей: хлорида натрия, сульфата меди, нитрата калия.
Определите валентность кислотного остатка. Запишите в тетради названия и формулы веществ.
Задание №5. Постройте модели молекул гидроксида натрия, гидроксида кальция, гидроксида алюминия.
 Определите количество гидроксильных групп в названных веществах. Запишите в тетради названия и формулы перечисленных выше оснований.
Определите количество гидроксильных групп в названных веществах. Запишите в тетради названия и формулы перечисленных выше оснований.(Задания по органической химии рассчитаны на большую самостоятельность учащихся, поэтому ответы не прилагаются.)
Тема: Предельные углеводороды.
Задание №6. Постройте поочередно модели гомологического ряда метана (выборочно). Постройте модели молекул возможных изомеров. Запишите в тетради названия и формулы полученных веществ.
Задание №7. Постройте поочередно модели молекул циклопропана, циклобутана, циклопентана, циклогексана. Какое из перечисленных веществ обладает наибольшей прочностью и почему?
Тема: Непредельные углеводороды. Изомерия.
Задание№8. Постройте поочередно молекулы бутадиена 1,2 и бутадиена 1,3. Запишите в тетради названия и структурные формулы веществ.
Задание 10.
 Постройте поочередно возможные изомеры бутилена 2. Запишите в тетради названия изомеров и их структурные формулы.
Постройте поочередно возможные изомеры бутилена 2. Запишите в тетради названия изомеров и их структурные формулы.Тема: Ароматические углеводороды
Задание 11. Постройте поочередно модели молекул бензола и его производных: толуола, нитробензола. Постройте модель молекулы фенола. Запишите в тетради названия и структурные формулы веществ.
Производитель оставляет за собой право изменять спецификации и характеристики приборов без согласования с пользователями
Лабораторная работа № 7 — Студопедия
«Моделирование молекул алканов и их производных»
Цели работы
· изучить особенности строения молекул органических веществ;
· найти общие признаки и различия гомологов и изомеров;
· научиться составлять модели молекул различной сложности.
Краткие теоретические сведения
| Для того чтобы понять сущность работы, надо знать, что: 1. Простейшим представителем насыщенных углеводородов является метан, структурная формула которого | |
2. | рис. 10 |
| 3. Атом углерода в молекуле метана расположен в центре тетраэдра, атомы водорода – в его вершинах. 4. Валентные углы между направлениями связей равны между собой и составляют угол 109°28′. | |
| 5. В этане есть углерод-углеродные связи. L (С-С) = 0,154 нм. Оборудование пластилин, спички. | рис. 11 |
Задание № 1. Составление сокращённых структурных формул углеводородов.
1. Формула молекулы метана.
2. Формула молекулы этана.
3. Формула молекулы пропана.
4. Формулы молекул бутана и изобутана.
5. Формулы молекулы пентана и всех его изомеров.
Задание № 2. Изготовление моделей молекул углеводородов
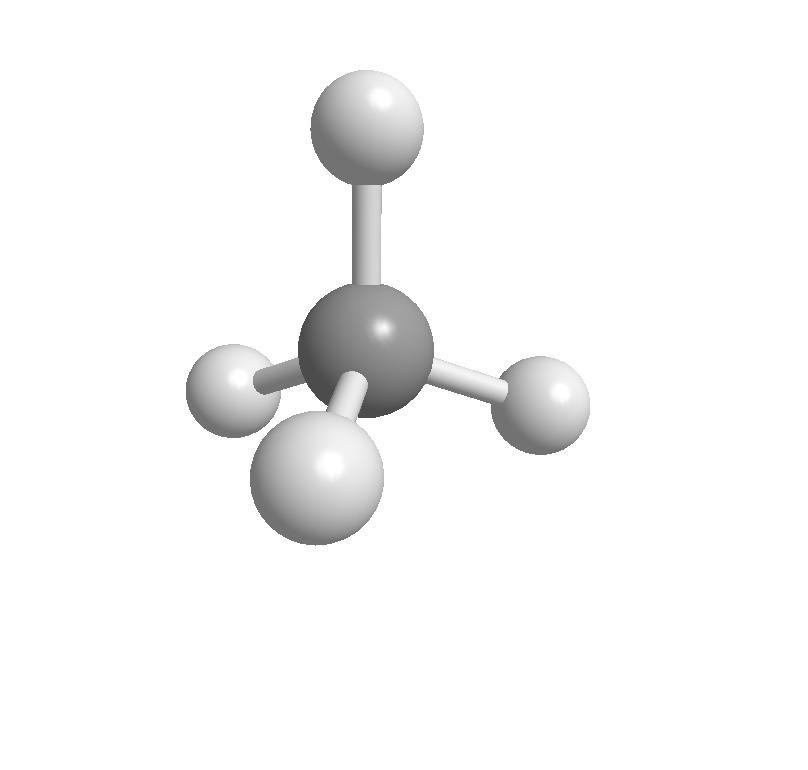
1. Модель молекулы метана. Соберите модель молекулы метана, используя для этого спички и пластилин. Для этого из пластилина (в наборе 16 шариков) выберите четыре шарика, а из пластилина (в наборе 7 шариков) – один шарик. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями С–Н составляет 109°28′, т. е. молекула имеет тетраэдрическое строение (см. рис. 10).
Модель молекулы метана. Соберите модель молекулы метана, используя для этого спички и пластилин. Для этого из пластилина (в наборе 16 шариков) выберите четыре шарика, а из пластилина (в наборе 7 шариков) – один шарик. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями С–Н составляет 109°28′, т. е. молекула имеет тетраэдрическое строение (см. рис. 10).
2. Модель молекулы этана. Соберите модель молекулы этана, используя для этого спички и пластилин. Учтите, что в молекуле этана угол между химическими связями С–Н составляет 109°28′, а углерод-углеродные связи L (С-С) = 0,154 нм. (см. рис. 11).
3. Модель молекулы пропана. Соберите модель молекулы пропана, используя для этого спички и пластилин.
4. Модели молекул бутана и изобутана. Соберите модель молекулы н-бутана, используя пластилин. Подумайте и переделайте модель н-бутана в модель молекулы изобутана. Учтите, что в бутане атомы углерода расположены по отношению друг к другу под углом 109°, т.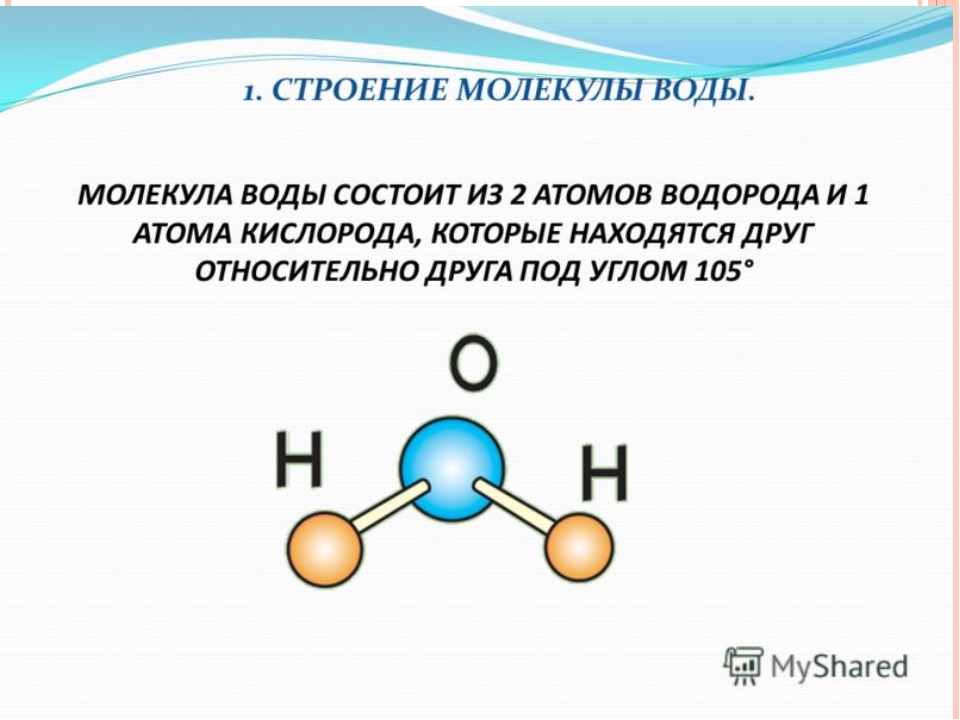
5. Модели молекул пентана и всех его изомеров. Соберите модель молекулы н-пентана и всех его изомеров последовательно, используя пластилин.
Вопросы для выводов
1. Сколько моделей: а) гомологов, б) изомеров было собрано во время лабораторной работы
2. Что общего и в чём различия в строении а) гомологов, б) изомеров
Контрольные вопросы
1) Какие вещества называют органическими?
2) В чем отличие органических веществ от неорганических веществ?
3) Определите молекулярную формулу вещества, если оно содержит С-80%,Н-20%, а плотность вещества по водороду равна 15.
Опыт № 11/12. Изготовление моделей молекул органических соединений
Оборудование. Наборы разного цвета шаров и стержней.
А. Изготовление моделей углеводородов и их галогенопроизводных
Задания. 1—5. Соберите шаростержневые модели молекулы метана и его гомологов.
6—7. Соберите шаростержневые модели молекул дихлор-метана и дихлорэтана.
Выполнение опыта
1. Возьмите шарик, который условно будет изображать атом углерода, и четыре стержня (или спички), которые будут изображать связи С—Н. Объясните, почему химические связи располагаются вокруг атома углерода под углом 109°28′ относительно друг друга. Расположите четыре стержня под указанным углом между ними.
2. Мысленно или при помощи нити соедините центры ядер атомов водорода (свободные концы стержней) друг с другом. Изображение какой геометрической фигуры вы получили?
3. На свободные концы стержней прикрепите (наколите) четыре шарика. Такая модель молекулы метана называется шаростержневой моделью.
Аналогичные модели молекул, в которой детали, изображающие атомы элементов, выполняются в соответствующем масштабе, называются масштабными.
4. Соберите шаростержневые модели молекул метана, этана, пропана, бутана.
Что общего в строении молекул этих веществ, в чем различие? Чем объясняется зигзагообразное строение углеродной цепи в молекулах пропана и бутана? Какова величина угла в зигзагообразном отрезке углеродной цепи? Продемонстрируйте на моделях молекул этана и пропана возможность свободного вращения углеводородных радикалов относительно друг друга (конформация) и образования в результате этого огромного числа пространственных изомеров. Почему нельзя выделить эти изомеры?
5. Изготовьте шаростержневые модели н-бутана и н-пентана. С помощью моделей покажите возможный переход парафинов в циклопарафины и наоборот. Сохраняется ли размер валентных углов в углеродной цепи парафинов при превращении их в циклопарафины?
6. Изготовьте шаростержневые модели молекул метана и четырех молекул хлора. С помощью этих моделей продемонстрируйте поэтапное замещение атомов водорода в метане на атомы хлора с образованием хлороводорода и соответствующих галогенопроизводных метана.
7. Соберите шаростержневые модели молекул дихлорметана и дихлорэтана. Имеются ли изомеры у этих галогенопроизводных? Если да, то покажите их с помощью моделей, назовите их.
Б. Изготовление моделей молекул метиламина и диметиламина
Выполнение опыта
1. Используя приемы, описанные выше, соберите шаростержневые модели молекул аммиака и метана. Удалите по одному атому из каждой молекулы и остатки соедините свободными валентностями. Получилась модель молекулы метиламина. Сделайте вывод, что представляет собой это соединение по отношению к аммиаку и метану.
2. Соберите шаростержневую модель молекулы диметиламина. Что представляет собой это соединение по отношению к аммиаку?
Оборудование. Наборы разного цвета шаров и стержней.
А. Изготовление моделей углеводородов и их галогенопроизводных
Задания. 1—5. Соберите шаростержневые модели молекулы метана и его гомологов.
6—7. Соберите шаростержневые модели молекул дихлор-метана и дихлорэтана.
Выполнение опыта
1. Возьмите шарик, который условно будет изображать атом углерода, и четыре стержня (или спички), которые будут изображать связи С—Н. Объясните, почему химические связи располагаются вокруг атома углерода под углом 109°28′ относительно друг друга. Расположите четыре стержня под указанным углом между ними.
2. Мысленно или при помощи нити соедините центры ядер атомов водорода (свободные концы стержней) друг с другом. Изображение какой геометрической фигуры вы получили?
3. На свободные концы стержней прикрепите (наколите) четыре шарика. Такая модель молекулы метана называется шаростержневой моделью.
Аналогичные модели молекул, в которой детали, изображающие атомы элементов, выполняются в соответствующем масштабе, называются масштабными.
4. Соберите шаростержневые модели молекул метана, этана, пропана, бутана.
Что общего в строении молекул этих веществ, в чем различие? Чем объясняется зигзагообразное строение углеродной цепи в молекулах пропана и бутана? Какова величина угла в зигзагообразном отрезке углеродной цепи? Продемонстрируйте на моделях молекул этана и пропана возможность свободного вращения углеводородных радикалов относительно друг друга (конформация) и образования в результате этого огромного числа пространственных изомеров. Почему нельзя выделить эти изомеры?
Почему нельзя выделить эти изомеры?
5. Изготовьте шаростержневые модели н-бутана и н-пентана. С помощью моделей покажите возможный переход парафинов в циклопарафины и наоборот. Сохраняется ли размер валентных углов в углеродной цепи парафинов при превращении их в циклопарафины?
6. Изготовьте шаростержневые модели молекул метана и четырех молекул хлора. С помощью этих моделей продемонстрируйте поэтапное замещение атомов водорода в метане на атомы хлора с образованием хлороводорода и соответствующих галогенопроизводных метана.
7. Соберите шаростержневые модели молекул дихлорметана и дихлорэтана. Имеются ли изомеры у этих галогенопроизводных? Если да, то покажите их с помощью моделей, назовите их.
А. 1, 2, 3.
Потому, что этот угол (109°28′) наиболее выгоден для молекулы, получается симметричная структура: атомы и равно отдалены друг от друга и находятся на одинаковом расстоянии от атома С. Атомы водорода образуют тетраэдр, причем атом C расположен в центре.
4. Пространственное строение не изменилось.
5.
Общее: углы между связями одинаковы для разных молекул (109°28′). Зигзагообразное строение углеродной связи объясняется углом (109°28′) и способностью свободно вращаться. Пространственные изомеры нельзя выделить потому, что углеводородные радикалы вращаются свободно относительно друг друга.
6. Размер валентных углов сохраняется.
7. 8.
2.
Изомерия в химии | Путешествие в мир химии
Оптическая изомерия в химии — не редкость. Она возникает, когда молекулы асимметричны и их формулы относятся друг к другу, как правая рука к левой (или как предмет к его зеркальному изображению).
Такие формулы (и такие предметы), как их ни верти в пространстве, невозможно совместить друг с другом — как невозможно левую перчатку надеть на правую руку, и наоборот.
Простейшую модель двух таких молекул легко сделать из пластилина и спичек.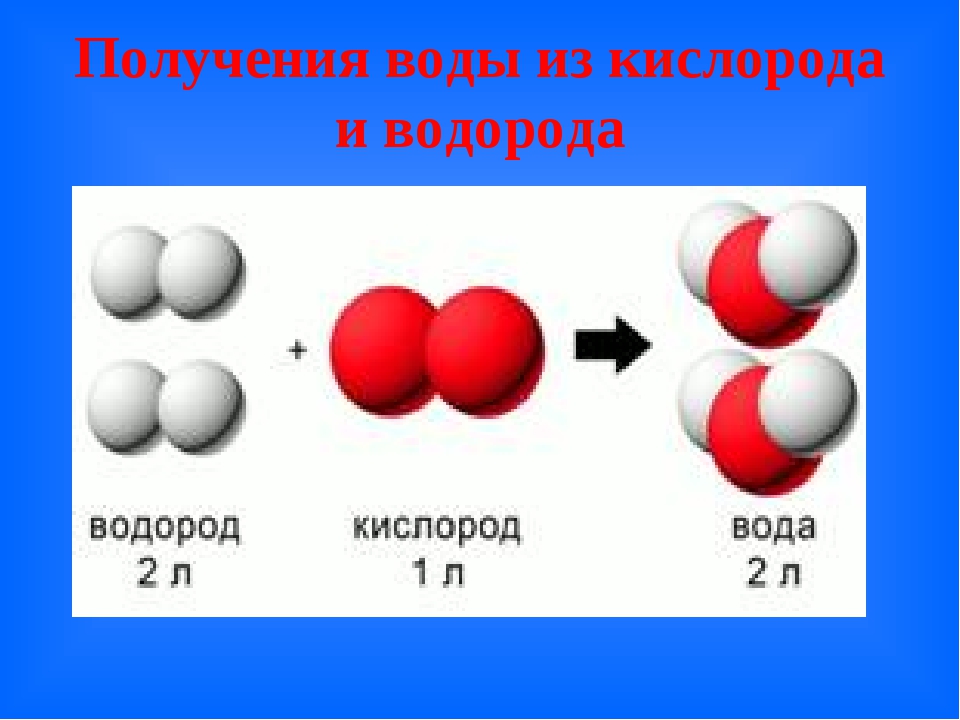 Сначала сделаем модель молекулы метана СН4. Для этого один атом углерода поместим в центре и во все стороны от него на равных расстояниях от центра, а также друг от друга поместим четыре маленьких пластилиновых шарика — атомы водорода.
Сначала сделаем модель молекулы метана СН4. Для этого один атом углерода поместим в центре и во все стороны от него на равных расстояниях от центра, а также друг от друга поместим четыре маленьких пластилиновых шарика — атомы водорода.
Такую форму имеет геометрическая фигура тетраэдр (в переводе с греческого это значит «с четырьмя гранями»).
Понятно, что такая молекула — единственная.
Заменим теперь один атом водорода на какой-нибудь другой атом, например на атом хлора (этот шарик должен быть из пластилина другого цвета).
Получилась модель хлорметана СН3С1.
И эта молекула единственная.
Заменим второй атом водорода, например, на атом брома (шарик третьего цвета). Получилась опять-таки единственная молекула хлорбромметана СН2С1Вг.
Наконец, заменим третий атом водорода, например, на атом йода. Получилась интересная молекула CHClBrI, в которой все четыре заместителя у атома углерода — разные.
А интересна она тем, что молекул с такой формулой может быть две! И, следовательно, из таких молекул можно построить два разных вещества. Если же хотя бы два атома из четырёх будут одинаковыми, молекулы будут полностью идентичными.
Если же хотя бы два атома из четырёх будут одинаковыми, молекулы будут полностью идентичными.
Это легко проверить, если сделать ещё одну точно такую же модель молекулы CHClBrI и потом поменять местами два любых заместителя у атома углерода.
Получатся две модели, которые невозможно, как их ни крути, совместить друг с другом. Зато вторую модель можно увидеть (хотя нельзя потрогать), если первую, расположив её нужным образом, отразить в зеркале.
Одну из пары подобных молекул называют правым изомером, а вторую — левым изомером.
А само это свойство молекул называют хиральностью.
Это слово появилось сравнительно недавно, хотя в русском языке давно есть однокоренные слова: хирург, хирургия, хиромантия.
Все они произошли от греческого слова cheir — «рука». С хирургом и хиромантией (гаданием по руке) понятно.
Но и две хиральные молекулы отличаются друг от друга, как правая рука от левой, так что это свойство условно можно назвать «ручностью». Вещества, построенные из «правых» и «левых» молекул, называют оптическими антиподами, потому что они различаются некоторыми оптическими свойствами.
По-гречески слово «антиподы» означает «расположенные ногами к ногам»; так, например, называют жителей двух противоположных точек на земном шаре, что очень удивило Алису в Стране чудес. И если кристаллы веществ не центрально-симметричны (как, например, у поваренной соли), то такие кристаллы тоже будут отличаться друг от друга как предмет и его отражение.
Именно это обнаружил впервые французский химик и микробиолог Луи Пастер (1822-1895).
Но здесь нужно рассказать о некоторых эпизодах из истории другой науки, оптики.
Стереохимическую теорию (слово происходит от греч. stereos — «пространственный») создал молодой голландский учёный Якоб Хендрик Вант-Гофф (1852-1911), получивший в 1901 году первую в истории Нобелевскую премию по химии.
Со временем проявилось его страшное побочное действие: средство оказалось тератогенным (этот термин происходит от греч. teras (род. падеж teratos) — «чудовище», «урод» и означает «рождающее уродов»).
У множества женщин, принимавших это лекарство, на свет появились младенцы с врождёнными уродствами. Лишь в конце 1980-х годов выяснилось, что причиной несчастий был только один из энантиомеров талидомида — его правая D-форма.
Лишь в конце 1980-х годов выяснилось, что причиной несчастий был только один из энантиомеров талидомида — его правая D-форма.
К сожалению, такое различие в действии лекарственных форм раньше не было известно, и талидомид представлял собой рацемическую смесь обоих антиподов.
Со временем было обнаружено немало примеров разного действия лекарств, молекулы которых являются оптическими антиподами. «Когда молекула смотрится в зеркало» — так называлась статья, опубликованная в одном американском химическом журнале.
На обложке журнала в качестве иллюстрации к этой статье был помещён необычный рисунок. В зеркало смотрится добродушно виляющий хвостом пёс, на боку которого изображена химическая формула одного из лекарственных средств — пеницилламина.
Отражение же этого пса в зеркале было нарисовано в виде страшного зверя с оскаленной клыкастой пастью и вставшей дыбом шерстью. Формула вещества на его боку была просто зеркальным отображением первой.
И действие правого и левого изомеров отличалось так же, как и эти два рисунка. Пеницилламин — довольно простое производное аминокислоты цистеина.
Пеницилламин — довольно простое производное аминокислоты цистеина.
Это вещество применяют в ряде случаев, в том числе при острых и хронических отравлениях медью, ртутью, свинцом, другими тяжёлыми металлами, так как оно обладает способностью связывать эти металлы и затем выводить их из организма через почки.
Но используют только его «левую» форму, так как «правый» изомер токсичен и может привести к слепоте.
В настоящее время многие лекарственные средства выпускаются в виде оптически чистых соединений.
Разделять рацематы или прямо синтезировать лишь один оптически активный энантиомер сложно, и это одна из причин очень высокой стоимости некоторых лекарств.
Запахи тмина и мяты — действие разных изомеров одного и того же вещества: карвона.
Читайте так же:
Конспект урока «Различать атомы и молекулы»
Раздел долгосрочного плана: Строение и свойства веществ | Школа: НИШ ХБН г. | ||||||||
Дата: | ФИО учителя: | ||||||||
Класс: 6 | Количество присутствующих: | отсутствующих: | |||||||
Тема урока | Атомы и молекулы. Простые и сложные вещества. | ||||||||
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу) | 6.3.1.1 различать атомы и молекулы, простые и сложные вещества | ||||||||
Цели урока | Сформировать понятия «молекула», «атом», «простое вещество», «сложное вещество». Научить различать атомы и молекулы, простые и сложные вещества. | ||||||||
Критерии успеха | Учащиеся: — умеют различать атомы и молекулы, простые и сложные вещества | ||||||||
Языковые цели | Учащиеся могут: пользоваться ключевой лексикой для устного описания атома и молекулы, простого и сложного вещества | ||||||||
Привитие ценностей | Уважение по отношению к себе и окружающим Сотрудничество Ответственная гражданская позиция Академическая честность Обучение на протяжении всей жизни Прозрачность | ||||||||
Межпредметные связи | Естествознание | ||||||||
Серия полезных фраз для диалога/письма | Вещества состоят из отдельных мельчайших частиц… Молекулы способны к самостоятельному существованию. Все предметы и вещества состоят из атомов и молекул. Молекула — это наименьшая частица вещества. Молекулы построены из атомов. Сложное вещество состоит из молекул, построенных из атомов разных видов. Простое вещество состоит из атомов только одного вида или из молекул. | ||||||||
Навыки использования ИКТ | |||||||||
Предварительные знания | |||||||||
Предметная лексика | Атом, молекула, простое вещество, сложное вещество. | ||||||||
Ход урока | |||||||||
Запланированные этапы урока | Запланированная деятельность на уроке | Ресурсы | |||||||
Начало урока 3 мин 5 мин 2 мин | Приветствие. Разделить класс на 4 группы, используя технологию «Атомы и молекулы»: Атомы и молекулы Участники группы разбредаются по классу. Учитель произносит: «Каждый из вас — одинокий атом, блуждающий в пространстве. Вы встречаетесь с другими атомами, иногда даже случаются легкие столкновения. Но иногда вы получаете возможность объединиться в молекулы. Вы будете делать это по моей команде. Число атомов в молекуле я назову». Через некоторое время учитель хлопает в ладоши и произносит, например: «Четыре». Учащиеся быстро составляют группы по четыре человека. Те, кто не успел войти ни в одну «молекулу» (скажем, игроков осталось трое), выбывают из игры. «Молекулы» снова распадаются на атомы, продолжающие блуждать в пространстве до следующей команды учителя. В результате можно либо создать две команды (из тех, кто выбыл, и из тех, кто остался в игре), либо в определенный момент дать команду собраться в молекулы с таким числом атомов, какое нужно для дальнейших процедур (хорошо, если это число будет равно количеству выбывших участников, которые тогда смогут образовать свою группу). Предложить отгадать ребусы (Приложение 1). Предварительно объявить, что ребусы выполняют на скорость. Назвать тему, цели урока, критерии оценивания. | Можно включить тихую мелодию Ребусы (на листах А-4) Презентация | |||||||
Середина урока 5 мин 7 мин 8 мин 5 мин | Учитель: «Люди давно догадывались о том, что вещества состоят из отдельных мельчайших частиц. Их называют атомами. В подавляющем большинстве случаев атомы не существуют по одиночке, а объединяются в группы — молекулы. Атомы и молекулы чрезвычайно малы: в любом крошечном кусочке вещества, который мы в состоянии разглядеть (например, в пылинке) содержится больше атомов, чем звезд во всей нашей Галактике. По сравнению с многообразием веществ число атомов весьма ограничено. Атомы могут различным образом соединяться друг с другом. Как из букв алфавита можно составить сотни тысяч слов, так из одних и тех же атомов образуются молекулы или кристаллы огромного количества различных веществ, из которых состоит окружающий мир. Молекула — это наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию. Молекулы построены из атомов». Простое вещество состоит из атомов только одного вида или из молекул, построенных из атомов одного вида. Сложное вещество состоит из молекул, построенных из атомов разных видов. Задание №1: Приложение 2: 1 (а) На рисунке представлены атомы, молекулы, простые и сложные вещества. Определите их. Атом | Молекула | Простое вещество | Сложное вещество | |||||
1.Учащийся правильно записывает в таблицу номера картинок, изображающих атомы.
2. Учащийся правильно записывает в таблицу номера картинок, изображающих молекулы.
3. Учащийся правильно записывает в таблицу номера картинок, изображающих простые вещества.
4. Учащийся правильно записывает в таблицу номера картинок, изображающих сложные вещества.
1(b) В таблицы приведены высказывания. Определите, какие из них «истина», а какие высказывания «ложь» (ответы отметьте галочкой в соответствующем столбце)
Задание №2
Раздать учащимся коробочки со спичками, пластилин (на 2 человека). Разделить на 4 группы (по желанию учащихся). Предложить создать модели атомов, молекул, простых веществ, сложных веществ. Учащиеся представляют свои работы друг другу по очереди.
Приложение 4
Задание №3
Завершите предложения:
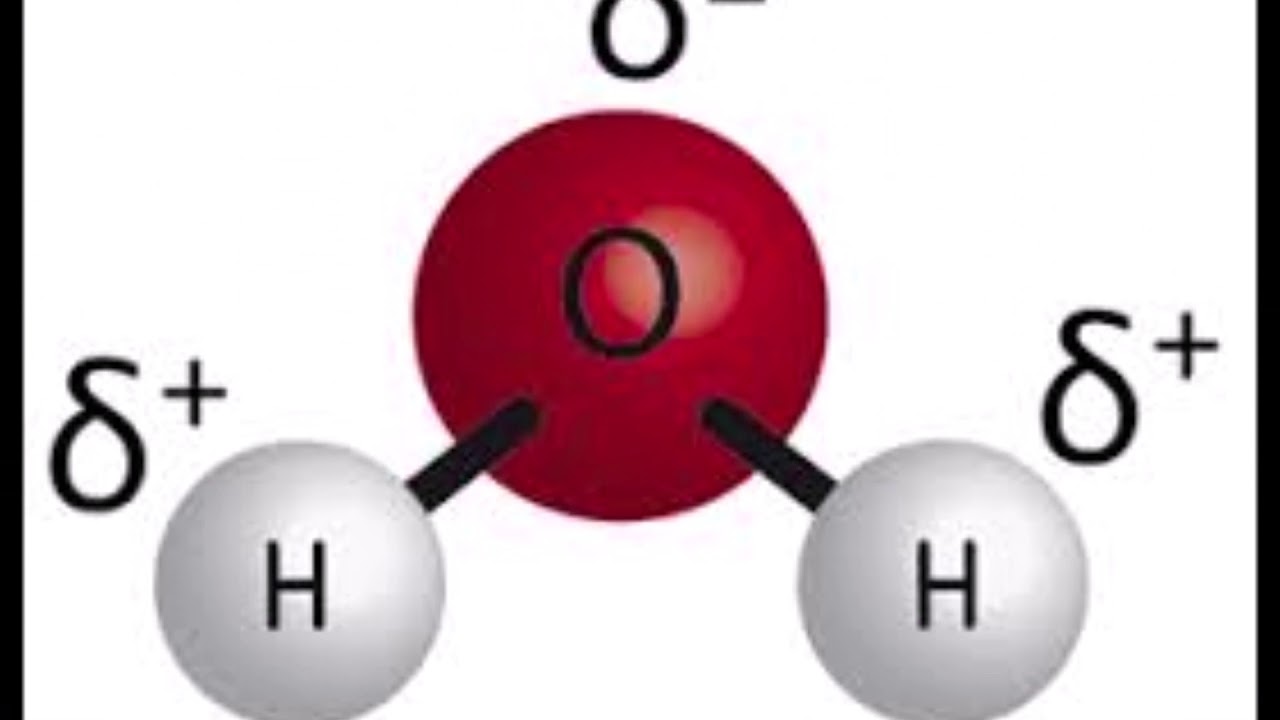
На Солнце водород существует в виде изолированных ………….. из-за высокой температуры. А на Земле – в……………………………….виде, 2 атома водорода соединяются друг с другом, и образуется ………………….вещество – водород, который является самым лёгким газом. Но элемент водород способен соединяться не только друг с другом, но также и с другими ……………. Если 2 атома водорода соединятся с 1 атомом кислорода, то получится ……………….. воды.
……………. всех химических элементов при очень высоких температурах существуют в виде свободных (изолированных) ………………. (на Солнце).
Простые вещества – ………………….(примеры).
Сложные вещества – …………………..(примкры).
Карточка. Приложение 1
Пластилин, спички
Карточка
Конец урока
5 мин
Рефлексия
Выборочно провести опрос среди учащихся:
Что узнали нового?
Что запомнили?
Над чем надо поработать?
Д/з Повторить конспект
Мяч
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися?
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися?
Здоровье и соблюдение техники безопасности
Дифференциация может быть выражена в подборе заданий, в ожидаемом результате от конкретного ученика, в оказании индивидуальной поддержки учащемуся, в подборе учебного материала и ресурсов с учетом индивидуальных способностей учащихся (Теория множественного интеллекта по Гарднеру).
Дифференциация может быть использована на любом этапе урока с учетом рационального использования времени.
Используйте данный раздел для записи методов, которые Вы будете использовать для оценивания того, чему учащиеся научились во время урока.
Здоровьесберегающие технологии.
Используемые физминутки и активные виды деятельности.
Пункты, применяемые из Правил техники безопасности на данном уроке.
Рефлексия по уроку
Были ли цели урока/цели обучения реалистичными?
Все ли учащиеся достигли ЦО?
Если нет, то почему?
Правильно ли проведена дифференциация на уроке?
Выдержаны ли были временные этапы урока?
Какие отступления были от плана урока и почему?
Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки.
Общая оценка
Какие два аспекта урока прошли хорошо (подумайте как о преподавании, так и об обучении)?
1:
2:
Что могло бы способствовать улучшению урока (подумайте как о преподавании, так и об обучении)?
1:
2:
Что я выявил(а) за время урока о классе или достижениях/трудностях отдельных учеников, на что необходимо обратить внимание на последующих уроках?
Теория
Атомы и молекулы. Простые и сложные вещества
Люди давно догадывались о том, что вещества состоят из отдельных мельчайших неделемые частиц. Их называют атомами. В подавляющем большинстве случаев атомы не существуют по одиночке, а объединяются в группы — молекулы. Атомы и молекулы чрезвычайно малы: в любом крошечном кусочке вещества, который мы в состоянии разглядеть (например, в пылинке) содержится больше атомов, чем звезд во всей нашей Галактике.
По сравнению с многообразием веществ число атомов весьма ограничено. Атомы могут различным образом соединяться друг с другом. Как из букв алфавита можно составить сотни тысяч слов, так из одних и тех же атомов образуются молекулы или кристаллы огромного количества различных веществ, из которых состоит окружающий мир.
Молекула — это наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию. Молекулы построены из атомов.
Вещество (например, сахар) можно размолоть на самой тонкой мельнице и все равно каждая крупинка будет состоять из огромного количества одинаковых молекул сахара и сохранит все известные нам свойства этого вещества. Даже если раздробить вещество на отдельные молекулы, как это происходит при растворении сахара в воде, то вещество продолжает существовать и проявлять свои свойства (в этом легко убедиться, попробовав раствор на вкус). Значит, самостоятельно существующая молекула сахара — это еще вещество под названием «сахар» (пусть даже очень маленькое количество этого вещества). Но если продолжить дробление дальше, то придется разрушить молекулы. А разрушив молекулы или даже отняв у них по паре атомов (из трех десятков, составляющих молекулу сахара!), мы уже разрушаем само вещество. Конечно, атомы никуда не исчезают — они начинают входить в состав каких-то других молекул. Но сахар как вещество при этом перестает существовать — он превращается в какие-то другие вещества.
Вещества не вечны, потому что не вечны их молекулы. Зато атомы практически вечны. В каждом из нас найдутся атомы, существовавшие еще во времена динозавров. Или участвовавших в походах Александра Македонского, или в плавании Колумба, или побывавших при дворе Ивана Грозного.
Рис. 1-1. Модели молекул и названия веществ, входящих в состав лесного воздуха: 1 — азот, 2 — кислород, 3 — аргон, 4 — углекислый газ, 5 — вода, 6 — озон, 7 — терпинеол (последние два вещества находятся в воздухе в следовых количествах).
Существует условное деление веществ на простые и сложные. Молекулы простых веществ состоят из атомов одного вида. Примеры: азот, кислород, аргон, озон. Молекулы сложных веществ составлены из атомов двух и более видов: углекислый газ, вода, терпинеол.
Часто физическое тело состоит из молекул нескольких разных веществ. Такое физическое тело называется смесью. Например, воздух — смесь нескольких простых и сложных веществ. Не нужно путать сложное вещество со смесью. Сложное вещество, если оно состоит из молекул только одного вида, смесью не является.
Простое вещество состоит из атомов только одного вида или из молекул, построенных из атомов одного вида.
Сложное вещество состоит из молекул, построенных из атомов разных видов.
Смесью называется вещество, состоящее из молекул (или атомов) двух или нескольких веществ. Вещества, составляющие смесь, могут быть простыми и сложными.
На Земле пока никто не смог написать такой книги, в которой были бы описаны абсолютно все известные человечеству вещества — от «а» до «я». Впрочем, в этом нет особой необходимости. Чтобы знать химию, не нужно заучивать названия или сведения об огромном количестве веществ — достаточно знать законы, по которым они образуются и взаимодействуют с другими веществами.
Приложение 1 — Ребусы.
Задание: отгадайте ребусы
Дескриптор:
Правильно разгадывает первое слово.
Правильно разгадывает второе слово.
Правильно разгадывает третье слово.
Правильно разгадывает четвертое слово.
Приложение 2
1 (а) На рисунке представлены атомы, молекулы, простые и сложные вещества. Определите их.Дескрипторы:
1. Учащийся правильно записывает в таблицу номера картинок, изображающих атомы.
2. Учащийся правильно записывает в таблицу номера картинок, изображающих молекулы.
3. Учащийся правильно записывает в таблицу номера картинок, изображающих простые вещества.
4. Учащийся правильно записывает в таблицу номера картинок, изображающих сложные вещества.
1 (b) В таблицы приведены высказывания. Определите, какие из них «истина», а какие высказывания «ложь» (ответы отметьте галочкой в соответствующем столбце)
Простое вещество | Мельчайшие неделимые частицы | |
Сложное вещество | Вещество, состоящее из молекул, построенных из атомов разных видов |
Дескрипторы:
1) Правильно соотносит понятие «Атом».
2) Правильно соотносит понятие «Молекула».
3) Правильно соотносит понятие «Простое вещество».
4) Правильно соотносит понятие «Сложное вещество».
Приложение 3
Создать модели атомов, молекул, простых веществ, сложных веществ.
Дескриптор:
Правильно создаёт модель атома.
Правильно создаёт модель молекулы.
Правильно создаёт модель простого вещества.
Правильно создаёт модель сложного вещества.
Приложение 4
Задание №3Завершите предложения:
На Солнце водород существует в виде изолированных ………….. из-за высокой температуры. А на Земле – в……………………………….виде, 2 атома водорода соединяются друг с другом, и образуется ………………….вещество – водород, который является самым лёгким газом. Но элемент водород способен соединяться не только друг с другом, но также и с другими ……………. Если 2 атома водорода соединятся с 1 атомом кислорода, то получится ……………….. воды.
……………. всех химических элементов при очень высоких температурах существуют в виде свободных (изолированных) ………………. (на Солнце).
Простые вещества – ………….(примеры).
Сложные вещества – ………….…(примеры).
Задание №3
Завершите предложения:
На Солнце водород существует в виде изолированных ………….. из-за высокой температуры. А на Земле – в……………………………….виде, 2 атома водорода соединяются друг с другом, и образуется ………………….вещество – водород, который является самым лёгким газом. Но элемент водород способен соединяться не только друг с другом, но также и с другими ……………. Если 2 атома водорода соединятся с 1 атомом кислорода, то получится ……………….. воды.
……………. всех химических элементов при очень высоких температурах существуют в виде свободных (изолированных) ………………. (на Солнце).
Простые вещества – ………….(примеры).
Сложные вещества – ………….…(примеры).
Задание №3
Завершите предложения:
На Солнце водород существует в виде изолированных ………….. из-за высокой температуры. А на Земле – в……………………………….виде, 2 атома водорода соединяются друг с другом, и образуется ………………….вещество – водород, который является самым лёгким газом. Но элемент водород способен соединяться не только друг с другом, но также и с другими ……………. Если 2 атома водорода соединятся с 1 атомом кислорода, то получится ……………….. воды.
……………. всех химических элементов при очень высоких температурах существуют в виде свободных (изолированных) ………………. (на Солнце).
Простые вещества – ………….(примеры).
Сложные вещества – ………….…(примеры).
Задание №3
Завершите предложения:
На Солнце водород существует в виде изолированных ………….. из-за высокой температуры. А на Земле – в……………………………….виде, 2 атома водорода соединяются друг с другом, и образуется ………………….вещество – водород, который является самым лёгким газом. Но элемент водород способен соединяться не только друг с другом, но также и с другими ……………. Если 2 атома водорода соединятся с 1 атомом кислорода, то получится ……………….. воды.
……………. всех химических элементов при очень высоких температурах существуют в виде свободных (изолированных) ………………. (на Солнце).
Простые вещества – ………….(примеры).
Сложные вещества – ………….…(примеры).
Дескриптор:
Правильно дополняет пропуски словами.
Приложение 4 — Ответы
Задание №3Солнце водород существует в виде изолированных атомов из-за высокой температуры. А на Земле – в молекулярном виде, 2 атома водорода соединяются друг с другом, и образуется простое вещество – водород, который является самым лёгким газом. Но элемент водород способен соединяться не только друг с другом, но также и с другими атомами. Если 2 атома водорода соединятся с 1 атомом кислорода, то получится молекула воды.
Атомы всех химических элементов при очень высоких температурах существуют в виде свободных (изолированных) атомов (на Солнце).
Простые вещества – водород, кислород, медь, железо, сера, золото, серебро, азот.
Сложные вещества – вода, сахар, углекислый газ, спирт, бензол.
Задание №3
Солнце водород существует в виде изолированных атомов из-за высокой температуры. А на Земле – в молекулярном виде, 2 атома водорода соединяются друг с другом, и образуется простое вещество – водород, который является самым лёгким газом. Но элемент водород способен соединяться не только друг с другом, но также и с другими атомами. Если 2 атома водорода соединятся с 1 атомом кислорода, то получится молекула воды.
Атомы всех химических элементов при очень высоких температурах существуют в виде свободных (изолированных) атомов (на Солнце).
Простые вещества – водород, кислород, медь, железо, сера, золото, серебро, азот.
Сложные вещества – вода, сахар, углекислый газ, спирт, бензол.
Задание №3
Солнце водород существует в виде изолированных атомов из-за высокой температуры. А на Земле – в молекулярном виде, 2 атома водорода соединяются друг с другом, и образуется простое вещество – водород, который является самым лёгким газом. Но элемент водород способен соединяться не только друг с другом, но также и с другими атомами. Если 2 атома водорода соединятся с 1 атомом кислорода, то получится молекула воды.
Атомы всех химических элементов при очень высоких температурах существуют в виде свободных (изолированных) атомов (на Солнце).
Простые вещества – водород, кислород, медь, железо, сера, золото, серебро, азот.
Сложные вещества – вода, сахар, углекислый газ, спирт, бензол.
Задание №3
Солнце водород существует в виде изолированных атомов из-за высокой температуры. А на Земле – в молекулярном виде, 2 атома водорода соединяются друг с другом, и образуется простое вещество – водород, который является самым лёгким газом. Но элемент водород способен соединяться не только друг с другом, но также и с другими атомами. Если 2 атома водорода соединятся с 1 атомом кислорода, то получится молекула воды.
Атомы всех химических элементов при очень высоких температурах существуют в виде свободных (изолированных) атомов (на Солнце).
Простые вещества – водород, кислород, медь, железо, сера, золото, серебро, азот.
Сложные вещества – вода, сахар, углекислый газ, спирт, бензол.
Газообразные (газ) — презентация онлайн
1. газообразные (газ).
2. Демонстрационный опыт нагревание над пламенем спиртовки соли и сахара
3. Демонстрационный опыт Растворение и разбавление раствора перманганата марганца (марганцовки).
4. Дополнительный материал.
Сам термин появился в наукесравнительно недавно (1647 г. фр.
ученый Пьер Гассенди).
Самая малая частица воды –
молекула
воды. Самая
малая
частица сахара – молекула сахара.
Молекулы сохраняют основные
свойства
вещества.
Молекула
сахара — сладкая. Молекула соли –
солёная. Молекула марганцовки –
розовая.
5. Ломоносов Михаил Васильевич (1711-1765)
Молекула кислородаМолекула воды
Молекула водорода
7. Задания: Из цветного пластилина слепить: модель молекулы муравьиной кислоты. модель молекулы углекислого газа. модель молекулы
поваренной соли.8. Разделите рисунки на три группы: тело, вещество, молекула.
9. Домашнее задание
§ 3; рабочая тетрадь – всезадания на с. 6-7, задания
№1-2 на с.18 учебника
10. Благодарю за внимание!
11. газообразные (газ).
12. Демонстрационный опыт нагревание над пламенем спиртовки соли и сахара
13. Демонстрационный опыт Растворение и разбавление раствора перманганата марганца (марганцовки).
14. Дополнительный материал.
Сам термин появился в науке сравнительнонедавно (1647 г. фр. ученый Пьер
Гассенди).
Самая малая частица воды – молекула
воды. Самая малая частица сахара –
молекула сахара.
Молекулы сохраняют основные свойства
вещества. Молекула сахара — сладкая.
Молекула соли – солёная. Молекула
марганцовки – розовая.
15. Ломоносов Михаил Васильевич (1711-1765)
Молекула кислородаМолекула воды
Молекула водорода
17. Задания: Из цветного пластилина слепить: модель молекулы муравьиной кислоты. модель молекулы углекислого газа. модель молекулы
поваренной соли.18. Разделите рисунки на три группы: тело, вещество, молекула.
19. Домашнее задание
§ 3; рабочая тетрадь – всезадания на с. 6-7, задания
№1-2 на с.18 учебника
Тетраэдр как модель атома углерод
Геометрическая изомерия (цис- и транс-изомерия). Этот вид изомерии требует пространственного распределения частиц. Подобно тому как для объяснения изомерии в органической химии Вант-Гофф построил тетраэдрическую модель молекулы, где в центре тетраэдра располагается атом углерода, а в вершинах — связанные с ним группы, Вернер для объяснения изомерии неорганических комплексных соединений с координационным числом 6 привлек октаэдрическую модель, где в центре октаэдра находится центральный атом, а в вершинах — координированные группы — лиганды. [c.378]Модели атомов и молекул можно представить в форме различных тел шара, пирамиды, тетраэдра и т. д. Модель атома углерода имеет тетраэдрическое строение. Тетраэдр —это пирамида, в основании которой лежит равносторонний треугольник. В центре тетраэдра находится атом углерода, а все его четыре валентности направлены к вершинам тетраэдра (рис. 2). [c.34]
Структурные формулы не дают представления о пространственной структуре молекул веществ. Они только изображают порядок сцепления атомов друг с другом. Молекула метана имеет тетраэдрическое строение 4 атома водорода образуют правильный тетраэдр вокруг атома углерода, находящегося в центре (рис. 55). Модель молекулы метана изображена на рис. 56. Атомы на нем показаны как бы сплющенными. Основанием для такого изображения послужило строение метана. Атом углерода связан с каждым водородным атомом в молекуле метана парой общих электронов. Электронные пары образуются при непосредственном соприкосновении атомов. Они как бы стягивают атомы, вследствие чего их электронные обо- [c.194]
На рис. 23 представлены две пространственные модели молекул молочной кислоты в них асимметрический атом углерода, расположенный в центре тетраэдра, изображен черным шариком остальные группы (в вершинах тетраэдра) условно обозначены шариками с различной штриховкой. [c.199]
Рассмотрим тетраэдрическую модель метана (рис. 16). Атом углерода находится в центре правильного тетраэдра, а четыре [c.55]
На рис. 10 представлена модель молекулы метана. Атом углерода (черный шарик) расположен как бы в центре тетраэдра (стр. 24), [c.37]
Вант-Гофф предложил тетраэдрическую модель атома углерода Согласно этой теории, четыре валентности атома углерода в метане направлены к четырем углам тетраэдра, в центре которого находится углеродный атом, а в вершинах — атомы водорода (рис 1, а) Этан, согласно Вант-Гоффу, можно представить себе как два тетраэдра, соединенных вершинами и свободно вращающихся около общей оси (рис 1, б) Модель молекулы этилена представляет собой два тетраэдра, соединенных ребрами (рис 1, в), а молекулы с тройной связью изображаются моделью, в которой тетраэдры соприкасаются плоскостями (рис 1, г) [c.24]
Стереохимия — область химии, изучающая структуру соединений. В качестве пособия при изучении трехмерных структур рекомендуется применять простые модели из палочек. (Некоторые, изготовленные кустарно, очень хороши.) Стереохимию иногда рассматривают только как область органической химии, но это большое заблуждение. Органические соединения характеризуются большим разнообразием форм и структур вследствие возможности существования длинных углерод-углеродных цепей, в которых каждый отдельный атом углерода окружен четырьмя группами, расположенными в вершинах тетраэдра. Поскольку углерод — элемент, находящийся во втором ряду, то в образовании химической связи принимают участие только 5- и р-орбиты. [c.72]
Модель алмаза (рис. 48) показывает, что в кристалле алмаза каждый атом углерода лежит в центре правильного тетраэдра, а четыре ближайших атома углерода — в его углах. [c.735]
Чтобы у учащихся сложилось правильное представление о строении молекул, необходимо дать сведения о пространственном строении молекул углеводородов на примере одного из них (например, метана). В конце XIX в. молодые ученые Вант-Гофф и Ле-Бель независимо друг от друга показали, что соединение с четырьмя заместителями имеет тетраэдрическую структуру в центре трехгранной пирамиды (тетраэдра), в вершинах которой располагаются атомы водорода, находится атом углерода, связанный со всеми четырьмя атомами водорода. Такую модель можно сделать из пластилина и палочек (см. рис. 1). Тетраэдрическая конфигурация соединений углерода объясняется р -гибридизацией валентных электронов углерода. [c.49]
Оптическая изомерия. В 1815 г. французский химик Био обнаружил, что некоторые органические вещества в жидком и растворенном состояниях способны вращать плоскость поляризованного света. Ранее эта особенность была отмечена для кристаллов кварца при прохождении через них поляризованного луча происходит вращение плоскости поляризации, причем одни кристаллы отклоняют ее вправо, другие—влево. В 1848 г. Л. Пастер обнаружил эту способность у винных кислот. Это явление, названное оптической изомерией, получило объяснение в работах Вант-Гоффа и Ле-Бе тя. Оно связано с определенной пространственной ориентацией ковалентных связей. Все четыре валентности атома углерода тождественны и направлены к вершинам правильного тетраэдра, в центре которого находится атом углерода. Если в вершинах тетраэдра расположить различные заместители, то молекула станет асимметричной. Пространственные модели этой молекулы будут относиться [c.150]
Модель алмаза (рис. 48) показывает, что в кристалле алмаза каждый атом углерода лежит в центре правильного тетраэдра, а четыре ближайших атома углерода — в его углах. Иначе говоря, атомы углерода в алмазе находятся в положениях, отвечающих стереохимической модели Вант-Гоффа. Расстояние между ближайшими [c.641]
В которых асимметрический атом углерода (он в формуле помечен звездочкой) находится в центре тетраэдра. Нетрудно заметить, что эти модели невозможно совместить в пространстве они построены зеркально и отображают пространственную конфигурацию молекул двух различных веществ (в данном примере молочных кислот), отличающихся некоторыми физическими, а главным образом, биологическими свойствами. Такая изомерия называется зеркальной стереоизомерией, а соответствующие изомеры— зеркальными изомерами. Различие в пространственном строении зеркальных изомеров может быть представлено и прн помощи структурных формул, в которых показано различное расположение атомных групп при асимметрическом атоме например, для приведенных на рис. 130 зеркальных изомеров молочной кислоты [c.462]
Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Ниже представлены Ь- и О-стереоизомеры глицеринового альдегида. Рядом показаны пространственные конфигурации Ь-и О-аланина [c.39]
Модель молекулы метана, где углерод соединен с четырьмя одинаковыми атомами водорода, можно представить в виде тетраэдра (правильного четырехгранника) в центре его находится атом углерода, в вершинах — атомы водорода (см. рис. 1 и 15). Таким образом, четыре валентности углерода направлены в пространстве к четырем вершинам тетраэдра. Они расположены друг к другу под углом 109°28. Эти направления сохраняются и при образовании углеродных цепей. Молекулу этана можно представить фигурой, состоящей из двух тетраэдров, соединенных вершинами (см. рис. 16), и т. д. [c.308]
Предпосылки для возникновения стереохимии создавало не только от, что в связи с изучением оптически активных соединений формировалась мысль о существовании изомерии, обусловленной геометрией молекул не только то, что стали накапливаться факты из области собственно геометрической изомерии, но и то, что в связи с разработкой теории химического строения, хотя и по случайным поводам, не раз высказывалась идея углеродного тетраэдра. Правда, как мы уже говорили (стр. 10), еще в начале века встречались упоминания о тетраэдрической модели, но они, конечно, были основательно забыты и, кроме того, и не относились специально к атому углерода. Даже модель неправильного тетраэдра у Пастера, строго говоря, относилась к целой молекуле (винной кислоты), а не к атому углерода, и в то время, когда она была предложена в качестве одной из иллюстраций понятия диссимметрии молекул, т. е. до возникновения теории химического строения, никак не могла относиться к направлению связей в пространстве. [c.33]
Для примера кратко проанализируем атом углерода, модели которого имеют разную форму в зависимости от типа связи. Углерод алифатической цепи — тетраэдр с четырьмя связями по плоскостям. Углероды этиленовой двойной связи и в ароматических соединениях имеют призматическую форму, что отражает несимметричный характер распределения л-электронов. Эллиптическая форма сечения двойной связи затрудняет свободное вращение, в то же время заместители имеют возможность свободно вращаться вокруг простых связей. Углерод тройной связи имеет форму сфероида. [c.186]
Пространственную симметрию расположения атомов и полярных связей можно легко себе представить при рассмотрении тетраэдрической модели строения метана, в соответствии с которой атом углерода находится в центре правильного тетраэдра, а другие четыре атома (водород или его заместители) расположены по отношению к нему в вершине тетраэдра (рис. 10). В том случае, когда дипольные моменты всех четырех связей равны, т. е. когда атом углерода связан с четырьмя одинаковыми атомами, как это имеет место, например, в [c.28]
В заключение рассмотрим атом углерода. Электронную конфигурацию свободного атома можно записать в виде 18 2А 2р . Два 15-электрона па первой или 7(Г-оболочке взаимно насыщаются так же, как и 25-алектроны на второй или -оболочке. Только два 2р-электрона могут дать валентные связи с другими атомами. Если бы в действительности осуществлялась эта конфигурация, углерод оказался бы двухвалентным. Хорошо известно, однако, что углерод четырехвалентен. Чтобы объяснить этот факт, представим себе, что один из 25-электронов перешел на уровень 2р, благодаря чему возникло состояние 1.ч 28 2р . Теперь атом углерода может об. 1адать четырьмя простыми связями, три из которых обусловлены р-электронами п расположены под прямыми углами, а четвертая, обусловленная 25-электропом, безразлична к выбору направления. Эта модель, хотя она и лучше первой, все же неверна, так как противоречит хорошо известному пз органической химии алифатических углеводородов факту абсолютной эквивалентности четырех валентных связей в метане. Истолкование этого явления методами во.лновой механики дано Полингом. При этом не учитывается разница энергий 25- и 2р-элек-тропов. В основе объяснения лежит факт, что если гр(25), 2р ), (2р ) и гр (2р,) являются волновыми функциями для четырех электронов, то любая их линейная комбинация такн- е является законным решением уравнения Шредингера для атома углерода. Найдя коэффициенты, аналогичные а и Ь в уравнении (203), и использовав условие, что энергия молекулы должна быть минимальной, можпо показать [18], что четыре валентности атома углерода должны быть одинаковыми и расположенными под углом а, определяемым уравнением соза= /з. Как показано в гл. XII, это как раз угол, необходимый для построения правильного тетраэдра. [c.185]
В состоянии 5р -гибридизации атом углерода связан с четырьмя заместителями. Если эти заместители одинаковы, то модель представляет собой правильный тетраэдр с валентными углами 109°28. Если с атомом углерода связаны неодинаковые заместители, то валентные углы отклоняются от тетраэдрических, разными оказываются и длины связей — тетраэдр становится неправильным. В состоянии хр -гибридизации атом углерода связан с тремя заместителями, причем все четыре атома лежат в одной плоскости, валентные углы равны 120°. Углерод в состоянии 5р-гибридизации связан с двумя заместителями все четыре атома системы с тройной связью лежат на одной прямой, валентный угол равен 180°. Все это хорошо известно из курса органической химии и не требует дополнительного обсуждения. [c.8]
Существуют стереоизомеры и другого рода. Рассмотрим, например, чем отличаются друг от друга в пространственном отношении пропионовая кислота СНз—СНг—СООН и ее а-оксипро-изводное — молочная кислота СНз—СН(ОН)—СООН. Пользуясь тетраэдрической моделью атома углерода ( 16), изобразим их молекулы и построим их зеркальное изображение (рис. 9 и 10), для чего поместим зеркало АВ перпендикулярно плоскости чертежа. Теперь будем вращать тетраэдры вокруг оси, проходящей через центральный атом углерода и карбоксильную груп- [c.161]
Изображать соединения в виде тетраэдров (см. рис. 9 и 10) неудобно, особенно если в молекуле имеется несколько асимметрических атомов углерода. Поэтому пользуются проекционными формулами. Для перехода от тетраэдрической модели к проекционной формуле тетраэдр ориентируют в пространстве горизонтальным ребром к наблюдателю и в большинстве случаев таким образом, чтобы более окисленная группа (для молочной кислоты — карбоксильная) оказалась по вертикали вверху, а менее окисленная (метильная) —внизу. Гидроксильные группы и водород будут находиться при этом справа и слева. Затем этот тетраэдр проектируют на бумагу и получают крест, в центре которого находится асимметрический атом углерода (его в проекционных формулах не пишут) (рис. 11). [c.163]
К основным представлениям учения о пространственном расположении атомов в молекулах относится тетраэдрическая модель углеродного атома (рис. 1). Атом углерода находится в центре правильного тетраэдра (черный кружок), четыре валентности углеродного атома (обозначение —) направлены к вершинам углов тетраэдра (белые кружки). Углы между направлениями валентных связей 109°28. [c.107]
Тетраэдрическая модель атома углерода. Одновременно и независимо друг от друга Вант-Гофф и Ле-Бель (1874 г.) показали, что оптическую изомерию, а также и другие явления можно объяснить, предположив, что валентности атома углерода ориентированы в пространстве. По Вант-Гоффу, все четыре валентности углерода тождественны и направлены по четырем углам правильного тетраэдра, в центре которого находится атом углерода. Такое строение представляет собой наиболее равномерное расположение валентностей четырехвалентного атома [c.30]
К основным по.чожениям учения о пространственном расположении атомов в молекулах относится представление о тетраэдрической модели углеродного атома (рис. 1). Атом углерода находится в центре правильного тетраэдра (черный кружок), четыре валентности углеродного атома (обозначение —) направлены к вершинам углов тетраэдра (белые кружки). Углы между направлениями валентных связей 109°28. Если два атома углерода соединены между собой двойной связью, то тетраэдры соприкасаются ребрами (рис. 2). [c.122]
Основой стереохимии Я. Вант-Гоффа стало учение о тетраэдрическом строении молекулы метана. Он допустил, что атом углерода расположен в центре правильного тетраэдра, а четыре-вполне равноценных его сродства направлены к углам тетраэдра. Если атом углерода связан с четырьмя различными атомными группами (радикалами), он становится асимметрическим и соединение оказывается опти 1ески активным. Тетраэдрическая модель углеродного атома дала возможность Я. Вант-Гоффу наглядно представить пространстве11ное строение многих соединений. При этом наличие двойной связи он изображал в виде общего ребра двух тетраэдров (двух атомов углерода). При тройной связи общей является плоскость двух тетраэдров. Одновременно с Я. Вант-Гоффом и независимо от него близкие представления о пространственном расположении атомов в молекулах были высказаны А. Ле Белем (ноябрь 1874). Статью Я. Вант-Гоффа (1874) вскоре перевели на немецкий язык, и она вышла с предисловием И. Вислиценуса (1877). [c.150]
И сам углерод, и его аналоги могут существовать в нескольких аллотропических модификациях. Если для типичных неметаллов, например кислорода и серы, явление аллотропии связано с возможностью образования молекул различного состава, то в простых телах кристаллической структуры, например у у1 лерода, олова, кремния, аллотропия связана с возможностью построения кристаллических решеток различного типа. Так, в кристаллической структуре алмаза каждый атом углерода связан четырьмя связями с другими атомами таким образом, что все углы между связями равны 109,5°. Модель кристаллической решетки алмаза можно получить, если поместить атом углерода в центр тетраэдра на пересечении его высот и соединить его с четырьмя Е ершинами тетраэдра, поместив в них еще четыре атома углерода рассматривая каждый из этих атомов как центр нового тетраэдра, можно таким путем воспроизвести всю решетку. [c.95]
Модель неправильного тетраэдра у Пастера относилась к молекуле виппой кислоты, а не к атому углерода. [c.214]
Стереохимия. — Стереохимия — наука о расположении атомов в пространстве. В 1874 г. Вант-Гофф и Ле-Вель независимо друг от друга пришли к заключению, что атом углерода тетра-эдричен (рис. 5,а). По Вант-Гоффу его четыре связи направлены в трехмерном пространстве под равными углами одна к другой. Этот вывод был подтвержден многими химическими и физическими данными. В трехмерной симметричной молекуле метана атом углерода расположен в центре, а четыре атома водорода — как бы в вершинах правильного тетраэдра. Такое расположение схематически представлено на модели (рис. 5,6), в которой черный шар изображает центральный атом углерода, а серые шары — связанные с ним атомы водорода. [c.38]
Вайссенберг считает возможным идти вторым путем, т. е. принять пирамидальную модель вместо тетраэдрической в качестве основы для построения единообразной (einheitli he) стереохимии, поскольку, по его мнению, все факты, объясняемые с помощью тетраэдрической модели или подтверждающие ее, могут с таким же успехом быть объяснены и с помощью новой модели. Но в то же время Вайссенберг, учитывая, что тот же рентгенографический метод дал ясные доказательства существования в СВГ4 (кубическая модификация) и в С(СНд)4 углеродных тетраэдров, говорит Конфигурация правильного тетраэдра — даже для высокосимметричных замещенных производных метана — не универсальна [там же, стр. 1538],— центральный атом углерода может лежать и по одну сторону от всех четырех заместителей. Вайссенберг стремится до- [c.160]
На рис. 10 представлена шариковая модадь молекулы метана. Атом углерода (черный шарик) расположен как бы в центре тетраэдра (см.), а атомы водорода (белые шарики) — в его вершинах. При этом все валентные углы (углы между направлениями связей) в метане равны между собой и составляют 109°28. Нетрудно заметить, что структурная формула метана представляет собой не что иное, как проекцию его модели на плоскрсть чертежа. [c.34]
Тетраэдр в качестве модели атома углерода уже давно предложен Вант-Гоффом и ЛеБелем (см. стр. 84). Поэтому утверждалось, что изложенное выше математическое доказательство тетраэдрической структуры атома углерода значительно запоздало. Хотя это и правильно, но, с другой стороны, такая оценка все же несправедлива. Во-первых, атомная физика и ее математический вспомогательный аппарат развились лишь в начале нашего столетия, так что раньше этого доказательства нельзя было дать. Во-вторых, сейчас мы можем понять сущность атомной связи углерода и понять, почему именно атом углерода в основном четырехвалентен, почему его связи направлены тетраэдрически и почему он стремится сохранить это тетраэдрическое расположение. При таком подходе выведенная на основании атомной теории тетраэдрическая структура атома углерода является блестящим доказательством надежности и применимости современных взглядов для решения основных проблем органической химии. [c.37]
Согласно идее Вант-Гоффа и Лебеля, атом углерода имеет тетраэдрическое строение и может соединяться с другими атомами либо вершиной тетраэдра, образуя единичную связь, либо ребром, образуя двойную связь, либо гранью, образуя тройную связь. Из этой модели вытекает ряд следствий. Так, все атомы в молекуле этилена оказываются лежащими в одной плоскости, т. е. двойная связь С=С задает плоскостное расположение нег[осредственно соединенных с ней атомов. Все атомы в молекуле ацетилена, по Вант-Гоффу, лежат на одной прямой—тройная связь С=С задает линейное расположение атомов. [c.44]
В моделях Дрейдинга атомы углерода вместе с их связями выполнены в виде металлических стержней, двух сплошных и двух полых, соединенных в точке, соответствующей центру атома, под правильными углами тетраэдра. Для соединения двух атомов сплошной стержень одного из них вставляют в полый стержень другого. Длина связей и положение стопоров внутри полых стержней таковы, что расстояния С — Н и С —С передаются в соответствующем масштабе свободным стержнем и двумя соединенными стержнями. Для структур с двойными связями используют атом углерода, состоящий из трех конланарных стержней под углом 120° друг к другу. Имеются также и некоторые гетероатомы. Эти модели превосходны для показа у доски, хотя слишком малы для демонстрации в больших аудиториях (1А=2,5 см). [c.20]
Руководство для начинающих по построению и визуализации молекул в программном обеспечении молекулярной графики с открытым исходным кодом
BMC Res Notes. 2021; 14: 66.
иSiripreeya Phankingthongkum
Научный отдел, Международный колледж Университета Махидол, Университет Махидол, Салая, Пхуттамонтон, Накхон Патом, 73170 Таиланд
Международный колледж Тавитхам
1 Научный университет Махидол 2 , Университет Махидол, Салая, Пхуттамонтон, Накхон Патом, 73170 ТаиландОтдел науки, Международный колледж Университета Махидол, Университет Махидол, Салая, Пхуттамонтон, Накхон Патом, 73170 Таиланд
Автор, отвечающий за переписку.Поступило 05.11.2020 г .; Принято 2021 22 января.
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или любом формате при условии, что вы надлежащим образом укажете оригинал Автор (ы) и источник предоставляют ссылку на лицензию Creative Commons и указывают, были ли внесены изменения. Изображения или другие материалы третьих лиц в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной линии для материала.Если материал не включен в лицензию Creative Commons для статьи и ваше предполагаемое использование не разрешено законодательными актами или превышает разрешенное использование, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/. Отказ Creative Commons Public Domain Dedication (http://creativecommons.org/publicdomain/zero/1.0/) распространяется на данные, представленные в этой статье, если иное не указано в кредитной линии для данных.- Дополнительные материалы
Дополнительный файл 1. Рабочий лист и файлы для студентов.
GUID: 32F53857-8DC4-48ED-9A60-93704EBAF0D9
Дополнительный файл 2. Критерии оценки и полные решения, включая дополнительные упражнения.
GUID: 4863F12D-9FDF-4B40-856A-7CDEDB2A5DD1
Дополнительный файл 3. Вопросы обследования и подробные результаты.
GUID: 77BC443F-D0E8-4A13-A2BF-EEAA17F5BE55
- Заявление о доступности данных
Наборы данных, подтверждающие выводы этой статьи, доступны в репозитории данных Mendeley по адресу https: // doi.org / 10.17632 / hfynpvtrz3: Руководство, содержащее скриншоты с пошаговыми инструкциями по выполнению поставленных задач и видео с примерами процесса.
Реферат
Цель
Представлено применение программного обеспечения молекулярной графики в качестве простой и бесплатной альтернативы наборам молекулярных моделей для изучающих химию начального уровня.
Результаты
На основе Avogadro или IQmol мы предложили студентам четыре набора задач, построение базовой молекулярной геометрии, визуализацию орбиталей и плотностей, предсказание полярности молекул и сопоставление трехмерных структур со структурами линий связи.Эти темы обычно охватываются общей химией для студентов первого курса бакалавриата. Для всех задач обеих программ предусмотрены подробные пошаговые процедуры, чтобы преподаватели и студенты могли использовать одну из двух программ в своем обучении и обучении в качестве альтернативы наборам молекулярных моделей.
Ключевые слова: Химическое образование, Молекулярная модель, Общая химия, Программное обеспечение для молекулярной графики
Введение
Использование молекулярной модели рекомендовано в качестве части учебной программы для улучшения пространственного мышления студентов-химиков [1].Наборы физических молекулярных моделей обычно используются в химической лаборатории начального уровня [2]. Другие аналогичные учебные пособия [3–45] сильно различаются по стоимости, простоте использования, необходимому количеству времени и пригодности для изучения соответствующих тем по химии. Мы рассмотрели и попробовали некоторые из них в нашем классе и пришли к некоторым наблюдениям. В таблице представлен краткий обзор литературы и наши наблюдения по некоторым физическим молекулярным моделям.
Таблица 1
Краткий обзор средств обучения молекулярным моделям и наши наблюдения над некоторыми физическими моделями молекул
| Средства обучения молекулярным моделям | Наши наблюдения |
|---|---|
Физические молекулярные модели o Мячи для пинг-понга [3], резиновые шары [4], крышки от бутылок [5, 6], маркеры для белых досок [7] или другие материалы [8–14] (Использование имеющихся материалов) o Пластилин [15], глина или тесто [16], (ручное строительство из податливых материалов) o Лазерная / проволочная резка [17], 3D-печать [18–21], 3D-лазерная гравировка [22], силикон, залитый магнитом [23] (Изготовление на заказ модели с помощью передовых технологий) Компьютерное программное обеспечение или веб-приложения o Специализированные онлайн-сервисы, такие как молекулярные кликеры на основе 3Dmol.js [24], Android-приложение для химического распознавания символов и трехмерной визуализации [25], моделирования элементарных ячеек [26] и моделирования формы молекул [27] o Платоновые твердые тела на языке POV-Ray [28] или орбитальные дисплеи в системе Mathematica [29] ] o Программное обеспечение для молекулярной графики o Собственное коммерческое программное обеспечение, например GaussView [30], Chem3D [31] o Программное обеспечение с открытым исходным кодом, например Avogadro [32, 33], Chimera [34], Gabedit [35], IQmol [36], PyMOL [37] и QuteMol [33] o Онлайн-сервис для молекулярной графики, такой как WebMO [38] и CheMagic [39]) 3D / дополненная реальность (Расширенные методы визуализации обычно требуют для работы как специального оборудования, так и программного обеспечения.) o 3D-видеоочки [40, 41] o Приложение на мобильных устройствах [42–44] o Голографическая проекция [45] | ● Коммерческие наборы молекулярных моделей могут быть дорогостоящими единовременными вложениями. Поскольку в набор входит множество элементов, представляющих различные типы атомов / связей, пользователи молекулярных моделей обычно тратят значительное количество времени на инвентаризацию. Время может быть сокращено, если для этого процесса подсчета используются аналитические весы. Во многих случаях учащиеся также тратят много времени или сталкиваются с трудностями при разборке моделей до их первоначальных частей.Эта разборка обычно необходима перед построением следующих молекул, поскольку стандартный набор молекулярных моделей из 165 частей содержит только 14 атомов углерода. ● Другие физические модели (например, мячи для настольного тенниса и пластилин) могут иметь свои плюсы и минусы. Например, пластилин пластичен и из него можно формировать шариковые и палочные модели, а также модели, заполняющие пространство. Мы попросили студентов взвесить пластилин, чтобы они вручную строили модели, пропорциональные реальным молекулам. Студенты четко наблюдали относительный размер водорода по сравнению с галогеном в галогенидах водорода и правильно предсказали тенденцию кислотности.Однако использование пластилина может быть обременительным, грязным и отвлекающим для некоторых учеников. |
Программное обеспечение для молекулярной графики доступно на рынке в течение многих десятилетий. До недавнего времени эти программы предназначались для опытных пользователей моделирования квантовой и молекулярной механики и лицензировались по высокой цене. С лицензированием с открытым исходным кодом стоимость и доступность программного обеспечения больше не являются проблемой.
Большинство программ молекулярной графики позволяют пользователям конструировать, редактировать и визуализировать молекулы в 3D и, следовательно, являются жизнеспособной альтернативой обычным учебным материалам.Поэтому проблема здесь в том, как использовать эти динамические и интерактивные программы визуализации в качестве строительных инструментов для обучения студентов [46]. В ряде статей описывается использование этого программного обеспечения для обучения студентов старших курсов [24, 25, 31, 33, 34, 47, 48]. Однако учебные упражнения по химии начального уровня ограничены, поскольку эти программы считаются специализированными и используются в основном для исследований.
В этой статье описывается наш опыт использования двух программ, Avogadro и IQmol, для урока в лабораторных занятиях по химии вводного уровня.Урок был разработан таким образом, чтобы максимально соответствовать содержанию, изучаемому по общей химии. Расширенные функции, традиционно связанные с использованием этих программ, намеренно не учитываются. Насколько нам известно, наша работа является первой статьей, в которой подробно описывается использование программного обеспечения для молекулярной графики в образовательных целях для этого уровня аудитории.
Лабораторный курс — первая лаборатория химии для студентов естественных наук. Урок можно пройти независимо от лекционного класса. Цели этого четырехчасового сеанса с программным обеспечением:
использовать виртуальный инструмент таким же образом, как используются физические молекулярные модели (задачи 1 и 4 ниже)
для использования некоторых дополнительных функций визуализации программное обеспечение, связанное с тем, что обсуждается в курсе общей химии, без выполнения квантово-химического расчета (задачи 2 и 3 ниже).
Инструкции составлены таким образом, чтобы учащиеся могли легко выполнять их даже без предварительных знаний по химии, а учащиеся также могли оценить качество изображений учебного качества. В связи с четким разделением лаборатории и лекции в учебной программе мы не намерены преподавать базовые концепции, а только предоставлять инструменты и практики для поддержки их обучения.
Описание программного обеспечения и функций
Avogadro [32] и IQmol [36] — это кроссплатформенные программы с открытым исходным кодом для Mac и Windows, запущенные в 2016 и 2015 годах соответственно.Обе программы легки и просты в установке. Они предлагают ряд функций для выполнения и анализа вычислений. Каждая программа требует минимального дискового пространства (<50 МБ), и для большинства пользователей загрузка и установка может занять менее 5 минут. Программы также доступны для Linux, но установка может оказаться нетривиальной.
Как упоминалось ранее, в этой статье мы не собираемся знакомить новичков с выполнением каких-либо расчетов [47–49] или работой с какими-либо макромолекулами. Мы используем только следующие возможности программ.
o
Чтение файлов различных типов (геометрия xyz или z-матрицы, файл контрольных точек, выходные данные расчета частоты).
o
Создавайте и редактируйте молекулы с помощью графического пользовательского интерфейса и оптимизируйте структуры с помощью встроенных силовых полей молекулярной механики.
o
Визуализируйте молекулы в различных представлениях (шар и палка или заполнение пространства), а также отображая длину связи, угол связи и угол скручивания.
o
Некоторые из дополнительных функций, например отображение анимации, дипольного момента, спектров и поверхностей (орбиталей и плотностей).
Основной текст
Задачи учащегося и их выполнение
Компьютерная модель молекулярной модели была внедрена в химической лаборатории первого курса Университета Махидол с 2019 года. Рабочий лист студента в Дополнительном файле 1 был разработан и постоянно обновлялся. Студентам было предложено заполнить двухстраничный рабочий лист, состоящий из четырех наборов задач.Общее время на выполнение всех задач составляет примерно три-четыре часа. Наша деятельность проводится в компьютерной лаборатории в течение первой недели курса, поскольку студентам еще предстоит найти свой собственный лабораторный халат и защитные очки для химической лаборатории. В результате ознакомительный / демонстрационный сеанс безопасности [50] запланирован на вторую неделю, а реальный эксперимент начинается на третьей неделе. Это дает студентам и сотрудникам больше времени для завершения необходимых мероприятий и подготовки, связанных с лабораторным занятием.
Мы рекомендуем студентам использовать одну из двух программ, заранее установленных в нашей компьютерной лаборатории. Однако некоторые студенты хотят использовать свои собственные ноутбуки. Совершенно законно загружать / делиться и устанавливать эти программы с открытым исходным кодом на студенческие машины.
Учащиеся по-разному выполняют наши задания в зависимости от их компьютерной грамотности. Распределение их случайным образом на группы по два человека так же, как и другие лабораторные задания, частично помогает устранить разницу. Лучше всего продемонстрировать один пример из каждой задачи для четырех задач подряд.Мы убеждаемся, что все группы могут правильно выполнять примеры задач, прежде чем позволить им работать независимо. Студентам также предлагается продемонстрировать различные подходы к выполнению задач. (Скриншоты шагов для выполнения этих задач находятся в репозитории данных Mendeley.)
Дополнительные упражнения, выделенные желтым цветом в дополнительном файле 2, также рассматриваются ниже для этих задач. В то время как основные задачи требуют небольшого количества предварительных знаний от лекционного класса или совсем не требуют его, эти дополнительные упражнения требуют некоторых базовых знаний.Обычно они более сложные и требуют много времени. Эти упражнения использовались в нашей предыдущей версии рабочего листа, но больше не используются в нашей текущей версии из-за нехватки времени и их сложности. Мы рекомендуем при желании, чтобы только некоторые из этих упражнений были включены для продвинутых учеников в соответствии с классом. Целью включения дополнительных упражнений в каждое задание было дать учащимся более прочную связь между заданиями и темами по химии.
Задание 1: Построение базовой молекулярной геометрии
Студентам предлагается представить в виде шарика и палки 12 одноцентровых молекул на рабочем листе, как показано на рис.. Молекулы являются типичными примерами структур, охватываемых теорией VSEPR. В этом задании учащиеся выбирают xyz-файл молекулы-шаблона со стерическим числом от двух до шести и удаляют / заменяют атомы по мере необходимости. Такой подход построения по шаблону позволяет программному обеспечению работать так же, как набор физических молекулярных моделей. Все длины связей и углы не меняются, когда учащиеся строят новую молекулу путем удаления или замены атомов из шаблона.
Образец заданий 1 и 2, в которых студенты строят молекулы из различных шаблонов и визуализируют орбитали атомов водорода в IQmol.
Дополнительное упражнение состоит из различных задач.Найдите начало каждого валентного угла в таблице, включая угол ~ 109,5 ° для тетраэдрической структуры. Найдите структуру дополнительной молекулы для теории VSEPR. Визуализируйте молекулу в модели заполнения пространства. Примените силовое поле к молекулам и используйте правило Бента, чтобы объяснить отклонение от ожидаемого угла связи ~ 109,5 ° в аммиаке и воде и небольшое различие в длине связи C-H в метане и галометанах [51].
Задача 2: Визуализация орбиталей и плотностей
Два файла контрольных точек заранее подготовлены для учащихся для визуализации поверхностей в программном обеспечении.Исследуются молекулярные орбитали (МО), такие как самая высокая занятая молекулярная орбиталь (ВЗМО) и самая низкая незанятая молекулярная орбиталь (НСМО). Учащиеся используют первый файл для визуализации атомных орбиталей (1s, 2s, 3s, 2p, 3p и 3d) атома водорода. Второй файл формальдегида используется для построения HOMO, LUMO и карты полной электронной плотности молекулы. Студенты оценивают формы и относительные размеры атомов и молекул на карте плотности.
Необязательным упражнением является наблюдение за влиянием различных значений ISO на результаты и изучение других функций рендеринга, таких как рендеринг сетки и обрезка.
Задание 3: Предсказание полярности молекул
Учащиеся строят молекулу, создают цветную карту электростатического потенциала, показывают частичные заряды на атомах и показывают стрелку дипольного момента на каждой молекуле. Это помогает студентам понять концепции электроотрицательности, резонансной структуры, дипольного момента связи и полярности молекул.
Необязательное упражнение — изучить колебательную спектроскопию на основе заданного выходного файла квантово-химических расчетов. Учащиеся могут наблюдать колебательный режим молекулы на разных частотах в анимации, а также наблюдать за ее инфракрасным / рамановским спектром.Задача не только позволяет студентам пользоваться интерактивной функцией программного обеспечения, но и связывает понятие дипольного момента с правилом выбора в колебательной спектроскопии.
Задача 4: Сопоставление трехмерных структур со структурами линий связи
Студентам предоставляется набор файлов геометрии, которые они могут открыть с помощью программы. Студенты сопоставляют каждую трехмерную визуализацию в программе с двухмерной структурой линий связи, например. Проекция Фишера, проекция Ньюмана, конформация кресла. Учащиеся могут записать имена файлов под этими структурами в таблицах рабочего листа.
Необязательное упражнение включает идентификацию всех энантиомеров, диастереомеров и ротамеров вместе с ранжированием их стабильности; изменение структуры кресла замещенного циклогексана на другую структуру кресла; и построение более сложных молекул, таких как парацетамол и аспирин. Кроме того, однобуквенные имена файлов в основной задаче сопоставления, приведенной выше, могут быть заменены систематическими или общими именами. В процессе студенты будут ознакомлены с названиями этих химических структур.
Результаты и обсуждение
Мы разработали новое лабораторное упражнение для начинающих студентов химии, чтобы изучить молекулярное моделирование. Использование компьютерных программ для урока молекулярной модели помогает преодолеть традиционные трудности и предлагает большую гибкость в преподавании и обучении. Значительная часть наших задач требует, чтобы студенты документировали свою работу, помещая изображения в рабочий лист. Эти изображения более или менее похожи на рисунки в большинстве учебников по общей химии и помогают студентам подготовиться к изучению химических понятий или закрепить их на лекциях.У нас есть ограниченные доказательства того, что учащиеся позже используют приобретенные здесь навыки для создания высококачественного изображения для последующих задач в классе [52, 53].
Хотя эти задачи предназначены для очного выполнения, в период вспышки COVID-19 задачи были выполнены удаленно в мае 2020 года и январе 2021 года с минимальными изменениями. Инструктор (TL) и ассистент преподавателя (SP) проводили обучение студентов в режиме реального времени. Студенты по-прежнему работали в парах и отправляли по одному листу на пару во время урока, как мы обычно делаем в классе на территории кампуса.Некоторые из наших студентов сообщили о технических проблемах с одной из двух программ дома. Затем мы предложили им попробовать другую программу для решения проблемы.
Предварительные и последующие тесты использовались в классе на территории кампуса в сентябре 2020 года для оценки успеваемости студентов во время лабораторных упражнений. Средний балл ученика в классе из 31 ученика увеличился с 63% до 74% после выполнения заданий. Вопросы плюс / минус / дельта были частью заключительного теста. Подробные комментарии можно найти в Дополнительном файле 3.Вкратце, ученики используют следующие слова для описания своего положительного опыта, например ( n = 8), см. ( n = 9), визуализировать / визуально ( n = 5), интересно ( n = 2). ) и поймите ( n = 2). Область, требующая улучшения, включает в себя управление временем в классе и темпами обучения.
В заключение, перепрофилирование двух свободно доступных программ молекулярной графики, Avogadro и IQmol, из специализированных применений в образовательные для начинающих, как описано в этой статье, является жизнеспособной альтернативой традиционным наборам молекулярных моделей.Эти простые упражнения можно использовать в других классах, других доступных программах или онлайн-сервисах [38, 39] с минимальными усилиями. Более того, эти мероприятия можно легко проводить в режиме онлайн, чтобы обеспечить соблюдение требований физического дистанцирования во время пандемии.
Ограничения
Некоторые концепции, такие как порядок облигаций и резонанс, могут быть плохо представлены в программах. Другие концепции, такие как формальный заряд атома, общий заряд структуры и несвязывающий электрон, могут быть недоступны для визуализации.
Количественное доказательство обучения в этой статье является предварительным (двустороннее значение p -значение = 0,055 для класса в кампусе в сентябре 2020 г.) и может зависеть от двукратного прохождения параллельных тестов (в предварительном и пост-тесты).
Во избежание плагиата учащихся могут попросить создать видео с помощью встроенного средства записи экрана (XBox в Windows или Quicktime в Mac), чтобы показать процесс своей работы.
Установка программ может быть ограничена политикой безопасности.«Невозможно проверить разработчика» — известная проблема, которую можно обойти.
Дополнительная информация
Благодарности
Мы признательны техническим специалистам (С. Фомсурин и В. Йимкосол), лаборантам (С. Датта, К. Кэвпичит, В. Лорпайбун и П. Таворнпарча) и студентам за их помощь. участие в классе. TL благодарит оргкомитет STT46 за приглашение представить эту работу на сессии конференции «Ответственные химические науки для будущего устойчивого развития» в Университете Рамкамхенг 6 октября 2020 года.
Сокращения
| OCR | Оптическое распознавание символов | |||||||
| POV-Ray | The Persistence of Vision Ray Tracer | |||||||
| VSEPR | Теория отталкивания пар валентных оболочек |
| Химическое изменение | Процесс? |
|---|---|
| Пирит на гематит | |
| Кальцит на ионы кальция и бикарбоната | |
| От полевого шпата до глины | |
| Оливин — змеевик | |
| Пироксен до оксида железа |
Учебное пособие по хиральным центрам и хиральным молекулам
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Зеркальное отображение молекул и хиральность
Ваша левая и правая рука хиральны. Ваши руки демонстрируют свойство хиральности. 4
Ваша левая рука является зеркальным отражением вашей правой руки, но вы не можете накладывать левую руку на правую.
Многие биологические молекулы, такие как аминокислоты, белки и сахара, являются хиральными, как и ваша левая и правая рука, но только одна из этих хиральных молекул может проявлять биологическую активность. 5
Точно так же, как ваша левая рука не помещается в перчатку для правшей, «левосторонний» белок не подходит для «правостороннего» фермента, поэтому скорость химической реакции для » левосторонний »белок не подвержен влиянию« правостороннего »фермента.
Рассмотрим молекулу метана, CH 4 .
Мы могли бы использовать набор молекулярных моделей для построения трехмерной модели молекулы метана, как показано ниже 6 :
Центральный атом углерода — это черный шар в центре, каждый серый шар представляет собой атом водорода.
Две связи C-H лежат в одной плоскости ( красный цвет ниже).
Одна связка C-H простирается вперед, к вам, когда вы читаете это (цвет синий ниже).
Одна связка C-H идет назад, от вас, когда вы читаете это (цвет зеленый ниже).
Химики обычно не используют цвета, чтобы показать трехмерную структуру молекулы, вместо этого мы рисуем различные виды линий и форм, чтобы представить, как атомы расположены в пространстве.
Когда мы это делаем, мы обращаемся к представлению как к трехмерной структурной формуле:
- Связи в одной плоскости ( красные линии выше) показаны сплошной линией.
- Связи, идущие к вам (синяя линия выше) показаны сплошным клином.
- Связи, которые простираются от вас (зеленая линия выше) показаны пунктирным клином.
| Шарик и клюшка Молекулярная модель | 3-х мерный структурная формула | |
|---|---|---|
| ≡ |
Представьте, что вы можете взять молекулу метана и поместить ее перед зеркалом.
В зеркальном отображении центральный атом углерода окажется на том же расстоянии «позади» зеркала, что и центральный атом углерода «настоящей» молекулы перед зеркалом.
Зеркальная версия каждого атома водорода будет казаться такой же «позади» зеркала, как и реальная версия перед зеркалом.
| «настоящий метан» | зеркало | «зеркальное отображение метана» |
|---|---|---|
Мы написали зеркальные изображения «C» и «H», чтобы выделить «настоящую» молекулу, а какая «зеркальное отображение» молекулы, но ясно, что оба атома углерода идентичны друг другу, и весь водород атомы неотличимы друг от друга, на самом деле только расположение этих атомов в трехмерном пространстве важно для следующего обсуждения.
Две молекулы метана, «реальная» и «зеркальное отображение» — одно и то же.
Мы можем повернуть «зеркальное отображение» молекулы вокруг вертикальной оси, чтобы получить такое же расположение связей C-H в 3-х измерениях, что и «настоящая» молекула.
| → |
Мы видим, что «зеркальное отображение» молекулы метана может быть наложено на «реальную» молекулу метана, просто вращая молекулу вокруг вертикальной оси.
Метан, CH 4 , НЕ является примером хиральной молекулы. Мы говорим, что метан ахиральный.
Что делать, если один из атомов водорода замещен другим атомом, например атомом хлора.
Будет ли хлорметан, CH 3 Cl, и его зеркальное отображение иметь одинаковое расположение атомов в трех измерениях или различное?
Будет ли хлорметан, CH 3 Cl, хиральным или ахиральным?
| «настоящий хлорметан» | зеркало | «зеркальное отображение хлорметана» |
|---|---|---|
Если мы повернем «зеркальное отображение» хлорметана вокруг вертикальной оси, мы получим точно такое же трехмерное расположение атомов, как и в «настоящей» молекуле хлорметана.
«Зеркальное отражение» молекулы хлорметана накладывается на «настоящую» молекулу хлорметана.
Хлорметан не хиральный, его называют ахиральным.
Что делать, если один из атомов водорода в хлорметане заменен другим атомом, например атомом брома.
Будет ли бромхлорметан и его зеркальное отображение иметь одинаковое расположение атомов в 3-х измерениях или различное?
Будет бромхлорметан хиральным или ахиральным?
| «бромхлорметан настоящий» | зеркало | «зеркальное отображение бромхлорметана» |
|---|---|---|
Связь C-Cl и связь C-Br были представлены как находящиеся в одной плоскости на «реальной» молекуле.
На зеркальном изображении мы могли бы повернуть молекулу до тех пор, пока атом брома не окажется «за» плоскостью (пунктирный клин), а затем выбрать представление молекулы так, чтобы обе связи C-Cl и C-Br находились в одной плоскости, так что одна связь CH простирается к нам, а другая CH — от нас, так что эти два представления, «реальное» и «зеркальное отображение» одинаковы, поэтому бромхлорметан НЕ хиральный, он ахиральный.
Что, если мы заменим один из оставшихся атомов водорода в бромхлорметане другим атомом, например фтором.
Будет ли бромхлорфторметан и его зеркальное отображение иметь одинаковое трехмерное расположение атомов или расположение атомов будет другим?
Бромхлорфторметан хиральный или ахиральный?
| «бромхлорфторметан настоящий» | зеркало | «зеркальное отображение бромхлорфторметана» |
|---|---|---|
Если мы повернем «зеркальное отображение» молекулы так, чтобы связь C-Br находилась «позади» (пунктирный клин), тогда связь CF будет в той же плоскости, что и связь C-Cl, а связь CH будет «вперед». (сплошной клин), как показано ниже:
| повернуть → |
Если мы теперь представим эту повернутую «зеркальное отображение» молекулы со связью C-Br в той же плоскости, что и связь C-Cl (как это было в «реальной» молекуле), мы теперь обнаружим, что связь CF простирается от нас. (пунктирный клин), а связь CH направлена к нам (сплошной клин), как показано ниже:
| ≡ |
Теперь сравните бок о бок «настоящую» молекулу и эту повернутую версию молекулы «в зеркальном отражении»:
| «настоящая» молекула | повернутая «зеркальная» молекула | |
|---|---|---|
| & nequiv; |
Когда мы пытаемся наложить «зеркальное отображение» молекулы на «настоящую» молекулу, мы обнаруживаем, что связи C-Cl и C-Br накладываются друг на друга, но связь CF в «реальной» молекуле выходит из плоскости к вам. в то время как в молекуле «зеркального отображения» он простирается за плоскость и от вас.
Точно так же связь C-H в «настоящей» молекуле простирается за плоскость и от вас, но в молекуле «зеркального отображения» связь C-H простирается от плоскости к вам.
Нельзя наложить «зеркальное отображение» молекулы бромхлорфторметана на «настоящую» молекулу.
Бромхлорфторметан ЯВЛЯЕТСЯ хиральной молекулой.
Атом углерода, который имеет 4 различных заместителя, называется хиральным центром (иногда хиральным углеродом).
Атом углерода в молекуле бромхлорфторметана является хиральным центром, поскольку он имеет 4 различных заместителя (H, Br, Cl и F).
Эти две молекулы, «настоящий» и «зеркальное отображение» бромхлорфторметана, называются энантиомерами.
Определение хиральных центров
В органической молекуле любой атом углерода с 4 различными заместителями будет хиральным центром.
Органическая молекула с хиральным центром будет хиральной молекулой. 7
Рассмотрим следующую молекулу:
Он содержит 2 атома углерода, один показан как синий , другой как красный .
К синему атому углерода, C , присоединены 3 атома водорода и 1 атом углерода.
Поскольку к этому атому углерода присоединены только 2 различных заместителя (H и C), этот атом углерода НЕ является хиральным центром.
Теперь рассмотрим красный атом углерода, C .
К этому атому углерода присоединена одна группа OH, один атом H, один атом F и одна метильная группа (CH 3 ).
У этого атома углерода 4 разных заместителя.
Этот атом углерода является хиральным центром.
Эта молекула будет хиральной.
Рассмотрим молекулу 2-бромбутана, показанную ниже, с атомами углерода под номерами 1, 2, 3 и 4:
| H | | Br | | H | | H | | |||||
| H- | С 1 | – | С 2 | – | С 3 | – | С 4 | -H |
| | H | | H | | H | | H |
Ясно, что атомы углерода 1 и 4 не могут быть хиральными центрами, потому что с ними связаны 3 атома водорода, поэтому у них нет 4 разных заместителей.
Точно так же углерод 3 не может быть хиральным центром, потому что с ним связаны 2 атома водорода, поэтому он не имеет 4 различных заместителей и, следовательно, не может быть хиральным центром.
А как насчет углерода 2? Это хиральный центр?
Давайте перерисуем структуру, чтобы было понятнее …
| Br | | ||||
| H 3 C | – | С 2 | – | Канал 2 Канал 3 |
| | H |
Теперь мы ясно видим, что углерод 2 имеет 4 различных заместителя:
(i) метильная группа (CH 3 )
(ii) атом брома (Br)
(iii) атом водорода (H)
(iv) этильная группа (CH 2 CH 3 )
Углерод 2 — хиральный центр, а молекула — хиральная.
Молекулярное моделирование с использованием глины, часть 1 — Пол Саттон
Молекулярное моделирование с использованием глины, часть 1
Около месяца назад я начал обсуждение молекулярного моделирования на форуме Qoto Discourse.
Поскольку я знаю, что не все могут позволить себе наборы Molymod [1], я предположил, что должно быть возможно сделать что-то подобное, по крайней мере, на базовом уровне с пластилином. Поскольку в то время у меня их не было, я сделал грубую модель с помощью BluTack.
С тех пор мне удалось найти пластилин из Паундленда [3], поэтому я представляю здесь часть 1 из 2 о том, как это сделать.
Примечание: было предложено сделать видео об этом, у меня нет оборудования для этого, поэтому я буду использовать фотографии вместо этого, но, надеюсь, когда вернется South Devon Tech Jam [4], возможно, я смогу получить некоторая помощь в создании видео.
Я предпочитаю использовать фотографии, чем делать действительно плохое видео, и искать опыт в создании видео.
Итак, как упоминалось в ветке обсуждения [2], к которой вы можете присоединиться и добавить в обсуждение. Мы хотим построить простые молекулы.
Здесь показаны некоторые основные алканы, полученные с помощью набора Molymod [1].
Итак, во-первых, цена глины, которую я купил в Паундленде, ниже
.Я уже отрезал соломинки для питья до длины
Таким образом, в этом случае прямые части имеют длину примерно 1 дюйм, а изогнутые части — примерно 1 дюйм по обе стороны от изгиба.
И, как упоминалось ранее, они могут действовать как часть двойной связи или прямых связей.
Как уже говорилось, цвета будут соответствовать обычному соглашению:
| Цвет | Атом |
|---|---|
| Черный | Углерод |
| Красный | Кислород |
| Белый | Водород |
| Синий | Азот |
| Зеленый | Галоген |
Эта система с использованием глины не будет идеальной, но это , а не .Если мы можем построить базовые молекулы, это очень важно.
Я отправлю следующий пост завтра.
Список литературы
1 Молимод 2 Qoto Discourse 3 фунта стерлингов 4 Южный Девон Tech Jam 5 цветов Molymod
Конечные примечания
Надеюсь, это будет полезно, и если это так, я все еще ищу работу в школе, я чувствую, что способность думать о решениях, подобных этому, демонстрирует важные навыки, такие как решение проблем, а написание этих сообщений в блоге также демонстрирует коммуникативные навыки .
Вы можете найти ссылку на мой профиль в LinkedIn и другие контактные данные на моей странице контактов здесь.
# химия, # химическая, # лепка, # глина, # соломка, # визуализация
.

 Павлодар
Павлодар