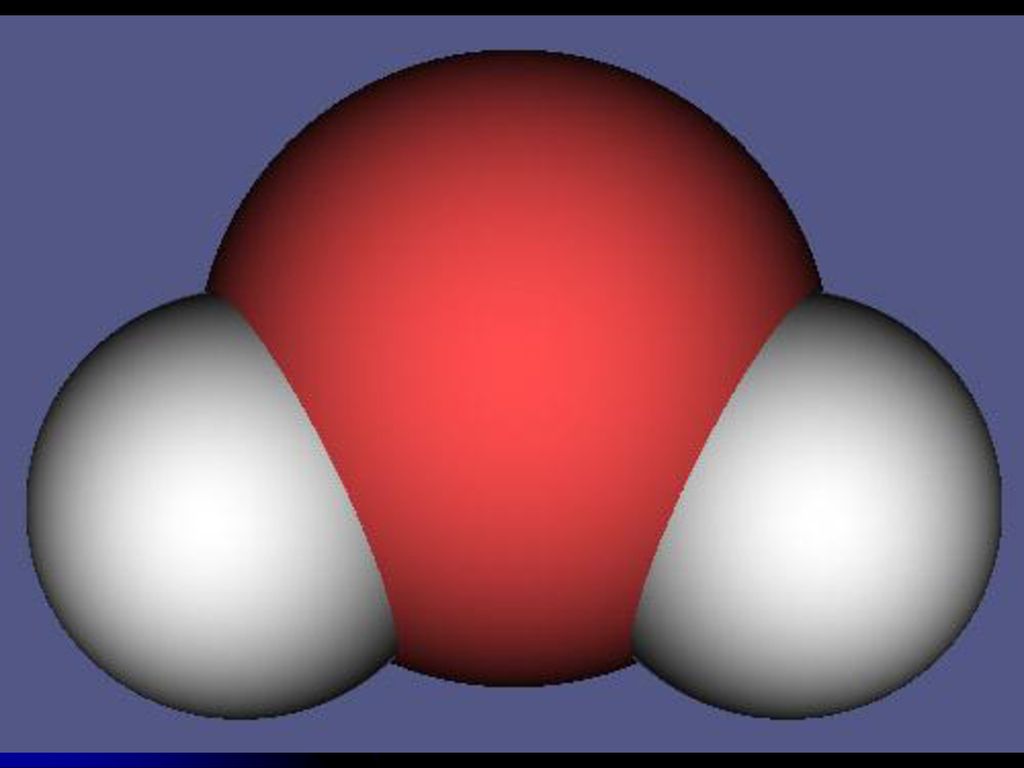
Вода
Вода — это неорганическое соединение с химической формулой H20. Представляет собой прозрачную жидкость, без цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, а в газообразном— водяным паром.
Вода. Строение молекулы.
Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
Самая простая модель молекулы воды предсталяет собой тетраэдр. На самом деле одиночные молекулы воды при нормальных температуре и давлении не существуют, все они соединены друг с другом водородными связями. Можно сказать, все молекулы связаны в одну пространственную сетку – макромолекулу. Каждая молекула воды может участвовать максимум в четырёх водородных связях (каждый атом водорода в одной и атом кислорода — в двух). В таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, и молекулы воды располагаются плотнее.
Вода имеет несколько химических названий: оксид водорода, монооксид дигидрогена, гидроксид водорода (соединение гидроксильной группы OH- и катиона H+), гидроксильная кислота (воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «кислотного остатка» OH- оксидан дигидромонооксид.)
Кислород и водород в молекуле воды имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода выделяют следующие виды воды: лёгкая вода Н2О, тяжёлая вода (дейтериевая) D2O и сверхтяжёлая вода (тритиевая) T2O.
Вода. Важные свойства.
Вода – самое необычное вещество природы. Это связано с тем, что свойства воды во многом не соответствуют физическим законам, которым подчиняются другие вещества.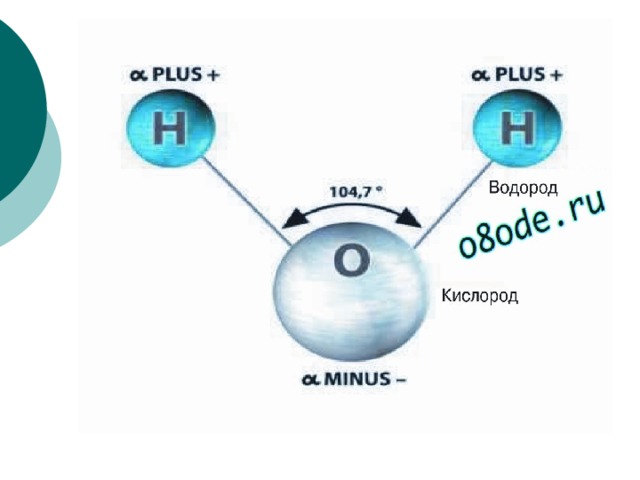 Рассмотрим какими удивительными физическими свойствами обладает вода. Большинство веществ находясь в твердом состоянии обладают более высокой плотностью чем в жидком. А вода наоборот в твердом состоянии (лед) обладает более низкой плотностью чем в жидком. Наибольшая плотность воды достигается при температуре +4оС, что обеспечивает жизнь в воде зимой. В замерзающих водоёмах, когда температура падает ниже +4°C, более холодная вода, как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура. Еще одно аномальное свойство воды – расширение объема на 10% при замерзании обеспечивает плавание льда, и как следствие сохранение жизни подо льдом.
Рассмотрим какими удивительными физическими свойствами обладает вода. Большинство веществ находясь в твердом состоянии обладают более высокой плотностью чем в жидком. А вода наоборот в твердом состоянии (лед) обладает более низкой плотностью чем в жидком. Наибольшая плотность воды достигается при температуре +4оС, что обеспечивает жизнь в воде зимой. В замерзающих водоёмах, когда температура падает ниже +4°C, более холодная вода, как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура. Еще одно аномальное свойство воды – расширение объема на 10% при замерзании обеспечивает плавание льда, и как следствие сохранение жизни подо льдом.
Важное свойство воды – это большое поверхностное натяжение (72мН/м при 25 ОС). Так как у воды силы межмолекулярного взаимодействия очень велики, то каждая расположенная на поверхности воды молекула как бы втягивается внутрь слоя воды.
Вода это хороший растворитель полярных веществ. В связи со своими малыми размерами молекулы воды в большом количестве могут окружить каждую молекулу растворяемого вещества. Положительно заряженные части молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода.
В связи со своими малыми размерами молекулы воды в большом количестве могут окружить каждую молекулу растворяемого вещества. Положительно заряженные части молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода.
Чистая вода (без примесей) — хороший изолятор
Вода сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул воды, она также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.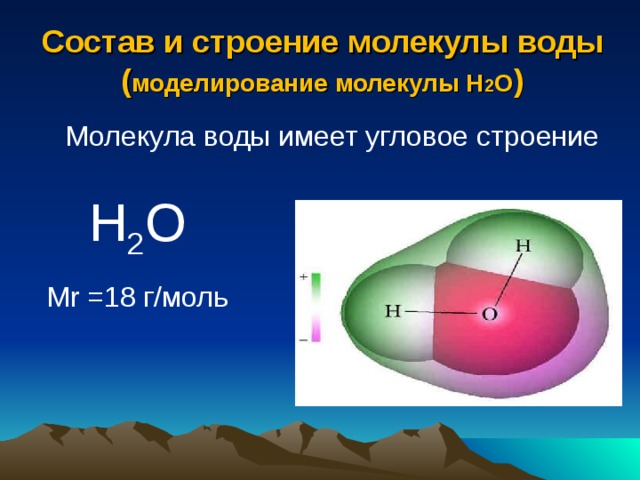
Вода медленно нагревается благодаря высокой теплоемкости, но процесс остывания происходит намного медленнее. Это дает возможность в летнее время года накапливать тепло на нашей планете посредством океанов и морей, а затем постепенно высвобождать тепло в зимний период. Таким образом, океаны и моря – это оригинальный и природный аккумулятор тепла на территории нашей планеты. Теплоемкость воды более чем в два раза превышает теплоемкость любого другого химического соединения, поэтому именно воду используют в качестве рабочего тела в энергетик.
«Водные» новости мира
Фильтры очищают от вирусов
Американские ученые-экологи из Стэндфордского университета США утверждают, что поведение вирусов SARS-CoV-2 в окружающей среде зависит во многом от их строения. Ученые пока не могут выяснить, как себя ведет новый вирус в окружающей среде. Однако все зависит от того, «обернут» ли он в слои липидов или же «голый».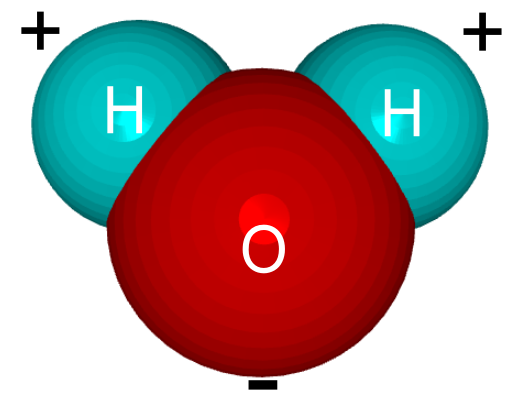 Если вирус «одет», то это помогает ему не сталкиваться с иммунной системой хозяина, а «голые» вирусы могут легко распространяться в воде.
Если вирус «одет», то это помогает ему не сталкиваться с иммунной системой хозяина, а «голые» вирусы могут легко распространяться в воде.
Ученые провели исследование и выяснили, что фильтры для очистки воды и различные барьеры справляются с задачей избавления воды от вирусов, сходных с SARS-CoV-2. В связи с этим предполагается, что вода не может быть основным путем передачи коронавируса.
Обнаружены запасы пресной воды
Под морским дном у побережья Южного острова Новой Зеландии обнаружили скрытые запасы пресной воды. Этот природный резервуар позволит предотвратить будущие засухи и смягчить последствия изменений климата в ближайшие годы. Слой грунтовых вод открыли при помощи методов сейсмологии и электромагнитного сканирования. По предположениям ученых, эта система может содержать до 2000 кубических километров пресной воды – это 800 млн олимпийских плавательных бассейнов, или больше, чем озеро Онтарио.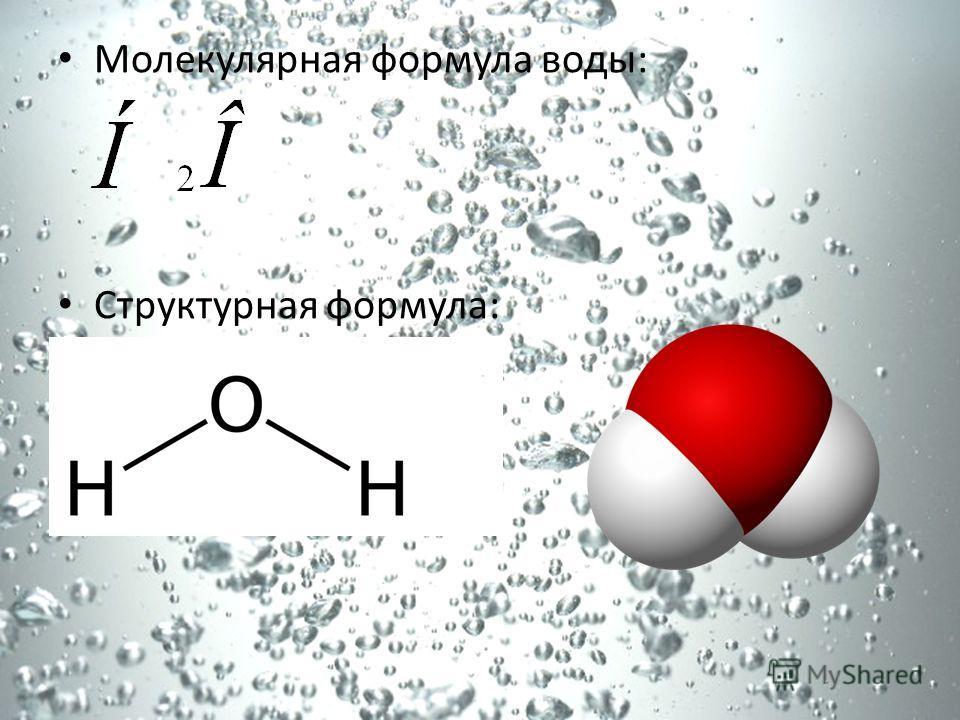
Сейчас ученые намерены взять пробы пресной воды из подземного источника и установить, как его можно использовать без ущерба для окружающей среды и местных экосистем.
Вода на Юпитере
Миссия NASA Juno («Юнона») представила первые научные данные о количестве воды в атмосфере Юпитера. По словам ученых, на экваторе планеты содержится около 0,25% молекул Н2О – почти в три раза больше, чем на Солнце, сообщает Nature Astronomy.
Отметим, что вопрос наличия воды на Юпитере оставался открытым на протяжении десятков лет. В 1995 году миссия Galileo предположила, что гигант может быть чрезвычайно сухим. Одноименный зонд погрузился на 120 километров вглубь атмосферы, где давление достигало 22 бар (для сравнения, на Земле – около 1,01 бар), и обнаружил там в 10 раз меньше воды, чем предполагалось.
Против COVID-19
Российские ученые провели исследование и выяснили, что вода, обработанная холодной плазмой, способна эффективно бороться с бактериями, грибками и вирусами, в том числе и с COVID-19. Специалисты из Сколкова создали установку, которая позволяет преобразовать обычную воду так, чтобы она уничтожала мелкие биологические объекты, благодаря содержащимся активным формам кислорода и хлорноватистой кислоты.
Суть технологии заключается в производстве холодной плазмы – газа из заряженных и незаряженных частиц, поступающего в воду. Это приводит к тому, что атомы теряют часть электронов и не могут соединиться в молекулу h3O. В результате рождаются различные формы кислорода и водорода, повреждающие клетки вирусов.
По словам экспертов, получившуюся жидкость можно использовать для обработки медицинских масок и разных поверхностей, а также распылять в воздухе.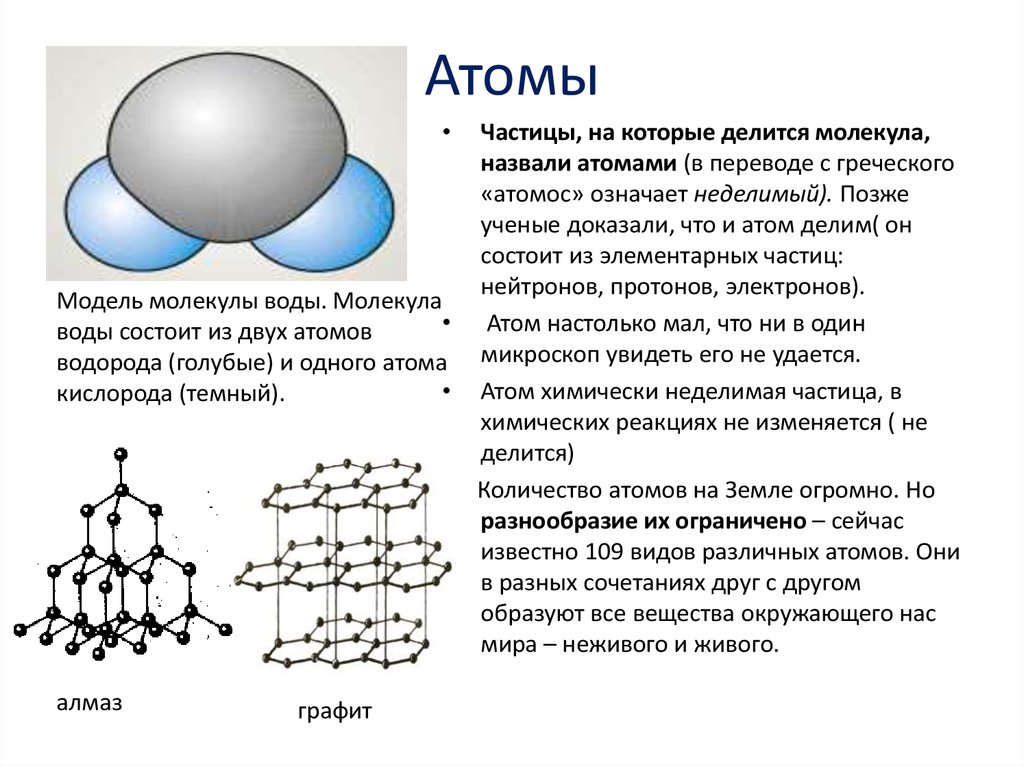 При этом, в отличие от хлорки и спиртовых растворов, она абсолютно безопасна для организма.
При этом, в отличие от хлорки и спиртовых растворов, она абсолютно безопасна для организма.
Солнечная батарея очищает
В Саудовской Аравии создан агрегат, который использует солнечную энергию для одновременного генерирования электричества и дистилляции воды. Как пишет журнал Nature, устройство разработано группой ученых из саудовского Научно-технологического университета короля Абдаллаха (KAUST). Агрегат состоит из двух резервуаров для загрязненной и очищенной воды и многоступенчатой мембранной системы дистилляции. Он может работать как с домашними аккумуляторами солнечной энергии, так и с крупными солнечными панелями промышленных электростанций.
Новая технология может сыграть важную роль в обеспечении питьевой водой жителей развивающихся стран Азии и Африки, где использование традиционных технологий очистки воды требует дорогостоящей инфраструктуры.
Вино разбавленное?
В Чили на пленарном заседании группы WWTG (World Wine Trade Group) развернулась дискуссия по поводу решения нескольких новосветских стран узаконить и регламентировать технологическое использование воды в виноделии. Так вот, оценка доли «технологической» воды, которая может попасть в вино будто бы без намерения винодела это вино разбавить, разнилась от 2,8% до 7%. В зависимости от климатических условий, если быть совсем честным… Не достигнув компромисса, WWTG воздержалась от принятия заявления по водному вопросу, но «процесс пошел», и ждать, какую форму примет вода в винных законодательствах, осталось уже недолго.
Виноделы стоят перед выбором: честно признать существующий факт технологического использования воды и ограничить его хоть какими-нибудь зримыми рамками или все же не пугать потребителя, который пока не потерял веру, что вино — натуральный продукт.
Вода из среды
Итальянские архитекторы из Architecture and Vision спроектировали башню Warka Water, которая без всяких энергетических затрат аккумулирует воду из окружающей среды.
Эта башня была специально разработана для беднейших районов Африки. Поэтому архитекторы поставили перед собой основную задачу — общая стоимость сооружения не должна превышать тысячу долларов. Как обещают разработчики, производительность Warka Water будет достаточно высокой — за сутки башня может «генерировать» примерно 100 литров питьевой воды.
Внутри конструкции из бамбуковых прутьев находится специальная проницаемая сетка, на которой собирается конденсат — капли воды от росы и тумана, а также дождевая вода. Затем вся собранная вода поступает в единый резервуар.
Право на чистую воду
22 марта во многих странах мира ежегодно отмечается Всемирный день воды (World Day of Water) или Всемирный день водных ресурсов.
По данным ООН, в настоящее время более двух миллиардов людей не имеют доступа к безопасной воде, и их домашние хозяйства, школы, предприятия, фермерские хозяйства и фабрики ведут борьбу за выживание и процветание.
Беженцы, коренные народы, люди с ограниченными возможностями и многие другие часто сталкиваются с дискриминацией при попытке получить доступ к необходимой им безопасной воде и возможность ее использования.
По оценкам ООН, около 159 миллионов людей осуществляют сбор воды для питья из поверхностных источников, например прудов и ручьев. В четверти начальных школ по всему миру отсутствует система питьевого водоснабжения и учащиеся потребляют воду из незащищенных источников или не имеют возможности утолить жажду. Более 700 детей в возрасте младше пяти лет ежедневно погибают от диареи, которая связана с потреблением небезопасной воды и плохими санитарными условиями.
Для более 68,5 миллионов людей, которые были вынуждены покинуть свои дома, доступ к системам безопасного водоснабжения крайне затруднителен.
ООН призывает все страны направить помощь тем, кто в ней нуждается больше всего.
Пара- и орто-вода
Ученым из Швейцарии удалось разделить воду на две разных жидкости, состоящих из двух типов молекул воды, свойства которых заметно отличаются.
Способ реализации их эксперимента опубликован в журнале Nature Communications. Пространственная структура и некоторые физические свойства молекул воды зависят от спина атомов водорода. Если спин (собственный момент импульса элементарных частиц) обоих атомов одинаковый, то такая молекула называется пара-водой, если они противоположны – орто-водой. Штефан Виллич из университета Базеля и его коллеги впервые смогли решить эту «невозможную» задачу, охладив воду до температуры, близкой к абсолютному нулю, и заставив молекулы пара- и орто-воды самостоятельно разделиться на два лагеря, не соприкасающихся друг с другом.
Ученые надеются, что дальнейшие эксперименты с «чистыми» версиями воды помогут раскрыть и другие различия между ними, и понять, почему пропорции пара- и орто-воды на Земле отличаются от тех значений, которые были вычислены для других звездных систем. Это может оказаться критически важным для раскрытия истории формирования планеты и зарождения жизни на ее поверхности.
(По материалам ИА и открытых источников)
Молекулы 7 класс онлайн-подготовка на Ростелеком Лицей
Можно ли делить вещество на части до бесконечности?
Мы знаем, что все вещества состоят из частиц. Эти частицы непрерывно движутся, между ними есть промежутки, а сами частицы очень малы.
Вспомним опыт из предыдущего занятия. Мы взяли раствор красителя, перенесли в сосуд небольшую его долю и долили сосуд чистой водой. Весь объем жидкости в сосуде окрасился, но окраска стала слабее. Из этого сосуда мы перелили часть подкрашенной жидкости в следующий сосуд и опять долили чистой водой. И вновь весь объем жидкости оказался окрашенным.
Мы взяли раствор красителя, перенесли в сосуд небольшую его долю и долили сосуд чистой водой. Весь объем жидкости в сосуде окрасился, но окраска стала слабее. Из этого сосуда мы перелили часть подкрашенной жидкости в следующий сосуд и опять долили чистой водой. И вновь весь объем жидкости оказался окрашенным.
Рис. 1. При многократном разбавлении раствора красителя водой окраска все равно сохраняется
Из данного опыта мы можем сделать вывод, что при каждом последующем разделении раствора количество частиц красителя в растворе становится все меньше и меньше. И тогда напрашивается вопрос: можно ли делить вещество (в нашем случае краситель) на части до бесконечности?
Что такое молекула
Ответ на поставленный нами вопрос предложил древнегреческий ученый Демокрит, живший в V веке до нашей эры.
Рис. 2. Демокрит – автор идеи о существовании предела деления вещества на части
Демокрит утверждал, что все вещества состоят из частиц. Самая мельчайшая частичка воды – молекула воды. Все молекулы воды абсолютно одинаковые. Самая мельчайшая частица сахара – молекула сахара. Все молекулы сахара также одинаковые. Их строение таково, что сахар на вкус сладкий. А строение молекул воды таково, что чистая вода сладкой не кажется. Сладкий вкус – одно из многих химических свойств молекул сахара.
Самая мельчайшая частичка воды – молекула воды. Все молекулы воды абсолютно одинаковые. Самая мельчайшая частица сахара – молекула сахара. Все молекулы сахара также одинаковые. Их строение таково, что сахар на вкус сладкий. А строение молекул воды таково, что чистая вода сладкой не кажется. Сладкий вкус – одно из многих химических свойств молекул сахара.
Молекулой называется мельчайшая частица вещества, сохраняющая его химические свойства.
Все молекулы одного вещества одинаковы, молекулы разных веществ различны.
Размеры молекул
Кусочек сахара можно разломить на очень маленькие частички. Капля бензина или масла может растекаться по поверхности жидкости на очень большие площади. Толщина пленки при этом будет в несколько тысяч раз меньше толщины человеческого волоса. И даже мельчайшая частица сахара, и даже небольшой участок масляной пленки на поверхности воды будут содержать не одну, а огромное количество молекул.
Молекулы состоят из атомов
Молекулы очень малы. Но даже они могут разделиться на еще более мелкие составные части. Они называются атомы. Слово «атом» ввел в употребление Демокрит. В переводе на русский язык оно означает «неделимый». Атомы – это «кирпичики», из которых строятся молекулы любого вещества. Различных сортов атомов около сотни. Каждый сорт атомов имеет свое общепринятое обозначение из одной или двух латинских букв.
Рис. 3. Каждый сорт атомов имеет свое название и принятое во всем мире обозначение
Атомы, соединяясь друг с другом, образуют молекулы. Так, если взять два атома водорода (обозначаются латинской буквой H) и один атом кислорода (обозначается буквой O), то при соединении этих атомов получится молекула воды. Ее химическое обозначение (химическую формулу), записывают так: H2O.
Рис. 4. Молекула воды получается при соединении двух атомов водорода и одного атома кислорода
Как увидеть атомы?
Все тела представляются нам сплошными.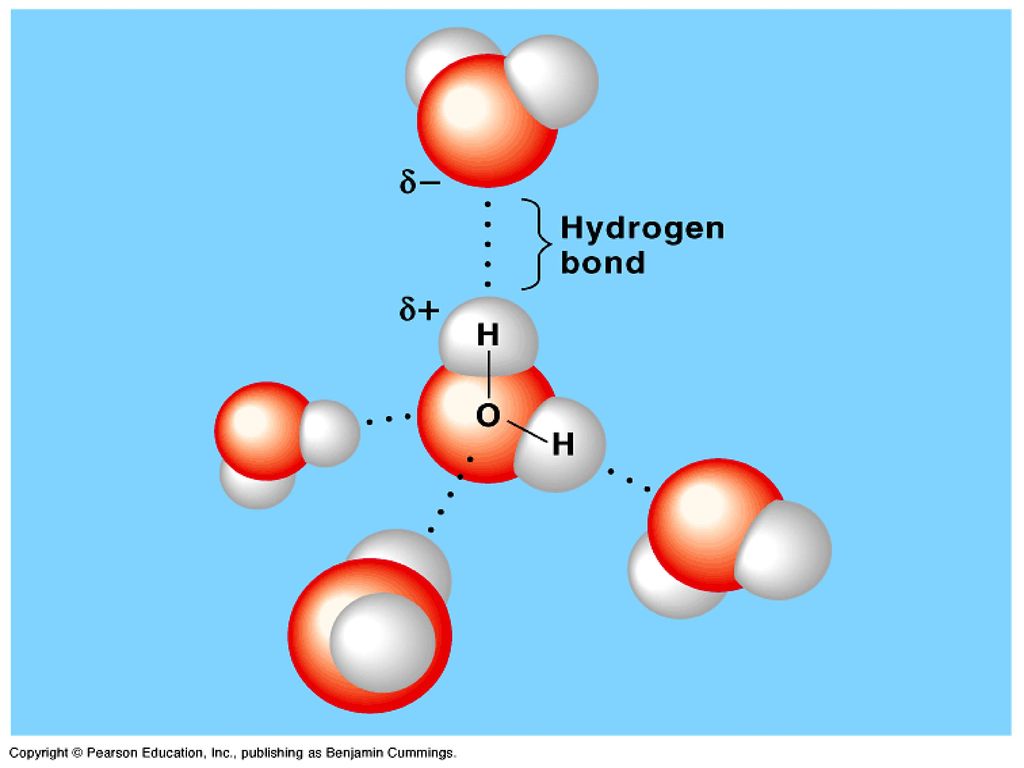 Это объясняется тем, что молекулы и тем более составляющие их атомы очень малы. И все же ученые придумали очень сложные приборы, позволяющие увидеть молекулы вещества и даже отдельные атомы. Одно из таких сложнейших устройств называется электронный микроскоп.
Это объясняется тем, что молекулы и тем более составляющие их атомы очень малы. И все же ученые придумали очень сложные приборы, позволяющие увидеть молекулы вещества и даже отдельные атомы. Одно из таких сложнейших устройств называется электронный микроскоп.
| Рис. 5. Современный электронный микроскоп | Рис. 6. Изображение атомов углерода |
Заключение
Атомы – очень мелкие частицы. Но и они, несмотря на название, оказываются делимы. Атомы тоже состоят из еще более мелких частиц (удивительно, что этих частиц всего три сорта – электроны, протоны, нейтроны). Об их существовании, конечно, не было известно Демокриту. О внутреннем строении атома физики узнали только в начале ХХ столетия, а вам предстоит познакомиться в старшей школе.
В заключение урока уместно привести одну правдивую историю.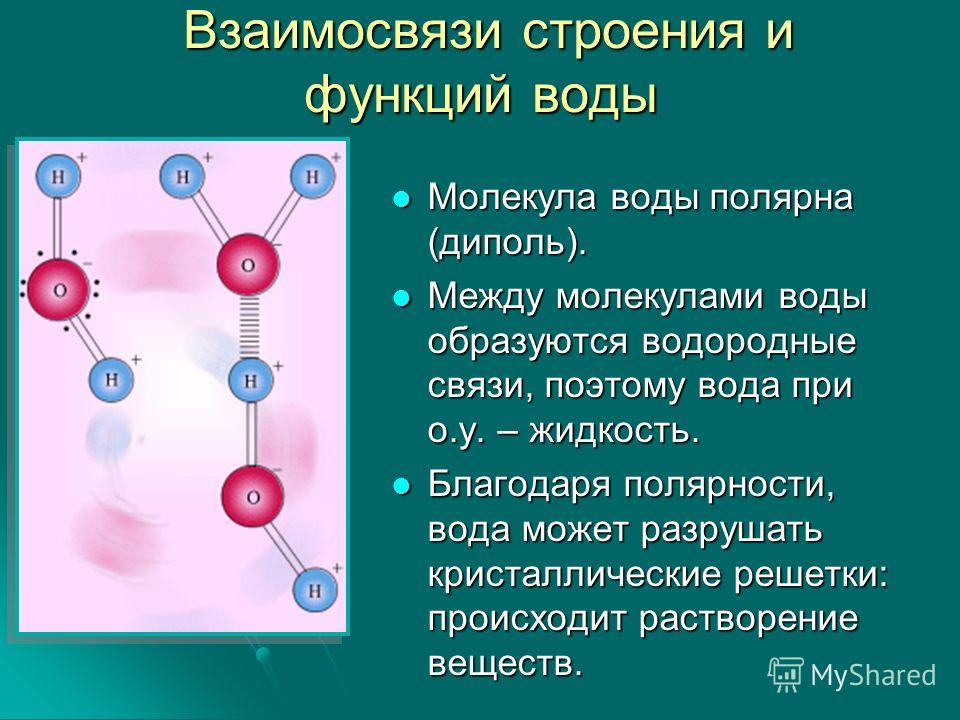
Корреспондент некой американской газеты спросил знаменитого физика Ричарда Фейнмана: «Господин Фейнман, если бы вдруг выяснилось, что в результате катастрофы все знания человечества должны погибнуть и Вам необходимо в одной фразе передать будущим поколениям самое ценное из них, то что бы Вы сказали потомкам?»
Ученый ответил так: «Безусловно, это была бы атомистическая гипотеза: весь мир состоит из мельчайших частиц, которые непрерывно движутся и взаимодействуют друг с другом».
Рис. 7. Ричард Фейнман (1918–1988) – один из крупнейших ученых, работавших над изучением физики микромира
Список литературы
- Перышкин А.В. Физика. 7 кл. – 14-е изд., стереотип. – М.: Дрофа, 2010.
- Перышкин А.В. Сборник задач по физике, 7 – 9 кл.: 5-е изд., стереотип. – М: Издательство «Экзамен», 2010.
- Лукашик В.И., Иванова Е.В. Сборник задач по физике для 7 – 9 классов общеобразовательных учреждений. – 17-е изд. – М.: Просвещение, 2004.

Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция Цифровых Образовательных Ресурсов (Источник)
- Единая коллекция Цифровых Образовательных Ресурсов (Источник)
Домашнее задание
Лукашик В.И., Иванова Е.В. Сборник задач по физике для 7 – 9 классов
№№ 41, 42.
Вода (молекула) — Простая англоязычная Википедия, свободная энциклопедия
| Вода (H 2 O) | |
|---|---|
| Общие | |
| Систематическое название | Вода |
| Другие наименования | Вода Оксид водорода Гидроксид водорода Гидрат Оксидан Соляная кислота Монооксид дигидрогена Гидроксикислота μ -Оксидодигидроген |
| Молекулярная формула | HOH или H 2 O |
| Молярная масса | 18,01524 г·моль −1 |
| Внешний вид | прозрачная, почти бесцветная жидкость с легким оттенком синего [1] |
| Номер CAS | [7732-18-5] |
см.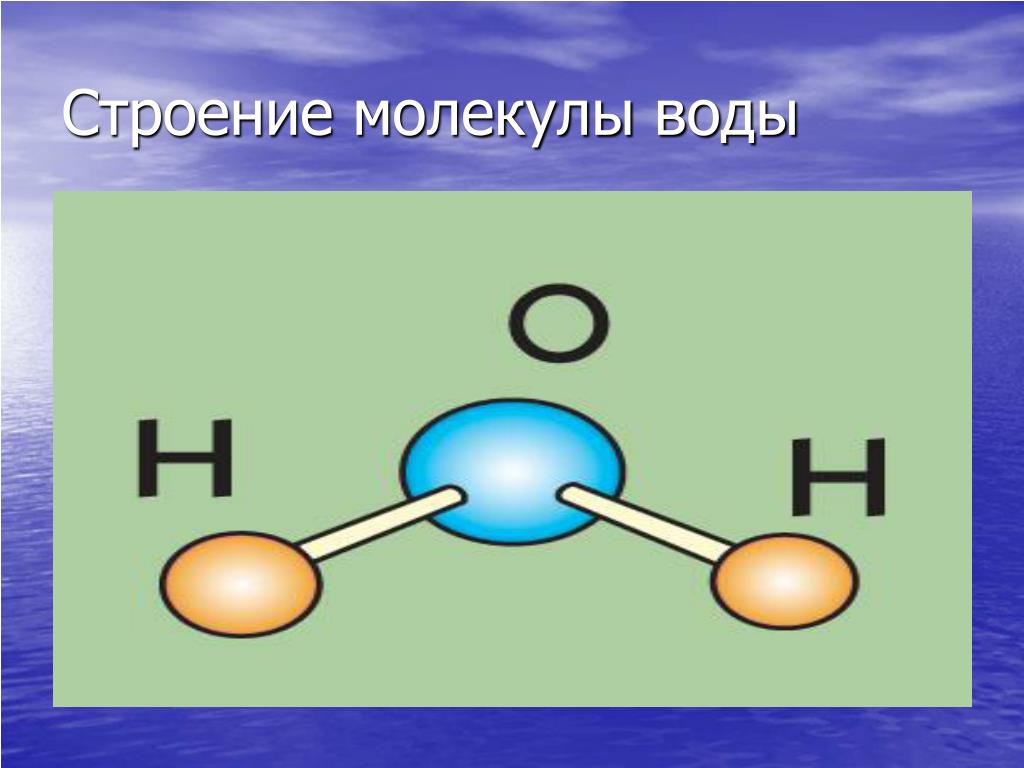 также также | Вода (страница данных) |
| Недвижимость | |
| Плотность и фаза | 1000 кг·м −3 , жидкость (4 °C) 917 кг·м −3 , твердое |
| Температура плавления | 0 °C, 32 °F (273,15 K) [2] |
| Температура кипения | 100 °C, 212 °F (373,15 K) [2] |
| Тройная точка | 273,16 К, 611,73 Па |
| Критическая точка | 647 К, 22,1 МПа |
| Удельная теплоемкость Производительность (газ) | C P = 1970 j · кг −1 · K −1 @ 300 K C V = 1510 J · KG −1 · K ° 33333333333333333333333333333333333333333333337. [3] |
| Удельная теплоемкость Емкость (жидкость) | 4186 Дж·кг −1 ·K −1 |
| Удельная теплоемкость Емкость (твердая) | 2060 Дж·кг −1 ·K −1 |
| Кислотность (p K a ) | 15,74 |
| Основность (p K b ) | 15,74 |
| Вязкость | 0,001 Па·с при 20 °C |
| Поверхностное натяжение при 20 °C | 7,28 Н·м −1 |
| Структура | |
| Молекулярная форма | нелинейный изгиб |
| Кристаллическая структура | Шестигранник См. 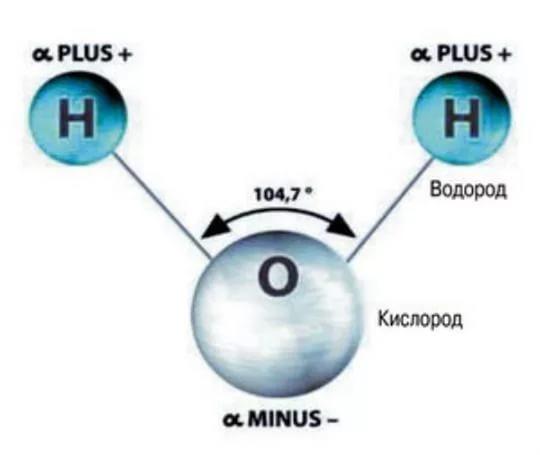 лед лед |
| Дипольный момент | 1,85 Д |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности |
| Основные опасности | Утопление |
| NFPA 704 |
|
| Номер РТЭКС | ZC0110000 |
| Страница дополнительных данных | |
| Структура и свойства | n , ε r и т. д. |
| Термодинамические данные | Фазовое поведение Твердое, жидкое, газообразное |
| Спектральные данные | УФ, ИК, ЯМР, МС |
| Родственные соединения | |
| Родственные растворители | ацетон метанол |
| Родственные соединения | водяной пар лед тяжелая вода |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) Отказ от ответственности и ссылки на Infobox | |
Вода (H 2 O, HOH) покрывает 70-75% поверхности Земли в жидком и твердом (лед) состояниях и присутствует в атмосфере в виде пара. Это самая распространенная молекула на поверхности Земли. [4]
Это самая распространенная молекула на поверхности Земли. [4]
При комнатной температуре это почти бесцветная жидкость без вкуса и запаха. Многие вещества растворяются в воде, и обычно ее рассматривают как растворитель универсальный ; из-за этого вода в природе и в употреблении редко бывает чистой и может иметь некоторые свойства, отличные от лабораторных. Но есть много соединений, которые практически, если не полностью, нерастворимы в воде. Вода — единственное обычное чистое вещество, встречающееся в природе во всех трех агрегатных состояниях. О других веществах см. Химические свойства.
Чистая вода не имеет вкуса. Это другие химические вещества в воде, которые могут придать воде вкус.
Как правило, объем жидкости увеличивается при нагревании, однако объем воды уменьшается при нагревании в диапазоне температур от 0°C до 4°C. Его объем увеличивается только при нагревании выше 4°С. Такое поведение является одним из ряда аномальных свойств воды.
Это свойство уменьшения объема позволяет рыбам и другим водным животным выживать в водоеме, когда на его поверхности намерзает лед. В холодном климате, когда температура водоема достигает 4°С, верхние слои воды, соприкасающиеся с холодным воздухом, продолжают терять тепловую энергию, и их температура падает ниже 4°С. При охлаждении ниже 4°С эти слои поднимаются, а не опускаются, так как вода имеет максимальную плотность при 4°С. Таким образом, на дне остается слой воды с температурой 4°С, а выше образуются слои воды 3°С, 2°С, 1°С и 0°С. Поскольку лед является плохим проводником тепла, он не позволяет передавать тепловую энергию от жидкой воды под слои льда, что предотвращает замерзание жидкой воды. Следовательно, водные существа выживают в таких местах.
- ↑ Браун К.Л. и Смитнов С.Н. 1993. Почему вода голубая? J. Chem Ed . 70 , 612. [1] Архивировано 25 мая 2019 г. в Wayback Machine.
- ↑ 2.0 2.1 Венский стандарт средней океанской воды (VSMOW), используемый для калибровки, плавится при 273,1500089(10) К (0,000089(10) °C, и кипит при 373,1339 К (99,9839 °C)
- ↑ Serway, Raymond A.
 Физика для ученых и инженеров , 3-е издание
Физика для ученых и инженеров , 3-е издание - ↑ Химия воды [2]
- Структура и поведение воды Комплексный и актуальный ресурс NPOV, поддерживаемый профессором Мартином Чаплином из Университета Саут-Бэнк, Великобритания
- Поддельный сайт о «опасности» монооксида дигидрогена
- Стокгольмский международный институт водных ресурсов (SIWI)
- Объяснение аномальных свойств воды
- Computational Chemistry Wiki Архивировано 27 сентября 2007 г. в Wayback Machine
Обман окиси дигидрогена включает в себя перечисление негативных эффектов воды с использованием незнакомого научного названия, а затем просьбу людей помочь контролировать это, казалось бы, опасное вещество. Обман призван проиллюстрировать, как отсутствие научных знаний и преувеличенный анализ могут привести к неуместным страхам. Обман был, по-видимому, создан Эриком Лехнером, Ларсом Норпхеном и Мэтью Кауфманом, соседями по дому во время учебы в Калифорнийском университете в Санта-Круз в 1989 году, переработан Крейгом Джексоном в 1994 году и привлек внимание широкой общественности в 1997 году, когда Натан Зонер, 14-летний… старый студент собрал петиции о запрете «DHMO» в качестве основы своего научного проекта под названием «Насколько мы доверчивы?» [1] Дополнительные рекомендуемые знания
Исходный внешний вид в ИнтернетеПервая веб-публикация Крейга Джексона включала следующее: Монооксид дигидрогена: Исходная веб-страница больше недоступна, но она была скопирована Интернет-архивом: Запрет монооксида дигидрогена! Терминология «Монооксид дигидрогена» может показаться опасным для тех, кто плохо разбирается в химии или придерживается идеала «безхимической» жизни. Молекула воды имеет химическую формулу H 2 O, что означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Буквально термин «моноксид дигидрогена» означает «два водорода, один кислород» в соответствии с его молекулярной формулой: префикс ди в диводород означает «два», приставка моно в монооксид означает «один», а оксид представляет собой соединение, содержащее один или несколько атомов кислорода. Использование цифровых префиксов является типичной номенклатурой для соединений, образованных ковалентными связями, которые присутствуют в воде. Префикс для первого названного элемента часто опускается, если участвующие элементы обычно образуют только одно соединение или даже если число атомов первого названного элемента одинаково во всех соединениях двух (или более) элементов. Префикс mono- часто опускается для второго элемента, если он является единственным общим соединением, которое образуют элементы. Таким образом, обращение к H 2 S как к моносульфиду водорода встречается гораздо реже, чем название сероводород. Однако, поскольку углерод и кислород могут образовывать несколько соединений (окись углерода, двуокись углерода, двуокись углерода и двуокись углерода), префикс моно- сохраняется, как и в случае с окисью кремния и двуокисью кремния. Действительно, водород и кислород образуют другое общее соединение, H 2 О 2 . Используя префиксную номенклатуру, это соединение можно было бы назвать диоксидом водорода, также известным как перекись водорода. Вода имеет обычное научное или систематическое название оксид водорода , а также щелочное название гидроксид водорода и несколько названий кислот, таких как гидроксидная кислота , гидроксильная кислота и гидроксильная кислота . Между прочим, термин «гидроксикислота», использованный в оригинальном розыгрыше, немного неверен, так как не соответствует общепринятому. Для этого соединения были разработаны дополнительные названия μ-оксидодигидрогена и оксидана. Вода не является систематическим химическим названием в рамках какой-либо признанной номенклатуры и не является международным. Это также не термин, обычно используемый для твердых или газообразных форм. Согласно редакции номенклатуры неорганической химии ИЮПАК 2005 г., для каждого соединения не существует единого правильного названия. [2] Основная функция химической номенклатуры состоит в том, чтобы у человека, который слышит или читает химическое название, не было двусмысленности относительно того, к какому химическому соединению оно относится: каждое название должно относиться к одному веществу. Общественные усилия с участием DHMO
| |
Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Dihydrogen_monoxide_hoax». Список авторов есть в Википедии. Он использует материал из статьи Википедии «Dihydrogen_monoxide_hoax». Список авторов есть в Википедии. |
Молекулярная геометрия h3O, структура Льюиса, форма и валентные углы
Структура Льюиса
- Posted by Priyanka
26 Oct
We have previously discussed the Lewis structures of CO2 , O3 , SO2 , SO3, and more. Сегодня мы собираемся узнать о структуре Льюиса молекулы h3O, а также о ее молекулярной геометрии и форме.
Вода является одним из самых несложных химических соединений для понимания, поскольку она имеет простую структуру Льюиса. Хотя мы всегда знали, что химия повсюду, в детстве мы определенно не знали, что даже у воды есть химические формулы. Вода имеет химическую формулу h3O, так как состоит из двух атомов водорода и одного атома кислорода. Эта молекула также имеет другое химическое название монооксида дигидрогена.
Эта молекула также имеет другое химическое название монооксида дигидрогена.
| Name of molecule | Water ( h3O ) | |
| No of Valence Electrons in the molecule | 8 | |
| Hybridization of H 2 O | гибридизация sp3 | |
| Бонд-углы | 104,5 градуса | 9 0104120076 Молекулярная геометрия H 2 OBENT |
В этом блоге GEURELISTERIS, GEBRIDIS, GOBRIDIS, GOBRIDIS, GOBRIDIS, GOBRIDIS, GOBRIDIS, GOBRIDIS, GOBRIDIS, GOBRIDIS, GOBRIDIS, DEBRIDIS, DEBRIDIS, DEBRIDIS, DEBRIDIS, DEBRIDIS, GEBRIDIS, GEBRIDIS. Это может помочь вам понять другие физические и химические свойства молекулы.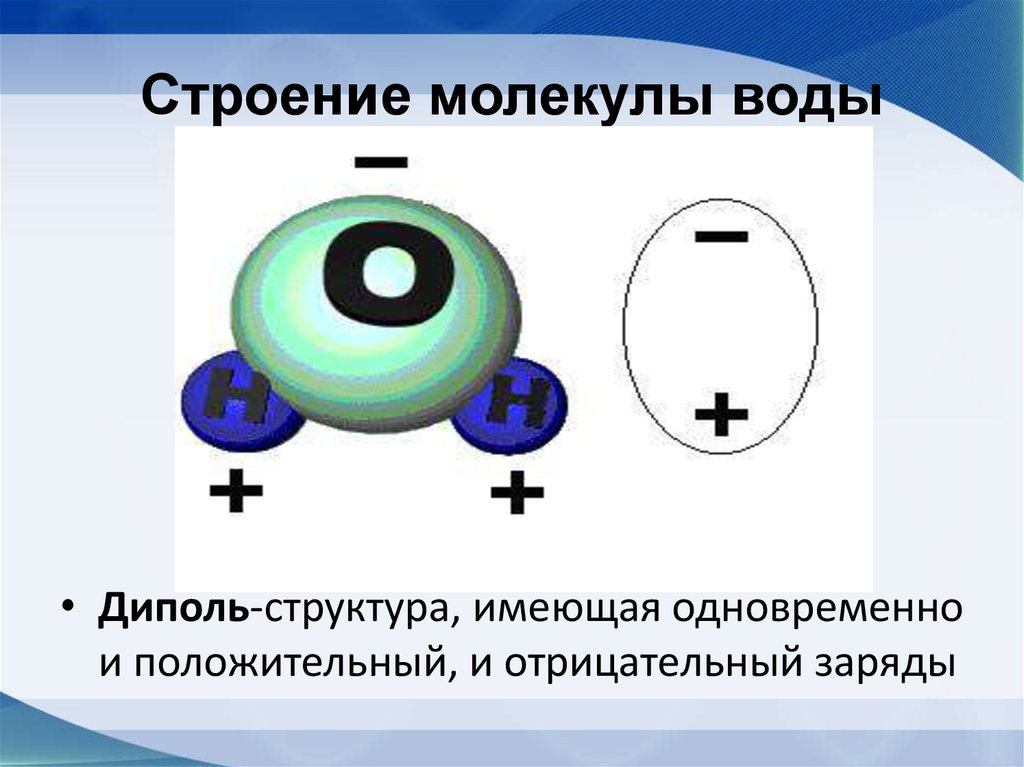 Но прежде чем рассматривать ее структуру Льюиса, мы сначала пройдемся по общему количеству валентных электронов для этой молекулы, поскольку именно эти электроны участвуют в формирование облигаций .
Но прежде чем рассматривать ее структуру Льюиса, мы сначала пройдемся по общему количеству валентных электронов для этой молекулы, поскольку именно эти электроны участвуют в формирование облигаций .
Содержание
H 2 O Валентные электроныЧтобы получить общее количество валентных электронов для этой молекулы, мы сложим валентные электроны атомов водорода и кислорода.
Валентные электроны водорода: 1*2 (поскольку атомов водорода 2, умножим на 2)
Валентные электроны кислорода: 6
Общее количество валентных электронов в H3O: 2 + 6
= 8 валентные электроны
Таким образом, у h3O всего 8 валентных электронов.
H 2 O Структура Льюиса Структура Льюиса для любой молекулы помогает узнать связи, образованные в структуре, и электроны, участвующие в образовании связи. Электроны, которые участвуют в образовании связи, известны как связывающая пара электронов. Напротив, те, которые не принимают участия в образовании какой-либо связи, называются несвязывающими парами электронов или неподеленными парами электронов.
Напротив, те, которые не принимают участия в образовании какой-либо связи, называются несвязывающими парами электронов или неподеленными парами электронов.
Здесь мы сначала разместим атомы и отдельные валентные электроны, чтобы шаг за шагом понять структуру Льюиса h3O.
Атомы кислорода займут центральное положение, так как атомы водорода всегда находятся снаружи. Поэтому поместите кислород в центр с обоими атомами водорода по бокам. Каждому атому водорода здесь нужен еще один валентный электрон, чтобы достичь стабильной структуры. Точно так же атому кислорода нужно два валентных электрона, чтобы завершить свой октет.
Оба атома водорода разделят один валентный электрон атома кислорода для достижения стабильной структуры. Чтобы показать совместное использование электронов, покажите одинарную связь с обеих сторон.
Это структура Льюиса молекулы h3O, которая имеет две одинарные связи между кислородом и водородом. В результате в этой молекуле есть две неподеленные пары и две связывающие пары электронов.
Когда два атома имеют общие электроны и образуют связи, образуются гибридные орбитали. Эти орбитали помогают нам предсказать гибридизацию молекулы. Здесь мы рассмотрим гибридизацию атома кислорода, поскольку он делит два своих валентных электрона с обоими атомами водорода. Три 2p-орбитали кислорода и одна 2s-орбиталь гибридизованы, так как есть две пары связывающих электронов и две неподеленные пары. И поскольку четыре орбитали кислорода гибридизуются, гибридизация h3O представляет собой sp3.
H 2 O Молекулярная геометрияМолекулярная геометрия любой молекулы зависит от ее структуры Льюиса, расположения атомов и ее электронов. В молекуле h3O атом кислорода образует две одинарные сигма-связи с атомами водорода. Хотя эти два атома водорода расположены симметрично в плоскости, две неподеленные пары электронов на атоме кислорода толкают эти атомы.
Поскольку силы отталкивания неподеленных пар больше, чем силы отталкивания связанных пар, расположение атомов искажается. Следовательно, молекулярная геометрия молекулы воды является угловой или V-образный , и некоторые люди также называют эту геометрию связи искаженной геометрией тетраэдра.
Следовательно, молекулярная геометрия молекулы воды является угловой или V-образный , и некоторые люди также называют эту геометрию связи искаженной геометрией тетраэдра.
Валентный угол для молекул с тетраэдрической геометрией составляет 109°, но поскольку геометрия молекулы h3O искажена из-за присутствия неподеленных пар электронов валентный угол уменьшается от 109° до 104,5°
H 2 Форма OМолекулярная форма молекулы h3O изогнута.
Заключительные замечания
- Подводя итог этой статье, можно сказать, что молекула h3O состоит из двух атомов водорода и одного атома кислорода.
- Всего у этой молекулы 8 валентных электронов, из которых четыре используются для образования сигма-связей O-H.
- На атоме кислорода две неподеленные пары, так как он не участвует в образовании связей.




 Физика для ученых и инженеров , 3-е издание
Физика для ученых и инженеров , 3-е издание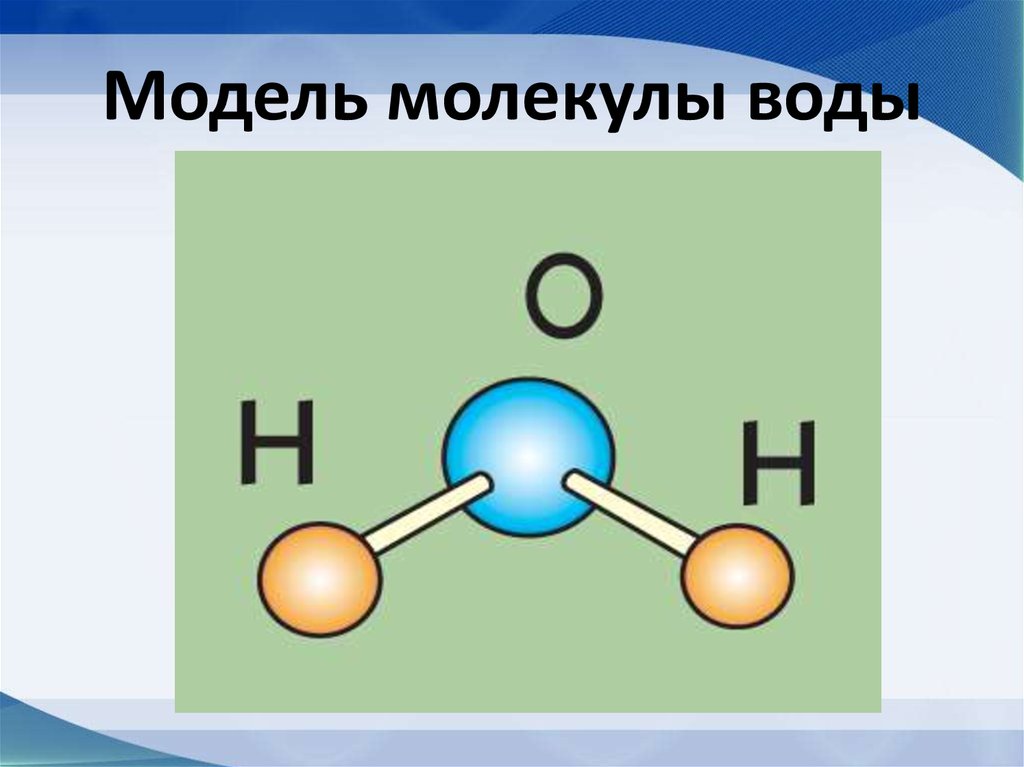 Моноокись дигидрогена, сокращенно до DHMO, является научным названием воды, которое, хотя и является технически правильным, почти никогда не используется.
Моноокись дигидрогена, сокращенно до DHMO, является научным названием воды, которое, хотя и является технически правильным, почти никогда не используется.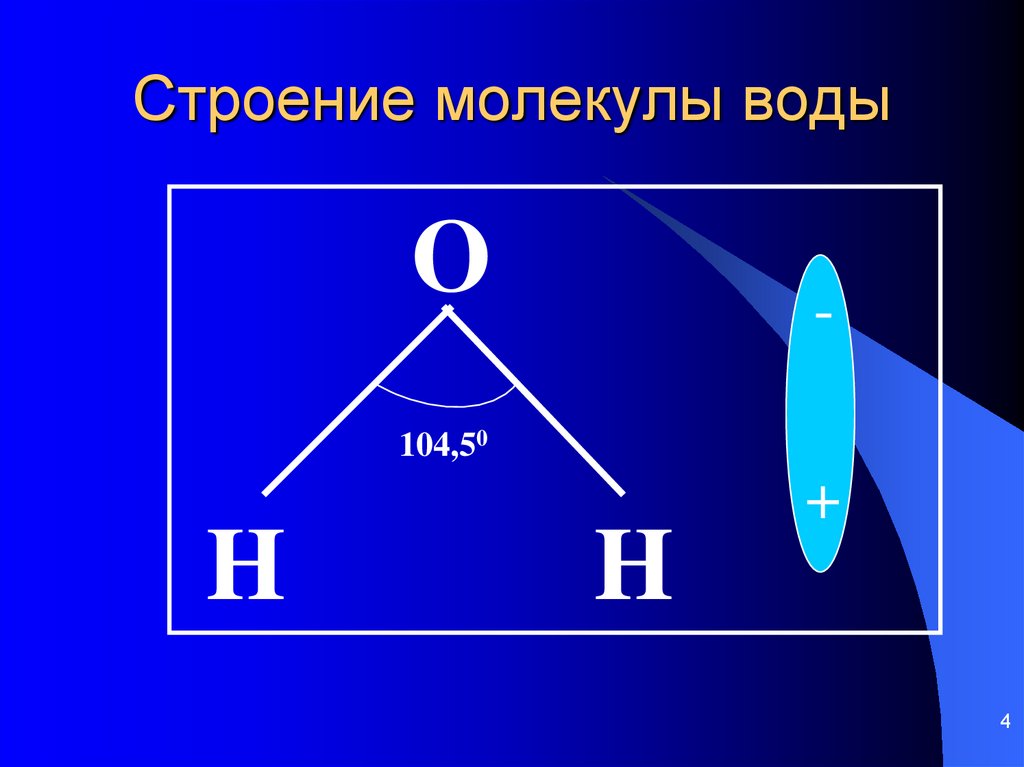
 Термин монооксид имеет отрицательный оттенок из-за того, что он является частью названия высокотоксичного монооксида углерода.
Термин монооксид имеет отрицательный оттенок из-за того, что он является частью названия высокотоксичного монооксида углерода. Таким образом, Н 2 S часто называют просто сероводородом, а оксид лития является общим названием для Li 2 O. Однако названия дигидрогенсульфид, оксид дилития и монооксид дилития также широко используются как в промышленности, так и в университетах.
Таким образом, Н 2 S часто называют просто сероводородом, а оксид лития является общим названием для Li 2 O. Однако названия дигидрогенсульфид, оксид дилития и монооксид дилития также широко используются как в промышленности, так и в университетах.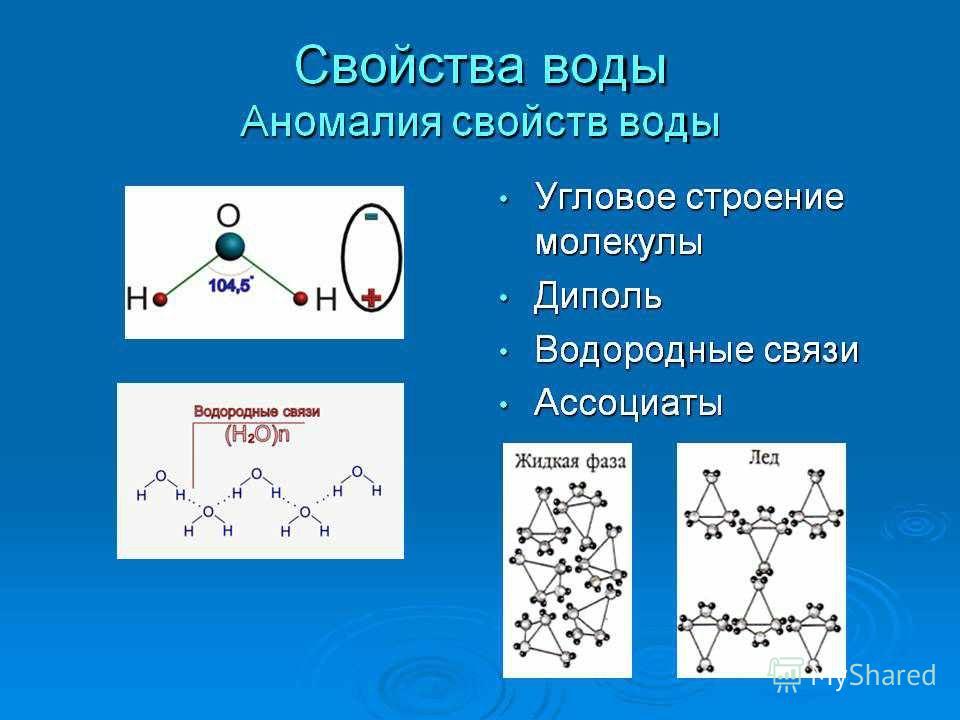 Таким образом, сохранение монооксида дигидрогена позволяет отличить его от другого соединения.
Таким образом, сохранение монооксида дигидрогена позволяет отличить его от другого соединения.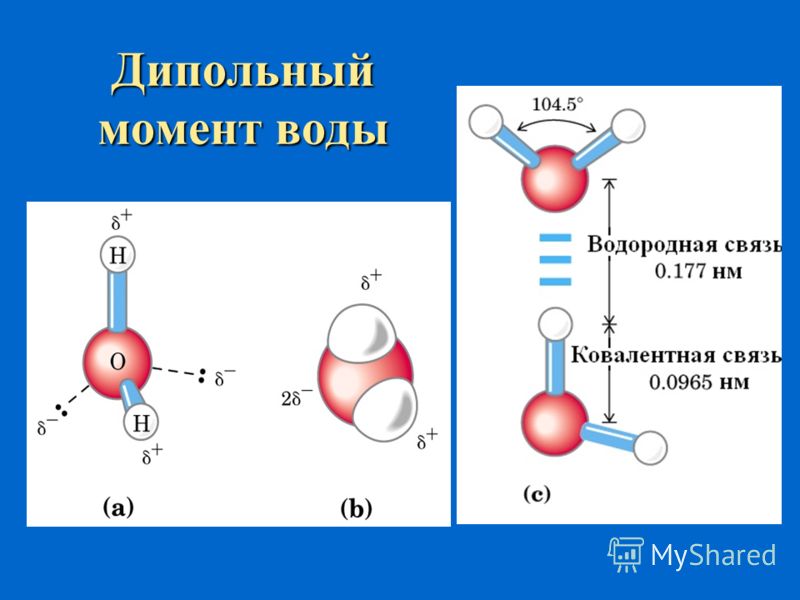 Считается менее важным обеспечить, чтобы каждое вещество имело одно название, хотя количество допустимых названий ограничено. [2] Вода — одно из допустимых названий этого соединения.
Считается менее важным обеспечить, чтобы каждое вещество имело одно название, хотя количество допустимых названий ограничено. [2] Вода — одно из допустимых названий этого соединения.

 Помощник юриста попросил городской совет включить это в повестку дня; позже он объяснил это плохим исследованием. [6] Закон был снят с повестки дня еще до того, как он был поставлен на голосование, но не раньше, чем город получил массу негативных отзывов. [1]
Помощник юриста попросил городской совет включить это в повестку дня; позже он объяснил это плохим исследованием. [6] Закон был снят с повестки дня еще до того, как он был поставлен на голосование, но не раньше, чем город получил массу негативных отзывов. [1]  «Рассчитывая на непонимание химического состава воды», он распорядился разместить на фонтане таблички с надписью: «ОПАСНО, ВОДА — СОДЕРЖИТ ВЫСОКОЕ УРОВЕНЬ ВОДОРОДА — НЕ ДОПУСКАТЬ».0052 [7] [8]
«Рассчитывая на непонимание химического состава воды», он распорядился разместить на фонтане таблички с надписью: «ОПАСНО, ВОДА — СОДЕРЖИТ ВЫСОКОЕ УРОВЕНЬ ВОДОРОДА — НЕ ДОПУСКАТЬ».0052 [7] [8]