Атомы и молекулы
Атомы — это маленькие частицы, из которых состоит вещество. Невозможно даже представить себе, насколько они малы. Если сложить в цепочку сто миллионов атомов, у нас получится ниточка длиной всего лишь в 1 см. В тонком листе бумаги, наверное, не меньше миллиона слоев атомов. Науке известно более ста видов атомов; соединяясь друг с другом, они образуют все окружающие нас вещества.

 Представление об атомах
Представление об атомах
Мысль о том, что всё в природе состоит из атомов, возникла давно. Еще 2500 лет назад древнегреческие философы полагали, что вещество состоит из таких частиц, которые нельзя разделить. Само слово «атом» восходит к греческому слову «атомос», что значит «неделимый». В Древней Греции (см. статью «Загадочные жители Греции«) философы обсуждали гипотезу о том, что всё вещество в мире состоит из неделимых частиц. Правда, Аристотель в этом сомневался.
 Термин «атом» был впервые использован английским химиком Джоном Дальтоном (1766- 1844). В 1807 г. Дальтон выдвинул свою атомную теорию. Атомами он назвал составляющие всякое вещество малые частицы, которые не изменяются входе химических реакций. Согласно Дальтону, химическая реакция — это процесс, при котором атомы соединяются вместе или отделяются друг от друга. Атомная теория Дальтона лежит в основе представлений современных ученых.
Термин «атом» был впервые использован английским химиком Джоном Дальтоном (1766- 1844). В 1807 г. Дальтон выдвинул свою атомную теорию. Атомами он назвал составляющие всякое вещество малые частицы, которые не изменяются входе химических реакций. Согласно Дальтону, химическая реакция — это процесс, при котором атомы соединяются вместе или отделяются друг от друга. Атомная теория Дальтона лежит в основе представлений современных ученых.  Структура атома
Структура атома
Атомы состоят из еще меньших, чем они сами, частиц, называемых элементарными
Строение атома часто описывают строгой диаграммой, однако сегодня ученые полагают, что электроны существуют на своих орбитах в размытом состоянии. Это представление отражено на рисунке, где электронные орбиты представлены в виде «облаков». Так вы бы увидели молекулу под электронным микроскопом. Равными цветами показаны разные уровни плотности электронов. Бирюзовым цветом отмечена область наибольшей плотности.
Атомный номер и атомная масса
Атомный номер — это число протонов в атомном ядре. Как правило, в состав атома входит одинаковое число протонов и электронов, поэтому по атомному номеру можно судить и о том, сколько в атоме электронов. В разных атомах содержится разное количество протонов. В ядре атома фосфора 15 протонов и 16 нейтронов, значит, его атомный номер 15. В ядре атома золота 79 протонов и 118 нейтронов: следовательно, атомный номер золота 79.
Чем больше протонов и нейтронов имеет атом, тем больше его масса (величина, показывающая количество вещества в составе атома). Сумму числа протонов и числа нейтронов мы называем атомной массой. Атомная масса фосфора — 31. При исчислении атомной массы электроны в расчет не принимаются, так как их масса ничтожно мала по сравнению с массой атома. Существует особый прибор — масс-спектрометр. Он позволяет определить для каждого данного атома его массу.

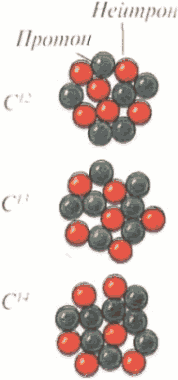
Изотопы
У большинства элементов существуют изотопы, атомы которых имеют несколько отличное строение. Количество протонов и электронов в атомах изотопов одного элемента всегда неизменно. Атомы изотопов различаются числом нейтронов в ядре. Следовательно, у всех изотопов одного элемента один и тот же атомный номер, но разная атомная масса. На этом рисунке вы видите три изотопа углерода. У изотопа С12 есть 6 нейтронов и 6 протонов. С13 имеет 7 нейтронов. В ядре изотопа С12 восемь нейтронов и 6 протонов.
Физические свойства изотопов различны, но они обладают одинаковыми химическими свойствами. Обычно большая часть атомов элемента (вещества, состоящего из атомов одного вида) принадлежит к одному изотопу, а другие изотопы встречаются в меньших количествах.
Молекулы
Атомы редко встречаются и свободном состоянии. Как правило, они связываются друг с другом и образуют молекулы либо другие, более массивные структуры. Молекула — это мельчайшая частица вещества, которая может существовать самостоятельно. Она состоит из атомов, удерживающихся вместе при помощи связей. Например, у молекулы воды два атома водорода связанны с атомом кислорода. Атомы удерживаются вместе благодаря электрическим зарядам частиц, из которых они состоят. Описывая строение молекул, ученые прибегают к помощи
Химические формулы
Химическая формула вещества показывает, сколько атомов каких элементов входит в состав одной молекулы. Каждый атом обозначается символом. Как правило, в качестве символа выбирается первая буква английского, латинского или арабского названия элемента. Например, молекула углекислою газа состоит из двух атомов кислорода и одного атома углерода, поэтому формула углекислого газа СО
Этот опыт продемонстрирует вам, что молекулы вещества удерживаются вместе силами притяжения. Наполните стакан водой до краев. Осторожно опустите в стакан несколько монет. Вы увидите, что над краями стакана приподнялся водяной купол. Сила, притягивающая молекулы воды друг к другу, может удержать некоторое количество воды над краями стакана. Эта сила называется силой поверхностного натяжения.
Конспект «Атомы, молекулы и ионы»
«Атомы, молекулы и ионы»
Ключевые слова конспекта: Атомно-молекулярное учение, атомы, молекулы и ионы, элементарные частицы, ядро, электрон, протон, нейтрон.
Учение о молекулах и атомах в основном было разработано в XVIII— XIX вв. Великий русский учёный М. В. Ломоносов утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы). Многообразие веществ учёный объяснял соединением разных атомов в молекулах и различным расположением атомов в них.

Основоположником атомно-молекулярного учения принято считать известного английского учёного Джона Дальтона. Тем не менее некоторые представления об атомах и молекулах, высказанные Ломоносовым за полвека до Дальтона, оказались более достоверными, научными. Например, английский учёный отрицал возможность существования молекул, образованных одинаковыми атомами.
Атомно-молекулярное учение получило окончательное признание только в 1860 г. на Всемирном съезде химиков в Карлсруэ.
Молекулы
Каждое отдельно взятое вещество состоит из одинаковых молекул. Например, вещество вода состоит из молекул воды. Но размеры молекул воды очень малы, поэтому даже маленькая капелька воды содержит огромное количество молекул, которые имеют одинаковые состав и свойства.
Молекулы — это мельчайшие частицы многих веществ, состав и химические свойства которых такие же, как у данного вещества. При химических реакциях молекулы распадаются, то есть они являются химически делимыми частицами. Молекулы состоят из атомов.

Атомы
Следует иметь в виду, что существуют также вещества, состоящие из отдельных одинаковых атомов. Мельчайшими частицами, сохраняющими характерные химические свойства таких веществ, являются атомы. Так, из отдельных атомов состоят благородные газы — гелий, неон, аргон и др. Атомы в отличие от молекул в ходе химических реакций не делятся на более мелкие части.
Атомы — это мельчайшие химически неделимые частицы вещества.
Элементарные частицы
В конце XIX—начале XX в. было обнаружено, что атомы состоят из ешё более мелких частиц. Эти частицы были названы элементарными частицами. В центре атома находится положительно заряженное ядро, вокруг которого находятся отрицательно заряженные частицы — электроны. Заряд электрона принято считать равным —1.
Ядро атома, в свою очередь, также состоит из элементарных частиц. В состав ядер атомов входят положительно заряженные частицы — протоны и частицы, имеющие почти такую же массу, как протоны, но не имеющие заряда,— нейтроны. Заряд протона численно равен заряду электрона, но имеет противоположный знак (+1).
Например, атом водорода состоит из ядра, в котором находится только один протон и один электрон. Атом гелия состоит из ядра, в котором находятся 2 протона и 2 нейтрона, а также 2 электрона. Атом лития состоит из ядра, в котором находятся 3 протона, 4 нейтрона, а также 3 электрона.
Ионы
Одни атомы, взаимодействуя с другими атомами, могут терять или, наоборот, приобретать один или более электронов. В результате электрически нейтральный атом превращается в заряженную частицу — ион. Если атом теряет один или несколько электронов, его называют положительно заряженным ионом. Атом, дополнительно присоединивший один или несколько электронов, называют отрицательно заряженным ионом. Противоположно заряженные ионы притягиваются друг к другу. Подробнее электронно-ионная теория рассматривается в курсе физики (читать Конспект «Электронно-ионная теория»)

Конспект урока «Атомы, молекулы и ионы».
Следующая тема: «Простые и сложные вещества».
Обсуждение:Молекула — Википедия
Материал из Википедии — свободной энциклопедии
а может стоит добавить как дошли ло понимания молекул и кто их придумал? а также написать кто их впервые разглядел
- кто ж тебе мешает — напиши. MaxiMaxiMax 15:18, 22 Июн 2004 (UTC)
Словарное определение[править код]
В статье написано, что молекула это частица, состоящая из двух и более атомов, хотя это неверно, ведь существуют одноатомные молекулы у благородных газов. Наиболее верным и распространенным являтся определение, приведенное ниже в тексте статьи:
Молекула — наименьшая стабильная частица вещества, обладающая всеми его химическими свойствами.
По моему мнению, им и стоит заменить текущее определение.
Не хотелось бы менять определение в статье, без согласия человека это определение сюда написавшего. Fizhimik 23:00, 22 декабря 2008 (UTC)
Определение противоречиво[править код]
Определение противоречиво. По первой его части один атом серебра (к примеру) можно называть молекулой. По второй его части — нельзя. 85.141.46.98 10:27, 29 мая 2009 (UTC)alex
- По-моему, фраза «Молекула состоит из двух или более атомов» откровенно неправильная. Благородные газы образуют одноатомные молекулы. Поэтому определение нужно менять. Ну а металлы сами молекул, как раз, и не образуют — только металлическую кристаллическую решетку. Fizhimik 18:33, 29 мая 2009 (UTC)
Противоречия в определении нет.[править код]
- Фраза «молекула состоит из двух и более атомов» правильная. Если бы молекула состояла только из одного атома, то она называлась бы атомом, а не молекулой.
Благородные (инертные) газы являются одноатомными и не образуют молекул в нормальных условиях. В возбужденном состоянии атомы инертных газов образуют короткоживущие двухатомные молекулы, называемые эксимерами. На этом принципе работают эксимерные лазеры и эксилампы. Ну, а металлы всё-таки образуют молекулы. Так, например, молекула лития (Li2) имеет длину 2,67Å и характеризуется энергией диссоциации 26 ккал/моль.—Golart 17:47, 29 октября 2012 (UTC)
- Просто в химии и в физике понятие разное. Например, когда физик изучает свойства инертного газа, ему неважно, что он состоит из «атомов», для него эти частицы — такие же «молекулы», как у кислорода и т.п. —аимаина хикари 18:43, 29 октября 2012 (UTC)
- Не обязательно инертный газ; например, пары ртути состоят из одноатомных молекул. Сейчас у химиков принято определение ИЮПАК, согласно которому молекула нейтральна и состоит из двух и более атомов. Более раннее «химическое» определение: наименьшая частица, сохраняющая химические свойства вещества. Одноатомные молекулы сюда подпадают. У физиков количество атомов в молекуле неважно, в рамках этого определения ксенон, ртуть и т.п. состоят из молекул. —V1adis1av 10:08, 30 октября 2012 (UTC)
- Некоторые вещества состоят из одной макро-молекулы, поэтому «наименьшая частица, сохраняющая химические свойства вещества» звучит неправильно. Думаю химические свойства вообще нужно убрать из определения, и оставить количественные «2 и более». Alexander Mayorov 11:17, 30 октября 2012 (UTC)
- Alexander Mayorov предлагает оставить в определении только количественные свойства «2 и более». Радикальное предложение.
Но что делать в этом случае с «одноатомными молекулами»? Этот термин широко используется в Гугле и Яндексе. —Golart 16:06, 31 октября 2012 (UTC)
Спор ни о чем — Молекула не состоит из атомов[править код]
- Из квантовой механики известно: Молекула не состоит из атомов! Все химические вещества состоят из атомных ядер и электронов. «С современной точки зрения ясно, что при образовании молекулы сохраняются не атомы, а только ядра атомов и электроны». Смотри Татевский В.М. Квантовая механика и теория строения молекул. МГУ, 1965. стр.17.
- Понятия атома в молекуле из квантовой механики не вытекает, но попыток дать такое определение было много. Наиболее последовательное — Бейдер Р. Атомы в молекулах. Квантовая теория. М.: Мир, 2001. При этих подходах пытаются выделить области электронной плотности около атомных ядер и назвать их атомами, что не имеет никакого отношения к стандартному понятию атома.
Baz.77.243.99.32
- Опишите в статье квантовомех. толкование и определение Бейдера. Конечно, всё прочее это упрощения, но они тоже используются и даже не только в школе значительно чаще, чем квантовомеханическое. —аимаина хикари 13:17, 1 ноября 2012 (UTC)
- «Современную точку зрения» Татевский В.М. формулировал по мотивам своего выступления на печально известном Совещании 1951 года, участники которого громили теорию Лайнуса Полинга, будущего дважды лауреата Нобелевской премии (Совещание по теории химического строения в органической химии. Успехи физических наук, 1951, т. XLV, вып. 2, стр. 291).
В настоящее время считается, что деформационная поляризация затрагивает только внешнюю электронную оболочку атома. Определена электронная поляризуемость практически всех элементов таблицы Менделеева (Потапов А.А. Деформационная поляризация: Поиск оптимальных моделей. — Новосибирск: Наука, 2004. — 511 с.). Атомное ядро и внутренние электронные оболочки составляют устойчивый атомный остов в молекуле, размер которого соответствует ионному радиусу по Полингу. Это положение входит составной частью в теорию отталкивания электронных пар Гиллеспи-Найхолма [1]. —Golart 17:33, 4 ноября 2012 (UTC)
- Уважаемый Golart: Все указанные модели хороши в качестве несложных запоминающихся образов для варки веществ. Из квантовой механики — все электроны в молекуле являются общими, и можно лишь использовать для описания редуцированные (одночастичные, двухчастичные, s-частичные) матрицы плотности (статистические операторы), одночастичные электронные плотности (см Местечкин М.М. Метод матрицы плотности в теории молекул. Киев: Наукова думка, 1977). Разделение на внешние и внутренние электроны — от лукавого. Последовательное описание может быть построено лишь с использованием РМП и обобщений методов самосогласованного поля (см Местечкин Параграфы 11 и 12). Все другие модели носят феноменологический характер и не имеют обоснования на фундаменте квантовой механики. Возможно, они важны для практических целей (варки веществ), но это не имеет отношения к квантовой механике молекул. Кроме того, «атомный остов в молекуле» — еще более некорректное понятие, чем атом в молекуле (с точки зрения квантовой теории). Атомного остова не существует. Baz.77.243.99.32
- Квантовая механика позволяет решить аналитически точно уравнение Шрёдингера для систем, содержащих только один электрон — атом водорода, ион гелия, молекулярный ион водорода. Поскольку точное решение уравнения Шрёдингера для атомно-молекулярных систем, содержащих более одного электрона, невозможно, возникли различные приближённые теории, взаимно исключающие друг друга.
Апологеты какой-либо приближённой теории чтут свою и хулят другие теории. Консенсус невозможен. Но мы удалились от темы — «Одноатомная молекула». —Golart 16:56, 6 ноября 2012 (UTC)
- Атом и молекула, действительно являются составными частицами, состоящими из элементарных частиц и входят в избранный список Проекта:Физика. [2] Атомно-молекулярное учение утверждает, что при взаимодействии атомов образуется молекула. Может ли образоваться «одноатомная молекула» из одного атома?
PS. Уважаемый Baz.77.243.99.32. Поведение атомов в молекуле интересно, творческое наследие Rihard F.W.Bader по поведению атомов в молекуле важно, но статьи Бейдер,Ричард и Бадер,Ричард целесообразно объединить. —Golart 19:05, 1 ноября 2012 (UTC)
- Словосочетание «одноатомная молекула» представляет собой софизм (словесное ухищрение, вводимое в заблуждение).
Частица, содержащая один атом — это атом, а не молекула. Нельзя пользоваться формально кажущимся правильным, но ложным по существу умозаключением, основанным на преднамеренно неправильном подборе исходных положений. Необходимо делать различие между атомом и молекулой. Википедия — это энциклопедия, а не сборник софизмов. —Golart 16:05, 5 ноября 2012 (UTC)
- Невзирая на обсуждение, участник Burzuchius ввёл в преамбулу фразу — «В физике к молекулам причисляют также одноатомные молекулы, то есть свободные (химически не связанные) атомы (например, инертных газов)». Но где аргументы, позволяющие физикам причислять свободные атомы к молекулам? Зачем физикам нужно смешивать понятия «атом» и «молекула»? —Golart 17:24, 8 ноября 2012 (UTC)
- Физики не смешивают, у них просто другое понятие молекулы. А Википедия не вправе решать кто здесь более прав, а только должна описывать оба понятия. —аимаина хикари 18:51, 8 ноября 2012 (UTC)
- Первоначально преамбула содержала определение молекулы в рамках ИЮПАК. Участник Burzuchius дополнил преамбулу, отметив, что в физике к молекулам причисляют и свободные атомы, без ссылки на АИ. Расширение понятия молекулы и причисление к молекулам и атомов является оригинальным исследованием и подлежит удалению. —Golart 17:18, 9 ноября 2012 (UTC)
- Вот куча ссылок на употребление в АИ понятия «одноатомная молекула» / «monoatomic molecule» / «single-atom molecule». —V1adis1av 22:30, 13 ноября 2012 (UTC)
- Так всё-таки какое конкретное понятие молекулы имеется у физиков? Нужно выполнить предложение Аимаина хикари и дать физическое толкование термина молекула, а также обосновать, почему молекула может быть атомом. —Golart 17:27, 16 ноября 2012 (UTC)
- На физиков грешат напрасно. Физики солидарны с химиками и считают, что «молекула состоит из двух и более атомов». См. Список частиц. Убираю утверждение участника Burzuchius как орисс. —Golart 16:43, 21 ноября 2012 (UTC)
- Википедия не является АИ, так что ссылка на статью Список частиц не подтверждает Ваше мнение. Я дал выше ссылку на употребление в АИ понятия «одноатомная молекула» / «monoatomic molecule» / «single-atom molecule». Отменяю Вашу правку, поскольку Википедия должна отражать все имеющиеся и широко распространённые толкования терминов. —V1adis1av 18:52, 29 ноября 2012 (UTC)
- Уважаемый V1adis1av, Вы в своей ссылке приводите лишь перечень по употреблению понятия «одноатомная молекула», но, к сожалению, не даёте нужного Википедии толкования этого термина. —Golart 16:06, 3 декабря 2012 (UTC)
- Кроме того, Ваша куча ссылок не является АИ, нужен конкретный источник (См.Википедия:Форум/Вопросы) —Golart 18:40, 4 декабря 2012 (UTC)
Ни одной фотографии в статье, серьёзно? В английской Вики их несколько, и даже в литературе 15-летней давности были приведены фотографии молекул, которых увидели через сканирующий микроскоп. Надо бы добавить. 91.224.77.194 09:42, 27 сентября 2019 (UTC)
Что такое молекула?
В первый раз слово «молекула» большинство из нас услышали в школе на уроках природоведения. Это одно из основополагающих понятий современной химии, которое сделало возможным дальнейшее познание окружающей среды.
Что же такое молекула, из чего она состоит и зачем вообще нужно изучать молекулы?
Откуда взялось слово «молекула»?
Из чего состоит молекула?
Чему равна масса молекулы?
Откуда взялось слово «молекула»?
Как и большинство химических терминов, слово «молекула» имеет в основе латынь. Оно образовано из двух слов: «мoles», имеющего значение массы, тяжести и «-cule» — уменьшительного суффикса. Дословное значение – маленькая масса.
В современной химии молекула – мельчайшая частица какого-либо вещества. Даже одна молекула любого вещества обладает всеми свойствами, которые характерны для этого вещества.
Если молекулу разделить на составные части, вещество, которое она составляла, уничтожится, распавшись на более простые элементы – атомы. На этой основе сформирован весь свод понятий, образующих современную химическую науку и практику.
Из чего состоит молекула?
Как здание состоит из кирпичиков, а любой механизм, сделанный человеком – из деталей, так и молекула состоит из простых «кирпичиков» — атомов химических элементов.
Некоторые молекулы состоят всего из одного атома – например, молекулы металлов. Но подавляющее большинство веществ, которые нас окружают, имеют гораздо более сложное молекулярное строение.
Строение любой молекулы можно записать в виде химической формулы, которая указывает, из атомов каких химических элементов состоит вещество и сколько атомов каждого вещества содержится в одной молекуле. Молекула кислорода состоит из двух одинаковых атомов элемента кислорода.
Всем известна формула воды: h3O, которая означает, что каждая молекула воды содержит один атом кислорода и два атома водорода. Еще одна известная буквально всем формула – С2Н5ОН, формула этилового спирта, которая показывает, что это вещество состоит из двух атомов углерода (С), шести атомов водорода (Н) и одного атома кислорода (О).
В процессе взаимодействия друг с другом вещества обмениваются химическими элементами, вступая в реакции. При этом образуются новые вещества, обладающие новыми свойствами, отличными от свойств исходных веществ.
Так, уголь (практически полностью состоящий из углерода), сгорая (взаимодействуя с кислородом, содержащимся в воздухе), образует углекислый газ – вещество, непригодное для дыхания, в отличие от кислорода.
Молекулы в обычном состоянии не несут электрического заряда и называются нейтральными. Те молекулы, которые получают положительный или отрицательный заряд, называются ионами, а процесс – ионизацией. Молекулы, атомы которых имеют неспаренные электроны, называются радикалами.
Чему равна масса молекулы?
Конечно, таких чувствительных весов, которые позволяли бы взвесить одну молекулу вещества, не существует в арсенале современной науки. Масса молекул и атомов вычисляется другими способами. Принято считать, что масса молекулы любого вещества равна сумме масс всех атомов, из которых состоит это вещество.
Но как узнать, сколько весит атом? Это можно узнать из Периодической таблицы элементов Менделеева, где указана масса каждого элемента. Правда, указана не в привычных нам килограммах, а в специальных единицах атомной массы.
Одна атомная единица массы (а.е.м.) равна 1/12 массы атома углерода, что в численном выражении равно 1,660*10-27 кг.
Т.е. чтобы подсчитать, сколько весит молекула вещества, нужно взять его формулу, сложить атомные массы всех входящих в нее элементов и умножить на вес атомной единицы массы.
Физика элементарных частиц вашего тела
Экология жизни.14 млрд лет назад, когда горячая и плотная точка, которой была наша Вселенная, быстро расширялась, вся материя и антиматерия, существовавшие в те времена, должны были уничтожиться и не оставить нам ничего, кроме энергии. Однако часть материи сохранилась.
14 млрд лет назад, когда горячая и плотная точка, которой была наша Вселенная, быстро расширялась, вся материя и антиматерия, существовавшие в те времена, должны были уничтожиться и не оставить нам ничего, кроме энергии. Однако часть материи сохранилась.
Сейчас мы живем в мире, полном частиц. Не любых частиц, а тех, чьи массы и заряды необходимы для существования жизни человека. Сейчас мы приведем несколько фактов о физике элементарных частиц, которые заставят ваши электроны попрыгать.

Частицы, из которых мы состоим
Примерно 99% вашего тела состоит из атомов водорода, углерода, азота и кислорода. Также в вас содержатся и другие необходимые для жизни элементы, но в гораздо меньших пропорциях.
В то время как большинство клеток вашего тела обновляются каждые 7-15 лет, многие частицы, из которых состоят ваши клетки, существуют уже миллионы тысячелетий. Ваши атомы водорода образовались еще во время Большого Взрыва, а атомы углерода, азота и кислорода возникли во время рождения звезд. Самые тяжелые элементы, содержащиеся в вашем теле, появились во время вспышек сверхновой.
Размер атома зависит от того, как расположены его электроны. Ядро, находящееся внутри атома, приблизительно в 100 000 раз меньше самого элемента. Если бы ядро было размером с арахис, атом был бы по размеру с баскетбольную площадку. Если из атома убрать свободное пространство, мы бы могли уместиться в частице свинцовой пыли, а вся человеческая раса могла бы уместиться в одном сахарном кубике.
Как вы можете догадаться, эти внешние частицы составляют лишь малейшую часть вашей массы тела. Каждый протон и нейтрон внутри ядра атома состоит из трех кварков. Масса кварков, которая появляется из-за их взаимодействия с полем Хиггса, составляет лишь несколько процентов от массы протона или нейтрона. Переносчики сильного ядерного взаимодействия, удерживающего кварки вместе, глюоны и вовсе невесомы.
Но если масса вашего тела – это не масса этих частиц, то откуда она берется? Ответ: энергия. Почти вся масса человеческого тела состоит из кинетической энергии кварков и энергии связи глюонов.
Частицы, которые мы производим
Ваше тело — это маленькое месторождение радиоактивных элементов. Каждый год вы получаете дозу природной радиации величиной в 40 миллибэр, которая образуется внутри вас. Такое же количество радиации вы получаете во время четырех рентгенографий грудной клетки. Уровень радиации вашего тела может увеличиваться на 1-2 миллибэр каждые 8 часов, если вы спите рядом с вашим таким же радиоактивным любимым человеком.
Вы излучаете радиацию, потому что еда и напитки, которые вы потребляете, и даже воздух, которым вы дышите, содержат радионуклиды – такие как калий-40 и углерод-14. Они взаимодействуют с молекулами вашего тела, распадаются и продуцируют радиацию в вашем теле.
Когда Калий-40 распадается, он излучает позитрон – античастицу электрона. Таким образом, ваше тело содержит небольшое количество антиматерии. В среднем, каждый человек излучает более 4000 позитронов в день – примерно 180 позитронов в час. Но вскоре эти позитроны сталкиваются с вашими электронами и превращаются в радиацию в форме гамма-лучей.
Частицы, с которыми мы сталкиваемся
Радиоактивность вашего тела – лишь часть той радиации, с которой вы сталкиваетесь каждый день, не получая вреда. Среднестатистический американец получает дозу радиации, равную 620 миллибэр в год. Еда, которую вы потребляете, дом, в котором вы живете, камни и почва, по которым вы ходите, снабжают вас низким уровнем радиации. Если вы просто съедите бразильский орех или сходите к дантисту, то получите уровень радиации в несколько миллибэр. Курение может повысить уровень радиации на 16 000 миллибэр.
Космическое излучение – это излучение, имеющее внеземной источник, которое постоянно проникает в нашу атмосферу. В нашей атмосфере оно сталкивается с другими ядрами и производит мезоны, многие из которых распадаются на частицы – такие как мюоны и нейтрино. Эти частицы, в свою очередь, падают на поверхность Земли и проникают в ваши тела со скоростью примерно 10 атомов в секунду. Они добавляют примерно 27 миллибэр к вашей годовой дозе радиации. Эти космические частицы могут иногда нарушать вашу генетику и провоцировать возникновение небольших мутаций, тем самым делая свой вклад в эволюцию.
Кроме того, что постоянно бомбардирует вас фотонами, создавая внешний облик окружающего вас мира, Солнце атакует вас и частицами, называемыми нейтрино. Нейтрино – постоянные гости вашего тела, проникающие в вас в количестве 100 триллионов в секунду. Солнце – не единственный источник нейтрино; эти частицы приходят также и из других источников – например, из ядерных реакций на других звездах и даже из ядерных реакций на нашей собственной планете.
Многие нейтрино образовались еще в первые несколько секунд после Большого Взрыва. И они старше даже ваших собственных атомов. Нейтрино очень слабо взаимодействуют с другими частицами, и поэтому их визиты вашему телу не несут практически никаких последствий.
Скорее всего, ваше тело постоянно взаимодействует с частицами темной материи. Темная материя не излучает, не отражает и не поглощает свет – и поэтому ее очень сложно обнаружить. Однако ученые считают, что темная материя составляет примерно 80% всего вещества во Вселенной.
Учитывая такое большое количество темной материи, содержащейся во Вселенной, ученые посчитали, что сотни тысяч этих частиц взаимодействуют с вашим телом каждую секунду. Они сталкиваются с вашими атомами каждую минуту. Но темная материя не сильно взаимодействует с материей, из которой вы состоите, и поэтому эффекты этого взаимодействия, скорее всего, незаметны.
В следующий раз, когда вы заинтересуетесь, как физика элементарных частиц влияет на вашу жизнь, просто загляните внутрь собственного тела. опубликовано econet.ru
Строение вещества. Молекулы
Строение вещества
Познать сущее нельзя извне, можно только изнутри
Николай Бердяев
Данная тема посвящена строению вещества. Еще в древности люди высказывали предположения о том, что все вещества состоят из очень маленьких частичек. Однако лишь в восемнадцатом веке эти предположения сложились в более или менее стройную теорию. Представления о строении вещества помогли людям не только понять и объяснить те или иные физические явления, но и влиять на происхождение явлений, предсказывать поведение различных веществ при изменении внешних условий. Более того, люди научились сами получать вещества с заданными свойствами.
Некоторые явления можно легко предсказать, опираясь на свой повседневный опыт. Например, если сжать руками воздушный шарик, то он изменит свой объем и форму.

Если развязать шарик, то из него выйдет воздух. Если капнуть каплю краски в воду, то вода окрасится. Если нагреть лед, то он растает и превратится в воду.

Рассмотрим несколько целенаправленных опытов, которые дадут некоторые сведения о строении вещества. Возьмем самый обычный листочек с дерева. Можно ли его разделить? Конечно, легко можно его разорвать. Полученные кусочки можно разорвать ещё и ещё. Если растереть маленький кусочек листика пальцами, то можно увидеть, мелкие частички, оставшиеся у вас на пальцах. Можно провести аналогичный опыт с водой. Если взять бутылку, в которой находится некоторое количество воды.

Легко можно перелить часть воды в другую ёмкость, а из этой ёмкости – в еще одну, и так далее. Подобные опыты говорят нам, что самые различные вещества состоят из частиц.
Сжимая шарик, можно добиться уменьшения его объёма. При этом следует заметить, что количество частиц воздуха внутри шарика не изменилось. Следовательно, уменьшилось расстояние между частицами.

Аналогично, можно растянуть резиновый шнурок, тем самым увеличив его объём. Опять же, количество частиц от этого не меняется. Следовательно, увеличивается расстояние между частицами. Таким образом, вещество состоит из частиц, и между этими частицами есть определенные промежутки. Но только ли механическими усилиями можно уменьшить или увеличить эти промежутки? Оказывается, что нет. Можно провести следующий опыт: проденем шарик, подвешенный на цепочке через кольцо.

Нагреем этот шарик и попытаемся вытащить его обратно. После нагревания шарик в кольцо не пролезает. Это говорит о том, что при нагревании тела расширяются, то есть, увеличивается их объём. Если подождать, пока шарик остынет, то он снова сможет пройти через кольцо. Значит, при охлаждении, объем тела уменьшается. То же самое будет происходить и с жидкостью. Наполним сосуд водой до краев и закупорим его пробкой. В пробку проденем маленькую стеклянную трубку. При нагревании вода частично заполнит трубку, а, значит, объём воды тоже увеличивается при нагревании. Это хорошо подтверждается и другим бытовым опытом: если в сосуд с горячей водой опустить термометр, то столбик ртути поползет вверх. То есть, при нагревании ртути, промежутки между её частицами увеличиваются, что приводит к увеличению объёма.

Таким образом, когда частицы тела отдаляются друг от друга, объём тела увеличивается. И наоборот, когда частицы тела сближаются друг с другом, объём тела уменьшается. Может возникнуть вопрос: о каких частицах идет речь, если все тела являются сплошными и их можно перемещать целиком, не волнуясь о том, что эти частицы рассыплются?! Более детальное объяснения этих вопросов, будет раскрыто при дальнейшем изучении физики. Тем не менее, можно провести довольно простой опыт, подтверждающий, что вещество состоит из частиц. Возьмем три стакана с водой и окрасим воду в одном из них.

Перенесем часть окрашенной воды в другой стакан. Видно, что вода в этом стакане тоже окрасилась, но цвет менее насыщенный. Если затем перенести часть воды из второго стакана в третий, то вода в нем тоже окрасится, но совсем немного. Этот опыт подтверждает, что вещество состоит из частиц. Все меньшая насыщенность цвета в стаканах объясняется присутствием меньшего количества частиц краски. И это, конечно, лишь один из множества опытов, подтверждающих то, что вещества состоят из мельчайших частичек.
Такие частички были названы молекулами. Молекула в переводе с латинского языка означает «маленькая масса». Размеры молекул настолько малы, что человеческий глаз просто не в состоянии увидеть отдельные молекулы. Чтобы представить, насколько малы молекулы, приведем несколько примеров. Например, в яблоке содержится примерно столько же молекул, сколько яблок можно было бы уложить внутри нашей планеты – Земли. Ещё один пример: в одной капле воды содержится примерно столько же молекул, сколько капель содержится в Черном море. В очень малом объёме воздуха – в одном кубическом миллиметре содержится 27×1015, то есть миллионы миллиардов молекул. Конечно, столь малые частицы мы не в состоянии увидеть без специальных приборов. Один из таких приборов называется электронным микроскопом: с его помощью, мы можем увидеть молекулы и получить их изображения. Например, на рисунке представлен один из видов частичек крови – эритроциты, а также витамин C.

На сегодняшний день ученые изучили множество различных молекул и с уверенностью могут сказать, что молекулы разных веществ отличаются друг от друга, но молекулы одинаковых веществ абсолютно одинаковы. Таким образом, из молекул воды может состоять только вода и ничего больше. Однако, даже молекулы не являются наиболее мелкими частицами. Они состоят из атомов (атом в переводе с греческого означает «неделимый»). При дальнейшем изучении физики будет показано, что и атом имеет внутреннее строение. Молекулы принято изображать схематически: вот, например, схематическое изображение молекулы воды: она состоит из двух атомов водорода и одного атома кислорода.

Каждое вещество имеет своё обозначение. Например, водород обозначается латинской буквой H, а кислород – буквой О. Таким образом, молекула воды имеет химическую формулу H2O – эта формула показывает, что в молекуле два атома водорода и только один атом кислорода.
Если молекулы состоят из атомов, почему же, молекулы считаются наименьшими частицами данного вещества? Дело здесь вот в чем: молекулы образуют вещество таким, каким мы его видим, осязаем, ощущаем и так далее. Например, графит и алмаз являются совершенно разными веществами, поскольку их молекулы различны. Тем не менее, и молекулы графита, и молекулы алмаза, построены из атомов углерода.
Основные выводы:
– Все тела состоят из частиц.
– Между этими частицами есть промежутки.
– Размеры этих частиц очень и очень малы.
– Наименьшие частицы данного вещества называются молекулами.
– Молекулы состоят из атомов.
– При нагревании тела расширяются, а при охлаждении – сжимаются.



 Структура атома
Структура атома