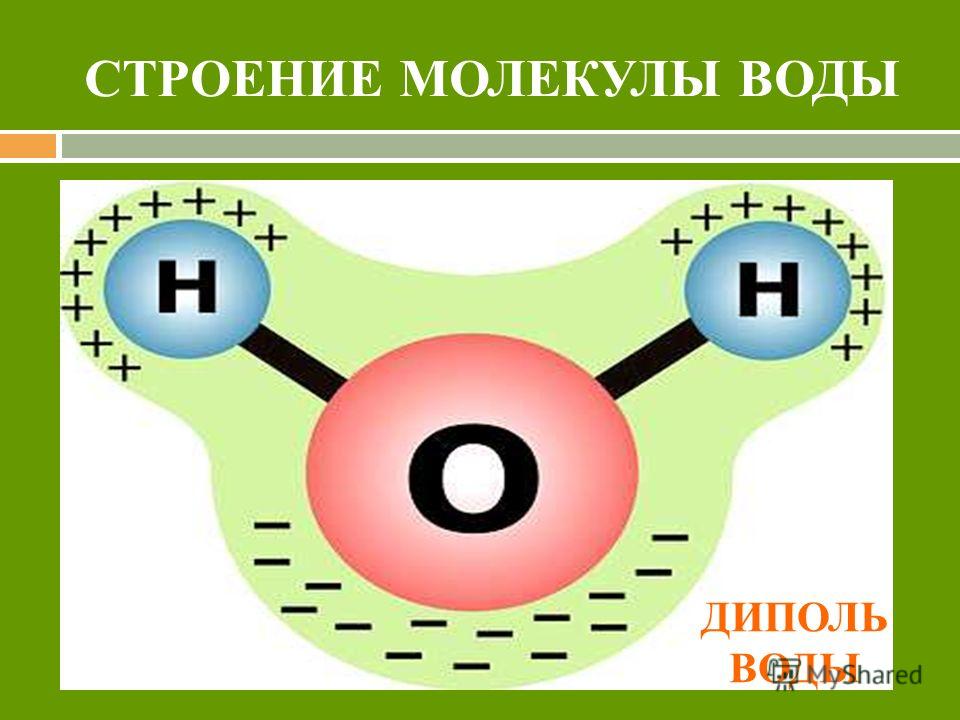
Диаметр молекулы воды в мм. Kvant
>>Физика: Основные положения молекулярно-кинетической теории. Размеры молекул
Молекулы очень малы, но посмотрите, как просто оценить их размеры и массу. Достаточно одного наблюдения и пары несложных расчетов. Правда, надо еще додуматься до того, как это сделать.
В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом . Каждое утверждение строго доказано с помощью опытов.
Свойства и поведение всех без исключения тел от инфузории до звезды определяются движением взаимодействующих друг с другом частиц: молекул, атомов или еще более малых образований — элементарных частиц.
Оценка размеров молекул. Для полной уверенности в существовании молекул надо определить их размеры.
Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды.
Объем V слоя масла равен произведению его площади поверхности S на толщину d слоя, т. е. V=Sd . Следовательно, размер молекулы оливкового масла равен:
Перечислять сейчас всевозможные способы доказательства существования атомов и молекул нет необходимости. Современные приборы позволяют видеть изображения отдельных атомов и молекул. На рисунке 8.2 показана микрофотография поверхности кремниевой пластины, где бугорки — это отдельные атомы кремния. Подобные изображения впервые научились получать в 1981 г. с помощью не обычных оптических, а сложных туннельных микроскопов .
Размеры молекул, в том числе и оливкового масла, больше размеров атомов. Диаметр любого атома примерно равен 10 -8 см. Эти размеры так малы, что их трудно себе представить. В таких случаях прибегают к помощи сравнений.
Вот одно из них. Если пальцы сжать в кулак и увеличить его до размеров земного шара, то атом при том же увеличении станет размером с кулак.
Диаметр молекулы воды равен примерно 3 10 -8 см. Считая, что каждая молекула воды при плотной упаковке молекул занимает объем (3 10 -8 см) 3 , можно найти число молекул в капле, разделив объем капли (1 см 3) на объем, приходящийся на одну молекулу:
При каждом вдохе вы захватываете столько молекул, что если бы все они после выдоха равномерно распределились в атмосфере Земли, то каждый житель планеты при вдохе получил бы две-три молекулы, побывавшие в ваших легких.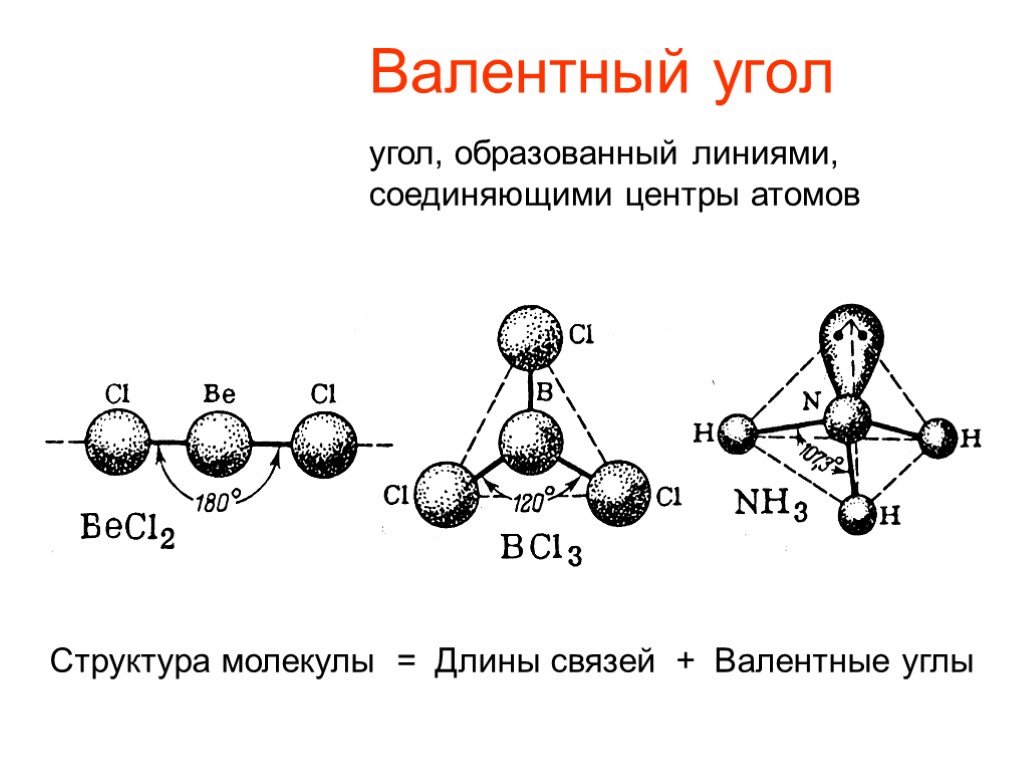
Размеры атома малы: .
О трех основных положениях молекулярно-кинетической теории речь будет идти неоднократно.
???
1. Какие измерения надо произвести, чтобы оценить размеры молекулы оливкового масла?
2. Если бы атом увеличился до размеров макового зернышка (0,1 мм), то размеров какого тела при том же увеличении достигло бы зернышко?
3. Перечислите известные вам доказательства существования мо¬лекул, не упомянутые в тексте.
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие
Совершенствование учебников и уроковисправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку,
МКТ — это просто!
«Ничто не существует, кроме атомов и пустого пространства …» — Демокрит
«Любое тело может делиться до бесконечности» — Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ — это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.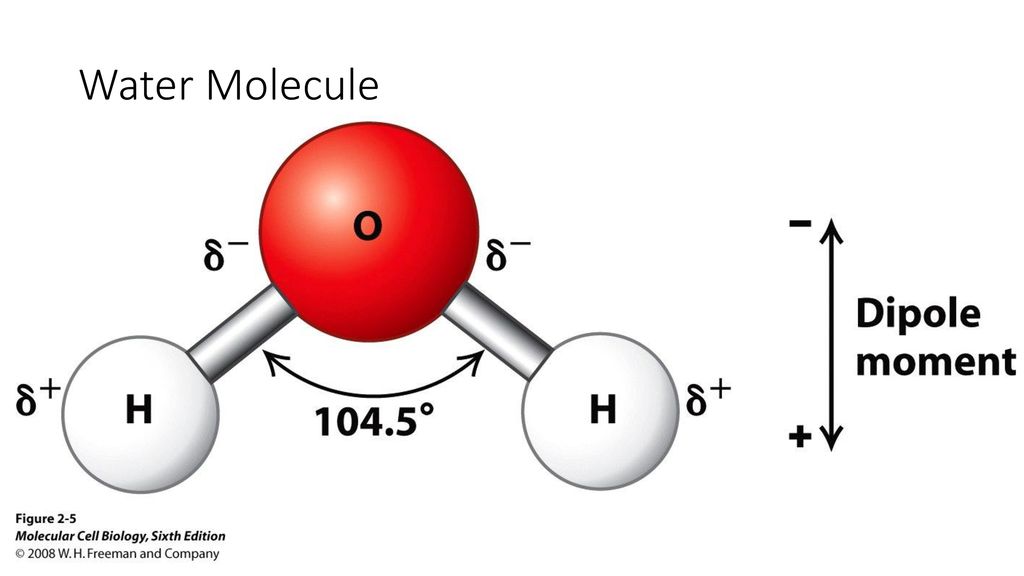
Макроскопические тела — это большие тела, состоящие из огромного числа молекул.
Тепловые явления — явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
— механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
Диффузия; броуновское движение частиц в жидкости под ударами молекул;
Плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
— фотографирование, определение размеров частиц.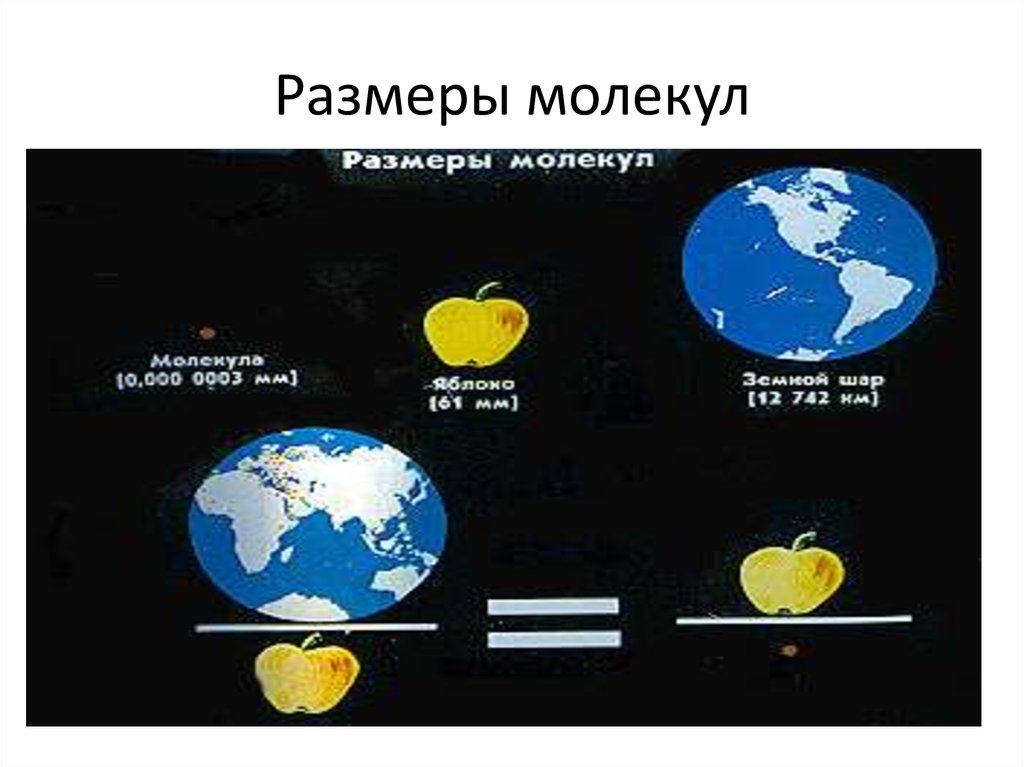
Броуновское движение
Броуновское движение — это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
— открыто английским ботаником Р. Броуном в 1827 г.
— дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
— экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около см.
Число молекул в веществе
где V — объем вещества, Vo — объем одной молекулы
Масса одной молекулы
где m — масса вещества,
N — число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина — относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель — это масса молекулы, а знаменатель — 1/12 массы атома углерода
Это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента
где числитель — это масса атома, а знаменатель — 1/12 массы атома углерода
Величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества (ν) определяет относительное число молекул в теле.
где N — число молекул в теле, а Na — постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль — это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.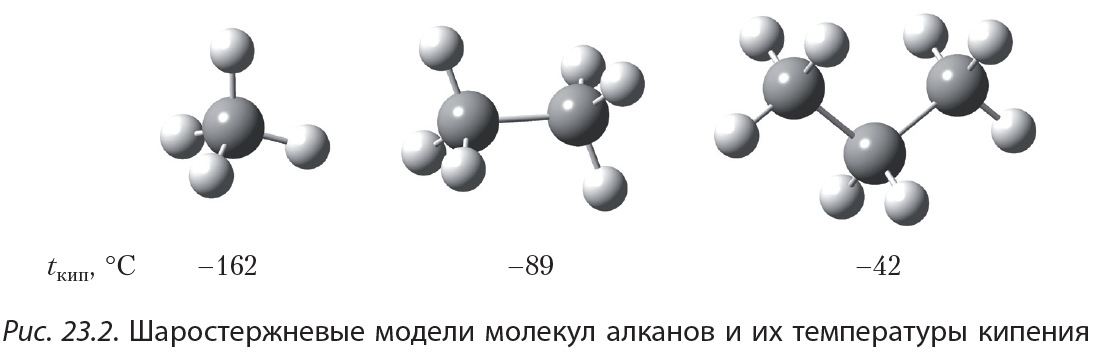
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) — это масса вещества, взятого в одном моле, или иначе — это масса одного моля вещества.
Масса молекулы
— постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10 -8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса ) вещества М r – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
М r = (m 0) : (m 0C / 12)
где m 0 – масса молекулы (или атома) данного вещества, m 0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С 12 . Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С 12 . Точные измерения показали, что атомная единица массы составляет 1,660*10 -27 кг, то есть
1 а.е.м. = 1,660 * 10 -27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д. И. Менделеева.
И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса , которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m 0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10 -27 = 40,3463 * 10 -27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н 2 О) будет равна:
Например, масса молекулы воды (Н 2 О) будет равна:
m 0Н2О = 2 * m 0H + m 0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10 -27 кг
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С 12 . То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества .
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / N A
где N – количество молекул в данном теле, N A – количество молекул в 1 моле вещества, из которого состоит тело.
N A – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
N A = 6,02 * 10 23 моль -1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m 0 * N A
где m 0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль -1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10 -3 * M r [кг*моль -1 ]
Масса любого количества вещества m равна произведению массы одной молекулы m 0 на количество молекул:
m = m 0 N = m 0 N A ν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m 0 = m / N = m / νN A = μ / N A
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10 -27 кг. Тогда молярная масса будет:
μ = m 0Mg * N A = 40,3463 * 10 -27 * 6,02 * 10 23 = 2,4288 * 10 -2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10 -2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Муниципальное общеобразовательное учреждение
«Основная общеобразовательная школа №10»
Определение диаметра молекул
Лабораторная работа
Исполнитель: Масаев Евгений
7 класс «А»
Руководитель: Резник А. В.
Гурьевский район
Введение
В этом учебном году я начал изучать физику. Я узнал, что тела, которые нас окружают, состоят из мельчайших частиц – молекул. Меня заинтересовало, каковы размеры молекул. Из-за очень малых размеров молекулы нельзя увидеть невооруженным глазом или с помощью обыкновенного микроскопа. Я прочитал, что молекулы можно увидеть только с помощью электронного микроскопа. Ученые доказали, что молекулы разных веществ отличаются друг от друга, а молекулы одного и того же вещества одинаковы. Мне захотелось на практике измерить диаметр молекулы. Но к сожалению, в школьной программе не предусматривает изучение проблем такого рода, а рассмотреть её одному оказалось нелёгкой задачей и пришлось изучать литературу о методах определения диаметра молекул.
Из-за очень малых размеров молекулы нельзя увидеть невооруженным глазом или с помощью обыкновенного микроскопа. Я прочитал, что молекулы можно увидеть только с помощью электронного микроскопа. Ученые доказали, что молекулы разных веществ отличаются друг от друга, а молекулы одного и того же вещества одинаковы. Мне захотелось на практике измерить диаметр молекулы. Но к сожалению, в школьной программе не предусматривает изучение проблем такого рода, а рассмотреть её одному оказалось нелёгкой задачей и пришлось изучать литературу о методах определения диаметра молекул.
Глава I . Молекулы
1.1 Из теории вопроса
Молекула в современном понимании – это наименьшая частица вещества, обладающая всеми его химическими свойствами. Молекула способна к самостоятельному существованию. Она может состоять как из одинаковых атомов, например кислород О 2 , озон О 3 , азот N 2 , фосфор P 4 , сера S 6 и т. д., так и из различных атомов: сюда относятся молекулы всех сложных веществ. Простейшие молекулы состоят из одного атома: это молекулы инертных газов – гелия, неона, аргона, криптона, ксенона, радона. В так называемых высокомолекулярных соединениях и полимерах каждая молекула может состоять из сотен тысяч атомов.
Простейшие молекулы состоят из одного атома: это молекулы инертных газов – гелия, неона, аргона, криптона, ксенона, радона. В так называемых высокомолекулярных соединениях и полимерах каждая молекула может состоять из сотен тысяч атомов.
Экспериментальное доказательство существования молекул первым наиболее убедительно дал французский физик Ж. Перрен в 1906 г. при изучении броуновского движения. Оно, как показал Перрен, является результатом теплового движения молекул – и ничем иным.
Сущность молекулы можно описать и с другой точки зрения: молекула – устойчивая система, состоящая из ядер атомов (одинаковых или различных) и окружающих электронов, причем химические свойства молекулы определяются электронами внешних оболочек в атомах. Атомы объединяются в молекулы в большинстве случаев химическими связями. Обычно такая связь создается одной, двумя или тремя парами электронов, которыми владеют сообща два атома.
Атомы в молекулах соединены друг с другом в определенной последовательности и определённым образом распределены в пространстве. Связи между атомами имеют различную прочность; она оценивается величиной энергии, которую необходимо затратить для разрыва межатомных связей.
Связи между атомами имеют различную прочность; она оценивается величиной энергии, которую необходимо затратить для разрыва межатомных связей.
Молекулы характеризуются определёнными размером и формой. Различными способами было определено, что в 1 см 3 любого газа при нормальных условиях содержится около 2,7×10 19 молекул.
Чтобы понять, насколько велико это число, можно представить, что молекула – это «кирпич». Тогда если взять количество кирпичей, равное числу молекул в 1 см 3 газа при нормальных условиях, и плотно уложить ими поверхность суши всего земного шара, то они покрыли бы поверхность слоем высотой 120 м, что почти в 4 раза превосходит высоту 10-этажного дома. Огромное число молекул в единице объёма указывает на очень малые размеры самих молекул. Например, масса молекулы воды m=29,9 x 10 -27 кг. Соответственно малы и размеры молекул. Диаметром молекулы принято считать минимальное расстояние, на которое им позволяет сблизиться силы отталкивания. Однако понятие размера молекулы является условным, так как на молекулярных расстояниях представления классической физики не всегда оправданы. Средний размер молекул порядка 10-10 м.
Средний размер молекул порядка 10-10 м.
Молекула как система, состоящая из взаимодействующих электронов и ядер, может находиться в различных состояниях и переходить из одного состояния в другое вынужденно (под влиянием внешних воздействий) или самопроизвольно. Для всех молекул данного вида характерна некоторая совокупность состояний, которая может служить для идентификации молекул. Как самостоятельное образование молекула обладает в каждом состоянии определенным набором физических свойств, эти свойства в той или иной степени сохраняются при переходе от молекул к состоящему из них веществу и определяют свойства этого вещества. При химических превращениях молекулы одного вещества обмениваются атомами с молекулами другого вещества, распадаются на молекулы с меньшим числом атомов, а также вступают в химические реакции других типов. Поэтому химия изучает вещества и их превращения в неразрывной связи со строением и состоянием молекул.
Обычно молекулой называют электрически нейтральную частицу. В веществе положительные ионы всегда сосуществуют вместе с отрицательными.
В веществе положительные ионы всегда сосуществуют вместе с отрицательными.
По числу входящих в молекулу атомных ядер различают молекулы двухатомные, трехатомные и т.д. Если число атомов в молекуле превосходит сотни и тысячи, молекула называется макромолекулой. Сумма масс всех атомов, входящих в состав молекулы, рассматривается как молекулярная масса. По величине молекулярной массы все вещества условно делят на низко- и высокомолекулярные.
1.2 Методы измерения диаметра молекул
В молекулярной физике главные «действующие лица» — это молекулы, невообразимо маленькие частицы, из которых состоят все на свете вещества. Ясно, что для изучения многих явлений важно знать, каковы они, молекулы. В частности, каковы их размеры.
Когда говорят о молекулах, их обычно считают маленькими упругими твердыми шариками. Следовательно, знать размер молекул, значит знать их радиус.
Несмотря на малость молекулярных размеров, физики сумели разработать множество способов их определения. В «Физике 7» рассказывается о двух из них. В одном используется свойство некоторых (очень немногих) жидкостей растекаться в виде пленки толщиной в одну молекулу. В другом размер частицы определяется с помощью сложного прибора — ионного проектора.
В «Физике 7» рассказывается о двух из них. В одном используется свойство некоторых (очень немногих) жидкостей растекаться в виде пленки толщиной в одну молекулу. В другом размер частицы определяется с помощью сложного прибора — ионного проектора.
Строение молекул изучают различными экспериментальными методами. Электронография, нейтронография и рентгеновский структурный анализ позволяют получать непосредственную информацию о структуре молекул. Электронографии, метод, исследующий рассеяние электронов на пучке молекул в газовой фазе, позволяет рассчитать параметры геометрической конфигурации для изолированных сравнительно простых молекул. Нейтронография и рентгеновский структурный анализ ограничены анализом структуры молекул либо отдельных упорядоченных фрагментов в конденсированной фазе. Рентгенографические исследования кроме указанных сведений дают возможность получить количественные данные о пространственном распределении электронной плотности в молекулах.
Спектроскопические методы основаны на индивидуальности спектров химических соединений, которая обусловлена характерным для каждой молекулы набором состояний и отвечающих им энергетических уровней. Эти методы позволяют проводить качественный и количественный спектральный анализ веществ.
Эти методы позволяют проводить качественный и количественный спектральный анализ веществ.
Спектры поглощения или испускания в микроволновой области спектра позволяют изучать переходы между вращательными состояниями, определять моменты инерции молекул, а на их основе — длины связей, валентные углы и другие геометрические параметры молекул. Инфракрасная спектроскопия исследует, как правило, переходы между колебательно-вращательными состояниями и широко используется для спектрально-аналитических целей, поскольку многие частоты колебаний определенных структурных фрагментов молекул являются характеристическими и слабо меняются при переходе от одной молекулы к другой. В то же время инфракрасная спектроскопия позволяет судить и о равновесной геометрической конфигурации. Спектры молекул в оптическом и ультрафиолетовом диапазонах частот связаны главным образом с переходами между электронными состояниями. Результатом их исследований являются данные об особенностях потенциальных поверхностей для различных состояний и значения молекулярных постоянных, определяющих эти потенциальные поверхности, также времена жизни молекул в возбужденных состояниях и вероятности переходов из одного состояния в другое.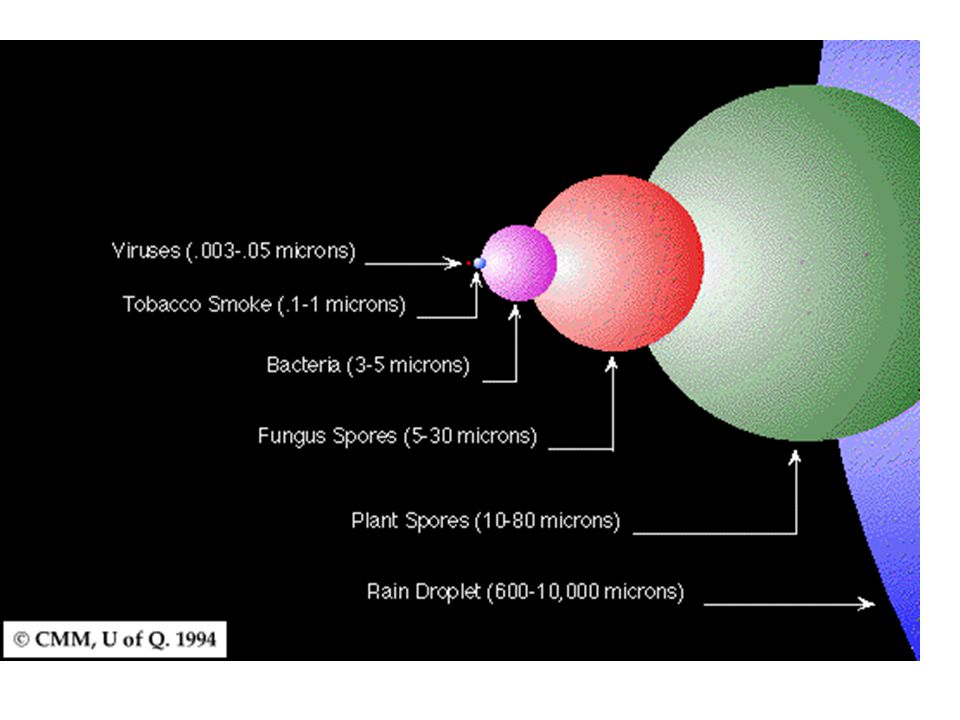
О деталях электронного строения молекул уникальную информацию дают фото- и рентгеноэлектронные спектры, а также оже-спектры, позволяющие оценить тип симметрии молекулярных орбиталей и особенности распределения электронной плотности. Широкие возможности для изучения отдельных состояний молекул открыла лазерная спектроскопия (в различных диапазонах частот), отличающаяся исключительно высокой селективностью возбуждения. Импульсная лазерная спектроскопия позволяет анализировать строение короткоживущих молекул и их превращения в электромагнитное поле.
Разнообразную информацию о строении и свойствах молекул дает изучение их поведения во внешних электрических и магнитных полях.
Существует, однако, очень простой, хотя и не самый точный, способ вычисления радиусов молекул (или атомов) Он основан на том, что молекулы вещества, когда оно находится в твердом или жидком состоянии, можно считать плотно прилегающими друг к другу. В таком случае для грубой оценки можно считать, что объем V некоторой массы m вещества просто равен сумме объемов содержащихся в нем молекул. Тогда объем одной молекулы мы получим, разделив объем V на число молекул N .
Тогда объем одной молекулы мы получим, разделив объем V на число молекул N .
Число молекул в теле массой m равно, как известно,
, где М — молярная масса вещества N A — число Авогадро. Отсюда объем V 0 одной молекулы определяется из равенства .
В это выражение входит отношение объема вещества к его массе. Обратное же отношение
Молекулы имеют размеры и разнообразные формы. Для наглядности будем изображать молекулу в виде шарика, воображая, что она охвачена сферической поверхностью, внутри которой находятся электронные оболочки ее атомов (рис. 4, а). По современным представлениям молекулы не имеют геометрически определенного диаметра. Поэтому за диаметр d молекулы условились принимать расстояние между центрами двух молекул (рис. 4, б), сблизившихся настолько, что силы притяжения между ними уравновешиваются силами отталкивания.
Из курса химии» известно, что килограмм-молекула (киломоль) любого вещества, независимо от его агрегатного состояния, содержит одинаковое количество молекул, называемое числом Авогадро, а именно N A = 6,02*10 26 молекул.
Теперь оценим диаметр молекулы, например воды. Для этого разделим объем киломоля воды на число Авогадро. Киломоль воды имеет массу 18 кг. Считая, что молекулы воды расположены плотно друг к другу и ее плотность 1000 кг / м 3 , можем сказать, что 1 кмоль воды занимает объем V = 0,018 м 3 . На долю одной молекулы воды приходится объем
Приняв молекулу за шарик и воспользовавшись формулой объема шара вычислим приблизительный диаметр, иначе линейный размер молекулы воды:
Диаметр молекулы меди 2,25*10 -10 м. Диаметры молекул газов того же порядка. Например, диаметр молекулы водорода 2,47*10 -10 м, углекислого газа — 3,32*10 -10 м. Значит, молекула имеет диаметр порядка 10 -10 м. На длине 1 см рядом могут расположиться 100 млн. молекул.
Произведем оценку массы молекулы, например сахара (C 12 H 22 О 11). Для этого надо массу киломоля сахара (μ = 342,31 кг / кмоль) разделить на число Авогадро, т. е. на число молекул в
е. на число молекул в
В «стеснённых условиях» молекула воды меняет свойства
Вода, попав в тесные каналы внутри бериллового кристалла, переходит в особое квантовое состояние с «размазанными» атомами водорода.
В кристаллической решетке берилла присутствуют небольшие пустоты с шестигранным поперечным сечением. У них очень маленький размер – примерно 0,5 нанометра (10-9 м) в ширину и 0,9 нанометра в длину. Молекула воды в таком небольшом пространстве может разместиться, однако взаимодействие с атомами кристаллической решетки не позволяет ей свободно поворачиваться. Поэтому вода располагается в центре канала, а её атомы водорода остаются повернутыми к одной из шести его граней. Чтобы изменить собственное положение, перейти из одного устойчивого состояния в другое, молекуле воды необходима энергия около 50 мегаэлектронвольт – иными словами, воде нужно преодолеть энергетический барьер.
Структура берилла (красные кружки – атомы кислорода, зеленые – бериллия, синие – кремния, голубые – алюминия).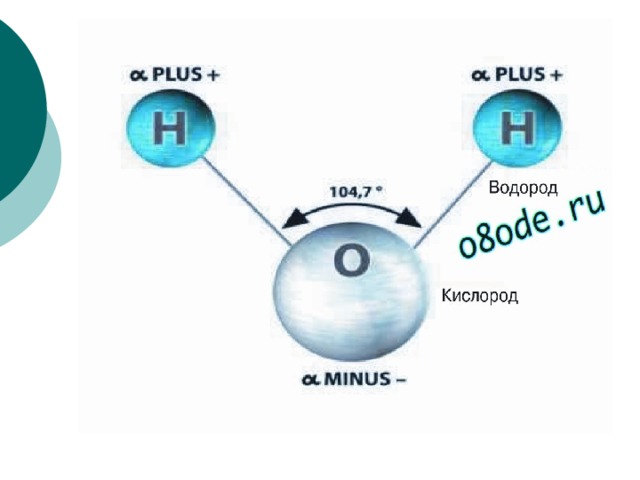 У молекул воды шестью розовыми кружками показаны все возможные положения атомов водорода. (A. I. Kolesnikov et al., Phys. Rev. Lett. (2016))
У молекул воды шестью розовыми кружками показаны все возможные положения атомов водорода. (A. I. Kolesnikov et al., Phys. Rev. Lett. (2016))
Рассчитанная плотность зарядов для протона. Желтым цветом показана самая высокая плотность, синим – самая низкая (A. I. Kolesnikov et al., Phys. Rev. Lett. (2016))
‹
›
Открыть в полном размере
Однако в микромире существует квантовое явление, названное туннельным эффектом – когда частица переходит в другое состояние, даже если ей не хватает энергии. Например, туннельный эффект имеет место при альфа-распаде радиоактивных атомов, когда альфа частица покидает ядро атома, преодолевая барьер, созданный ядерными силами. В случае с водой, заключённой в берилловом кристалле, такой эффект позволяет атомам в молекуле переходить из одного положения в другое, как бы поворачивая ее. Но это не классический поворот, поскольку молекула переходит из одного положения в другое скачком, минуя промежуточные состояния.
О том, что молекула воды может так вести себя в кристалле берилла, впервые несколько лет назад сообщили российские физики, анализировавшие спектры терагерцового излучения молекулы воды.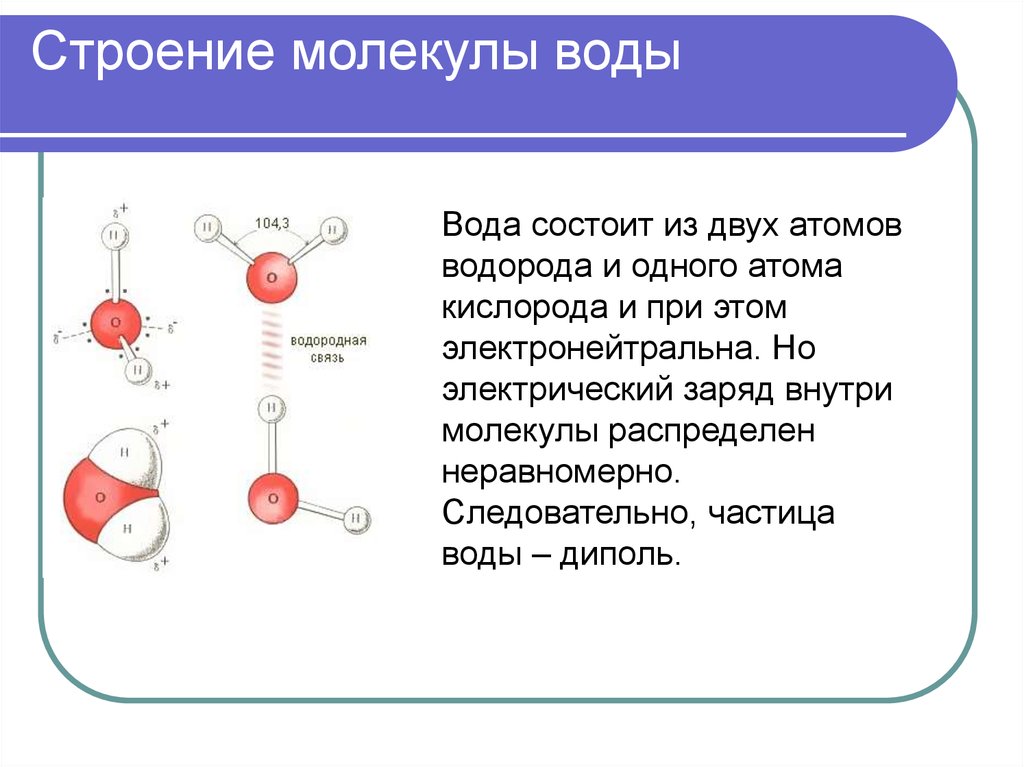 Ее прыжки между состояниями приводят к появлению в спектре нескольких энергетических уровней вместо одного. Но прямых экспериментальных доказательств такого поведения у исследователей тогда ещё не было.
Ее прыжки между состояниями приводят к появлению в спектре нескольких энергетических уровней вместо одного. Но прямых экспериментальных доказательств такого поведения у исследователей тогда ещё не было.
Американские физики из национальной лаборатории Oak Ridge (США) под руководством бывшего сотрудника Института твердого тела РАН Александра Колесникова исследовали рассеяние нейтронов при низких температурах (5-50 градусов Кельвина) на кристалле берилла, содержавшего воду.
Для интерпретации полученных результатов они провели компьютерное моделирование. Эксперимент показал, что молекула воды непрерывно туннелирует между всеми шестью возможными ориентациями. Атомы водорода при этом не находятся в определенном месте пространства – они «размазаны» вокруг центрального атома кислорода, находясь во всех шести состояниях одновременно. Их плотность заряда представляет собой волнистое кольцо. Об особом квантовом состоянии воды в кристаллической ловушке исследователи рассказали в статье, опубликованной в журнале в журнале Physical Review Letters.
Такое размытие, или «делокализация» атомов водорода изменяет свойства молекулы воды. В обычном состоянии она несимметрична, поскольку оба атома водорода расположены по одну сторону от атома кислорода. Из-за этого молекула воды поляризована – со стороны атомов водорода она имеет положительный заряд, а со стороны кислорода – отрицательный. Другими словами, она обладает дипольным моментом, который определяет электрические и термодинамические свойства воды, а также ее способности служить эффективным растворителем. В берилле дипольный момент у молекул воды исчезает из-за размазанности водорода.
Исследователи полагают, что подобное туннелирование имеет место и в других ситуациях, когда вода находится в сильно «стесненных» условиях. Так что результаты данной работы помогут лучше понять диффузию воды, ее транспорт в каналах клеточных мембран, углеродных нанотрубках и геологических средах.
(Для справки. Химическая формула минерала берилл Be3Al2Si6O18. Некоторые его разновидности являются драгоценными камнями, например изумруд и аквамарин. Окраска этих камней определяется примесями.)
Некоторые его разновидности являются драгоценными камнями, например изумруд и аквамарин. Окраска этих камней определяется примесями.)
По материалам Oak Ridge National Laboratory
Размер кластера молекул воды
Размер кластера молекул воды Aqui-Live – как он обеспечивает эффективное поглощение организмом человека
Вода в природе существует не в виде отдельной молекулы (h3O), форме молекулярных кластеров. Проще говоря, это означает, что атомы водорода связываются друг с другом, образуя небольшие группы молекул воды, называемые кластерами. Разные типы воды имеют кластеры молекул разного размера: водопроводная вода обычно имеет самые большие кластеры, в то время как природные минеральные воды часто имеют меньшие кластеры.
Ученые считают, что более мелкие кластеры воды могут проникать в ядро и ДНК клеток человека быстрее и намного лучше, чем более крупные кластеры, что улучшает функцию клеточного метаболизма и участвует в жизнедеятельности.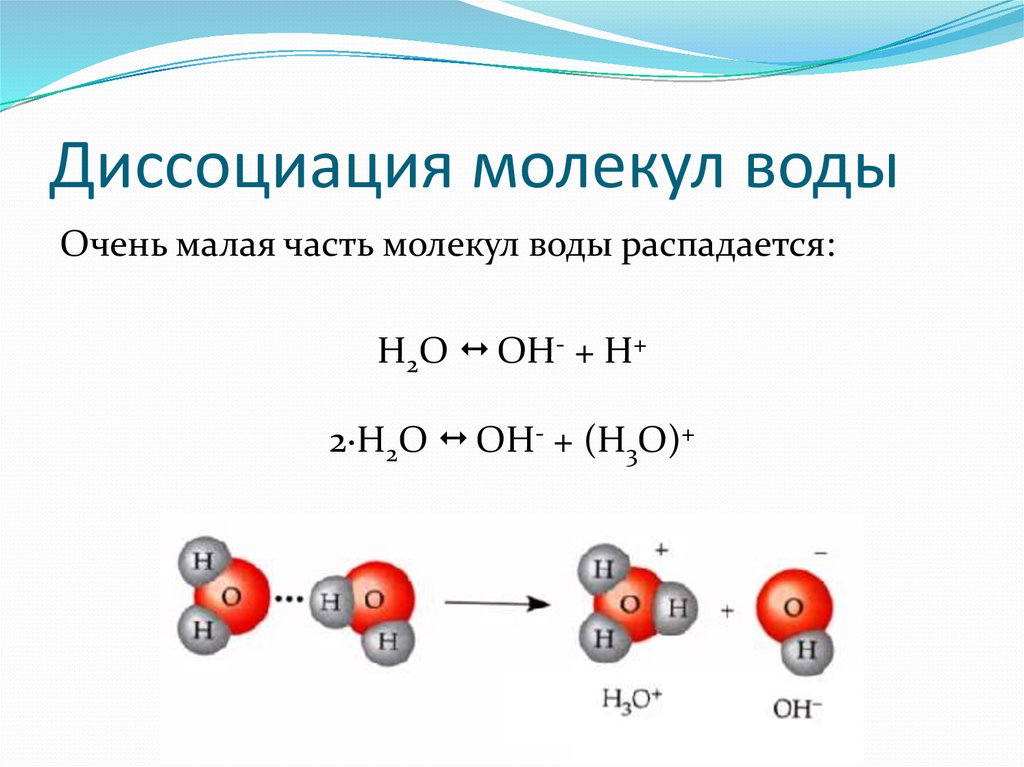 Попадая в организм человека, небольшие кластеры молекул воды постоянно активируют клетки человека и могут нести больше полезных питательных веществ, минералов и кислорода в организм человека и проникать в каждый уголок человеческого тела и клеток, чтобы сделать клетки человека более энергичными и энергичными.
Попадая в организм человека, небольшие кластеры молекул воды постоянно активируют клетки человека и могут нести больше полезных питательных веществ, минералов и кислорода в организм человека и проникать в каждый уголок человеческого тела и клеток, чтобы сделать клетки человека более энергичными и энергичными.
Размер кластера молекул воды измеряется с помощью аппарата ядерного магнитного резонанса (ЯМР) Oxygen 17. Это похоже на машину MMR. Результатом является график, который измеряет полуширину кластера молекул воды в герцах. Он измеряется в герцах посредством вибрации 9-го нейтрона изотопа кислорода 17.
Чем шире кривая графика, тем крупнее кластеры; чем уже кривая, тем меньше кластеры. В частности, кластеры воды, которые имеют кластеры ниже 70 Гц, называются гидратацией малых молекул. Кластеры воды с частотой от 50 до 55 герц считаются лучшей водой для поглощения человеком.
В прошлом году мы привлекли ученых из Университета Монаш в Мельбурне для проведения ЯМР-теста Oxygen17 для Aqui-Live.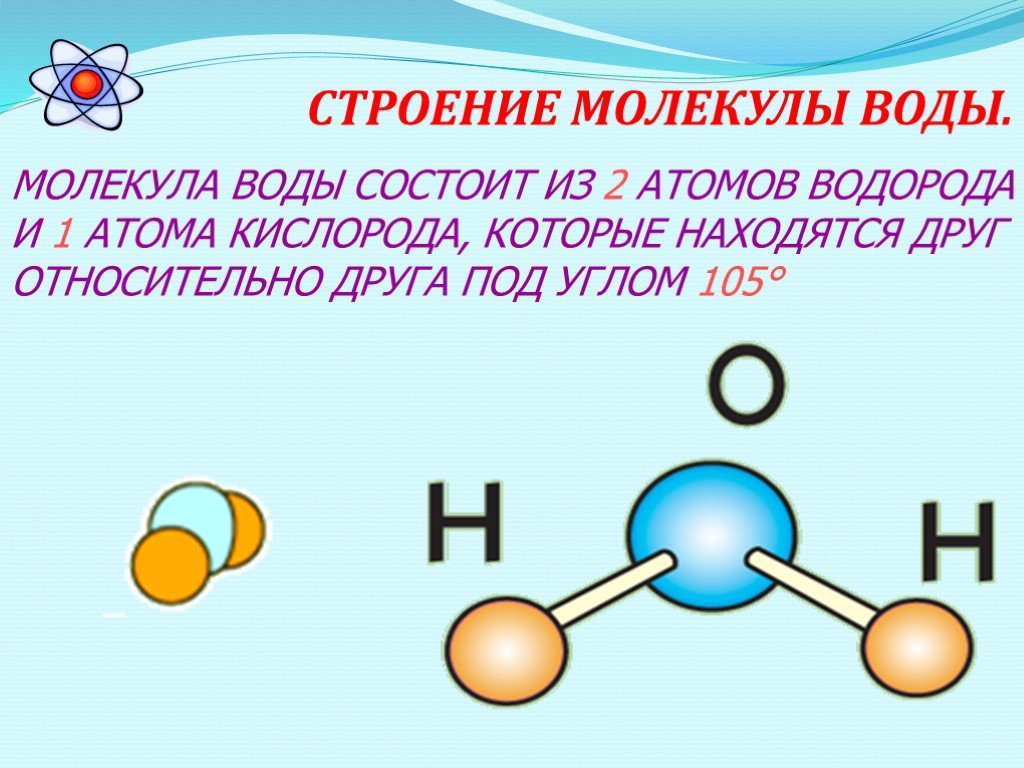 Ученые также протестировали воду из-под крана и дешевую родниковую воду из супермаркета. Aqui-Live выдал результат 54,4 герца. Для сравнения, водопроводная вода дала результат 108 герц, а родниковая вода 80 герц. График с техническими деталями показан в заголовке.
Ученые также протестировали воду из-под крана и дешевую родниковую воду из супермаркета. Aqui-Live выдал результат 54,4 герца. Для сравнения, водопроводная вода дала результат 108 герц, а родниковая вода 80 герц. График с техническими деталями показан в заголовке.
23 минерала Aqui-Live идеально дополняют кластер молекул воды идеального размера
Широко известно, что человеческий организм не может усваивать жизненно важные минералы, если они не растворены в воде (ионная форма). Вот почему люди лишь частично поглощают минералы из пищи — наша пищеварительная система должна сначала расщепить их и превратить в жидкости, теряя при этом минералы.
Кроме того, минералы не усваиваются клетками человека по отдельности, они зависят друг от друга. Например, магний не может проникнуть в клетки без присутствия бикарбоната . И магний не может проникать в митохондрии клеток и обеспечивать энергией АТФ (откуда клетки получают энергию) без присутствия селена . Aqui-Live содержит эти 3 минерала.
Aqui-Live содержит эти 3 минерала.
Когда все 23 минерала Aqui-Live присутствуют в кластере молекул почти идеального размера с частотой 54,4 Гц, это означает, что 23 из 24 жизненно важных минералов на 100% усваиваются каждой клеткой человеческого тела. Никакая другая известная вода не может этого сделать.
Сочетание идеального размера молекулярных кластеров Aqui-Live, 23 из 24 необходимых для жизни минералов и невероятной чистоты Aqui-Live означает, что Aqui-Live является самой чистой, самой богатой питательными веществами и самой дающей энергию водой.
Какую воду ты пьешь сегодня?
Молекула воды | Структура и свойства воды
Фильтр поиска панели навигации Oxford AcademicСтруктура и свойства водыФизика конденсированного состоянияКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicСтруктура и свойства водыФизика конденсированного состоянияКнигиЖурналы Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать Цитировать
Разрешения
- Делиться
- Твиттер
- Подробнее
Cite
Eisenberg, D. , and W. Kauzmann,
, and W. Kauzmann,
«Молекула воды»
,
The Structure and Properties of Water
, Oxford Classic Texts in the Physical Sciences
882005 г.,
онлайн-издание,
Oxford Academic
, 1 сентября 2007 г.
), https://doi.org/10.1093/acprof:oso/9780198570264.003.0001,
, по состоянию на 6 ноября 2022 г.
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации Oxford AcademicСтруктура и свойства водыФизика конденсированного состоянияКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicСтруктура и свойства водыФизика конденсированного состоянияКнигиЖурналы Термин поиска на микросайте
Advanced Search
Abstract
В этой главе представлено описание изолированной молекулы воды, основанное на эксперименте и теории. Описание, основанное на эксперименте, включает измерения водяного пара при достаточно низких давлениях или высоких температурах, чтобы убедиться, что взаимодействия между молекулами практически отсутствуют. Описание, основанное на теории, содержит такие детали, как форма облака электронного заряда воды и указание того, какие части заряда вносят наибольший вклад в общую полярность молекулы. Разделение этих взаимозависимых описаний искусственно, но оно служит для того, чтобы подчеркнуть, какая часть нашего понимания воды основана на наблюдениях, а какая — на достаточно точных моделях молекулы.
Описание, основанное на эксперименте, включает измерения водяного пара при достаточно низких давлениях или высоких температурах, чтобы убедиться, что взаимодействия между молекулами практически отсутствуют. Описание, основанное на теории, содержит такие детали, как форма облака электронного заряда воды и указание того, какие части заряда вносят наибольший вклад в общую полярность молекулы. Разделение этих взаимозависимых описаний искусственно, но оно служит для того, чтобы подчеркнуть, какая часть нашего понимания воды основана на наблюдениях, а какая — на достаточно точных моделях молекулы.
Ключевые слова: молекула воды, эксперимент, теория, модельное наблюдение, водяной пар, облако
Предмет
Физика конденсированного состояния
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок.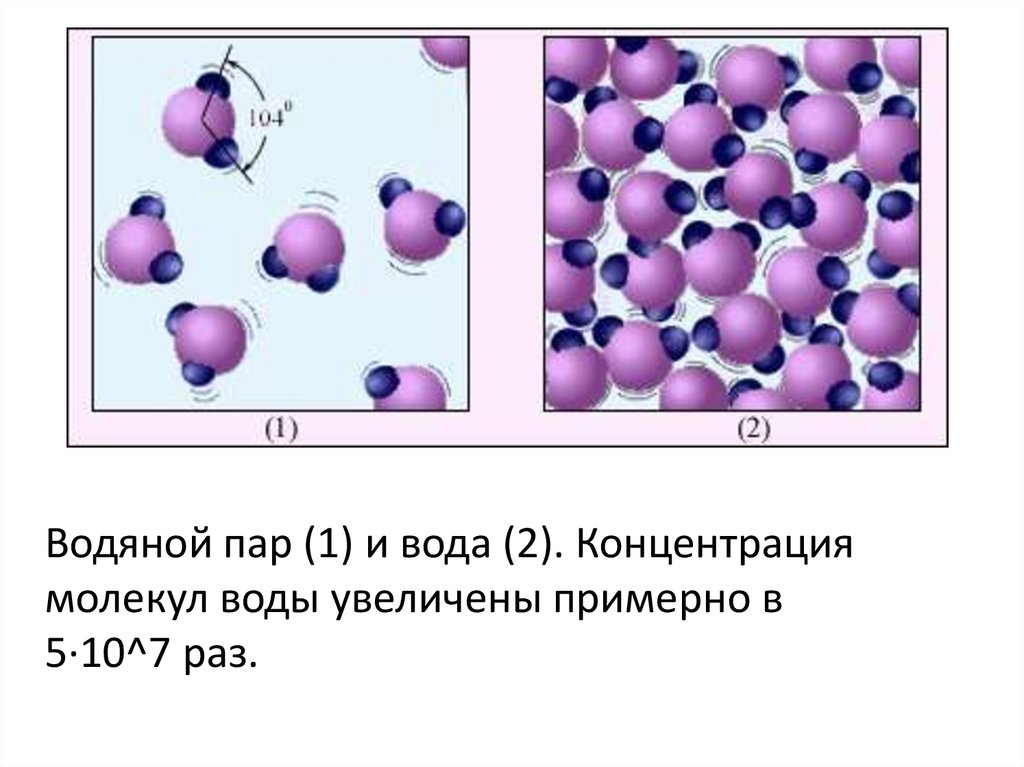 Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Нажмите Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи, в которой выполнен вход, и доступ к функциям управления учетной записью.



 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic.