Каталог радиолюбительских схем. ЭЛЕКТРОФОРЕЗ ДОМА
Каталог радиолюбительских схем. ЭЛЕКТРОФОРЕЗ ДОМАЗдравствуйте прошу помощи в изготовлениимед прибора для электрофореза-регулируемого стабилизатора тока.Радиолюбитель 6.1993 стр 26 А.Партин. В нете есть схема прибора,но плохо видны номиналы резисторов.Если можете или есть правильная схема или др аналогичные схемы-отправте мне пожалуйста.Мне нужно для лечения своей позвоночной грыжи,а ездить по больницам нет времени и больших денег.
Спасибо Сергей.
ЭЛЕКТРОФОРЕЗ ДОМА
А.ПАРТИН,
620085, г.Екатеринбург, ул.3енитчиков, 14а — 48
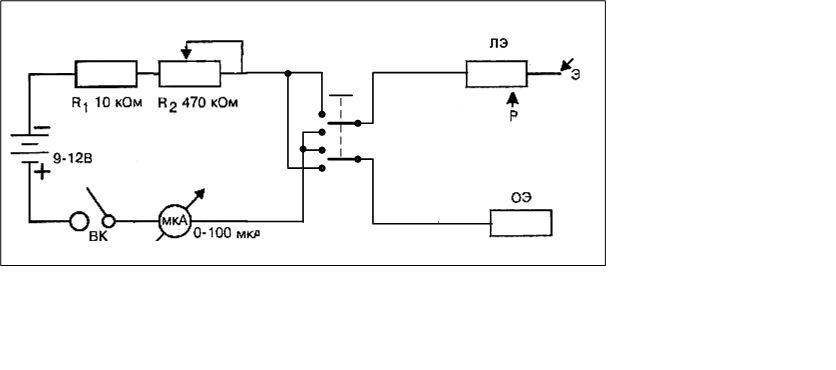
Предлагаемый электрофорез представляет собой регулируемый стабилизатор тока (рис.1).
Рис.1
Он содержит понижающий трансформатор Т1, двухполупе-риодный выпрямитель VD1 — VD4, конденсатор фильтра и стабилизатор тока на транзисторах VT1 — VT3. Регулировка тока осуществляется резистором R6. Величину тока в приборе определяют миллиамперметром РА1. На выходе вторичной обмотки трансформатора Т1 устанавливается напряжение 24 — 26 В.
На выходе вторичной обмотки трансформатора Т1 устанавливается напряжение 24 — 26 В.
Для повышения электробезопасности при пользовании электрофорезом требуется тщательное изготовление понижающего трансформатора. Так как вторичная цепь потребляет около 300 мВт, толщина провода вторичной обмотки выбирается из соображений удобства ее намотки (чтобы не оборвалась и разместилась на каркасе). Между первичной и вторичной обмотками укладывается хорошая межобмоточная изоляция — 3 — 4 слоя лакоткани.
Корпус прибора лучше сделать из диэлектрика: пластмассы или дерева. На передней панели размещаются клеммы, миллиамперметр, тумблер включения сети и переменный резистор.
Вся электронная схема располагается на плате из фольгированного стеклотекстолита (рис.2). Монтаж осуществляется со стороны фольги, которая разрезается на токонесущие части резаком.
Рис.2
После сборки по эталонному амперметру при коротком замыкании между выходными клеммами подбирается резистор шунта R3. Полное отклонение стрелки прибора должно быть 5 мА.
Полное отклонение стрелки прибора должно быть 5 мА.
Электродами служат две свинцовые пластинки 30 х 50 мм, толщиной 0,5 — 0,8 мм. Пластинки при процедурах вставляются в мешочки из белой бязевой ткани.
Место наложения электродов, полярность, количество лекарства и требуемая величина тока определяются физиотерапевтом.
Радиолюбитель 6/93, с.26 .
> Спасибо за схему Евгений,но где искать допотопные транзисторы,может можно чем то современным заменить. > Сергей.
допотопные транзисторы можно современным заменить легко и просто.
Схема представляет классический стабилизатор тока с глубокой отрицательной обратной связью. СтавЬте любые транзисторы p-n-p структуры выдерживающие напряжения 40-60 В (например КТ3107А,Б). VT3 можно поставить помощней КТ814 или КТ816 с любой буквой, но это для души(если захочеЦа кого-то попытать:-), подняв ток), необходимости в этом нет.
Удачи.
Мерзликин Евгений.
| Содержание | © Каталог радиолюбительских схемВсе права защищены.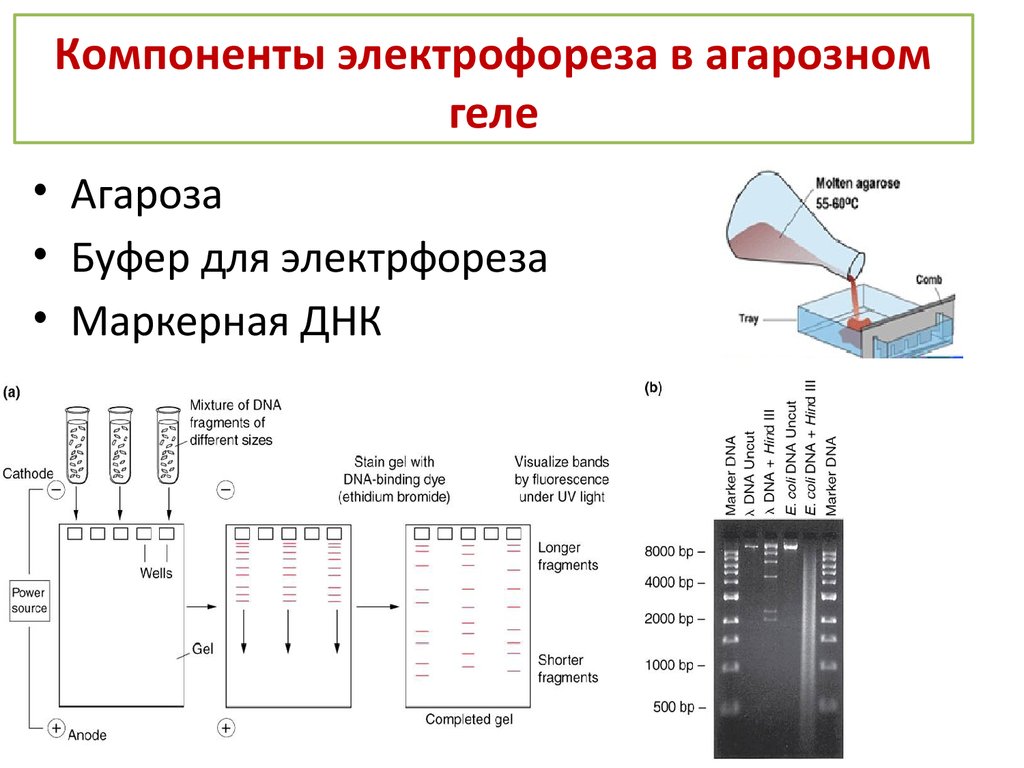 Радиолюбительская страница. Радиолюбительская страница.Перепечатка разрешается только с указанием ссылки на данный сайт. Пишите нам. E-mail: [email protected] или [email protected]. | Я радиолюбитель |
Методика электрофореза карипаин сухой бальзам
Подготовка электродов
Смочить многоразовые фланелевые прокладки теплой водой 37-39 °C и отжать. Фланелевые прокладки с токопроводящей углеродной тканью следует использовать совместно с резиновыми токопроводящими электродами, которыми оснащены все современные физиотерапевтические аппараты гальванизации и электрофореза. Для старых аппаратов с свинцовыми электродами необходимо использовать гидрофильные прокладки без токораспределительного слоя углеродной ткани.
Подготовка раствора
Ввести шприцом во флакон «Карипаин сухой бальзам» 10 мл. физраствора. Физраствор желательно предварительно подогреть до температуры 36-37°C.
Нанесение раствора на положительный электрод
Открыть колпачок флакона «Карипаин сухой бальзам» и добавить в него пипеткой две капели «Димексид» или шприцом 0,5 мл.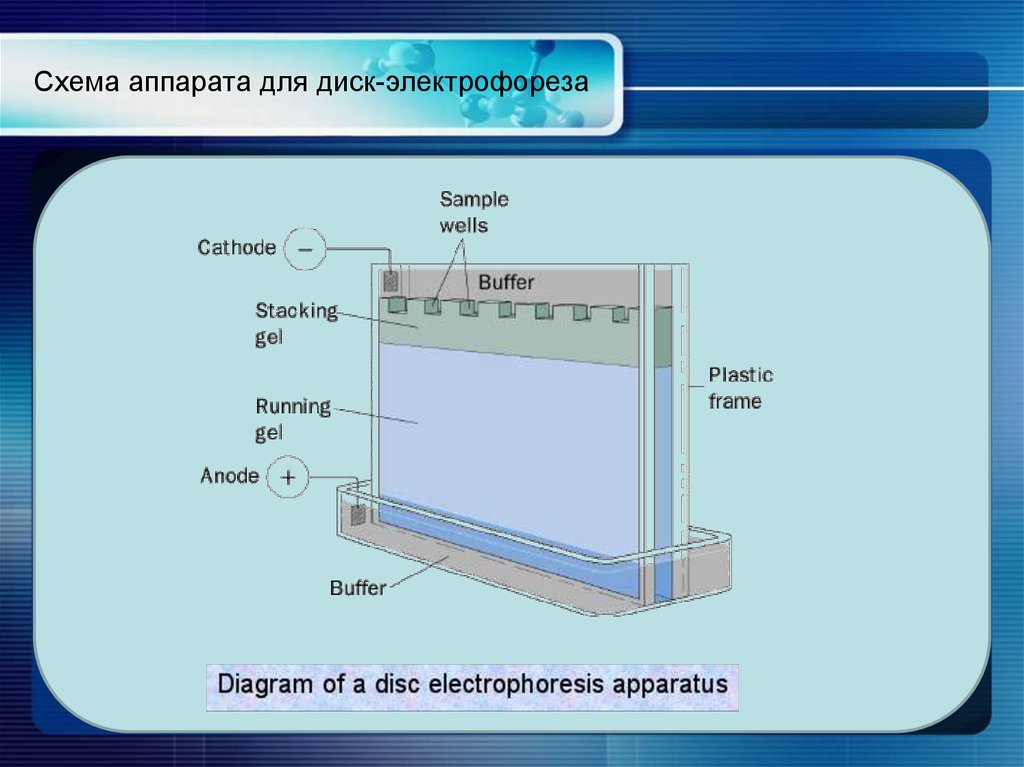 После чего вылить подготовленную субстанцию на одну из фланелевых прокладок. В случает отсутствия в наличии «Димексид» — можно исключить его из процедуры.
После чего вылить подготовленную субстанцию на одну из фланелевых прокладок. В случает отсутствия в наличии «Димексид» — можно исключить его из процедуры.
Нанесение «Эуфиллин 2,4%» на отрицательные электроды
На другие прокладки нанести шприцом 10 мл. «Эуфиллин 2,4%». В случае отсутствия «Эуфиллин», вместо него допускается использование 10 мл. физраствора.
Подготовка к процедуре электрофореза
Вставить резиновые электроды в технический разрез прокладок соблюдая полярность. Два резиновых электрода с красным проводом в одну прокладку с растровом «Карипаин сухой бальзам», и по одному резиновому электроду с синим проводом в прокладки с растровом «Эуфиллин».
Установка времени и силы тока
Установить таймер процедуры на 15-20 минут и регулятором тока выставить значение в диапазоне от 0,5 мА до 15 мА. в зависимости от ощущений пациента. Повышать ток необходимо плавно, опираясь исключительно на ощущения пациента (повышать ток до легкого покалывания). Прокладки должны плотно прилегать к телу пациента, это поможет исключить точечный контакт, в области которого могут появиться микроожоги.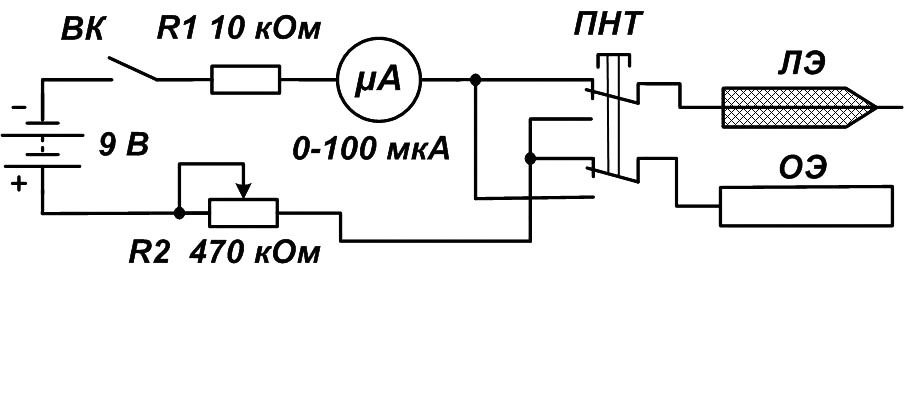
Курсовое лечение
Процедуры лекарственного электрофореза необходимо делать ежедневно и систематически. Количество курсов зависит от степени тяжести заболевания (чаще всего 2-3 курса). Количество процедур лекарственного электрофореза в одном курсе лечения зависит от локализации заболевания. Заболевания позвоночника (протрузия, межпозвоночная грыжа) — курс 30 процедур. Заболевания суставов (артроз, артрит) — курс 10 процедур.
Общие рекомендации
Процедуры выполняются ежедневно, без пропуска. Процедуры электрофореза желательно проводить вечером за 1-2 часа до сна. После процедуры электрофореза необходимо протереть кожу водно-спиртовым раствором или влажной гигиенической салфеткой. Нанести массирующим движением 2-3 г. «Карипаин ультра гель» на зону, где располагалась прокладка с «Карипаин сухой бальзам», после чего отдохнуть 10-15 минут в расслабленном состоянии в тепле. Утром необходимо также нанести 2-3 г. «Карипаин ультра гель». На случай пропуска процедур электрофореза, необходимо продолжать лечение «Карипаин ультра гель».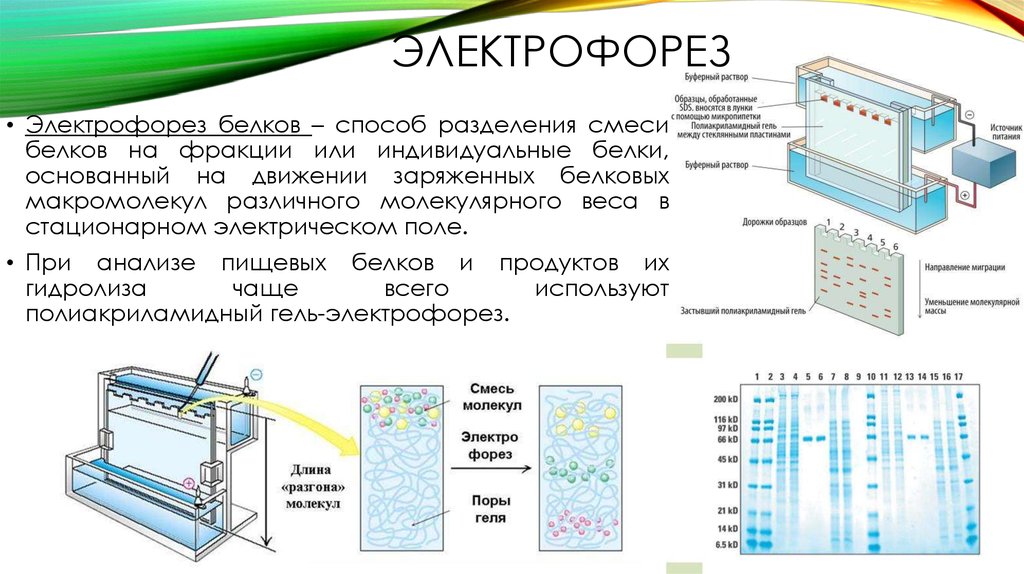 2 раза в день. (утром и вечером).
2 раза в день. (утром и вечером).
Схемы расположения электродов
Усовершенствованная дискриминационная схема гель-электрофореза в пульсирующем поле для субтипирования серотипов Salmonella Heidelberg, Kentucky, SaintPaul и Hadar
. 2008 окт; 71 (10): 2067-72.
doi: 10.4315/0362-028x-71.10.2067.
Мейли Си 1 , Цзе Чжэн, Шаохуа Чжао, Эрик В. Браун, Цзянхун Мэн
принадлежность
- 1 Колледж пищевых наук и инженерии, Северо-Западный университет A&F, Шэньси, Китай.
- PMID: 18939754
- DOI:
10.
 4315/0362-028х-71.10.2067
4315/0362-028х-71.10.2067
Мейли Си и др. J Пищевая защита. 2008 9 октября0003
. 2008 окт; 71 (10): 2067-72.
doi: 10.4315/0362-028x-71.10.2067.
Авторы
Мейли Си 1 , Цзе Чжэн, Шаохуа Чжао, Эрик В. Браун, Цзянхун Мэн
принадлежность
- 1 Колледж пищевых наук и инженерии, Северо-Западный университет A&F, Шэньси, Китай.
- PMID: 18939754
- DOI:
10.
 4315/0362-028х-71.10.2067
4315/0362-028х-71.10.2067
Абстрактный
Традиционные протоколы гель-электрофореза в пульсирующем поле (PFGE), широко используемые в качестве успешного подхода для субтипирования многих сальмонелл, могут быть недостаточными для различения штаммов, обладающих одинаковым уровнем гомогенности в пределах одного и того же серотипа. Четыре дополнительных фермента рестрикции (SpeI, PacI, SfiI и NotI), в дополнение к XbaI и BlnI, использовались для PFGE-типирования 33 изолятов Salmonella Heidelberg, 27 Salmonella Kentucky, 27 Salmonella SaintPaul и 27 изолятов Salmonella Hadar, которые были выделены из домашней птицы. и мясо свинины в розницу из разных штатов США. Дендрограмма, полученная в результате комбинированного анализа шести ферментов, показала высокую дискриминацию со значением индекса разнообразия Симпсона более 0,9.50. Отношение узлов к изолятам было более 0,75, в среднем менее трех изолятов в каждой политомии для всех четырех серотипов.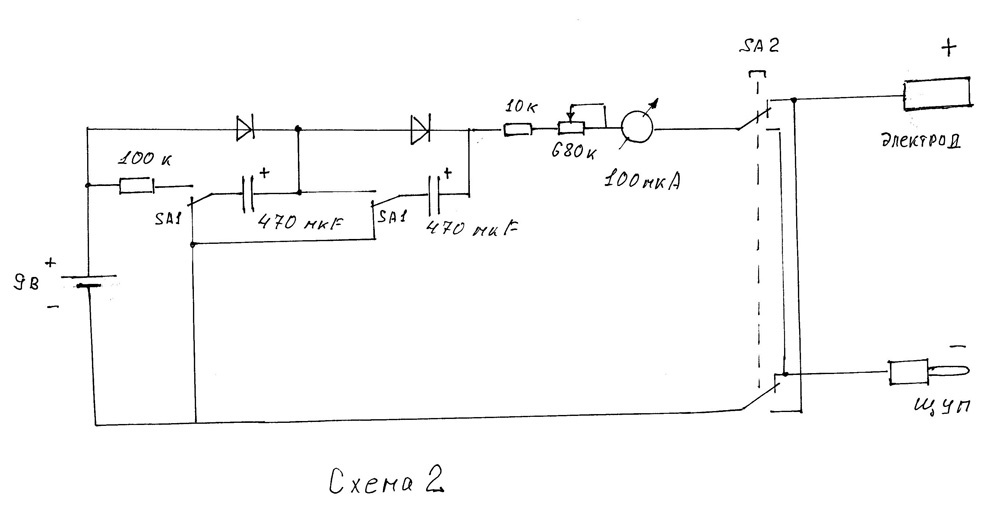
Похожие статьи
Устойчивость к противомикробным препаратам и генетическое родство среди сальмонелл из розничных пищевых продуктов животного происхождения: надзор NARMS за розничным мясом.
Чжао С.
 , Макдермотт П.Ф., Фридман С., Эббот Дж., Айерс С., Гленн А., Холл-Робинсон Э., Хьюберт С.К., Харботтл Х., Уокер Р.Д., Чиллер Т.М., Уайт Д.Г.
Чжао С. и др.
Патог пищевого происхождения Dis. 2006 Весна; 3(1):106-17. doi: 10.1089/fpd.2006.3.106.
Патог пищевого происхождения Dis. 2006.
PMID: 16602986
, Макдермотт П.Ф., Фридман С., Эббот Дж., Айерс С., Гленн А., Холл-Робинсон Э., Хьюберт С.К., Харботтл Х., Уокер Р.Д., Чиллер Т.М., Уайт Д.Г.
Чжао С. и др.
Патог пищевого происхождения Dis. 2006 Весна; 3(1):106-17. doi: 10.1089/fpd.2006.3.106.
Патог пищевого происхождения Dis. 2006.
PMID: 16602986Анализ профилей гель-электрофореза в импульсном поле с использованием нескольких ферментов для прогнозирования потенциальных резервуаров-источников штаммов Salmonella Enteritidis и Salmonella Typhimurium, выделенных от человека.
Сон И, Чжэн Дж., Киз К.Э., Чжао С., Мэн Дж., Браун Э.В. Сын I и др. Заразить Генет Эвол. 2013 июнь;16:226-33. doi: 10.1016/j.meegid.2013.01.020. Epub 2013 18 февраля. Заразить Генет Эвол. 2013. PMID: 23429060

Чжэн Дж., Киз К.Э., Чжао С., Ахмед Р., Мэн Дж., Браун Э.В. Чжэн Дж. и др. Дж. Клин Микробиол. 2011 Январь; 49 (1): 85-94. doi: 10.1128/JCM.00120-10. Epub 2010 27 октября. Дж. Клин Микробиол. 2011. PMID: 20980570 Бесплатная статья ЧВК.
Винокур ПЛ. Винокур ПЛ. Фронт биосай. 2003 г., 1 января; 8: c14-24. дои: 10.2741/947. Фронт биосай. 2003. PMID: 12456335 Обзор.
PFGE: значение для качества продуктов питания.
Верниле А., Джамманко Г., Масса С. Вернил А. и др. Последние Пэт Фуд Нутр Агрик. 2009 г.Ноябрь; 1 (3): 248-51. дои: 10.2174/2212798410
0248. Последние Пэт Фуд Нутр Агрик. 2009. PMID: 20653547
Обзор.
PMID: 20653547
Обзор.
Посмотреть все похожие статьи
Цитируется
Анализ последовательности ДНК всего генома подвида Salmonella enterica серотипа Теннесси, полученный в результате связанных вспышек пищевого происхождения с арахисовым маслом.
Уилсон М.Р., Браун Э., Киз С., Штамм Э., Луо Ю., Муруванда Т., Грим С., Жан-Жиль Бобрун Дж., Джарвис К., Юинг Л., Гопинат Г., Хейнс Д., Аллард М.В., Мюссер С. Уилсон М.Р. и соавт. ПЛОС Один. 3 июня 2016 г .; 11 (6): e0146929. doi: 10.1371/journal.pone.0146929. Электронная коллекция 2016. ПЛОС Один. 2016. PMID: 27258142 Бесплатная статья ЧВК.
Подтип CRISPR-MVLST Salmonella enterica subsp. enterica серовары Typhimurium и Heidelberg и их применение для выявления изолятов, выделяемых при вспышках.

Шариат Н., Сандт Ч., ДиМарцио М.Дж., Баррангоу Р., Дадли Э.Г. Шариат Н. и др. БМС микробиол. 2013 12 ноября; 13:254. дои: 10.1186/1471-2180-13-254. БМС микробиол. 2013. PMID: 24219629 Бесплатная статья ЧВК.
Об истории эволюции, популяционной генетике и разнообразии изолятов Salmonella Enteritidis PFGE pattern JEGX01.0004.
Allard MW, Luo Y, Strain E, Pettengill J, Timme R, Wang C, Li C, Keys CE, Zheng J, Stones R, Wilson MR, Musser SM, Brown EW. Аллард М.В. и соавт. ПЛОС Один. 2013;8(1):e55254. doi: 10.1371/journal.pone.0055254. Epub 2013 30 января. ПЛОС Один. 2013. PMID: 23383127 Бесплатная статья ЧВК.
Распространенность и характеристика подвижной сальмонеллы на коммерческих птицефабриках-несушках в Бангладеш.

Баруа Х., Бисвас П.К., Олсен К.Е., Кристенсен Дж.П. Баруа Х. и др. ПЛОС Один. 2012;7(4):e35914. doi: 10.1371/journal.pone.0035914. Epub 2012, 25 апреля. ПЛОС Один. 2012. PMID: 22558269 Бесплатная статья ЧВК.
Кластеризация штаммов Salmonella enterica серовара Монтевидео с высоким разрешением с использованием подхода к секвенированию следующего поколения.
Allard MW, Luo Y, Strain E, Li C, Keys CE, Son I, Stones R, Musser SM, Brown EW. Аллард М.В. и соавт. Геномика BMC. 2012 19 января; 13:32. дои: 10.1186/1471-2164-13-32. Геномика BMC. 2012. PMID: 22260654 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Биология – электрофорез – Бирмингемский университет
Электрофорез и хроматография являются формами молекулярного сита.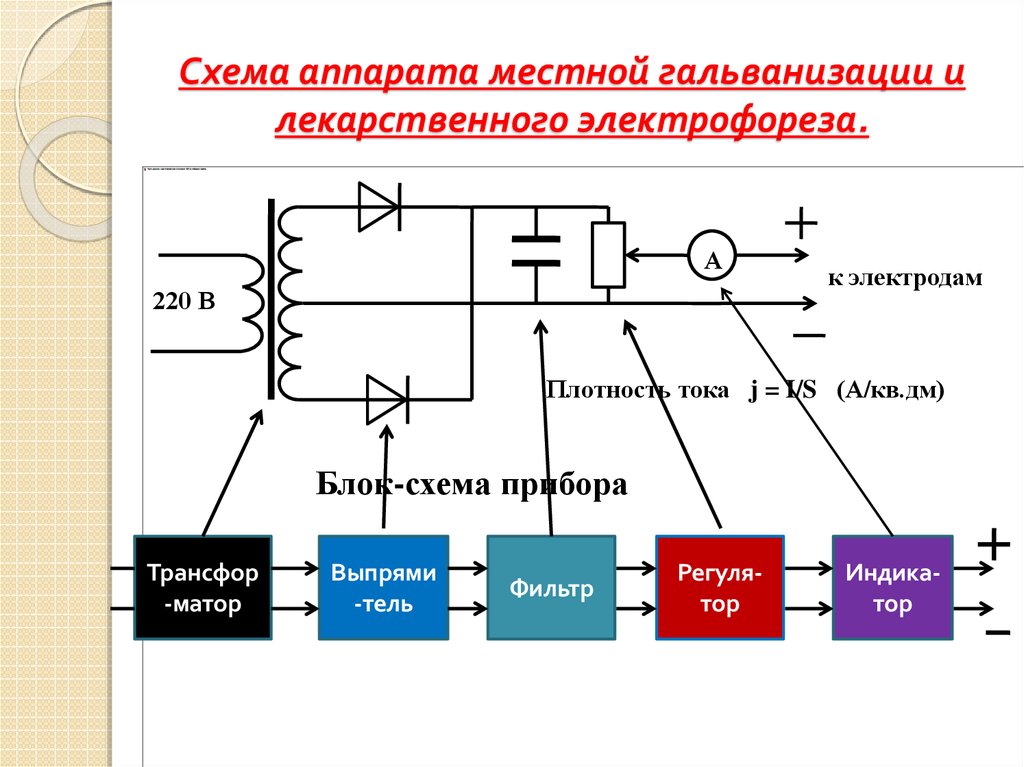 Это невероятно полезные и широко используемые инструменты, которые позволяют исследователям разделять сложные объекты на идентифицируемые части.
Это невероятно полезные и широко используемые инструменты, которые позволяют исследователям разделять сложные объекты на идентифицируемые части.
Введение | Видео | В фокусе | Подкаст | Заключение | Следующие шаги |
В чем разница между хроматографией и электрофорезом?
Вполне вероятно, что вы будете проводить либо эксперимент с тонкослойной/бумажной хроматографией, либо эксперимент по электрофорезу во время вашего уровня A, а не оба, поэтому может быть полезно знать разницу между ними, а также их сходство. В обоих этих методах используются вещества, которые действуют как сита для разделения смесей, и на самом деле электрофорез — это просто особая форма хроматографии. Есть много других форм хроматографии, используемых в исследованиях, включая газовую хроматографию и аффинную хроматографию.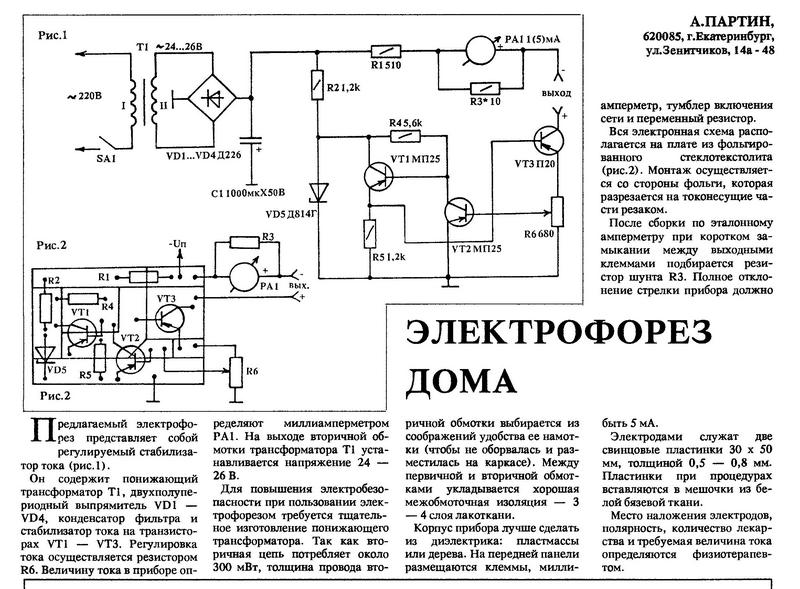 Во всех этих формах хроматография использует разницу между подвижной и неподвижной фазами. Подвижная фаза — это вещество, которое способно перемещаться по неподвижной фазе, позволяя нашей пробной смеси двигаться вместе с ней. Неподвижная или адсорбирующая фаза представляет собой вещество, которое поглощает проходящие частицы исследуемой смеси. Степень перемещения частей образца позволяет идентифицировать его составные части, а различия в схемах разделения смесей образцов позволяют нам определять различия между образцами.
Во всех этих формах хроматография использует разницу между подвижной и неподвижной фазами. Подвижная фаза — это вещество, которое способно перемещаться по неподвижной фазе, позволяя нашей пробной смеси двигаться вместе с ней. Неподвижная или адсорбирующая фаза представляет собой вещество, которое поглощает проходящие частицы исследуемой смеси. Степень перемещения частей образца позволяет идентифицировать его составные части, а различия в схемах разделения смесей образцов позволяют нам определять различия между образцами.
Как в тонкослойной, так и в бумажной хроматографии используется растворяющая подвижная фаза, которая вытягивается из стационарной фазы за счет капиллярного действия. Самая большая разница между этими методами заключается в различных стационарных фазах. Неподвижная фаза в тонкослойной хроматографии (ТСХ) часто представляет собой силикагель или целлюлозу на инертной подложке. Тип используемой подвижной фазы и легкость, с которой образец может связываться с неподвижной фазой, определяют создаваемый образец. Например, пластина с силикагелем очень полярна, а это означает, что сильно полярные молекулы в вашем образце пройдут меньшее расстояние до связывания с неподвижной фазой, чем менее полярные. Обычно для разделения пигментов в холофилле используют пластину с силикагелем и неполярный растворитель, поскольку растворитель позволяет разделить пигменты в зависимости от того, насколько они полярны.
Например, пластина с силикагелем очень полярна, а это означает, что сильно полярные молекулы в вашем образце пройдут меньшее расстояние до связывания с неподвижной фазой, чем менее полярные. Обычно для разделения пигментов в холофилле используют пластину с силикагелем и неполярный растворитель, поскольку растворитель позволяет разделить пигменты в зависимости от того, насколько они полярны.
Существуют преимущества использования ТСХ по сравнению с бумагой в зависимости от используемого образца. ТСХ можно проводить быстрее, чем бумажную хроматографию, и с большим количеством образцов на той же бумаге, поскольку зоны распределения часто меньше. Это также может облегчить выполнение двусторонней хроматографии. Меньшие зоны распространения также улучшают чувствительность обнаружения, если вы пытаетесь определить, из чего сделаны ваши пятна, а пластины для ТСХ часто более термостойкие, что позволяет вам легче проявлять пятна на вашей пластине, и могут быть более устойчивыми к использованию. сильных растворителей в подвижной фазе.
сильных растворителей в подвижной фазе.
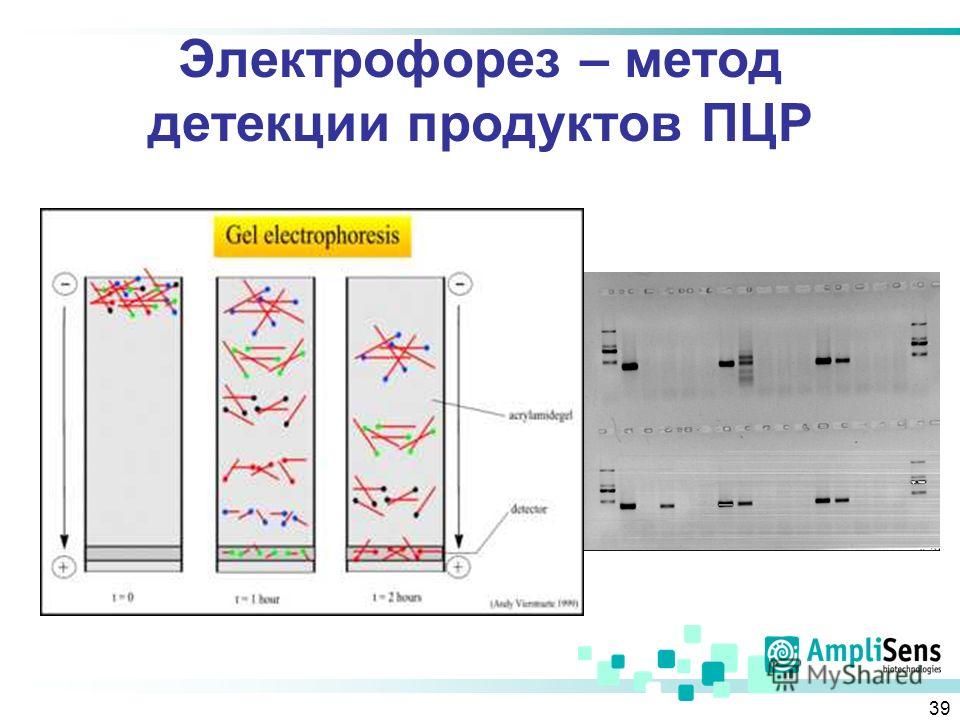
Гель-электрофорез обычно используется для анализа ДНК. Существует множество способов подготовки образцов ДНК до того, как они будут помещены в гель для электрофореза, хотя, поскольку может присутствовать только одна или несколько копий интересующего гена или фрагмента ДНК, образец обычно необходимо амплифицировать с помощью процесс, называемый полимеразной цепной реакцией (ПЦР). ПЦР может генерировать тысячи или даже миллионы копий вашего образца, используя термоциклирование ДНК с ферментом ДНК-полимеразы. Этот фермент создает копии ДНК, а затем копии копий, поэтому количество образцов ДНК экспоненциально увеличивается за относительно короткий период времени, что значительно упрощает их визуализацию.
После того, как образцы ДНК будут готовы, их можно поместить в небольшие лунки агарозного геля в резервуар, подобный изображенному выше. Резервуар заполняется буферным раствором, чтобы обеспечить прохождение электрического тока, протягивающего электрически заряженные частицы ДНК через гель агарозы. Размер последовательности ДНК будет определять, насколько быстро она проходит через гель, а это означает, что участки ДНК могут быть разделены по размеру. Это позволяет нам увидеть, например, наличие гена, встроенного в генетически модифицированный организм, которого нет в диком типе.
Размер последовательности ДНК будет определять, насколько быстро она проходит через гель, а это означает, что участки ДНК могут быть разделены по размеру. Это позволяет нам увидеть, например, наличие гена, встроенного в генетически модифицированный организм, которого нет в диком типе.
Как исследователи используют эти методы?
Как можно использовать хроматографию и электрофорез для анализа ДНК?
Что такое CRISPR?
CRISPR (короткие палиндромные повторы, регулярно расположенные кластерами) представляют собой короткие участки повторяющейся ДНК, которые можно найти в прокариотических организмах, таких как бактерии. Их открытие было сочтено необычным, потому что прокариоты имеют сравнительно небольшие, компактные геномы, в которых отсутствует большая часть некодирующей ДНК (иногда ошибочно называемой мусорной ДНК), обнаруженной у эукариот. Было обнаружено, что последовательности ДНК между этими повторами на самом деле точно совпадают с ДНК вируса, а это означает, что CRISPR на самом деле является формой приобретенной системы защиты прокариот от вирусов.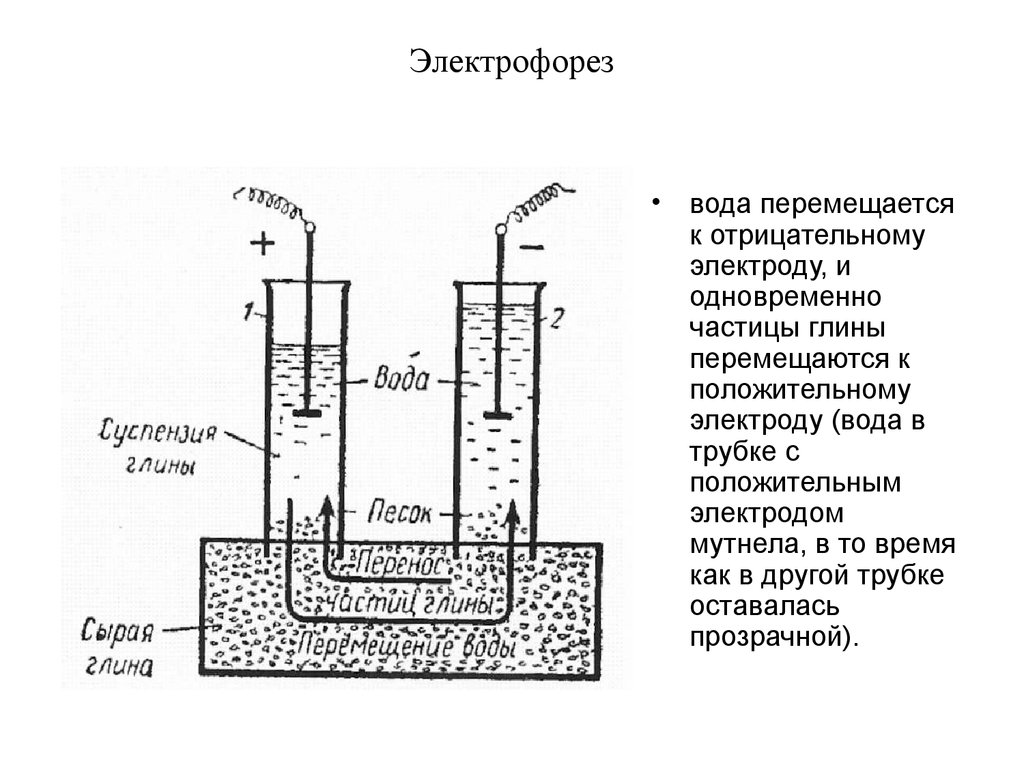 Бактерии способны распознавать ДНК вируса с помощью ассоциированных с CRISPR белков (Cas), и если они вступают в контакт с этой последовательностью ДНК, белок Cas немедленно разрезает и уничтожает ее.
Бактерии способны распознавать ДНК вируса с помощью ассоциированных с CRISPR белков (Cas), и если они вступают в контакт с этой последовательностью ДНК, белок Cas немедленно разрезает и уничтожает ее.
CRISPR очень полезен для бактерий, чтобы они могли распознавать вирусы и бороться с ними, но ученые быстро поняли, что эту систему можно использовать как способ целенаправленного редактирования генов. Это огромное преимущество перед традиционными методами генетической модификации, поскольку предыдущие методы редактирования были гораздо менее точными. Ген, который вы пытались вставить или удалить из генома, с гораздо меньшей вероятностью находил нужное место в геноме, что делало его более дорогим и трудоемким для успешного выполнения. CRISPR, по-видимому, также работает с прокариотическими и эукариотическими организмами, поэтому его потенциальное применение огромно.
Существуют важные медицинские приложения для CRISPR. Появляются новые методы лечения CRISPR для таких заболеваний, как рак, когда гены, которые способствуют неконтролируемому делению клеток, могут быть заменены на те, которые вместо этого вызывают гибель клеток, и эта идея уже работает на мышах. Любое заболевание с генетическим компонентом потенциально можно лечить с помощью CRISPR, хотя редактирование зародышевой линии повлияет на будущие поколения, у которых не будет возможности дать согласие на такую процедуру, что противоречит одному из фундаментальных принципов медицинской этики.
Любое заболевание с генетическим компонентом потенциально можно лечить с помощью CRISPR, хотя редактирование зародышевой линии повлияет на будущие поколения, у которых не будет возможности дать согласие на такую процедуру, что противоречит одному из фундаментальных принципов медицинской этики.
Лабораторные признания
В подкасте Labor Confessions исследователи рассказывают о своем лабораторном опыте в контексте практических оценок уровня A. В этом выпуске мы рассмотрим разделение биологических соединений с помощью тонкослойной или бумажной хроматографии и использование соответствующих приборов для записи количественных измерений, таких как колориметр или потометр.
Что означают ваши измерения?
В геле вы прогоняете все свои экспериментальные образцы вместе с маркером размера молекулярной массы, обычно называемым лестницей ДНК. Лестница, помеченная здесь на изображении как «ELP», позволяет вам определить приблизительную молекулярную массу ваших образцов. Стоит отметить, что молекулярная масса обратно пропорциональна расстоянию, пройденному гелем, поэтому лестница обозначает логарифмическую шкалу. Возможно, вас интересует только наличие или отсутствие полосы на геле для электрофореза, поэтому добавление лестницы ДНК не является жизненно важным для вашего эксперимента. Тем не менее, при работе с гелем в лаборатории обычно используют лестницу.
Лестница, помеченная здесь на изображении как «ELP», позволяет вам определить приблизительную молекулярную массу ваших образцов. Стоит отметить, что молекулярная масса обратно пропорциональна расстоянию, пройденному гелем, поэтому лестница обозначает логарифмическую шкалу. Возможно, вас интересует только наличие или отсутствие полосы на геле для электрофореза, поэтому добавление лестницы ДНК не является жизненно важным для вашего эксперимента. Тем не менее, при работе с гелем в лаборатории обычно используют лестницу.
Для анализа движения пробы в тонкослойной или бумажной хроматографии главное, что представляет интерес, — это расстояние, на которое перемещаются различные части пробы по отношению к общему движению растворителя. Крайне важно быстро отметить фронт растворителя карандашом после того, как хроматографическая пластина будет готова, чтобы вы могли точно измерить эти расстояния. Расстояние, пройденное пятном, деленное на расстояние, пройденное фронтом растворителя, называется коэффициентом удерживания или Rf.


 4315/0362-028х-71.10.2067
4315/0362-028х-71.10.2067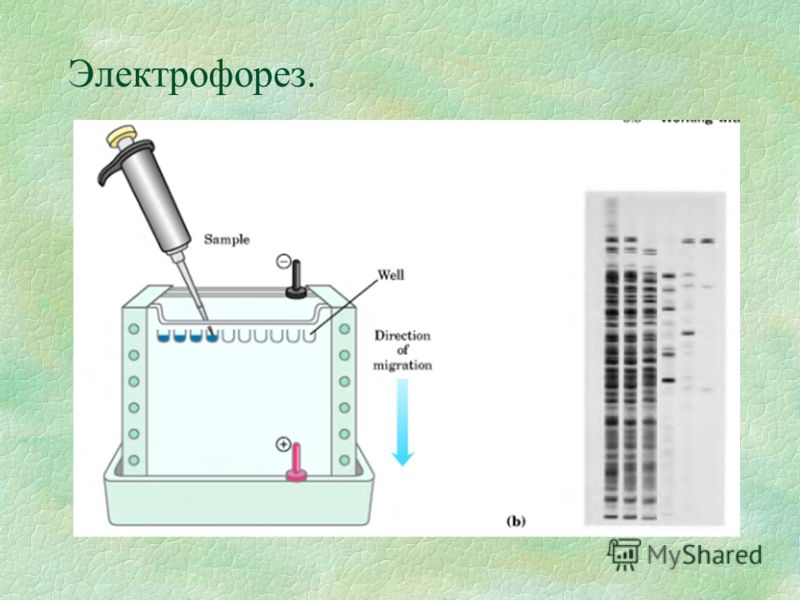 4315/0362-028х-71.10.2067
4315/0362-028х-71.10.2067 , Макдермотт П.Ф., Фридман С., Эббот Дж., Айерс С., Гленн А., Холл-Робинсон Э., Хьюберт С.К., Харботтл Х., Уокер Р.Д., Чиллер Т.М., Уайт Д.Г.
Чжао С. и др.
Патог пищевого происхождения Dis. 2006 Весна; 3(1):106-17. doi: 10.1089/fpd.2006.3.106.
Патог пищевого происхождения Dis. 2006.
PMID: 16602986
, Макдермотт П.Ф., Фридман С., Эббот Дж., Айерс С., Гленн А., Холл-Робинсон Э., Хьюберт С.К., Харботтл Х., Уокер Р.Д., Чиллер Т.М., Уайт Д.Г.
Чжао С. и др.
Патог пищевого происхождения Dis. 2006 Весна; 3(1):106-17. doi: 10.1089/fpd.2006.3.106.
Патог пищевого происхождения Dis. 2006.
PMID: 16602986
 PMID: 20653547
Обзор.
PMID: 20653547
Обзор.