Гальванический элемент: схема, принцип работы, состав
Главная » Виды батареек
На чтение 5 мин Просмотров 6к.
Впервые в мире гальванический элемент был разработан Луиджи Гальвани. Об его истории читайте в этой статье. По сути это временный источник электрического тока, который формируется за счет протекания химической реакции. Поток электронов формируется за счет взаимодействия между двумя разноименными металлами. В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Кроме Гальвани созданием эффективной батареи занимался Даниэль Якоби.
Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Содержание
- Схема гальванического элемента
- Устройство гальванического элемента
- Принцип работы гальванического элемента
- Ответы на часто задаваемые вопросы
- Типы гальванических элементов
- Таблица гальванических элементов
- Назначение гальванического элемента
- Гальванический элемент в домашних условиях
- Процесс изготовления
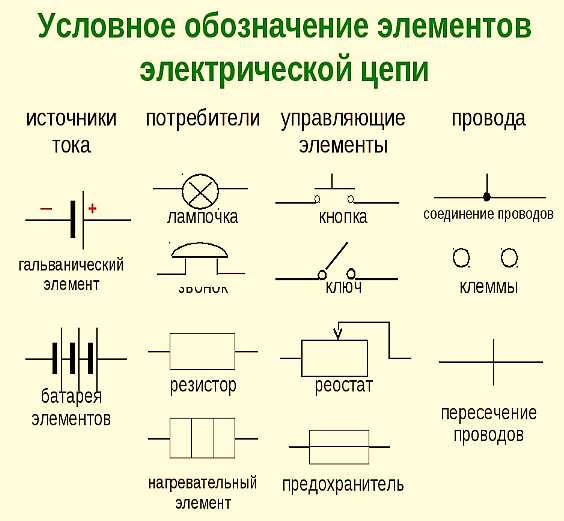
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно — цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элементаОн предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.

- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Гальванический элемент в домашних условияхПростой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит. В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
- Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Более детально создание батареи своими руками описано в этой статье.
Таким образом изготавливается самодельный гальванический элемент.
Batareykaa.ru
Юный радиолюбитель
Юный радиолюбитель
ОглавлениеПРЕДИСЛОВИЕ К СЕДЬМОМУ ИЗДАНИЮБЕСЕДА ПЕРВАЯ ИЗ ГЛУБИНЫ ВЕКОВ ЗАГЛЯНЕМ В МИКРОМИР О ПРОВОДНИКАХ, НЕПРОВОДНИКАХ И ПОЛУПРОВОДНИКАХ ЭЛЕКТРИЧЕСКИЙ ТОК ЭЛЕКТРИЧЕСТВО И МАГНЕТИЗМ: КАКАЯ МЕЖДУ НИМИ СВЯЗЬ? ПЕРЕМЕННЫЙ ТОК РОЖДАЕТ ЭЛЕКТРОМАГНИТНЫЕ ВОЛНЫ РОЖДЕНИЕ РАДИО «ГАЗЕТА БЕЗ БУМАГИ И БЕЗ РАССТОЯНИЙ» БЕСЕДА ВТОРАЯ 2.  ПЕРВОЕ ЗНАКОМСТВО С РАДИОПЕРЕДАЧЕЙ И РАДИОПРИЕМОМ ПЕРВОЕ ЗНАКОМСТВО С РАДИОПЕРЕДАЧЕЙ И РАДИОПРИЕМОМО КОЛЕБАНИЯХ И ВОЛНАХ О ПЕРИОДЕ И ЧАСТОТЕ КОЛЕБАНИЙ ЕЩЕ РАЗ О РАДИОВОЛНАХ РАДИОВЕЩАТЕЛЬНЫЕ ДИАПАЗОНЫ ВОЛН РАДИОПЕРЕДАЧА РАСПРОСТРАНЕНИЕ РАДИОВОЛН БЕСЕДА ТРЕТЬЯ. ТВОЙ ПЕРВЫЙ РАДИОПРИЕМНИК ПЕРВЫЙ РАДИОПРИЕМНИК ПРИНЦИПИАЛЬНАЯ ЭЛЕКТРИЧЕСКАЯ СХЕМА ТВОЕГО ПРИЕМНИКА КОНСТРУКЦИЯ ПРИЕМНИКА ВОЗМОЖНЫЕ НЕИСПРАВНОСТИ БЕСЕДА ЧЕТВЕРТАЯ. КАК РАБОТАЕТ РАДИОПРИЕМНИК КОЛЕБАТЕЛЬНЫЙ КОНТУР ДЕТЕКТОР И ДЕТЕКТИРОВАНИЕ ГОЛОВНОЙ ТЕЛЕФОН ГРОМКИЙ РАДИОПРИЕМ БЕСЕДА ПЯТАЯ. ЭКСКУРСИЯ В ЭЛЕКТРОТЕХНИКУ ЭЛЕКТРИЧЕСКИЙ ТОК И ЕГО ОЦЕНКА ЭЛЕКТРИЧЕСКОЕ СОПРОТИВЛЕНИЕ ЭЛЕКТРИЧЕСКОЕ НАПРЯЖЕНИЕ ЗАКОН ОМА ИНДУКТИВНОЕ СОПРОТИВЛЕНИЕ МОЩНОСТЬ И РАБОТА ТОКА ТРАНСФОРМАЦИЯ ПЕРЕМЕННОГО ТОКА РЕЗИСТОРЫ КОНДЕНСАТОРЫ СИСТЕМА СОКРАЩЕННОГО ОБОЗНАЧЕНИЯ НОМИНАЛЬНЫХ СОПРОТИВЛЕНИЙ РЕЗИСТОРОВ И ЕМКОСТЕЙ КОНДЕНСАТОРОВ КОРОТКО О ПЛАВКОМ ПРЕДОХРАНИТЕЛЕ ОСТОРОЖНО – ВЫСОКОЕ НАПРЯЖЕНИЕ! БЕСЕДА ШЕСТАЯ.  ПОЛУПРОВОДНИКИ И ПОЛУПРОВОДНИКОВЫЕ ПРИБОРЫ ПОЛУПРОВОДНИКИ И ПОЛУПРОВОДНИКОВЫЕ ПРИБОРЫПОЛУПРОВОДНИКИ И ИХ СВОЙСТВА ЭЛЕКТРОПРОВОДНОСТЬ ПОЛУПРОВОДНИКА ДИОДЫ И ИХ ПРИМЕНЕНИЕ СТАБИЛИТРОН И ЕГО ПРИМЕНЕНИЕ БИПОЛЯРНЫЕ ТРАНЗИСТОРЫ ТРАНЗИСТОР – УСИЛИТЕЛЬ СХЕМЫ ВКЛЮЧЕНИЯ И ОСНОВНЫЕ ПАРАМЕТРЫ БИПОЛЯРНЫХ ТРАНЗИСТОРОВ КОРОТКО О ПОЛЕВОМ ТРАНЗИСТОРЕ БЕСЕДА СЕДЬМАЯ. ПЕРВЫЙ ТРАНЗИСТОРНЫЙ ПРИЕМНИК ОТ ДЕТЕКТОРНОГО – К ОДНОТРАНЗИСТОРНОМУ ПРИЕМНИКУ ВАРИАНТЫ ОДНОТРАНЗИСТОРНОГО ПРИЕМНИКА ОДНОТРАНЗИСТОРНЫЙ РЕФЛЕКСНЫЙ ПОДВЕДЕМ НЕКОТОРЫЕ ИТОГИ БЕСЕДА ВОСЬМАЯ. ИЗМЕРИТЕЛЬНАЯ ТЕХНИКА ПЕРВОЙ НЕОБХОДИМОСТИ ИЗМЕРИТЕЛЬНЫЕ ПРОБНИКИ ИЗМЕРИТЕЛЬНЫЙ ПРИБОР МАГНИТОЭЛЕКТРИЧЕСКОЙ СИСТЕМЫ МИЛЛИАМПЕРМЕТР ВОЛЬТМЕТР ОММЕТР МИЛЛИАМПЕРВОЛЬТОММЕТР ИЗМЕРЕНИЕ ОСНОВНЫХ ПАРАМЕТРОВ ТРАНЗИСТОРОВ БЕСЕДА ДЕВЯТАЯ. ТВОЯ МАСТЕРСКАЯ ВЕРСТАЧНАЯ ДОСКА РАБОЧИЙ СТОЛ НАУЧИСЬ ПАЯТЬ О НЕКОТОРЫХ МАТЕРИАЛАХ И ПРИЕМАХ МОНТАЖА ГНЕЗДА И ЗАЖИМЫ КОММУТАЦИОННЫЕ УСТРОЙСТВА КАТУШКИ ИНДУКТИВНОСТИ КОЛЕБАТЕЛЬНЫХ КОНТУРОВ МАКЕТНАЯ ПАНЕЛЬ ПЕЧАТНЫЙ МОНТАЖ О МЕРАХ ПРЕДОСТОРОЖНОСТИ ПРИ МОНТАЖЕ ТРАНЗИСТОРОВ БЕСЕДА ДЕСЯТАЯ.  МИКРОФОНЫ, ЗВУКОСНИМАТЕЛИ, ЭЛЕКТРОДИНАМИЧЕСКИЕ ГОЛОВКИ МИКРОФОНЫ, ЗВУКОСНИМАТЕЛИ, ЭЛЕКТРОДИНАМИЧЕСКИЕ ГОЛОВКИМИКРОФОНЫ ЗВУКОСНИМАТЕЛИ ГОЛОВКИ ДИНАМИЧЕСКИЕ ПРЯМОГО ИЗЛУЧЕНИЯ И ГРОМКОГОВОРИТЕЛИ БЕСЕДА ОДИННАДЦАТАЯ. ИСТОЧНИКИ ТОКА ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И БАТАРЕИ АККУМУЛЯТОРЫ И АККУМУЛЯТОРНЫЕ БАТАРЕИ ВЫПРЯМИТЕЛЬ СЕТЕВОЙ БЛОК ПИТАНИЯ БЕСЕДА ДВЕНАДЦАТАЯ. УСИЛИТЕЛЬ ЗВУКОВОЙ ЧАСТОТЫ КАСКАДЫ УСИЛИТЕЛЯ ПРОСТОЙ ДВУХКАСКАДНЫЙ УСИЛИТЕЛЬ ДВУСТОРОННИЙ ТЕЛЕФОН СТАБИЛИЗАЦИЯ РЕЖИМА РАБОТЫ ТРАНЗИСТОРА ДВУХТАКТНЫЙ УСИЛИТЕЛЬ МОЩНОСТИ ПАРАМЕТРЫ УСИЛИТЕЛЯ ЗЧ УСИЛИТЕЛЬ ЗЧ С ПОВЫШЕННОЙ ВЫХОДНОЙ МОЩНОСТЬЮ ЭЛЕКТРОФОН ПЕРЕНОСНЫЙ РАДИОУЗЕЛ БЕСЕДА ТРИНАДЦАТАЯ. ТРАНЗИСТОРНЫЕ ПРИЕМНИКИ ПРЯМОГО УСИЛЕНИЯ ОТ УСИЛИТЕЛЯ – К ПРИЕМНИКУ ПРЯМОГО УСИЛЕНИЯ УСИЛИТЕЛЬ РАДИОЧАСТОТЫ И МАГНИТНАЯ АНТЕННА О НЕКОТОРЫХ ДЕТАЛЯХ ПОРТАТИВНЫХ ПРИЕМНИКОВ ПОРТАТИВНЫЙ ПРИЕМНИК РАДИОЧАСТОТНЫЙ БЛОК РАДИОЛЫ РЕФЛЕКСНЫЕ ПРИЕМНИКИ БЕСЕДА ЧЕТЫРНАДЦАТАЯ. НА ЭЛЕКТРОННЫХ ЛАМПАХ УСТРОЙСТВО ЭЛЕКТРОННОЙ ЛАМПЫ КАК РАБОТАЕТ ДИОД ТРИОД И ЕГО СВОЙСТВА КАТОДЫ ЭЛЕКТРОННЫХ ЛАМП ТРИОД – УСИЛИТЕЛЬ МНОГОЭЛЕКТРОДНЫЕ ЛАМПЫ КОНСТРУКЦИЯ, МАРКИРОВКА И ЦОКОЛЕВКА РАДИОЛАМП УСИЛИТЕЛЬ ЗВУКОВОЙ ЧАСТОТЫ ПРИЕМНИК 1-V-1 БЕСЕДА ПЯТНАДЦАТАЯ.  ОТ ПРИЕМНИКА ПРЯМОГО УСИЛЕНИЯ – К СУПЕРГЕТЕРОДИНУ ОТ ПРИЕМНИКА ПРЯМОГО УСИЛЕНИЯ – К СУПЕРГЕТЕРОДИНУОСОБЕННОСТИ СУПЕРГЕТЕРОДИНА ПРЕОБРАЗОВАТЕЛЬ ЧАСТОТЫ ТРАНЗИСТОРНЫЙ СУПЕРГЕТЕРОДИН ЛАМПОВЫЙ СУПЕРГЕТЕРОДИН БЕСЕДА ШЕСТНАДЦАТАЯ. ЗНАКОМСТВО С АВТОМАТИКОЙ ФОТОЭЛЕМЕНТЫ ЭЛЕКТРОМАГНИТНЫЕ РЕЛЕ ЭЛЕКТРОННОЕ РЕЛЕ ФОТОРЕЛЕ АВТОМАТ ВКЛЮЧЕНИЯ УЛИЧНОГО ОСВЕЩЕНИЯ РЕЛЕ ВЫДЕРЖКИ ВРЕМЕНИ АКУСТИЧЕСКОЕ РЕЛЕ ЭЛЕКТРОННЫЙ СТОРОЖ КОДОВЫЙ ЗАМОК БЕСЕДА СЕМНАДЦАТАЯ. О МУЛЬТИВИБРАТОРЕ И ЕГО ПРИМЕНЕНИИ МУЛЬТИВИБРАТОР АВТОКОЛЕБАТЕЛЬНЫЙ ЖДУЩИЙ МУЛЬТИВИБРАТОР МУЛЬТИВИБРАТОР В ГЕНЕРАТОРАХ И ЭЛЕКТРОННЫХ ПЕРЕКЛЮЧАТЕЛЯХ МУЛЬТИВИБРАТОР В РАДИОТЕХНИЧЕСКИХ ИГРУШКАХ МУЗЫКАЛЬНЫЙ АВТОМАТ «СОЛОВЕЙ» БЕСЕДА ВОСЕМНАДЦАТАЯ. ТВОЯ ИЗМЕРИТЕЛЬНАЯ ЛАБОРАТОРИЯ МОСТОВОЙ ИЗМЕРИТЕЛЬ ТРАНЗИСТОРНЫЙ ВОЛЬТМЕТР ПОСТОЯННОГО ТОКА ЧАСТОТОМЕР ИЗМЕРИТЕЛЬНЫЕ ГЕНЕРАТОРЫ СИГНАЛОВ ЗВУКОВОЙ ЧАСТОТЫ БЕСЕДА ДЕВЯТНАДЦАТАЯ. НА МИКРОСХЕМАХ НА АНАЛОГОВЫХ МИКРОСХЕМАХ СЕРИЙ К118 и К122 СУПЕРГЕТЕРОДИН НА МИКРОСХЕМАХ СЕРИИ К224 УСИЛИТЕЛЬ ЗЧ НА ОДНОЙ МИКРОСХЕМЕ НА ЛОГИЧЕСКИХ ЭЛЕМЕНТАХ МИНИАТЮРНЫЙ ПРИЕМНИК БЕСЕДА ДВАДЦАТАЯ.  СТЕРЕОФОНИЯ СТЕРЕОФОНИЯСТЕРЕОЭФФЕКТ. ЧТО ЭТО ТАКОЕ? СТЕРЕОФОНИЧЕСКИЙ ЗВУКОСНИМАТЕЛЬ СТЕРЕОФОНИЯ НА ГОЛОВНЫЕ ТЕЛЕФОНЫ СТЕРЕОФОНИЧЕСКИЙ КОМПЛЕКС БЕСЕДА ДВАДЦАТЬ ПЕРВАЯ. ВВЕДЕНИЕ В ЭЛЕКТРО- И ЦВЕТОМУЗЫКУ О НЕКОТОРЫХ СВОЙСТВАХ МУЗЫКАЛЬНОГО ЗВУКА ТЕРМЕНВОКС ЗВУЧАЩАЯ КЛАВИАТУРА ЭЛЕКТРОННЫЙ РОЯЛЬ ЭЛЕКТРОГИТАРА О ЦВЕТОМУЗЫКЕ ЦВЕТОМУЗЫКАЛЬНАЯ ПРИСТАВКА СВЕТОДИНАМИЧЕСКАЯ УСТАНОВКА БЕСЕДА ДВАДЦАТЬ ВТОРАЯ. ТЕЛЕУПРАВЛЕНИЕ МОДЕЛЯМИ МОДЕЛЬ ИДЕТ НА СВЕТ ДЕШИФРАТОР МОДЕЛЬ, УПРАВЛЯЕМАЯ ЗВУКОМ АППАРАТУРА РАДИОУПРАВЛЕНИЯ МОДЕЛЯМИ БЕСЕДА ДВАДЦАТЬ ТРЕТЬЯ. ПРИГЛАШЕНИЕ В РАДИОСПОРТ ЧТО ТАКОЕ «ЛИСА»? РАДИОКОМПАС ПРИЕМНИК «ЛИСОЛОВА» НА СОРЕВНОВАНИЯХ РАДИОСПОРТСМЕНЫ КОРОТКОВОЛНОВИКИ ТРАНСИВЕР НАЧИНАЮЩЕГО КОРОТКОВОЛНОВИКА БЕСЕДА ДВАДЦАТЬ ЧЕТВЕРТАЯ. НА СТРАЖЕ ОТЧИЗНЫ ОРУЖИЕ РАДИСТА ОРГАНИЗАЦИЯ РАДИОСВЯЗИ РАДИОРЕЛЕЙНАЯ СВЯЗЬ РАДИОЛОКАЦИЯ ЗАКЛЮЧЕНИЕ ПРИЛОЖЕНИЯ 1. МЕЖДУНАРОДНАЯ СИСТЕМА ЕДИНИЦ 2.  УСЛОВНЫЕ БУКВЕННО-ЦИФРОВЫЕ ОБОЗНАЧЕНИЯ НА ЭЛЕКТРИЧЕСКИХ СХЕМАХ УСЛОВНЫЕ БУКВЕННО-ЦИФРОВЫЕ ОБОЗНАЧЕНИЯ НА ЭЛЕКТРИЧЕСКИХ СХЕМАХ |
17.9: Обозначение ячеек и условные обозначения
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49560
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан 9{2–}(aq)}\) в ячейке \(\ce{Zn–Cu}\) обычно не указывают.
По соглашению электрод, записываемый в слева от солевого моста в этой нотации ячейки, всегда считается анодом , а связанное с ним полууравнение всегда записывается как окисление . Таким образом, правый электрод всегда является катодом , а полууравнение всегда записывается как восстановление .
 Это легко запомнить, потому что чтение слева направо дает анод и катод в алфавитном порядке. 9Реакция ячейки 0052 , соответствующая данному сокращенному описанию, получается путем суммирования полууравнений после умножения на любые коэффициенты, необходимые для выравнивания количества электронов, потерянных на аноде, с числом электронов, полученных на катоде. Если не указано иное, обычно подразумеваются стандартные условия 1 M . Однако могут быть созданы нестандартные ячейки.
Это легко запомнить, потому что чтение слева направо дает анод и катод в алфавитном порядке. 9Реакция ячейки 0052 , соответствующая данному сокращенному описанию, получается путем суммирования полууравнений после умножения на любые коэффициенты, необходимые для выравнивания количества электронов, потерянных на аноде, с числом электронов, полученных на катоде. Если не указано иное, обычно подразумеваются стандартные условия 1 M . Однако могут быть созданы нестандартные ячейки.Пример \(\PageIndex{1}\): полуреакции
Напишите полууравнения и реакции ячеек для каждой из следующих ячеек: 9{3+}} \mid \ce{Pt} \nonumber \]
(Поскольку и Fe 2+ , и Fe 3+ находятся в растворе, используется Pt-электрод.)
Условные обозначения, которые мы разработали можно использовать, чтобы решить, действительно ли клеточная реакция является спонтанной. Если это так, то окисление высвободит электроны во внешнюю цепь на левом электроде. Если в цепь поместить вольтметр, эти электроны сделают его левый вывод отрицательным.
 Поскольку правый электрод соответствует восстановлению, электроны будут оттягиваться от правого вывода вольтметра. Это показано для элемента Zn-Cu на рисунке 1 из раздела «Гальванические элементы». Вы можете легко подтвердить, что спонтанная клеточная реакция (уравнение (1) из Galvanic Cells) соответствует сокращенному обозначению ячейки уравнения \(\ref{1}\). 9{2+}(водн.)} \номер\]
Поскольку правый электрод соответствует восстановлению, электроны будут оттягиваться от правого вывода вольтметра. Это показано для элемента Zn-Cu на рисунке 1 из раздела «Гальванические элементы». Вы можете легко подтвердить, что спонтанная клеточная реакция (уравнение (1) из Galvanic Cells) соответствует сокращенному обозначению ячейки уравнения \(\ref{1}\). 9{2+}(водн.)} \номер\]Но это спонтанная клеточная реакция, которую мы описали ранее (уравнение (2) из Galvanic Cells). Поскольку реакция клетки несамопроизвольна, электроны не будут вытеснены во внешнюю цепь на левом электроде и не будут отведены на правый. На самом деле произойдет обратное. Таким образом, если к этой ячейке подключить вольтметр, его правый вывод станет более отрицательным, а левый — более положительным. Это показано на рисунке 2 от Galvanic Cells.
В общем, если гальванический элемент подключен к вольтметру, электрод, подключенный к отрицательной клемме счетчика, должен быть анодом. Если наша сокращенная запись ячейки показывает этот электрод слева, то соответствующая реакция клетки должна быть спонтанной.
 Электроны будут освобождены полууравнением окисления слева и приняты восстановлением справа. Если, с другой стороны, вольтметр показывает, что правый электрод испускает электроны, то мы должны записать нашу сокращенную запись назад . Это значит, что в действительности должна иметь место обратная клеточная реакция, полученная по нашим правилам, и именно эта обратная реакция является самопроизвольной. Таким образом, просто наблюдая, какой электрод в клетке испускает электроны, а какой их принимает, т. е. находя, какой электрод отрицательный, а какой положительный, мы можем определить, является ли реакция клетки самопроизвольной.
Электроны будут освобождены полууравнением окисления слева и приняты восстановлением справа. Если, с другой стороны, вольтметр показывает, что правый электрод испускает электроны, то мы должны записать нашу сокращенную запись назад . Это значит, что в действительности должна иметь место обратная клеточная реакция, полученная по нашим правилам, и именно эта обратная реакция является самопроизвольной. Таким образом, просто наблюдая, какой электрод в клетке испускает электроны, а какой их принимает, т. е. находя, какой электрод отрицательный, а какой положительный, мы можем определить, является ли реакция клетки самопроизвольной.Эта страница под названием 17.9: Обозначение ячеек и условные обозначения распространяется под лицензией CC BY-NC-SA 4.0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Обозначение ячейки
- клеточная реакция
Диаграммы клеток — химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47679
- Вспомнить стандартные условия, которые предполагаются в гальваническом элементе, если никакие условия не заданы
- Произвести соответствующее обозначение электрохимической ячейки для данной электрохимической реакции
- Сначала описывается анодная полуячейка; следует катодный полуэлемент. В пределах данной полуячейки первыми указываются реагенты, а последними — продукты. Описание реакции окисления идет первым, а реакция восстановления последним; когда вы читаете его, ваши глаза движутся в направлении потока электронов. Ионы зрителя не учитываются.
- Одна вертикальная линия ( | ) проведена между двумя химическими веществами, которые находятся в разных фазах, но находятся в физическом контакте друг с другом (например, твердый электрод | жидкость с электролитом). Двойная вертикальная линия ( || ) представляет солевой мостик или пористую мембрану, разделяющую отдельные полуклетки.

- Фаза каждого химического вещества (s, l, g, aq) указана в скобках. Если электролиты в ячейках не соответствуют стандартным условиям, концентрациям и/или давлению, они указаны в скобках с обозначением фаз. Если концентрация или давление не указаны, предполагается, что электролиты в ячейках находятся в стандартных условиях (1,00 М или 1,00 атм и 298 К).
- Анод и катод ячейки (полуэлементы) разделены двумя полосами или косыми чертами, которые представляют солевой мостик.
- Анод расположен слева, а катод справа.

Цели обучения
Cell Notation (Cell Diagrams)
Напомним, что стандартные клеточные потенциалы могут быть рассчитаны из потенциалов E 0 ячейки как для реакций окисления, так и для восстановления.![]() Положительный потенциал клетки указывает на то, что реакция протекает самопроизвольно в том направлении, в котором реакция записана. И наоборот, реакция с отрицательным потенциалом клетки протекает самопроизвольно в обратном направлении.
Положительный потенциал клетки указывает на то, что реакция протекает самопроизвольно в том направлении, в котором реакция записана. И наоборот, реакция с отрицательным потенциалом клетки протекает самопроизвольно в обратном направлении.
Обозначения элементов представляют собой сокращенное описание гальванических или гальванических (самопроизвольных) элементов. Условия реакции (давление, температура, концентрация и т. д.), анод, катод и компоненты электрода описаны в этой уникальной стенограмме.
Напомним, что окисление происходит на аноде, а восстановление — на катоде. Когда анод и катод соединены проводом, электроны текут от анода к катоду.
Типичное расположение полуэлементов, соединенных в гальванический элемент.
Используя расположение компонентов, давайте соберем ячейку.
Один стакан содержит 0,15 М Cd (NO 3 ) 2 и металлический электрод Cd. Другой стакан содержит 0,20 М AgNO 3 и металлический электрод Ag. Итоговое ионное уравнение реакции имеет вид:
Итоговое ионное уравнение реакции имеет вид:
В ходе реакции ион серебра восстанавливается, приобретая электрон, а твердый Ag является катодом. Кадмий окисляется, теряя электроны, и твердый Cd является анодом.
Анодная реакция:
Катодная реакция:
Правила обозначения ячеек
Используя эти правила, обозначение для ячейки, которую мы составили, будет:
Cd (s) | Cd 2+ (водн., 0,15 М) || Ag + (водн., 0,20 М) | Ag(s)
Дайте нам отзыв об этом содержании:
Назначьте чтение концепции
Назначьте только эту концепцию или целые главы вашему классу бесплатно.
Редактировать это содержимое
ПРЕДЫДУЩАЯ КОНЦЕПЦИЯ
Электролизеры
Стандартные восстановительные потенциалы
СЛЕДУЮЩАЯ КОНЦЕПЦИЯ
Упоминается в 3 вопроса викторины
Учитывая следующую информацию, укажите соответствующие обозначения электрохимической ячейки для следующей реакции: ZnSO4(водн. ) + Mn(тв.) Zn(тв.) + MnSO4(водн.) 1,0 М, 1,0 атм и 298 К
) + Mn(тв.) Zn(тв.) + MnSO4(водн.) 1,0 М, 1,0 атм и 298 К
Zn (s) | Zn 2+ || Мн 2+ | Mn (с), Mn (с) | Мн 2+ || Zn 2+ | Zn (т), Zn 2+ | Zn (с) || Мн (с) | Mn 2+ или Mn 2+ | Мн (с) || цинк (с) | Цин 2+
Какие из следующих условий считаются стандартными при написании обозначений электрохимических элементов?a. 1 литр объема раствораb. 1 атмосфера давленияc. 1,00 молярный раствор концентрированный. 298 кельвинов температура
а, б и г, а, в и г, а. b и c или b, c и d
Какое обозначение ячейки для гальванического элемента со следующим уравнением? Pb2+(водн.) + Cd(s) → Pb(s) + Cd2+(водн.)
Pb | Pb2⁺|| Cd2⁺| Cd, Pb2⁺ | свинца || компакт-диск | Cd2⁺, Cd | Cd2⁺|| Pb2⁺ | Pb или Cd | Pb2⁺|| свинца | Cd2
Резюме



 Это легко запомнить, потому что чтение слева направо дает анод и катод в алфавитном порядке. 9Реакция ячейки 0052 , соответствующая данному сокращенному описанию, получается путем суммирования полууравнений после умножения на любые коэффициенты, необходимые для выравнивания количества электронов, потерянных на аноде, с числом электронов, полученных на катоде. Если не указано иное, обычно подразумеваются стандартные условия 1 M . Однако могут быть созданы нестандартные ячейки.
Это легко запомнить, потому что чтение слева направо дает анод и катод в алфавитном порядке. 9Реакция ячейки 0052 , соответствующая данному сокращенному описанию, получается путем суммирования полууравнений после умножения на любые коэффициенты, необходимые для выравнивания количества электронов, потерянных на аноде, с числом электронов, полученных на катоде. Если не указано иное, обычно подразумеваются стандартные условия 1 M . Однако могут быть созданы нестандартные ячейки. Поскольку правый электрод соответствует восстановлению, электроны будут оттягиваться от правого вывода вольтметра. Это показано для элемента Zn-Cu на рисунке 1 из раздела «Гальванические элементы». Вы можете легко подтвердить, что спонтанная клеточная реакция (уравнение (1) из Galvanic Cells) соответствует сокращенному обозначению ячейки уравнения \(\ref{1}\). 9{2+}(водн.)} \номер\]
Поскольку правый электрод соответствует восстановлению, электроны будут оттягиваться от правого вывода вольтметра. Это показано для элемента Zn-Cu на рисунке 1 из раздела «Гальванические элементы». Вы можете легко подтвердить, что спонтанная клеточная реакция (уравнение (1) из Galvanic Cells) соответствует сокращенному обозначению ячейки уравнения \(\ref{1}\). 9{2+}(водн.)} \номер\] Электроны будут освобождены полууравнением окисления слева и приняты восстановлением справа. Если, с другой стороны, вольтметр показывает, что правый электрод испускает электроны, то мы должны записать нашу сокращенную запись назад . Это значит, что в действительности должна иметь место обратная клеточная реакция, полученная по нашим правилам, и именно эта обратная реакция является самопроизвольной. Таким образом, просто наблюдая, какой электрод в клетке испускает электроны, а какой их принимает, т. е. находя, какой электрод отрицательный, а какой положительный, мы можем определить, является ли реакция клетки самопроизвольной.
Электроны будут освобождены полууравнением окисления слева и приняты восстановлением справа. Если, с другой стороны, вольтметр показывает, что правый электрод испускает электроны, то мы должны записать нашу сокращенную запись назад . Это значит, что в действительности должна иметь место обратная клеточная реакция, полученная по нашим правилам, и именно эта обратная реакция является самопроизвольной. Таким образом, просто наблюдая, какой электрод в клетке испускает электроны, а какой их принимает, т. е. находя, какой электрод отрицательный, а какой положительный, мы можем определить, является ли реакция клетки самопроизвольной.