что это такое и как он измеряется
- Статья
- Видео
В природе не все можно объяснить с точки зрения механики, МКТ и термодинамики, есть и электромагнитные явления, которые воздействуют на тело, при этом не зависят от их массы. Способность тел быть источником электромагнитных полей характеризуется физической скалярной величиной – электрическим зарядом. Его впервые вывели в законе Кулона в 1785 году, но обратили внимание на его существование еще до нашей эры. В этой статье мы простыми словами расскажем о том, что такое электрический заряд и как он измеряется.
- История открытий
- Теоретические сведения
- В чем измеряется
- Проводники, полупроводники и диэлектрики
- В чем выражается взаимодействие
- Способы измерения
История открытий
Еще в древности было замечено, что если потереть янтарь о шелковую материю, то камень начнет притягивать к себе легкие предметы. Уильям Гильберт изучал эти опыты до конца XVI века. В отчете о проделанной работе предметы, которые могут притягивать другие тела, назвал наэлектризованными.
Уильям Гильберт изучал эти опыты до конца XVI века. В отчете о проделанной работе предметы, которые могут притягивать другие тела, назвал наэлектризованными.
Следующие открытия в 1729 году сделал Шарль Дюфе, наблюдая за поведением тел при их трении об разные материи. Таким образом он доказал существование двух видов зарядов: первые образуются при трении смолы о шерсть, а вторые – при трении стекла о шелк. Следуя логике, он назвал их «смоляными» и «стеклянными». Бенджамин Франклин также исследовал этот вопрос и ввел понятия положительного и отрицательного заряда. На иллюстрации – Б. Франклин ловит молнию.
Шарлем Кулоном, портрет которого изображен ниже, был открыт закон, который впоследствии был назван Законом Кулона. Он описывал взаимодействие двух точечных зарядов. Также смог измерить величину и изобрел для этого крутильные весы, о которых мы расскажем позже.
И уже в начале прошлого века Роберт Милликен, в результате проведенных опытов, доказал их дискретность. Это значит, что заряд каждого тела равен целому кратному элементарного электрического заряда, а элементарным является электрон.
Это значит, что заряд каждого тела равен целому кратному элементарного электрического заряда, а элементарным является электрон.
Теоретические сведения
Электрическим зарядом называется способность тел создавать электромагнитное поле. В физике раздел электростатики изучает взаимодействия неподвижных относительно выбранной инерциальной системы отчета зарядов.
В чем измеряется
Единица измерения в системе СИ называется «Кулон» – это электрический заряд, проходящий через сечение проводника 1 Ампер за 1 секунду.
Буквенное обозначение – Q или q. Может принимать как положительные, так и отрицательные значения. Название носит в честь физика Шарля Кулона, он вывел формулу для нахождения сил взаимодействия между ними, она называется «Закон Кулона»:
В ней q1, q2 – модули зарядов, r – расстояние между ними, k – коэф-т пропорциональности.
Формула похожа на закон притяжения, в принципе она и описывает подобное взаимодействие. Он имеет наименьшую массу.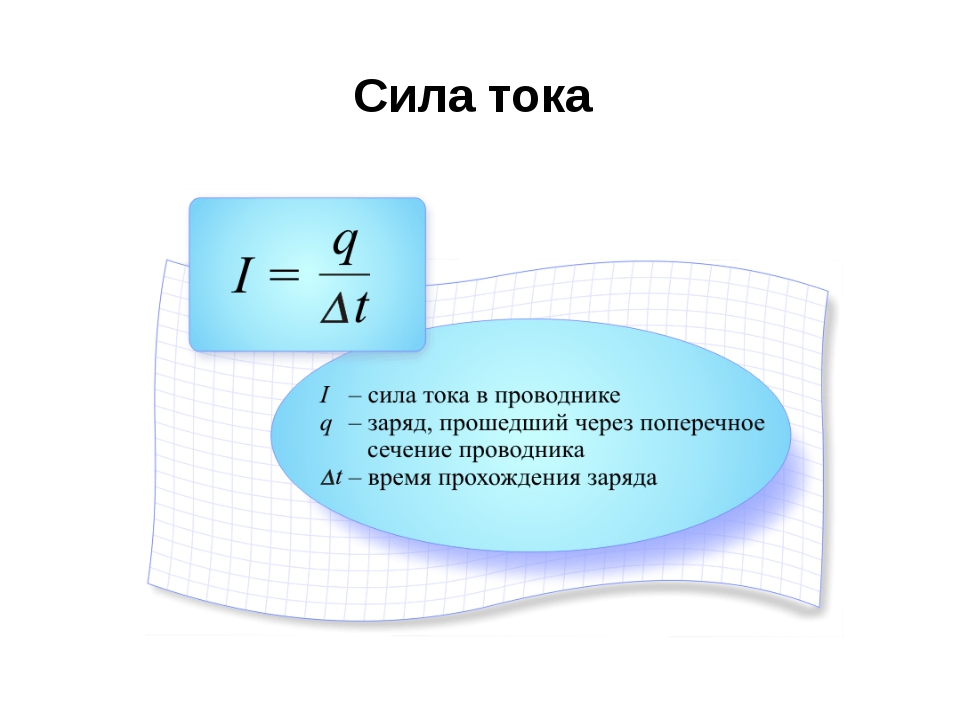 (-19) Кл
(-19) Кл
Позитрон – это противоположная величина электрону, также состоит из одного положительного элементарного заряда.
Кроме того, что он дискретен, квантуется или измеряется порциями, для него еще и справедлив Закон сохранения зарядов, который говорит о том, что в замкнутой системе могут возникать только одновременно заряды обоих знаков. Простым языком – алгебраическая (с учетом знаков) сумма зарядов частиц и тел, в замкнутой (изолированной) системе всегда остается неизменной. Он не изменяется со временем или при движении частицы, он постоянен в течение её времени жизни. Простейшие заряженные частицы условно сравнивают с электрическими зарядами.
Закон сохранения электрических зарядов впервые подтвердил Майкл Фарадей в 1843 году. Это один из фундаментальных законов физики.
Проводники, полупроводники и диэлектрики
В проводниках есть много свободных зарядов. Они свободно перемещаются по всему объему тела. В полупроводниках свободных носителей почти нет, но если передать телу небольшую энергию они образуются, в результате чего тело начинает проводить электрический ток, т. е. электрические заряды начинают движение. Диэлектриками называют вещества, где число свободных носителей минимально, поэтому ток через них протекать не может или может при определенных условиях, например, очень высокое напряжение.
е. электрические заряды начинают движение. Диэлектриками называют вещества, где число свободных носителей минимально, поэтому ток через них протекать не может или может при определенных условиях, например, очень высокое напряжение.
В чем выражается взаимодействие
Электрические заряды притягиваются и отталкиваются друг от друга. Это похоже на взаимодействие магнитов. Всем знакомо, что если потереть линейку или шариковую ручку о волосы – она наэлектризуется. Если в этом состоянии поднести её к бумаге, то она прилипнет к наэлектризованному пластику. При электризации происходит перераспределение зарядов, так что на одной части тела их становится больше, а на другой меньше.
По этой же причине вас иногда бьёт током шерстяной свитер или другие люди, когда вы их касаетесь.
Вывод: электрические заряды с одним знаком стремятся друг к другу, а с разными – отталкиваются. Они перетекают с одного тела на другое, когда касаются друг друга.
Способы измерения
Существует ряд способов измерения электрического заряда, давайте рассмотрим некоторые из них.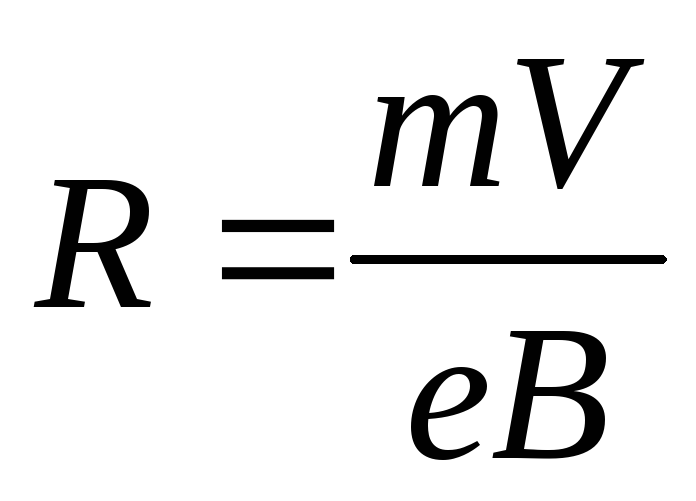
Весы Кулона – это крутильные весы его изобретения. Смысл заключается, в том, что в сосуде на кварцевой нити подвешена легкая штанга с двумя шариками на концах, и один неподвижный заряженный шарик. Вторым концом нить закреплена за колпак. Неподвижный шарик вынимается, для того чтобы сообщить ему заряд, после этого нужно установить его обратно в сосуд. После этого подвешенная на нити часть начнет движение. На сосуде нанесена проградуированная шкала. Принцип его действия отражен на видео.
Другой прибор для измерения электрического заряда – электроскоп. Он, как и предыдущие, представляет собой стеклянный сосуд с электродом, на котором закреплено два металлических листочка из фольги. Заряженное тело подносят к верхнему концу электрода, по которому заряд стекает на фольгу, в результате оба листочка окажутся одноименно заряженными и начнут отталкиваться.
Электрометр – еще один измерительный прибор. Состоит из металлического стержня и вращающейся стрелки. При прикосновении к электрометру заряженным телом, заряды стекают по стержню к стрелке, стрелка отклоняется и указывает на шкале определенную величину.
Напоследок рекомендуем просмотреть еще одно полезное видео по теме:
Мы рассмотрели важную физическую величину. Учения о ней позволили значительно расширить знания об электричестве в целом. Вклад в науку и технику достаточно весомый, а область применения этих знаний связана и с медициной. Ионизаторы воздуха положительно воздействуют на организм человека: ускоряют процесс доставки кислорода из воздуха к клеткам. Примером такого прибора является люстра Чижевского. Теперь вы знаете, что такое электрический заряд и как его измеряют.
- Как перевести ватты в киловатты
- Закон Джоуля-Ленца простыми словами
- Что такое статическое электричество
Выделим в поляризованном диэлектрике наклонную призму с основанием S и ребром L, параллельным вектору поляризации P (рис. 2.4).
В результате поляризации на одном из оснований призмы появятся отрицательные
заряды с поверхностной плотностью ,
а на другой положительные заряды с плотностью . С макроскопической точки зрения, рассматриваемый объем эквивалентен диполю, образованному зарядами и , которые отстоят друг от друга на расстояние L, тогда электрический момент призмы равен . С другой стороны, электрический момент единицы объема равен , где — угол, между направлением нормали к основанию призмы и вектором P. Произведение есть объем призмы. Приравняв друг к другу оба выражения для электрического момента, получаем,
что поверхностная плотность связанных зарядов равна нормальной составляющей
вектора поляризации: , где n — единичный вектор нормали к поверхности диэлектрика. Если вектор поляризации P различен в разных точках объема диэлектрика,
то в диэлектрике возникают объемные поляризационные заряды, объемная
плотность которых . Электрическое поле в диэлектрике. Рассмотрим плоский однородный
диэлектрический слой, расположенный между двумя разноименно заряженными
плоскостями (рис. 2.5). Пусть напряженность электрического поля, которое
создается этими плоскостями в вакууме, равна , где — поверхностная плотность зарядов на пластинах (эти заряды называют свободными). Под действием поля диэлектрик поляризуется, и на его гранях появляются поляризационные или связанные заряды. Эти заряды создают в диэлектрике электрическое поле , которое направлено против внешнего поля . , где — поверхностная плотность связанных зарядов. Результирующее поле внутри диэлектрика . Поверхностная плотность связанных зарядов
меньше плотности
свободных зарядов, и не все поле E0 компенсируется полем
диэлектрика: часть линий напряженности проходит сквозь диэлектрик, другая
часть обрывается на связанных зарядах (рис. , Вопросы 1) Почему заряды имеют различные названия: связанные, свободные заряды,
сторонние, поляризационные | ||||||
Расчет + ярлык для студентов, изучающих органическую химию
Формальное обвинение — это надоедливая концепция, появившаяся в начале органической химии и почему-то кажется, что она никогда не исчезнет.
Почему я называю это надоедливым?
Потому что уравнение в вашем учебнике длинное, запутанное и излишне раздражающее.
Как вы можете позволить себе столько времени при работе над многоэтапным синтезом?
Нельзя!
Вам не нужно.
Тем не менее, понимание природы формального заряда является важным компонентом, когда речь идет о освоении реакций и механизмов органической химии. Формальный заряд помогает вам понять закономерности реакции, показывая, почему конкретный атом атакует и почему его «жертва» принимает атаку.
Так что же такое официальное обвинение?
Формальный заряд — это фактический заряд отдельного атома в более крупной молекуле или многоатомном ионе.
Сумма формальных зарядов любой молекулы или иона дает суммарный общий заряд.
Эта концепция достаточно проста для небольших ионов. Очевидно, что хлорид имеет отрицательный заряд. Даже отрицательный заряд гидроксида кислорода понять несложно.
Но что, если у вас есть гораздо большая группа связанных атомов с общим суммарным зарядом? Например, отрицательный нитрат или тройной отрицательный фосфат.
Откуда берется заряд?
Какой именно атом отвечает за общий заряд?
Может ли быть больше одного атома?
А что, если вы изучаете незаряженную молекулу — могут ли отдельные атомы нести заряд, несмотря на общую нейтральность?
Ответы: да, да, да и еще раз да.
Вспомните общую химию, когда вы изучали образование ионов. Ион — это просто атом или молекула, которые приобрели или потеряли электроны, чтобы получить суммарный заряд.
Если в атоме всего на один отрицательный электрон больше, чем протонов, он будет иметь суммарный отрицательный заряд.
Если атом теряет отрицательно заряженные электроны и поэтому имеет хотя бы один дополнительный ПОЛОЖИТЕЛЬНЫЙ протон в своем ядре, он будет нести суммарный положительный заряд.
Теперь, когда вы знаете, ЧТО мы изучаем, давайте посмотрим, КАК! — Вот тут я могу тебе помочь.
Как рассчитать официальное обвинение
Когда я впервые изучил формальное обвинение, я потерялся. Формула в моем учебнике была длинной, утомительной и жестокой. Долгая, надоедливая поездка в рабочее время моего профессора позволила мне понять это, но это все равно было чрезвычайно УТОМИТЕЛЬНЫМ!
Давайте начнем с правильной формулы, а затем выучим ярлык.
Уравнение формального заряда
Формальный заряд = [# валентных электронов на нейтральном атоме] – [(# неподеленных электронных пар) + (½ # связывающих электронов)]
- Валентные электроны = соответствует номеру группы периодическая таблица (для репрезентативных элементов).
- Одинокие пары = одинокие электроны, сидящие на атоме. Каждый электрон считается за один, поэтому пара считается за два.
- ½ # связывающих электронов = Поскольку связь образуется путем обмена 2 электронами между 2 атомами, каждый атом в связи может получить кредит только за один из 2 электронов.
 Двойная связь, содержащая четыре электрона, позволяет каждому атому претендовать на 2. Тройная связь из 6 электронов позволяет каждому атому претендовать на три.
Двойная связь, содержащая четыре электрона, позволяет каждому атому претендовать на 2. Тройная связь из 6 электронов позволяет каждому атому претендовать на три.
Вы запутались?
Вы боитесь повторять это каждый раз, когда заканчиваете реакцию?
Я с тобой.
Да, уравнение работает, но оно слишком утомительно и раздражает! Слишком много шагов и вычислений.
Вот еще вариант, МОЙ вариант — проще, быстрее и с тем же результатом!
Ярлык для формального расчета стоимости
Вот моя версия этого уравнения.
Готов?
Формальная оплата = Должен – Есть
Определенно быстрее, верно?
Этот ярлык гарантированно сэкономит драгоценные секунды на вашем экзамене, ЕСЛИ И ТОЛЬКО ЕСЛИ вы понимаете, как его применять.
Но когда вы поймете это, вы сможете решить формальный заряд в уме менее чем за 8 секунд на атом.
Давайте удостоверимся, что вы понимаете этот ярлык.
Имеет = количество электронов, которые непосредственно присоединены к атому, касаясь рассматриваемого атома.
Неподеленные пары представляют 2 электрона, сидящих на атоме, так что Has = 2
Каждая связь учитывается только для одного электрона, так как второй электрон в связи касается другого атома.
Хотите, чтобы этот ярлык ожил? См. видео моего формального заряда ниже
. Когда вы впервые изучаете формальный заряд, это помогает нарисовать структуру Льюиса для каждой рассматриваемой молекулы. Когда вы освоитесь с этой темой, вы сможете выбирать связи на чертежах скелетных линий связи.
А пока давайте остановимся на основах (или лучше — давайте будем проще) и рассмотрим несколько примеров, используя контрольный список, представленный в видеоролике Lewis Structures ниже. Это обязательный контрольный список — так что, если вы еще не смотрели, просмотрите это видео:
Это обязательный контрольный список — так что, если вы еще не смотрели, просмотрите это видео:
При работе со структурами Льюиса полезно иметь под рукой периодическую таблицу. Поскольку мы работаем над тем, чтобы сэкономить ваше время, наиболее эффективными результатами будут запоминание следующих 10 атомов. Запоминая их порядок и расположение, обратите особое внимание на следующие тенденции:
- Номера групп, как написано сверху
- Электроотрицательность увеличивается вверх и вправо
- Размер увеличивается вниз и влево
Начнем с более простого примера. Мы уже обсуждали гидроксид, поэтому давайте посмотрим на структуру ОН-Льюиса.
Следуя контрольному списку в видеоролике Lewis Structures, мы имеем кислород, связанный с водородом, с 3 неподеленными парами вокруг кислорода.
Давайте применим сокращение:
Водород должен иметь 1 валентный электрон
Водород имеет один присоединенный электрон Это.
Нейтральный кислород должен иметь 6 валентных электронов
Кислород имеет 7 присоединенных электронов, как показано красным
Должен – Имеет = 6 – 7 = -1
Гидроксид имеет отрицательный формальный заряд на атоме кислорода.
Как насчет нитратов?
Давайте проанализируем структуру и формальный заряд NO3-Льюиса
Следуя контрольному списку, мы нарисуем наши атомы, связи и электроны.
Из-за резонанса мы бы показали три структуры для нитрата. Однако мы просто посмотрим на один ради нашего эксперимента.
Теперь формальный заряд
Должен – Имеет = 5 – 4 = +1
Нейтральный азот должен иметь 5 валентных электронов, но на нашем рисунке показано только 4 прикрепленных.
Далее мы рассмотрим двойной связанный кислород.
Должен – имеет = 6 – 6 = 0
Двойной кислород счастлив, стабилен и имеет чистый нейтральный заряд.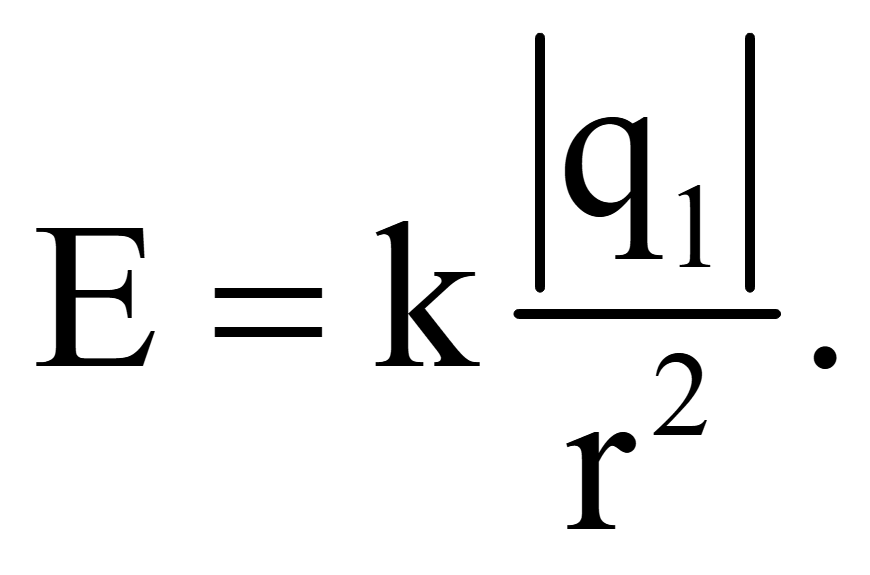
Наконец, у нас есть 2 одиночных связанных атома кислорода с 3 неподеленными парами каждый. Поскольку они идентичны, мы должны вычислить только один, чтобы получить ответ для обоих.
Должен – Имеет = 6 – 7 = -1
Кислород должен иметь 6 валентных электронов, каждый из оставшихся атомов кислорода имеет 7 присоединенных электронов для общего отрицательного заряда.
Давайте попробуем еще один простой, но хитрый пример. Окись углерода.
Простой, потому что состоит всего из 2 атомов.
Сложно, потому что окись углерода нейтральна, но пусть вас это не смущает. Многие гемоглобины были обмануты углекислым газом, что сделало его таким смертельным ядом.
Существует 2 типа молекул с нулевым суммарным зарядом
- молекулы без формального заряда
- молекулы с формальным зарядом, которые компенсируются для нулевого формального заряда.
CO Структура Льюиса и формальный заряд
Начните с контрольного списка структуры Льюиса
Теперь давайте займемся отдельными атомами.
Углерод должен иметь 4, прилагается 5, формальный заряд = -1
Кислород должен иметь 6, прилагается 5, формальный заряд = +1
+1 и -1 аннулируются для чистого формального заряда, равного нулю
Что вы думаете? Вы по-прежнему находите официальное обвинение таким же утомительным и пугающим, как когда вы впервые узнали об этом? Будем надеяться, что сокращение «должно было» придало вам уверенности, что вы просто смотрите на молекулу и получаете мгновенные формальные заряды.
Или вам нужно больше практики со структурами Льюиса, формой, гибридизацией и многим другим? Смотрите ниже!
Буду рад прочитать ваши отзывы в комментариях ниже!
Готовы проверить свои навыки резонанса? Попробуйте мою БЕСПЛАТНУЮ викторину по практике резонанса.

Удельный заряд: определение, формула, уравнение
Атомы состоят из частиц, обладающих электрическим зарядом и массой, которые, однако, чрезвычайно малы. Отношение массы к заряду известно как удельный заряд атома.
Атомы и их заряд
Атомы нейтральны; они не имеют заряда, потому что их частицы уравновешены. Однако если вы уберете или добавите один из их отрицательных зарядов (электронов), у вас получится несбалансированный атом. Атом или частица с зарядом, отличным от нуля, называется ионом. Ионы могут быть положительными (катион) или отрицательными (анион).
- Катион: положительно заряженный ион, имеющий избыток положительных частиц.
- Анион: отрицательно заряженный ион, содержащий избыток отрицательных частиц.
Рис. 1 — Слева направо: анион водорода, нейтральный атом водорода и катион водорода
Удельный заряд электронов и протонов
Удельный заряд могут иметь не только атомы; то же самое верно и для элементарных частиц. Удельный заряд каждой частицы зависит от массы и заряда частицы (см. ниже), что также влияет на удельный заряд атома.
Удельный заряд каждой частицы зависит от массы и заряда частицы (см. ниже), что также влияет на удельный заряд атома.
- Величина удельного заряда электронов больше удельного заряда протонов, потому что протон тяжелее электрона.
- Нейтрон имеет нулевой удельный заряд, так как имеет нейтральный заряд.
- В атоме с равным количеством протонов и электронов удельный заряд равен нулю.
Как рассчитать удельный заряд частицы
Чтобы получить удельный заряд частицы, нужно знать ее массу и электрический заряд. Основываясь на них, мы можем рассчитать удельный заряд, разделив электрический заряд частицы на ее массу:
Масса и заряд атома показаны в обозначении нуклидов, которое определяет количество частиц, составляющих массу ядра, и общее количество протонов в отдельном атоме элемента.
Чтение обозначения нуклида
Обозначение нуклида сообщает нам символ элемента (латинскими буквами) и часть структуры атома, используя его массовое число и атомный номер:
- Массовое число, которое указывает количество протонов и нейтронов, составляющих массу элемента, находится в верхнем левом углу.

- Атомный номер в левом нижнем углу показывает количество протонов в атоме.
См. два примера ниже.
Символ говорит нам, что мы имеем дело с атомом углерода, а число двенадцать указывает на то, что в ядре углерода 12 двенадцать частиц.
Частицы ядра составляют большую часть массы атома. Число шесть дает нам количество положительных зарядов (или протонов) в ядре.
Символ говорит нам, что мы имеем дело с атомом кислорода, а число шестнадцать указывает на то, что в ядре кислорода 16 содержится шестнадцать частиц.
Число восемь дает нам количество положительных зарядов в ядре.
Рис. 2. Обозначение нуклида содержит информацию о структуре атома
Получение электрического заряда
Чтобы получить электрический заряд, нам нужно умножить количество заряженных частиц на значение заряда, как показано в следующих примерах.
Рассчитайте полный заряд ядра гелия.
Нам нужно умножить заряд одного протона на общее количество протонов в ядре. -27кг, хотя нейтроны немного тяжелее.
-27кг, хотя нейтроны немного тяжелее.
Получение удельного заряда
После того, как мы получили общий заряд и общую массу частицы, нам нужно только разделить общий заряд на общую массу, как в следующем примере.
Рассчитайте удельный заряд ядра углерода 12.
Чтобы рассчитать удельный заряд, сначала умножим заряд одного протона на общее число протонов, которое в случае атома углерода равно шести.
Теперь умножим массу частиц, составляющих ядро, на номер частицы, который в данном случае равен двенадцати.
Наконец, вам нужно разделить две величины.
Удельный заряд – основные выводы
- Удельный заряд атома – это отношение его электрического заряда к его массе.
- Величина электрического заряда как электронов, так и протонов одинакова, но заряд электронов отрицательный.
- Масса электронов меньше массы протонов и нейтронов.
- Положительно заряженная частица называется катионом, а отрицательно заряженная частица называется анионом.





 2.5). Вне диэлектрика .
Следовательно, в результате поляризации поле внутри диэлектрика оказывается
слабее, чем внешнее .
Таким образом,
2.5). Вне диэлектрика .
Следовательно, в результате поляризации поле внутри диэлектрика оказывается
слабее, чем внешнее .
Таким образом, Двойная связь, содержащая четыре электрона, позволяет каждому атому претендовать на 2. Тройная связь из 6 электронов позволяет каждому атому претендовать на три.
Двойная связь, содержащая четыре электрона, позволяет каждому атому претендовать на 2. Тройная связь из 6 электронов позволяет каждому атому претендовать на три.
