Хлорметан — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 марта 2019; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 марта 2019; проверки требуют 2 правки.| Хлорметан | |||
|---|---|---|---|
| |||
| Систематическое наименование | Хлорметан | ||
| Традиционные названия | монохлорметан, метилхлорид, фреон 40, R 40, UN 1063 | ||
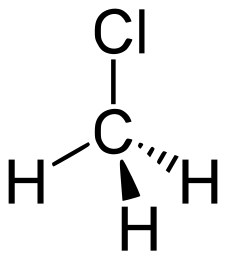
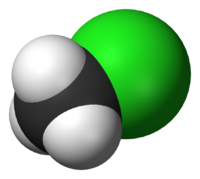
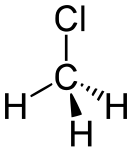
| Хим. формула | CH3Cl | ||
| Рац. формула | CH3Cl | ||
| Состояние | газ | ||
| Молярная масса | 50.49 г/моль | ||
| Плотность | 0.915 г/см³ | ||
| Энергия ионизации | 11,28 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | −97.7 °C | ||
| • кипения | -24.2 °C | ||
| • вспышки | -46 °C | ||
| • самовоспламенения | 625 °C | ||
| Пределы взрываемости | 8,1 ± 0,1 об.%[1] | ||
| Удельная теплота испарения | 423850 Дж/кг | ||
| Давление пара | 490 kPa | ||
| Растворимость | |||
| • в воде | 5.325 г/100 мл | ||
| Гибридизация | тетраэдр | ||
| Рег. номер CAS | 74-87-3 | ||
| PubChem | 6327 | ||
| Рег. номер EINECS | 200-817-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | PA6300000 | ||
| ChEBI | 36014 | ||
| Номер ООН | 1063 | ||
| ChemSpider | 6087 | ||
| Токсичность | ядовит, огнеопасен, канцероген | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Хлормета́н (метилхлори́д) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий ядовитый газ со сладковатым запахом. Из-за слабого запаха можно легко не заметить токсичной или взрывоопасной концентрации.
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции:
- Ch4OH+HCl→Ch4Cl+h3O{\displaystyle {\mathsf {CH_{3}OH+HCl\rightarrow CH_{3}Cl+H_{2}O}}}
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Хлорметан был широкоприменяемым хладагентом. Данное его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец).
Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина.
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Вдыхание газообразного хлорметана оказывает токсическое действие на центральную нервную систему. У пострадавшего возникает сонливость, головокружение, рассеянность, нарушение координации движений, спутанность речи, нарушение дыхания, удушье. При больших концентрациях наступают судороги, параличи и кома.
В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения.
Хроническое воздействие хлорметана вызывает тератогенный эффект.
Хлорметан — это… Что такое Хлорметан?
Хлорметан (метилхлорид) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий газ со сладковатым запахом. Благодаря слабому запаху, можно легко не заметить токсичной или взрывоопасной концентрации.
Производство
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции
CH3OH + HCl → CH3Cl + H2O
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако, этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец). Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количество используется в качестве растворителя при производстве бутилкаучука и очистке бензина. Хлорметан используется как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность
Вдыхание газообразного хлорметана приводит действию на центральную нервную систему, схожую на интоксикацию. Пострадавший может почувствовать сонливость, головокружение, рассеянность и тяжесть дыхания, удушье, неуверенную походку и спутанность речи. При больших концентрациях наступают судороги, паралич и кома. В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения. Хроническое воздействие хлорметана связывают с врождёнными дефектами на мышах. Для людей контакт с хлорметаном во время беременности может вызвать неправильное развития позвоночника, таза, ног, но это не доказано окончательно.
| ||||||||||||||||
| ||||||||||||||||
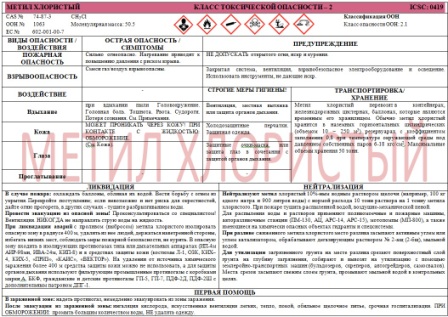
| ВИДЫ ОПАСНОСТИ / ВОЗДЕЙСТВИЯ | ОСТРАЯ ОПАСНОСТЬ / СИМПТОМЫ | ПРЕДУПРЕЖДЕНИЕ | ||||||||||||||
| ПОЖАРНАЯ ОПАСНОСТЬ | Сильно огнеопасно. Нагревание приводит к повышению давления с риском взрыва. | НЕ ДОПУСКАТЬ открытого огня, искр и курения. | ||||||||||||||
| ВЗРЫВООПАСНОСТЬ | Смеси газ/воздух взрывоопасны. | Закрытая система, вентиляция, взрывобезопасное электрооборудование и освещение. Использовать инструменты, не дающие искр. | ||||||||||||||
| ВОЗДЕЙСТВИЕ | – | СТРОГИЕ МЕРЫ ГИГИЕНЫ! | ТРАНСПОРТИРОВКА/ХРАНЕНИЕ | |||||||||||||
| Вдыхание | при вдыхании пыли Головокружение. Головная боль. Тошнота. Рвота. Судороги. Потеря сознания. См. Примечания. | Вентиляция, местная вытяжка или защита органов дыхания. | Метил хлористый перевозят в контейнерах, железнодорожных цистернах, баллонах, которые являются временным его хранилищем. Обычно метил хлористый хранится в наземных горизонтальных цилиндрических (объемом 10 – 250 м3) резервуарах с коэффициентом заполнения 0,8 при температуре окружающей среды под давлением собственных паров 6-18 кгс/см2. Максимальные объемы хранения 50 тонн. | |||||||||||||
| Кожа | МОЖЕТ ПРОНИКАТЬ ЧЕРЕЗ КОЖУ! ПРИ КОНТАКТЕ С ЖИДКОСТЬЮ: ОБМОРОЖЕНИЕ. | Холодозащитные перчатки. Защитная одежда. | ||||||||||||||
| Глаза | (См. Кожа). | Защитные очки-маска, или защита глаз в сочетании с защитой органов дыхания. | ||||||||||||||
| Проглатывание | – | – | ||||||||||||||
| ЛИКВИДАЦИЯ | НЕЙТРАЛИЗАЦИЯ | |||||||||||||||
В случае пожара: охлаждать баллоны, обливая их водой. Вести борьбу с огнем из укрытия. Перекройте поступление; если невозможно и нет риска для окрестностей, дайте огню прогореть, в других случаях – тушите разбрызгиванием воды. Провести эвакуацию из опасной зоны! Проконсультироваться со специалистом! Вентиляция. НИКОГДА не направлять струю воды на жидкость. При ликвидации аварий с проливом (выбросом) метила хлористого изолировать опасную зону в радиусе 400 м, удалить из нее людей, держаться наветренной стороны, избегать низких мест, соблюдать меры пожарной безопасности, не курить. В опасную зону входить в изолирующих противогазах типа или дыхательных аппаратах (ИП-4м АИР-98ми, ИВА-24м, КИП-8) и в средствах защиты кожи (костюмы Л-1, ОЗК, КИХ–4, КИХ-5, «ПРИЗ», «КАИС», «ВЕКТОР»). На удалении от источника химического заражения более 400 м средства защиты кожи можно не использовать, а для защиты органов дыхания используют фильтрующие промышленные противогазы с коробками марки А, БКФ, гражданские и детские противогазы ГП-5, ГП-7, ПДФ-2Д, ПДФ-2Ш с дополнительным патроном ДПГ-1. | Нейтрализуют метил хлористый 10%-ным водным раствором щелочи (например, 100 кг едкого натра и 900 литров воды) с нормой расхода 10 тонн раствора на 1 тонну метила хлористого. При пожаре тушить распыленной водой, воздушно-механической пеной. Для распыления воды и растворов применяют поливомоечные и пожарные машины, авторазливочные станции (ПМ-130, АЦ, АРС-14, АРС-15), мотопомпы (МП-800), а также имеющиеся на химически опасных объектах гидранты и спецсистемы. При разливе сжиженного метила хлористого место разлива засыпают активным углем или углем катализатором, обрабатывают дегазирующим раствором № 2-ащ (2-бщ), мыльной водой. Для утилизации загрязненного грунта на месте разлива срезают поверхностный слой грунта на глубину загрязнения, собирают и вывозят на утилизацию с помощью землеройно-транспортных машин (бульдозеров, скреперов, автогрейдеров, самосвалов). Места срезов засыпают свежим слоем грунта, промывают мыльной водой в контрольных целях.
| |||||||||||||||
| ПЕРВАЯ ПОМОЩЬ | ||||||||||||||||
В зараженной зоне: надеть противогаз, немедленно эвакуировать из зоны заражения. После эвакуации из зараженной зоны: ингаляция кислорода, искусственная вентиляция легких, тепло, покой, обильное щелочное питье, срочная госпитализация. ПРИ ОБМОРОЖЕНИИ: промыть большим количеством воды, НЕ удалять одежду. | ||||||||||||||||
| ВАЖНЫЕ ДАННЫЕ | ||||||||||||||||
ФИЗИЧЕСКОЕ СОСТОЯНИЕ, ВНЕШНИЙ ВИД: ФИЗИЧЕСКАЯ ОПАСНОСТЬ: Газ тяжелее воздуха. и может стелиться по земле; возможно возгорание на расстоянии. и может накапливаться в помещениях с низкими потолками, вызывая недостаток кислорода. См. Примечания. ХИМИЧЕСКАЯ ОПАСНОСТЬ: Вещество разлагается при сжигании с образованием токсичных и едких паров, в том числе хлористого водорода и фосгена. Реагирует бурно с порошкообразным алюминием, порошкообразным цинком, трихлоридом алюминия и этиленом с опасностью пожара и взрыва. Агрессивно в отношении многих металлов в присутствии влаги. | ПУТИ ПОСТУПЛЕНИЯ: РИСК ПРИ ВДЫХАНИИ: ВЛИЯНИЕ КРАТКОВРЕМЕННОГО ВОЗДЕЙСТВИЯ: Жидкость может вызвать обморожение. Вещество может оказывать действие на центральную нервную систему. Воздействие может вызвать потерю сознания. Воздействие на уровне, значительно превышающем OEL может вызвать поражение печени, сердечно-сосудистой системы и почек. Показано медицинское наблюдение. ВЛИЯНИЕ ДОЛГОВРЕМЕННОГО ИЛИ МНОГОКРАТНОГО ВОЗДЕЙСТВИЯ: Вещество может оказывать действие на центральную нервную систему приводя к эффектам, мерой которых служат поведенческие реакции. Исследования на животных показывают, что вещество, возможно, оказывает токсическое действие на репродуктивную функцию человека. | НАЛИЧИЕ ХЛОРМЕТАНА ОПРЕДЕЛЯЮТ: В воздухе производственных помещений: пламенно-ионизационным сигнализатором до взрывных концентраций СДК-3, взрывоопасным искровым пневматическим сигнализатором СВИП-1, СВИП-2. На открытом пространстве: приборами СИП «КОРСАР-Х». В закрытом помещении: приборами СИП «ВЕГА-М»
| ||||||||||||||
| ФИЗИЧЕСКИЕ СВОЙСТВА | ПРЕДЕЛЬНО ДОПУСТИМАЯ КОНЦЕНТРАЦИЯ (ПДК) | |||||||||||||||
Температура кипения: -24.2°C Температура плавления: -97.6°C Относительная плотность (вода = 1): 0.92 Растворимость в воде, г/100 мл при 25°C: 0.5 Давление паров, кПа при 21°C: 506 Относительная плотность пара (воздух = 1): 1.8 Температура вспышки: Горючий газ Температура самовоспламенения: 632°C Пределы взрываемости, объем% в воздухе: 8.1-17.4 | Предельно – допустимая концентрация (ПДК) метила хлористого составляет: в воздухе рабочей зоны производственных помещений 5,0 мг/м3, в воздухе населенных пунктов 0,06 мг/м3. При остром отравлении оказывает наркотическое и выраженное нейротоксическое действие, поражает почки, печень, вызывает отек легких, является мутагеном. Признаки поражения: общая слабость, головокружение, тошнота, рвота, сонливость, повышение температуры, тахикардия, расстройство зрения; в тяжелых случаях затемнение сознания, судороги. Средняя смертельная концентрация составляет 50 мг/м3 в течение 2-х часов. Поражающая токсодоза 90 мг∙мин./л. | |||||||||||||||
| ПРИМЕНЕНИЕ | ||||||||||||||||
| Метил хлористый используется в качестве растворителя при производстве бутилкаучука, инсектофунгицидов, а также для отделения масел, жиров, резинатов в продуктах перегонки нефти и получении пластмасс и фумигантов. Метил хлористый применяется как метилирующий агент в органическом синтезе для получения тетраметила свинца, метилцеллюлозы, кремнийорганических соединений (силанов), используется в лакокрасочной промышленности. | ||||||||||||||||
| ПРИМЕЧАНИЯ | ||||||||||||||||
| После интоксикации пациент должен находиться под постоянным контролем в течении 48 часов. Проверить содержание кислорода перед тем, как входить на участок. | ||||||||||||||||
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ | ||||||||||||||||
ПО КНОПКЕ СКАЧАТЬ
| ||||||||||||||||
Хлорметан — Википедия
Материал из Википедии — свободной энциклопедии
| Хлорметан | |
|---|---|
| Систематическое наименование | Хлорметан |
| Традиционные названия | монохлорметан, метилхлорид, фреон 40, R 40, UN 1063 |
| Хим. формула | CH3Cl |
| Рац. формула | CH3Cl |
| Состояние | газ |
| Молярная масса | 50.49 г/моль |
| Плотность | 0.915 г/см³ |
| Энергия ионизации | 11,28 ± 0,01 эВ[1] |
| Т. плав. | −97.7 °C |
| Т. кип. | -24.2 °C |
| Т. всп. | -46 °C |
| Т. свспл. | 625 °C |
| Пр. взрв. | 8,1 ± 0,1 об.%[1] |
| Удельная теплота испарения | 423850 Дж/кг |
| Давление пара | 490 kPa |
| Растворимость в воде | 5.325 г/100 мл |
| Гибридизация | тетраэдр |
| Рег. номер CAS | 74-87-3 |
| PubChem | 6327 |
| Рег. номер EINECS | 200-817-4 |
| SMILES | |
| InChI | |
| RTECS | PA6300000 |
| ChEBI | 36014 |
| Номер ООН | 1063 |
| ChemSpider | 6087 |
| Токсичность | ядовит, огнеопасен, канцероген |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хлормета́н (метилхлори́д) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий ядовитый газ со сладковатым запахом. Из-за слабого запаха можно легко не заметить токсичной или взрывоопасной концентрации.
Производство
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции:
- Ch4OH+HCl→Ch4Cl+h3O{\displaystyle {\mathsf {CH_{3}OH+HCl\rightarrow CH_{3}Cl+H_{2}O}}}
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец).
Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина.
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность
Вдыхание газообразного хлорметана оказывает токсическое действие на центральную нервную систему. У пострадавшего возникает сонливость, головокружение, рассеянность, нарушение координации движений, спутанность речи, нарушение дыхания, удушье. При больших концентрациях наступают судороги, параличи и кома.
В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения.
Хроническое воздействие хлорметана вызывает тератогенный эффект.
Примечания
Дихлорметан — Википедия
Дихлормета́н (метиленхлорид, хлористый метилен, ДХМ, CH2Cl2) — прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету.
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении равном 5:1
- Ch5+Cl2⟶ Ch4Cl+HCl{\displaystyle {\mathsf {CH_{4}+Cl_{2}\longrightarrow \ CH_{3}Cl+HCl}}}
- Ch4Cl+Cl2⟶ Ch3Cl2+HCl{\displaystyle {\mathsf {CH_{3}Cl+Cl_{2}\longrightarrow \ CH_{2}Cl_{2}+HCl}}}
- Ch3Cl2+Cl2⟶ CHCl3+HCl{\displaystyle {\mathsf {CH_{2}Cl_{2}+Cl_{2}\longrightarrow \ CHCl_{3}+HCl}}}
- CHCl3+Cl2⟶ CCl4+HCl{\displaystyle {\mathsf {CHCl_{3}+Cl_{2}\longrightarrow \ CCl_{4}+HCl}}}
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются ректификацией.
Растворимость в воде 2 % по массе (20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину, муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlCl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан.[2]
Дешевизна, высокая способность растворять многие органические вещества, лёгкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Также нашел применение для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории[править | править код]
Специализированные применения[править | править код]
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Контакт дихлорметана с щелочными металлами приводит к взрыву. Работы с дихлорметаном следует проводить при работающей вытяжной вентиляции.
Дихлорметан способен вызвать наркоз. Он также токсичен: воздействует на печень, почки и селезёнку, способен проникать через кожу, гематоэнцефалитический и плацентарный барьеры.
При остром отравлении при вдыхании дихлорметана наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, головокружение, головные боли, помрачение сознания, рвота и понос. В случае тяжёлого отравления происходит потеря сознания вследствие наркоза вплоть до остановки дыхания. При хронических отравлениях наблюдаются постоянные головные боли, головокружение, потеря аппетита, поражение внутренних органов. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и возникновение диабетической нейропатии.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им.[4]
На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессионального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
ПДК в рабочей зоне 50 мг/м³, в воде водоёмов не более 7.5 мг/л. Концентрационный предел воспламенения 12-22 %. Не горюч, но поддерживает горение, от огня дает вспышку, но не горит сам, горит в смеси с другими горящими материалами внося свой вклад при пожаре, однако пролить на стол около спиртовки его не так опасно как горючие растворители, скорее как масло[источник не указан 806 дней].
- Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с. — ISBN 5-98371-025-7.
- Ошин Л. А. Промышленные хлорорганические продукты. — М.: Химия, 1978. — 656 с. — 8400 экз.
Метил хлористый

ГОСТ 12794-80
ХИМИЧЕСКАЯ ФОРМУЛА: CH3Cl
МОЛЕКУЛЯРНАЯ МАССА: 50,49
Хлорметан (метилхлорид) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий газ со сладковатым запахом. Благодаря слабому запаху, можно легко не заметить токсичной или взрывоопасной концентрации.
НАИМЕНОВАНИЕ ПОКАЗАТЕЛЯ | ЗНАЧЕНИЕ | |
ПЕРВЫЙ СОРТ | ВТОРОЙ СОРТ | |
Массовая доля нелетучего остатка, %, не более | 0,010 | 0,02 |
Показатель активности водородных ионов водного раствора, рН | 3,5-7,0 | 3,5-7,0 |
Содержание метанола и карбонильных соединений | Выдерживает испытание | Выдерживает испытание |
Массовая доля воды, %, не более | 0,008 | 0,02 |
Объемная доля диметилового эфира, %, не более | 0,001 | 0,001 |
Массовая доля двуокиси углерода, %, не более | 0,0005 | 0,005 |
Массовая доля фосфорорганических соединений в пересчете на фосфор, %, не более | 0,00002 | 0,0003 |
ПРИМЕНЕНИЕ: Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец). Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина.
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
ОСОБЫЕ СВОЙСТВА: Горючий газ, образует с воздухом взрывоопасные смеси, пределы воспламенения паров в воздухе: нижний — 5,6%, верхний — 35%. Относится ко 2 классу опасности. Обладает наркотическим действием, раздражает кожные покровы и слизистые оболочки глаз и дыхательных путей. Поражает нервную и сердечнососудистую системы.
ТАРА: Специальные железнодорожные цистерны, предназначенные для перевозки сжиженных газов, и баллоны вместимостью 20-40 дм3. На каждый литр емкости тары допускается наполнять не более 0,75 кг хлористого метила.
ТРАНСПОРТИРОВКА И ХРАНЕНИЕ: Транспортируется в специальных железнодорожных цистернах, предназначенных для перевозки сжиженных газов. Баллоны транспортируют только автотранспортом в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта. Хранить в крытых складских помещениях, отвечающих требованиям правил для складов с ядовитыми горючими сжиженными газами. Гарантийный срок хранения — два месяца со дня изготовления.
Хлорметан — Википедия
Материал из Википедии — свободной энциклопедии
| Хлорметан | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорметан |
| Традиционные названия | монохлорметан, метилхлорид, фреон 40, R 40, UN 1063 |
| Хим. формула | CH3Cl |
| Рац. формула | CH3Cl |
| Физические свойства | |
| Состояние | газ |
| Молярная масса | 50.49 г/моль |
| Плотность | 0.915 г/см³ |
| Энергия ионизации | 11,28 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | −97.7 °C |
| Т. кип. | -24.2 °C |
| Т. всп. | -46 °C |
| Т. свспл. | 625 °C |
| Пр. взрв. | 8,1 ± 0,1 об.%[1] |
| Удельная теплота испарения | 423850 Дж/кг |
| Давление пара | 490 kPa |
| Химические свойства | |
| Растворимость в воде | 5.325 г/100 мл |
| Структура | |
| Гибридизация | тетраэдр |
| Классификация | |
| Рег. номер CAS | 74-87-3 |
| PubChem | 6327 |
| Рег. номер EINECS | 200-817-4 |
| SMILES | |
| InChI | |
| RTECS | PA6300000 |
| ChEBI | 36014 |
| Номер ООН | 1063 |
| ChemSpider | 6087 |
| Безопасность | |
| Токсичность | ядовит, огнеопасен, канцероген |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хлормета́н (метилхлори́д) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий ядовитый газ со сладковатым запахом. Из-за слабого запаха можно легко не заметить токсичной или взрывоопасной концентрации.
Производство
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции:
- Ch4OH+HCl→Ch4Cl+h3O{\displaystyle {\mathsf {CH_{3}OH+HCl\rightarrow CH_{3}Cl+H_{2}O}}}
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец).
Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина.
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность
Вдыхание газообразного хлорметана оказывает токсическое действие на центральную нервную систему. У пострадавшего возникает сонливость, головокружение, рассеянность, нарушение координации движений, спутанность речи, нарушение дыхания, удушье. При больших концентрациях наступают судороги, параличи и кома.
В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения.
Хроническое воздействие хлорметана вызывает тератогенный эффект.


 (
(