Конкурс — Получение водорода тремя способами
Получить водород! До недавнего времени это была моя мечта 🙂 . И я твёрдо решил осуществить ее.
В магазине я приобрёл все необходимые реактивы:
Далее заперся в своей комнате и начал творить! В итоге я в домашних условиях смог повторить все нижеописанные способы получения водорода. И я просто обязан поделиться с вами своими знаниями. Итак, три способа получения водорода.
Способ №1 и все необходимые для него реактивы.
1 Сульфат меди (медный купорос ) его можно купить в любом цветочном магазине ( внимание не путайте с лавками где продоются только цветы нужен магазин с удобрениями ) просто зайдите и скажите что вам нужен медный купорос
2 Обычная пищевая соль
3 фольга (если честно то подойдёт любое алюминиевое изделие будь то ложка или проволока)
Вот собственно и все реактивы. Теперь немного о посуде в которой мы всё это будем делать.
1 Бутылка из толстого стекла ( отлично подойдёт из под вина, пива или шампанского )
2 Кострюля с холодной водой .
Для чего нужно было именно из толстого стекла и с холодной водой? А нужно это поскольку при данной реакции выделяется большоё количество тепла и бутылка может треснуть или вовсе лопнуть.
А теперь начнём!!!! Насыпаем в бутылку примерно четыре ложки сульфата меди и столько же соли ( соли желательно брать немного больше ) добавим воды и всё это тщательно перемешиваем. Если всё сделано правильно то раствор должен стать зелёным, если нет, то добавьте ещё соли. Раствор готов! Начнём кидать туда алюминий ИИИИИИИ УРА-УРА начал выделяться водород, при этом алюминий начнёт ржаветь , а вода начнёт пузыриться.
Но как-же это происходит, как идёт реакция??? Дело в том что образующися хлорид меди смывает защитную пленку с алюминия и на равне с восстановлением меди идет образование водорода.
Способ № 2 и реактивы.
- Гидроксид натрия. Раньше я незнал где его купить, но потом узнал что он продоётся как средство для прочистки труб — крот в любом магазине бытовой химии.
- Алюминий ( ну вы поняли).
Ну бутылка и вода как в способе №1
Нальём крота в бутылку(если у вас сухой и в гранулах, то разбавьте водой ) . Добавим алюминий (его лучше обжечь на костре перед добавлением).
Внимание!!!!!!!! Второй способ ООООчень опасный, советую проделывать его в перчатках( Гидроксид натрия сильно разъедает кожу!!!). Перчаток у меня не нашлось и я делал без них. Потом сильно пожалел. К вечеру у меня все руки были КРАСНЫМИ! и безумно болели. Но самая большая опасность в этой реакции это ВОДОРОД!!!!Его выделяется много!!!! И вообще я не советую проводить этот способ в домашних условиях!!!!
Тут всё тоже самое, только едкая щелочь намного быстрее смывает защитную плёнку с алюминия и далее идёт реакция с выделением водорода
Способ №3.
В этом способе не нужно реактивов. Ну кроме поваренной соли. Этот опыт будет проводится с помощью электролиза. Всё что нужно это пропустить через раствор поваренной соли электричество.Ток должен быть постоянным. ( Водород будет выделяться на аноде, а на катоде небольшие количества кислорода
ПОДЕЛИТЕСЬ С ДРУЗЬЯМИ!
Горение водорода — Википедия
Эта статья описывает физико-химические процессы горения водорода; о ядерном горении водорода в звёздах см. Протон-протонный цикл.Водород считается одним из наиболее перспективных видов топлива и зарекомендовал себя как эффективный и экологически чистый энергоноситель. С практической точки зрения
Смеси водорода с кислородом или воздухом взрывоопасны и называются гремучим газом (название происходит от knallgas, нем. knall — громкий хлопок, резкий звук выстрела или взрыва). При зажигании искрой или другим источником смесь водорода с воздухом небольшого объёма сгорает чрезвычайно быстро, с громким хлопком, что субъективно воспринимается как взрыв. В физике горения такой процесс считается медленным горением, или дефлаграцией, однако гремучий газ способен и к детонации, при этом действие взрыва оказывается существенно более сильным.
Наиболее взрывоопасны смеси с составом, близким к стехиометрическому, в стехиометрической смеси на один моль кислорода приходится два моля водорода, то есть, с учётом того, что в воздухе соотношение кислорода и азота и других не участвующих в горении газов по объёму составляет примерно 21 % : 79 % = 1:3,72, то объёмное соотношение водорода с воздухом в гремучем газе в стехиометрическом соотношении составляет ≈0,42[2]. Однако гремучий газ способен гореть в широком диапазоне концентраций водорода в воздухе, от 4—9 объёмных процентов в бедных смесях и до 75 % в богатых смесях. Приблизительно в этих же пределах он способен и детонировать
Гремучий газ самовоспламеняется при атмосферном давлении и температуре 510 °C. При комнатной температуре в отсутствие источников зажигания (искра, открытое пламя) гремучий газ может храниться неограниченно долго, однако он способен взорваться от самого слабого источника, так как для инициирования взрыва достаточно искры с энергией 17 микроджоулей[4]. С учётом того, что водород обладает способностью проникать через стенки сосудов, в которых он хранится, например, диффундировать сквозь металлические стенки газового баллона, и не обладает никаким запахом, при работе с ним следует быть чрезвычайно осторожным.
В 1766 г. Генри Кавендиш получил водород в реакции металла с кислотой:
- Fe+h3SO4⟶FeSO4+h3{\displaystyle {\ce {Fe + h3SO4 -> FeSO4 + h3}}}.
В лабораторных условиях гремучий газ можно получить электролизом воды в реакции:
- 2h3O⟶2h3+O2{\displaystyle {\ce {2h3O -> 2h3 + O2}}}.
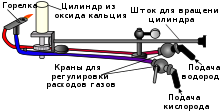
В XIX веке для освещения в театрах использовался так называемый друммондов свет, где свечение получалось с помощью пламени кислород-водородной смеси, направленного непосредственно на цилиндр из негашёной извести, которая может нагреваться до высоких температур (белого каления) без расплавления. В пламени кислород-водородной смеси достигается высокая температура, и также в XIX веке это нашло применение в паяльных лампах для плавления тугоплавких материалов, резки и сварки металлов. Однако все эти попытки применения гремучего газа были ограничены тем, что он очень опасен в обращении, и были найдены более безопасные варианты решения этих задач.
В настоящее время водород считается перспективным топливом для водородной энергетики. При горении водорода образуется чистая вода, поэтому этот процесс считается экологически чистым. Основные проблемы связаны с тем, что затраты на производство, хранение и транспортировку водорода к месту его непосредственного применения слишком высоки, и при учёте всей совокупности факторов водород пока не может конкурировать с традиционными углеводородными топливами.
Кинетическая схема горения водорода[править | править код]
Горение водорода формально выражается суммарной реакцией:
- 2h3+O2⟶2h3O{\displaystyle {\ce {2h3 + O2 -> 2h3O}}}.
Однако эта суммарная реакция не описывает разветвлённые цепные реакции, протекающие в смесях водорода с кислородом или воздухом. В реакциях участвуют восемь компонентов: H2, O2, H, O, OH, HO2, H2O, H2O
В силу того, что механизм горения водорода является одним из наиболее простых по сравнению с механизмами горения прочих газообразных топлив, таких, например, как синтез-газ или углеводородные топлива, а кинетические схемы горения углеводородных топлив включают в себя все компоненты и элементарные реакции из механизма горения водорода, он изучается чрезвычайно интенсивно многими группами исследователей[5][6]
Критические явления при воспламенении[править | править код]
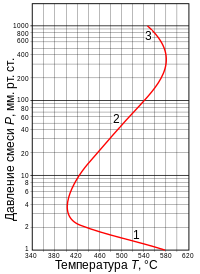 Полуостров самовоспламенения смеси H2 + O2. Цифрами 1, 2 и 3 помечены соответственно первый, второй и третий пределы воспламенения[8].
Полуостров самовоспламенения смеси H2 + O2. Цифрами 1, 2 и 3 помечены соответственно первый, второй и третий пределы воспламенения[8].При комнатной температуре стехиометрическая смесь водорода и кислорода может храниться в закрытом сосуде неограниченно долго. Однако при повышении температуры сосуда выше некоторого критического значения, зависящего от давления, смесь воспламеняется и сгорает чрезвычайно быстро, со вспышкой или взрывом. Это явление нашло своё объяснение в теории цепных реакций, за которую Н. Н. Семёнов и Сирил Хиншелвуд были удостоены Нобелевской премии по химии 1956 года.
Кривая зависимости между критическими давлением и температурой, при которых происходит самовоспламенение смеси, имеет характерную Z-образную форму, как показано на рисунке. Нижняя, средняя и верхняя ветви этой кривой называются соответственно первым, вторым и третьим пределами воспламенения. Если рассматриваются только первые два предела, то кривая имеет форму полуострова, и традиционно этот рисунок называется полуостровом воспламенения.
В 1960-е года американский инженер Уильям Роудс (William Rhodes) якобы открыл «новую форму» воды, коммерциализированную Юллом Брауном (Yull Brown), болгарским физиком, эмигрировавшим в Австралию. «Брауновский газ», то есть фактически смесь кислорода и водорода, получаемая в аппарате электролиза воды, объявлялся способным очищать радиоактивные отходы, гореть как топливо, расслаблять мышцы и стимулировать проращивание семян[9]. Впоследствии итальянский физик Руджеро Сантилли (en:Ruggero Santilli) выдвинул гипотезу, утверждающую существование новой формы воды в виде «газа HHO», то есть химической структуры вида (H × H — O), где «×» представляет гипотетическую магнекулярную связь, а «—» — обычную ковалентную связь. Статья Сантилли, опубликованная в авторитетном реферируемом журнале International Journal of Hydrogen Energy[10], вызвала жёсткую критику со стороны коллег, назвавших утверждения Сантилли псевдонаучными[11], однако некоторые другие учёные выступили в поддержку Сантилли[12][13].
- ↑ Sánchez, Williams — review, 2014.
- ↑ Уравнение горения стехиометрической водородно-воздушной смеси: 0,21·2Н2 + 0,21О2 + 0,79(N2 + …) → 0,42H2O + 0,79(N2+…).
- ↑ Гельфанд и др., Водород: параметры горения и взрыва, 2008, с. 85,196.
- ↑ Корольченко, Пожаровзрывоопасность веществ, 2004, с. 311.
- ↑ Konnov A. A. Remaining uncertainties in the kinetic mechanism of hydrogen combustion // Combustion and Flame. — Elsevier, 2008. — Vol. 152, № 4. — P. 507–528. — doi:10.1016/j.combustflame.2007.10.024.
- ↑ Shimizu K., Hibi A., Koshi M., Morii Y., Tsuboi N. Updated Kinetic Mechanism for High-Pressure Hydrogen Combustion // Journal of Propulsion and Power. — American Institute of Aeronautics and Astronautics, 2011. — Vol. 27, № 2. — P. 383–395. — doi:10.2514/1.48553.
- ↑ Burke M. P., Chaos M., Ju Y., Dryer F. L., Klippenstein S. J. Comprehensive H2/O2 kinetic model for high-pressure combustion // International Journal of Chemical Kinetics. — Wiley Periodicals, 2012. — Vol. 44, № 7. — P. 444–474. — doi:10.1002/kin.20603.
- ↑ Льюис, Эльбе, Горение, пламя и взрывы в газах, 1968, с. 35.
- ↑ Ball, Philip. Nuclear waste gets star attention (англ.) // Nature : journal. — 2006. — ISSN 1744-7933. — doi:10.1038/news060731-13.
- ↑ Ruggero Maria Santilli. A new gaseous and combustible form of water (англ.) // International Journal of Hydrogen Energy : journal. — 2006. — Vol. 31, no. 9. — P. 1113—1128. — doi:10.1016/j.ijhydene.2005.11.006.
- ↑ J. M. Calo. Comments on «A new gaseous and combustible form of water» by R.M. Santilli (Int. J. Hydrogen Energy 2006: 31(9), 1113–1128) (англ.) // International Journal of Hydrogen Energy : journal. — 2006. — 3 November (vol. 32, no. 9). — P. 1309—1312. — doi:10.1016/j.ijhydene.2006.11.004. Архивировано 1 августа 2013 года.
- ↑ Martin O. Cloonan. A chemist’s view of J.M. Calo’s comments on: «A new gaseous and combustible form of water» by R.M. Santilli (Int. J. Hydrogen Energy 2006:31(9), 1113–1128) (англ.) // International Journal of Hydrogen Energy : journal. — 2008. — Vol. 33, no. 2. — P. 922—926. — doi:10.1016/j.ijhydene.2007.11.009. Архивировано 20 марта 2012 года.
- ↑ J.V. Kadeisvili. Rebuttal of J.M. Calo’s comments on R.M. Santilli’s HHO paper (англ.) // International Journal of Hydrogen Energy : journal. — 2008. — Vol. 33, no. 2. — P. 918—921. — doi:10.1016/j.ijhydene.2007.10.030. Архивировано 20 марта 2012 года.
- Льюис Б., Эльбе Г. Горение, пламя и взрывы в газах. 2-е изд. Пер. с англ. под ред. К. И. Щёлкина и А. А. Борисова. — М.: Мир, 1968. — 592 с.
- Гельфанд Б. Е., Попов О. Е., Чайванов Б. Б. Водород: параметры горения и взрыва. — М.: Физматлит, 2008. — 288 с. — 700 экз. — ISBN 9785922108980.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.
Обзоры[править | править код]
Жидкий водород — Википедия
Жи́дкий водоро́д (ЖВ, жh3, жH2, Lh3, LH2) — жидкое агрегатное состояние водорода, с низкой плотностью − 0,07 г/см³, и криогенными свойствами с точкой замерзания 14,01 K (−259,14 °C) и точкой кипения 20,28 K (−252,87 °C)[1]. Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4—75 %. Спиновое соотношение изомеров в жидком водороде[en] составляет: 99,79 % — параводород; 0,21 % — ортоводород[2]. Коэффициент расширения[en] водорода при смене агрегатного состояния на газообразное при комнатной температуре составляет 848:1.
Как и для любого другого газа, сжижение водорода приводит к уменьшению его объёма. После сжижения жидкий водород хранится в термически изолированных контейнерах под давлением. Жидкий водород используется в промышленности (в качестве формы хранения газа) и в космонавтике (в качестве ракетного топлива).
Первое документированное использование искусственного охлаждения в 1756 году было осуществлено английским учёным Вильямом Калленом[3], Гаспар Монж первым получил жидкое состояние оксида серы в 1784 году, Майкл Фарадей первым получил сжиженный аммиак, американский изобретатель Оливер Эванс первым разработал холодильный компрессор в 1805 году, Яков Перкинс первым запатентовал охлаждающую машину в 1834 году и Джон Гори первым в США запатентовал кондиционер в 1851 году[4][5], Вернер Сименс предложил концепцию регенеративного охлаждения в 1857 году, Карл Линде запатентовал оборудование для получения жидкого воздуха с использованием каскадного «эффекта расширения Джоуля — Томсона» и регенеративного охлаждения[6] в 1876 году. В 1885 году польский физик и химик Зигмунд Вро́блевский опубликовал критическую температуру водорода 33 K, критическое давление 13.3 атм. и точку кипения при 23 K. Впервые водород был сжижен Джеймсом Дьюаром в 1898 году с использованием регенеративного охлаждения и своего изобретения, сосуда Дьюара. Первый синтез устойчивого изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году.
Водород при комнатной температуре состоит на 75 % из спинового изомера, ортоводорода. После производства жидкий водород находится в метастабильном состоянии и должен быть преобразован в параводородную форму, для того чтобы избежать спонтанной экзотермической реакции его превращения, приводящей к сильному самопроизвольному испарению полученного жидкого водорода. Преобразование в параводородную фазу обычно производится с использованием таких катализаторов, как оксид железа, оксид хрома, активированный уголь, покрытых платиной асбестов, редкоземельных металлов или путём использования урановых или никелевых добавок[7].

Жидкий водород может быть использован в качестве формы хранения топлива для двигателей внутреннего сгорания и топливных элементов. Различные проекты водородного транспорта были созданы с использованием этой агрегатной формы водорода (см. например DeepC[en] или BMW h3R[en]). Благодаря близости конструкций, создатели техники на «ЖВ» могут использовать или только дорабатывать системы, использующие сжиженный природный газ («СПГ»). Однако из-за более низкой объёмной плотности энергии для горения требуется больший объём водорода, чем природного газа. Если жидкий водород используется вместо «СПГ» в поршневых двигателях, обычно требуется более громоздкая топливная система. При прямом впрыске увеличившиеся потери во впускном тракте уменьшают наполнение цилиндров.
Жидкий водород используется также для охлаждения нейтронов в экспериментах по нейтронному рассеянию. Массы нейтрона и ядра водорода практически равны, поэтому обмен энергией при упругом столкновении наиболее эффективен.
Преимущества[править | править код]
Преимуществом использования водорода является «нулевая эмиссия» его применения. Продуктом его взаимодействия с кислородом в воздухе является вода, но в реальности — как и в случае с обычными ископаемыми энергоносителями — из-за наличия в воздухе молекул азота при его горении образуется также незначительное количество оксидов этого газа. В качестве топлива для транспортных средств, эксплуатируемых на открытом воздухе, водород при авариях и протечках не скапливается на месте, а уходит вверх, в атмосферу, что снижает пожароопасность.
Препятствия[править | править код]
Один литр «ЖВ» весит всего 0,07 кг. То есть его удельная плотность составляет 70,99 г/л при 20 K. Жидкий водород требует криогенной технологии хранения, такой как специальные теплоизолированные ёмкости и требует особого обращения, что свойственно для всех криогенных материалов. Он близок в этом отношении к жидкому кислороду, но требует большей осторожности из-за пожароопасности. Даже в случае с ёмкостями с тепловой изоляцией его тяжело содержать при той низкой температуре, которая требуется для его сохранения в жидком состоянии (обычно он испаряется со скоростью 1 % в день[8]). При обращении с ним также нужно следовать обычным мерам безопасности при работе с водородом («Водородная безопасность») — он достаточно холоден для сжижения воздуха, что взрывоопасно. Жидкий водород при атмосферном давлении имеет очень узкий температурный диапазон стабильности — всего 7 градусов Цельсия, что создает определенные трудности при хранении.
Жидкий водород является распространенным компонентом ракетного топлива, которое используется для реактивного ускорения ракет-носителей и космических аппаратов. В большинстве жидкостных ракетных двигателей на водороде, он сначала применяется для регенеративного охлаждения сопла и других частей двигателя, перед его смешиванием с окислителем и сжиганием для получения тяги. Используемые современные двигатели на компонентах H2/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульса двигателя за счет уменьшения молекулярного веса, это ещё сокращает эрозию сопла и камеры сгорания.
Такие препятствия использования ЖВ в других областях, как криогенная природа и малая плотность, являются также сдерживающим фактором для использования в данном случае. На 2009 год существует только одна ракета-носитель («Дельта-4»), которая целиком является водородной ракетой. В основном ЖВ используется либо на верхних ступенях ракет, либо на разгонных блоках, которые значительную часть работы по выводу полезной нагрузки в космос выполняют в вакууме. В качестве одной из мер по увеличению плотности этого вида топлива существуют предложения использования шугообразного водорода, то есть полузамерзшей формы ЖВ.
Водород с разными окислителями[править | править код]
Данные приводятся на основании[9] таблиц, опубликованных в США в рамках проекта сбора термодинамических данных «JANAF» (англ. Joint Army Navy Air Force, «Сборник ВМС и ВВС армии США»), которые широко используются в этих целях. Изначально вычисления производились компанией «Рокетдайн».[10] При этом делались предположения, что имеет место адиабатическое сгорание, изоэнтропийное расширение в одном направлении и имеет место смещение равновесного состояния. Кроме варианта использования водорода в качестве топлива, приводятся варианты с использованием водорода в качестве рабочего тела, что объясняется его небольшим молекулярным весом. Все данные рассчитаны для давления в камере сгорания («КС»), равного 68,05 атмосфер. Последняя строка таблицы содержит данные для газообразных водорода и кислорода.
| Оптимальное расширение от 68.05 атм до условий: | поверхности Земли (1 атм) | вакуума (0 атм, расширение сопла 40:1) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Окислитель | Топливо | Комментарий | Ve | r | Tc | d | C* | Ve | r | Tc | d | C* |
| жO2 | H2 | распространено | 3816 | 4.13 | 2740 | 0.29 | 2416 | 4462 | 4.83 | 2978 | 0.32 | 2386 |
| H2-Be 49/51 | 4498 | 0.87 | 2558 | 0.23 | 2833 | 5295 | 0.91 | 2589 | 0.24 | 2850 | ||
| CH4/H2 92.6/7.4 | 3126 | 3.36 | 3245 | 0.71 | 1920 | 3719 | 3.63 | 3287 | 0.72 | 1897 | ||
| F2 | H2 | 4036 | 7.94 | 3689 | 0.46 | 2556 | 4697 | 9.74 | 3985 | 0.52 | 2530 | |
| H2-Li 65.2/34.0 | 4256 | 0.96 | 1830 | 0.19 | 2680 | |||||||
| H2-Li 60.7/39.3 | 5050 | 1.08 | 1974 | 0.21 | 2656 | |||||||
| OF2 | H2 | 4014 | 5.92 | 3311 | 0.39 | 2542 | 4679 | 7.37 | 3587 | 0.44 | 2499 | |
| F2/O2 30/70 | H2 | 3871 | 4.80 | 2954 | 0.32 | 2453 | 4520 | 5.70 | 3195 | 0.36 | 2417 | |
| O2 | H2 | 3997 | 3.29 | 2576 | — | 2550 | 4485 | 3.92 | 2862 | — | 2519 | |
при этом «Ve» является той же единицей, что и удельный импульс, но приведена к размерности скорости [Н*сек/кг], а «C*» вычисляется путём умножения давления в камере сгорания на коэффициент расширения площади сопла и последующего деления на массовый расход топлива и окислителя, что дает приращение скорости на единицу массы.
Жидкий водород довольно опасен для человека. Попадание ЖВ на кожу может вызвать обморожение, а вдыхание паров привести к отёку легких.
- ↑ IPTS-1968 (en)
- ↑ Жидкий воздух/водород (en)
- ↑ Уильям Каллен, «О производстве холода, произведенного при испарении жидкостей и некоторые другие способы получения холода», в «Essays and Observations Physical and Literary Read Before a Society in Edinburgh and Published by Them, II», (Эдинбург, 1756) (en)
- ↑ США: 1851 Джон Гори (en)
- ↑ США: 1851 Патент 8080 (en)
- ↑ НАСА: Водород в течение XIX века (en)
- ↑ Преобразование водорода «Орто-Пара». Стр. 13 Архивировано 16 декабря 2008 года. (en)
- ↑ Водород в качестве альтернативного топлива Архивировано 8 августа 2008 года. (en)
- ↑ NIST-JANAF Thermochemical Tables 2 Volume-Set, (Journal of Physical and Chemical Reference Data Monographs), Hardcover: 1951 pp, Publisher: American Institute of Physics; 4th edition (1 августа 1998), Language: English, ISBN 1-56396-831-2, ISBN 978-1-56396-831-0
- ↑ Modern Engineering for Design of Liquid-Propellant Rocket Engines, (Progress in Astronautics and Aeronautics), Huzel and Huang, Rocketdyne division of Rockwell International
Биоводород — Википедия
Материал из Википедии — свободной энциклопедии
 Производство водорода с помощью водорослей
Производство водорода с помощью водорослейБиоводород — водород, полученный из биомассы.
В настоящее время во всём мире ежегодно производится около 50 млн тонн водорода. Из них примерно 48 % производится из природного газа, 30 % из нефти, и 18 % из угля. При производстве водорода из углеводородов получается большое количество СО2, который является одной из причин глобального потепления. К тому же не все страны обладают собственными углеводородами. Решением этих проблем может стать производство водорода из биомассы.
Водород из биомассы получается термохимическим или биохимическим способом.
При термохимическом методе биомассу нагревают без доступа кислорода до температуры 500—800 °C (для отходов древесины), что намного ниже температуры процесса газификации угля. В результате процесса выделяется H2, CO и CH4.
Себестоимость процесса $5—7 за килограмм водорода. В будущем возможно снижение до $1,0—3,0.
В биохимическом процессе водород вырабатывают различные бактерии, например, Rodobacter speriodes, Enterobacter cloacae.
Возможно применение различных энзимов для ускорения производства водорода из полисахаридов (крахмал, целлюлоза), содержащихся в биомассе. Процесс проходит при температуре 30 °C и нормальном давлении. Себестоимость водорода около $2 за кг.
Учёные Калифорнийского университета в Беркли в 1999 году обнаружили, что если водорослям не хватает кислорода и серы, то процессы фотосинтеза у них резко ослабевают и начинается бурная выработка водорода.
Водород может производить группа зелёных водорослей, например, Chlamydomonas reinhardtii. Водоросли могут производить водород из морской воды, или канализационных стоков.
Водород может производиться риформингом биогаза или лэндфилл-газа.
Как сделать водородный генератор — советы и пошаговые инструкции
Здесь вы узнаете:
Перед тем, как сделать водородный генератор, необходимо изучить все тонкости — экономическую целесообразность, безопасность. Предлагаем несколько простых схем и конструкций водородного генератора.
Описание и принцип работы водородного генератора
Есть несколько методик выделения водорода и из других веществ, перечислим наиболее распространенные:
- Электролиз, данная методика наиболее простая и может быть реализована в домашних условиях. Через водный раствор, содержащий соль, пропускается постоянный электрический ток, под его воздействием происходит реакция, которую можно описать следующим уравнением: 2NaCl + 2h3O→2NaOH + Cl2 + h3↑. В данном случае пример приведен для раствора обычной кухонной соли, что не лучший вариант, поскольку выделяющийся хлор является ядовитым веществом. Заметим, что полученный данным способом водород наиболее чистый (порядка 99,9%).
- Путем пропускания водяного пара над каменноугольным коксом, нагретым до температуры 1000°С, при таких условиях протекает следующая реакция: Н2О + С ⇔ СО↑ + h3↑.
- Добыча из метана путем конверсии с водяным паром (необходимое условие для реакции – температура 1000°С): СН4 + Н2О ⇔ СО + 3Н2. Второй вариант – окисление метана: 2СН4 + О2 ⇔ 2СО + 4Н2.
- В процессе крекинга (переработки нефти) водород выделяется в качестве побочного продукта. Заметим, что в нашей стране все еще практикуется сжигание этого вещества на некоторых нефтеперерабатывающих заводах ввиду отсутствия необходимого оборудования или достаточного спроса.
Из перечисленных вариантов последний наименее затратный, а первый наиболее доступный, именно он положен в основу большинства генераторов водорода, в том числе и бытовых. Их принцип действия заключается в том, что в процессе пропускания тока через раствор, положительный электрод притягивает отрицательные ионы, а электрод с противоположным зарядом – положительные, в результате происходит расщепление вещества.

Пример электролиза на растворе хлорида натрия
Основные достоинства отопления на водороде
Данный способ обогрева дома имеет несколько существенных преимуществ, которыми обусловлена возрастающая популярность системы.
- Впечатляющий КПД, который нередко достигает 96%.
- Экологичность. Единственный побочный продукт, выделяющийся в атмосферу – это водяной пар, который не способен навредить окружающей среде в принципе.
- Водородное отопление постепенно заменяет традиционные системы, освобождая людей от необходимости в добыче природных ресурсов – нефти, газа, угля.
- Водород действует без огня, тепловая энергия образуется путем каталитической реакции.
Область применения
Сегодня электролизёр — такое же привычное устройство, как и генератор ацетилена или плазменный резак. Изначально водородные генераторы использовались сварщиками, поскольку носить за собой установку весом всего несколько килограмм было намного проще, чем перемещать огромные кислородные и ацетиленовые баллоны. При этом высокая энергоёмкость агрегатов решающего значения не имела — всё определяло удобство и практичность. В последние годы применение газа Брауна вышло за рамки привычных понятий о водороде, как топливе для газосварочных аппаратов. В перспективе возможности технологии очень широки, поскольку использование HHO имеет массу достоинств.
- Сокращение расхода горючего на автотранспорте. Существующие автомобильные генераторы водорода позволяют использовать HHO как добавку к традиционному бензину, дизелю или газу. За счёт более полного сгорания топливной смеси можно добиться 20 – 25 % снижения потребления углеводородов.
- Экономия топлива на тепловых электростанциях, использующих газ, уголь или мазут.
- Снижение токсичности и повышение эффективности старых котельных.
- Многократное снижение стоимости отопления жилых домов за счёт полной или частичной замены традиционных видов топлива газом Брауна.
- Использование портативных установок получения HHO для бытовых нужд — приготовления пищи, получения тёплой воды и т. д.
- Разработка принципиально новых, мощных и экологичных силовых установок.
Генератор водорода, построенный с использованием «Технологии водяных топливных ячеек» С. Мейера (а именно так назывался его трактат) можно купить — их изготовлением занимается множество компаний в США, Китае, Болгарии и других странах. Мы же предлагаем изготовить водородный генератор самостоятельно.
Конструкция водородного генератора
Для постройки генераторов водорода своими руками обычно берут в качестве основы классическую схему установки Брауна. Такой электролизёр средней мощности состоит из группы ячеек, каждая из которых содержит группу пластинчатых электродов. Мощность установки определяется общей площадью поверхности пластинчатых электродов.
Ячейки помещаются внутрь ёмкости, хорошо изолированной от внешней среды. На корпус резервуара выводятся патрубки для подключения водяной магистрали, вывода водорода, а также контактная панель подключения электричества.

Аппарат генерации водорода, спроектированный по схеме Брауна. По всем расчётам эта установка вполне должна обеспечить домашнее хозяйство теплом и светом. Другой вопрос – какие габариты и мощности позволят это сделать (+)
Схема генератора Брауна, кроме всего прочего, предусматривает наличие водяного затвора и обратного клапана. За счёт этих элементов организуется защита установки от обратного хода водорода. По такой схеме теоретически не исключается сборка водородной установки, к примеру, для организации отопления загородного дома.
Как изготовить генератор
Масса интернет-ресурсов публикуют самые разные схемы и чертежи генератора для получения водорода, но все они действуют по одному принципу. Мы предложим вашему вниманию чертеж простого устройства, взятый из научно-популярной литературы:

Здесь электролизер представляет собой группу металлических пластин, стянутых между собой болтами. Между ними установлены изоляционные прокладки, крайние толстые обкладки тоже изготовлены из диэлектрика. От штуцера, вмонтированного в одну из обкладок, идет трубка для подачи газа в сосуд с водой, а из него – во второй. Задача емкостей – отделять паровую составляющую и накапливать смесь водорода с кислородом, чтобы подавать его под давлением.
Совет. Электролитические пластины для генератора надо делать из нержавеющей стали, легированной титаном. Он послужит дополнительным катализатором реакции расщепления.

Пластины, что служат электродами, могут быть произвольного размера. Но надо понимать, что производительность аппарата зависит от их площади поверхности. Чем большее число электродов удастся задействовать в процессе, тем лучше. Но при этом и потребляемый ток будет выше, это следует учитывать. К концам пластин припаиваются провода, ведущие к источнику электричества. Здесь тоже есть поле для экспериментов: можно подавать на электролизер разное напряжение с помощью регулируемого блока питания.

В качестве электролизера можно применить пластиковый контейнер от водяного фильтра, поместив в него электроды из нержавеющих трубок. Изделие удобно тем, что его легко герметизировать от окружающей среды, выводя трубку и провода через отверстия в крышке. Другое дело, что этот самодельный водородный генератор обладает невысокой производительностью из-за малой площади электродов.

Делаем простейший генератор водорода своими руками пошагово
Расскажем, как можно сделать самодельный генератор для получения смеси водорода и кислорода (ННО). Его мощности на отопления дома не хватит, но для газовой горелки для резки металла количество полученного газа будет достаточным.

Рис. 8. Схема газовой горелки
Обозначения:
- а – сопло горелки;
- b – трубки;
- c – водные затворы;
- d – вода;
- е – электроды;
- f – герметичный корпус.
В первую очередь делаем электролизер, для этого нам понадобится герметичная емкость и электроды. В качестве последних используем стальные пластины (их размер выбираем произвольно, в зависимости от желаемой производительности), прикрепленные к диэлектрическому основанию. Соединяем между собой все пластины каждого из электродов.
Когда электроды готовы их надо укрепить в емкости таким образом, чтобы места подключения проводов питания были выше предполагаемого уровня воды. Провода от электродов идут к блоку питания на 12 вольт или автомобильному аккумулятору.
В крышке емкости делаем отверстие под трубку для выхода газа. В качестве водных затворов можно использовать обычные стеклянные банки емкостью 1 литр. Заполняем их на 2/3 водой и подключаем к электролизеру и горелке, как показано на рисунке 8.
Горелку лучше взять готовую, поскольку не каждый материал может выдержать температуру горения газа Брауна. Подключаем ее к выходу последнего водного затвора.
Наполняем электролизер водой, в которую добавлена обычная кухонная соль.
Подаем напряжение на электроды и проверяем работу устройства.
Отопление дома газом Брауна

Схема работы водородного генератора.
Водород является самым распространенным химическим элементом, поэтому экономически выгодно его использовать.
Для многих владельцев домов и дач часто встает вопрос, как получить «чистую» и дешевую энергию для нужд в быту. Ответ можно найти в таких инновациях, как водогенератор для отопления жилища.
Ученые, благодаря своим разработкам, позволили многим использовать такое устройство для получения газа. Установка способна генерировать водород (газ Брауна) и этот газ будет использован для получения энергии.
Можно это соединение представить химической формулой, как hho. Данный газ можно получить из воды с помощью метода электролиза. Есть много примеров в жизни, когда люди хотят свой дом отапливать оксиводородом. Но чтобы этот вид топлива получил популярность, надо сначала научиться получать его (газ Брауна) в бытовых условиях.
Пока еще нет технологии водородного отопления частного дома, которая была бы достаточно надежной.
Смотрите видео, в котором опытный пользователь разъясняет, как сделать водородный генератор своими руками:
Безопасность установки
Многие умельцы размещают пластины в пластиковых ёмкостях. Не стоит экономить на этом. Нужен бак из нержавеющего металла. Если его нет, можно использовать конструкцию с пластинами открытого типа. В последнем случае необходимо применять качественный изолятор тока и воды для надёжной работы реактора.
Известно, что температура горения водорода составляет 2800. Это самый взрывоопасный газ в природе. Газ Брауна – не что иное, как «гремучая» смесь водорода. Поэтому водородные генераторы на автомобильном транспорте требуют качественной сборки всех узлов системы и наличия датчиков для слежения за течением процесса.

Датчик температуры рабочей жидкости, давления и амперметр не будут лишними в конструкции установки. Особое внимание стоит уделить гидрозатвору на выходе из реактора. Он жизненно необходим. Если произойдёт воспламенение смеси, такой клапан предотвратит распространение пламени в реактор.
Водородный генератор для отопления жилых и производственных помещений, работающий на тех же принципах, отличается в несколько раз большей производительностью реактора. В таких установках отсутствие гидрозатвора представляет смертельную опасность. Водородные генераторы на автомобилях в целях обеспечения безопасной и надёжной работы системы также рекомендуется оборудовать таким обратным клапаном.
Генератор промышленного изготовления
На уровне промышленного производства технологии изготовления водородных генераторов бытового назначения постепенно осваиваются и развиваются. Как правило, выпускаются энергетические станции домашнего применения, мощность которых не превышает 1 кВт.
Такой аппарат рассчитан на выработку водородного топлива в режиме постоянного функционирования не более чем в течение 8 часов. Главное их предназначение – энергоснабжение отопительных систем.
Также разрабатываются и производятся установки под эксплуатацию в составе кондоминиумов. Это уже более мощные конструкции (5-7 кВт), назначение которых не только энергетика отопительных систем, но также выработка электричества. Такой комбинированный вариант быстро набирает популярность в западных странах и в Японии.
Комбинированные водородные генераторы характеризуются как системы с высоким КПД и небольшим выбросом углекислого газа.

Пример реально действующей промышленно изготовленной станции мощностью до 5 кВт. Подобные установки в перспективе планируется делать под оснащение коттеджей и кондоминиумов
Российская промышленность тоже начала заниматься этим перспективным видом добычи топлива. В частности, «Норильский никель» осваивает технологии производства водородных установок, в том числе бытовых.
Планируется использовать самые разные типы топливных элементов в процессе разработки и производства:
- протонно-обменные мембранные;
- ортофосфорно-кислотные;
- протонно-обменные метанольные;
- щелочные;
- твердотельные оксидные.
Между тем процесс электролиза является обратимым. Этот факт говорит о том, что есть возможность получать уже нагретую воду без сжигания водорода.
Кажется, это очередная идея, ухватившись за которую можно запускать новый виток страстей, связанных с бесплатной добычей топлива для домашнего котла.
Экономическая целесообразность
В домашних условиях изготовить качественную водородную установку очень сложно. Мастеру придется учитывать массу параметров. Например, нужно точно подобрать металл для электродов. Он должен обладать определенными свойствами.

Всеми любимая нержавейка — доступное, но недолговечное решение. Топливные ячейки на них довольно быстро выйдут из строя.
Также при сборке гидролизатора нужно соблюдать монтажные размеры. Чтобы их получить, нужно произвести сложные расчеты с учетом качества воды, необходимой мощности на выходе и т. д.
При изготовлении устройства значение имеет даже сечение проводов, по которым на электроды подается ток. Речь идет не о производительности генератора, а о безопасности его эксплуатации, но и этот важный нюанс нужно учитывать.
Главная проблема таких приборов — большие затраты электричества для получения оксиводорода. Они превышают энергию, которую можно получить от сжигания такого топлива.
Из-за низкого КПД цена водородной установки для дома делает производство этого газа и его последующее использование для отопления невыгодным. Чем впустую расходовать электричество, проще установить любой электрокотел. Он будет эффективнее.

Что касается автомобильного транспорта, то здесь картина не сильно отличается. Да, можно сделать гидролизер для экономии топлива, но при этом снижается безопасность и надежность.
Единственное, где водород можно эффективно применять как топливо, — газосварка. Аппараты на hydrogen весят меньше, они компактнее, чем кислородные баллоны, но намного эффективнее. К тому же стоимость получения смеси здесь не играет никакой роли.

