Чем отличаются молекулы воды и молекулы льда?
Понятие молекулы ( и производные от него представления о молекулярном строении вещества, структуры собственно молекулы) позволяет понимать свойства веществ создающих мир. Современные, как и ранние, физико-химические исследования опираются и базируются на грандиозном открытие об атомно-молекулярном строении вещества. Молекула – единая «деталь» всех веществ, существование которой предположил ещё Демокрит. Потому именно её структура и взаимосвязь с другими молекулами (образуя определенное строение и состав) и определяет/объясняет все различия между веществами, их видом и свойствами.
Сама молекула, будучи не самой мельчайшей составной частью вещества (коей является атом) имеет определенную структуру, свойства. Определяется структура молекулы числом вхожих в неё определенных атомов и характером связи (ковалентной) между ними. Состав этот неизменен, даже если вещество преобразуется в другое состояние(как примеру, происходит с водой – об этом пойдет речь дальше).
Молекулярное строение вещества фиксируется формулой, которая сообщает информацию об атомах, их количестве. Кроме того, молекулы составляющие вещество/тело не статичны: и сами являются подвижными – атомы вращаются, взаимодействуя между собой (притягиваются/отталкиваются).
Характеристики воды, её состояния
Состав такого вещества, как вода (равно как и её химическая формула) знаком каждому. Каждую её молекулу составляют три атома: атом кислорода, обозначающийся буквой «О», и атомы водорода – латинская «Н», в количестве 2-х. Форма молекулы воды не симметрична (схожа с равнобедренным треугольником).
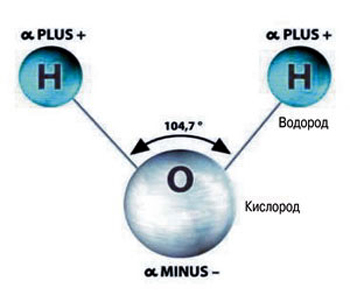
Молекула воды
Вода, как вещество, составляющие её молекулы, реагирует на внешнюю «обстановку», показатели окружающей среды — температуру, давление. Зависимо от последних вода способна изменять состояние, которых три:
- Наиболее привычное, естественное для воды состояние жидкое. Молекулярная структура (дигидроль) своеобразного порядка, при котором одиночные молекулы заполняют (водородными связями) пустоты.
- Состояние пара, при котором молекулярная структура (гидроль) представлена одиночными молекулами между которыми не образуются водородные связи.
- Твердое состояние (собственно лед), имеет молекулярную структуру (тригидроль) с прочными и устойчивыми водородными связями.
Помимо данных различий, естественно, разнятся и способы «перехода» вещества из одного состояния (жидкого) в другие. Эти переходы и трансформируют вещество, и провоцируют передачу энергии (выделение/поглощение). Среди них есть процессы прямые – преобразование жидкой воды в пар (испарение), в лед (замерзание) и обратные – в жидкость из пара (конденсация), из льда (таяние). Также и состояния воды — парообразное и лед — могут трансформироваться друг в друга: возгонка – лед в пар, сублимация – обратный процесс.
Специфичность льда как состояния воды
Широко известно, что лед замерзает ( трансформируется из воды) при пересечении температурой в сторону уменьшения границы в ноль градусов. Хотя, в этом всем понятном явлении, есть свои нюансы. К примеру, состояние льда неоднозначно, различны его виды, модификации. Отличаются они первоочередно условиями, при которых возникают – температурой, давлением. Таких модификаций насчитывается аж пятнадцать.
Лед в разных своих видах имеет различное молекулярное строение (молекулы же неотличимы от молекул воды). Природный и естественный лед, в научной терминологии обозначающийся как лед Ih — вещество с кристаллической структурой. То есть, каждая молекула с четырьмя окружающими её «соседками» (расстояние между всеми равное) создают геометрическую фигуру тетраэдр. Другие фазы льда обладают более сложной структурой, к примеру высокоупорядоченная структура тригонального, кубического или моноклинного льда.
Основные отличия льда от воды на молекулярном уровне
Первое и напрямую не относящееся к молекулярному строению воды и льда различие между ними – показатель плотности вещества. Кристаллическая структура, присущая льду, образовываясь, способствует одновременному уменьшению плотности (с показателя почти в 1000 кг/м³ до 916,7 кг/м³). А это стимулирует увеличение объема на 10%.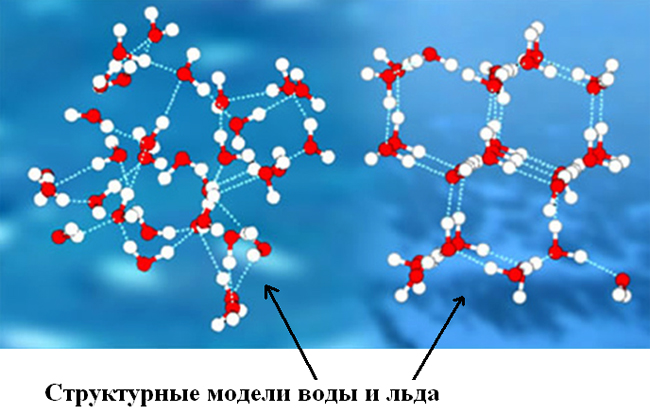
Основное же отличие в молекулярном строении этих агрегатных состояний воды (жидкого и твердого) в количестве, виде и силе водородных связей между молекулами
Сами молекулы веществ воды и льда, как упоминалось ранее, одинаковы. Но в молекулах льда атом кислорода (для создания кристаллической «решетки» вещества) образовывает водородные связи (две) с молекулами-«соседками».
Отличает вещество воды в разных её состояниях (агрегатных) не только структура расположения молекул (молекулярное строение), но и движение их, сила взаимосвязи/притяжения между ними. Молекулы воды в жидком состоянии достаточно слабо притягиваются, обеспечивая текучесть воды. В твердом же льду наиболее сильно притяжение молекул, потому и мала их двигательная активность (она обеспечивает постоянство формы льда).
Лёд — Википедия
Лёд — вода в твёрдом агрегатном состоянии[2].
Льдом иногда называют некоторые вещества в твёрдом агрегатном состоянии, которым свойственно иметь жидкую или газообразную форму при комнатной температуре; в частности, сухой лёд, аммиачный лёд или метановый лёд.
В настоящее время известны три аморфных разновидности и 17 кристаллических модификаций льда. Фазовая диаграмма на рисунке справа показывает, при каких температурах и давлениях существуют некоторые из этих модификаций (более полное описание см. ниже).

В природных условиях Земли вода образует кристаллы одной кристаллической модификации — гексагональной сингонии (лёд Ih). Во льду Ih каждая молекула Н2O окружена четырьмя ближайшими к ней молекулами, находящимися на одинаковых расстояниях от неё, равных 2,76 Å и размещённых в вершинах правильного тетраэдра.
Кристаллическая структура льда Ih. Серыми пунктирными линиями показаны водородные связи.Ажурная кристаллическая структура такого льда приводит к тому, что его плотность, равная 916,7 кг/м³ при 0 °C, меньше плотности воды (999,8 кг/м³) при той же температуре. Поэтому вода, превращаясь в лёд, увеличивает свой объём примерно на 9 %
Высокая удельная теплота плавления льда, равная 330 кДж/кг, (для сравнения — удельная теплотa плавления железа равна 270 кДж/кг), служит важным фактором в обороте тепла на Земле. Так, чтобы растопить 1 кг льда или снега, нужно столько же тепла, сколько требуется, чтобы нагреть литр воды на 80 °C.
Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного), а также в виде снега, инея, изморози. Под действием собственного веса лёд приобретает пластические свойства и текучесть.
Природный лёд обычно значительно чище, чем вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды (см. зонная плавка). Лёд может содержать механические примеси — твёрдые частицы, капельки концентрированных растворов, пузырьки газа. Наличием кристалликов соли и капелек рассола объясняется солоноватость морского льда.

На Земле[править | править код]
Общие запасы льда на Земле около 30 млн км³. Основные запасы льда на Земле сосредоточены в полярных шапках (главным образом, в Антарктиде, где толщина слоя льда достигает 4 км).
В океане[править | править код]
Вода в мировом океане солёная и это препятствует образованию льда, поэтому лёд образуется только в полярных и субполярных широтах, где зима долгая и очень холодная. Замерзают некоторые неглубокие моря, расположенные в умеренном поясе. Различают однолетние и многолетние льды. Морской лёд может быть неподвижным, если связан с сушей, или плавучим, то есть дрейфующим. В океане встречаются льды, отколовшиеся от ледников суши и спустившиеся в океан в результате абляции — айсберги.
В космосе[править | править код]
Имеются данные о наличии льда на планетах Солнечной системы (например, на Марсе), их спутниках, на карликовых планетах и в ядрах комет.

Ледяная гидросмесь. В конце 1980-х годов лаборатория Аргонн разработала технологию изготовления ледяной гидросмеси (Ice Slurry), способной свободно течь по трубам различного диаметра, не собираясь в ледяные наросты, не слипаясь и не забивая системы охлаждения[4]. Солёная водяная суспензия состояла из множества очень мелких ледяных кристалликов округлой формы. Благодаря этому сохраняется подвижность воды и, одновременно, с точки зрения теплотехники она представляет собой лёд, который в 5—7 раз эффективнее простой холодной воды в системах охлаждения зданий. Кроме того, такие смеси перспективны для медицины. Опыты на животных показали, что микрокристаллы смеси льда прекрасно проходят в довольно мелкие кровеносные сосуды и не повреждают клетки. «Ледяная кровь» удлиняет время, в течение которого можно спасти пострадавшего. Скажем, при остановке сердца это время удлиняется, по осторожным оценкам, с 10—15 до 30—45 минут
Использование льда в качестве конструкционного материала широко распространено в приполярных регионах для строительства жилищ — иглу. Лёд входит в состав предложенного Д. Пайком материала пайкерит, из которого предлагалось сделать самый большой в мире авианосец. Использование льда для постройки искусственных островов описывается в фантастическом романе «Ледяной остров».
| Фаза | Характеристики[5][6] |
|---|---|
| Аморфный лёд | Аморфный лёд не обладает кристаллической структурой. Он существует в трех формах: аморфный лёд низкой плотности (LDA), образующийся при атмосферном давлении и ниже, аморфный лёд высокой плотности (HDA) и аморфный лёд очень высокой плотности (VHDA), образующийся при высоких давлениях. Лёд LDA получают очень быстрым охлаждением жидкой воды («сверхохлаждённая стекловидная вода», HGW), или конденсацией водяного пара на очень холодной подложке («аморфная твёрдая вода», ASW), или путём нагрева высокоплотностных форм льда при нормальном давлении («LDA»). |
| Лёд Ih | Обычный гексагональный кристаллический лёд. Почти весь лёд на Земле относится ко льду Ih, и только очень малая часть — ко льду Ic. |
| Лёд Ic | Метастабильный кубический кристаллический лёд. Атомы кислорода расположены как в кристаллической решётке алмаза. Его получают при температуре в диапазоне от −133 °C до −123 °C, он остаётся устойчивым до −73 °C, а при дальнейшем нагреве переходит в лёд Ih. Он изредка встречается в верхних слоях атмосферы. |
| Лёд II | Тригональный кристаллический лёд с высокоупорядоченной структурой. Образуется изо льда Ih при сжатии и температурах от −83 °C до −63 °C. При нагреве он преобразуется в лёд III. |
| Лёд III | Тетрагональный кристаллический лёд, который возникает при охлаждении воды до −23 °C и давлении 300 МПа. Его плотность больше, чем у воды, но он наименее плотный из всех разновидностей льда в зоне высоких давлений. |
| Лёд IV | Метастабильный тригональный лёд. Его трудно получить без нуклеирующей затравки. |
| Лёд V | Моноклинный кристаллический лёд. Возникает при охлаждении воды до −20 °C и давлении 500 МПа. Обладает самой сложной структурой по сравнению со всеми другими модификациями. |
| Лёд VI | Тетрагональный кристаллический лёд. Образуется при охлаждении воды до −3 °C и давлении 1,1 ГПа. В нём проявляется дебаевская релаксация. |
| Лёд VII | Кубическая модификация. Нарушено расположение атомов водорода; в веществе проявляется дебаевская релаксация. Водородные связи образуют две взаимопроникающие решётки. |
| Лёд VIII | Более упорядоченный вариант льда VII, где атомы водорода занимают, очевидно, фиксированные положения. Образуется изо льда VII при его охлаждении ниже 5 °C. |
| Лёд IX | Тетрагональная метастабильная модификация. Постепенно образуется изо льда III при его охлаждении от −65 °C до −108 °C, стабилен при температуре ниже −133 °C и давлениях между 200 и 400 МПа. Его плотность 1,16 г/см³, то есть, несколько выше, чем у обычного льда. |
| Лёд X | Симметричный лёд с упорядоченным расположением протонов. Образуется при давлениях около 70 ГПа. |
| Лёд XI | Ромбическая низкотемпературная равновесная форма гексагонального льда. Является сегнетоэлектриком. |
| Лёд XII | Тетрагональная метастабильная плотная кристаллическая модификация. Наблюдается в фазовом пространстве льда V и льда VI. Можно получить нагреванием аморфного льда высокой плотности от −196 °C до примерно −90 °C и при давлении 810 МПа. |
| Лёд XIII | Моноклинная кристаллическая разновидность. Получается при охлаждении воды ниже −143 °C и давлении 500 МПа. Разновидность льда V с упорядоченным расположением протонов. |
| Лёд XIV | Ромбическая кристаллическая разновидность. Получается при температуре ниже −155 °C и давлении 1,2 ГПа. Разновидность льда XII с упорядоченным расположением протонов. |
| Лёд XV | Псевдоромбическая кристаллическая разновидность льда VI с упорядоченным расположением протонов. Можно получить путём медленного охлаждения льда VI примерно до −143 °C и давлении 0,8-1,5 ГПа[7]. |
| Лёд XVI | Кристаллическая разновидность льда с наименьшей плотностью (0,81 г/см3)[8] среди всех экспериментально полученных форм льда. Имеет строение топологически эквивалентное полостной структуре КС-II (англ. sII) газовых гидратов. |
| Лёд XVII | Кристаллическая разновидность льда с меньшей кристаллографической плотностью (0,85 г/см3)[9], чем у других экспериментально полученных форм льда. Его структура, как и у льда XVI, сходна с клатратной структурой газовых гидратов. Получается при температуре 280 К и давлении ~ 400 МПа. Его номинальный состав (Н2О)2Н2 с тремя формульными единицами на элементарную ячейку. |
Новые исследования формирования водяного льда на ровной поверхности меди при температурах от −173 °C до −133 °C показали, что сначала на поверхности возникают цепочки молекул шириной около 1 нм не гексагональной, а пентагональной структуры[10].
-

Дрейфующий лёд в Арктике
Лёд в период летней навигации
-

-

Образование ниласа
Снежницы на ледяном поле
- ↑ Петрушевский Ф. Ф., Гершун А. Л. Лед, в физике // Энциклопедический словарь — СПб.: Брокгауз — Ефрон, 1896. — Т. XVII. — С. 471–473.
- ↑ РМГ 75-2014. Измерения влажности веществ. Термины и определения, 2015, с. 1.
- ↑ Замерзающая вода выдавливает дно металлической ёмкости (видео)
- ↑ 1 2 Хирурги наполнят тела пациентов текущим льдом
- ↑ Фазы льда (англ.) (неопр.) (недоступная ссылка). Дата обращения 5 февраля 2009. Архивировано 25 марта 2009 года.
- ↑ Ледяные узоры высокого давления (неопр.) (недоступная ссылка). Дата обращения 6 февраля 2009. Архивировано 18 февраля 2009 года.
- ↑ Впервые получен лёд XV
- ↑ Andrzej Falenty, Thomas C. Hansen & Werner F. Kuhs. Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate // Nature. — Vol. 516, P. 231—233 (11 December 2014) — Falenty Andrzej, Hansen Thomas C., Kuhs Werner F. Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate // Nature. — 2014. — Декабрь (т. 516, № 7530). — С. 231—233. — ISSN 0028-0836. — DOI:10.1038/nature14014. [исправить]
- ↑ Timothy A. Strobel, Maddury Somayazulu, Stanislav V. Sinogeikin, Przemyslaw Dera & Russell J. Hemley. Hydrogen-stuffed, quartz-like water ice // Journal of the American Chemical Society. — Vol. 138. — P. 13786-13789 (19 August 2016) — Strobel Timothy A., Somayazulu Maddury, Sinogeikin Stanislav V., Dera Przemyslaw, Hemley Russell J. Hydrogen-Stuffed, Quartz-like Water Ice // Journal of the American Chemical Society. — 2016. — 18 октября (т. 138, № 42). — С. 13786—13789. — ISSN 0002-7863. — DOI:10.1021/jacs.6b06986. [исправить].
- ↑ A one-dimensional ice structure built from pentagons. Nature Materials. 8 March 2009 (англ.)
Движение молекул в газах, жидкостях и твёрдых телах
Молекулярно-кинетическая теория даёт объяснение тому, что все вещества могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Например, лёд, вода и водяной пар. Часто плазму считают четвёртым состоянием вещества.
Агрегатные состояния вещества (от латинского aggrego – присоединяю, связываю) – состояния одного и того же вещества, переходы между которыми сопровождаются изменением его физических свойств. В этом и заключается изменение агрегатных состояний вещества.
Во всех трёх состояниях молекулы одного и того же вещества ничем не отличаются друг от друга, меняется только их расположение, характер теплового движения и силы межмолекулярного взаимодействия.
Движение молекул в газах
В газах обычно расстояние между молекулами и атомами значительно больше размеров молекул, а силы притяжения очень малы. Поэтому газы не имеют собственной формы и постоянного объёма. Газы легко сжимаются, потому что силы отталкивания на больших расстояниях также малы. Газы обладают свойством неограниченно расширяться, заполняя весь предоставленный им объём. Молекулы газа движутся с очень большими скоростями, сталкиваются между собой, отскакивают друг от друга в разные стороны. Многочисленные удары молекул о стенки сосуда создают давление газа.
Движение молекул в жидкостях
В жидкостях молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее. Эти перескоки происходят периодически. Временной отрезок между такими перескоками получил название среднее время оседлой жизни (или среднее время релаксации) и обозначается буквой ?. Иными словами, время релаксации – это время колебаний около одного определённого положения равновесия. При комнатной температуре это время составляет в среднем 10-11 с. Время одного колебания составляет 10-12…10-13 с.
Время оседлой жизни уменьшается с повышением температуры. Расстояние между молекулами жидкости меньше размеров молекул, частицы расположены близко друг к другу, а межмолекулярное притяжение велико. Тем не менее, расположение молекул жидкости не является строго упорядоченным по всему объёму.
Жидкости, как и твёрдые тела, сохраняют свой объём, но не имеют собственной формы. Поэтому они принимают форму сосуда, в котором находятся. Жидкость обладает таким свойством, как текучесть. Благодаря этому свойству жидкость не сопротивляется изменению формы, мало сжимается, а её физические свойства одинаковы по всем направлениям внутри жидкости (изотропия жидкостей). Впервые характер молекулярного движения в жидкостях установил советский физик Яков Ильич Френкель (1894 – 1952).
Движение молекул в твёрдых телах
Молекулы и атомы твёрдого тела расположены в определённом порядке и образуют кристаллическую решётку. Такие твёрдые вещества называют кристаллическими. Атомы совершают колебательные движения около положения равновесия, а притяжение между ними очень велико. Поэтому твёрдые тела в обычных условиях сохраняют объём и имеют собственную форму.
Различие в молекулярном строении твердых тел, жидкостей и газов
Различия в молекулярном строении твердых тел, жидкостей и газов
«Свойства тел не случайны,
они зависят от свойств с
оставляющих их корпускул»
М.В. Ломоносов
В данной теме будет продолжен разговор об агрегатных состояниях вещества. Ранее речь шла о трёх агрегатных состояниях вещества – это твердое состояние, жидкое, и газообразное. Было выяснено, что твердые тела сохраняют и объём и форму. Жидкости легко меняют форму, но при этом сохраняют объём. Газы не имеют собственной формы и занимают весь предоставленный им объём. Например, вода на планете Земля встречается во всех трех состояниях. При этом и лёд, и вода, и водяной пар состоят из абсолютно одинаковых молекул. Изменение агрегатного состояния не влечет за собой изменение самих молекул.
Агрегатные состояния характеризуются расположением молекул, движением молекул и взаимодействием молекул. Твёрдые тела сохраняют свою форму и объём. Поэтому, молекулы в твердых телах расположены в строгом порядке и жестко связаны друг с другом. Из-за значительного взаимного притяжения и отталкивания, взаимное расположение молекул твердого тела достаточно сложно изменить. Тем не менее, беспорядочное движение все равно присутствует в твердых телах. Молекулы в твердых телах совершают небольшие колебания, т.е. молекулы двигаются из стороны в сторону, но тут же встречают отталкивание со стороны соседних молекул и возвращаются на свои места.

В жидкостях нет никакого определенного порядка расположения. Тем не менее, молекулы жидкости находятся очень близко (практически вплотную) друг к другу, поэтому, жидкости практически несжимаемы. Молекулы жидкости так же, как и молекулы твердых тел, колеблются. Но, помимо этого, они могут совершать перескоки, меняться местами, что, легко может привести к изменению формы. Именно этим и объясняется текучесть жидкостей.

В газах, молекулы находятся друг от друга на расстояниях во много раз превышающих размеры самих молекул. Поэтому, взаимное притяжение и взаимное отталкивание между молекулами газов очень незначительны. Это и приводит к тому, что газы не имеют формы и достаточно легко сжимаются. Поскольку молекулы практически не испытывают ни притяжения, ни отталкивания, они могут перемещаться с очень большими скоростями (по несколько сотен километров в час). Таким образом, в газах нет никакого порядка в расположении молекул.

Для наглядности можно провести некоторые аналогии. В твердых телах молекулы расположены в соответствии со строгим порядком и только колеблются. Это можно сравнить с тем, как ученики сидят на уроке. Ученики расположены в строгом порядке относительно друг друга (то есть сидят на определенных местах по рядам). При этом сидя на своём месте, ученик может совершать некоторые движения.

Аналогией жидкости может послужить метро в час-пик. Люди находятся очень близко друг к другу, но, тем не менее, каждый человек может переместиться из одного места в другое (точно так же, как молекула жидкости может перескочить из одного положения равновесия в другое).

Движение газа можно сравнить с движением футболистов. Они бегают по всему футбольному полю с большими скоростями и находятся на большом расстоянии друг от друга.

Известно, если нагревать лед, то он со временем, превратится в воду. Если продолжить нагревать воду, то она закипит и превратится в водяной пар. При каждом изменении агрегатного состояния будет изменяться характер движения и взаимодействия молекул. Рассмотрим данные процессы. Во льду молекулы жестко связаны и только колеблются. Когда лед понемногу начинает плавиться, происходит нарушение порядка. Некоторые молекулы уже способны перескакивать со своих мест на другие. В конце концов, порядок совсем нарушится, и молекулы то и дело будут перескакивать с места на место, но все еще находится вплотную друг к другу. По мере нагревания воды, скорости молекул будут увеличиваться. Некоторые молекулы наберут такую скорость, что смогут оторваться от поверхности воды, таким образом, покинув её. Такие молекулы уже будут находиться в газообразном состоянии. В итоге, вся вода выкипит, превратившись в пар. Молекулы теперь уже будут двигаться совершенно беспорядочно, очень слабо взаимодействуя друг с другом.
Данный процесс можно сравнить со школьным процессом. Ученики стоят на линейке. Все ученики стоят в определенном порядке, но никуда не перемещаются (это напоминает поведение молекул льда). Когда линейка заканчивается, ученики начинают расходится. Происходит нарушение порядка, и ученики уже не стоят ровными рядами, а образуют толпу, в которой они могут меняться местами (это уже похоже на поведение молекул жидкости). Далее ученики выбегают в коридор или на улицу, уже находясь на существенном расстоянии друг от друга, и перестают толкаться (то есть, не взаимодействуете с другими, а двигаетесь сами по себе). Это напоминает поведение молекул газа.
Основные выводы:

чем отличаются молекулы воды от молекул льда
Ничем, молекулы те же, только во льду выстроены упорядоченно
Структурой соединения
Строением по моему. Водородными связями.
кристалической решоткой
молекулы льда (воды) собраны в кристаллическую решётку (соединены друг с другом) , а в жидком состоянии молекулы воды движутся хаотично (беспорядочно) . наверно так.
Любое твердое вещество, в том числе и лед, имеет структуру в виде кристаллической решетки из молекул. При нагревании молекулы начинают колебаться на своих местах в решетке, и при достижении определенной температуры (для воды — 0 градусов по Цельсию) решетка ломается и молекулы освобождаются. Лед превращается в жидкость — воду. В жидком виде молекулы уже раздельны и движутся хаотически, но между ними остается какая-то связь. Чем больше температура, тем быстрее движутся молекулы, и наконец, при 100 градусах, связи разрываются и расстояние между молекулами сильно увеличивается. Жидкость превращается в газ. Сами молекулы при этом никак не меняются.
Движение молекул в газах, жидкостях и твёрдых телах
Молекулярно-кинетическая теория даёт объяснение тому, что все вещества могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Например, лёд, вода и водяной пар. Часто плазму считают четвёртым состоянием вещества.
Агрегатные состояния вещества (от латинского aggrego – присоединяю, связываю) – состояния одного и того же вещества, переходы между которыми сопровождаются изменением его физических свойств. В этом и заключается изменение агрегатных состояний вещества.
Во всех трёх состояниях молекулы одного и того же вещества ничем не отличаются друг от друга, меняется только их расположение, характер теплового движения и силы межмолекулярного взаимодействия.
Движение молекул в газах
В газах обычно расстояние между молекулами и атомами значительно больше размеров молекул, а силы притяжения очень малы. Поэтому газы не имеют собственной формы и постоянного объёма. Газы легко сжимаются, потому что силы отталкивания на больших расстояниях также малы. Газы обладают свойством неограниченно расширяться, заполняя весь предоставленный им объём. Молекулы газа движутся с очень большими скоростями, сталкиваются между собой, отскакивают друг от друга в разные стороны. Многочисленные удары молекул о стенки сосуда создают давление газа.
Движение молекул в жидкостях
В жидкостях молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее. Эти перескоки происходят периодически. Временной отрезок между такими перескоками получил название среднее время оседлой жизни (или среднее время релаксации) и обозначается буквой τ. Иными словами, время релаксации – это время колебаний около одного определённого положения равновесия. При комнатной температуре это время составляет в среднем 10-11 с. Время одного колебания составляет 10-12…10-13 с.
Время оседлой жизни уменьшается с повышением температуры. Расстояние между молекулами жидкости меньше размеров молекул, частицы расположены близко друг к другу, а межмолекулярное притяжение велико. Тем не менее, расположение молекул жидкости не является строго упорядоченным по всему объёму.
Жидкости, как и твёрдые тела, сохраняют свой объём, но не имеют собственной формы. Поэтому они принимают форму сосуда, в котором находятся. Жидкость обладает таким свойством, как текучесть. Благодаря этому свойству жидкость не сопротивляется изменению формы, мало сжимается, а её физические свойства одинаковы по всем направлениям внутри жидкости (изотропия жидкостей). Впервые характер молекулярного движения в жидкостях установил советский физик Яков Ильич Френкель (1894 – 1952).
Движение молекул в твёрдых телах
Молекулы и атомы твёрдого тела расположены в определённом порядке и образуют кристаллическую решётку. Такие твёрдые вещества называют кристаллическими. Атомы совершают колебательные движения около положения равновесия, а притяжение между ними очень велико. Поэтому твёрдые тела в обычных условиях сохраняют объём и имеют собственную форму.
Строение вещества » ГДЗ (решебник) по физике 7-11 классов
7.1. На рисунке показан опыт, иллюстрирующий, что тела при нагревании расширяются. Обведите ручкой на рисунке предмет, который нагревали в этом опыте – шар или кольцо. Ответ обоснуйте.

7.2. Выберите правильное утверждение.
Согласно современным представлениям, при остывании колбы с водой уровень воды в трубке опускается потому, что… .
7.3. Вещества состоят из мельчайших частиц. Какие явления и эксперименты это подтверждают?
7.4. В таблице приведены точные данные об изменении объема воды V от времени t при нагревании.
Ответьте на вопросы.
а) Можно ли утверждать, что в течение всего времени наблюдения вода в колбе нагревалась равномерно? Ответ поясните.
б) Как изменялся объем воды при нагревании?

8.1. Выберите правильное утверждение.
Если нагреть гвоздь, то он удлиняется и становится толще. Это происходит потому, что при нагревании… .
8.2. Слова молекула, капля, атом запишите в таком порядке, чтобы каждый последующий элемент входил в состав предыдущего.

8.3. На рисунке представлены модели молекул воды, кислорода и углекислого газа. В состав всех молекул входит атом кислорода (черный). Заполните пропуски в тексте.

8.4. Измерьте длину своей руки от локтя до мизинца и сравните полученное значение с размером молекулы воды.
9.1. Заполните пропуски в тексте. «В ____ г. английский ботаник Роберт Броун, рассматривая в микроскоп…»

9.2. На рисунке схематически представлены молекулы жидкости, окружающие крупинку краски, помещенную в эту жидкость. Стрелками указаны направления движения молекул жидкости в определенный момент времени.

9.3. Отметьте те явления, которые являются примером броуновского движения.
9.4. На рисунке показана ломаная линия, вдоль которой перемещалась пылинка в воздухе в течение нескольких секунд.

а) Объясните, почему пылинка много раз поменяла направление своего движения за время наблюдения за ней.
Из-за столкновения с молекулами воздуха и другими пылинками.
б) На рисунке обозначьте точки, в которых на пылинку действовали окружающие ее молекулы.
10.1. В стеклянный цилиндр сверху налита чистая вода, а на дно через узкую трубку залит раствор медного купороса. Цилиндр находится в покое при постоянной температуре. Покажите на рисунке, как будет выглядеть содержимое цилиндра через различные промежутки времени.

10.2. Два одинаковых резиновых шарика соединены прозрачным шлангом (см. рис.), причем левый шарик в обоих случаях заполнен водородом (закрасьте водород синим цветом), правый – на рисунке а пуст, а на рисунке б заполнен воздухом (закрасьте воздух зеленым цветом). Шланг между шариками зажат зажимом.

10.3. Зачеркните по одному из выделенных слов, чтобы получилось верное объяснение описанного эксперимента.

10.4. Домашний эксперимент.
Положите на дно стакана с холодной водой кусочек сахара, но не перемешивайте. Запишите, через какое время вам удалось обнаружить присутствие молекул сахара на поверхности воды в стакане и какой «прибор» при этом вы использовали.
11.1. Заполните пропуски в тексте, используя слова: сильнее; слабее; притяжение; отталкивание.

11.2. Соедините линиями явления и соответствующие им объяснения.

11.3. Зачеркните по одному из выделенных слов, чтобы получилось верное объяснение описанного эксперимента.

11.4. Допишите предложение, чтобы получилось правильное объяснение явления.
11.5. Заполните пропуски в тексте. «В быту мы часто сталкиваемся с явлениями смачивания и несмачивания.»

12.1. Какое состояние вещества характеризуется перечисленными признаками?
12.2. С помощью насоса газ полностью перекачали из баллона А объемом 0,3 м3 в баллон В объемом 4 м3. Каковы начальный и конечный объемы газа?
12.3. В цилиндрах под плотно прилегающими к стенкам поршнями находятся тела одинакового объема: твердое (рис. а), жидкое (рис. б) и газообразное (рис. в). Отметьте на рисунке положение поршней после того, как на них сверху поместят одинаковые грузы.

13.1. Соедините линиями описание реального явления и соответствующий ему переход вещества из одного состояния в другое.

13.2. На рисунке показана картина расположения молекул воды в твердом кристалле льда. Нарисуйте расположение молекул воды в жидком и газообразном состояниях.

13.3. на рисунке изображены измерительные цилиндры с жидкостями: в трех из них находится вода, а в одном – спирт. При сливании одинаковых жидкостей из двух цилиндров (рис. а) их суммарный объем не меняется и равен 100 мл. При сливании разных жидкостей (рис. б) их суммарный объем немного уменьшается и оказывается меньше 100 мл. Объясните явление.





