Новые фотокатализаторы ускоряют выделение кислорода из воды
Группа ученых из ФИЦ «Институт катализа им. Г. К. Борескова СО РАН» и Института неорганической химии им. А. В. Николаева СО РАН при поддержке Российского научного фонда разработали активный и стабильный фотокатализатор окисления воды на основе оксидов иридия, который позволяет ускорить выделение кислорода из воды. Результаты опубликованы в высокорейтинговом журнале ACS Applied Materials & Interfaces.Фотокаталитическое разложение воды с образованием водорода и кислорода — актуальная задача получения «зеленого» водорода, экологически чистого топлива. Основная проблема в процессе расщепления воды — медленная кинетика процесса ее окисления и выделения кислорода. Разработанные стабильные фотокатализаторы на основе оксидов иридия помогают ускорить этот процесс.
«Нам удалось синтезировать стабильный комплекс иридия с нитро- и аква-лигандами, который далее мы использовали для получения композитных фотокатализаторов. Уникальность данного соединения заключается в отсутствии в его составе ионов хлора, которые могут снижать активность катализаторов. Кроме того, из данного соединения легко образуется активная форма иридия — достаточно нагревания при невысокой температуре», — рассказал старший научный сотрудник ИНХ СО РАН кандидат химических наук Данила Борисович Васильченко.
Уникальность данного соединения заключается в отсутствии в его составе ионов хлора, которые могут снижать активность катализаторов. Кроме того, из данного соединения легко образуется активная форма иридия — достаточно нагревания при невысокой температуре», — рассказал старший научный сотрудник ИНХ СО РАН кандидат химических наук Данила Борисович Васильченко.
Автоклав с реакционной смесью: (А) — в начале эксперимента, (В) — в его конце.
По словам руководителя проекта, заместителя руководителя Центра НТИ «Водород как основа низкоуглеродной экономики» ИК СО РАН, доктора химических наук, профессора РАН Екатерины Александровны Козловой, проведенная работа продолжает сделанные ранее исследования, общая цель которых — разработка катализаторов полного разложения воды.
«Ранее мы уже получили высокоактивные фотокатализаторы на основе графитоподобного нитрида углерода с нанесенной платиной для выделения водорода. Исследование процесса образования кислорода является продолжением работы, конечная цель которой заключается в разработке катализаторов полного фотокаталитического разложения воды на водород и кислород. Теперь у нас есть не только активные, но и стабильные фотокатализаторы получения кислорода с малым содержанием иридия — всего 0,25 %. Еще одно важное преимущество наших фотокатализаторов состоит в способности работать под действием видимого излучения, что открывает перспективы использования энергии солнца для разложения воды», — пояснила Екатерина Козлова.
Теперь у нас есть не только активные, но и стабильные фотокатализаторы получения кислорода с малым содержанием иридия — всего 0,25 %. Еще одно важное преимущество наших фотокатализаторов состоит в способности работать под действием видимого излучения, что открывает перспективы использования энергии солнца для разложения воды», — пояснила Екатерина Козлова.
Образцы катализатора.
Уникальность полученного фотокатализатора для выделения кислорода также в его гетерогенности: обычно такие вещества гомогенные, что затрудняет процесс отделения катализатора от реакционной смеси. Новый катализатор находится в смеси в суспендированном состоянии, что значительно облегчает его отделение и повторное использование.
Один из авторов статьи, студент Новосибирского государственного университета, сотрудник ИК СО РАН Николай Сидоренко рассказал о практическом применении результатов исследования: «Водород из воды получить достаточно легко, но при помощи доноров, то есть добавления, например, органики, в частности, спиртов. Разложение же чистой воды на водород и кислород будет сильно удешевлять процесс, потому что ничего дополнительно добавлять не нужно. Сначала мы работали над фотокатализатором получения водорода из воды, затем — над эффективным катализатором выделения кислорода, а следующий этап — создание “общего” катализатора для одновременного разложения чистой воды на водород и кислород».
Разложение же чистой воды на водород и кислород будет сильно удешевлять процесс, потому что ничего дополнительно добавлять не нужно. Сначала мы работали над фотокатализатором получения водорода из воды, затем — над эффективным катализатором выделения кислорода, а следующий этап — создание “общего” катализатора для одновременного разложения чистой воды на водород и кислород».
Ученые планируют получать водород с использованием солнечной энергии путем фотокаталитического разложения чистой воды и затем использовать его, например, в качестве топлива для топливных элементов. В этом случае будет замкнутый экологически чистый цикл: водород станет питать топливные элементы, которые вырабатывают электричество посредством электрохимической реакции между водородом и кислородом с образованием воды.
Источник: пресс-служба ИК СО РАН
В России создали никель-медные катализаторы для получения водорода и кислорода из воды — Газета.
 Ru
RuВ России создали никель-медные катализаторы для получения водорода и кислорода из воды — Газета.Ru | Новости
Размер текста
А
А
А
close
100%
Российские ученые получили новый электрокатализатор для производства водорода и кислорода из воды. Об этом сообщает пресс-служба РНФ.
Водород считается перспективным «зеленым» топливом, поскольку при его сгорании не образуется вредных выбросов. Существует два основных способа его производства — методом электролиза воды и выделением из природного газа, при этом лишь электролиз (или химическое разложение) воды обеспечивает нулевой выброс углекислого раза в атмосферу. При этом из воды также выделяется кислород, необходимый в медицине для вентиляции легких, для производства металлов и во многих других отраслях промышленности. Для эффективного электролиза нужны подходящие катализаторы, при этом необходимо избегать использования платины и других драгоценных металлов.
Специалисты Физико-технического института имени А.Ф. Иоффе Российской академии наук и их коллеги создали катализаторы нового типа, состоящие из покрытых никелем и медью углеродных микротрубок. Покрытия были синтезированы методом электроосаждения из комплексных аммоний-сульфосалициловых электролитов, то есть содержащих органические лиганды, которые сложнее по структуре, чем обычно применяемые в подобных задачах. Электроосаждение — это выделение металла на поверхности электрода в результате протекания электрохимической реакции.
Авторам удалось создать очень тонкие покрытия с наночастицами металлов: толщина трубок составила примерно 1,2 нм в случае системы Ni-углерод и около 0,5 нм в случае Ni-Cu-углерод. Образцы исследовали с помощью сканирующей электронной микроскопии, рентгеновских и электрохимических методов. Так, благодаря переходу от использования простого метода синтеза к сложному, получилось увеличить площадь электрохимически активной поверхности материалов: с 265 до 1400 см2 для никелевого и до 780 см2 для никель-медного катализаторов соответственно. Это позволит выделять водород более эффективно, а использование углеродного волокна в качестве подложки сделает производство материала более дешевым, экологически чистым и с меньшим расходом металлов.
Так, благодаря переходу от использования простого метода синтеза к сложному, получилось увеличить площадь электрохимически активной поверхности материалов: с 265 до 1400 см2 для никелевого и до 780 см2 для никель-медного катализаторов соответственно. Это позволит выделять водород более эффективно, а использование углеродного волокна в качестве подложки сделает производство материала более дешевым, экологически чистым и с меньшим расходом металлов.
В дальнейшем авторы надеются повысить эффективность производства этих катализаторов за счет оптимизации состава электролита и скорости осаждения. Кроме того, сульфосалициловую кислоту потенциально можно заменить на более экологичную лимонную.
Ранее в России открыли два вида арктических ракообразных с причудливым названием.
Все новости на тему:
ЦивилизацияПодписывайтесь на «Газету.Ru» в Новостях, Дзен и Telegram.
Чтобы сообщить об ошибке, выделите текст и нажмите Ctrl+Enter
Новости
Дзен
Telegram
Арам Тер-Газарян
Кому выгодно переводить время?
Об очередном предложении ввести в России зимнее и летнее время
Анастасия Миронова
Почему люди все еще пьют?
Сидром отравились уже журналист и владелец Lexus: зачем они его купили?
Елена Соколова
На одном дыхании
Директор департамента по продуктам разработчика ИИ-решений в сфере медицины СберМедИИ Елена Соколова о том, как ИИ изменил подход к компьютерной томографии (КТ) легких
Георгий Бовт
Почему авторство диверсии против «Северных потоков» уже не так важно
О том, почему эту историю почти забыли
Дмитрий Воденников
Твои невыносимые георгины
О том, что наша встреча впереди неизбежна
Высвобождение кислорода из воды: лучшие катализаторы для накопителей энергии исследования, которые дают новое понимание того, почему определенные катализаторы настолько эффективны в стимулировании выделения кислорода из воды во время электролиза — ключевого процесса во многих устройствах накопления энергии.

Исследователи Массачусетского технологического института и Лейденского университета в настоящее время представили недвусмысленные экспериментальные доказательства того, что традиционная теория неточно описывает, как высокоэффективные катализаторы на основе оксидов металлов помогают высвобождать газообразный кислород из воды во время электролиза — критического процесса во многих технологиях накопления энергии. Используя особую форму кислорода в качестве маркера, они продемонстрировали, что газообразный кислород поступает не только из воды, но и из самого катализатора на основе оксида металла. Параллельно с теоретическими исследованиями они показали, что определенные электронные свойства таких высокоэффективных катализаторов допускают участие кислорода из катализатора. В настоящее время команда работает над определением последовательности химических реакций, которые приводят к выделению кислорода на этих специальных катализаторах. Их результаты уже дают новые ориентиры в продолжающемся поиске недорогих, эффективных материалов и конструкций для этих важных катализаторов.
Многие системы хранения энергии основаны на электрохимических реакциях, вызывающих выделение газообразного кислорода из воды. Эти так называемые реакции выделения кислорода имеют решающее значение для эффективности устройств, которые расщепляют воду для извлечения водородного топлива, а также для работы регенеративных топливных элементов, металло-воздушных батарей и многого другого.
«Выделение кислорода — это одна из универсальных реакций, которая играет ключевую роль в разработке эффективных технологий накопления энергии за счет сохранения энергии электронов в химической форме», — говорит Ян Шао-Хорн, исследователь W.M. Кека, профессор энергетики, профессор машиностроения, материаловедения и инженерии, а также содиректор Исследовательского центра энергосбережения MIT Energy Initiative.
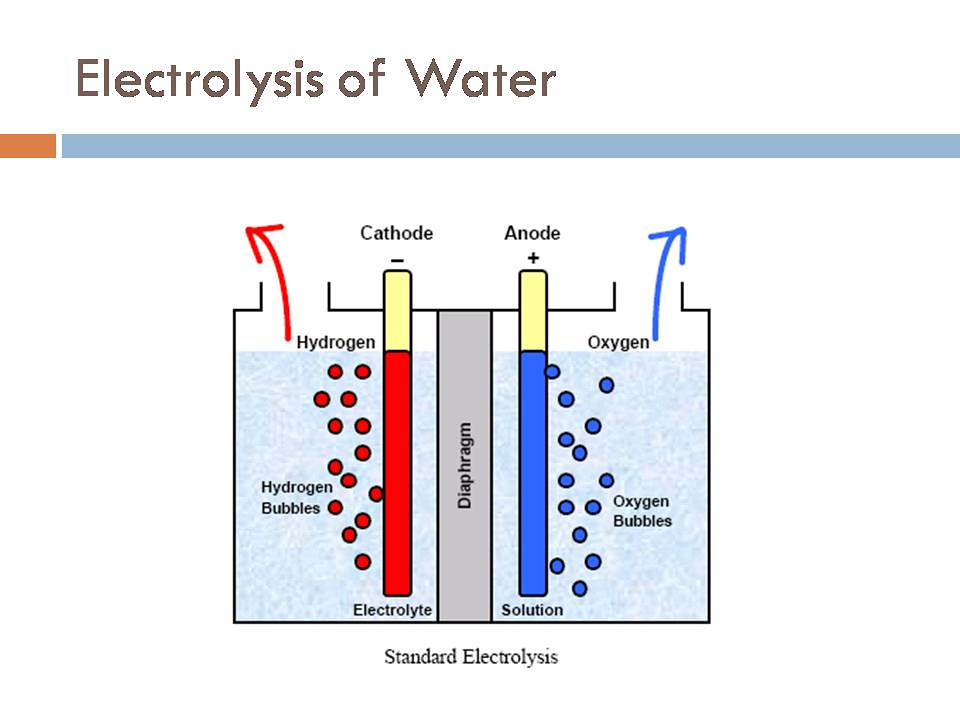
Кинетика реакций выделения кислорода обычно медленная, поэтому для ускорения химических реакций требуются катализаторы, такие как оксиды металлов (без расхода в процессе). При электролизе воды металлооксидный катализатор погружают в электролит на водной основе. При подаче потенциала молекулы воды вступают в реакцию с катализатором, разделяясь на положительно заряженные ионы водорода (протоны) и атомы кислорода, которые образуют газообразный кислород, выходящий из системы пузырьками.
При электролизе воды металлооксидный катализатор погружают в электролит на водной основе. При подаче потенциала молекулы воды вступают в реакцию с катализатором, разделяясь на положительно заряженные ионы водорода (протоны) и атомы кислорода, которые образуют газообразный кислород, выходящий из системы пузырьками.
Многие исследования были сосредоточены на выявлении оксидов металлов, которые будут выполнять эту задачу. Работают многие соединения, но каталитическая активность одних на порядки выше, чем у других. После трех лет интенсивных экспериментальных и теоретических исследований Шао-Хорн и ее коллеги из Лаборатории электрохимической энергии по-новому поняли, почему некоторые катализаторы на основе оксидов металлов работают так хорошо, и подготовили практические рекомендации по поиску новых, более эффективных катализаторов в будущее.
Этот электрохимический элемент лежит в основе экспериментальной установки, показанной на первой фотографии в этой статье. В его центре зонд, содержащий образец катализатора, погружен в электролит на водной основе.
Экспериментальное свидетельство: отслеживание кислорода
В своей работе Шао-Хорн, Бинхонг Хан, доктор философии ’16, бывший постдоктор Алексис Гримо, приглашенный профессор Ливия Джордано из Милано-Бикокка университета в Италии, и их сотрудники исследовали многообещающий класс каталитических материалов, известных как перовскиты, которые, в отличие от современных современных катализаторов, состоят из недорогих материалов с высоким содержанием земли. Чтобы понять, что определяет эффективность катализатора, они хотели сравнить поведение двух перовскитов, один из которых более каталитически активен, чем другой. Поэтому они испытали катализаторы на основе того же переходного металла — кобальта — в сочетании с лантаном и стронцием.
Чтобы ответить на этот вопрос, исследователи Массачусетского технологического института объединились с Оскаром Диас-Моралесом и Марком Т. Копером из Лейденского университета в Нидерландах. Вместе они проводят тесты, основанные на особой форме кислорода, которая служит экспериментальным маркером — изотопе кислорода-18 (кислород-16 — это форма, которая преобладает в обычной воде).
Чтобы начать свои испытания, они сначала погружают образец металлооксидного катализатора в «тяжелую» воду, почти полностью содержащую кислород-18, а затем проводят электролиз, вызывая реакции на катализаторе. Во время этого процесса любые атомы кислорода, которые выходят из кристаллической решетки катализатора на основе оксида кобальта, оставляют вакансии, которые затем заполняются новыми атомами кислорода — в данном случае атомами кислорода-18 из тяжелой воды.
Затем исследователи удаляют катализатор из тяжелой воды, помещают его в обычную воду и снова проводят процесс электролиза. Затем они анализируют образующийся газообразный кислород с помощью масс-спектрометра, который разделяет различные изотопы на основе их атомного веса. Результаты показывают, сколько кислорода-18 присутствует в газообразных продуктах — кислороде, который должен был храниться в оксиде металла в первой части эксперимента. Исследователи провели этот тест с катализаторами, изготовленными из кобальта и кислорода, а также различных пропорций лантана и стронция, и результаты заметно отличались. Как показано на рисунках ниже, версии, содержащие стронций, не только проявляли большую каталитическую активность во время электролиза (измеряемую по протеканию тока), но также давали различные смеси продуктов кислорода.
Как показано на рисунках ниже, версии, содержащие стронций, не только проявляли большую каталитическую активность во время электролиза (измеряемую по протеканию тока), но также давали различные смеси продуктов кислорода.
Испытания с катализаторами на основе оксида кобальта, содержащими лантан и стронций
На этих рисунках показаны результаты экспериментов с катализаторами на основе оксида лантана-кобальта и стронция-оксида кобальта. Слева: здесь ток — показатель каталитической активности во время электролиза — измеряется как функция движущей силы. (Движущая сила определяется как приложенное напряжение относительно электрода сравнения, в частности, обратимого водородного электрода.) По мере увеличения движущей силы активность катализатора на основе стронция намного превышает активность катализатора на основе лантана. Справа: в тех же экспериментах концентрации кислорода-36, образованного из кислорода, высвобождаемого из решетки оксида металла, значительно возрастают с движущей силой в тестах на стронций, но остаются практически постоянными с лантаном.
В газообразной форме молекулы кислорода состоят из пары атомов кислорода, связанных вместе. Анализ образцов, собранных в ходе экспериментов с катализатором на основе оксида лантана и кобальта, выявил кислород-32 — комбинацию двух атомов кислорода-16. Таким образом, кислород в газообразных продуктах поступает из воды, как это и предписывается общепринятой теорией.
Напротив, испытания с высокоактивным катализатором на основе оксида стронция-кобальта дали продукты, содержащие значительное количество кислорода-36, т. е. комбинации двух атомов кислорода-18 — атомов, которые могли произойти только из кристаллической решетки оксид металла (см. схему ниже).
Схема, показывающая выделение кислорода из решетки оксида металла
На этой схеме октаэдры представляют структуру катализатора оксида стронция-кобальта с интересующими атомами в их вершинах. Сверху поступают молекулы воды, состоящие из атомов водорода и кислорода-16. Во время электрохимической реакции атомы кислорода-18 высвобождаются из катализатора и объединяются в пары, образуя кислород-36, обнаруженный в экспериментах.
Эти результаты убедительно показывают, что кислород в кристаллической решетке принимает участие в реакции выделения кислорода. Интересно, что комбинированный лантан-стронциевый вариант катализатора производил кислород-34. В этом молекулярном соединении один кислород-16 из воды объединился с одним кислородом-18 из решетки оксида металла.
Одна возможность состоит в том, что кислород-18 адсорбируется и высвобождается только на поверхности катализатора. Чтобы проверить, исследователи подсчитали, сколько кислорода-18 может содержаться в объеме катализатора на основе оксида стронция-кобальта. Затем они определили, сколько материала потребуется для адсорбции и высвобождения количества кислорода-18, которое они измерили в газообразном кислороде. Их анализ подтверждает, что в поверхностных слоях недостаточно места для хранения. Действительно, кислород-18, который участвует, должен был появиться глубоко внутри катализатора на основе стронция.
Испытания со стронциевым катализатором принесли еще один интересный вывод: изменение кислотности воды вызывало значительные изменения каталитической активности. Для большинства катализаторов на основе оксидов металлов, включая оксид лантана и кобальта, изменение pH воды не влияет на скорость реакции. Но с высокоактивным катализатором на основе оксида стронция-кобальта повышение pH (то есть повышение его щелочности) увеличивало скорость выделения кислорода.
Для большинства катализаторов на основе оксидов металлов, включая оксид лантана и кобальта, изменение pH воды не влияет на скорость реакции. Но с высокоактивным катализатором на основе оксида стронция-кобальта повышение pH (то есть повышение его щелочности) увеличивало скорость выделения кислорода.
На рисунке ниже представлены результаты этих экспериментов с катализаторами. Влияние изменения рН почти незначительно в случае оксида лантана-кобальта, несколько больше, когда стронций заменяет часть лантана, и весьма заметно в тестах с оксидом стронция-кобальта.
Влияние pH на каталитическую активность
На этом рисунке показано, как изменение pH воды влияет на каталитическую активность катализаторов на основе оксида кобальта. В то время как активность катализатора на основе оксида лантана-кобальта не зависит от повышения pH, добавление стронция к катализатору меняет этот результат. В опытах с катализатором на основе оксида стронция-кобальта каталитическая активность вначале выше, а затем повышается быстрее по мере увеличения рН.
Копаем глубже
Очевидно, что высокоактивный катализатор не соответствует общепринятому мнению, что весь кислород для реакций выделения кислорода поступает из воды и что реакции происходят только на металлических участках на поверхности катализатора. Что отличает катализатор на основе оксида стронция-кобальта от катализатора на основе оксида лантана-кобальта?
Основываясь на своем теоретическом моделировании, исследователи пришли к выводу, что ответ лежит в электронной структуре двух оксидов металлов: в версии стронция связи металл-кислород гораздо более ковалентны. В любом материале существуют определенные энергетические уровни, которые могут занимать электроны, и электроны с наивысшим энергетическим уровнем легче всего удалить. В оксидах металлов с рекордно высокой каталитической активностью, таких как оксид стронция-кобальта, наивысшие уровни электронной энергии металла и кислорода совпадают, и говорят, что материалы являются ковалентными.
«В нашем катализаторе на основе стронция и металл, и кислород способны отдавать электроны на энергетическом уровне, необходимом для соединения пар освобожденных атомов кислорода с образованием молекул», — говорит Шао-Хорн.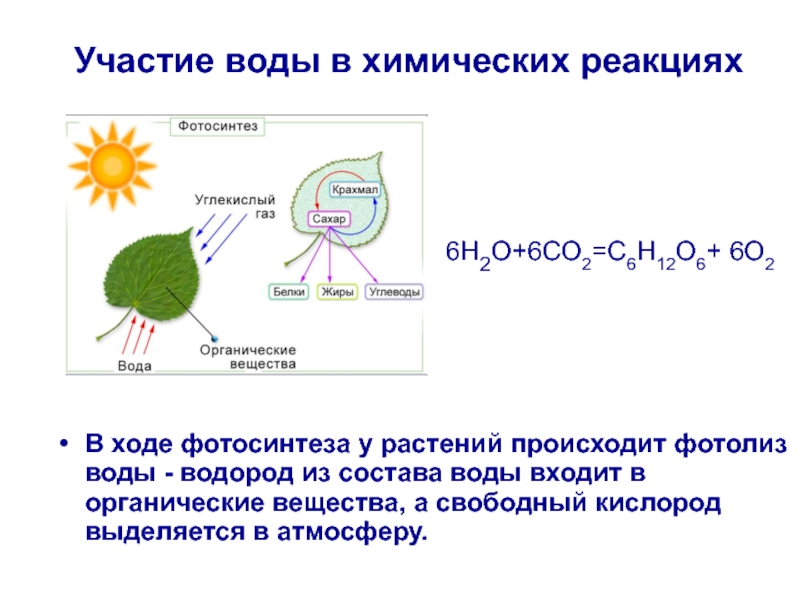 «В результате и металл, и кислород в катализаторе являются активными центрами для реакций выделения кислорода».
«В результате и металл, и кислород в катализаторе являются активными центрами для реакций выделения кислорода».
Выводы исследователей предполагают необходимость пересмотра теоретического механизма реакции, описывающего последовательность химических изменений, происходящих при выделении кислорода на металлооксидном катализаторе. Преобразование воды в кислород на катализаторе требует переноса четырех электронов и четырех протонов. Обычный механизм реакции говорит, что электроны и протоны должны двигаться одновременно. То есть их передача должна быть согласованной. «Но этот механизм не допускает участия кислорода из кристаллической решетки или зависимости от pH», — говорит Джордано.
Исследователи пришли к выводу, что при выделении кислорода на высокоактивном катализаторе из оксида металла должен происходить несогласованный перенос. Разделение переноса протонов и электронов допускает участие атомов кислорода из кристаллической решетки, и это объясняет, почему они наблюдали рН-зависимую реакционную способность. «Если механизм не согласован — скажем, сначала идет протон, а затем электрон, — тогда активность может зависеть от pH», — говорит Джордано. «Когда мы изменяем pH, мы изменяем концентрацию протонов в нашем электролите, и это повлияет на скорость реакции, но только если протоны и электроны могут двигаться независимо».
«Если механизм не согласован — скажем, сначала идет протон, а затем электрон, — тогда активность может зависеть от pH», — говорит Джордано. «Когда мы изменяем pH, мы изменяем концентрацию протонов в нашем электролите, и это повлияет на скорость реакции, но только если протоны и электроны могут двигаться независимо».
Руководство по проектированию
Новое понимание реакций выделения кислорода открывает новые направления для разработки эффективных катализаторов. Например, исследователи могут исследовать другие материалы, включая альтернативы кобальту, чтобы найти комбинации с более высокой ковалентностью. «Мы показали, что выделение кислорода из оксида металла увеличивает каталитическую активность», — говорит Джордано. «Поэтому для разработки особенно активных катализаторов мы должны попытаться увеличить ковалентность оксида металла, чтобы вызвать активацию кислорода в решетке и обеспечить несогласованный перенос протон-электрон». В этих условиях влияние на реактивность путем изменения pH воды становится еще одним направлением для изучения.
Их выводы дают еще один практический совет. В начале проекта основной целью было определить этап, ограничивающий скорость выделения кислорода. Скорость любой химической реакции определяется скоростью самой медленной стадии процесса. Таким образом, ускорение этого шага является ключом к ускорению общей реакции.
При использовании многих катализаторов на основе оксидов металлов скорость электролиза воды ограничена тем, насколько быстро кислород выходит из катализатора. Но в их высококовалентном материале перенос электронов, необходимый для освобождения молекул кислорода, должен быть довольно легким. «Итак, мы предполагаем, что удаление протонов с поверхности может на самом деле ограничивать скорость протекания реакции», — говорит Джордано. Они пока не могут подтвердить эту гипотезу, в основном потому, что нет единого мнения о том, как теоретически моделировать несогласованные этапы реакции на этих сложных материалах. «Это то, что мы действительно хотели бы сделать», — говорит она. Их следующая задача — выяснить, как это сделать.
Их следующая задача — выяснить, как это сделать.
В исследовательскую группу для этой работы также входили Уэсли Хонг, доктор философии 16 года, бывший постдоктор Юэ-Лин Ли и Келси Стоерзингер, доктор философии 16 года. Исследование проводилось при поддержке Центра электрохимической энергетики Сколтеха и Массачусетского технологического института, Сингапурского альянса по исследованиям и технологиям Массачусетского технологического института, Министерства энергетики США и Национальной лаборатории энергетических технологий. Дополнительную информацию можно найти в:
А. Гримо, О. Диас-Моралес, Б. Хан, В. Т. Хонг, Ю-Л. Ли, Л. Джордано, К.А. Штёрцингер, М.Т.М. Копер и Ю. Шао-Хорн. «Активация окислительно-восстановительных реакций кислорода в решетке в оксидах металлов для катализа выделения кислорода». Nature Chemistry , январь 2017 г. DOI: 10.1038/NCHEM.2695.
Эта статья опубликована в выпуске Energy Futures за весну 2017 года.
Распределение электроэнергии и хранение энергии
Для запросов прессы: [email protected]
Растворенный кислород – Управление растениями в водах Флориды – Комплексный подход – Университет Флориды, Институт пищевых и сельскохозяйственных наук
Кислород – это природный элемент, без которого не может жить ни одно животное. Рыбы и другие водные животные зависят от газообразного кислорода, растворенного в воде, так же, как люди зависят от газообразного кислорода в воздухе.
Многие люди с удивлением узнают, что рыбы и другие водные организмы не используют кислород из молекул воды (h3O). Это связано с тем, что одна молекула кислорода (O) связана с двумя молекулами водорода (h3) и не может использоваться в этой форме. Вместо этого водные организмы зависят от растворенного газообразного кислорода (O2), бесцветного вещества без вкуса и запаха, которое попадает в воду из растений и атмосферы.
Кислород растений
Используя углекислый газ, воду и энергию света, растения (водные и наземные) создают новые клетки и восстанавливают поврежденные, используя процесс, известный как фотосинтез. В качестве побочного продукта выделяется газообразный растворенный кислород.
В качестве побочного продукта выделяется газообразный растворенный кислород.
В водной среде свободно плавающие микроскопические растения, известные как водоросли, и более крупные подводные растения (макрофиты) выделяют кислород непосредственно в воду, где он используется животными и другими организмами, включая сами растения.
Кислородные установки
Хотя все растения производят кислород, некоторые производят больше, чем другие. В водной среде ряд видов водных растений обладают способностью насыщать кислородом.
Некоторые виды особенно популярны среди любителей аквариумов и прудов.
- Bacopa caroliniana (бакопа)
- Cabomba caroliniana (кабомба или веерник)
- Ceratophyllum demersum (хвост)
- Juncus repens (каша)
- Najas guadalupensis (южная наяда)
- Nymphoides aquatica (банановая лилия)
- Potamogeton diversifolius (водоросль водоросль)
- Vallisneria americana (ленточная трава или угорь)
К сожалению, некоторые из них не являются местными и могут стать инвазивными во Флориде.
- Hydrilla verticillata (гидрила)
- Myriophyllum aquaticum (перо попугая)
- Nymphoides cristata (белоснежная снежинка)
- Nymphoides peltata (желтое плавающее сердце)
Кислород из атмосферы
Помимо кислорода, вырабатываемого растениями, земное атмосферное давление постоянно выталкивает крошечные молекулы растворенного кислорода в поверхностные воды наших озер, прудов, океанов и бассейнов — даже в стеклянные воды на кухонном столе. Процесс известен как диффузия. Когда газообразный кислород выталкивается в воду, избыток кислорода из воды одновременно выделяется в воздух. Воздействие ветра и волн или механические аэраторы ускоряют диффузию, создавая большую площадь поверхности для проникновения кислорода в воду.
Уникальная способность воды удерживать и выделять кислород позволяет рыбам и другим животным дышать под водой. Однако концентрации кислорода в водной среде редко бывают стабильными.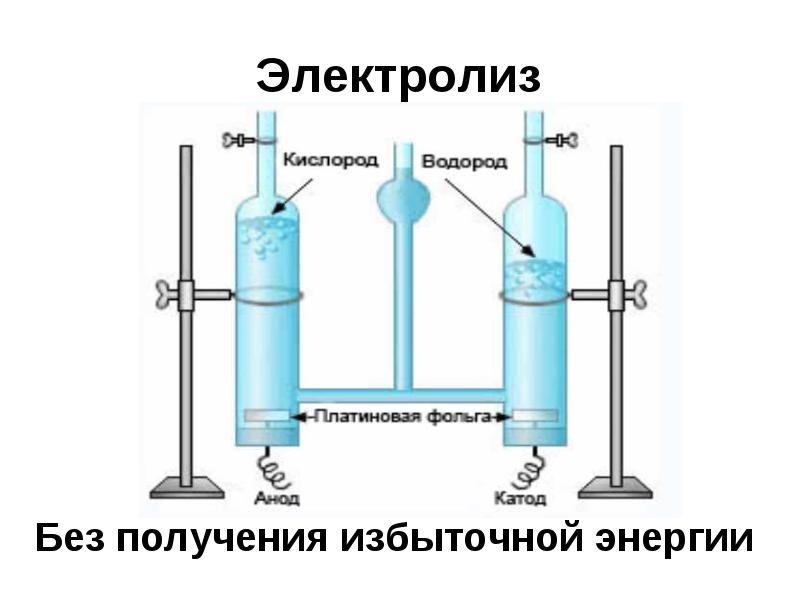 Когда светит солнце и водные растения (включая водоросли) фотосинтезируют на полную мощность, кислорода много. Однако после захода солнца фотосинтетическая активность и, следовательно, концентрация кислорода резко снижаются. Обычно в воде есть растворенный кислородный буфер, которого хватает до утра, когда процесс начинается снова. Однако, если что-то меняет схему, кислород может быть истощен.
Когда светит солнце и водные растения (включая водоросли) фотосинтезируют на полную мощность, кислорода много. Однако после захода солнца фотосинтетическая активность и, следовательно, концентрация кислорода резко снижаются. Обычно в воде есть растворенный кислородный буфер, которого хватает до утра, когда процесс начинается снова. Однако, если что-то меняет схему, кислород может быть истощен.
Погода и недостаток кислорода
Изменение уровня кислорода в течение дня
Погодные условия, особенно в субтропическом климате Флориды, могут вызывать проблемы с кислородным истощением. Несколько последовательных дней пасмурной погоды уменьшают количество солнечного света, доступного для фотосинтеза водорослями и растениями. Поскольку водоросли, растения и животные продолжают использовать сокращающиеся запасы кислорода, уровень кислорода падает ниже 2 мг/л. Рыбы и другие животные испытывают стресс, что увеличивает вероятность заболевания или, если условия сохраняются, смерти. За одну ночь может погибнуть большое количество рыбы. Это обычно называют гибелью рыбы. Обычно это происходит в ранние утренние часы или незадолго до рассвета (с 4 до 6 утра) и часто в жаркую погоду, когда изначально в воде мало кислорода.
За одну ночь может погибнуть большое количество рыбы. Это обычно называют гибелью рыбы. Обычно это происходит в ранние утренние часы или незадолго до рассвета (с 4 до 6 утра) и часто в жаркую погоду, когда изначально в воде мало кислорода.
Проливные дожди могут смывать органические вещества (листья, ветки и травы) в водоем и вызывать цепную реакцию, при которой быстро расходуется кислород. Как только мусор смывается водой, миллиарды микроорганизмов (включая бактерии и зоопланктон) начинают разлагать растительность. Если сразу вносится большое количество органического материала, повышенная активность микроорганизмов может ускорить потребление кислорода. Растворенные вещества из разлагающейся растительности в озере (или из водно-болотных угодий, окружающих озеро) также могут выщелачиваться в воду после сильного дождя и иметь аналогичный эффект; как и отходы с откормочных площадок или сточные воды из септиков. Для получения дополнительной информации о влиянии цвета и растворенных веществ на воду см.