Электролизер. Виды и типы. Устройство и работа. Применение
Электролизер – это специальное устройство, которое предназначено для разделения компонентов соединения или раствора с помощью электрического тока. Данные приборы широко используются в промышленности, к примеру, для получения активных металлических компонентов из руды, очищения металлов, нанесения на изделия металлических покрытий. Для быта они используются редко, но также встречаются. В частности для домашнего использования предлагаются устройства, которые позволяют определить загрязненность воды или получить так называемую «живую» воду.
Основа работы устройства принцип электролиза, первооткрывателем которого считается известный зарубежный ученый Фарадей. Однако первый электролизер воды за 30 лет до Фарадея создал русский ученый по фамилии Петров. Он на практике доказал, что вода может обогащаться в катодном или анодном состоянии. Несмотря на эту несправедливость, его труды не пропали даром и послужили развитию технологий. На данный момент изобретены и с успехом используются многочисленные виды устройств, которые работают по принципу электролиза.
Что это
Электролизер работает благодаря внешнему источнику питания, который подает электрический ток. Упрощенно агрегат выполнен в виде корпуса, в который вмонтировано два или несколько электродов. Внутри корпуса находится электролит. При подаче электрического тока происходит разложение раствора на требуемые составляющие. Положительно заряженные ионы одного вещества направляются к отрицательно заряженному электроду и наоборот.
Основной характеристикой подобных агрегатов является производительность. То есть это количество раствора или вещества, которое установка может перерабатывать за определенный период времени. Данный параметр указывается в наименовании модели. Однако на него также могут влиять и иные показатели: сила тока, напряжение, вид электролита и так далее.
Виды и типы
По конструкции анода и расположению токопровода электролизер может быть трех видов, это агрегаты с:
- Прессованными обожженными анодами.
- Непрерывным самообжигающимся анодом, а также боковым токопроводом.
- Непрерывным самообжигающимся анодом, а также верхним токопроводом.
Электролизер, используемый для растворов, по конструктивным особенностям можно условно разделить на:
- Сухие.
- Проточные.
- Мембранные.
- Диафрагменные.
Устройство
Конструкции агрегатов могут быть различными, но все они работают на принципе электролиза.
Устройство в большинстве случаев состоит из следующих элементов:
- Электропроводящий корпус.
- Катод.
- Анод.
- Патрубки, предназначенные для ввода электролита, а также вывода веществ, полученных в ходе реакции.
Электроды выполняются герметичными. Обычно они представлены в виде цилиндров, которые сообщаются с внешней средой с помощью патрубков. Электроды изготавливаются из специальных токопроводящих материалов. На катоде осаждается металл или к нему направляют ионы отделенного газа (при расщеплении воды).
В цветной промышленности часто применяют специализированные агрегаты для электролиза. Это более сложные установки, которые имеют свои особенности. Так электролизер для выделения магния и хлора требует ванну, выполненную из стенок торцевого и продольного вида. Она обкладывается с помощью огнеупорных кирпичей и иных материалов, а также делится с помощью перегородки на отделение для электролиза и ячейку, в которой собираются конечные продукты.
Конструктивные особенности каждого вида подобного оборудования позволяют решать лишь конкретные задачи, которые связаны с обеспечением качества выделяющихся веществ, скоростью происходящей реакции, энергоемкостью установки и так далее.
Принцип действия
В электролизных устройствах электрический ток проводят лишь ионные соединения. Поэтому при опускании электродов в электролит и включении электрического тока, в нем начинает течь ионный ток. Положительные частицы в виде катионов направляются к катоду, к примеру, это водород и различные металлы. Анионы, то есть отрицательно заряженные ионы текут к аноду (кислород, хлор).
При подходе к аноду анионы лишаются своего заряда и становятся нейтральными частицами. В результате они оседают на электроде. У катода происходят похожие реакции: катионы забирают у электрода электроны, что приводит к их нейтрализации. В результате катионы оседают на электроде. К примеру, при расщеплении воды образуется водород, которые поднимается наверх в виде пузырьков. Чтобы собрать этот газ над катодом сооружаются специальные патрубки. Через них водород поступает в необходимую емкость, после чего его можно будет использовать по назначению.
Принцип действия в конструкциях разных устройств в целом схож, но в ряде случаев могут быть и свои особенности. Так в мембранных агрегатах используется твердый электролит в виде мембраны, которая имеет полимерную основу. Главная особенность подобных приборов кроется в двойном назначении мембраны. Эта прослойка может переносить протоны и ионы, в том числе разделять электроды и конечные продукты электролиза.
Диафрагменные устройства применяются в случаях, когда нельзя допустить диффузию конечных продуктов электролизного процесса. С этой целью применяют пористую диафрагму, которая выполнена из стекла, асбеста или керамики. В ряде случаев в качестве подобной диафрагмы могут применяться полимерные волокна либо стеклянная вата.
Применение
Электролизер широко применяется в различных отраслях промышленности. Но, несмотря на простую конструкцию, оно имеет различные варианты исполнения и функции. Данное оборудование применяется для:
- Добычи цветных металлов (магний, алюминий).
- Получения химических элементов (разложение воды на кислород и водород, получение хлора).
- Очистки сточных вод (обессоливание, обеззараживание, дезинфекция от ионов металлов).
- Обработки различных продуктов (деминерализация молока, посол мяса, электроактивация пищевых жидкостей, извлечение нитратов и нитритов из овощных продуктов, извлечения белка из водорослей, грибов и рыбных отходов).
В медицине установки используются в интенсивной терапии для детоксикации организма человека, то есть для создания растворов гипохлорита натрия высокой чистоты. Для этого используется устройство проточного вида с электродами из титана.
Электролизные и электродиализные установки нашли широкое применение для решения экологических проблем и опреснения воды. Но эти агрегаты в виду их недостатков используются редко: это сложность конструкции и их эксплуатации, необходимость трехфазного тока и требования периодической замены электродов из-за их растворения.
Подобные установки находят применение и в быту, к примеру, для получения «живой» воды, а также ее очистки. В будущем возможно создание миниатюрных установок, которые будут использоваться в автомобилях для безопасного получения водорода из воды. Водород станет источником энергии, а машину можно будет заправлять обычной водой.
Похожие темы:
Электролиз обыкновенной воды
В данной статье поговорим про электролиз обыкновенной воды.
Тот, кто не задумываясь, тешит себя роликами с Ютюба, а после этого пытается повторить преподнесённое им на блюдечке, обречён на неудачу. Интернет «кишит» роликами-обманками, и это шоу является частью жизни людей. Кто-то на этом зарабатывает деньги, а кто-то помогает ему зарабатывать деньги, просматривая это шоу. К видеороликам необходимо подходить осторожно. Я, например, знаю, что можно повысить КПД электролизной установки, но я не уверен, действительно ли Мэйер ездил на своем автомобиле на воде? Первое, я себе доказал и теоретически и практически, а второе пока нет.
Для достаточного количества газа необходимого автомобилю, площадь электродов в ячейке Мэйера слишком мала! Один из загадочных элементов в конструкции автомобиля Мэйера – красный бак, находящийся за креслом водителя. Про него ничего нигде не пишут. В бак вставлены ячейка — «Resonant Cavity», индикатор уровня воды – «water level indicator», и лазерный стимулятор. Всё кроме этого бака, так или иначе, описано, а про бак вообще ничего. Неужели это и есть топливный бак (для воды). Но на видеороликах Мэйер наливает воду непосредственно в ячейку. Это было небольшое отступление от темы статьи, а для Вас — тема для раздумий.
Мои исследования, прежде всего, направлены не на скорейшее «подключение» электролизной ячейки к автомобилю, а на максимальное повышение её производительности. Цель – уменьшить электролизный ток, или другими словами – затраты энергии, но при этом увеличить объём выхода кислородно-водородной смеси. В ходе моих экспериментальных исследований выявились определённые физические свойства воды, изучив которые и в последующем используя, удалось увеличить производительность обыкновенной электролизной установки в несколько раз. Сначала я начинал эксперименты с установки, собранной из пластин, но в ходе экспериментов пришлось от них отказаться, перейдя на трубки. Пластины, представляли собой несогласованную нагрузку на сверхвысоких частотах. Тяжело было сделать синфазный СВЧ-разветвитель без потери мощности. Самая банальная, но главная проблема – все активные элементы должны были быть равноудалены от специального СВЧ-резонатора на расстояние кратное длине волны, иначе происходило неравномерное выделение газа. Поэтому я вынужден был перейти на трубки.
Для того, чтобы было с чем сравнивать в дальнейшем, последовательность экспериментов началась с обыкновенного электролиза постоянным током. Опыты я проводил на установке изображённой ниже. Электролизную ячейку я наполнял обыкновенной, пропущенной через угольный фильтр водопроводной водой, не используя при этом кислоты и щелочи. Во время эксперимента, из электролизной ячейки, водородно-кислородная смесь поступала в «перевёрнутую» наполненную водой ёмкость 1 объёмом 100 миллилитров. В начале опыта, при включении установки запускался секундомер. Когда ёмкость наполнялась газом и появлялись выходящие из неё во внешнюю ёмкость 2 пузырьки, секундомер останавливался. Для сокращения времени на опыты, были взяты три пары трубок описанных в патентах Мейера длиной 4 дюйма. Общая площадь электролизного активного пространства (площади электродов) составила около 180 см2.
Указанную ёмкость я «наполнял» газом несколько раз при различных токах электролиза. Мной были выбраны токи: 0,25А; 0,5А; 1А; 1,5А; 2А.
При обыкновенном электролизе постоянным током обнаружилось, что с повышением напряжения U на пластинах электролизной установки, происходит нелинейный рост тока I. По предварительному предположению, пузырьки газа должны препятствовать прохождению тока в межэлектродном пространстве, поэтому увеличение напряжения на пластинах должно приводить к увеличению сопротивления водно-газовой смеси по параболическому закону. На самом деле происходило обратное явление.
Сопротивление R , с повышением напряжения резко падало по нелинейному графику – «гиперболе». Ожидалось, что появляющиеся на поверхности электродов пузырьки газов должны препятствовать прохождению электрического тока между электродами. Но на практике, оказалось, что при повышении тока еще на малых его значениях, происходило резкое падение сопротивления, а при токах выше 7-ми ампер, свойства проводимости воды не изменяются – выполняется Закон Ома. Описанное явление поясняется графиками.
Опыты показали, что пузырьки газов не препятствуют току, а наоборот – проводят его. Произведя несложные вычисления расхода электрической мощности P, и сопоставив её с выходом газа V, получился интересный результат. Оказалось, что чем меньше мощность, а конкретнее – ток, тем производительнее установка. Другими словами, затраты электроэнергии на единицу объёма вырабатываемой кислородно-водородной смеси меньше при малых токах, а при повышении тока, растут его паразитные потери. Это показано на следующих графиках.
Безусловно, при большом токе вырабатывается больше газа, ведь мы стремимся к большему количеству газа, но соотношение выхода газа к затраченной мощности резко падает, что снижает КПД установки.
Проводя эксперименты, я заметил, что в начальный момент подачи фиксированного напряжения, ток электролизной установки увеличивается не сразу, а постепенно. Что это за явление? Какой бы ток не прикладывался, вода свой химический состав не изменит. Это же не философский камень: «Из гумна делать золото». Можно было предположить, что вода обладает индуктивными свойствами, но откуда этим свойствам взяться? Другой вариант является наиболее приемлемым – вода, под действием электрического тока изменяет свои электрохимические свойства. Но что изменяется? Неужели молекулы медленно выстраиваются в ряды? Можно долго рассуждать об ориентации и вытягивании молекул, как это объясняет Мэйер, о поверхностной ионизации электродов, как это делает Канарев, но мы не будем этого делать сейчас. В ходе экспериментов я обратил внимание, что пузырьки образуются не только на внутренних поверхностях электродов, но и снаружи (более медленно). Я решил сбить пузырьки ударами по пластиковому корпусу моей электролизной установки. И тут я заметил, что когда я стучал рукояткой отвёртки по корпусу электролизёра, то стрелка амперметра незначительно, но резко отклонялась в меньшую сторону, а через секунду возвращалась на прежнее деление шкалы. Это и стало очередным открытием. Я подключил вместо стрелочного амперметра параллельно соединенные осциллограф и 25-ти ваттный резистор сопротивлением 1 Ом. При ударах по корпусу электролизной установки, на экране осциллографа наблюдалось более резкое падение тока. Оказалось, что в результате тряски, поверхность электродов быстрее освобождалась от пузырьков газа, что приводило к уменьшению паразитного тока снижающего КПД установки. Этот факт и явился решающим в моих дальнейших экспериментах.
Необходимо было создать такое устройство, которое бы «трясло» электролизную установку. На роль трясущего можно рассмотреть кандидатуру пенсионера — нигде не работает, сидит и трясёт, но он занимает определённый объём пространства, его надо кормить, лечить его старые косточки! Выйдет дороже! Поэтому необходимы технические средства.
На некоторых сайтах встречаются статьи о том, что трубки Мэйера имеют специальные пропилы для настройки в резонанс на звуковых частотах. Пропилы вы видите на рисунке.
Конечно, такой вариант использования звуковых колебаний возможен, но крепление трубок сделано так, что не позволяет трубкам вибрировать. Зная о том, что вода хорошо передает звуковые колебания, проще установить в ёмкости один, например – ультразвуковой резонатор и эффект достигнут. Мной использовался обыкновенный генератор прямоугольных импульсов на ТТЛ-микросхеме и ультразвуковой «пятак». Эксперимент с ультразвуковым резонатором показал незначительное увеличение количества выхода газа, при неизменной затрачиваемой мощности. Характеристика этого процесса показана на графике.
Здесь первый график – отношение объёма выходящего газа V, к электрической мощности P, от самой мощности, затрачиваемой на получение кислородно-водородной смеси без ультразвукового воздействия, а второй график — с ультразвуковым воздействием. Положительный эффект имеется, но не выразительный. На малой мощности (малом токе), ультразвуковое воздействие вообще не влияет на процесс электролиза, а на большой мощности производительность установки в некоторой степени повышается. В идеале, можно предположить, чем сильнее вибрация, тем выше будет график производительности, но для удаления пузырьков газа из межэлектродного пространства всё равно необходимо время.
Один из вариантов, позволяющих удалять пузырьки газа из межэлектродного пространства – обеспечить быструю циркуляцию воды, вымывающую пузырьки кислорода и водорода. Этот способ использует в своих реакторах товарищ Канарёв. А Мэйер, помимо других способов, конструкцию трубок своей мобильной установки сделал так, чтобы обеспечить наилучшую естественную циркуляцию воды и газов.
Обратившись к патентам Мэйера, я обратил внимание на то, что в патентах он значительное место отводит лазерной стимуляции. Мерцание светодиодов происходит на частоте, приблизительно равной 30 кГц. В качестве стимуляторов, используются мощные красные светодиоды, подобные тем, которые стоят в лазерных указках. Колупать лазерные указки – не дешёвое удовольствие, поэтому я этого делать не стал. Можно конечно повозиться со сверхъяркими светодиодами, но я до этого не дошёл. Если у Вас есть желание и возможности, попробуйте.
До красного светового диапазона я не дошёл, остановившись на СВЧ-частотах. Как я писал ранее, используется резонансная частота молекул воды. Это позволяет коротким маломощным импульсом с СВЧ-заполнением «встряхнуть» практически любой объём воды. Но поскольку непрерывное колебание на сверхвысоких частотах способно только нагревать молекулы воды (подобно квазинепрерывному колебанию микроволновой СВЧ-печи), а нам этого не надо, я применил короткий импульс. Старая конструкция показала неравномерный выход газа из разных пар трубок, поэтому пришлось переделывать конструкцию ячейки с выполнением премудростей техники СВЧ. Благодаря использованию короткого сверхвысокочастотного импульса, произошло значительное увеличение количества выхода газа, при неизменной затрачиваемой мощности.
Здесь первый график – зависимость отношения объёма выходящего газа V, к мощности P, от самой электрической мощности, затрачиваемой на получение кислородно-водородной смеси без дополнительного воздействия. Второй график – с ультразвуковым воздействием, а третий — с воздействием СВЧ-импульсом. Положительный эффект от стимуляции СВЧ-импульсами выразительнее, чем стимуляция ультразвуком. В ходе экспериментов при СВЧ-стимуляции, наблюдалось незначительное падение производительности на подводимой мощности около 16-ти Ватт, а потом снова наблюдался подъём производительности. Что это за падение, объяснить пока не могу, думал – ошибка измерения, но при повторных экспериментах и проводимых с использованием других приборов «падение» повторялось. Для точности, повторные измерения проводились с шагом тока в 0,2А, в диапазоне от 0,2А, до 2,4А. На конечном участке графика происходило резкое падение производительности. Правильнее сказать – ток повышался, а количество газа не увеличивалось. Предполагаю, что на больших токах, большое количество выделяемого газа препятствовало работе установки, поэтому при более больших токах, я экспериментировать не стал, нет смысла.
Если Вы посмотрите на последний график, то сможете сделать вывод: эта экспериментальная установка с полезной площадью электродов равной 180 см2 (три пары трубок), способна при затрате 27 Ватт электрической мощности вырабатывать около 2,2 литров кислородно-водородной смеси в час. При указанной мощности и напряжении 12 вольт, ток потребления приблизительно будет равен 2,25 ампера. Отсюда следует, что для выработки 22 литров кислородно-водородной смеси в час, требуется 270 Вт электрической энергии, что при бортовом напряжении в 12 вольт соответствует току 22,5 ампер. При этом необходимо 30 пар трубок высотой около 10 сантиметров. Как видите, ток не малый, но он вполне «вписывается» в затраты энергии штатным генератором автомобиля. Можно и по другому: на 1 киловатт затраченной электрической мощности вырабатывается 81 литр газа, или с пересчётом на метры кубические – необходимо приблизительно 12,3 киловат*час. для выработки одного кубического метра кислородно-водородной смеси.
Если сравнивать с известными электролизными установками, например ИФТИ, затрачивающими 4…5 киловат*час на кубический нормированный метр водорода, то описанная в этой статье установка проигрывает в производительности, поскольку она затрачивает на кубический нормированный метр водорода 18,5 киловат*час. Поэтому из приведённых мной цифр делайте выводы сами.
Обратите внимание, что в описываемой мной установке используется обыкновенная вода, не «сдобренная» каустической содой, или другой щелочью. Щелочь необходима в обыкновенных электролизных установках, без неё установки не производительны. Кроме того, подача напряжения на электроды производится в непрерывном режиме. Но по патентам Мэйера следует, что он использовал импульсный режим. Мэйер пишет, что во время пауз, происходит восстановление воды. Думаю, что паузы в подаче напряжения используются для очистки электродов от пузырьков газа, которые вызывают появление в межэлектродном пространстве дополнительных паразитных токов.
Какой объем газа необходим для работы двигателя внутреннего сгорания, я пока не разбирался. Но то, что показывают на Ютюбе, мало соответствует действительности.
Электролиз воды в промышленных генераторах водорода
Электролиз
это окислительно-восстановительная реакция, которая протекает только под действием электричества. В промышленных генераторах водорода для получения водорода и кислорода проводят электролиз воды. Для протекания реакции необходимо поместить в электролит два электрода, подключенных к источнику питания постоянного тока:- Анод — электрод к которому подключен положительный проводник;
- Катод — электрод к которому подключен отрицательный проводник.

Электролиз воды
Под действием электрического тока вода разделяется на составляющие ее молекулы: водород и кислород. Отрицательно заряженный катод притягивает катионы водорода а положительно заряженный анод — анионы ОНДеминерализованная вода, используемая в промышленных электролизных установках сама по себе является слабым электролитом, поэтому в нее добавляют сильные электролиты для увеличения проводимости электрического тока. Зачастую выбирают электролиты с меньшим катионным потенциалом, чтобы исключить конкуренцию с катионами водорода : KOH или NaOH. Электрохимическая реакция протекающая на электродах выглядит следующим образом:
- Реакция на аноде: 2H2O → O2 + 4H+ + 4e− — выделение кислорода;
- Реакция на катоде: 2H2O + 2e− → H2 + 2OH− — выделение водорода.
Данный метод является наиболее применяемым методом в промышленности и позволяет получать газообразный водород с КПД от 50 до 70% производительностью до 500 м3/час при удельных энергозатратах 4,5-5,5 Н2м3/кВт-ч.
ЭЛЕКТРОЛИЗ НА ТПЭ
В настоящий момент к наиболее эффективным методом разделения можно отнести электролиз с применением твердо-полимерных электролитов на основе перфторированной ионно обменной мембраны.
Данный тип электролизеров позволяет получать водород с КПД до 90% и является наиболее экологичным. Электролизеры с ТПЭ дороже щелочных в 6-7 раз и поэтому пока не получили свое распространение в промышленности.
Электролизер TDS — Проверяем воду дома
Дополнил значения цветов и последствия для человекаЦвет воды после электролиза Загрязняющие вещества Влияние на человеческий организм
Розовый Оксид железа (медянка) Рвота, диарея, уремия
Зеленый Медный азот (медянка) Страдают почки и центральная нервная система
Соединения хлора (CL) Канцерогенные вещества
Сульфат алюминия (Алюминий) Опасно для нервной системы
Синий Удобрения, пестициды Неблагоприятно для печени и почек
Магниевые соединения,
соединения кальция Диарея, рвота
Белый Коллоидные бактерии, вирусы, Инфекционные заболевания
водоросли
Асбест Асбест Канцерогены
Черный Соединения тяжелых металлов Опасно для печени, почек, центральной
нервной системы, сердца,
накапливаются в организме.
Желтый, оранжевый Минералы Необходимые организму микро и макро элементы
Без цвета Дистиллированная (техническая) вода Отсутствие полезных минералов
Электролиз воды — Electrolysis of water
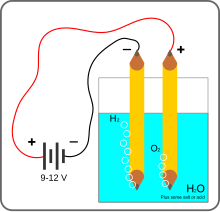 Простая установка для демонстрации электролиза воды в домашних условиях
Простая установка для демонстрации электролиза воды в домашних условиях 
Электролиз воды является разложение воды в кислород и водород газа из — за прохождения электрического тока . Реакция имеет стандартный потенциал -1.23 V, то есть его в идеале требует разность потенциалов 1,23 вольт для расщепления воды.
Этот метод может быть использован для газообразного водорода и кислорода для дыхания. Поскольку водород является важным промышленным товаром, на сегодняшний день большинства промышленных способов получения водорода из природного газа , вместо того, чтобы , в паровом риформинге процесса.
история
Ян Рудольф Deiman и Адриан ван Paets Troostwijk используются, в 1789 году, электростатический машин для производства электричества , который был выписан на золотые электродов в лейденских банках с водой. В 1800 году Алессандро Вольта изобрел гальваническую груду , и через несколько недель Уильям Николсон и Энтони Carlisle использовали его для электролиза воды. Когда Зеноб Теофил Грамм изобрел машину Грамма в 1869 г. электролиза воды стал дешевым способом для производства водорода. Способ промышленного синтеза водорода и кислорода посредством электролиза был разработан Дмитрием Лачинами в 1888 году.
Принцип
Источник электропитания постоянного тока подключен к двум электродам или два пластин ( как правило , изготовленных из металла , какого — либо инертного , такие как платина , нержавеющая сталь или иридий ) , которые помещены в воде. Водород будет появляться на катоде (где электроны входят в воду), и кислород будет появляться на аноде . Предполагая , что идеальную фарадеевскую эффективность , то количество водорода генерируется в два раза превышаю количество кислорода, и оба они пропорциональны к общему электрическому заряду , проведенному раствором. Тем не менее, во многих клетках конкурирующих побочные реакции происходят, что приводит к различным продуктам и меньше , чем идеальная фарадеевская эффективность.
Электролиз из чистой воды требует избыточной энергии в форме перенапряжения , чтобы преодолеть различные барьеры активации. Без лишней энергии электролиз чистой воды происходит очень медленно или вовсе нет. Это отчасти из — за ограниченную самостоятельную ионизацию воды . Чистая вода имеет электропроводность около одной миллионной в морской воде. Многие электролизеры могут также отсутствие необходимых электрокатализаторов . Эффективность электролиза увеличивается за счет добавления электролита (например, соли , с кислотой или основанием ) и использование электрокатализаторах .
В настоящее время электролитический процесс редко используется в промышленных применениях , так как водород , в настоящее время может быть получен более приемлемым из ископаемого топлива .
уравнения

В чистой воде при отрицательно заряженный катод, уменьшение реакция происходит, с электронами (е — ) с катода отдается катионы водорода с образованием газообразного водорода. Полуреакции , сбалансирован с кислотой, является:
- Снижение на катоде: 2 Н + ( водн ) + 2е — → H 2 ( г )
В положительно заряженного анода, окисление происходит реакция, генерации газообразного кислорода и давая электроны к аноду , чтобы замкнуть цепь:
- Окисление на аноде: 2 Н 2 О ( л ) → O 2 ( г ) + 4 Н + ( водно ) + ом —
Та же полуреакция также может быть сбалансирована с основанием, как указано ниже. Не все полуреакции должны быть сбалансированы с кислотой или основанием. Многие из них, как окисление или восстановление воды, перечисленных здесь. Чтобы добавить половину реакции они оба должны быть сбалансированы с любой кислотой или основанием. Кислотно-сбалансирован реакции преобладают в кислых растворах (низкий рН), в то время как базовые балансировкой реакции преобладают в основных растворах (с высоким рН).
| Катод (сокращение): | 2 Н 2 О ( л ) + 2е — | → | Н 2 ( г ) + 2 ОН — ( водн ) |
| Анод (окисление): | 2 ОН — ( водно ) | → | 1/2 O 2 ( г ) + Н 2 О ( л ) + 2 е — |
Сочетание либо полуреакция дает то же общее разложение воды на кислород и водород:
- Общая реакция: 2 Н 2 О ( л ) → 2 Н 2 ( г ) + O 2 ( г )
Число молекул водорода, полученного таким образом, в два раза превышает число молекул кислорода. Предполагая, равную температуру и давление для обоих газов, полученный газ водород имеет, следовательно, в два раза объем производимого газообразного кислорода. Число электронов проталкивается через воду в два раза превышает число генерируемых молекул водорода и в четыре раза числа генерируемых молекул кислорода.
Термодинамика
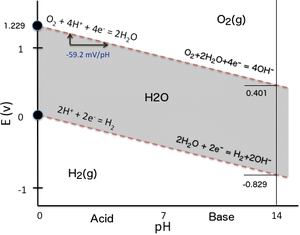
Разложение чистой воды на водород и кислород при нормальной температуре и давлении не является благоприятным в термодинамических условиях.
| Анод (окисление): | 2 Н 2 О ( л ) | → | O 2 ( г ) + 4 Н + ( водн ) + 4e — | Е о = 1,23 В (для восстановления полуоси уравнения) | |
| Катод (сокращение): | 2 Н + ( водно ) + 2е — | → | Н 2 ( г ) | Е о = 0,00 В |
Таким образом, стандартный потенциал воды электролизера (E ø ячейки = Е о катоде — Е о аноде ) составляет -1,23 В при 25 ° С при рНе 0 ([H + ] = 1,0 М). При температуре 25 ° С с рН 7 ([H + ] = 1,0 × 10 -7 М), потенциал не изменяется на основе уравнения Нернста . Термодинамический стандартный потенциал клетки может быть получен из стандартного состояния свободных расчетов энергии , чтобы найти ΔG ° , а затем , используя уравнение: ΔG ° = -nFE ° (где Е ° является потенциал клетки). На практике , когда электрохимическая ячейка «ведомая» к завершению, применяя разумный потенциал, она кинетический контролируются. Таким образом, энергия активации, подвижности ионов (диффузия) и концентрация, сопротивление проволоки, поверхность помеха , включая образование пузырьков (вызывает площадь электрода закупорку), и энтропию, требует более приложенного потенциала , чтобы преодолеть эти факторы. Сумма увеличения потенциала , необходимого называется перенапряжением .
выбор Электролит

Если описанные выше процессы происходят в чистой воде, H + катионы будут потребляться / уменьшены на катоде и ОН — анионы будут потребляться / окисляются на аноде. Это может быть проверено путем добавления индикатора рН в воде: вода вблизи катода является основным , а вода вблизи анода является кислой. Эти отрицательные ионы гидроксида , которые приближаются к аноду в основном , в сочетании с положительными ионами гидроксония (H 3 O + ) с образованием воды. Положительные ионы гидроксония , которые приближаются к катоду в основном в сочетании с отрицательными ионами гидроксида с образованием воды. Относительно небольшое количество ионов гидроксония / гидроксид достигают катода / анода. Это может привести к концентрации перенапряжения на обоих электродах.
Чистая вода является достаточно хорошим диэлектриком , так как он имеет низкую автоионизацию , К ш = 1,0 × 10 -14 при комнатной температуре и , таким образом , чистая вода проводит ток плохо, 0,055 мкСм · см -1 . Если очень большой потенциал не применяется , чтобы вызвать увеличение автоионизацией воды электролиз чистой воды протекает очень медленно ограничена общей проводимости.
Если растворимый в воде электролит добавляют, проводимость воды значительно повышается. Электролит диссоциирует на катионы и анионы; анионы устремитесь к аноду и нейтрализовать накопление положительно заряженного Н + там; аналогичным образом , катионы устремляются к катоду и нейтрализовать накопление отрицательно заряженный ОН — там. Это позволяет непрерывный поток электричества.
Электролит для электролиза воды
Необходимо соблюдать осторожность при выборе электролита, так как анион , из электролита находится в конкуренции с ионами гидроксидом , чтобы дать вверх по электрону . Электролита анион с менее стандартным электродным потенциалом , чем гидроксид будет окисляться вместо гидроксида, и ни один газообразный кислорода не будет производиться. Катион с большим стандартным электродным потенциалом , чем ион водорода будет уменьшен вместо этого, и ни один газообразного водорода не будет производиться.
Следующие катионы имеют более низкий электродный потенциал , чем Н + и, следовательно , пригодны для использования в качестве катионов электролита: Li + , Rb + , К + , Cs + , Ва 2+ , Sr 2+ , Са 2+ , Na + и Mg 2 + . Натрия и лития часто используются, так как они образуют недорогие, растворимые соли.
Если кислота используется в качестве электролита, катион Н + , и нет ни одного конкурента для H + , созданного отмежевывается воды. Наиболее часто используемый анион является сульфат ( SO 2-
4 ), так как это очень трудно окислить, со стандартным потенциалом для окисления этого иона к пероксидисульфату иону +2.010 вольта.
Сильные кислоты , такие как серная кислота (H 2 SO 4 ) и сильные основания , такие как гидроксид калия (KOH) и гидроксид натрия (NaOH) часто используют в качестве электролитов из — за их сильные проводящие способности.
Твердый полимерный электролит также может быть использован , такой как Nafion и при нанесении с помощью специального катализатора на каждой стороне мембраны может эффективно разделить молекулу воды с всего лишь 1,5 вольт. Есть также ряд других твердых электролитных систем , которые были опробованы и разработанной с рядом систем электролизных теперь доступен коммерчески , которые используют твердые электролиты.
Чистый электролиз воды
Электролит свободной электролиз чистой воды была достигнута с помощью глубокой суб-Дебай длины нанометрических зазоров электрохимических ячеек . Когда расстояние зазор между катодом и анодом , даже меньше , чем дебаевской длины (1 микрон в чистой воде, около 220 нм в дистиллированной воде), в двухслойных регионы из двух электродов могут перекрываться друг с другом, что приводит к равномерно высокое электрическое поле распределяется внутри весь зазор. Такое высокое электрическое поле может значительно повысить перенос ионов внутри воды ( в основном за счет миграции), дальнейшее повышение уверенности в ионизацию воды и сохранение всей реакции продолжается, и показывает малое сопротивление между двумя электродами. В этом случае две полуреакции соединены друг с другом и ограничиваются шагами переноса электронов (ток электролиза насыщенным при дальнейшем уменьшении расстояния электрода).
методы
Фундаментальная демонстрация
Два провода , идущие от клемм батареи, помещают в чашку воды с количеством электролита , чтобы установить проводимость в растворе. Используя NaCl (поваренную соль) на результатах раствора электролита в хлора газа , а не кислород из — за конкурирующую полуреакцию . С правильными электродами и правильным электролитом, такими как пищевая сода ( бикарбонат натрия ), газа водорода и кислородом будет течь из противоположно заряженных электродов . Кислород будет собирать на положительно заряженного электрода ( анода ) и водорода будут собирать на отрицательно заряженный электрод ( катода ). Следует отметить , что водород положительно заряженный в H 2 молекулы О, так что в конце концов на отрицательном электроде. (И наоборот , для кислорода) .
Следует отметить , что водный раствор воды с ионами хлорида, когда электролизу, приведет либо ОН — если концентрация Cl — низкий, или в газообразный хлор будучи преимущественно разряжается , если концентрация Cl — больше , чем 25% по массе в решение.
 Тест Match используется для обнаружения присутствия газообразного водорода
Тест Match используется для обнаружения присутствия газообразного водородаHofmann вольтаметр
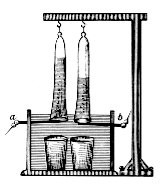
Аппарат Гофман часто используются в качестве малого электролизере. Она состоит из трех соединенных вертикальных цилиндров. Внутренний цилиндр является открытым в верхней части , чтобы позволить добавление воды и электролита. Платины электрод помещаются в нижней части каждого из двух боковых цилиндров, соединенного с положительными и отрицательными выводами источника электроэнергии . Когда ток проходит через Вольтметр Hofmann, газообразные формы кислорода на аноде (положительный) и газообразного водорода на катоде (отрицательный). Каждый газ вытесняет воду и собирает в верхней части два наружных труб, где оно может быть отсасывают с запорным краном.
промышленные
Многие промышленные электролизеры очень похожи на Hofmann voltameters , со сложными платиновыми пластинами или сотнями в качестве электродов. Как правило , единственный раз , когда водород преднамеренно производится из электролиза для конкретной точки использования приложений , таких как в случае с гремучими факелами или при чрезвычайно высокая чистотой водород или кислород желательно. Подавляющее большинство водорода получают из углеводородов и в результате содержит следовые количества окиси углерода среди других примесей. Примеси окиси углерода могут быть вредными для различных систем , включая многие топливные элементы .
Высокое давление
Электролиз высокого давления является электролиз воды с помощью сжатого водорода выход около 12-20 МПа (120-200 бар , 1740-2900 фунтов на квадратный дюйм ). Путем повышения давления водорода в электролизере, необходимость внешнего компрессора водорода исключается; среднее потребление энергии для внутреннего сжатия составляет около 3%.
Высокая температура
Высокотемпературный электролиз (также HTE или пар электролиз) представляет собой метод в настоящее время исследуется для электролиза воды с тепловым двигателем . Высокая температура электролиза может быть предпочтительнее традиционной комнатной температуре электролиза , так как часть энергии поступает в виде тепла, что дешевле , чем электричество, а потому что реакция электролиза является более эффективным при более высоких температурах.
Алкалиновая вода
мембранный электролит Полимер
Никель / железо
В 2014 году исследователи объявили систему электролиза , изготовленную из недорогого, обильные драгоценных металлических катализаторов, таких как платина или иридий никель и железо , а не. Структура никель-металл / никель-оксид является более активной , чем чистый металлическим никелем или только чистый оксид никеля. Катализатор значительно снижает требуемое напряжение . Также никель-железные аккумуляторы исследуются для использования в качестве комбинированных батарей и электролиза для получения водорода. Этот «battolysers» можно заряжать и разряжать , как обычные батареи, и будет производить водород при полной зарядке.
Нанометрических зазоров гальванических элементов
В 2017 году исследователи сообщили об использовании нанометрических зазоров электрохимических элементов для достижения высокой эффективности электролита , свободного от чистого электролиза воды при комнатной температуре. В нанометрических зазорах электрохимических ячеек, два электрода настолько близко друг к другу (даже меньше , чем дебаевская длина в чистой воде) , что массовая скорость транспорта может быть даже выше , чем скорость переноса электрона, что приводит к двум полуреакциям соединены друг с другом и ограничена шагом переноса электрона. Эксперименты показывают , что плотность электрического тока от чистого электролиза воды может быть даже больше , чем от 1 моль / л раствора гидроксида натрия. Механизм, «Виртуальная Разбивка механизм», полностью отличается от устоявшейся традиционной электрохимической теории, из — за такой размером нанометрических зазоров эффекта.
Приложения
Около пяти процентов водорода газа , добываемого во всем мире создается путем электролиза. Большая часть этого водорода , полученный путем электролиза представляет собой продукт стороны в производстве хлора и каустической соды . Это яркий пример конкурирующей побочной реакции .
- 2NaCl + 2H 2 O → Cl 2 + Н 2 + 2NaOH
Электролиз солевого раствора , смесь хлорида воды / натрия, только половина электролиз воды , так как хлориды ионы окисляют до хлора , а не воды окисляется до кислорода. Термодинамически, это не было бы ожидать , поскольку потенциал окисления иона хлора меньше , чем у воды, но скорость реакции хлорида намного больше , чем у воды, в результате чего она преобладает. Водород , получаемый в результате этого процесса либо сожжен (преобразование его обратно в воду), используемый для производства специальных химических веществ или различных других мелких приложений.
Электролиз воды также используются для генерации кислорода для Международной космической станции .
Водород позже может быть использован в топливном элементе в качестве способа хранения энергии и воды.
КПД
промышленная продукция
Эффективность современных генераторов водорода измеряются с помощью энергии , потребляемой в стандартном объеме водорода (МДж / м 3 ), при условии стандартной температуры и давления в H 2 . Ниже , энергию , используемую генератором, тем выше будет его эффективность; 100% -efficient электролизер будет потреблять 39,4 киловатт-часов на килограмм (142 МДж / кг) водорода , 12,749 джоулей на литр (12,75 МДж / м 3 ). Практическая электролиз ( с помощью вращающегося электролизера при давлении 15 бар) может потреблять 50 киловатт-часов на килограмм (180 МДж / кг) и еще 15 киловатт-часов (54 МДж) , если водород сжимается для использования в водородных автомобилей.
Электролизер производители обеспечивают эффективность на основе теплосодержания . Для того, чтобы оценить эффективность заявленного электролизера важно установить , как это было определено с помощью поставщика (то есть то , что значение энтальпии, чем плотность тока, и т.д.).
Есть две основные технологии , доступные на рынке, щелочная и протонной обменной мембраной (PEM) электролизера. Щелочные электролизеры дешевле с точки зрения инвестиций (они обычно используют никелевые катализаторы), но менее эффективными; PEM электролизеры, наоборот, являются более дорогими (они обычно используют дорогие металлические катализаторы платиновой группы) , но более эффективны и могут работать при более высоких плотностях тока, и , следовательно , может быть , возможно , дешевле , если производство водорода достаточно велико.
Обычный щелочной электролиз имеет КПД около 70%. Учет принятого использования более высокой теплотворной способностью (из — за неэффективности с помощью тепла может быть перенаправлен обратно в систему , чтобы создать пар , необходимый катализатором), средние рабочие эффективности для PEM электролиза составляет около 80%. Это , как ожидается , увеличится до 82-86% от до 2030 г. Теоретический КПД для PEM электролизеров прогнозируются до 94%.
H 2 производственные затраты ($ -gge облагаемых налогом) на различных цен на природный газУчитывая промышленное производство водорода, а также с использованием текущих лучшими процессов для электролиза воды (PEM или щелочно — электролиз) , которые имеют эффективную электрическую эффективность 70-80%, производство 1 кг водорода (который имеет удельную энергию 143 МДж / кг или около 40 кВт * ч / кг) требуют 50-55 кВт — ч электроэнергии. При стоимости электроэнергии в $ 0,06 / кВт · ч, как указано в Департаменте энергетики производства водорода целях на 2015, стоимость водорода составляет $ 3 / кг. С диапазоне цен на природный газ с 2016 года , как показано на графике ( производства водорода Технология команды дорожной карты, ноябрь 2017 ) положить стоимость SMR водорода при температуре между $ 1.20 и $ 1.50, себестоимость водорода с помощью электролиза еще более двойной 2015 DOE водорода целевые цены. МЭ США целевая цена водорода в 2020 году составляет $ 2,30 / кг, что требует затрат на электроэнергию в размере $ 0,037 / кВтч, что достижимые учитывая последние тендеры PPA для ветровой и солнечной энергии во многих регионах. Это ставит $ 4 / GGE Н2 разливает объективные хорошо в пределах досягаемости, и близко к слегка повышенной стоимости добычи природного газа для SMR.
В других частях мира, паровой риформинг метана составляет от $ 1-3 / кг в среднем. Это делает производство водорода с помощью электролиза стоимости конкурентоспособной во многих регионах уже, как это изложено Nel водорода и других, в том числе статьи МЭА разбирая условия, которые могут привести к конкурентному преимуществу для электролиза.
перенапряжение
Реальные электролизеры воды требуют более высоких напряжений для протекания реакции. Часть , которая превышает 1,23 V называется перенапряжением или повышенным напряжением, и представляет собой любые потери и неидеальности в электрохимическом процессе.
Для хорошо разработанной клетки самого большое перенапряжением является реакция перенапряжение на четыре-электронное окисление воды до кислорода на аноде; электрокатализаторы могут облегчить эту реакцию, и платиновые сплавы являются состоянием техники для этого окисления. Разработка дешевый, эффективный электрокатализатор для этой реакции было бы большим шагом вперед, и является предметом исследования; Есть много подходов, среди них 30-летний рецепт сульфида молибдена , графеновых квантовых точек , углеродных нанотрубок , перовскита , и никель / никель-оксид. Проще реакцию двух электронов для получения водорода на катоде может быть electrocatalyzed почти без перенапряжения платины, или в теории с гидрогеназой фермента . Если другие, менее эффективны, материалы используются для катода (например , графит ), будут появляться большие перенапряжения.
Термодинамика
Электролиз воды в стандартных условиях требует теоретического минимума 237 кДж электрической энергии вход для диссоциации каждый моль воды, которая является стандартной свободной энергии Гиббса образования воды. Он также требует энергии , чтобы преодолеть изменения энтропии реакции. Таким образом, этот процесс не может протекать ниже 286 кДж на моль , если не добавляется никакого внешнего тепла / энергии.
Поскольку каждый моль воды требует два молей электронов , и при условии , что постоянная Фарадея F представляет собой заряд моль электронов (96485 С / моль), отсюда следует , что минимальное напряжение , необходимое для электролиза составляет около 1,23 В. Если электролиз осуществляют при высокой температуре, это напряжение снижается. Это позволяет эффективно электролизера работать на более чем 100% электрической эффективности. В электрохимических системах это означает , что тепло должно подаваться в реактор для поддержания реакции. Таким образом , тепловая энергия может быть использована для части требования электролиза энергии. Аналогичным образом требуемое напряжение может быть снижено (менее 1 В) , если топливо (такие как углерод, спирт, биомасса) подвергают взаимодействию с водой (PEM на основе электролизера при низкой температуре) или ионов кислорода (твердый оксид электролита электролизера основе при высоких температурах ). Это приводит некоторые из энергии в топливе используется для «помочь» процесс электролиза и может уменьшить общую стоимость водорода , полученного.
Однако, наблюдая компонент энтропии (и другие потери), напряжения свыше 1,48 V необходимы для реакции протекать при практических плотностях тока (The термонейтрального напряжении).
В случае электролиза воды, свободная энергия Гиббса представляет собой минимальную работу , необходимую для протекания реакции, и реакция энтальпия количество энергии (работа , так и тепла) , что должно быть обеспечено таким образом продукты реакции при той же температуре в качестве реагента (т.е. стандартной температуры для значений , указанных выше). Потенциально, электролизер работает на 1,48 V была бы 100% эффективность.
Смотрите также
Рекомендации
внешняя ссылка
Новый вид обмана: «проверка» качества воды электролизом
В последнее время участились жалобы от жителей города на представителей неких компаний, которые назойливо пытаются убедить в низком качестве употребляемой воды.
В гости ко многим жителям Ижевска по телефону напрашиваются некие «эксперты» с предложением бесплатно проверить качество питьевой воды.
Доверчивые горожане, согласившиеся на проверку у себя дома, становятся зрителями опыта, результаты которого многих удручают. «Исследователи» за несколько минут демонстрируют, что вода, которую они пьют, полна опасных примесей и перед употреблением нуждается в очистке. Легко догадаться, что эксперты на самом деле являются торговыми представителями, цель которых продать свой фильтр.
Так называемая «проверка» воды представляет собой демонстрацию определения степени минерализации и процесса электролиза воды.
Для опыта в стаканы наливают разные пробы воды, как правило, водопроводную, бутилированную и, конечно же, «свой» образец воды, полученный на выходе из рекламируемого фильтра. Что на деле является обычной дистиллированной водой.
В первую очередь представитель опускает в воду TDS-метр, специальный прибор, который замеряет степень минерализации воды. Разумеется, измеритель показывает разные цифры, которые зависят от минерализации воды и ее температуры. В воде же, которую принес с собой «эксперт», данная цифра близка к нулю. Это объясняется тем, что дистиллированная вода практически лишена минеральных солей и микроэлементов. Тем более никто не станет уточнять, что минимальное наличие солей необходимо организму.
Для того, чтобы убедиться в наличии примесей в воде, применяется электролиз. Представители демонстрируют прибор (электролизер), который якобы может определить, какого качества исследуемая вода. В стакан с испытуемой водой помещают два противоположно заряженных электрода — катод, анод. С их помощью, пропускают через воду электрический ток. В результате этого процесса в воде наблюдается выпадение хлопьев от серого до зеленовато-коричневого цвета. Во время такого химического процесса соли, содержащиеся в воде, выпадают в осадок, по цвету которого «исследователи» делают выводы о составе и «загрязненности» воды.
На самом деле, этот прибор показывает наличие или отсутствие в воде растворимых солей. Материал электрода под действием электрического тока растворяется. А продукты растворения в воде образуют хлопья. Для сравнения подобная процедура проводится с дистиллированной водой, которая, как известно, не содержит ничего, кроме молекул Н2О. Демонстрируя в ней работу электролизера, визуальные изменения практически не отмечаются, что, по словам «исследователей», говорит о «высоком» качестве воды. Это утверждение абсолютно не отвечает действительности. Дистиллированная вода не пригодна для употребления ни одним живым существом.
Говоря простыми словами, любая вода – это раствор солей, и за исключением химически чистой – дистиллированной, под действием электрического тока оставит осадок. Это признак физиологически полноценной воды.
Прибор электролизер применяют для этой «проверки» специально для тех, кто не верит в цифры, а верит своим глазам. Он не сертифицирован и не применяется ни в лабораториях, ни на производстве.
Существуют утверждённые и закреплённые в законодательном порядке методы контроля содержания в воде токсичных элементов и других веществ. Количественная и качественная оценка этих элементов может проводиться только компетентными инстанциями – аккредитованными лабораториями Роспотребнадзора, имеющими оборудование и полномочия для подобных исследований. Результаты этой оценки достоверно покажут, стоит ли пить эту воду. Качество воды невозможно определить «на глаз». Таким образом, эксперимент с электролизером нельзя воспринимать, как оценку качества воды.
Следует так же заметить, что любой порядочный производитель воды регулярно делает анализы по химическим и бактериологическим параметрам, на которые у лаборатории уходит от 2 до 5 дней. И результаты данных анализов всегда имеются у производителя в открытом доступе.
Напоследок хочется еще раз повторить: как бы убедительно ни звучали слова торговых представителей, не теряйте бдительности! Потому что «проверка» качества воды продавцов фильтрами на самом деле оказалась элементарной уловкой.
Вашему вниманию представляем видео, где подробно показывается и объясняется процесс электролиза воды: http://www.youtube.com/watch?v=gYAuiL-rBeM или http://vk.com/video3719088_165929653
Каким образом получается разный цвет осадка?
Согласно закону электролиза английского физика Фарадея, масса веществ, выделяющегося на электроде, прямо пропорциональна количеству электричества, прошедшего через электролит. Таким образом, окрашивание воды, вызвано растворением электрода. Цвет осадка зависит от материала электрода. А интенсивность окрашивания зависит от общей минерализации воды (концентрации солей) и длительности электротока.
Рассмотрим три вида электродов для описываемого опыта — стальные, алюминиевые, медные. При электролизе с железными электродами анод сразу начинает растворяться с образованием чёрно-зелёных хлопьев гидроокиси двухвалентного железа. Это расслоение получается за пару минут работы на хорошем постоянном токе. Со временем гидроокись железа меняет цвет от зелёного в сторону рыже-бурого. С разрушенного алюминиевого анода наблюдается смесь бело-серой окиси/гидроокиси алюминия. Ионы меди образуют в основном бурый осадок, с течением времени который тоже меняет цвет на более светлый.
Соответственно, основная масса полученных веществ — это продукты разрушения анода.
Очистка воды прямым электролизом
При прохождении воды через электролизер в результате действия электрического тока происходит образование особых соединений. С их помощью воду можно обеззараживать во время ее течения. Данная технология обеззараживания воды без применения реагентов является сегодня самым перспективным направлением.
Научные предпосылки.
Очистка воды прямым электролизом при прохождении электрического тока вызывает электрохимические реакции. Таким образом, в воде образуются новые вещества. Также происходит изменение структуры межмолекулярных взаимодействий.
Экологические предпосылки.
Окислители во время электролиза образуются непосредственно из воды, что не требует их дополнительного внесения.
Экономические предпосылки.
Природную воду методом прямого электролиза можно обрабатывать при помощи блока электропитания и электролизёра. Дозирующие насосы, реагенты в данном случае не нужны. При прямом электролизе природной воды затраты электроэнергии составляют около 0,2 кВт/м³.
Нормативные предпосылки.
Обеззараживание воды прямым электролизом рекомендуется СНиП 2.04.02-84 в том случае, если в воде содержится не менее 20 мг/л хлоридов. При этом ее жесткость выражается в показателе не больше 7 мг-экв/л. Такую обработку могут производить станции, производительность которых составляет 5 000 м³ в сутки.
Очистка и обеззараживание воды прямым электролизом
Прямой электролиз идеально подходит для очистки природных вод. Во время этого процесса образуются несколько окислителей, например, озон и кислород. Любая природная вода содержит хлориды в разной степени, поэтому в процессе прямого электролиза образуется свободный хлор.
Электролизные установки базируются на модульности. Производительность электролизного оборудования можно увеличить за счет увеличения количества модулей. Модули с мощностью 5 или 12 кг активного хлора в сутки имеют сейчас повышенный спрос. Модули с производительностью от 20 до 50 кг активного хлора в сутки применяются на объектах с большей мощностью.
Электролиз воды сопровождается серией электрохимических реакций, в результате которых в воде происходит синтез окислителей. Основными реакциями электролиза воды является образование кислорода O2 и водорода H2, а также гидроксид иона OH¯:
на аноде 2H2O → O2↑ + 4H+ + 4e− (1)
на катоде 2H2O + 2e → H2↑ + 2OH¯ (2)
При электролизе воды также образуются озон O3 и перекись водорода H2O2:
на аноде 3H2O → O3↑ + 6e− + 6H+ (3)
на катоде 2H2O + O2 + 2e− → H2O2 + 2OH− (4)
В присутствии хлоридов при электролизе воды образуется растворённый хлор:
на аноде 2Cl– → Cl2+2e– (5)
Растворённый хлор Cl2, реагируя с водой и гидроксид ионом, образует хлорноватистую кислоту HClO:
Cl2 + H2O → HClO + H+ + Cl¯ (6)
Cl2 + OH¯ → HClO + Cl¯ (7)
Разложение хлорноватистой кислоты HClO в воде приводит к образованию гипохлорит иона:
HOCl ↔ H+ + OCl¯ (8)
Из приведённых выше реакций следует, что при электролизе воды образуется ряд окислителей:
кислород O2,
озон O3,
перекись водорода H2O2,
гипохлорит ион OCl¯.
Появление при электролизе воды OH-радикалов, H2O2 и O3 приводит к образованию других сильных окислителей, таких как O3¯, O2¯, O¯, HO2, HO3, HO4 и др.
Компания «Принцип-Сервис» г. Краснодар данное оборудование изготавливает по следующим принципам:
- функциональность. Все оборудование и каждый узел выполняют главную задачу по получению реагента;
- экологическая безопасность при использовании электролизных установок по сравнению с газообразным хлором. Безопасная работа обслуживающего персонала;
- легкость в эксплуатации, поэтому с данным оборудованием может работать даже персонал со средним образованием;
- надежность. Для изготовления оборудования применяются в большинстве своем пластиковые материалы. Насосы и другие механические агрегаты не используются;
- экономичность. Затраты на получение гипохлорита натрия методом электролиза включают в себя стоимость электроэнергии, соли, воды в установке. Также сюда входят расходы на профилактическое обслуживание оборудования. Специальной подготовки воды, например, ее декарбонизации, не требуется. Вместе с гипохлоритом происходит ее возврат в воду, проходящую обработку. Это позволяет стоимость воды не учитывать вообще. Так как в процессе используется обычная и неочищенная соль, то она также практически ничего не стоит;
- эффективность означает наименьшие затраты при получении конечного результата. Данная установка позволяет получить гипохлорит натрия с концентрацией 5 г. активного хлора в 1л в первые 2 часа;
- прозрачность. Наблюдать за процессом синтеза и состоянием электродного пакета позволяет прозрачный пластик. Для изготовления важных гидравлических коммуникаций также применяются материалы высокой прозрачности.

