Строение, свойства и функции воды
Цель урока: сформировать представление о целостной картине мира на примере вещества воды, осуществив интеграцию знаний учащихся, полученных в курсах физики, химии и биологии.
Задачи урока:
- Образовательные: усвоение всеми учащимися стандартного минимума фактических сведений о строении и функциях воды на всех уровнях организации живого.
- Развивающие: совершенствование надпредметных умений сравнивать и анализировать, устанавливать причинно-следственные связи; переводить информацию в графический вид (таблицу), постановки и решения проблем; оперировать понятиями и связывать с ранее полученными знаниями в курсах ботаники, зоологии, анатомии; рассуждать по аналогии, развивать память, произвольное внимание.
- Воспитательные: развивать интерес к окружающим явлениям, умение работать в парах и в коллективе, вести диалог, слушать товарищей, оценивать себя и других, формировать культуру речи.

Планируемые результаты: умение характеризовать функции вещества на основе строения и свойств; обобщение полученных знаний о функциях воды на разных уровнях организации живого в форме таблицы.
Тип урока: изучение нового материала и первичное закрепление знаний.
Методы обучения: беседа, рассказ учителя, показ иллюстраций, презентации, индивидуальная работа с текстом, контроль знаний.
Формы организации учебной деятельности: работа в парах (составление обобщающей таблицы), индивидуальная, фронтальная, эксперимент.
Ход урока
Организационный момент (2 мин.): поздороваться, представиться детям.
Введение (5 мин.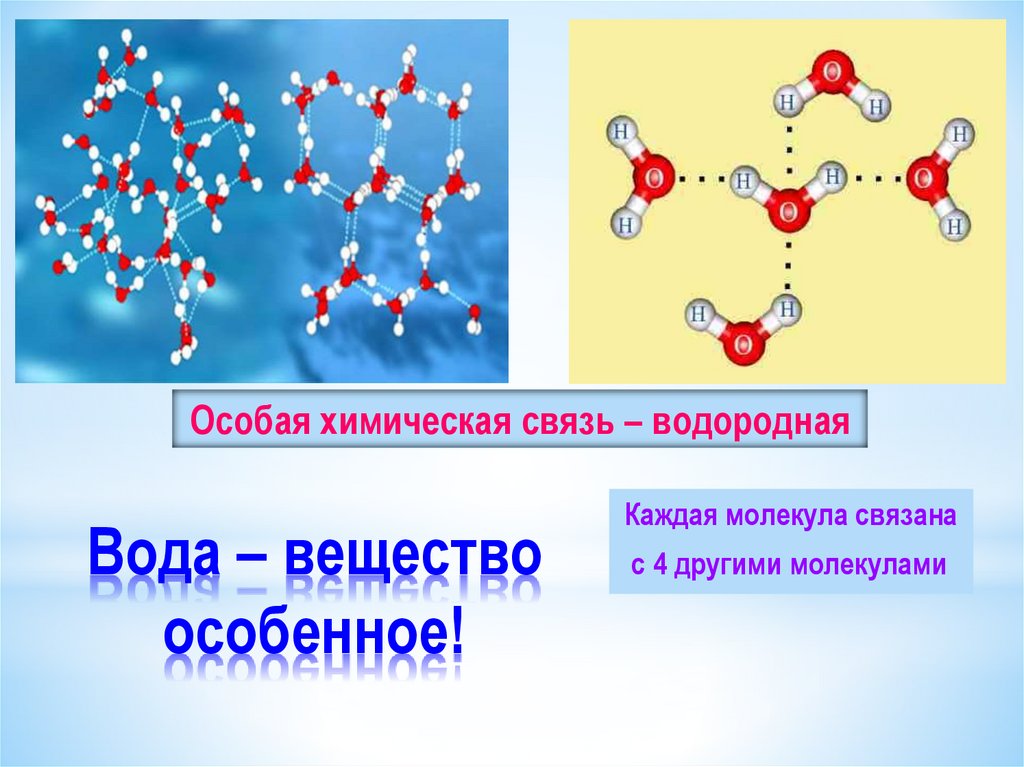 ):
):
Вода – самое распространенное и удивительное на Земле вещество (например, расширяется при охлаждении, замерзает уже при 0 0С, кипит при 100 0С, выполняет множество функций и даже может хранить информацию). Ею заполнены океаны, моря, озера и реки; пары воды входят и в состав воздуха. Вода содержится в клетках всех живых организмов (животных, растений, грибов, бактерий) в значительных количествах: организме млекопитающих массовая доля воды составляет примерно 70%, а в огурцах и арбузах ее около 90%, в костях человека – 45 %, а в мозге до 90 %.
Цели урока: почему воды больше всего в составе живых организмов? Почему вода покрывает большую часть суши? Как вода сохраняет информацию? На эти вопросы нам с вами предстоит ответить в конце урока.
Как будем работать: беседуем, я рассказываю, показываю иллюстрации и схемы (Презентация), в процессе объяснения заполняем пропущенные слова в распечатках (Приложение 1).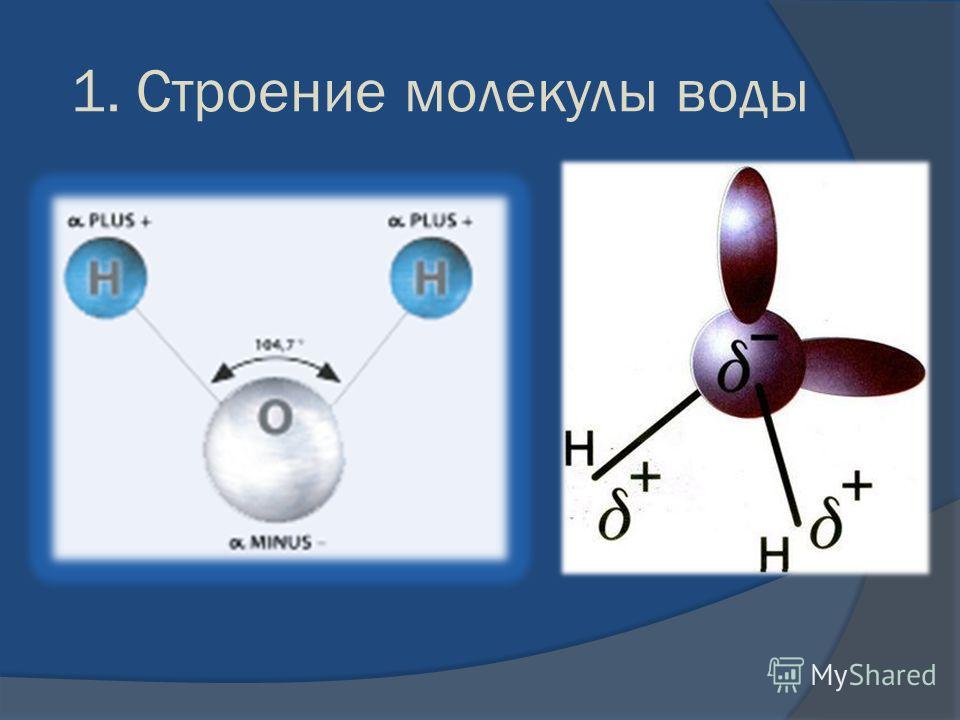
Демонстрационные опыты:
Опыт № 1:
Цель опыта: доказать растворимость веществ в воде.
Ход опыта: насыпать в колбу с водой соль или сахар. Размешать.
Результат: соль (сахар) полностью растворились.
Вывод: вода – хороший растворитель.
Опыт № 2
Цель опыта: доказать способность воды передвигаться по сосудам стебля за счет корневого давления и присасывающей силы испарения.
Ход опыта: поставить на сутки укоренившийся побег бальзамина в раствор чернил.
Результат: стебель и некоторые листья бальзамина окрасились в синий цвет.
Вывод: вода передвигается по сосудам стебля за счет сил сцепления между молекулами при помощи корневого давления и присасывающей силы испарения..
Опыт № 3:
Цель опыта: доказать способность воды двигаться в область меньшей концентрации растворителя.
Ход опыта: в две чашки Петри поместить одинаковые кусочки картофеля. В одну чашку налить воду, в другую – концентрированный раствор соли.
Результат: картофель в простой воде набух, а в концентрированном растворе соли сморщился.
Вывод: молекулы воды двигаются в область меньшей концентрации растворителя.
Объяснение нового материала (20 мин.):
Проводится в форме беседы. Изучаем вещества по определенному плану (пишу на доске): строение – свойства – функции на системных уровнях организации живого.
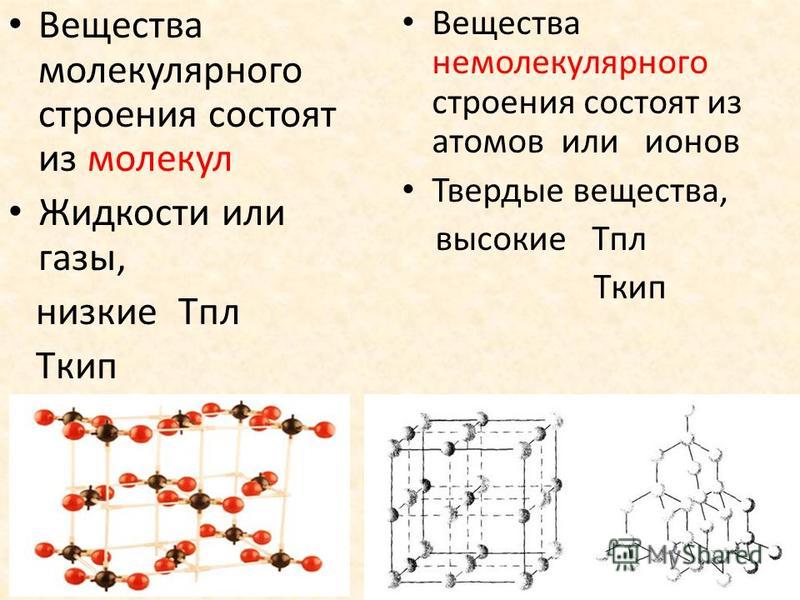
Строение молекулы и межмолекулярные связи | Свойства |
|---|---|
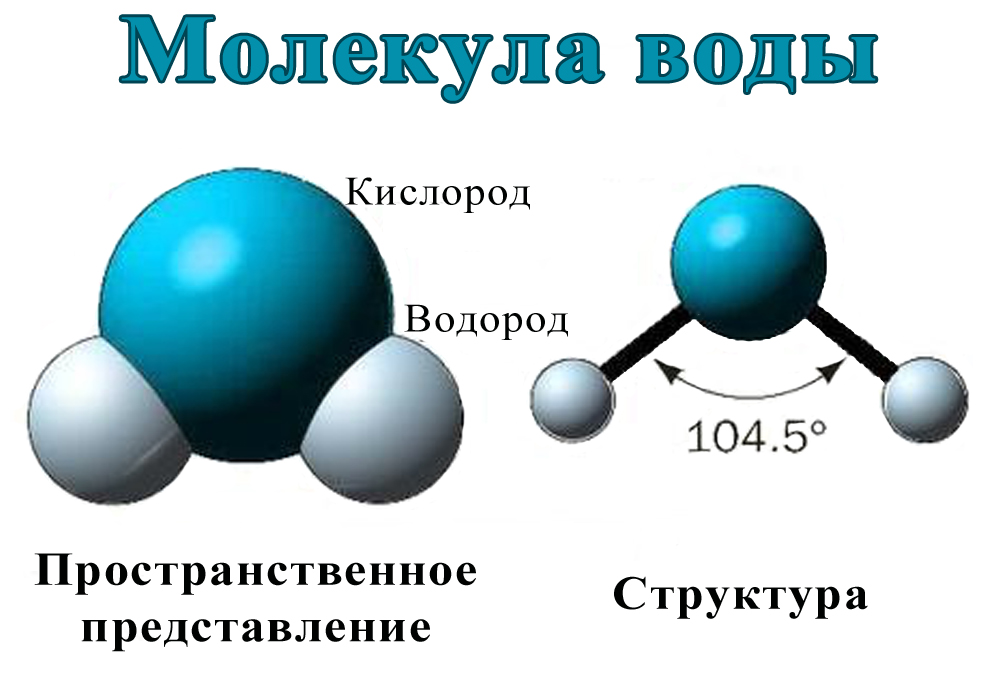
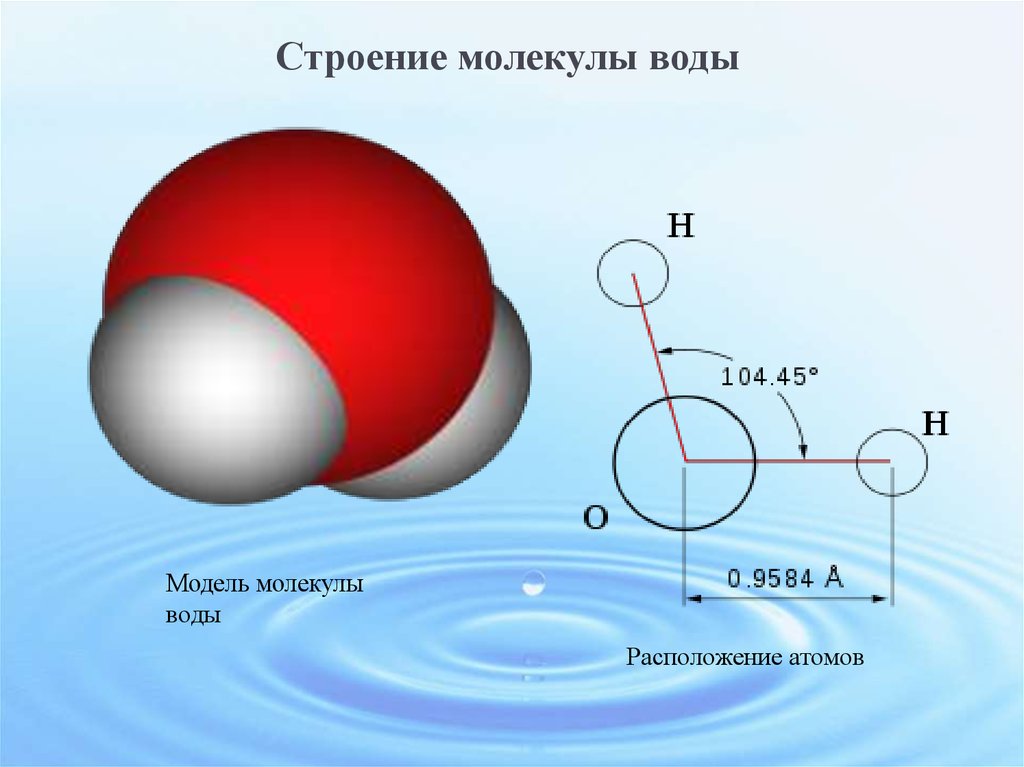
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный примерно 105 0. Поэтому молекула воды – диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород – отрицательно. |
Вода – хороший растворитель. Растворы образуются путем взаимодействия растворенного вещества с частицами растворителя. Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему растворителя. |
|
Вода – реагент в реакциях гидролиза (разрушение сложных химических веществ под действием воды до более простых с новыми свойствами) и ряде других реакций |
Водородные связи между молекулами воды |
|
Водородных связей много, поэтому необходимо много энергии для их разрыва.
|
Вода обладает хорошей теплопроводностью и большой теплоемкостью. Вода медленно нагревается и медленно остывает. |
Водородные связи слабые |
Молекулы воды подвижны относительно друг друга |
Силы межмолекулярного сцепления образуют пространства между молекулами |
Вода практически не сжимается |
Образование водородных связей между молекулами воды и других веществ |
Вода характеризуется оптимальным для биологических систем значением силы поверхностного натяжения, текучесть воды Опыт № 2 |
Вода замерзает при 0 0С, при замерзании образуется много водородных связей, возникают пространства между молекулами |
Максимальная плотность воды при 4 С° равна 1 г/см3, лед имеет меньшую плотность, и всплывает на ее поверхность. |
| Функции на системных уровнях организации живого |
|---|
Вода обеспечивает диффузию — пассивный транспорт веществ в клетку и из нее в область меньшей концентрации (осмос) и пиноцитоз, а также транспорт веществ из клетки. |
|
Гидрофильные вещества проникают внутрь клетки. |
Вода – терморегулятор. |
«Смазочный материал» в суставах, плевральной полости и околосердечной сумке. |
|
Капиллярный кровоток, движение веществ в капиллярах почвы, восходящий и нисходящий ток растворов в растениях. |
Лед защищает водоемы от промерзания. |
Вода может хранить информацию (Приложение 2).
Закрепление (13 мин.):
Биологические задачи:
- Показать синюю или зеленую хризантему. Как создают такие растения? Являются ли они результатом селекционной работы?
- Почему кожа на пальцах при длительном купании сморщивается?
- Почему сморщивается яблоко, лежащее в тепле?
Разделить класс на три группы (по рядам). Первая группа выписывает в тетрадь функции воды на уровне живой клетки. Вторая группа – на уровне живого организма. Третья группа – на уровне экосистем и биосферы. В конце работы оценить себя по количеству найденных функций. Работа ведется по парам.
Первая группа выписывает в тетрадь функции воды на уровне живой клетки. Вторая группа – на уровне живого организма. Третья группа – на уровне экосистем и биосферы. В конце работы оценить себя по количеству найденных функций. Работа ведется по парам.
Функции воды
| В живой клетке | В живом организме | В экосистемах и биосфере |
|---|---|---|
1. Транспорт веществ в клетке. |
1. Охлаждение организмов. |
1. Дыхание и фотосинтез водных организмов. |
2. Основная среда всех биохимических процессов. |
2. «Смазочный материал» в суставе, плевральной полости, околосердечной сумке, глазном яблоке. |
2. Регуляция температуры на планете. |
3. |
3. Гидростатический скелет. |
3. Благоприятная среда обитания для живых организмов. |
4. Сохранение структуры клетки. |
4. Защита плода млекопитающих. |
4. Защита водоемов от промерзания. |
5. Тургорное давление. |
5. Капиллярный кровоток, нисходящий и восходящий ток в растениях. |
5. Часть среды обитания животных. |
|
|
6. Подъем почвенных растворов по капиллярам почвы. |
Подведение итогов урока, оценка работы (2 мин.)
Словарик (Приложение 2)
Биологические молекулы • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Биологические молекулы имеют модульное строение. К числу важных классов биологических молекул относятся белки, углеводы, липиды и нуклеиновые кислоты. Множество других молекул в клетке играют роль «энергетической валюты».
К числу важных классов биологических молекул относятся белки, углеводы, липиды и нуклеиновые кислоты. Множество других молекул в клетке играют роль «энергетической валюты».
Жизнь — таинственная, сложная, загадочная — не что иное как совокупность достаточно крупных молекул и довольно простых химических реакций. Если бы вам понадобилось конструировать крупные молекулы, вы пошли бы по одному из двух путей. Либо, как в кустарном ювелирном деле, вы стали строить каждую молекулу «с нуля», проделывая каждый раз уникальную работу. Либо — этот путь используется в современных строительных технологиях — вы бы изготовили набор простых молекул, из которых можно собирать самые разнообразные молекулы большего размера, сочетая модули тем или иным образом. Оказывается, именно такое модульное строение имеют биологические молекулы. Согласно теории эволюции, таким и должен был быть самой простой путь к крупным молекулам, поскольку в начале эволюционного процесса необходимость в конструировании очень сложных молекул отсутствовала.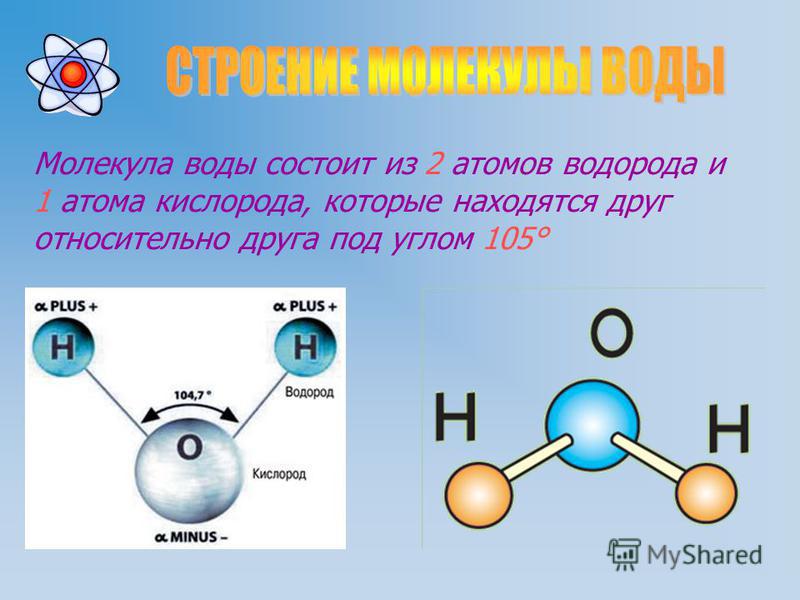 Со временем же могли добавляться новые модули, расширяя коллекцию крупных разнородных элементов, что вполне соответствует духу эволюции.
Со временем же могли добавляться новые модули, расширяя коллекцию крупных разнородных элементов, что вполне соответствует духу эволюции.
Белки
Основной структурной единицей белков являются молекулы аминокислот. Чтобы понять, что такое аминокислота, представьте себе совокупность атомов, у которых с одной стороны наружу выступает водород, с другой — соединенные между собой кислород и водород, а посередине расположены разнообразные другие компоненты. Подобно тому как бусины нанизываются на нить, из этих аминокислот собираются белки — ион водорода (Н+) одной аминокислоты объединяется с ионом гидроксила (ОН–) другой аминокислоты с образованием молекулы воды. (Представьте, как каждый раз при соединении двух аминокислотных молекул между ними пробегает капелька воды.) Среди белков самую важную роль играют белки-ферменты (см. Катализаторы и ферменты), регулирующие химические реакции в клетках; но белки также являются важными структурными компонентами живых организмов. Например, ваши волосы и ногти состоят из белков.
Например, ваши волосы и ногти состоят из белков.
Углеводы
Углеводы содержат кислород, водород и углерод в соотношении 1:2:1. Во многих живых системах молекулы углеводов выполняют роль источников энергии. Одним из важнейших углеводов можно считать сахар глюкозу, содержащую шесть атомов углерода (С6Н12О6). Глюкоза — конечный продукт фотосинтеза и, следовательно, основа всей пищевой цепи в биосфере. Соединяя молекулы глюкозы, как основные строительные модули, можно получить сложные углеводы. Как и белки, углеводы играют вспомогательную роль в клетках, поскольку входят в клеточные структуры. Например, растительные волокна состоят из целлюлозы, которая представляет собой вереницу сцепленных особым образом молекул глюкозы.
Липиды
Липиды — это нерастворимые в воде органические молекулы. Вы получите правильное представление о липидах, если вообразите капельки жира, плавающие на поверхности бульона. В живых организмах липиды выполняют две важные функции.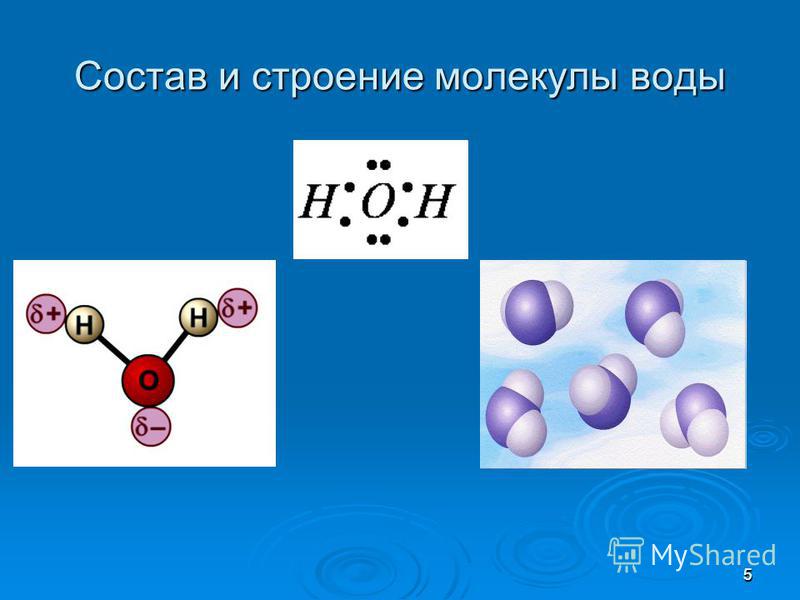 Один класс молекул — фосфолипиды — состоят из маленькой головки, содержащей фосфатную группу (атом фосфора, соединенный с четырьмя атомами кислорода), и длинного углеводородного хвоста. Углеводородный хвост этой молекулы гидрофобен, то есть энергетическое состояние молекулы минимально, когда этот хвост находится не в воде. Напротив, фосфатная головка гидрофильна, то есть энергетическое состояние молекулы минимально при контакте головки с водой . Если поместить молекулы фосфолипидов в воду, они будут стремиться достичь минимального энергетического состояния и выстроятся таким образом, что их хвосты окажутся вместе, а головки — врозь. Такая двухслойная структура очень стабильна, поскольку головки будут в контакте с водой, но вода будет вытеснена из области, окружающей хвосты молекул. Для перемещения липидным молекулам необходима энергия — либо чтобы удалить гидрофильные участки из воды, либо чтобы поместить в воду гидрофобные участки. Из таких липидных двухслойных структур состоят клеточные мембраны и мембраны, разделяющие компоненты клетки.
Один класс молекул — фосфолипиды — состоят из маленькой головки, содержащей фосфатную группу (атом фосфора, соединенный с четырьмя атомами кислорода), и длинного углеводородного хвоста. Углеводородный хвост этой молекулы гидрофобен, то есть энергетическое состояние молекулы минимально, когда этот хвост находится не в воде. Напротив, фосфатная головка гидрофильна, то есть энергетическое состояние молекулы минимально при контакте головки с водой . Если поместить молекулы фосфолипидов в воду, они будут стремиться достичь минимального энергетического состояния и выстроятся таким образом, что их хвосты окажутся вместе, а головки — врозь. Такая двухслойная структура очень стабильна, поскольку головки будут в контакте с водой, но вода будет вытеснена из области, окружающей хвосты молекул. Для перемещения липидным молекулам необходима энергия — либо чтобы удалить гидрофильные участки из воды, либо чтобы поместить в воду гидрофобные участки. Из таких липидных двухслойных структур состоят клеточные мембраны и мембраны, разделяющие компоненты клетки. Эти пластичные и прочные молекулы отделяют живое от неживого.
Эти пластичные и прочные молекулы отделяют живое от неживого.
Кроме того, в липидах запасается энергия. Липиды могут накапливать примерно вдвое больше энергии на единицу массы, чем углеводы. Вот почему, когда вы переедаете и ваш организм хочет запасти энергию на случай непредвиденных обстоятельств в будущем, когда пищи не будет, он станет запасать ее в форме жира. На этом простом факте строится многомиллиардная индустрия диетических продуктов.
Нуклеиновые кислоты
Молекулы ДНК и РНК (см. Центральная догма молекулярной биологии) переносят информацию о химических процессах, идущих в клетке, и участвуют в передаче содержащейся в ДНК информации в цитоплазму клетки. В ДНК живого организма закодированы белки-ферменты, которые катализируют все химические реакции, происходящие в этом организме.
Молекулы-переносчики энергии
Жизнедеятельность требует затрат энергии. В частности, нужно, чтобы энергия, произведенная в одном месте, могла быть использована в другом.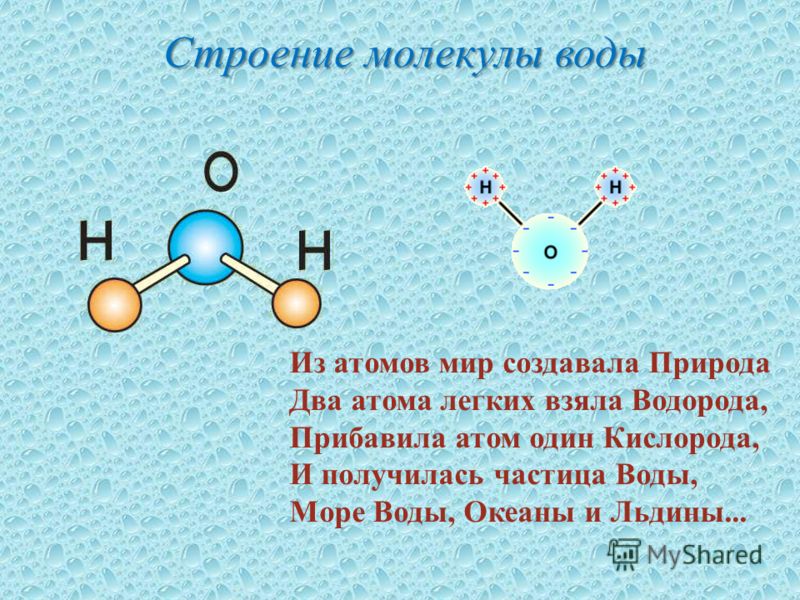 Эту функцию в клетке осуществляет целая армия специализированных молекул. Пожалуй, самые важные из них — аденозин трифосфат (АТФ) и аденозин дифосфат (АДФ). Обе молекулы устроены так: группа из атомов углерода, водорода и азота (она называется аденин) присоединена к молекуле рибозы (это сахар), и все это вместе крепится к хвосту из фосфатов. Из названий молекул понятно, что в хвосте АДФ содержится два фосфата, а в хвосте АТФ — три. Когда в клетке происходит химический процесс, например фотосинтез, образующаяся энергия идет на присоединение третьего фосфата к хвосту АДФ. Полученная молекула АТФ затем переносится в другие части клетки. Там запасенная энергия может быть использована в других химических процессах: она выделяется при отщеплении последнего фосфата от АТФ, в результате чего АТФ вновь превращается в АДФ.
Эту функцию в клетке осуществляет целая армия специализированных молекул. Пожалуй, самые важные из них — аденозин трифосфат (АТФ) и аденозин дифосфат (АДФ). Обе молекулы устроены так: группа из атомов углерода, водорода и азота (она называется аденин) присоединена к молекуле рибозы (это сахар), и все это вместе крепится к хвосту из фосфатов. Из названий молекул понятно, что в хвосте АДФ содержится два фосфата, а в хвосте АТФ — три. Когда в клетке происходит химический процесс, например фотосинтез, образующаяся энергия идет на присоединение третьего фосфата к хвосту АДФ. Полученная молекула АТФ затем переносится в другие части клетки. Там запасенная энергия может быть использована в других химических процессах: она выделяется при отщеплении последнего фосфата от АТФ, в результате чего АТФ вновь превращается в АДФ.
Как мы уже упоминали, существуют и другие молекулы, которые переносят энергию в клетке. Набор таких молекул чем-то напоминает разные варианты оплаты счетов. Вы можете выбрать наличные, банковский перевод, кредитную карту и т. д. — в зависимости от того, какой способ вам удобнее. Так же и клетка для поддержания своей жизнедеятельности может использовать АТФ (эквивалент наличных денег) или любую другую из большого набора более сложных молекул.
д. — в зависимости от того, какой способ вам удобнее. Так же и клетка для поддержания своей жизнедеятельности может использовать АТФ (эквивалент наличных денег) или любую другую из большого набора более сложных молекул.
Ученые ИАиЭ СО РАН получили новую информацию о структуре воды
Вода, казалось бы, уже очень хорошо изучена. Каждый школьник помнит простую формулу Н2О, однако проблема описания ее структуры не столь проста. Так, в современной науке предполагается существование короткоживущих группировок молекул воды, характеризующихся тетраэдрическим порядком и хорошо отличимых от окружающих молекул. Но ученые из Института автоматики и электрометрии СО РАН показали, что это не так, сообщает издание «Наука в Сибири». Результаты работы опубликованы в Physical Review E.
Как утверждают ученые, вода — самое удивительное и необычное
вещество на Земле. Она «не знает» законов физики, ведет себя
своенравно, имеет очень много аномальных свойств.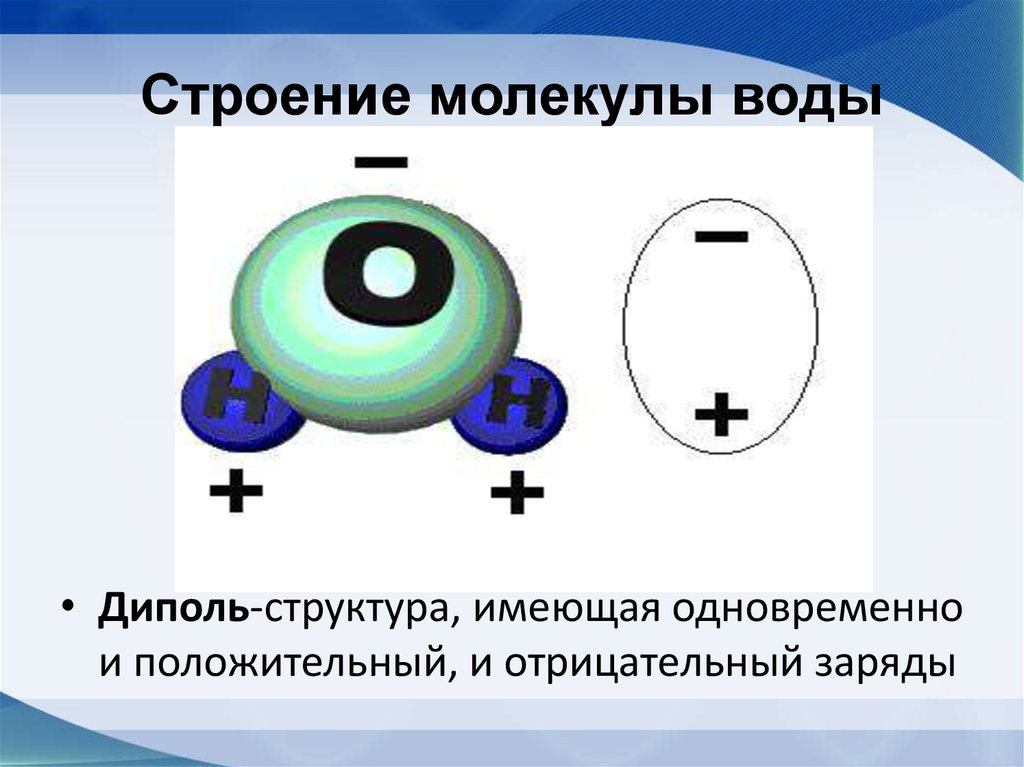 При охлаждении
ниже +4 °C вода не сжимается, а расширяется; в твердом
состоянии она легче, чем в жидком. Если рассматривать воду как
совокупность молекул Н2О, то ее удельный вес должен
быть 1,84 г/см³ (вместо наблюдаемой плотности 1 г/см³), а
температура кипения — 63,5 °C (на самом деле вода
кипит при +100 °C). Предполагается, что некоторые из необычных
свойств воды можно объяснить особенностями ее структуры.
При охлаждении
ниже +4 °C вода не сжимается, а расширяется; в твердом
состоянии она легче, чем в жидком. Если рассматривать воду как
совокупность молекул Н2О, то ее удельный вес должен
быть 1,84 г/см³ (вместо наблюдаемой плотности 1 г/см³), а
температура кипения — 63,5 °C (на самом деле вода
кипит при +100 °C). Предполагается, что некоторые из необычных
свойств воды можно объяснить особенностями ее структуры.
Наиболее распространенная гипотеза о строении воды основана
на представлении, что она состоит из молекул Н2О,
объединенных в группы с помощью так называемых водородных связей.
В настоящее время многие исследователи полагают, что вода
является флуктуирующей смесью кластеров двух типов, в одном из
которых молекулы связаны друг с другом как во льду, а в другом
связи нарушены, благодаря чему эти кластеры более плотные.
Гипотеза о том, что водная структура содержит два структурных
мотива, очень удобна для объяснения ее специфических свойств и
поэтому популярна для интерпретации экспериментальных
результатов.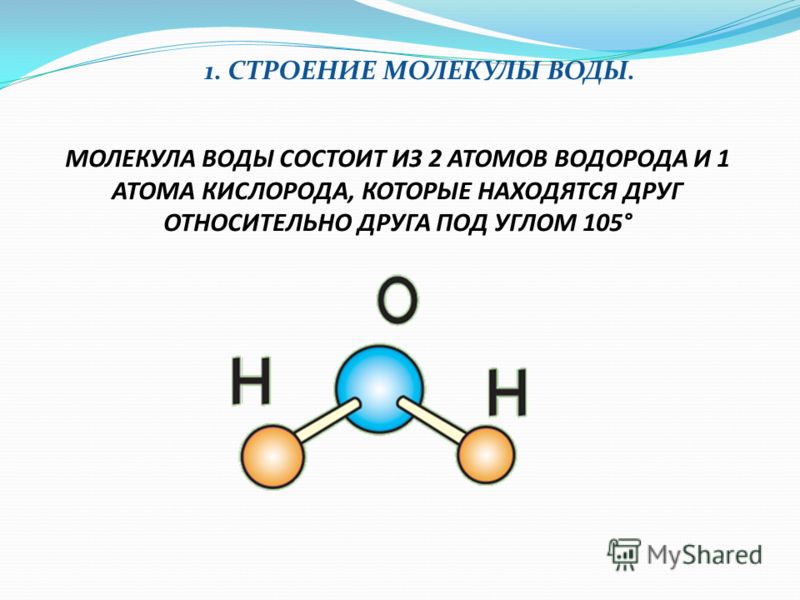 Однако прямых экспериментальных доказательств этого
утверждения в настоящее время нет, и ученые работают над
исследованием характеристик воды, которые могут прояснить вопрос.
Однако прямых экспериментальных доказательств этого
утверждения в настоящее время нет, и ученые работают над
исследованием характеристик воды, которые могут прояснить вопрос.
Сотрудники лаборатории спектроскопии конденсированных сред ИАиЭ
СО РАН также обратили свое внимание на проблему описания
структуры воды. Эта лаборатория традиционно исследует жидкости,
которые при охлаждении становятся стеклами. «Мы занимаемся
вопросом, насколько стеклующиеся жидкости остаются однородными в
плане структуры и какими методами это можно изучать. Нами было
показано, что их отличие от жидкостей кристаллизующихся
заключается в том, что первые при охлаждении, начиная с
определенной температуры, образуют локальные группировки,
становятся в нанометровом масштабе неоднородными, и это приводит
к ряду экспериментальных проявлений, в том числе и к повышенному
упругому рассеянию света», — рассказывает заведующий лабораторией
член-корреспондент РАН Николай Владимирович Суровцев.
Используя разработанные подходы к описанию стеклующихся жидкостей, исследователи решили посмотреть на свойства воды — предполагалось, что она будет вести себя практически так же, и присутствие двух структурных мотивов в ней приведет к увеличению интенсивности рассеянного света. В этом ожидании практически не было сомнений, поскольку молекулы Н2О способны образовывать водородные связи c соседними молекулами. Таким образом, один атом кислорода оказывается «соединен» ковалентными и водородными связями с четырьмя соседними атомами водорода, которые создают структуру, близкую к фигуре тетраэдра (тетраэдрическая координация). Считается, что с понижением температуры доля молекул воды, вовлеченных в этот процесс, увеличивается, и это приводит к рассеянию света. В таком случае отношение Ландау — Плачека должно резко возрастать по сравнению с теорией для однородных жидкостей. Исследователей интересовал вопрос: на какой температуре происходит такое интенсивное кластерообразование?
Отношение Ландау — Плачека — это отношение
интегральной интенсивности упруго рассеянного света к
интенсивности двух линий Мандельштама — Бриллюэна,
связанных с рассеянием на звуковых волнах. В литературе известны
только две работы по определению температурной зависимости
отношения Ландау — Плачека для воды, однако они были
выполнены в 1967 и1986 годах на аппаратуре с низким спектральным
разрешением.
В литературе известны
только две работы по определению температурной зависимости
отношения Ландау — Плачека для воды, однако они были
выполнены в 1967 и1986 годах на аппаратуре с низким спектральным
разрешением.
«Эксперимент ставили фактически для того, чтобы увидеть, что вода ведет себя подобно стеклующимся жидкостям, то есть в ней образуются определенные фрагменты структуры, хотя и короткоживущие. Но природа оказалась богаче в своих проявлениях и в очередной раз удивила исследователей», — отмечает главный научный сотрудник ИАиЭ СО РАН доктор физико-математических наук Валерий Константинович Малиновский.
Как проходил эксперимент? На запаянную ампулу с чистой водой
направлялся луч, и рассеянный свет измерялся с помощью
уникального 6-проходного интерферометра Фабри — Перо, высокое
разрешение которого исключило неоднозначность в описании
спектров. Это позволило оценить степень однородности жидкости.
Совершенно внезапно для самих ученых эксперимент не оправдал
ожиданий — при охлаждении воды во всем исследованном
температурном диапазоне никакого дополнительного увеличения
упругого рассеяния света обнаружено не было.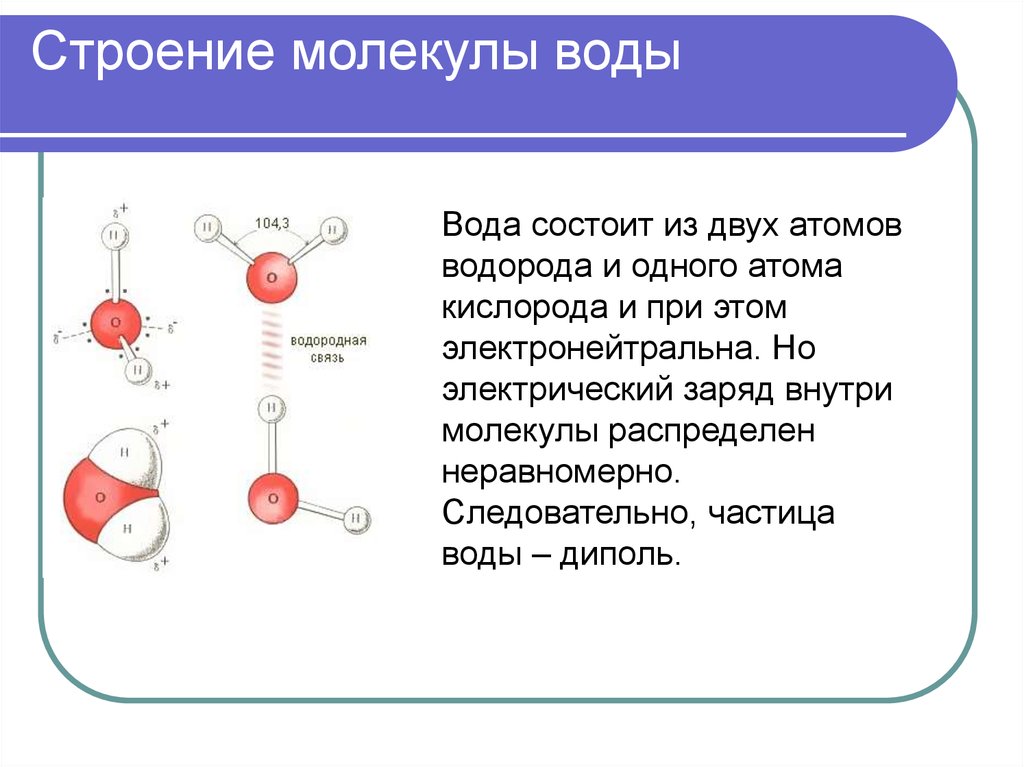 Вместо этого
полученные значения отношения Ландау — Плачека хорошо описывались
теорией однородной жидкости.
Вместо этого
полученные значения отношения Ландау — Плачека хорошо описывались
теорией однородной жидкости.
«Нет сомнений, что тетраэдрические координации присутствуют в структуре воды. Однако идеальных тетраэдров в жидкости быть не может — все они имеют искажения по длине и углам связей. Обычно ученые проводят гипотетическую границу и говорят: вот, начиная с этих параметров для углов и длин связей, мы считаем, что это тетраэдрическая координация, а при превышении определенного интервала — уже не она. При таком разделении в структуре воды естественно возникают две фазы. Результаты нашего эксперимента указывают, что распределение по параметрам плавное, и нет двух обособленных групп, между которыми можно было бы модельно-независимо провести границу», — говорит Николай Суровцев.
Здесь важно отметить, что вода очень изменчивая структура, она
существует в каком-то одном состоянии миллионную долю от
миллионной доли секунды, а затем молекулы перегруппируются,
образовывают новые связи. «Пусть на эту мельчайшую долю времени,
но вода всё равно могла бы образовывать хорошо определенные
кластеры на фоне некластерных молекул, но этого не происходит», —
отмечает Николай Суровцев.
«Пусть на эту мельчайшую долю времени,
но вода всё равно могла бы образовывать хорошо определенные
кластеры на фоне некластерных молекул, но этого не происходит», —
отмечает Николай Суровцев.
Взаимодействие молекул в воде можно представить как праздничную площадь, заполненную людьми, которые всё время хаотично перемещаются, где-то стоят плотнее, где-то более отдаленно друг от друга. Вот туда заходят маленькие группки солдат и смешиваются с толпой. Если бы группы солдат образовывали строй, сохраняя порядок шеренги, то их можно было бы считать хорошо различимыми кластерами на фоне остальной публики. Но в эксперименте увеличения упруго рассеянного света подобного положения вещей не наблюдается, что соответствует отсутствию упорядоченных групп.
«Результаты исследования естественно описываются в
предположении квазиоднородной жидкости и ограничивают возможности
свободного фантазирования по поводу структуры воды», — говорит
Валерий Малиновский.
Ученые обнаружили новые свойства h3O
Группа ученых открыла новые молекулярные свойства воды — открытие явления, которое ранее оставалось незамеченным.
Известно, что жидкая вода является отличным переносчиком продуктов собственной автоионизации; то есть заряженные частицы, полученные при расщеплении молекулы воды (H 2 O) на протоны (H + ) и ионы гидроксида (OH — ). Это замечательное свойство воды делает ее важнейшим компонентом новых электрохимических технологий производства и хранения энергии, таких как топливные элементы; действительно, сама жизнь была бы невозможна, если бы вода не обладала этой характеристикой.
Известно, что вода состоит из сложной сети слабых направленных взаимодействий, известных как водородные связи. В течение почти века считалось, что механизмы, с помощью которых вода переносит ионы H + и OH − , являются зеркальным отражением друг друга — идентичными во всех отношениях, за исключением направлений водородных связей, участвующих в этом процессе.
Текущие современные теоретические модели и компьютерное моделирование, однако, предсказывают фундаментальную асимметрию в этих механизмах. Если это так, то эту асимметрию можно использовать в различных приложениях, адаптируя систему так, чтобы один ион отдавал предпочтение другому.
Экспериментальное подтверждение теоретического предсказания остается труднодостижимым из-за сложности непосредственного наблюдения за двумя видами ионов. Различные эксперименты дали лишь проблески предсказанной асимметрии.
Группа ученых из Нью-Йоркского университета под руководством профессора Алексея Ершоу, в которую вошли Эмилия Силлетта, постдокторант Нью-Йоркского университета, и Марк Такерман, профессор химии и математики Нью-Йоркского университета, разработала новый эксперимент для выявления этой асимметрии. Экспериментальный подход заключался в охлаждении воды до ее так называемой температуры максимальной плотности, при которой асимметрия, как ожидается, будет наиболее сильно проявляться, что позволило ее тщательно обнаружить.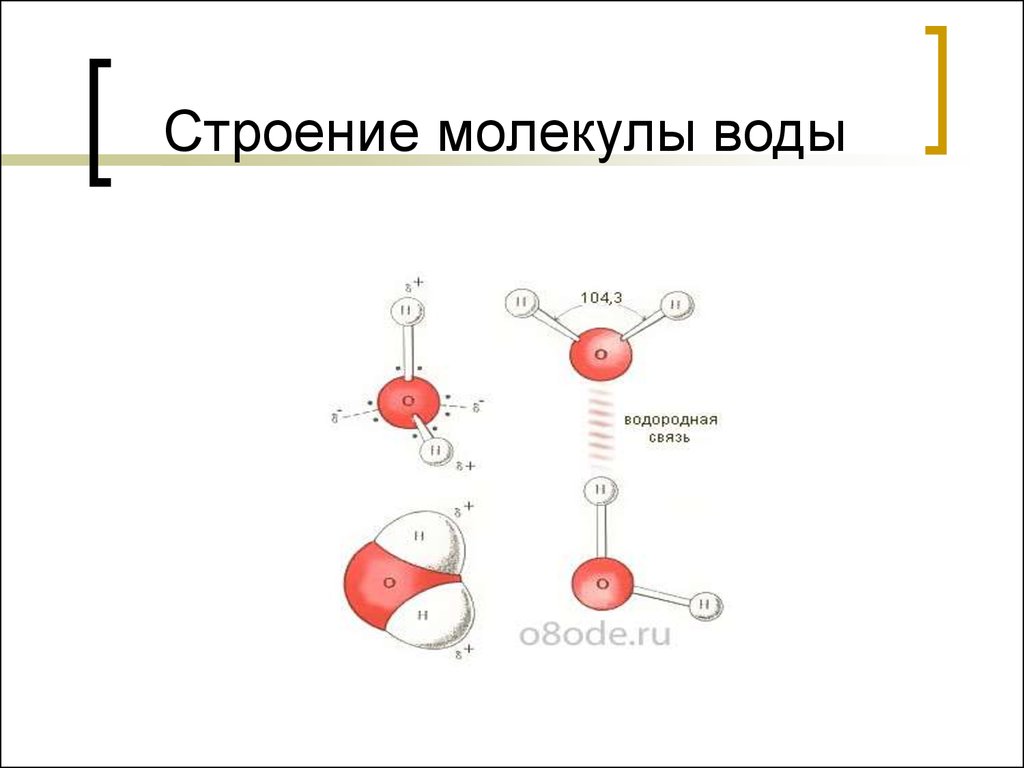
Общеизвестно, что лед плавает по воде, а озера замерзают сверху. Это связано с тем, что молекулы воды упаковываются в структуру с меньшей плотностью, чем плотность жидкой воды, что является проявлением необычных свойств воды: плотность жидкой воды увеличивается сразу после точки замерзания и достигает максимума при четырех градусах Цельсия (39 градусов по Фаренгейту). ), так называемая температура максимальной плотности; эта разница в плотности диктует, что жидкость всегда находится подо льдом.
Охлаждая воду до этой температуры, группа применила методы ядерного магнитного резонанса (тот же подход используется в медицине при магнитно-резонансной томографии), чтобы показать, что разница во времени жизни двух ионов достигает максимального значения (чем больше срок службы, тем медленнее транспорт). Подчеркнув разницу в продолжительности жизни, асимметрия стала очевидной.
Как отмечалось ранее, вода состоит из одного атома кислорода и двух атомов водорода, но атомы водорода относительно подвижны и могут перескакивать с одной молекулы на другую, и именно этот прыжок делает две ионные частицы столь подвижными в воде.
В поисках объяснений характеристик, зависящих от температуры, исследователи сосредоточились на скорости, с которой могут происходить такие прыжки.
Предыдущие исследования показали, что два основных геометрических расположения водородных связей (по одной связанной с каждым ионом) облегчают прыжки. Исследователи обнаружили, что одна из схем приводит к значительно более медленным скачкам для OH —, чем для H + при четырех градусах Цельсия. Поскольку это также температура максимальной плотности, исследователи сочли, что эти два явления должны быть связаны. Кроме того, их результаты показали, что прыжковое поведение молекул резко изменилось при этой температуре.
«Изучение молекулярных свойств воды представляет большой интерес из-за ее центральной роли в обеспечении физиологических процессов и ее повсеместного характера», — говорит Джершоу, соответствующий автор этого исследования. «Новое открытие весьма неожиданно и может способствовать более глубокому пониманию свойств воды, а также ее роли как жидкости во многих явлениях природы».
Такерман, который был одним из первых исследователей, предсказавших асимметрию в механизмах переноса и различие в расположении водородных связей, говорит: «Отрадно, что эти четкие экспериментальные данные подтверждают наши более ранние предсказания. В настоящее время мы ищем новые способы использования асимметрии между H + и OH − для разработки новых материалов для экологически чистой энергетики, и знание того, что мы начинаем с правильной модели, имеет решающее значение для нашего дальнейшего прогресса».
Находки группы также повлияют на широкий спектр других исследований, начиная от изучения функции ферментов в организме и заканчивая пониманием того, как живые организмы могут процветать в суровых условиях, включая минусовые температуры и сильнокислую среду.
Исследование было поддержано грантами Национального научного фонда (CHE 1710046, CHE-1534374) и частично программой MRSEC Национального научного фонда (DMR-1420073).
DOI: 10. 1103/PhysRevLett.121.076001
1103/PhysRevLett.121.076001
Молекула воды и ее взаимодействия | Вода: очень краткое введение
Фильтр поиска панели навигации Oxford AcademicВода: очень краткое введение Очень краткое введениеФизическая химияКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicВода: очень краткое введение Очень краткое введениеФизическая химияКнигиЖурналы Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать Цитировать
Разрешения
- Делиться
- Твиттер
- Подробнее
CITE
Finney, John,
‘Молекула воды и ее взаимодействия’
,
Вода: очень короткое введение
, очень короткие введения
(
Oxford,
2015;
онлайн онлайн. edn,
edn,
Oxford Academic
, 27 августа 2015 г.
), https://doi.org/10.1093/actrade/9780198708728.003.0002,
, по состоянию на 6 октября 2022 г.
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации Oxford AcademicВода: очень краткое введение Очень краткое введениеФизическая химияКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicВода: очень краткое введение Очень краткое введениеФизическая химияКнигиЖурналы Термин поиска на микросайте
Advanced Search
Abstract
В статье «Молекула воды и ее взаимодействия» обсуждаются структурные и электрические свойства молекулы воды.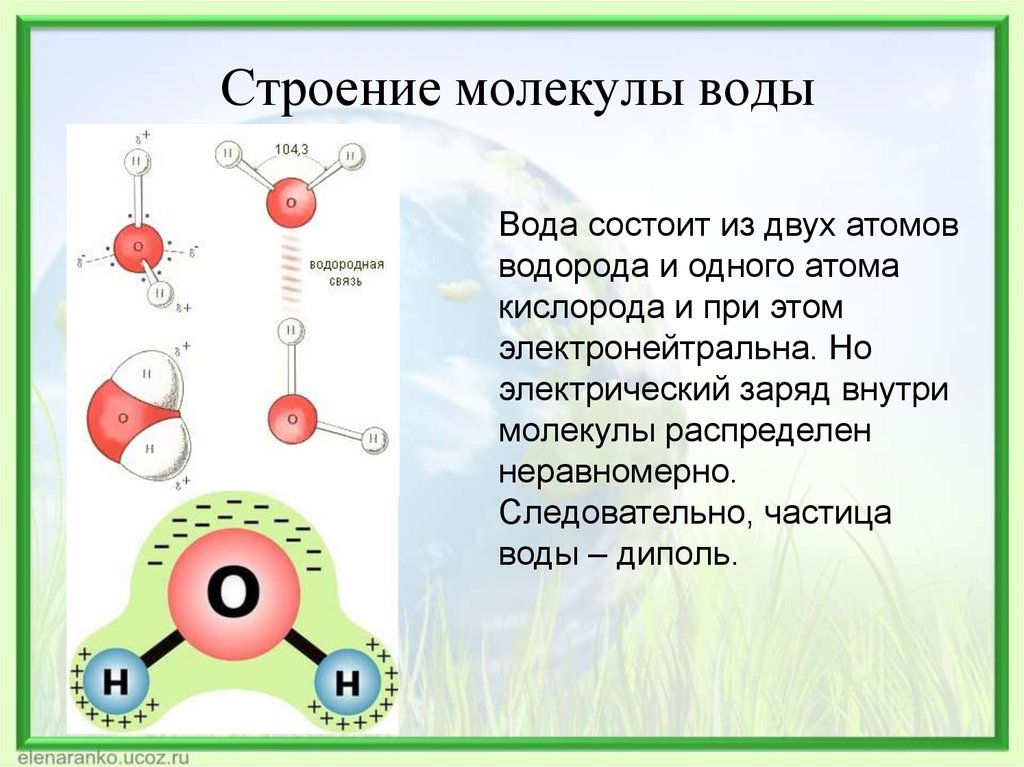 Молекула воды состоит из двух атомов водорода, соединенных ковалентными связями с одним атомом кислорода. Молекулы воды взаимодействуют друг с другом через тип взаимодействия, называемый водородной связью. Тетраэдрическое расположение четырех молекул воды вокруг центральной является ключом к пониманию воды. Это помогает объяснить структуру воды в ее различных состояниях, ее свойства и то, как она взаимодействует с другими видами молекул, позволяя исследовать свойства и поведение широкого спектра химических, физических и биологических систем, в которых участвует вода. .
Молекула воды состоит из двух атомов водорода, соединенных ковалентными связями с одним атомом кислорода. Молекулы воды взаимодействуют друг с другом через тип взаимодействия, называемый водородной связью. Тетраэдрическое расположение четырех молекул воды вокруг центральной является ключом к пониманию воды. Это помогает объяснить структуру воды в ее различных состояниях, ее свойства и то, как она взаимодействует с другими видами молекул, позволяя исследовать свойства и поведение широкого спектра химических, физических и биологических систем, в которых участвует вода. .
Ключевые слова: атомная теория, двуокись углерода, Джон Дальтон, водород, водородная связь, молекула, тетраэдрический угол, вода
Предмет
Физическая химия
Серия
Очень краткое введение
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок.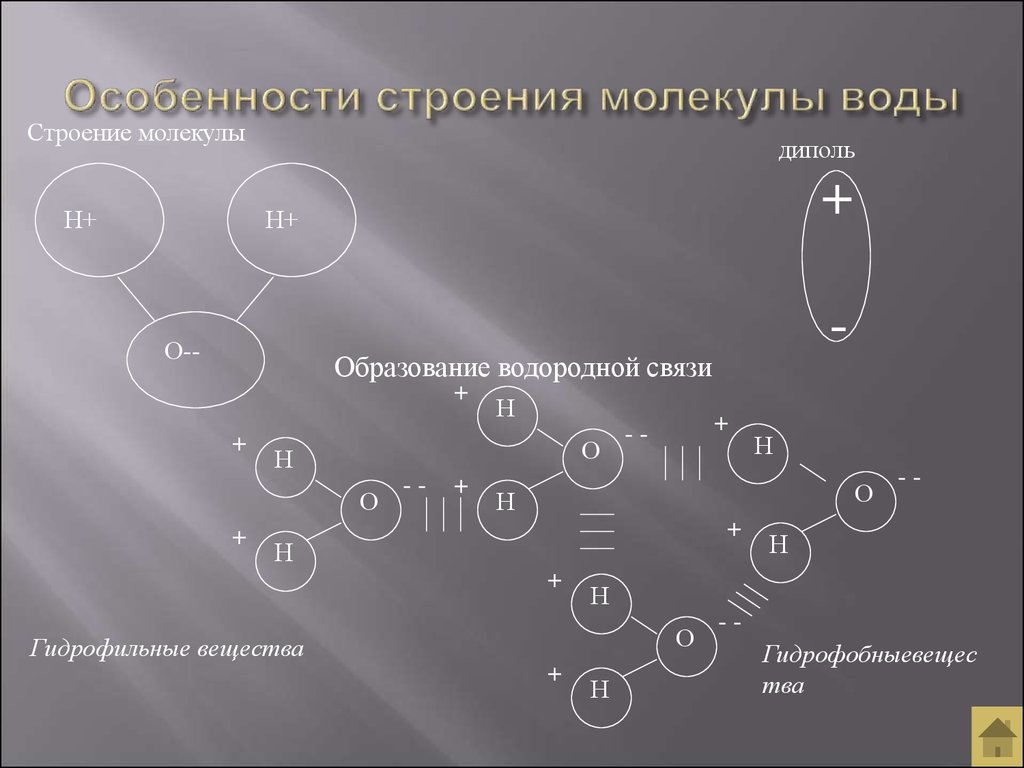 Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Нажмите Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- При посещении сайта учреждения используйте учетные данные, предоставленные вашим учреждением.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.

- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Ведение счетов организаций
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
Покупка
Наши книги можно приобрести по подписке или приобрести в библиотеках и учреждениях.
Информация о покупке
Каковы уникальные свойства воды?
Вода является одним из самых важных веществ на Земле для всех живых существ, поэтому неудивительно, что эта удивительная молекула обладает некоторыми особыми свойствами.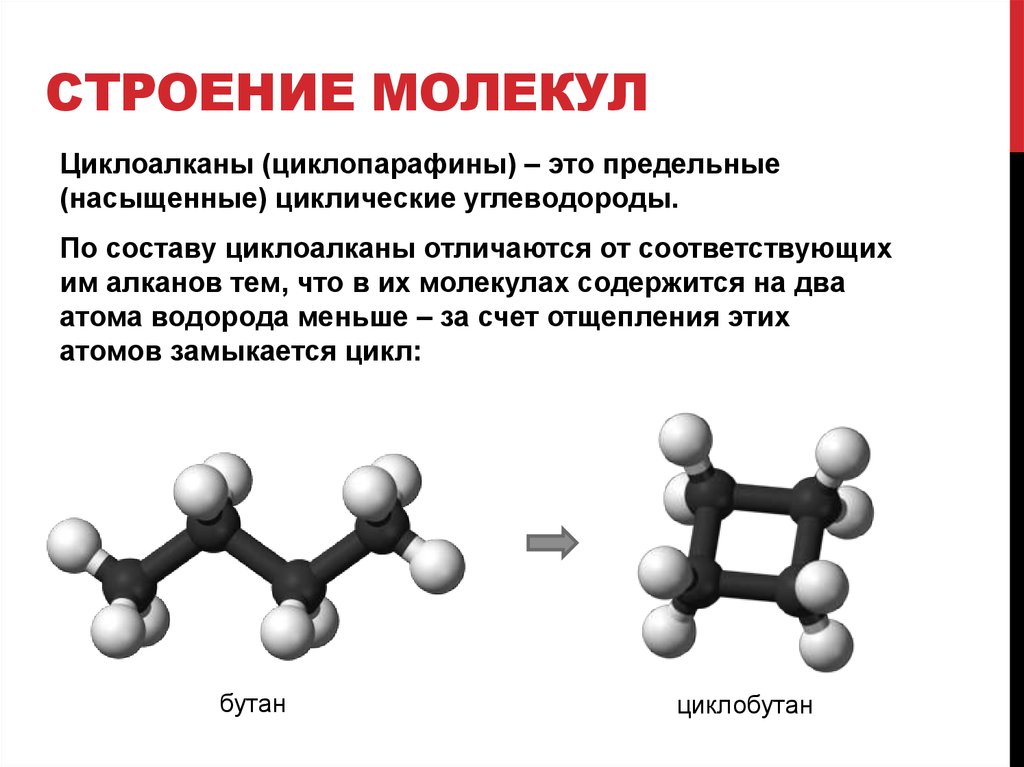 Откройте для себя химические и физические свойства воды, которые делают ее такой уникальной.
Откройте для себя химические и физические свойства воды, которые делают ее такой уникальной.
свойства воды в кубиках льда
Реклама
Основные химические свойства воды
Изучение уникальных свойств воды начинается с понимания ее основных химических свойств.
Полярность
Вода состоит из полярных молекул, поэтому полярность является одним из ее уникальных свойств. Каждая молекула воды имеет два атома водорода и один атом кислорода (h3O). Эти молекулы образуют полярные ковалентные связи. Атомы водорода заряжены положительно, а молекулы кислорода — отрицательно. Это свойство заставляет молекулы воды притягиваться друг к другу.
Сплоченность
Полярность воды приводит к ее сплоченности. Сплоченность относится к силам, которые заставляют или позволяют одинаковым молекулам оставаться вместе. Тот факт, что молекулы воды естественным образом стремятся цепляться друг за друга, означает, что вода обладает сцеплением.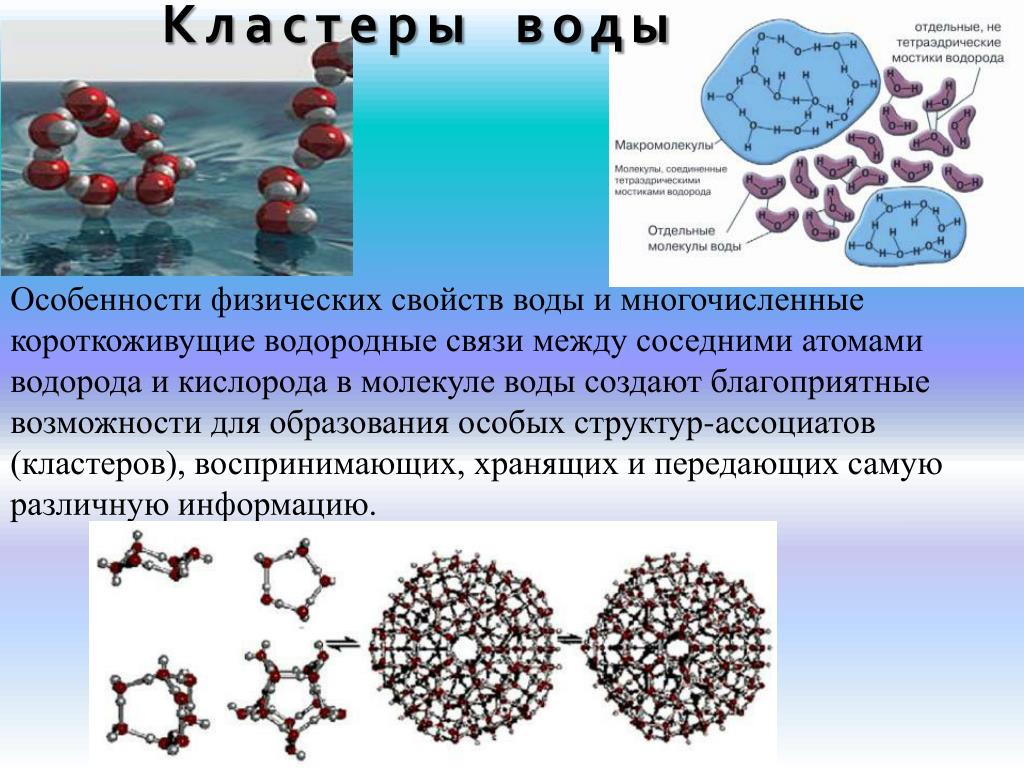 Вот почему могут образовываться капли воды. Сплоченность также объясняет, почему контейнер может быть наполнен водой чуть выше точки перелива, прежде чем она действительно прольется.
Вот почему могут образовываться капли воды. Сплоченность также объясняет, почему контейнер может быть наполнен водой чуть выше точки перелива, прежде чем она действительно прольется.
Поверхностное натяжение
Вода имеет второе по величине поверхностное натяжение среди всех жидких веществ (ртуть выше). Поскольку молекулы воды стремятся сцепиться друг с другом, молекулы на поверхности образуют более прочные связи, чем молекулы под поверхностью. Это приводит к поверхностному натяжению, которое становится барьером между водой и воздухом над ней (атмосферой). Поверхностное натяжение объясняет, почему маленькие объекты будут плавать на поверхности воды, а не тонуть под ее поверхностью.
Вязкость
Чем выше вязкость жидкости, тем сильнее она сопротивляется течению. И наоборот, чем менее вязкая жидкость, тем свободнее она течет. Мед является примером очень вязкой жидкости. Вода, конечно, не такая вязкая, как мёд, но вязкость у неё есть.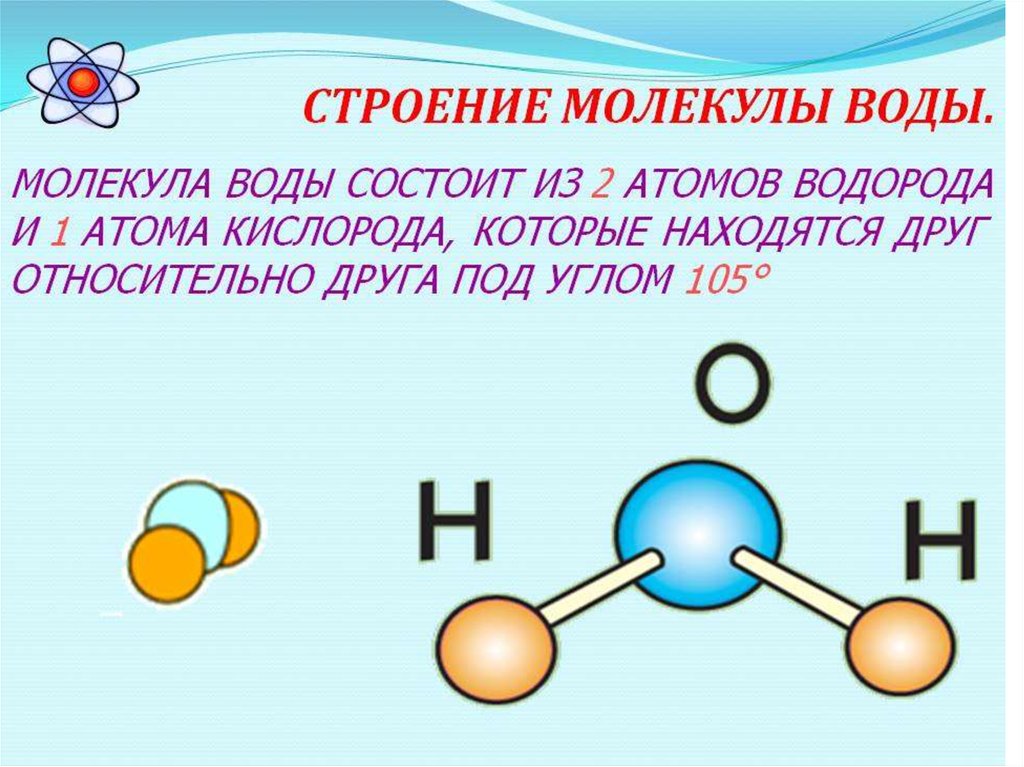 Степень вязкости воды зависит от температуры. Существует обратная зависимость, означающая, что с повышением температуры воды ее вязкость уменьшается.
Степень вязкости воды зависит от температуры. Существует обратная зависимость, означающая, что с повышением температуры воды ее вязкость уменьшается.
Точки кипения и замерзания
Вода имеет высокую точку кипения и низкую точку замерзания , что означает, что она не кипит и не замерзает быстро. Тот факт, что вода не реагирует быстро на колебания температуры, является причиной того, что она может поддерживать водную жизнь. Температура кипения воды составляет 212 градусов по Фаренгейту, что преобразуется в 100 градусов по Цельсию. Температура замерзания воды составляет 32 градуса по Фаренгейту, что равно нулю градусов по Цельсию.
Реклама
Жидкое состояние
Вода в жидкое состояние всякий раз, когда оно не замерзает в твердое состояние или не кипятится в газообразное. На самом деле это необычное свойство для вещества, не содержащего углерода (вода состоит из водорода и кислорода). Большинство веществ, не содержащих углерода, не являются жидкими при комнатной температуре. Вода имеет наименьшую плотность, когда находится в жидком состоянии.
Вода имеет наименьшую плотность, когда находится в жидком состоянии.
Твердое состояние
Лед — это твердое состояние воды. Когда вода охлаждается, она становится более плотной, пока не приблизится к температуре замерзания. По мере того как вода охлаждается и движется к замерзанию, она начинает становиться слякотной. Как только вода проходит точку замерзания, она становится льдом. Непосредственно перед точкой, в которой образуется лед, плотность воды начинает уменьшаться, а не продолжать увеличиваться. Вот почему кубики льда плавают в стакане воды.
Газообразное состояние
Пар — это газообразное состояние воды. Когда вода нагревается до точки кипения, она становится паром. Когда вода начинает кипеть, ее водородные связи начинают разрываться. Когда он достигает точки пара, водородные связи не могут образовываться. Это объясняет, почему ожоги паром на самом деле даже хуже, чем ожоги кипятком.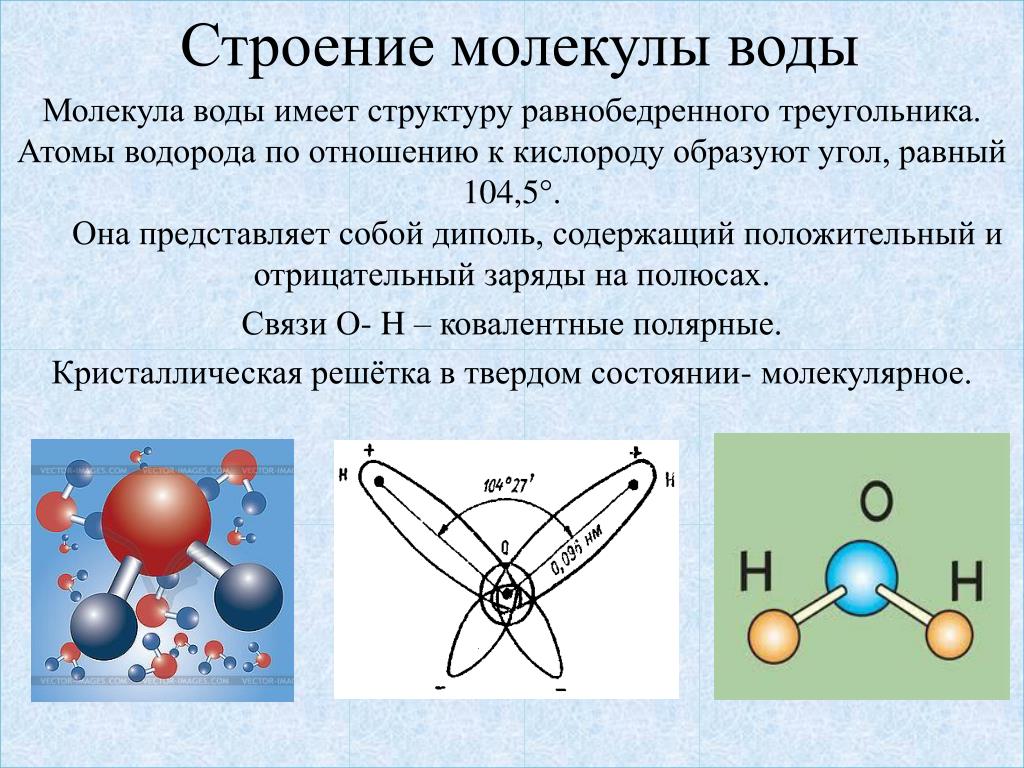 Когда пар соприкасается с кожей человека, этот человек ощущает энергию, полученную паром в результате разрыва водородных связей, а также тепло кипящей воды.
Когда пар соприкасается с кожей человека, этот человек ощущает энергию, полученную паром в результате разрыва водородных связей, а также тепло кипящей воды.
Основные физические свойства воды
Физические свойства воды — это ее характеристики, которые можно воспринимать органами чувств. То, что вы можете увидеть, потрогать, попробовать на вкус или понюхать в воде, представляет ее физические свойства. К самым основным физическим свойствам воды относятся температура, вкус, запах и цвет.
Реклама
Температура
Температура воды является физическим свойством. Температура воды влияет на многие характеристики, такие как уровень поверхностного натяжения, растворимость и вес. С повышением температуры скорость, с которой происходят биологические или химические реакции, также увеличивается.
Вкус
Вкус воды зависит от того, какие соединения в ней присутствуют. Например, соленая вода имеет соленый вкус из-за присутствия хлорида натрия. Это верно для естественной соленой воды, такой как та, что находится в океанах, заливах и других водоемах, а также для искусственной соленой воды. Если в воду добавить сахар (сахарозу), она станет сладкой на вкус.
Это верно для естественной соленой воды, такой как та, что находится в океанах, заливах и других водоемах, а также для искусственной соленой воды. Если в воду добавить сахар (сахарозу), она станет сладкой на вкус.
Запах
Чувства вкуса и обоняния тесно связаны. Те же типы соединений, которые могут изменить вкус воды, также могут повлиять на ее запах. Например, вода с высоким содержанием серы (сероводородный газ) также описывается как пахнущая тухлыми яйцами и имеющая кислый вкус.
Цвет
Цвет воды может варьироваться в зависимости от множества факторов. Например, океанская вода кажется синей, а чистая вода из крана — прозрачной. Вода в океане поглощает красный цвет из светового спектра, оставляя синий цвет, который обычно ассоциируется с океанской водой. Когда океанская вода имеет другой цвет, это может быть связано с другими веществами в частице, такими как водоросли или различные частицы.
Расширьте свои знания о воде
Теперь, когда вы знаете о некоторых уникальных свойствах воды, попробуйте немного попрактиковаться, чтобы развить более глубокое понимание.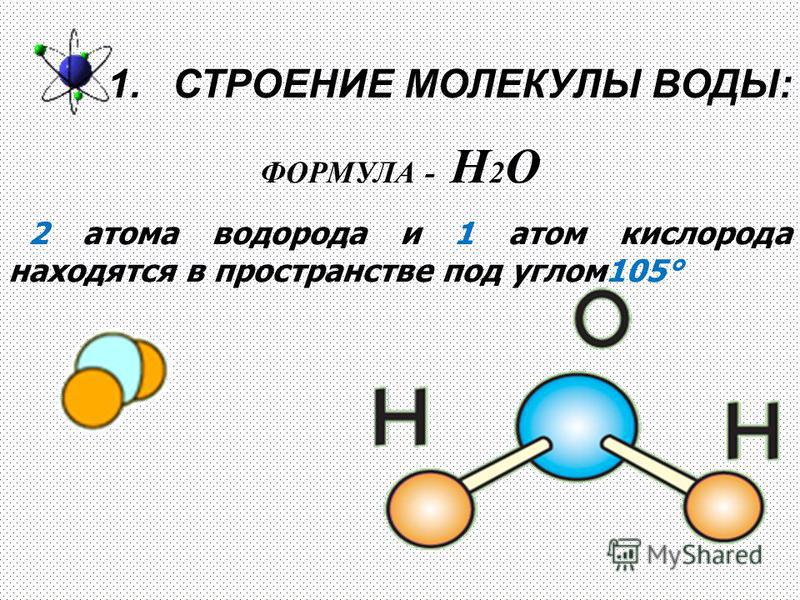





.jpg)
 Участвует в ряде химических реакций.
Участвует в ряде химических реакций.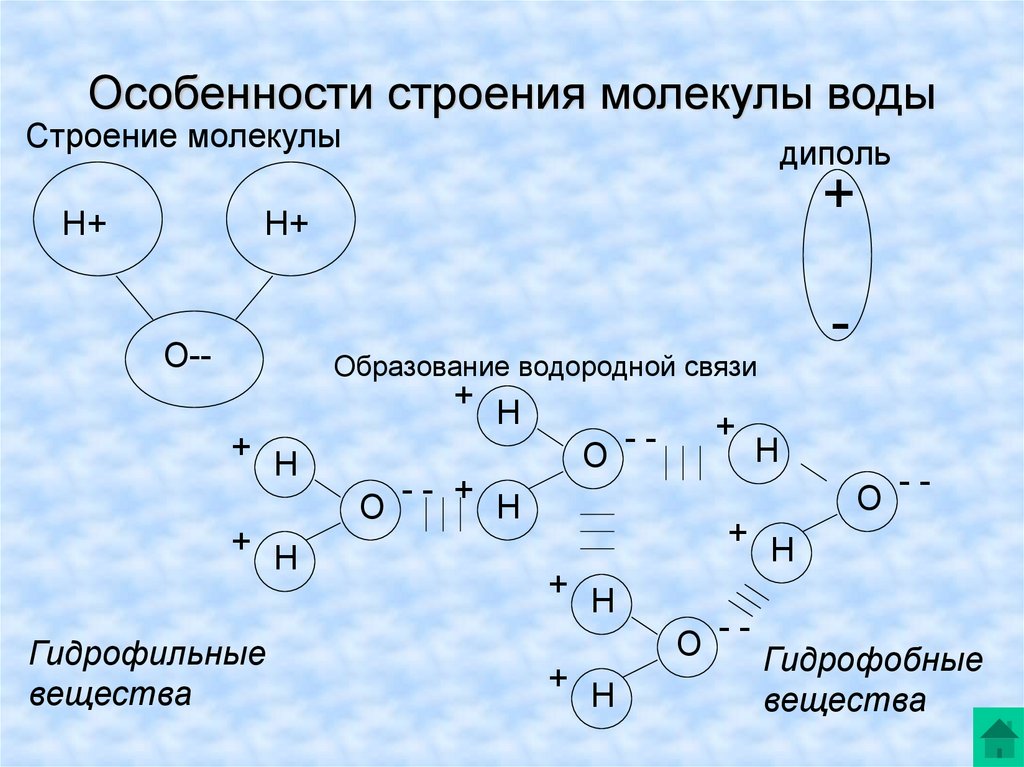 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic.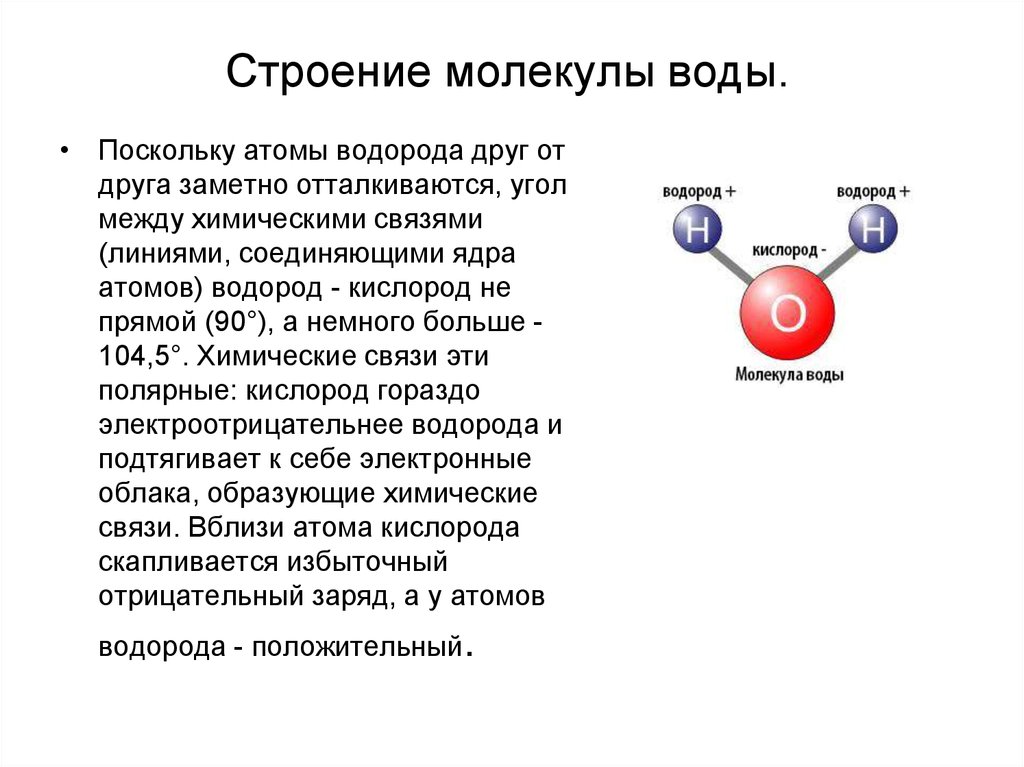 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic.