В чем особенность строения молекулы воды
Из всех соединений водорода наибольшее значение имеет его оксид Н2O, называемый водой. Общее
количество воды на Земле, включая связанную в минералах литосферы и мантии, оценивается в 1,6 · 1010 км3, в том числе пресной воды — 9 • 107 км.Вода-непременный участник всех процессов жизнедеятельности. В живых организмах она составляет от 50 до 90 % их общей массы.
Пресная вода содержит от 0,05 до 1 г/л растворенных солей. Самые важные из них — гидрокарбонаты магния и кальция, присутствие которых делает воду жесткой.
Океанская вода содержит в среднем 35 г/л растворенных солей. В основном это хлористый натрий NaCl (27 г/л). Установлено, что океанская вода содержит в той или иной форме практически все элементы периодической системы.
Изолированная молекула воды имеет уголковое строение.
 Наличие неподеленных пар на атоме кислорода, большой дипольный момент, •Удобная• геометрия делают воду весьма реакционноспособным веществом. Она реагирует со многими простыми веществами, как металлами, так и неметаллами, с оксидами, галогенидами и другими классами веществ.
Наличие неподеленных пар на атоме кислорода, большой дипольный момент, •Удобная• геометрия делают воду весьма реакционноспособным веществом. Она реагирует со многими простыми веществами, как металлами, так и неметаллами, с оксидами, галогенидами и другими классами веществ.Вода легко входит во внутреннюю сферу комплексных соединений, выступая в роли лиганда. В частности, многие гидратированные катионы переходят из растворов в кристаллы солей, образуя кристаллоГИдРаты.
Наконец, вода является прекрасным катализатором большинства окислительно-восстановительных реакций.
Структура воды
К.х.н. О.В. Мосин
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. При этом ядра водорода “оголяются”. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — правильный тетраэдр.
Строение молекулы воды (рисунок справа)
Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4-мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Однако, в жидком состоянии вода – неупорядоченная жидкость; эти водородные связи — спонтанные, короткоживущие, быстро рвутся и образуются вновь. Всё это приводит к неоднородности в структуре воды.
Водородные связи между молекулами воды (рисунок ниже слева)
То, что вода неоднородна по своему составу, было установлено давно. С давних пор известно, что лёд плавает на поверхности воды, то есть плотность кристаллического льда меньше, чем плотность жидкости.
Почти у всех остальных веществ кристалл плотнее жидкой фазы. К тому же и после плавления при повышении температуры плотность воды продолжает увеличиваться и достигает максимума при 4°C. Менее известна аномалия сжимаемости воды: при нагреве от точки плавления вплоть до 40°C она уменьшается, а потом увеличивается. Теплоёмкость воды тоже зависит от температуры немонотонно.
Кроме того, при температуре ниже 30°C с увеличением давления от атмосферного до 0,2 ГПа вязкость воды уменьшается, а коэффициент самодиффузии — параметр, который определяет скорость перемещения молекул воды относительно друг друга растёт.
Для других жидкостей зависимость обратная, и почти нигде не бывает, чтобы какой-то важный параметр вёл себя не монотонно, т.е. сначала рос, а после прохождения критического значения температуры или давления уменьшался. Возникло предположение, что на самом деле вода — это не единая жидкость, а смесь двух компонентов, которые различаются свойствами, например плотностью и вязкостью, а следовательно, и структурой. Такие идеи стали возникать в конце XIX века, когда накопилось много данных об аномалиях воды.
Первым идею о том, что вода состоит из двух компонентов, высказал Уайтинг в 1884 году. Его авторство цитирует Э.Ф. Фрицман в монографии “Природа воды. Тяжёлая вода”, изданной в 1935 году. В 1891 году В. Ренгтен ввёл представление о двух состояниях воды, которые различаются плотностью. После неё появилось множество работ, в которых воду рассматривали как смесь ассоциатов разного состава (“гидролей”).
Когда в 20-е годы определили структуру льда, оказалось, что молекулы воды в кристаллическом состоянии образуют трёхмерную непрерывную сетку, в которой каждая молекула имеет четырёх ближайших соседей, расположенных в вершинах правильного тетраэдра. В 1933 году Дж. Бернал и П. Фаулер предположили, что подобная сетка существует и в жидкой воде. Поскольку вода плотнее льда, они считали, что молекулы в ней расположены не так, как во льду, то есть подобно атомам кремния в минерале тридимите, а так, как атомы кремния в более плотной модификации кремнезёма — кварце. Увеличение плотности воды при нагревании от 0 до 4°C объяснялось присутствием при низкой температуре тридимитовой компоненты. Таким образом, модель Бернала — Фаулера сохранила элемент двухструктурности, но главное их достижение — идея непрерывной тетраэдрическои сетки. Тогда появился знаменитый афоризм И. Ленгмюра: „Океан — одна большая молекула“. Излишняя конкретизация модели не прибавила сторонников теории единой сетки.
Только в 1951 году Дж. Попл создал модель непрерывной сетки, которая была не так конкретна, как модель Бернала — Фаулера. Попл представлял воду как случайную тетраэдрическую сетку, связи между молекулами в которой искривлены и имеют различную длину. Модель Попла объясняет уплотнение воды при плавлении искривлением связей. Когда в 60–70-е годы появились первые определения структуры льдов II и IX, стало ясно, как искривление связей может приводить к уплотнению структуры. Модель Попла не могла объяснить немонотонность зависимости свойств воды от температуры и давления так хорошо, как модели двух состояний. Поэтому идею двух состояний ещё долго разделяли многие учёные.
Но во второй половине XX века нельзя было так фантазировать о составе и строении „гидролей“, как это делали в начале века. Уже было известно, как устроен лёд и кристаллогидраты, и многое знали про водородную связь. Помимо „континуальных“ моделей (модель Попла), возникли две группы „смешанных“ моделей: кластерные и клатратные. В первой группе вода представала в виде кластеров из молекул, связанных водородными связями, которые плавали в море молекул, в таких связях не участвующих. Модели второй группы рассматривали воду как непрерывную сетку (обычно в этом контексте называемую каркасом) водородных связей, которая содержит пустоты; в них размещаются молекулы, не образующие связей с молекулами каркаса. Нетрудно было подобрать такие свойства и концентрации двух микрофаз кластерных моделей или свойства каркаса и степень заполнения его пустот клатратных моделей, чтобы объяснить все свойства воды, в том числе и знаменитые аномалии.
Среди кластерных моделей наиболее яркой оказалась модель Г. Немети и Х. Шераги: предложенные ими картинки, изображающие кластеры связанных молекул, которые плавают в море несвязанных молекул, вошли во множество монографий.
Первую модель клатратного типа в 1946 году предложил О.Я. Самойлов: в воде сохраняется подобная гексагональному льду сетка водородных связей, полости которой частично заполнены мономерными молекулами. Л. Полинг в 1959 году создал другой вариант, предположив, что основой структуры может служить сетка связей, присущая некоторым кристаллогидратам.
В течение второй половины 60-х годов и начала 70-х наблюдается сближение всех этих взглядов. Появлялись варианты кластерных моделей, в которых в обеих микрофазах молекулы соединены водородными связями. Сторонники клатратных моделей стали допускать образование водородных связей между пустотными и каркасными молекулами. То есть фактически авторы этих моделей рассматривают воду как непрерывную сетку водородных связей. И речь идёт о том, насколько неоднородна эта сетка (например, по плотности). Представлениям о воде как о водородно-связанных кластерах, плавающих в море лишённых связей молекул воды, был положен конец в начале восьмидесятых годов, когда Г. Стэнли применил к модели воды теорию перколяции, описывающую фазовые переходы воды.
В 1999 г. известный российский исследователь воды С.В. Зенин защитил в Институте медико-биологических проблем РАН докторскую диссертацию, посвященную кластерной теории, которая явилась существенным этапом в продвижении этого направления исследований, сложность которых усиливается тем, что они находятся на стыке трех наук: физики, химии и биологии. Им на основании данных, полученных тремя физико-химическими методами: рефрактометрии (С.В. Зенин, Б.В. Тяглов, 1994), высокоэффективной жидкостной хроматографии (С.В. Зенин с соавт., 1998) и протонного магнитного резонанса (С.В. Зенин, 1993) построена и доказана геометрическая модель основного стабильного структурного образования из молекул воды (структурированная вода), а затем (С.В. Зенин, 2004) получено изображение с помощью контрастно-фазового микроскопа этих структур.
Сейчас наукой доказано, что особенности физических свойств воды и многочисленные короткоживущие водородные связи между соседними атомами водорода и кислорода в молекуле воды создают благоприятные возможности для образования особых структур-ассоциатов (кластеров), воспринимающих, хранящих и передающих самую различную информацию.
Структурной единицей такой воды является кластер, состоящий из клатратов, природа которых обусловлена дальними кулоновскими силами. В структуре кластров закодирована информация о взаимодействиях, имевших место с данными молекулами воды. В водных кластерах за счёт взаимодействия между ковалентными и водородными связями между атомами кислорода и атомами водорода может происходить миграция протона (Н+) по эстафетному механизму, приводящие к делокализации протона в пределах кластера.
Вода, состоящая из множества кластеров различных типов, образует иерархическую пространственную жидкокристаллическую структуру, которая может воспринимать и хранить огромные объемы информации.
На рисунке (В.Л. Воейков) в качестве примера приведены схемы нескольких простейших кластерных структур.
Некоторые возможные структуры кластеров воды
Переносчиками информации могут быть физические поля самой различной природы. Так установлена возможность дистанционного информационного взаимодействия жидкокристаллической структуры воды с объектами различной природы при помощи электромагнитных, акустических и других полей. Воздействующим объектом может быть и человек.
Вода является источником сверхслабого и слабого переменного электромагнитного излучения. Наименее хаотичное электромагнитное излучение создаёт структурированная вода. В таком случае может произойти индукция соответствующего электромагнитного поля, изменяющего структурно-информационные характеристики биологических объектов.
В течение последних лет получены важные данные о свойствах переохлаждённой воды. Изучать воду при низкой температуре очень интересно, поскольку её удаётся сильнее переохладить, чем другие жидкости. Кристаллизация воды, как правило, начинается на каких-то неоднородностях — либо на стенках сосуда, либо на плавающих частичках твердых примесей. Поэтому найти температуру, при которой бы переохлаждённая вода самопроизвольно закристаллизовалась нелегко. Но учёным удалось это сделать, и сейчас температура так называемой гомогенной нуклеации, когда образование кристаллов льдов идёт одновременно по всему объёму, известна для давлений вплоть до 0,3 ГПа, то есть захватывая области существования льда II.
От атмосферного давления до границы, разделяющей льды I и II, эта температура падает от 231 до 180 К, а потом слегка увеличивается — до 190К. Ниже этой критической температуры жидкая вода невозможна в принципе.
Структура льда (рисунок справа)
Однако с этой температурой связана одна загадка. В середине восьмидесятых годов была открыта новая модификация аморфного льда — лёд высокой плотности, и это помогло возрождению представлений о воде как о смеси двух состояний. В качестве прототипов рассматривались не кристаллические структуры, а структуры аморфных льдов разной плотности. В наиболее внятном виде эту концепцию сформулировали Е.Г. Понятовский и В.В. Синицин, которые в 1999 году написали: „Вода рассматривается как регулярный раствор двух компонентов, локальные конфигурации в которых соответствуют ближнему порядку модификаций аморфного льда“. Более того, изучая ближний порядок в переохлаждённой воде при высоком давлении методами дифракции нейтронов, учёным удалось найти компоненты, соответствующие этим структурам.
Следствием полиморфизма аморфных льдов стали также предположения о расслоении воды на два несмешивающихся компонента при температуре ниже гипотетической низкотемпературной критической точки. К сожалению, по оценке исследователей, эта температура при давлении 0,017 ГПа равна 230К — ниже температуры нуклеации, поэтому наблюдать расслоение жидкой воды никому ещё не удалось. Так возрождение модели двух состояний поставило вопрос о неоднородности сетки водородных связей в жидкой воде. Разобраться в этой неоднородности можно только с помощью компьютерного моделирования.
Говоря о кристаллической структуре воды, следует отметить, что известно 14 модификаций льда, большинство из которых не встречаются в природе, в которых молекулы воды и сохраняют свою индивидуальность, и соединены водородными связями. С другой стороны существует множество вариантов сетки водородных связей в клатратных гидратах. Энергии этих сеток (льдов высокого давления и клатратных гидратов) ненамного выше энергий кубического и гексагонального льдов. Поэтому фрагменты таких структур также могут появляться в жидкой воде. Можно сконструировать бесчисленное множество различных непериодических фрагментов, молекулы в которых имеют по четыре ближайших соседа, расположенных приблизительно по вершинам тетраэдра, но при этом их структура не соответствует структурам известных модификаций льда. Как показали многочисленные расчёты, энергии взаимодействия молекул в таких фрагментах будут близки друг к другу, и нет оснований говорить, что какая-то структура должна преобладать в жидкой воде.
Структурные исследования воды можно изучать разными методами; спектроскопией протонного магнитного резонанса, инфракрасной спекроскопии, дифракцией рентгеновских лучей и др. Например, дифракцию рентгеновских лучей и нейтронов в воде изучали много раз. Однако подробных сведений о структуре эти эксперименты дать не могут. Неоднородности, различающиеся по плотности, можно было бы увидеть по рассеянию рентгеновских лучей и нейтронов под малыми углами, однако такие неоднородности должны быть большими, состоящими из сотен молекул воды. Можно было бы их увидеть, и исследуя рассеяние света. Однако вода — исключительно прозрачная жидкость. Единственный же результат дифракционных экспериментов — функции радиального распределения, то есть расстояния между атомами кислорода, водорода и кислорода-водорода. Из них видно, что никакого дальнего порядка в расположении молекул воды нет. Эти функции для воды затухают гораздо быстрее, чем для большинства других жидкостей. Например, распределение расстояний между атомами кислорода при температуре, близкой к комнатной, даёт только три максимума, на 2,8, 4,5 и 6,7 Å. Первый максимум соответствует расстоянию до ближайших соседей, и его значение примерно равно длине водородной связи. Второй максимум близок к средней длине ребра тетраэдра — вспомним, что молекулы воды в гексагональном льду располагаются по вершинам тетраэдра, описанного вокруг центральной молекулы. А третий максимум, выраженный весьма слабо, соответствует расстоянию до третьих и более далёких соседей по водородной сетке. Этот максимум и сам не очень ярок, а про дальнейшие пики и говорить не приходится. Были попытки получить из этих распределений более детальную информацию. Так в 1969 году И.С. Андрианов и И.З. Фишер нашли расстояния вплоть до восьмого соседа, при этом до пятого соседа оно оказалось равным 3 Å, а до шестого — 3,1 Å. Это позволяет делать данные о дальнем окружении молекул воды.
Другой метод исследования структуры – нейтронная дифракция на кристаллах воды осуществляется точно также, как и рентгеновская дифракция. Однако из-за того, что длины нейтронного рассеяния различаются у разных атомов не столь сильно, метод изоморфного замещения становится неприемлемым. На практике обычно работают с кристаллом, у которого молекулярная структура уже приблизительно установлена другими методами. Затем для этого кристалла измеряют интенсивности нейтронной дифракции. По этим результатам проводят преобразование Фурье, в ходе которого используют измеренные нейтронные интенсивности и фазы, вычисляемые с учётом неводородных атомов, т.е. атомов кислорода, положение которых в модели структуры известно. Затем на полученной таким образом фурье-карте атомы водорода и дейтерия представлены с гораздо большими весами, чем на карте электронной плотности, т.к. вклад этих атомов в нейтронное рассеяние очень большой. По этой карте плотности можно, например, определить положения атомов водорода (отрицательная плотность) и дейтерия (положительная плотность).
Возможна разновидность этого метода, которая состоит в том, что кристалл образовавшийся в воде, перед измерениями выдерживают в тяжёлой воде. В этом случае нейтронная дифракция не только позволяет установить, где расположены атомы водорода, но и выявляет те из них, способные обмениваться на дейтерий, что особенно важно при изучение изотопного (H-D)-обмена. Подобная информация помогает подтвердить правильность установления структуры.
Другие методы также позволяют изучать динамику молекул воды. Это эксперименты по квазиупругому рассеянию нейтронов, сверхбыстрой ИК-спектроскопии и изучение диффузии воды с помощью ЯМР или меченых атомов дейтерия. Метод ЯМР-спектроскопии основан на том, что ядро атома водорода имеет магнитный момент — спин, взаимодействующий с магнитными полями, постоянными и переменными. По спектру ЯМР можно судить о том, в каком окружении эти атомы и ядра находятся, получая, таким образом, информацию о структуре молекулы.
В результате экспериментов по квазиупругому рассеянию нейтронов в кристаллах воды был измерен важнейший параметр — коэффициент самодиффузии при различных давлениях и температурах. Чтобы судить о коэффициенте самодиффузии по квазиупругому рассеянию нейтронов, необходимо сделать предположение о характере движения молекул. Если они движутся в соответствии с моделью Я.И. Френкеля (известного отечественного физика-теоретика, автора „Кинетической теории жидкостей“ — классической книги, переведённой на многие языки), называемой также моделью „прыжок-ожидание“, тогда время „осёдлой“ жизни (время между прыжками) молекулы составляет 3,2 пикосекунды. Новейшие методы фемтосекундной лазерной спектроскопии позволили оценить время жизни разорванной водородной связи: протону требуется 200 фс для того, чтобы найти себе партнёра. Однако всё это средние величины. Изучить детали строения и характера движения молекул воды можно только при помощи компьютерного моделирования, называемого иногда численным экспериментом.
Так выглядит структура воды по результатам компьютерного моделирования (по данным д.х.н. Г. Г. Маленкова). Общую беспорядочную структуру можно разбить на два типа областей (показаны тёмными и светлыми шариками), которые различаются по своему строению, например по объёму многогранника Вороного (а), степени тетраэдричности ближайшего окружения (б), значению потенциальной энергии (в), а также по наличию четырёх водородных связей у каждой молекулы (г). Впрочем, эти области буквально через мгновение, спустя несколько пикосекунд, изменят свое расположение.
Моделирование проводится так. Берётся структура льда и, нагревается до расплавления. Затем после некоторого времени, чтобы вода «забыла» о кристаллическом происхождении, снимаются мгновенные микрофотографии.
Для анализа структуры воды выбираются три параметра:
— степень отклонения локального окружения молекулы от вершин правильного тетраэдра;
-потенциальная энергия молекул;
-объём так называемого многогранника Вороного.
Чтобы построить этот многогранник, берут ребро от данной молекулы до ближайшей, делят его пополам и через эту точку проводят плоскость, перпендикулярную ребру. Получается объём, приходящийся на одну молекулу. Объём полиэдра — это плотность, тетраэдричность — степень искажения водородных связей, энергия — степень устойчивости конфигурации молекул. Молекулы с близкими значениями каждого из этих параметров стремятся сгруппироваться вместе в отдельные кластеры. Области как с низкой, так и с высокой плотностью обладают разными значениями энергии, но могут иметь и одинаковые значения. Эксперименты показали, что области с разным строением кластеры возникают спонтанно и спонтанно распадаются. Вся структура воды живёт и постоянно меняется, причём время, за которое происходят эти изменения, очень маленькое. Исследователи следили за перемещениями молекул и выяснили, что они совершают нерегулярные колебания с частотой около 0,5 пс и амплитудой 1 ангстрем. Наблюдались также и редкие медленные скачки на ангстремы, которые длятся пикосекунды. В общем, за 30 пс молекула может сместиться на 8-10 ангстрем. Время жизни локального окружения тоже невелико. Области, составленные из молекул с близкими значениями объёма многогранника Вороного, могут распасться за 0,5 пс, а могут жить и несколько пикосекунд. А вот распределение времён жизни водородных связей очень велико. Но это время не превышает 40 пс, а среднее значение — несколько пс.
В заключение следует подчеркнуть, что теория кластерного строения воды имеет много подводных камней. Например, Зенин предполагает, что основной структурный элемент воды — кластер из 57 молекул, образованный слиянием четырёх додекаэдров. Они имеют общие грани, а их центры образуют правильный тетраэдр. То, что молекулы воды могут располагаться по вершинам пентагонального додекаэдра, известно давно; такой додекаэдр — основа газовых гидратов. Поэтому ничего удивительного в предположении о существовании таких структур в воде нет, хотя уже говорилось, что никакая конкретная структура не может быть преобладающей и существовать долго. Поэтому странно, что этот элемент предполагается главным и что в него входит ровно 57 молекул. Из шариков, например, можно собирать такие же структуры, которые состоят из примыкающих друг к другу додекаэдров и содержат 200 молекул. Зенин же утверждает, что процесс трёхмерной полимеризации воды останавливается на 57 молекулах. Более крупных ассоциатов, по его мнению, быть не должно. Однако если бы это было так, из водяного пара не могли бы осаждаться кристаллы гексагонального льда, которые содержат огромное число молекул, связанных воедино водородными связями. Совершенно неясно, почему рост кластера Зенина остановился на 57 молекулах. Чтобы уйти от противоречий, Зенин и упаковывает кластеры в более сложные образования — ромбоэдры — из почти тысячи молекул, причём исходные кластеры друг с другом водородных связей не образуют. Почему? Чем молекулы на их поверхности отличаются от тех, что внутри? По мнению Зенина, узор гидроксильных групп на поверхности ромбоэдров и обеспечивает память воды. Следовательно, молекулы воды в этих крупных комплексах жёстко фиксированы, и сами комплексы представляют собой твёрдые тела. Такая вода не будет течь, а температура её плавления, которая связана с молекулярной массой, должна быть весьма высокой.
Какие свойства воды объясняет модель Зенина? Поскольку в основе модели лежат тетраэдрические постройки, её можно в той или иной степени согласовать с данными по дифракции рентгеновских лучей и нейтронов. Однако вряд ли модель может объяснить уменьшение плотности при плавлении — упаковка додекаэдров менее плотная, чем лёд. Но труднее всего согласуется модель с динамическими свойствами — текучестью, большим значением коэффициента самодиффузии, малыми временами корреляции и диэлектрической релаксации, которые измеряются пикосекундами.
К.х.н. О.В. Мосин
Cписок литературы:
Г.Г. Маленков. Успехи физической химии, 2001
С.В.Зенин, Б.М. Полануер, Б.В. Тяглов. Экспериментальное доказательство наличия фракций воды. Ж. Гомеопатическая медицина и акупунктура. 1997.№2.С.42-46.
С.В. Зенин, Б.В. Тяглов. Гидрофобная модель структуры ассоциатов молекул воды. Ж.Физ.химии.1994.Т.68.№4.С.636-641.
С.В. Зенин Исследование структуры воды методом протонного магнитного резонанса. Докл.РАН.1993.Т.332.№3.С.328-329.
С.В.Зенин, Б.В.Тяглов. Природа гидрофобного взаимодействия. Возникновение ориентационных полей в водных растворах. Ж.Физ.химии.1994.Т.68.№3.С.500-503.
С.В. Зенин, Б.В. Тяглов, Г.Б.Сергеев, З.А. Шабарова. Исследование внутримолекулярных взаимодействий в нуклеотидамидах методом ЯМР. Материалы 2-й Всесоюзной конф. По динамич. Стереохимии. Одесса.1975.с.53.
С.В. Зенин. Структурированное состояние воды как основа управления поведением и безопасностью живых систем. Диссертация. Доктор биологических наук. Государственный научный Центр «Институт медико-биологических проблем» (ГНЦ «ИМБП»). Защищена 1999. 05. 27. УДК 577.32:57.089.001.66.207 с.
В.И. Слесарев. Отчет о выполнении НИР по теме: «Воздействие фрактально-матричных транспарантов «Айрес» на характеристики структурно-информационного свойства воды». Санкт-Петербург. 2002.
С.В. Зенин, М.Ф.Меркулов, Д.Г. Мирза. Исследование медико-биологических свойств матричных аппликаторов «Айрес». Результаты апробации матричных аппликаторов «Айрес». СПб,2000.с.14-21.
Масару Эмото. Послания воды: Тайные коды кристаллов льда. Перев. с англ. М. ООО Издательский дом «София».2005.
Резников К.М. Вода жизни //Прикладные информационные аспекты медицины. – 2001. – Т.4. — №2. С.3-10.
О.В. Мосин, Д.А. Складнев, В.И. Швец. Биотехнология, Исследование физиологической адаптации бактерий к тяжёлой воде. 2001 г.
Галерея — картинки кластеров воды, полученных компъютерным моделированием
ее состав, строение молекулы, физические свойства. Химические свойства воды
Задача, выполняемая Ячейкой Мэйера — «лёгкое» разложение молекул воды под действием электрического тока, сопровождаемого электромагнитным излучением.
Для её решения разберёмся, что же вода из себя представляет? Каково строение молекул воды? Что известно о молекулах воды и их связях? В статье, я использовал различные публикации, имеющиеся в достаточном количестве в Интернете, но они размножены в большом количестве, поэтому, кто их автор, мне не понятно и ссылаться на источник с моей стороны глупо. Мало того, эти публикации «запутаны» до безобразия, что затрудняет восприятие, и значительно увеличивает время изучения. Анализируя статьи, я извлёк то, что может направить Вас на понимание того, с чем мы будем иметь дело в процессе добычи дешёвой энергии, а точнее в процессе разрыва молекул воды на составляющие – водород и кислород.
Итак, рассмотрим наиболее весомые понятия о строении молекул воды!
Вода — вещество, основной структурной единицей которого является молекула H 2 O, состоящая из одного атома кислорода и двух атомов водорода.
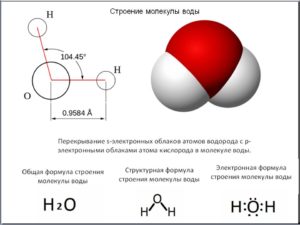
Молекула воды имеет структуру как бы равнобедренного треугольника: в вершине этого треугольника расположен атом кислорода, а в основании его — два атома водорода. Угол при вершине составляет 104°27, а длина стороны — 0,096 нм. Эти параметры относятся к гипотетическому равновесному состоянию молекулы воды без ее колебаний и вращений. Геометрия молекулы воды и её электронные орбиты изображены на рисунке.
Молекула воды представляет собой диполь, содержащий положительный и отрицательный заряды на полюсах. Если «свободную» молекулу воды — не связанную с другими молекулами, поместить в электрическое поле, то она «повернётся» отрицательными полюсами в сторону положительной пластины электрического поля, а положительными полюсами в сторону отрицательной пластины. Именно этот процесс изображён на рисунке 1, позиция — 3В, поясняющем работу Ячейки Мэйера в статье «Вода вместо бензина» .

Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4-мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Именно такое упорядоченное состояние молекул воды можно назвать «структурой». Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28′, направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру.

В жидком состоянии вода – неупорядоченная жидкость. Эти водородные связи — спонтанные, короткоживущие, быстро рвутся и образуются вновь.
Группируясь, тетраэдры молекул воды образуют разнообразные пространственные и плоскостные структуры.
И из всего многообразия структур в природе базовой является гексагональная (шестигранная) структура, когда шесть молекул воды (тетраэдров) объединяются в кольцо.

Структуры объединённых молекул воды называют кластерами, а отдельные молекулы воды — квантами. Кластер — объёмное соединение молекул воды, в том числе гексамеров, у которого имеются и положительные и отрицательные полюса.
В дистиллированной воде кластеры практически электронейтральны, потому что в результате испарения, произошло разрушение кластеров, а в результате конденсации, сильные связи между молекулами воды не появились. Однако, их электропроводность можно изменить. Если дистиллированную воду помешать магнитной мешалкой, связи между элементами кластеров будут частично восстановлены и электропроводность воды изменится. Другими словами,
На моём сайте имеются, и будут появляться статьи, которые, на первый взгляд «отдельные» и не имеют никакого отношения к другим статьям. На самом деле, большинство статей сайта имеет взаимосвязь в одно целое. В данном случае, описывая свойства дистиллированной воды, я использую Дипольную теорию электрического тока , это альтернативное понятие об электрическом токе, которое подтверждается и наукой и практикой лучше, чем классическое понятие.
При воздействии энергии источника электрического тока, все диполи атомов воды (как проводника) поворачиваются, ориентируясь своими одноимёнными полюсами в одном направлении. Если молекулы воды до появления внешнего электрического поля создавали кластерную (взаимно ориентированную) структуру, то для ориентации во внешнем электрическом поле потребуется минимальное количество энергии источника электрического тока. Если же структура была не организованной (как у дистиллированной воды), то потребуется большое количество энергии.
Заметьте, «в народе» бытует мнение, что дистиллированная вода и талая вода должны обладать одинаковыми электропроводными свойствами, ведь что у одной, что у другой отсутствуют химические примеси (как правило – соли), их химический состав одинаков, да и строение молекул воды что в талой воде, что в дистиллированной одинаково.
На самом деле всё выглядит наоборот, отсутствие примесей совсем не говорит о свойствах электропроводности воды. Не понимая этого, некоторые люди, «убивают» аккумуляторные батареи ещё на этапе их заправки электролитом, подменяя дистиллированную воду на талую, или просто очищенную через угольный фильтр. Как правило, заправленный аккумулятор, который куплен на автомобильном рынке служит меньше, чем тот, который вы купили сухозаряженным и разбавив серную кислоту дистиллированной водой, заправили его сами. Это лишь потому, что «готовый» электролит, или заправленный аккумулятор – это в наше время средство заработка, а чтобы определить какая вода использовалась, надо провести дорогую экспертизу, никто этим н
Связь строения воды с ее функциями
1. Один атом кислорода в воде соединен ковалентными связями с парой атомов водорода. Поэтому каждый атом водорода приобретает частично положительный заряд, а атом кислорода частично отрицательный.
2. Между отрицательно заряженным атомом кислорода одной молекулы воды и положительно заряженным атомом водорода другой молекулы имеется водородная связь. Потому молекулы воды и связаны друг с другом.
3. Водородные связи легко разрушаются — они в 20 раз слабее ковалентных связей. Поэтому молекулы воды подвижны в клетке и организме.
4. Водородные связи также обусловливают высокую температуру кипения воды, теплоемкость (способность поглощать тепло при минимальном колебании собственной температуры).
Роль воды в живой системе — клетке
1. Молекула воды — это диполь, так как в области атомов водорода преобладает заряд положительный, а в области атома кислорода выше плотность отрицательного заряда.
2. Угол связи H-O-H в молекуле воды составляет 104,5 градуса, поэтому положительный и отрицательный заряды сосредоточены на разных концах молекулы. И именно поэтому вода — прекрасный растворитель полярных веществ.
3. Вода вообще является универсальным растворителем благодаря своей способности образовывать гидраты.
4. Вода способна на ориентирование в электрическом поле, она может присоединиться к различным молекулам и участкам молекул, несущим заряд, — при этом образуются гидраты. Если силы притяжения внутри молекулы воды меньше, чем силы притяжения молекул воды к молекулам иного вещества, это вещество растворятся в воде.
5. Поэтому выделяют гидрофильные вещества — они хорошо растворимы в воде: соли, щелочи, кислоты. Данные вещества диссоциируют на заряженные частицы — катионы и анионы. Молекулы воды взаимодействуют с ними.
6. Кроме полярных соединений к гидрофильным веществам относятся также сахара, аминокислоты, спирты — неполярные соединения, в составе которых имеются полярные группы (OH, различные радикалы).
7. Гидрофобные вещества — с трудом или вовсе не растворяются в воде. К ним относятся жиры, жироподобные вещества, бензин, парафин, каучук. Жироподобные вещества находятся, например, внутри клеточных мембран, ограничивая исход растворенных веществ из клетки в окружающую среду и проникновение обратно.
8. Вода — участник многих реакций в клетке, ведь большинство реакций идут как раз в водном растворе. Белки, липиды, углеводы и другие органические вещества расщепляются в результате работы ферментов и взаимодействия с водой до более простых веществ в результате реакций гидролиза.
9. В связи с высокой теплоемкостью вода отлично поддерживает тепловое равновесие в клетке, и при сильном повышении температуры среды вода нагревается медленно, но долго сохраняет тепло. Организмы защищены водой от резких колебаний температуры окружающей среды, поэтому процессы обмена веществ могут происходить в стабильных условиях.
10. Вода имеет относительно высокую для жидкостей теплопроводность. Тепло равномерно распределяется по всему объему воды в клетке, препятствуя перегреванию в отдельных точках.
11. Испарение воды обеспечивает охлаждение именно всей поверхности клетки, так как на разрыв водородных связей тратится энергия. Таким образом, вода участвует в терморегуляции.
12. Вода — источник кислорода, который растения выделяют в атмосферу.
13. Вода — источник водорода, который используется для синтеза органических веществ растениями.
14. Вода — среда для транспорта веществ в организме. Она обеспечивает ток лимфы и крови, восходящие и нисходящие токи растворов по древесине и лубу у растений. В клетках вещества, растворенные в воде, транспортируются через клеточные мембраны. Транспортные функции воды обеспечиваются ее низкой вязкостью и высокой подвижностью.
15. В клетке различают воду свободную (ее 90 процентов) и связанную (10 процентов). Связанная вода участвует в образовании макромолекул и никогда не теряется живой клеткой. Вода определяет объем и тургор клеток и тканей. Тургор — напряженное состояние плазматической мембраны, вызванное давлением воды внутри клетки.
16. Вода характеризуется высоким поверхностным натяжением — этим обеспечивается сцепление ее молекул. Благодаря такому свойству молекулы воды передвигаются по проводящим тканям растений, а также некоторые животные двигаются по поверхности воды. Например, клоп-водомерка при передвижении использует именно поверхностное натяжение воды. На первой и третьей паре ног у него есть специальные волоски, которые не продавливают слой воды, а держат жука на поверхности.
17. При замерзании воды ее объем возрастает, а плотность уменьшается, поэтому вода в виде льда всплывает на поверхность водоема. Максимальную плотность вода имеет при температуре 4 градуса, а при 0 она имеет меньшую плотность. Зимой часть воды в реках превращается в более легкий лед, который всплывает на поверхность и создает защиту для речных обитателей, препятствуя промерзанию толщи воды. При этом более теплая и плотная вода (с температурой не ниже 4 градусов) концентрируется под покровом льда, создавая условия для выживания водных животных. Поздней осенью, при понижении температуры ниже 4 градусов в клетках растений образуются кристаллы льда и они погибают. Чтобы выжить, многие растения накапливают в тканях белки и сахара, благодаря чему вода с растворенными в ней органическими веществами не замерзает, и растения благополучно переносят холода.
Васильева Н.В. — Особенности стрения молекулы воды и способы изменения её свойств
Н. В. ВАСИЛЬЕВА
Южно-Уральский государственный университет, Челябинск
ОСОБЕННОСТИ СТРОЕНИЯ МОЛЕКУЛЫ ВОДЫ И СПОСОБЫ ИЗМЕНЕНИЯ ЕЕ СВОЙСТВ
Вода является не только наиболее распространенным, не только самым необходимым для жизни, но и одним из наиболее исследованных веществ на Земле. Сложно недооценить влияние воды на качество пищевых продуктов. В состав одних ее вводят для растворения кристаллических веществ, тогда как, являясь основным сырьевым компонентом других, она обусловливает их качество. Содержание воды в продуктах существенно влияет на вкус, питательность и консистенцию продукта. Изменение химического состава, структуры и свойств воды может значительно изменить качество и сохраняемость товаров. Однако на сегодня, не существует единой признанной модели строения воды, которая бы описывала все ее аномальные свойства.
На создание моделей, объясняющих удивительные свойства воды, направляли свои усилия многие ученые. Но общей характерной чертой большинства моделей воды служит недооценка структуры молекулы Н2О и возможной динамики ее изменения в процессе молекулярного взаимодействия.
С современных позиций строения атома электронные облака молекул воды расположены в форме неправильного тетраэдра. Атом кислорода оказывается при этом в центре, а два атома водорода — в противоположных углах одной из граней куба [3]. Межъядерные расстояния О-Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды, две электронные пары образуют ковалентные связи О-Н, а остальные четыре электрона представляют собой две не поделенных электронных пары.
Для объяснения аномальных свойств воды в жидком состоянии учеными созданы различные модели ее структуры. В основе многочисленных моделей жидкая вода рассматривается как кристаллическое вещество (жидкие кристаллы). Упорядоченное (кристаллическое) расположение частиц воды в жидком состоянии доказано экспериментально [12].
Представляет особый интерес модель структуры жидкой воды в виде мерцающих кластеров, состоящих из соединенных водородными связями молекул, плавающих в более или менее «свободной» воде. Кластер – это надмолекулярный комплекс, содержащий множество молекул.
Кластеры постоянно существуют в текучей жидкости, непрерывно образуясь и разрушаясь в соответствии со случайными тепловыми изменениями в микроучастках жидкости. Американские ученые определили время полужизни кластера как 10-10 — 10-11 с, что соответствует времени релаксационных процессов в воде. Это время в 100-1000 раз больше периода молекулярных колебаний.
Возникновение водородной связи в молекуле воды объясняется свойством атома водорода взаимодействовать с сильно электроотрицательным элементом, например с кислородом другой молекулы. Такая особенность водородного атома обусловливается тем, что, отдавая свой единственный электрон на образование ковалентной связи с кислородом, он остается в виде ядра очень малого размера, почти лишенного электронной оболочки. Поэтому он не испытывает отталкивания от электронной оболочки кислорода другой молекулы воды, а, наоборот, притягивается и может вступить с ней во взаимодействие [3].
В классической теории структуры воды существование максимума плотности при t = 4°С объясняется тем, что при этой температуре преобладающая часть молекул воды связана в кварцеподобную структуру, а при других температурах они имеют тридимитоподное кристаллическое строение, соответствующее меньшей плотности [4].
Во все времена ученые пытались изучить аномальные свойства воды и различные способы их изменений. При этом было установлено что, подвергаясь различным внешним воздействиям: температура, давление и др., вода может приобрести совершенно новые свойства. Особенно ярко это проявляется при действии на воду различных излучений. Существуют различные способы изменения свойств воды. Обычно эти процессы называют активацией.
Все методы активации можно свести к энергетическому воздействию на молекулы воды. В литературе не существует единой теории активационных процессов. Обычно каждый из них рассматривается в той из областей науки и техники, где он используется. Выделяют наиболее распространенные методы активации: магнитная, механическая, ультразвуковая, термическая, активация наносекундными электромагнитными импульсами и электрохимическая.
Магнитная обработка воды заключается в пропускании потока воды через магнитное поле. В общем случае действие магнитного поля на движущуюся воду сводится к действию сил Лоренца на заряженные частицы. Отмечается, что действие магнитных полей с напряженностью 105 — 106 А/м дает энергетическое воздействие порядка 5•10-8 – 5•10-9 Дж [5].
Существующие установки для омагничивания воды обычно включают и различные способы механического воздействия на воду: перемешивание, распыление, многократное прохождение через магнитное поле, смену направления действия поля и т.д. Очевидно, что в этих установках происходит и механическое воздействие на воду. Поэтому более точное название метода должно быть магнитно-механический способ активации.
Процесс омагничивания воды не имеет признанной теории и результаты обработки не всегда повторяются. Возникшие новые свойства воды часто не имеют объяснения.
Значительное количество исследований посвящено изучению влияния магнитных полей на изменение свойств воды. Рассмотрим некоторые из них.
В работе [6] отмечается зависимость режима магнитной обработки воды от её химического состава, скорости движения на участке омагничивания и конструктивных особенностей омагничивающих аппаратов.
В. И. Миненко, С. М. Петров, М. Н. Минц [9, 10] считают, что магнитная обработка воды приводит к изменению её структуры, поверхностного натяжения, вязкости, электросопротивления, магнитной восприимчивости, диэлектрической проницаемости и других физических свойств.
Под действием магнитного поля изменяются свойства чистой воды и водных растворов, но наибольшее влияние магнитное поле оказывает на ионы, магнитная восприимчивость которых значительно повышает восприимчивость молекул воды. На изменение свойств воды под влиянием магнитных полей указывается в работах [9, 10].
Многие исследователи [7, 8] считают, что магнитное поле оказывает влияние на структуру воды. Некоторые из них предполагают, что эти процессы происходят в результате изменений водородных связей между молекулами воды.
В работах Н. Н. Непримерова, У. Ш. Ахмерова [14] развивается идея о влиянии магнитного поля на воду через изменение её «ядерной структуры». Предполагается, что магнитная обработка воды изменяет ориентацию ядерных спинов водорода в молекулах воды, которая может быть параллельной (ортомодификация) и антипараллельной (парамодификация). Энергия перехода одной модификации воды в другую в сотни раз меньше, чем энергия, необходимая для разрыва связей. Авторы считают энергетически не обоснованными объяснения свойств омагниченной воды изменениями в системе водородных связей или переориентацией молекул, так как для осуществления этих процессов необходима энергия в несколько тысяч калорий на моль.
Опубликованные данные настолько противоречивы, что их зачастую трудно систематизировать.
В настоящее время выделяют четыре группы гипотез процесса омагничивания воды [5]: влияние на карбонатный состав воды, влияние на общий солевой состав, влияние на структуру воды, влияние на состояние водной системы в целом.
Ни одна из рассматриваемых гипотез не имеет строгого теоретического обоснования и не дает оценок изменения свойств омагниченной воды, которые получены в экспериментах. Также недостатком способа омагничивания воды является отсутствие разделения свойств получаемой воды и разнородность получаемых результатов.
Механическая активация может быть двух видов: статическая и динамическая. Статическая активация связана с повышением давления. Ее вероятные последствия — уменьшение межмолекулярных пустот, увеличение времени жизни кластеров и их количества. Динамическая активация (перемешивание), наоборот, приводит к быстрому разрушению кластеров и уменьшению их количества. Динамическая активация имеет наибольшее распространение в природе при падении дождевых капель [12]. Механическая активация не получила широкого применения и в литературных источниках имеется немногочисленный экспериментальный материал для данного способа активации.
Обработка воды ультразвуковыми колебаниями также может быть отнесена к механической динамической активации. Когда происходит импульсное или периодическое механическое воздействие на воду, в результате чего в ней возникают ультразвуковые колебания. В литературе описываются различные эффекты, которые происходят в воде при обработке ее ультразвуком. Но недостатком данного способа активации является недолговечность используемых установок.
Термическая активация приводит к увеличению скорости движения молекул, более быстрому разрушению кластеров. Если в воде имеются примеси других веществ, то они более быстро реагируют между собой и образующимися в воде частицами.
Вопросами термической активации воды посвящено достаточно большое количество работ, но ни одна из рассматриваемых гипотез не имеет строгого теоретического обоснования и не дает оценок изменения свойств полученной воды.
Использование наносекундных электромагнитных импульсов для активации воды является новым способом, что свидетельствует о недостаточной изученности происходящих процессов. Предложение об использовании несинусоидальных электромагнитных импульсов для активации водных растворов впервые было сделано в работе [13].
Характерной особенностью несинусоидального электромагнитного поля является использование однополярных импульсов тока. Это приводит к отсутствию осциллирующих колебаний в излучаемом поле. Следствием этого является наличие характерного пространственно-временного направления действия силы за время одного импульса.
Сравнение экспериментальных результатов приведенных в литературе показывает, что при облучении воды наносекундными электромагнитными импульсами изменяются ее физические и химические характеристики. Характер изменений — уменьшение удельного электрического сопротивления и увеличение диэлектрической постоянной — совпадают с их изменениями при радиолизе воды. Это позволяет сделать заключение о возникновении гидратированных электронов при облучении воды электромагнитными импульсами [13]. Недостатком данного метода является высокая стоимость оборудования, применяемого для обработки воды.
В процессе электрохимической активации за счет униполярного электрохимического воздействия происходит направленное безреагентное изменение рН, окислительно-восстановительного потенциала и других физико-химических параметров растворов или воды в диапазонах часто более широких, чем это достижимо при химическом регулировании. Изученные литературные данные свидетельствуют о воспроизводимости полученных результатов. В настоящее время авторами [1, 2] приводится ряд установок для получения анолита и католита, широко описаны свойства получаемой воды, но основные параметры обработки воды остаются неизвестными.
Преимуществом данного метода является невысокая величина затрат на изготовление установки для обработки воды, незначительные энергозатраты, а также наличие строгого теоретического обоснования и оценок свойств электрохимически активированной воды и повторяемость получаемых результатов. Нельзя не указать положительную сторону метода разделение анолита и католита при активации воды, а, следовательно, и их свойств.
Остальные способы активации (магнитная, механическая, термическая, наносекундные электромагнитные импульсы) не имеют четкой теоретической базы и не нашли широкого применения.
Вопрос о природе метастабильного состояния воды и разбавленных водных растворов после электрохимического воздействия является одним из центральных для исследования механизма процессов активации и до настоящего времени не решен окончательно, что отнюдь не мешает широкому практическому использованию электрохимически активированных жидкостей для производства пищевых продуктов.
Литература
1. Бахир В. М. Современные технические электрохимические системы для обеззараживания, очистки и активирования воды. – М.: ВНИИИМТ, 1999. – 84 с.
2. Прилуцкий В. И., Бахир В. М. Электрохимически активированная вода: аномальные свойства, механизм биологического действия: — М.: ВНИИИМТ АО НПО «Экран», 1997. – 228 с.
3. Возная Н. Ф. Химия воды и микробиология: Учеб. пособие для вузов. — М.: Высш. Школа, 1979. –340 с.
4. Синюков В. В. Вода известная и неизвестная. — М.: Знание, 1987. – 176 с.
5. Миненко В. И. Электромагнитная обработка воды в теплоэнергетике. – Харьков: ХГУ, 1981. – 96 с.
6. Голгер Ю. Я., Классен В. И. К термодинамической теории влияния структурных изменений жидкости на смачивание и флотационное прилипание. // Тезисы докладов ко второму Всесоюзному семинару «Вопросы теории и практики магнитной обработки воды», М.,1969.
7. Иванова Г. М., Махнев Ю. М. Изменение структуры воды и водных растворов под действием магнитного поля. // Тезисы докладов ко второму Всесоюзному семинару «Вопросы теории и практики магнитной обработки воды», М.,1969.
8. Кисловский Л. В. Метастабильные структуры в водных растворах. // Тезисы докладов ко второму Всесоюзному семинару «Вопросы теории и практики магнитной обработки воды», М.,1969.
9. Миненко В. И., Петров С. М., Минц М. Н. Магнитная обработка воды. Харьков, Харьковское кн. Издательство, 1962. – 125 с.
10. Миненко В. И., Петров С. М. О физико-механических основах магнитной обработки воды. «Теплотехника», 1962, №9.
11. Жук Н. П. Курс теории коррозии и защиты металлов. М.: Металлургия, 1976. — 472 с.
12. Зацепина Г. Н. Физические свойства и структура воды. – 2-е изд., перераб. – М.: Изд-во МГУ, 1987. – 171с.
13. Разработка теории и исследование возможностей создания технических устройств для излучения электромагнитных волн на основе сред с заряженными кластерами. Отчет по НИР № гос.рег. 01.960.009493, Челябинск, ЧГТУ.
14. Непримеров Н. Н., Ахмеров У. Ш., Бильдюкевич А. Л. К вопросу о механизме действия магнитных полей на водную систему. // Тезисы докладов и сообщений Всесоюзного научного семинара по проблеме «Магнитная обработка воды в процессах обогащения полезных ископаемых», М., 1966.
Структура воды и наука
Эта страница служит входом на сайт, посвященный физическим, химическим и биологическим свойствам воды.
Содержание | Карта сайта
Жидкая вода не играет роли в театре жизни — это заголовок закона
Многие считают воду (H 2 O) довольно неинтересным веществом, потому что она прозрачна, без запаха, вкуса и повсеместна.Это простейшее соединение из двух наиболее распространенных реактивных элементов во Вселенной, состоящее всего из двух атомов водорода, прикрепленных к одному атому кислорода. Действительно, очень немногие молекулы меньше или легче. Жидкая вода, однако, представляет собой наиболее необычный материал, противоречащий ее очевидной простой молекулярной составляющей. ⇒
.Хотя мы пьем его, моемся, ловим рыбу, плаваем в нем и готовим с ним (хотя, вероятно, не все одновременно), мы почти всегда упускаем из виду особые отношения, которые он имеет с нашей жизнью.Засуха вызывает голод, а наводнения — смерть и болезни. Он составляет более половины нас, и без него мы умираем в течение нескольких дней. Жидкая вода играет важную роль в качестве растворителя, растворенного вещества, реагента, катализатора и биомолекулы, структурируя белки, нуклеиновые кислоты и клетки и контролируя наше сознание. H 2 O — вторая по распространенности молекула во Вселенной (после водорода, H 2 ), самый распространенный твердый материал и фундаментальный для звездообразования. В нашем теле в сто раз больше молекул воды, чем сумма всех других молекул вместе взятых, с миллиардами молекул воды на молекулу ДНК.Жизнь не может развиваться или продолжаться без жидкой воды, поэтому так много волнения по поводу ее обнаружения на Марсе, других планетах и лунах. Неудивительно, что вода играет центральную роль во многих мировых религиях. На этом веб-сайте обсуждаются многие аспекты науки о воде. ⇒
.Вода — наиболее изученный материал на Земле, но примечательно то, что наука, лежащая в основе ее поведения и функций, так плохо понимается (или даже игнорируется) не только людьми в целом, но и учеными, работающими с ней каждый день.Он может быть одновременно чрезвычайно скользким и чрезвычайно липким, и это поведение «прилипание / скольжение» — это то, как мы узнаем ощущение воды. Небольшой размер его молекулы опровергает сложность его действий и его уникальные возможности. Многие попытки смоделировать воду как простое вещество потерпели неудачу и до сих пор терпят неудачу. Уникальные свойства жидкой воды и хамелеонная природа, кажется, идеально соответствуют требованиям для жизни, как никакая другая молекула. ⇒
.Было опубликовано много объяснений сложного поведения жидкой воды, некоторые из которых вызвали серьезные споры.На этом веб-сайте я попытался представить и объяснить эти идеи последовательным и сбалансированным образом, который, я надеюсь, будет способствовать как его пониманию, так и дальнейшей работе. ⇒
.Карта водного участка
Примечания.
Текст, разметка HTML и изображения на этом сайте защищены авторским правом. Обслуживание этого сайта не связано с коммерческими организации или их продукты.Пожалуйста, не копируйте с этого сайта или с некоторых пиратских копий этого сайта без надлежащего подтверждения на этом сайте. Пиратские копии обычно можно определить по их устаревшим штампам.
Этот сайт представляет взгляды автора, в основном без предварительная рецензия, но подтвержденная рецензируемыми статьями. Он пытается дать беспристрастную, нейтральную точку зрения. Комментарии и критика приветствуется как по электронной почте, так и через Посетителей книга.Я всегда гарантировал, что опубликую все материалы через Книгу Посетителя, лишь слегка отредактировав их написание грамматики и удаления ненужной рекламы, спама или оскорбительных материал.
Расчеты с использованием ограниченной волны Хартри-Фока функции (RHF) с использованием базового набора 6-31G ** используют пакет Hyperchem Professional 8.0. Чтобы увидеть все анимации, вам необходимо включить Java. Jmol — это программа для просмотра химических структур в 3D с открытым исходным кодом.На некоторых интерактивных страницах используются химические объекты. для файлов Web (* .cow) или Jmol (* .pdb). (* .Cow) HyperChem Веб-просмотрщик (2 МБ) доступен бесплатно с Hypercube, Inc. Кажется, что Internet Explorer 11 может быть самой простой программой для настройки javascript в Windows 10 ..
Если вы хотите ознакомиться с предыдущими версиями этого веб-сайта, в Интернет-архиве Wayback (по состоянию на 10 марта 2019 г.) имеется 743 копии, заархивированные с 1 октября 2000 г. по 24 февраля 2019 г. (Https: // веб.archive.org/web/*/www.sbu.ac.uk/water/ и https://web.archive.org/web/*/www.lsbu.ac.uk/water/).
По состоянию на 26 сентября 2018 г. на этом веб-сайте Water Structure and Science было 294 веб-страницы, 4421 ссылка, 28 549 ссылок, 308 800 слов, 1435 изображений и 121 файл трехмерной визуализации и анимации. Средняя читаемость была оценена как аналогичная New York Times. Данные на этом веб-сайте выдержали испытание временем, фрагменты которых были скопированы в Wikipedia и Chemical Reviews.На этот веб-сайт из Google Scholar имеется более 2600 научных ссылок.
,молекула | Определение, примеры, структуры и факты
Молекула , группа из двух или более атомов, которые образуют наименьшую идентифицируемую единицу, на которую может быть разделено чистое вещество, и при этом сохраняют состав и химические свойства этого вещества.
Несколько методов представления структуры молекулы. В структурах Льюиса символы элементов представляют атомы, а точки — окружающие их электроны. Пара общих электронов (ковалентная связь) также может быть показана одной чертой.Модель шарика и ручки лучше иллюстрирует пространственное расположение атомов. Для ароматических соединений обычна структура Кекуле, в которой каждая связь представлена тире, атомы углерода подразумеваются там, где встречаются две или более линий, а атомы водорода обычно опускаются. Формулы Bond-line, подобные структуре Кекуле, часто используются для сложных неароматических органических соединений. Сахара часто изображают в виде проекций Фишера, в которых углеродный «остов» изображен в виде прямой вертикальной линии с атомами углерода, подразумеваемыми там, где горизонтальные линии пересекаются с вертикальной. © Merriam-Webster Inc.Британская викторина
Подводки к химии
Что из этого не сделано из соединений калия?
Разделение образца вещества на все более мелкие части не приводит к изменению ни его состава, ни его химических свойств до тех пор, пока не будут получены части, состоящие из отдельных молекул.Дальнейшее деление вещества приводит к еще более мелким частям, которые обычно отличаются от исходного вещества по составу и всегда отличаются от него по химическим свойствам. На этой последней стадии фрагментации химические связи, удерживающие атомы вместе в молекуле, разрываются.
молекула кофеина молекула кофеина. Encyclopædia Britannica, Inc.Атомы состоят из одного ядра с положительным зарядом, окруженного облаком отрицательно заряженных электронов.Когда атомы близко подходят друг к другу, электронные облака взаимодействуют друг с другом и с ядрами. Если это взаимодействие таково, что полная энергия системы снижается, тогда атомы связываются вместе, образуя молекулу. Таким образом, со структурной точки зрения молекула состоит из совокупности атомов, удерживаемых вместе валентными силами. Двухатомные молекулы содержат два атома, которые химически связаны. Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они образуют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (CO), они составляют гетероядерная двухатомная молекула.Молекулы, содержащие более двух атомов, называются многоатомными молекулами, например диоксид углерода (CO 2 ) и вода (H 2 O). Молекулы полимера могут содержать многие тысячи составляющих атомов.
молекула воды Молекула воды состоит из двух атомов водорода и одного атома кислорода. Один атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется. Encyclopædia Britannica, Inc.Отношение количества атомов, которые могут быть связаны вместе с образованием молекул, является фиксированным; например, каждая молекула воды содержит два атома водорода и один атом кислорода. Именно эта особенность отличает химические соединения от растворов и других механических смесей. Таким образом, водород и кислород могут присутствовать в любых произвольных пропорциях в механических смесях, но при искрообразовании будут объединяться только в определенных пропорциях с образованием химического соединения воды (H 2 O).Одни и те же виды атомов могут объединяться в разных, но определенных пропорциях, чтобы образовать разные молекулы; например, два атома водорода будут химически связываться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически связываться с двумя атомами кислорода с образованием молекулы пероксида водорода (H 2 O 2 ). Кроме того, атомы могут связываться вместе в одинаковых пропорциях с образованием разных молекул. Такие молекулы называются изомерами и различаются только расположением атомов внутри молекул.Например, этиловый спирт (CH 3 CH 2 OH) и метиловый эфир (CH 3 OCH 3 ) оба содержат один, два и шесть атомов кислорода, углерода и водорода соответственно, но эти атомы связаны по-разному.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняНе все вещества состоят из отдельных молекулярных единиц. Хлорид натрия (обычная поваренная соль), например, состоит из ионов натрия и ионов хлора, расположенных в решетке так, что каждый ион натрия окружен шестью равноудаленными ионами хлора, а каждый ион хлора окружен шестью равноудаленными ионами натрия.Силы, действующие между любым натрием и любым соседним ионом хлора, равны. Следовательно, не существует отчетливого агрегата, идентифицируемого как молекула хлорида натрия. Следовательно, в хлориде натрия и во всех твердых телах подобного типа понятие химической молекулы не имеет значения. Следовательно, формула такого соединения задается как простейшее соотношение атомов, называемое формульной единицей — в случае хлорида натрия — NaCl.
Молекулы удерживаются вместе с помощью общих электронных пар или ковалентных связей.Такие связи являются направленными, что означает, что атомы занимают определенные положения относительно друг друга, чтобы максимизировать прочность связи. В результате каждая молекула имеет определенную, довольно жесткую структуру или пространственное распределение своих атомов. Структурная химия связана с валентностью, которая определяет, как атомы соединяются в определенных соотношениях и как это связано с направлениями и длинами связей. Свойства молекул коррелируют с их структурой; например, молекула воды структурно изогнута и поэтому имеет дипольный момент, тогда как молекула диоксида углерода является линейной и не имеет дипольного момента.Выяснение способа реорганизации атомов в ходе химических реакций очень важно. В некоторых молекулах структура не может быть жесткой; например, в этане (H 3 CCH 3 ) существует практически свободное вращение вокруг одинарной связи углерод-углерод.
Положение ядер в молекуле определяется либо из микроволновых колебательно-вращательных спектров, либо с помощью дифракции нейтронов. Электронное облако, окружающее ядра в молекуле, может быть изучено с помощью экспериментов по дифракции рентгеновских лучей.Дополнительную информацию можно получить с помощью методов электронного спинового резонанса или ядерного магнитного резонанса. Достижения электронной микроскопии позволили получать визуальные изображения отдельных молекул и атомов. Теоретически молекулярная структура определяется путем решения квантовомеханического уравнения движения электронов в поле ядер (называемого уравнением Шредингера). В молекулярной структуре длины связей и валентные углы — это те, для которых молекулярная энергия наименьшая.Определение структур путем численного решения уравнения Шредингера стало высокоразвитым процессом, предполагающим использование компьютеров и суперкомпьютеров.
Молекулярная масса молекулы — это сумма атомных масс составляющих ее атомов. Если вещество имеет молекулярную массу M , то M граммов вещества называется одним моль. Количество молекул в одном моль одинаково для всех веществ; это число известно как число Авогадро (6.022140857 × 10 23 ). Молекулярные массы можно определить масс-спектрометрией и методами, основанными на термодинамике или явлениях кинетического переноса.
физических свойств молекулярных веществ
Величина точки плавления или кипения будет зависеть от силы межмолекулярных сил. Присутствие водородных связей поднимет точки плавления и кипения. Чем больше молекула, тем больше возможно притяжений Ван-дер-Ваальса — и им также потребуется больше энергии для разрушения.
Растворимость в воде
Большинство молекулярных веществ нерастворимы (или растворимы лишь в очень низкой степени) в воде.Те, которые действительно растворяются, часто вступают в реакцию с водой или способны образовывать водородные связи с водой.
Почему метан, CH 4 , не растворяется в воде?
Проблема не в метане. Метан — это газ, поэтому его молекулы уже разделены — воде не нужно отделять их друг от друга.
Проблема в водородных связях между молекулами воды. Если бы метан растворился, ему пришлось бы пробиться между молекулами воды и таким образом разорвать водородные связи.Это стоит разумного количества энергии.
Единственное возможное притяжение между молекулами метана и воды — это гораздо более слабые силы Ван-дер-Ваальса — и при их создании выделяется не так много энергии. Смешивать метан и воду просто энергетически невыгодно.
Почему аммиак NH 3 растворяется в воде?
Аммиак обладает способностью образовывать водородные связи. Когда водородные связи между молекулами воды разрываются, они могут быть заменены эквивалентными связями между молекулами воды и аммиака.
Часть аммиака также вступает в реакцию с водой с образованием ионов аммония и гидроксид-ионов.
Обратимые стрелки показывают, что реакция не доходит до завершения. В любой момент времени только около 1% аммиака фактически прореагировало с образованием ионов аммония. Растворимость аммиака в основном обусловлена водородными связями, а не реакцией.
Другие распространенные вещества, которые легко растворяются в воде, поскольку они могут связывать водородные связи с молекулами воды, включают этанол (спирт) и сахарозу (сахар).
Растворимость в органических растворителях
Молекулярные вещества часто растворяются в органических растворителях, которые сами по себе являются молекулярными. Как растворенное вещество (вещество, которое растворяется), так и растворитель, вероятно, имеют молекулы, притягиваемые друг к другу силами Ван-дер-Ваальса. Хотя эти притяжения будут нарушены при смешивании, они заменяются аналогичными между двумя разными типами молекул.
Электропроводность
Молекулярные вещества не проводят электричество.Даже в тех случаях, когда электроны могут быть делокализованы внутри конкретной молекулы, между молекулами недостаточно контакта, чтобы позволить электронам перемещаться через твердое тело или жидкость в целом.
Йод, I 2
Йод — темно-серое кристаллическое вещество с пурпурным паром. Температура плавления: 114 ° C. Температура кипения: 184 ° C. Он очень и очень мало растворим в воде, но легко растворяется в органических растворителях.
Таким образом, йод представляет собой твердое вещество с низкой температурой плавления.Кристалличность предполагает регулярную упаковку молекул.
Структура описывается как кубическая гранецентрированная — это куб из молекул йода с другой молекулой в центре каждой грани.
Ориентацию молекул йода в этой структуре довольно сложно изобразить (не говоря уже о том, чтобы помнить!). Если ваш учебный план и прошлые экзаменационные работы предполагают, что вам необходимо его запомнить, внимательно посмотрите на следующую последовательность диаграмм, показывающих слои.
,
