Схемы образования веществ с различным типом связи. Видеоурок. Химия 9 Класс
Данный урок посвящен обобщению и систематизации знаний о видах химической связи. В процессе урока будут рассмотрены схемы образования химической связи в различных веществах. Урок поможет закрепить умение определять вид химической связи в веществе по его химической формуле.
Тема: Химическая связь. Электролитическая диссоциация
Урок: Схемы образования веществ с различным типом связи
Ионная связь образуется между ионами, а ковалентная связь возникает при перекрывании электронных орбиталей, при котором пара электронов становится общей для обоих атомов. Рассмотрим на конкретных примерах условия и схемы образования каждого вида химической связи: ионная связь, ковалентная полярная и ковалентная неполярная связь.
Сравнение сведений о различных типах химической связи.
Определим вид химической связи в следующих веществах: фтор F2, вода Н2О и хлорид калия KCl
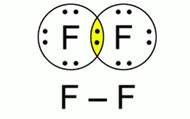
Рис. 1. Схема образования связи в молекуле фтора
Молекула фтора состоит из двух атомов одного химического элемента-неметалла с одинаковой электроотрицательностью, следовательно, в этом веществе реализуется ковалентная неполярная связь. Изобразим схему образования связи в молекуле фтора. Рис. 1.
Вокруг каждого атома фтора с помощью точек нарисуем семь валентных, то есть внешних, электронов. До устойчивого состояния каждому атому необходим еще один электрон. Таким образом, образуется одна общая электронная пара. Заменив ее черточкой, изобразим графическую формулу молекула фтора F-F.
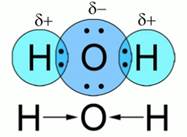
Рис. 2. Схема образования связи в молекуле воды
Молекула воды состоит из атомов водорода и кислорода – двух элементов-неметаллов с разными значениями относительной электроотрицательности, следовательно, в этом веществе – ковалентная полярная связь.
Так как кислород – более электроотрицательный элемент, чем водород, общие электронные пары смещаются в сторону кислорода. На атомах водорода возникает частичный заряд, а на атоме кислорода – частичный отрицательный. Заменив обе общие электронные пары черточками, а точнее стрелками, показывающими смещение электронной плотности, запишем графическую формулу воды Рис. 2.
Вывод: ковалентная полярная связь возникает между атомами разных элементов-неметаллов, то есть с разными значениями относительной электроотрицательности. При этом типе связи образуются общие электронные пары, которые смещаются
Водородная связь
Рассмотрим возникновение водородной связи в молекуле фтороводорода. В ней электронная пара смещена к атому фтора, т.е. атом водорода поляризован положительно, а фтор – отрицательно. Благодаря тому, что фтор сильно электроотрицателен, электронная пара практически полностью смещена к нему и ион водорода приобретает пустую, вакантную орбиталь, которая с неподеленной парой фтора образует донорно-акцепторную связь. Водородную связь принято обозначать точками. Обращаю внимание, что водородная связь это связь между молекулами, а не атомами в молекуле.
Благодаря
водородным связям фтороводородная
кислота, в отличие от соляной, является
слабой кислотой и образует соли типа
KHF
Водородная связь в молекуле воды
Пример. Серная кислота и фтороводород растворяется в воде неограниченно, а хлороводород обладает ограниченной растворимостью, что не позволяет получать соляную кислоту с концентрацией выше 37%. Объяснить это различие.
Решение. Серная кислота содержит связь О–Н, фтороводород Н–F , которые способны образовывать водородные связи с водой, которая тоже имеет связь О–Н, и растворение происходит практически неограниченно.
Виды химической связи
К основным характеристикам химической связи, дающим информацию о структуре молекулы и ее прочности, относятся валентный угол, длина, полярность и энергия связи.
Длиной связи называют расстояние между центрами атомов, образующих данную связь (межъядерное расстояние). Ее определяют экспериментально при помощи различных физико-химических методов. Длина связи обусловлена размером реагирующих атомов и степенью перекрывания их электронных облаков, которая зависит от типа химической связи. Надо обратить внимание, что длина связи всегда меньше суммы радиусов элементов, т.к. происходит
Длина связи от этана к ацетилену уменьшается, т.к. увеличивается кратность (порядок) связи от одинарной к тройной. Чем больше кратность связи, тем меньше длина связи.
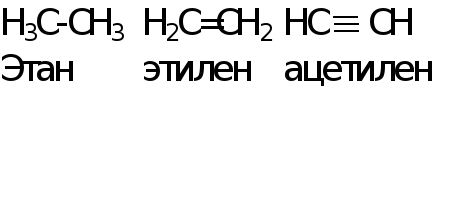
В
ряду галогеноводородов длина связи
Н‑Г имеет следующие значения (в пм,
1 пм = 10
Соединение | H-F | H-Cl | H-Br | H-I |
Длина связи | 100 | 127 | 141 | 162 |

Другой характеристикой химической связи, отражающей геометрическое строение, является валентный угол.
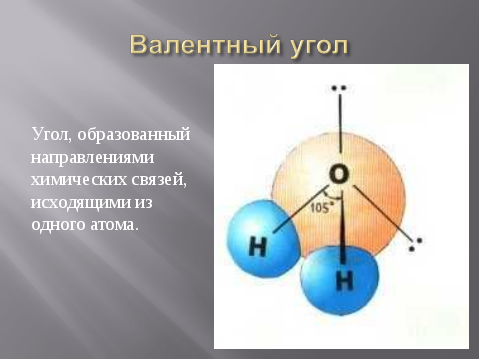
Он зависит от природы атомов и характера химической связи.
Количество энергии, выделяющейся при образовании химической связи, называется энергией связи. Эта величина является характеристикой прочности связи. Ее выражают в кДж/моль образующегося вещества.
Полярные
молекулы являются диполями,
т.е. системами, состоящими из двух равных
по величине, но противоположных по
знаку зарядов (q+
и q‑),
находящихся на расстоянии l
(длина диполя) друг от друга. Полярность
молекулы оценивается значением
электрического момента диполя =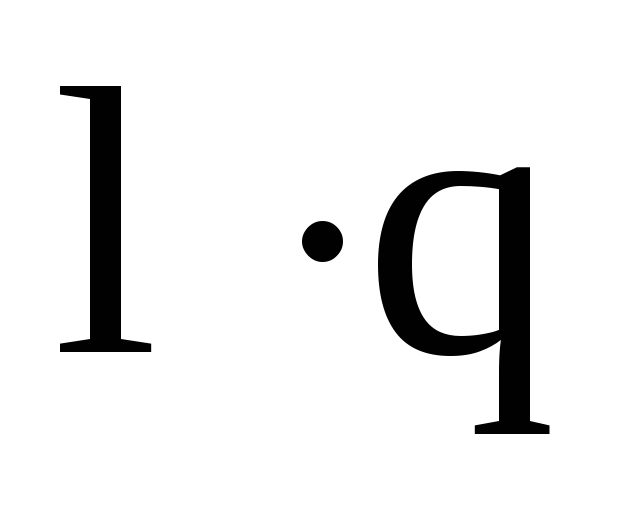
Типы связей воды — Справочник химика 21
Соединения со степенью окисления фосфора —3. При нагревании фосфор окисляет почти все металлы, образуя фосфиды. В зависимости от природы металла доля того или иного типа связи в фосфидах меняется в широких пределах. Так, фосфиды s-элементов И группы состава Э3Р2 можно рассматривать как ионно-ковалентные соединения. Они солеподобны, легко разлагаются водой [c.367]ТИПЫ СВЯЗИ ВОДЫ [c.649]
Объясните процесс электролитической диссоциации в воде веществ с ионным типом связи. Приведите примеры.
В следующем параграфе рассматриваются различные типы связей воды с растворенными веществами. [c.15]
Элементарной структурной ячейкой силикатов является кремнекислородный тетраэдр такие тетраэдры могут образовывать циклические, цепные, листовые и трехмерные каркасные структуры. Часть атомов кремния способна замещаться алюминием, но при этом компенсация заряда требует введения дополнительных катионов, что приводит к усилению электростатического вклада в химическую связь кристалла. На примере силикатов иллюстрируются четыре из пяти типов связи, обсуждавшихся в данной главе ковалентная связь между атомами кремния и кислородом в тетраэдрах, вандерваальсовы силы между силикатными листами в тальке, ионное притяжение между заряженными листами и цепочками, а также водородные связи между молекулами воды и силикатными атомами кислорода в глинах. Если включить в этот перечень еще никелевые катализаторы на глиняном носителе, то мы охватим и пятый тип химической связи (металлический). [c.640]
Вода является составной частью бетона. Но форме связи ее с твердым скелетом различают химическую, физико-химическую и физико-механическую связанную воду. Наиболее прочной формой связи является химическая вода. Ее удаление из бетона возможно лишь при температуре выше 100 °С, т.е. при дегидратации цементного камня. Физико-химической связью обладает адсорбционная влага в порах и капиллярах, радиус которых менее 10 см. Вода в адсорбционных слоях отличается от свободной воды по химическим и термодинамическим свойствам. Диэлектрическая постоянная адсорбционной влаги в 40 раз меньше, чем у свободной воды, а температура замерзания на несколько десятков градусов ниже. Физикомеханический тип связи воды в бетоне является наименее прочным. Она может быть полностью удалена из бетона при его высыхании. [c.237]
Теряя электроны, атомы превращаются в положительные ионы с зарядностью 1+ и 2+. Они относятся к типу благородногазовых ионов, бесцветны, обладают большим радиусом и малыми поляризующими свойствами. Большинство соединений их бесцветны, обладают высокой термической устойчивостью, хорошей растворимостью в воде. Ряд соединений лития и бериллия (несколько менее натрий и магний) отличаются от остальных своих аналогов по подгруппам. Это связано с небольшими величинами радиусов их ионов и особенностями структуры электронной оболочки последних, во внешнем слое которой содержится по 2 электрона, тогда как все другие ионы имеют по 8 электронов. Соединения лития во многом сходны с соединениями магния, а соединения бериллия — с соединениями алюминия (аналогия по диагонали). Ионы лития и бериллия образуют комплексные соединения, что для ионов щелочных и щелочноземельных металлов, как правило, нехарактерно. Большинство соединений имеют гетерополярный тип связи и могут быть отнесены к ионному типу молекул. В растворе все соединения ведут себя как сильные электролиты. [c.270]
В настоящее время известно, что ионообменивающими веществами могут быть как кристаллические минералы, так и вещества коллоидного характера. В то время минералоги особенно интересовались цеолитами, их крупнопористой структурой и способностью образовывать смешанные кристаллы, вопросами физико-химического равновесия и различными типами связи воды в цеолитах, специалисты же в области коллоидной химии нашли [c.7]
Интенсивная капиллярная конденсация, так же как и развитие коррозионных процессов, наблюдается при влажности воздуха более 70—75%. Поэтому эти значения влажности иногда считают критическими [76, 100]. Для бетона, являющегося капиллярно пористым материалом, взаимодействие с влагой воздуха несколько отличается. Вода является составной частью бетона. По формам связи с твердым телом различают химическую, физико-химическую и физико-механическую воду [71]. Наиболее прочной формой связи является химическая. Ее удаление из бетона возможно лишь при температуре выше 100°С, т. е. при дегидратации цементного камня. Физико-химической связью обладает адсорбционная влага в порах и капиллярах, радиус которых менее 10 см. Считается, что при влажности воздуха до 45% влага связана химически и физико-химически [6, 99]. Физико-механический тип связи воды в бетоне является наименее прочным. Влага полностью обладает свойствами свободной воды. Она образуется в результате капиллярной конденсации в порах и при увлажнении бетона осадками [c.13]
Зависимость давления пара влаги над поверхностью материала от его влажности определяется типом связи молекул воды с материалом. Различают несколько форм связи влаги с материалом (в порядке убывающей энергии связи). [c.405]
Растворимость веществ существенно зависит от природы растворяемого вещества и растворителя, температуры и давления. Причины различной растворимости веществ пока не выяснены, хотя их связывают с характером взаимодействия молекул растворителя и растворенного вещества. Например, известно, что молекулярные кристаллы, структурными единицами которых являются молекулы с ковалентным неполярным типом связи (сера и др.), практически нерастворимы в воде, так как энергия разрушения кристаллической решетки настолько велика, что не может быть компенсирована теплотой сольватации, которая очень мала. [c.63]
Из механизма диссоциации ясно также, что диссоциировать будут вещества, обладающие ионной или полярной связью, поэтому степень диссоциации зависит от природы растворенного вещества, вернее, от типа связи в его молекулах. Следовательно, из приведенных примеров растворов Na l (ионная связь), НС1 (полярная связь) и I2 (ковалентная связь) диссоциировать будут Na l и ИС1, а хлор в растворе будет находиться в виде молекул хлора. Если же в растворе оказываются сложные молекулы с различным типом химической связи, то распад на ионы произойдет в том месте молекулы, где существуют ионная и полярная связь. Так, молекула азотной кис
Ионная связь — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 октября 2016; проверки требуют 26 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 октября 2016; проверки требуют 26 правок.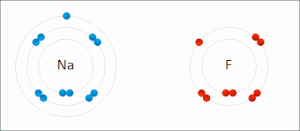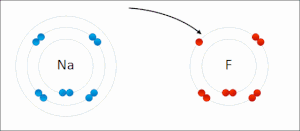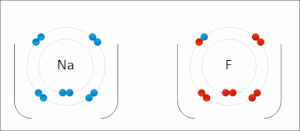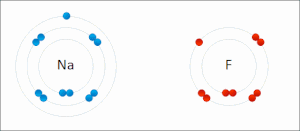 Атомы натрия и фтора подвергающиеся окислительно-восстановительной реакции с образованием фторида натрия. Натрий теряет свой внешний электрон, приобретая стабильную электронную конфигурацию, и этот электрон переходит в атом фтора. Противоположно заряженные ионы притягиваются друг к другу с образованием стабильного соединения.
Атомы натрия и фтора подвергающиеся окислительно-восстановительной реакции с образованием фторида натрия. Натрий теряет свой внешний электрон, приобретая стабильную электронную конфигурацию, и этот электрон переходит в атом фтора. Противоположно заряженные ионы притягиваются друг к другу с образованием стабильного соединения.Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов. Возникает между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Это притяжение ионов как разноимённо заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу, образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1,7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
- A⋅+⋅B→A+[:B−]{\displaystyle {\mathsf {A}}\cdot +\cdot {\mathsf {B}}\to {\mathsf {A}}^{+}[:{\mathsf {B}}^{-}]}
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы, окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии. Взаимодействие ионов
Если атом теряет один или несколько электронов, то он превращается в положительный ион — катион (в переводе с греческого — «идущий вниз). Так образуются катионы водорода Н+, лития Li+, бария Ва2+. Приобретая электроны, атомы превращаются в отрицательные ионы — анионы (от греческого «анион» — идущий вверх). Примерами анионов являются фторид ион F−, сульфид-ион S2−.
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью:
Ионная связь — это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
Рассмотрим способ образования на примере «хлорида натрия» NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: Na111s22s22p63s1{\displaystyle {\mathsf {Na^{11}1s^{2}2s^{2}2p^{6}3s^{1}}}} и Cl171s22s22p63s23p5{\displaystyle {\mathsf {Cl^{17}1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}}}}. Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его.
Схематично это можно записать так:
- Na−e→Na+{\displaystyle {\mathsf {Na-e\rightarrow Na^{+}}}} — ион натрия, устойчивая восьмиэлектронная оболочка (Na+1s22s22p6{\displaystyle {\mathsf {Na^{+}1s^{2}2s^{2}2p^{6}}}}) за счет второго энергетического уровня.
- Cl+e→Cl−{\displaystyle {\mathsf {Cl+e\rightarrow Cl^{-}}}} — ион хлора, устойчивая восьмиэлектронная оболочка.
Между ионами Na+{\displaystyle {\mathsf {Na^{+}}}} и Cl−{\displaystyle {\mathsf {Cl^{-}}}} возникают силы электростатического притяжения, в результате чего образуется соединение.
Физические свойства веществ с различным типом связи. Видеоурок. Химия 9 Класс
Данный урок посвящен изучению зависимости физических свойств веществ от их внутреннего строения. В ходе урока будут рассмотрены особенности физических свойств веществ в зависимости от типа химической связи в них.
Тема: Химическая связь. Электролитическая диссоциация
Урок: Физические свойства веществ с различным типом связи
Вещества с таким типом связи относятся к неметаллам. Они могут быть при н.у. газообразными (кислород, водород, хлор), жидкими (бром), твердыми (сера, фосфор, графит).
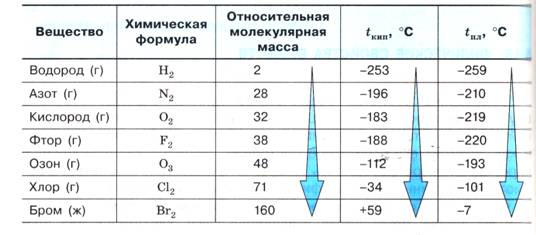
Интересная закономерность наблюдается с температурами кипения и плавления газообразных и жидких неметаллов (см. Таблицу 1): с увеличением относительной молекулярной массы , как правило, увеличиваются температуры кипения и плавления веществ с ковалентной неполярной связью.
Таблица 1. Температуры кипения и плавления некоторых газообразных и жидких простых веществ и их Мr
С твердыми неметаллами все не так просто (см. Таблицу 2). Среди них встречаются как легкоплавкие (сера, селен, фосфор), так и тугоплавкие вещества (графит, алмаз, кремний, бор). Температуры плавления этих веществ не зависят от их относительной атомной массы: относительная атомная масса йода 127, а бора всего 11, но температура плавления бора значительно выше. Рассмотрим причины такой разницы в физических свойствах твердых неметаллов.
Таблица 2. Температуры плавления некоторых твердых веществ-неметаллов и их Ar
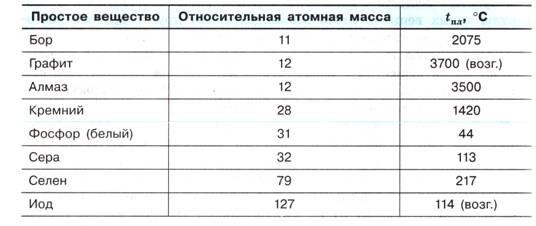
Почему кремний, бор, графит и алмаз имеют очень высокие температуры плавления? Чтобы ответить на этот вопрос, нужно рассмотреть строение кристаллов этих веществ. Дело в том, что в узлах кристаллических решеток этих веществ находятся атомы неметаллов, соединенные друг с другом прочными ковалентными неполярными связями. Рассмотрим кристаллические решетки графита и алмаза. В кристалле алмаза все атомы углерода связаны между собой равноценными ковалентными неполярными связями. Такой кристалл отличается особой прочностью, поэтому алмаз – необычайно твердое вещество.
Кристалл графита состоит из своеобразных слоев. Расстояние между слоями существенно больше, чем между атомами внутри слоя. Поэтому твердость графита низкая, графитом можно писать (при этом разрываются связи между слоями атомов углерода).
Кремний и бор тоже образуют атомную кристаллическую структуру.
Итак, вещества с атомной кристаллической структурой имеют более высокие температуры кипения и плавления, чем вещества с молекулярной кристаллической структурой. Это объясняется тем, что атомный кристалл разрушить сложнее, чем молекулярный, т.к. связи между молекулами слабые, а между атомами прочные.
Сера, селен, фосфор – вещества молекулярного строения, их молекулы имеют следующий состав: S8, Se8, P4. И для них также соблюдается закономерность: чем больше молекулярная масса вещества с молекулярной кристаллической структурой, тем выше его температура кипения и плавления (см. Таблицу 3).
Таблица 3. Температуры плавления некоторых твердых простых веществ-неметаллов и их Мr
Ковалентная связь — Википедия
 Ковалентная связь, формирующая молекулу водорода H2 (справа), где два атома водорода перекрывают два электрона
Ковалентная связь, формирующая молекулу водорода H2 (справа), где два атома водорода перекрывают два электрона 
Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных (находящихся на внешней оболочке атома) электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Ковалентная связь включает в себя многие виды взаимодействий, включая σ-связь, π-связь, металлическую связь, банановую связь и двухэлектронную трёхцентровую связь.[1][2]
С учётом статистической интерпретации волновой функции М. Борна плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис.1). В теории отталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементов каждого периода существует некоторый средний радиус электронной пары (Å):
0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть до криптона и 0,8 для элементов вплоть до ксенона[3].
Характерные свойства ковалентной связи[править | править код]
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
- Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы.
Углы между двумя связями называют валентными.
- Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
- Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов.
По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
- Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Однако, дважды лауреат Нобелевской премии Л. Полинг указывал, что «в некоторых молекулах имеются ковалентные связи, обусловленные одним или тремя электронами вместо общей пары»[4]. Одноэлектронная химическая связь реализуется в молекулярном ионе водорода H2+.
Молекулярный ион водорода H2+ содержит два протона и один электрон. Единственный электрон молекулярной системы компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии 1,06 Å (длина химической связи H2+). Центр электронной плотности электронного облака молекулярной системы равноудалён от обоих протонов на боровский радиус α0=0,53 А и является центром симметрии молекулярного иона водорода H2+.
Термин «ковалентная связь» был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 году[5][4]. Этот термин относился к химической связи, обусловленной совместным обладанием электронами, в отличие от металлической связи, в которой электроны были свободными, или от ионной связи, в которой один из атомов отдавал электрон и становился катионом, а другой атом принимал электрон и становился анионом.
Позднее (1927 год) Ф. Лондон и В. Гайтлер на примере молекулы водорода дали первое описание ковалентной связи с точки зрения квантовой механики.
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома[6].
- A· + ·В → А: В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет ни чем иным, как энергией связи).
Заполнение электронами атомных (по краям) и молекулярных (в центре) орбиталей в молекуле H2. Вертикальная ось соответствует энергетическому уровню, электроны обозначены стрелками, отражающими их спины.Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществлённые электроны располагаются на более низкой по энергии связывающей МО.
Образование связи при рекомбинации атомов[править | править код]
Атомы и свободные радикалы склонны к рекомбинации — образованию ковалентной связи путём обобществления двух неспаренных электронов, принадлежащих разным частицам.
- H+H→h3{\displaystyle {\mathsf {H+H\rightarrow H_{2}}}}
- Ch4⋅+Ch4⋅→Ch4-Ch4{\displaystyle {\mathsf {CH_{3}\cdot +CH_{3}\cdot \rightarrow CH_{3}{\text{-}}CH_{3}}}}
Образование связи при рекомбинации сопровождается выделением энергии. Так, при взаимодействии атомов водорода выделяется энергия в количестве 436 кДж/моль. Этот эффект используют в технике при атомно-водородной сварке. Поток водорода пропускают через электрическую дугу, где генерируется поток атомов водорода. Атомы затем вновь соединяются на металлической поверхности, помещаемой на небольшое расстояние от дуги. Металл может быть таким путём нагрет выше 3500 °C. Большим достоинством «пламени атомного водорода» является равномерность нагрева, позволяющая сваривать очень тонкие металлические детали[7].
Однако, механизм межатомного взаимодействия долгое время оставался неизвестным. Лишь в 1930 г. Ф. Лондон ввёл понятие дисперсионное притяжение — взаимодействие между мгновенным и наведённым (индуцированными) диполями. В настоящее время силы притяжения, обусловленные взаимодействием между флуктуирующими электрическими диполями атомов и молекул носят название «Лондоновские силы».
Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости α и обратно пропорциональна расстоянию между двумя атомами или молекулами в шестой степени[8].
Образование связи по донорно-акцепторному механизму[править | править код]
Кроме гомогенного механизма образования ковалентной связи существует гетерогенный механизм — взаимодействие разноименно заряженных ионов — протона H+ и отрицательного иона водорода H—, называемого гидрид-ионом:
- H++H−→h3{\displaystyle {\mathsf {H^{+}+H^{-}\rightarrow H_{2}}}}
При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и в конечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающую электронную пару. Частица, поставляющая электронную пару, называется донором, а частица, принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным[9].
Распределение электронной плотности между ядрами в молекуле водорода одно и то же, независимо от механизма образования, поэтому называть химическую связь, полученную по донорно-акцепторному механизму, донорно-акцепторной связью некорректно.
В качестве донора электронной пары, кроме гидрид-иона, выступают соединения элементов главных подгрупп V—VII групп периодической системы элементов в низшей степени окисления элемента. Так, ещё Йоханнес Брёнстед установил, что протон не существует в растворе в свободном виде, в воде он образует катион оксония:
- H++h3O→h4O+{\displaystyle {\mathsf {H^{+}+H_{2}O\rightarrow H_{3}O^{+}}}}
Протон атакует неподелённую электронную пару молекулы воды и образует устойчивый катион, существующий в водных растворах кислот[10].
Аналогично происходит присоединение протона к молекуле аммиака с образованием комплексного катиона аммония:
- Nh4+H+→Nh5+{\displaystyle {\mathsf {NH_{3}+H^{+}\rightarrow NH_{4}^{+}}}}
Таким путём (по донорно-акцепторному механизму образования ковалентной связи) получают большой класс ониевых соединений, в состав которого входят аммониевые, оксониевые, фосфониевые, сульфониевые и другие соединения[11].
В качестве донора электронной пары может выступать молекула водорода, которая при контакте с протоном приводит к образованию молекулярного иона водорода H3+:
- h3+H+→h4+{\displaystyle {\mathsf {H_{2}+H^{+}\rightarrow H_{3}^{+}}}}
Связывающая электронная пара молекулярного иона водорода H3+ принадлежит одновременно трём протонам.
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь. Для её образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
- Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют многие простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например, в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
- Если атомы различны, то степень владения обобществлённой парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь. Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
- 1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами — в анион-радикал (отрицательно заряженная частица с неспаренным электроном).
- 2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу.
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π{\displaystyle \pi }-связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
В молекуле этилена С2Н4 имеется двойная связь СН2=СН2, его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвёртого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π{\displaystyle \pi }-связью.
В линейной молекуле ацетилена
Н—С≡С—Н (Н : С ::: С : Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две π{\displaystyle \pi }-связи между этими же атомами углерода. Две π{\displaystyle \pi }-связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С6H6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвёртых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π{\displaystyle \pi }-связи, а единая π{\displaystyle \pi }-электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
Примеры веществ с ковалентной связью[править | править код]
Простой ковалентной связью соединены атомы в молекулах простых газов (Н2, Cl2 и др.) и соединений (Н2О, NH3, CH4, СО2, HCl и др.). Соединения с донорно-акцепторной связью — аммония NH4+, тетрафторборат анион BF4− и др. Соединения с семиполярной связью — закись азота N2O, O−-PCl3+.
Кристаллы с ковалентной связью — диэлектрики или полупроводники. Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями) могут служить алмаз, германий и кремний.
- ↑ March, Jerry. Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (англ.). — John Wiley & Sons, 1992. — ISBN 0-471-60180-2.
- ↑ Gary L. Miessler; Donald Arthur Tarr. Inorganic Chemistry (неопр.). — Prentice Hall (англ.)русск., 2004. — ISBN 0-13-035471-6.
- ↑ Гиллеспи Р. Геометрия молекул. — М: «Мир», 1975. — С. 49. — 278 с.
- ↑ 1 2 Л.Паулинг. Природа химической связи. — М.-Л.: Издательство химической литературы, 1947. — С. 16. — 440 с.
- ↑ I. Langmuir. Journal of the American Chemical Society. — 1919. — Т. 41. — 868 с.
- ↑ Полинг.Л., Полинг П. Химия. — «Мир», 1978. — С. 129. — 684 с.
- ↑ Некрасов Б. В. Курс общей химии. — 14. — М.: изд. химической литературы, 1962. — С. 110. — 976 с.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия. — М.: «Мир», 1978. — С. 453. — 646 с.
- ↑ Ахметов Н. С. Неорганическая химия. — изд. 2-е перераб. и доп.. — М.: Высшая школа, 1975. — С. 60. — 672 с.
- ↑ Химический энциклопедический словарь / гл. ред. И. Л. Кнунянц. — М.: Сов. энциклопедия, 1983. — С. 132. — 792 с.
- ↑ Onium compounds IUPAC Gold Book
- «Химический энциклопедический словарь», М., «Советская энциклопедия», 1983, с.264.
Химическая связь: определение, типы, свойства

Содержание:
Химическая связь, ее типы, свойства, наряду с химическими реакциями является одним из краеугольных камней интересной науки под названием химия. В этой статье мы разберем все аспекты химических связей, их значение в науке, приведем примеры и многое другое.
Что такое химическая связь
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Типы химических связей
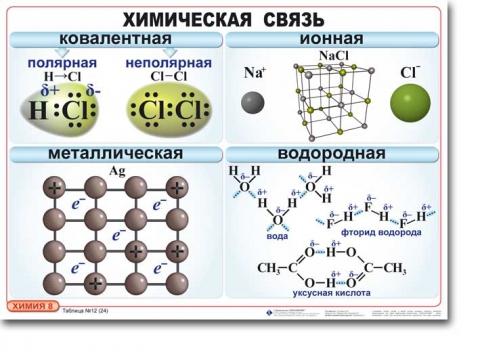
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
- Ковалентная химическая связь (которая в свою очередь может быть полярной и неполярной)
- Ионная связь
- Водородная связь
- Химическая связь металлов
подобных людям.
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
Ионная химическая связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.

Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
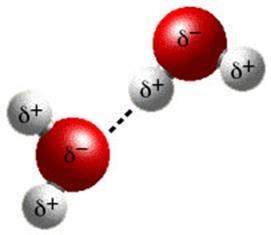
Водородная химическая связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.

На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Химическая связь металлов
Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип химической связи – атомы всех металлов расположены не абы как, а определенным образом, порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.

Так выглядит металлическая химическая связь.
В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.
Как определить вид химической связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.
Свойства химических связей
Чтобы провести сравнение разных химических реакций используются разные количественные характеристики, такие как:
- длина,
- энергия,
- полярность,
- порядок связей.
Разберем их подробнее.
Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью. Обычно измеряется экспериментально.
Энергия химической связи определяет ее прочность. В данном случае под энергией подразумевается усилие, необходимое, для того, чтобы разорвать химическую связь и разъединить атомы.
Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атомов смещать к себе электронную плотность или говоря простым языком «тянуть одеяло на себя» в химии называют электроотрицательностью.
Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь. Порядок может быть, как целым, так и дробным, чем он выше, тем большее число электронов осуществляют химическую связь и тем труднее ее разорвать.
Химическая связь, видео
И в завершение познавательное видео об разных видах химической связи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Bonding: Definition, Types, Properties.

