Повышение эффективности процесса генерации водорода в электролизерах с газопоглощающим электродом Текст научной статьи по специальности «Химические технологии»
УДК 536.2
ПОВЫШЕНИЕ ЭФФЕКТИВНОСТИ ПРОЦЕССА ГЕНЕРАЦИИ ВОДОРОДА В ЭЛЕКТРОЛИЗЕРАХ С ГАЗОПОГЛОЩАЮЩИМ
ЭЛЕКТРОДОМ
В.В. Соловей, профессор, д.т.н., А.А. Шевченко, И.А. Воробьева, В.М. Семикин, С.А Коверсун, ассистенты, ХНАДУ
Аннотация. Рассмотрены особенности разработанного способа электрохимического получения водорода и кислорода высокого давления без применения компрессорной техники. Способ дает возможность генерировать водород и кислород циклически — раздельно во времени, что позволяет исключить необходимость использования разделительных мембран.
Ключевые слова: электролизер, газопоглощающий электрод, водород, кислород, высокое давление.
Введение
Электролиз воды отличается от других методов получения водорода простотой технологической схемы, доступностью воды в качестве сырья, простотой обслуживания установок, высокой надежностью в эксплуатации. Это позволяет успешно применять данный метод в комплексе с использованием возобновляемых источников энергии (солнечной, ветровой и др.). Основным недостатком электрохимического метода получения водорода является его большая энергоемкость. Поэтому для водородной энергетики перспективной и актуальной является разработка электрохимических технологий генерации водорода из воды с минимальными затратами электроэнергии [1].
Это позволяет успешно применять данный метод в комплексе с использованием возобновляемых источников энергии (солнечной, ветровой и др.). Основным недостатком электрохимического метода получения водорода является его большая энергоемкость. Поэтому для водородной энергетики перспективной и актуальной является разработка электрохимических технологий генерации водорода из воды с минимальными затратами электроэнергии [1].
Анализ публикаций
В широко используемых в промышленности традиционных электролизерах с жидким электролитом: ФВ, СЭУ (Россия), Weuder Model, De Nora (Италия), Norsk (Норвегия), Stuart Imet (Бельгия), Teledyne (США), Lon-cza, Demag (ФРГ) — электролиз воды осуществляется в диапазоне температур от 333 К до 353 К и плотности тока от 1200 А/м2 до 2500 А/м2. В промышленных электролизерах энергозатраты (в зависимости от температуры процесса, давления, качества электродов,
конструкции электролизера и ряда других факторов) изменяются в пределах от 4,3 кВ-т-ч/м3 до 5,2 кВт-ч/м3 Н2.
Перспективным направлением развития водородной энергетики следует считать создание новой технологии электрохимической генерации водорода и кислорода, основанной на применении электрокаталитической конверсии с использованием в качестве электродных материалов металлов с переменной валентностью.
Разработанная электрохимическая технология разложения воды является циклической, состоящей из полуциклов выделения водорода и кислорода (рис. 1).
Ход эксперимента
На основании проведенных исследований была определена оптимальная комбинация электродов, обеспечивающая возможность раздельно во времени генерировать водород и кислород, а также разработана конструкция электродной сборки (рис. 2), учитывающая факторы, влияющие на минимизацию энергетических потерь [2, 3, 4].
Малое перенапряжение выделения водорода и кислорода на пассивном электроде позволяет получать эти газы непосредственно с самого
+2,0 и, В
+ 1,6 + 1,4 + 1,2 + 1,0 +0,8 +0,6 +0,4 +0,2 0 -0,2 -0,4 -0,6 -0,8 -1,0 -1,2 -1,4 -1,6 -1,8 -2,0
И,
В
А
Ме(ОН)з
Т, т1п
Ме(ОН)
2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 56 58
о2
С
Рис. 1. Циклограмма изменения напряжения выделения водорода и кислорода при электролизе. Плотность тока I = 200 А/м2: А — В — рабочая область полуцикла; В — С — область работы с дополнительными энергозатратами; ди — перенапряжение при восстановлении активной массы
1. Циклограмма изменения напряжения выделения водорода и кислорода при электролизе. Плотность тока I = 200 А/м2: А — В — рабочая область полуцикла; В — С — область работы с дополнительными энергозатратами; ди — перенапряжение при восстановлении активной массы
лг
1-
Рис. 2. Конструкция электродной сборки с использованием газопоглощающего электрода
начала протекания реакции электрохимического разложения воды (плотность тока от 200 А/м2 до 600 А/м2). При применении материала электрода с переменной валентностью, химически связывающего кислород, рабочий процесс в области А — В (рис. 1) соответствует реакции
Ме + 2ОН- <=> Ме(ОН)2 + 2е. (1)
При длительной работе активной массы электрода происходит более глубокое окисление Fe
Ме(ОН)2 + ОН- <=> Ме(ОН)з + е. (2) Область В — С циклограммы изменения электродного потенциала при электрохимическом
получении водорода и кислорода на полуцикле выделения Н2 (рис. 1) соответствует переходу Ме(П) в Ме(Ш), а полуцикл выделения О2 соответствует электрохимическому восстановлению Ме.
На полуцикле выделения Н2 Ме(ОН)2 сохраняет губчатую структуру и имеет развитую поверхность контакта с электролитом. Поляризация при окислении активной массы электрода вызвана замедлением диффузии ионов ОН-, при этом скорость диффузии снижается по мере увеличения толщины слоя прореагировавшего Ме.
Полуцикл выделения О2 характеризуется восстановлением иона гипоферрита на активном электроде.
Полученные теоретические значения напряжений электрохимических реакций разложения воды из щелочного электролита позволяют определить физическую природу возникновения характерных пологих областей А — В и В — С на циклограмме изменения электродного потенциала при электрохимическом получении водорода и кислорода (рис. 1).
Установлено, что для получения водорода с низкими энергозатратами целесообразно использовать процесс, соответствующий пологой области А — В с образованием Ме(ОН)2 (реакция (1)). Далее гидроксид железа (при глубокой проработке, область
В — С) переходит в Ме(ОН)3 (реакция (2)), наличие которого в активной массе газопоглоща-ющего электрода приводит к дополнительным энергозатратам. Поэтому для снижения затрат энергии процесса генерации водорода и кислорода необходима оптимизация режимов работы электрохимической ячейки.
Поэтому для снижения затрат энергии процесса генерации водорода и кислорода необходима оптимизация режимов работы электрохимической ячейки.
Одним из методов оптимизации режимов работы электрохимического генератора водорода и кислорода высокого давления, позволяющим снизить затраты электроэнергии на производство водорода и кислорода, является метод ограничения напряжения протекания электрохимической реакции на этапе, который соответствует пологим участкам А — В и В — С циклограммы изменения напряжения полуцикла выделения газообразного водорода (см. рис. 1).
На рис. 3 представлены экспериментальные циклограммы изменения напряжения генерации водорода и кислорода высокого давления. Циклограмма 1 соответствует рабочему процессу генерации водорода и кислорода без применения метода ограничения напряжения протекания электрохимической реакции цикла. При этом плотность тока I = 0,02 А/см2, напряжение протекания реакции окисления активной массы изменялось в пределах от 0,28 В до 1,8 В, а затраты электроэнергии на генерацию 1м3 водорода и 0,5 м3 кислорода составили 5,4 кВт-ч/м3. Имеющиеся на циклограмме две характерные пологие области соответствуют, на наш взгляд, доминированию одной из реакций —
Имеющиеся на циклограмме две характерные пологие области соответствуют, на наш взгляд, доминированию одной из реакций —
(1) или (2). Начало пологого участка первой области соответствует напряжению 0,28 В и заканчивается напряжением 0,54 В (реакция (1)). Вторая пологая область лежит в диапазоне напряжений от 0,54 В до 0,68 В (реакция (2)).
Циклограмма 2 (см. рис. 3) соответствует рабочему процессу генерации водорода и кислорода высокого давления с применением метода ограничения напряжения протекания электрохимической реакции цикла. Ограничение напряжения на полуцикле выделения Н2 величиной 1 В позволяет снизить затраты электроэнергии на генерацию 1 м3 водорода (и 0,5 м3 кислорода) с 5,4 кВт-ч до 4,8 кВт-ч.
Рабочему процессу генерации водорода и кислорода высокого давления соответствует циклограмма 3 (см. рис. 3) с использованием метода ограничения напряжения протекания электрохимической реакции величиной 0,5 В, при этом затраты электроэнергии снизились с 5,4 кВт-ч/м3 до 4,5 кВт-ч/м3. ч/ivi
ч/ivi
270 280 290 300 310 320 330 340 350 360 370 380 Т,К 400 1- U = 0.5 B; 2 — U = 1 B; 3 — U = 1,8 B; 4 — U = 0.2 B.
Рис. 4. Зависимость расхода электроэнергии от температур электрохимической реакции
5,0
4,0
3,0
электроэнергии при генерации водорода на 15-17 %. Таким образом, результаты исследований показали, что диапазон рабочих температур разработанного процесса электролиза находится в пределах от 280 К до 423 К, интервал давлений составляет величину от 0,1 МПа до 70 МПа. Затраты электроэнергии на генерацию 1 м3 Н2 (и 0,5 м3 О2) в пределах от 4,1 кВт-ч до 3,8 кВт-ч (традиционные электролизеры имеют энергозатраты от 4,3 кВт-ч/м3 до 5,2 кВт-ч/м3).
Циклическое генерирование водорода и кислорода исключает необходимость в использовании разделительных мембран, что обеспечивает генерацию водорода и кислорода высокого давления с рабочим диапазоном от 0,1 МПа до 70 МПа, что повышает надежность и безопасность эксплуатации генератора водорода и кислорода. В электрохимическом генераторе водорода и кислорода высокого давления для активации электродных материалов не используются редкоземельные металлы и металлы платиновой группы.
В электрохимическом генераторе водорода и кислорода высокого давления для активации электродных материалов не используются редкоземельные металлы и металлы платиновой группы.
Вывод
Все это дает основание полагать, что электрохимические генераторы водорода и кислорода высокого давления позволят решить ряд важных задач в области энергетики и, в частности, создание аккумулирующих установок с обратимым топливным элементом, при использовании возобновляемых источников энергии, характеризуемых непостоянством энергопоступления.
Литература
1. Соловей В.В. Влияние режимных факторов
на эффективность электролизера высокого давления / В.В. Соловей, А.С. Жиров, А.А. Шевченко // Совершенствование турбоустановок методами математического и физического моделирования / Сб. научн. трудов. — Харьков, 2003. -С.250 — 254.
2. Пат. № 29852А Украша, МКИ6 С 25В 1/40.
Пристрш для одержання водню та кисню високого тиску / О С. Жиров, В.С. Плич-ко, В.В. Соловей, О.О. Макаров (Украша). — № 97084338; Заявл. 21.08.97; Опубл. 29.12.99, Бюл. № 8. -15 с.
— № 97084338; Заявл. 21.08.97; Опубл. 29.12.99, Бюл. № 8. -15 с.
3. Пат. № 29853А Украша, МКИ6 С 25В 1/12,
С 25В 11/03. Пристрш для одержання водню / О.С. Жиров, В.В. Соловей, О.О. Макаров (Украша). — № 97084339; Заявл. 21.08.97; Опубл. 29.12.99, Бюл. № 8. — 9 с.
4. Пат. № 18579 Украша, МПК6 С 25В 1/02.
Пристрш для одержання водню високого тиску / В.В. Соловей, А.А. Шевченко, О.С. Жиров, О.О. Макаров (Украша). — № 2006 05150; Заявл. 10.05.06; Опубл. 15.11.2006, Бюл. № 11. — 4 с.
Рецензент: В.А. Юрченко, профессор, д.т.н., ХНАДУ.
Статья поступила в редакцию 12 сентября 2008 г.
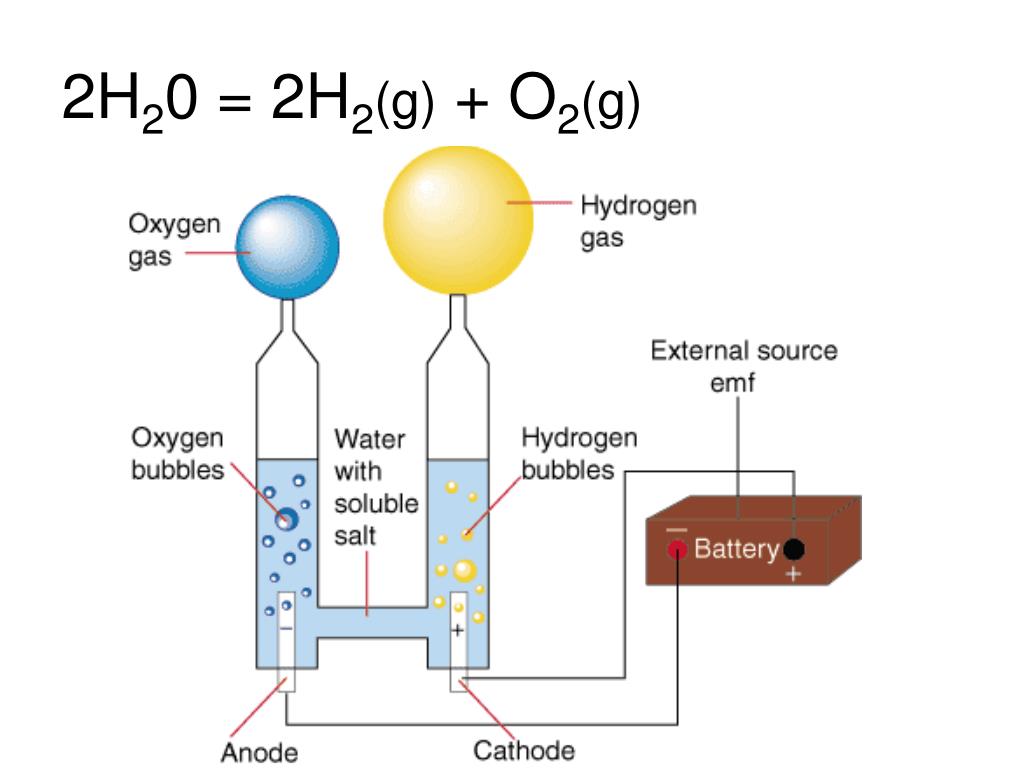
Реакция термического разложения воды
Химические реакции
Виктор Потехин
Реакция термического разложения воды.
Уравнение реакции термического разложения воды:
Вода разлагается под действием высокой температуры или электрического тока.
2H2O → 2H2 + O2 (t = 2000 °C или электрический ток).
Реакция термического разложения воды протекает при условии: при температуре 2000 °C.
В результате реакции термического разложения воды образуются водород и кислород.
Все химические реакции.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности 177
- ← Ультразвуковой нож
- Реакция магния с водой →
Мировая экономика
Нефть Brent и WTI
USD/JPY
USD/AUD
USD/CHF
USD/GBP
USD/CAD
Серебро
Палладий
Золото
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг.
 (107 196)
(107 196) - Экономика Второй индустриализации России (103 617)
- Программа искусственного интеллекта ЭЛИС (30 262)
- Этилен (этен), получение, свойства, химические реакции (30 231)
- Метан, получение, свойства, химические реакции (27 026)
- Крахмал, свойства, получение и применение (26 761)
- Целлюлоза, свойства, получение и применение (25 339)
- Пропилен (пропен), получение, свойства, химические реакции (24 121)
- Прямоугольный треугольник, свойства, признаки и формулы (24 024)
Еще технологии
Поиск технологий
Выберите отрасль экономики или все отраслиПоиск по всем отраслямБиотехнологииВодоснабжение и водоотведениеДобыча, обработка и переработка полезных ископаемыхЗдравоохранениеИнформация и связьЛегкая промышленностьЛесная и деревообрабатывающая промышленностьНаноиндустрияНефтехимическая промышленностьОбразование.
Поиск технологий
Финансирование:Технологии ожидают финансирования
В процессе разработки:Технологии в процессе разработки
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Может быть интересно:
Водород
| Водород | |
|---|---|
| Атомный номер | 1 |
| Внешний вид простого вещества | газ без цвета, вкуса и запаха |
| Свойства атома | |
|
Атомная масса (молярная масса) |
1,00794 а.е.м. (г/моль) |
| Радиус атома | 79 пм |
|
Энергия ионизации (первый электрон) |
|
| Электронная конфигурация | 1s1 |
| Химические свойства | |
| Ковалентный радиус | 32 пм |
| Радиус иона | 54 (−1 e) пм |
|
Электроотрицательность (по Полингу) |
2,20 |
| Электродный потенциал | |
| Степени окисления | 1, −1 |
| Термодинамические свойства простого вещества | |
|
Плотность вещества |
0,0000899 (при 273K (0 °C)) г/см³ |
| Молярная теплоёмкость | 14,235 Дж/(K·моль) |
| Теплопроводность | 0,1815 Вт/(м·K) |
| Температура плавления | 14,01K |
| Теплота плавления | 0,117 кДж/моль |
| Температура кипения | 20,28K |
| Теплота испарения | 0,904 кДж/моль |
| Молярный объём | 14,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,780 c=6,167 Å |
| Отношение c/a | 1,631 |
| Температура Дебая | |
| H | 1 |
| 1,00794 | |
| 1s1 | |
| Водород | |
Водород является первым элементом периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H— протон. Свойства ядра 1
Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H— протон. Свойства ядра 1
Трое из пяти изотопов водорода имеют собственные названия: 1H— протий (Н), 2H— дейтерий (D) и 3H— тритий (радиоактивен) (T).
Простое вещество водород— H2— лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
История водорода
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и М. В. Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Г. Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы.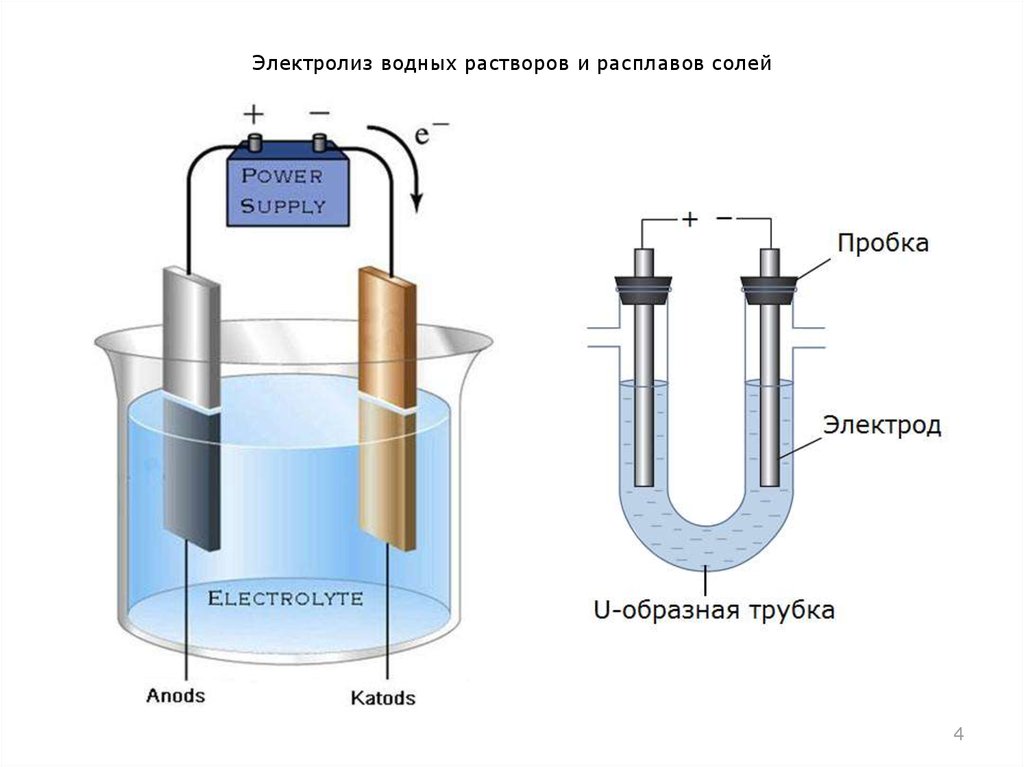
Происхождение названия водород
Лавуазье дал водороду название hydrogène (отὕδωρ— «вода» и γενναω— «рождаю»)— «рождающий воду». Русское наименование «водород» предложил химик М.Ф.Соловьев в 1824 году— по аналогии с ломоносовским «кислородом».
Распространённость водорода
Во Вселенной
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92% всех атомов (8% составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1%). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1%— это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна ~52%). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50%.
Получение Водорода
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом— выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Так, кислород, имеющийся в свободном состоянии, получают физическим способом— выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода— реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 +2Н2O =CO2↑ +4Н2 −165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности,— разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
Получение водорода в промышленности
1.Электролиз водных растворов солей:
2NaCl +2H2O → H2↑ +2NaOH +Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
H2O +C ⇄ H2↑ +CO↑
3.Из природного газа.
Конверсия с водяным паром:
CH4 +H2O ⇄ CO↑ +3H2↑ (1000°C)
Каталитическое окисление кислородом:
2CH4 +O2 ⇄ 2CO↑ +4H2↑
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
Получение водорода в лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn +2HCl → ZnCl2 +H2↑
2. Взаимодействие кальция с водой:|
Взаимодействие кальция с водой:|
Ca +2H2O → Ca(OH)2 +H2↑
3.Гидролиз гидридов:
NaH +H2O → NaOH +H2↑
4.Действие щелочей на цинк или алюминий:
2Al +2NaOH +6H2O → 2Na[Al(OH)4] +3H2↑
Zn +2KOH +2H2O → K2[Zn(OH)4] +H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ +2e— → H2↑ +2H2O
Дополнительная информация про Водород
Биореактор для производства водорода
Физические свойства Водорода
Спектр излучения водорода
Эмиссионный спектр водорода
Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды— с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды— с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.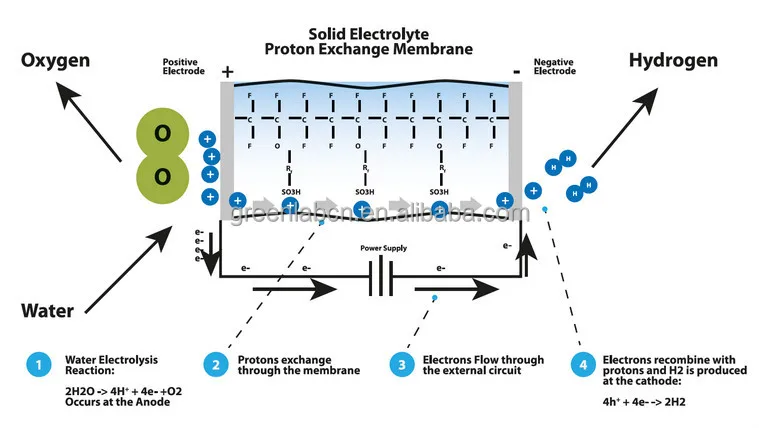
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9·106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79% пара-Н2, 0,21% орто-Н2.
Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79% пара-Н2, 0,21% орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии, пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Изотопы
Давление пара для различных изотопов водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H— протий (Н), 2Н— дейтерий (D), 3Н— тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1и 2. Содержание их в природе соответственно составляет 99,9885±0,0070% и 0,0115 ± 0,0070%. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4— 7и периодами полураспада 10−22— 10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
|
Температура плавления, K |
Температура кипения, K |
Тройная точка, K /kPa |
Критическая точка, K /kPa |
Плотность жидкий /газ, кг/м³ |
|
|---|---|---|---|---|---|
| H2 |
13. 95 95 |
20,39 | 13,96 /7,3 | 32,98 /1,31 | 70,811 /1,316 |
| HD | 16,60 | 22,13 | 16,60 /12,8 | 35,91 /1,48 | 114,80 /1,802 |
| HT | 22,92 | 17,63 /17,7 | 37,13 /1,57 | 158,62 /2,310 | |
| D2 | 18,62 | 23,67 | 18,73 /17,1 | 38,35 /1,67 | 162,50 /2,230 |
| DT | 24.38 | 19,71 /19,4 | 39,42 /1,77 | 211,54 /2,694 | |
| T2 | 25,04 | 20,62 /21,6 | 40,44 /1,85 | 260,17 /3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойства
Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
- Н2 =2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
- Ca +Н2 =СаН2
и с единственным неметаллом— фтором, образуя фтороводород:
- F2 +H2 =2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
- О2 +2Н2 =2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
- CuO +Н2 =Cu +Н2O
Записанное уравнение отражает восстановительные свойства водорода.
- N2 +3H2 → 2NH3
С галогенами образует галогеноводороды:
- F2 +H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
- Cl2 +H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
- C +2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
- 2Na +H2 → 2NaH
- Ca +H2 → CaH2
- Mg +H2 → MgH2
Гидриды— солеобразные, твёрдые вещества, легко гидролизуются:
- CaH2 +2H2O → Ca(OH)2 +2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
- CuO +H2 → Cu +H2O
- Fe2O3 +3H2 → 2Fe +3H2O
- WO3 +3H2 → W+3H2O
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы навзывают реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Эти процессы навзывают реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, гигантскими планетами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.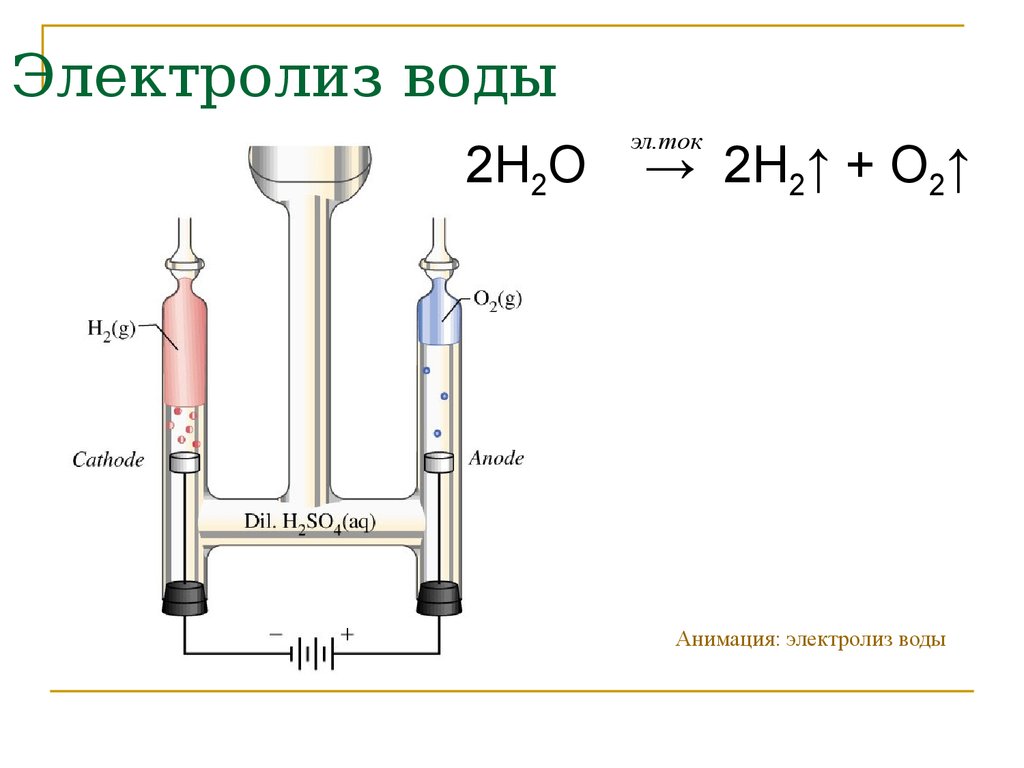
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращения
|
Водород при смеси с воздухом образует взрывоопасную смесь— так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21%. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Взрывоопасные концентрации водорода с кислородом возникают от 4% до 96% объёмных. При смеси с воздухом от 4% до 75(74)% объёмных. |
Применение водорода
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
При производстве аммиака, метанола, мыла и пластмасс
Пищевая промышленность
При производстве маргарина из жидких растительных масел.
Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XXв. произошло несколько катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием.
Топливо
Водород используют в качестве ракетного топлива. Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.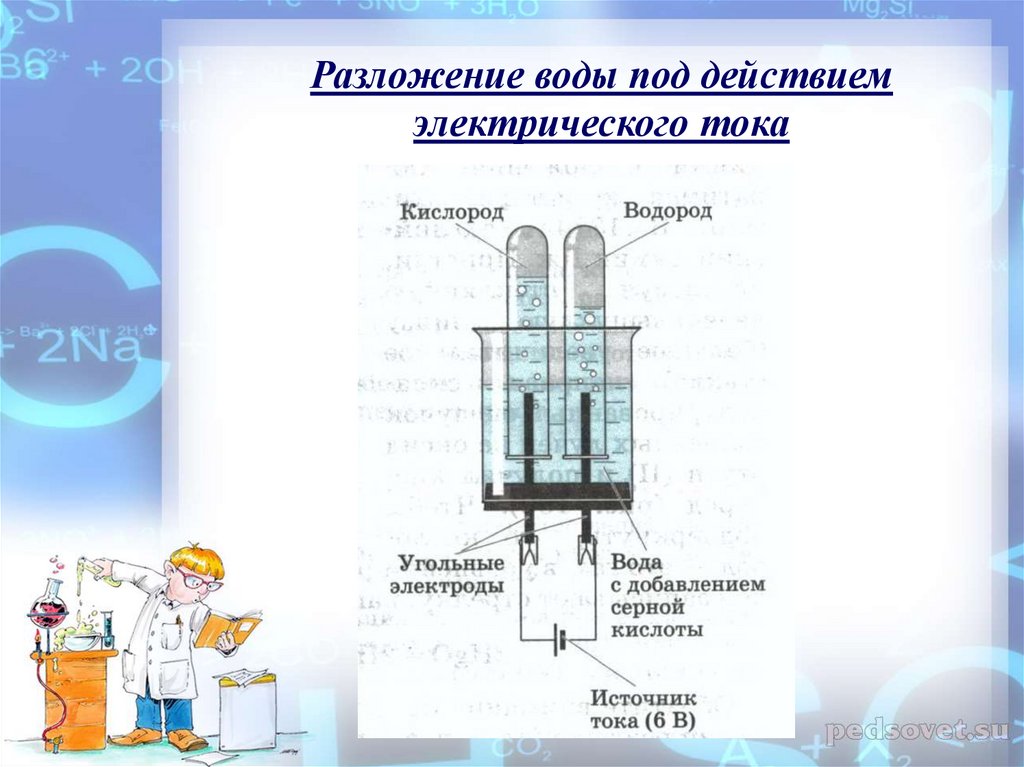
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Водород, Hydrogenium, Н (1)
Как горючий (воспламеняемый) воздух водород известен довольно давно. Его получали действием кислот на металлы, наблюдали горение и взрывы гремучего газа Парацельс, Бойль, Лемери и другие ученые XVI— XVIII вв. С распространением теории флогистона некоторые химики пытались получить водород в качестве «свободного флогистона». В диссертации Ломоносова «О металлическом блеске» описано получение водорода действием «кислотных спиртов» (например, «соляного спирта», т. е. соляной кислоты) на железо и другие металлы; русский ученый первым (1745) выдвинул гипотезу, о том что водород («горючий пар»— vapor inflammabilis) представляет собой флогистон. Кавендиш, подробно исследовавший свойства водорода, выдвинул подобную же гипотезу в 1766 г. Он называл водород «воспламеняемым воздухом», полученным из «металлов» (Inflammable air from metals), и полагал, как и все флогистики, что при растворении в кислотах металл теряет свой флогистон. Лавуазье, занимавшийся в 1779 г. исследованием состава воды путем ее синтеза и разложения, назвал водород Hydrogine (гидроген), или Hydrogene (гидрожен), от греч. гидор— вода и гайноме— произвожу, рождаю.
Лавуазье, занимавшийся в 1779 г. исследованием состава воды путем ее синтеза и разложения, назвал водород Hydrogine (гидроген), или Hydrogene (гидрожен), от греч. гидор— вода и гайноме— произвожу, рождаю.
Номенклатурная комиссия 1787 г. приняла словопроизводство Hydrogene от геннао, рождаю. В «Таблице простых тел» Лавуазье водород (Hydrogene) упомянут в числе пяти (свет, теплота, кислород, азот, водород) «простых тел, относящихся ко всем трем царствам природы и которые следует рассматривать как элементы тел»; в качестве старых синонимов названия Hydrogene Лавуазье называет горючий газ (Gaz inflammable), основание горючего газа. В русской химической литературе конца XVIII и начала XIX в. встречаются два рода названий водорода: флогистические (горючий газ, горючий воздух, воспламенительный воздух, загораемый воздух) и антифлогистические (водотвор, водотворное существо, водотворный гас, водородный гас, водород). Обе группы слов представляют собой переводы французских названий водорода.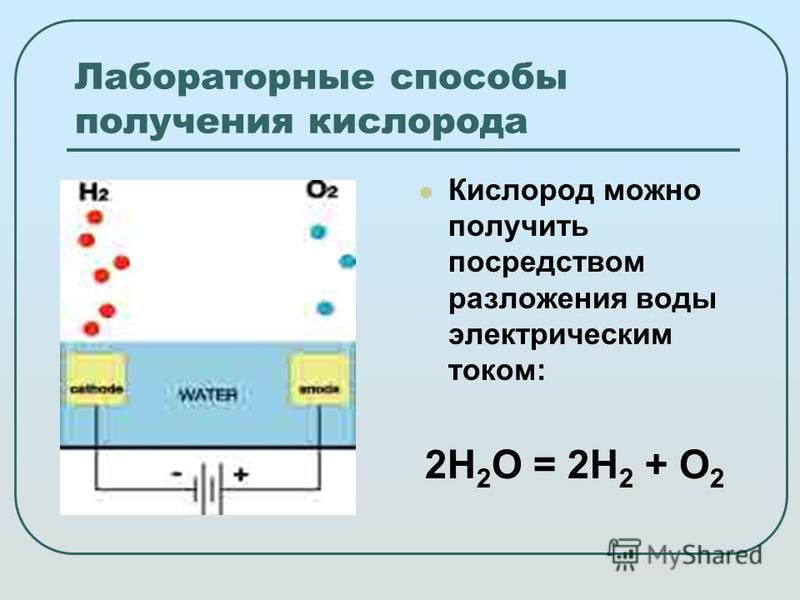
Изотопы водорода были открыты в 30-x годах текущего столетия и быстро приобрели большое значение в науке и технике. В конце 1931 г. Юри, Брекуэдд и Мэрфи исследовали остаток после длительного выпаривания жидкого водорода и обнаружили в нем тяжелый водород с атомным весом 2. Этот изотоп назвали дейтерием (Deuterium, D) от греч.— другой, второй. Спустя четыре года в воде, подвергнутой длительному электролизу, был обнаружен еще более тяжелый изотоп водорода 3Н, который назвали тритием (Tritium, Т), от греч.— третий.
Газ водород, физические свойства водорода, химические свойства водорода.
ПродажаПроизводствоДоставка
Газообразный
марка 4.6марка 5.0марка 6.0марка 7.0
особой чистоты марка «А»особой чистоты марка «Б»особой чистоты марка Втехнический марка «А»
технический марка «Б»технический марка «В»чистый I сорт
Жидкий
технический марка «А»технический марка «Б»технический марка «В»
Водород (лат. Hydrogenium; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Hydrogenium; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и рядеметаллов: железе, никеле, палладии, платине.
ИсторияВыделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Лавуазье дал водороду название hydrogène — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии сломоносовским «кислородом».
РаспространённостьВодород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
ПолучениеПромышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения.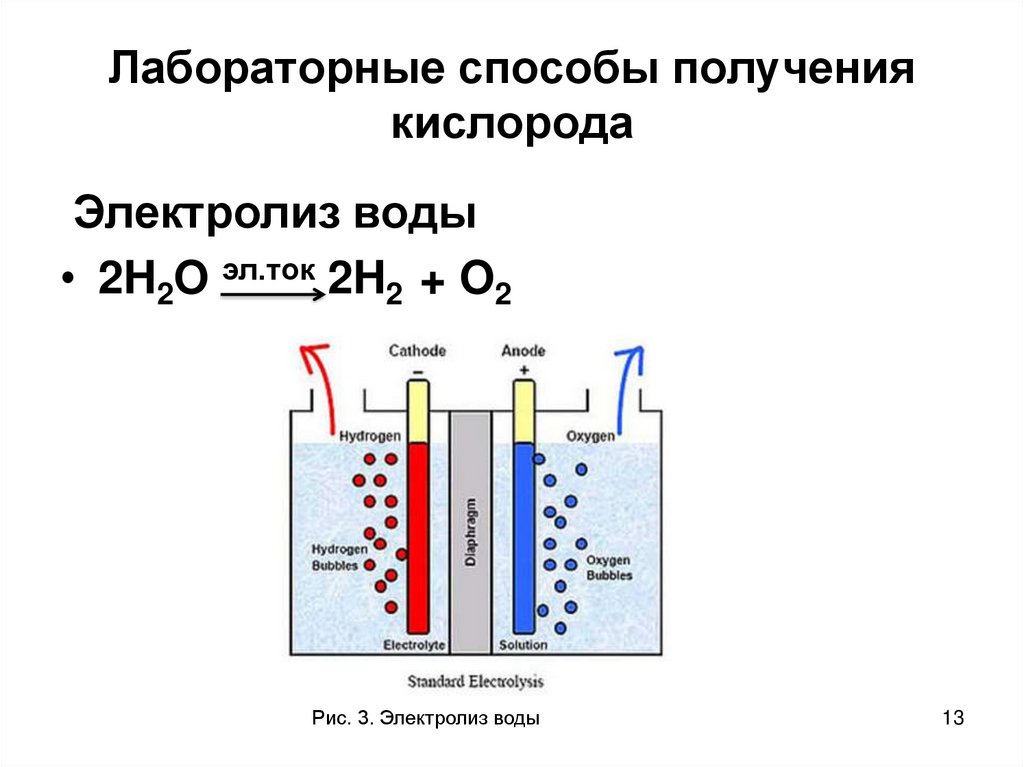 Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 + 2Н2O = CO2↑ + 4Н2 −165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
В промышленности1.Электролиз водных растворов солей:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C:
H2O + C ? H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O ? CO + 3H2 (1000 °C)
Каталитическое окисление кислородом:
2CH4 + O2 ? 2CO + 4H2
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn + 2HCl → ZnCl2 + H2↑
2.Взаимодействие кальция с водой:
Ca + 2H2O → Ca(OH)2 + H2↑
3. Гидролиз гидридов:
Гидролиз гидридов:
NaH + H2O → NaOH + H2↑
4.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e− → H2↑ + 2H2O
Физические свойстваВодород может существовать в двух формах (модификациях) — в виде орто- и пара- водорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9×106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии,пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
ИзотопыВодород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4 — 7 и периодами полураспада 10−22 — 10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
|
|
Температура |
Температура |
Тройная |
Критическая |
Плотность |
|
H2 |
13. |
20,39 |
13,96 / 7,3 |
32,98 / 1,31 |
70,811 / 1,316 |
|
D |
16,65 |
22,13 |
16,60 / 12,8 |
35,91 / 1,48 |
114,80 / 1,802 |
|
HT |
|
22,92 |
17,63 / 17,7 |
37,13 / 1,57 |
158,62 / 2,310 |
|
D2 |
18,65 |
23,67 |
18,73 / 17,1 |
38,35 / 1,67 |
162,50 / 2,230 |
|
DT |
|
24. |
19,71 / 19,4 |
39,42 / 1,77 |
211,54 / 2,694 |
|
T2 |
20,63 |
25,04 |
20,62 / 21,6 |
40,44 / 1,85 |
260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойстваДоля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2 = 2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2
и с единственным неметаллом — фтором, образуя фтороводород:
F2 + H2 = 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
О2 + 2Н2 = 2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н2O
Записанное уравнение отражает восстановительные свойства водорода.
N2 + 3H2 → 2NH3
С галогенами образует галогеноводороды:
F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металламиПри взаимодействии с активными металлами водород образует гидриды:
2Na + H2 → 2NaH
Ca + H2 → CaH2
Mg + H2 → MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
Гидрирование органических соединенийМолекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр.Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр.Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением . Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращенияВодород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водородпожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75(74) % объёмных.
ЭкономикаСтоимость водорода при крупнооптовых поставках колеблется в диапазоне 2-5$ за кг.
ПрименениеАтомарный водород используется для атомно-водородной сварки.
- При производстве аммиака, метанола, мыла и пластмасс
- При производстве маргарина из жидких растительных масел
- Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколькокатастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
ТопливоВодород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
«Жидкий водород» («ЖВ») — жидкое агрегатное состояние водорода, с низкой удельной плотностью 0.07 г/см³ и криогенными свойствами с точкой замерзания 14.01 K (−259.14 °C) и точкой кипения 20.28 K (−252.87 °C). Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4-75 %. Спиновое соотношение изомеров в жидком водороде составляет: 99,79 % —параводород; 0,21 % — ортоводород. Коэффициент расширения водорода при смене агрегатного состояния на газообразное составляет 848:1 при 20°C.
Как и для любого другого газа, сжижение водорода приводит к уменьшению его объема. После сжижения «ЖВ» хранится в термически изолированных контейнерах под давлением. Жидкий водород (англ. Liquid hydrogen, Lh3, LH2) активно используется в промышленности, в качестве формы хранения газа, и в космическойотрасли, в качестве ракетного топлива.
Первое документированное использование искусственного охлаждения в 1756 году было осуществлено английским ученым Вильямом Калленом, Гаспар Монж первым получил жидкое состояние оксида серы в 1784 году, Майкл Фарадей первым получил сжиженный аммиак, американский изобретатель Оливер Эванс первым разработал холодильный компрессор в 1805 году, Яков Перкинс первым запатентовал охлаждающую машину в 1834 году и Джон Гори первым в США запатентовалкондиционер в 1851 году. Вернер Сименс предложил концепцию регенеративного охлаждения в 1857 году, Карл Линде запатентовал оборудование для получения жидкого воздуха с использованием каскадного «эффекта расширения Джоуля — Томсона» и регенеративного охлаждения [6] в 1876 году. В 1885 году польскийфизик и химик Зигмунд Вро?блевский опубликовал критическую температуру водорода 33 K, критическое давление 13.3 атм. и точку кипения при 23 K. Впервыеводород был сжижен Джеймсом Дьюаром в 1898 году с использованием регенеративного охлаждения и своего изобретения, cосуда Дьюара. Первый синтез стабильного изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году.
Первый синтез стабильного изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году.
Водород при комнатной температуре состоит в основном из спинового изомера, ортоводорода. После производства, жидкий водород находится в метастабильном состоянии и должен быть преобразован в параводородную форму, для того чтобы избежать взрывоопасной экзотермической реакции, которая имеет место при его изменении при низких температурах. Преобразование в параводородную фазу обычно производится с использованием таких катализаторов, как оксид железа, оксид хрома, активированный уголь, покрытых платиной асбестов, редкоземельных металлов или путем использования урановых или никелевых добавок.
ИспользованиеЖидкий водород может быть использован в качестве формы хранения топлива для двигателей внутреннего сгорания и топливных элементов. Различные подлодки(проекты «212А» и «214», Германия) и концепты водородного транспорта были созданы с использованием этой агрегатной формы водорода (см. например «DeepC»или «BMW h3R»). Благодаря близости конструкций, создатели техники на «ЖВ» могут использовать или только модифицировать системы, использующие сжиженный природный газ («СПГ»). Однако из-за более низкой объемной плотности энергии для горения требуется больший объем водорода, чем природного газа. Если жидкий водород используется вместо «СПГ» в поршневых двигателях, обычно требуется более громоздкая топливная система. При прямом впрыске увеличившиеся потери во впускном тракте уменьшают наполнение цилиндров.
например «DeepC»или «BMW h3R»). Благодаря близости конструкций, создатели техники на «ЖВ» могут использовать или только модифицировать системы, использующие сжиженный природный газ («СПГ»). Однако из-за более низкой объемной плотности энергии для горения требуется больший объем водорода, чем природного газа. Если жидкий водород используется вместо «СПГ» в поршневых двигателях, обычно требуется более громоздкая топливная система. При прямом впрыске увеличившиеся потери во впускном тракте уменьшают наполнение цилиндров.
Жидкий водород используется также для охлаждения нейтронов в экспериментах по нейтронному рассеянию. Массы нейтрона и ядра водорода практически равны, поэтому обмен энергией при упругом столкновении наиболее эффективен.
Преимущества
Преимуществом использования водорода является «нулевая эмиссия» его применения. Продуктом его взаимодействия с воздухом является вода.
ПрепятствияОдин литр «ЖВ» весит всего 0. 07 кг. То есть его удельная плотность составляет 70.99 г/л при 20 K. Жидкий водород требует криогенной технологии хранения, такой как специальные термически изолированные контейнеры и требует особого обращения, что свойственно для всех криогенных материалов. Он близок в этом отношении к жидкому кислороду, но требует большей осторожности из-за пожароопасности. Даже в случае с контейнерами с тепловой изоляцией, его тяжело содержать при той низкой температуре, которая требуется для его сохранения в жидком состоянии (обычно он испаряется со скоростью 1 % в день). При обращении с ним также нужно следовать обычным мерам безопасности при работе с водородом — он достаточно холоден для сжижения воздуха, что взрывоопасно.
07 кг. То есть его удельная плотность составляет 70.99 г/л при 20 K. Жидкий водород требует криогенной технологии хранения, такой как специальные термически изолированные контейнеры и требует особого обращения, что свойственно для всех криогенных материалов. Он близок в этом отношении к жидкому кислороду, но требует большей осторожности из-за пожароопасности. Даже в случае с контейнерами с тепловой изоляцией, его тяжело содержать при той низкой температуре, которая требуется для его сохранения в жидком состоянии (обычно он испаряется со скоростью 1 % в день). При обращении с ним также нужно следовать обычным мерам безопасности при работе с водородом — он достаточно холоден для сжижения воздуха, что взрывоопасно.
Жидкий водород является распространенным компонентом ракетных топлив, которое используется для реактивного ускорения ракет-носителей и космических аппаратов. В большинстве жидкостных ракетных двигателях на водороде, он сначала применяется для регенеративного охлаждения сопла и других частей двигателя, перед его смешиванием с окислителем и сжиганием для получения тяги. Используемые современные двигатели на компонентах H2/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульсадвигателя за счет уменьшения молекулярного веса, это еще сокращает эрозию сопла и камеры сгорания.
Используемые современные двигатели на компонентах H2/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульсадвигателя за счет уменьшения молекулярного веса, это еще сокращает эрозию сопла и камеры сгорания.
Такие препятствия использования «ЖВ» в других областях, как криогенная природа и малая плотность, являются также сдерживающим фактором для использования в данном случае. На 2009 год существует только одна ракета-носитель (РН «Дельта-4»), которая целиком является водородной ракетой. В основном «ЖВ» используется либо на верхних ступенях ракет, либо на блоках, которые значительную часть работы по выводу полезной нагрузки в космос выполняют в вакууме. В качестве одной из мер по увеличению плотности этого вида топлива существуют предложения использования шугообразного водорода, то есть полузамерзшей формы «ЖВ».
Водород (Hydrogene, H) — Актуальные публикации на сайте компании «НИИ КМ»
В периодической системе водород располагается в двух абсолютно противоположных по своим свойствам группах элементов. Данная особенность делают его совершенно уникальным. Водород не просто представляет собой элемент или вещество, но также является составной частью многих сложных соединений, органогенным и биогенным элементом. Поэтому рассмотрим его свойства и характеристики более подробно.
Данная особенность делают его совершенно уникальным. Водород не просто представляет собой элемент или вещество, но также является составной частью многих сложных соединений, органогенным и биогенным элементом. Поэтому рассмотрим его свойства и характеристики более подробно.
История открытия водорода
Выделение горючего газа в процессе взаимодействия металлов и кислот наблюдали еще в XVI веке, то есть во время становления химии как науки. Известный английский ученый Генри Кавендиш исследовал вещество, начиная с 1766 года, и дал ему название «горючий воздух». При сжигании этот газ давал воду. К сожалению, приверженность ученого теории флогистона (гипотетической «сверхтонкой материи») помешала ему прийти к правильным выводам.
Французский химик и естествоиспытатель А. Лавуазье вместе с инженером Ж. Менье и при помощи специальных газометров в 1783 г. провел синтез воды, а после и ее анализ посредством разложения водяного пара раскаленным железом. Таким образом, ученые смогли прийти к правильным выводам. Они установили, что «горючий воздух» не только входит в состав воды, но и может быть получен из нее.
Они установили, что «горючий воздух» не только входит в состав воды, но и может быть получен из нее.
В 1787 году Лавуазье выдвинул предположение, что исследуемый газ является простым веществом и, соответственно, относится к числу первичных химических элементов. Он назвал его hydrogene (от греческих слов hydor — вода + gennao — рождаю), т. е. «рождающий воду».
Русское название «водород» в 1824 году предложил химик М. Соловьев. Определение состава воды ознаменовало конец «теории флогистона». На стыке XVIII и XIX веков было установлено, что атом водорода очень легкий (по сравнению с атомами прочих элементов) и его масса была принята за основную единицу сравнения атомных масс, получив значение, равное 1.
Физические свойства
Водород является легчайшим из всех известных науке веществ (он в 14,4 раз легче воздуха), его плотность составляет 0,0899 г/л (1 атм, 0 °С). Данный материал плавится (затвердевает) и кипит (сжижается), соответственно, при -259,1 °С и -252,8 °С (только гелий обладает более низкими t° кипения и плавления).
Критическая температура водорода крайне низка (-240 °С). По этой причине его сжижение — довольно сложный и затратный процесс. Критическое давление вещества — 12,8 кгс/см², а критическая плотность составляет 0,0312 г/см³. Среди всех газов водород имеет наибольшую теплопроводность: при 1 атм и 0 °С она равняется 0,174 вт/(мхК).
Удельная теплоемкость вещества в тех же условиях — 14,208 кДж/(кгхК) или 3,394 кал/(гх°С). Данный элемент слабо растворим в воде (около 0,0182 мл/г при 1 атм и 20 °С), но хорошо — в большинстве металлов (Ni, Pt, Pa и прочих), особенно в палладии (примерно 850 объемов на один объем Pd).
С последним свойством связана его способность диффундирования, при этом диффузия через углеродистый сплав (к примеру, сталь) может сопровождаться разрушением сплава из-за взаимодействия водорода с углеродом (этот процесс называется декарбонизация). В жидком состоянии вещество очень легкое (плотность — 0,0708 г/см³ при t° = -253 °С) и текучее (вязкость — 13,8 спуаз в тех же условиях).
Химические свойства водорода
Во многих соединениях этот элемент проявляет валентность +1 (степень окисления), подобно натрию и прочим щелочным металлам. Обычно он рассматривается в качестве аналога этих металлов. Соответственно он возглавляет I группу системы Менделеева. В гидридах металлов ион водорода проявляет отрицательный заряд (степень окисления при этом -1), то есть Na+H- имеет структуру, подобную хлориду Na+Cl-. В соответствии с этим и некоторыми другими фактами (близость физических свойств элемента «H» и галогенов, способность его замещения галогенами в органических соединениях) Hydrogene относят к VII группе системы Менделеева.
В обычных условиях молекулярный водород имеет низкую активность, непосредственно соединяясь только с самыми активными из неметаллов (с фтором и хлором, с последним — на свету). В свою очередь, при нагревании он взаимодействует со многими химическими элементами.
Атомарный водород имеет повышенную химическую активность (если сравнивать с молекулярным). С кислородом он образует воду по формуле:
С кислородом он образует воду по формуле:
Н₂ + ½О₂ = Н₂О,
выделяя 285,937 кДж/моль тепла или 68,3174 ккал/моль (25 °С, 1 атм). В обычных температурных условиях реакция протекает довольно медленно, а при t° >= 550 °С — неконтролируемо. Пределы взрывоопасности смеси водород + кислород по объему составляют 4–94 % Н₂, а смеси водород + воздух — 4–74 % Н₂ (смесь из двух объемов Н₂ и одного объема О₂ называют гремучим газом).
Данный элемент используют для восстановления большинства металлов, так как он отнимает кислород у оксидов:
Fe₃O₄ + 4H₂ = 3Fe + 4Н₂О,
CuO + H₂ = Cu + H₂O и т. д.
С разными галогенами водород образует галогеноводороды, к примеру:
Н₂ + Cl₂ = 2НСl.
Однако при реакции с фтором водород взрывается (это происходит и в темноте, при -252 °С), с бромом и хлором реагирует только при нагревании или освещении, а с йодом — исключительно при нагревании. При взаимодействии с азотом образуется аммиак, но лишь на катализаторе, при повышенных давлениях и температуре:
ЗН₂ + N₂ = 2NН₃.
При нагревании водород активно реагирует с серой:
Н₂ + S = H₂S (сероводород),
и значительно труднее — с теллуром или селеном. С чистым углеродом водород реагирует без катализатора, но при высоких температурах:
2Н₂ + С (аморфный) = СН₄ (метан).
Данное вещество непосредственно реагирует с некоторыми из металлов (щелочными, щелочноземельными и прочими), образуя гидриды, например:
Н₂ + 2Li = 2LiH.
Немаловажное практическое значение имеют взаимодействия водорода и оксида углерода (II). При этом в зависимости от давления, температуры и катализатора образуются разные органические соединения: НСНО, СН₃ОН и пр. Ненасыщенные углеводороды в процессе реакции переходят в насыщенные, к примеру:
СnН₂n + Н₂ = СnН₂n₊₂.
Водород и его соединения играют в химии исключительную роль. Он обусловливает кислотные свойства т. н. протонных кислот, склонен образовывать с разными элементами водородную связь, оказывающую значительное влияние на свойства многих неорганических и органических соединений.
Получение водорода
Основными видами сырья для промышленного производства этого элемента являются газы нефтепереработки, природные горючие и коксовые газы. Его также получают из воды посредством электролиза (в местах с доступной электроэнергией). Одним из важнейших методов производства материала из природного газа считается каталитическое взаимодействие углеводородов, в основном метана, с водяным паром (т. н. конверсия). Например:
СН₄ + H₂О = СО + ЗН₂.
Неполное окисление углеводородов кислородом:
СН₄ + ½О₂ = СО + 2Н₂.
Синтезированный оксид углерода (II) подвергается конверсии:
СО + Н₂О = СО₂ + Н₂.
Водород, производимый из природного газа, является самым дешевым.
Для электролиза воды применяется постоянный ток, который пропускается через раствор NaOH или КОН (кислоты не используют во избежание коррозии аппаратуры). В лабораторных условиях материал получают электролизом воды или в результате реакции между соляной кислотой и цинком. Однако чаще применяют готовый заводской материал в баллонах.
Из газов нефтепереработки и коксового газа данный элемент выделяют путем удаления всех остальных компонентов газовой смеси, так как они легче сжижаются при глубоком охлаждении.
Применение водорода
Промышленным образом этот материал стали получать еще в конце XVIII века. Тогда его использовали для наполнения воздушных шаров. На данный момент водород широко применяют в промышленности, главным образом — в химической, для производства аммиака.
Массовые потребители вещества — производители метилового и прочих спиртов, синтетического бензина и многих других продуктов. Их получают синтезом из оксида углерода (II) и водорода. Hydrogene используют для гидрогенизации тяжелого и твердого жидкого топлива, жиров и пр., для синтеза HCl, гидроочистки нефтепродуктов, а также в резке/сварке металлов. Важнейшими элементами для атомной энергетики являются его изотопы — тритий и дейтерий.
Биологическая роль водорода
Около 10 % массы живых организмов (в среднем) приходится на этот элемент. Он входит в состав воды и важнейших групп природных соединений, включая белки, нуклеиновые кислоты, липиды, углеводы. Для чего он служит?
Он входит в состав воды и важнейших групп природных соединений, включая белки, нуклеиновые кислоты, липиды, углеводы. Для чего он служит?
Этот материал играет решающую роль: при поддержании пространственной структуры белков (четвертичной), в осуществлении принципа комплиментарности нуклеиновых кислот (т. е. в реализации и хранении генетической информации), вообще в «узнавании» на молекулярном уровне.
Ион водорода Н+ принимает участие в важных динамических реакциях/процессах в организме. В том числе: в биологическом окислении, которое обеспечивает живые клетки энергией, в реакциях биосинтеза, в фотосинтезе у растений, в бактериальном фотосинтезе и азотфиксации, в поддержании кислотно-щелочного баланса и гомеостаза, в мембранных процессах транспорта. Наряду с углеродом и кислородом он образует функциональную и структурную основы явлений жизни.
Разложение воды на водород. Ученые обнаружили простой способ получения водорода из воды. Перспективы и проблемы водородной энергетики
В данной статье поговорим про разрыв молекул воды и Закон сохранения энергии. В конце статьи эксперимент для дома.
В конце статьи эксперимент для дома.
Нет никакого смысла изобретать установки и устройства по разложению молекул воды на водород и кислород не учитывая Закон сохранения энергии. Предполагается, что возможно создать такую установку, которая на разложение воды будет затрачивать меньшее количество энергии, чем та энергия, которая выделяется в процессе сгорания (соединения в молекулу воды). В идеале, структурно, схема разложения воды и соединение кислорода и водорода в молекулу будет иметь циклический (повторяющийся) вид.
Изначально, имеется химическое соединение – вода (H 2
O). Для её разложения на составляющие – водород (Н) и кислород (О) необходимо приложить определённое количество энергии. Практически, источником этой энергии может быть аккумуляторная батарея автомобиля. В результате разложения воды образуется газ, состоящий в основном из молекул водорода (Н) и кислорода (О). Одни, называют его «Газ Брауна», другие говорят, что выделяющийся газ, ничего не имеет общего с Газом Брауна. Думаю, нет необходимости рассуждать и доказывать, как называется этот газ, ведь это не важно, пускай этим занимаются философы.
Думаю, нет необходимости рассуждать и доказывать, как называется этот газ, ведь это не важно, пускай этим занимаются философы.
Газ, вместо бензина поступает в цилиндры двигателя внутреннего сгорания, где посредством искры от свечей системы зажигания воспламеняется. Происходит химическое соединение водорода и кислорода в воду, сопровождаемое резким выделением энергии взрыва, заставляющего двигатель работать. Вода, образованная в процессе химического соединения, выпускается из цилиндров двигателя в виде пара через выпускной коллектор.
Важным моментом является возможность повторного использования воды для процесса разложения на составляющие – водород (Н) и кислород (О), образованной в результате сгорания в двигателе. Ещё раз посмотрим на «цикл» круговорота воды и энергии. На разрыв воды, которая находится в устойчивом химическом соединении, затрачивается определённое количество энергии. В результате сгорания, наоборот выделяется определённое количество энергии. Выделяемая энергия может быть грубо рассчитана на «молекулярном» уровне. Из-за особенностей оборудования, затрачиваемую на разрыв энергию рассчитать сложнее, её проще измерить. Если пренебречь качественными характеристиками оборудования, потерями энергии на нагрев, и другими немаловажными показателями, то в результате расчётов и измерений, если они проведены правильно, окажется, что затраченная и выделенная энергии равны друг другу. Это подтверждает Закон сохранения энергии, который утверждает, что энергия никуда не пропадает и не появляется «из пустоты», она лишь переходит в другое состояние. Но мы хотим использовать воду как источник дополнительной «полезной» энергии. Откуда эта энергия вообще может взяться? Энергия тратится не только на разложение воды, но и на потери, учитывающие КПД установки по разложению и КПД двигателя. А мы хотим получить «круговорот», в котором энергии больше выделяется, чем затрачивается.
Выделяемая энергия может быть грубо рассчитана на «молекулярном» уровне. Из-за особенностей оборудования, затрачиваемую на разрыв энергию рассчитать сложнее, её проще измерить. Если пренебречь качественными характеристиками оборудования, потерями энергии на нагрев, и другими немаловажными показателями, то в результате расчётов и измерений, если они проведены правильно, окажется, что затраченная и выделенная энергии равны друг другу. Это подтверждает Закон сохранения энергии, который утверждает, что энергия никуда не пропадает и не появляется «из пустоты», она лишь переходит в другое состояние. Но мы хотим использовать воду как источник дополнительной «полезной» энергии. Откуда эта энергия вообще может взяться? Энергия тратится не только на разложение воды, но и на потери, учитывающие КПД установки по разложению и КПД двигателя. А мы хотим получить «круговорот», в котором энергии больше выделяется, чем затрачивается.
Я не привожу здесь конкретные цифры, учитывающие затраты и выработку энергии. Один из посетителей моего сайта прислал мне на Майл книгу Канарёва, за что я ему очень благодарен, в которой популярно разложены «подсчёты» энергии. Книга является очень полезной, и пара последующих статей моего сайта будет посвящена именно исследованиям Канарёва. Некоторые посетители моего сайта утверждают, что я своими статьями противоречу молекулярной физике, поэтому в своих последующих статьях я приведу на мой взгляд — основные результаты исследований молекулярщика — Канарёва, которые моей теории не противоречат, а даже наоборот подтверждают моё представление о возможности низкоамперного разложения воды.
Один из посетителей моего сайта прислал мне на Майл книгу Канарёва, за что я ему очень благодарен, в которой популярно разложены «подсчёты» энергии. Книга является очень полезной, и пара последующих статей моего сайта будет посвящена именно исследованиям Канарёва. Некоторые посетители моего сайта утверждают, что я своими статьями противоречу молекулярной физике, поэтому в своих последующих статьях я приведу на мой взгляд — основные результаты исследований молекулярщика — Канарёва, которые моей теории не противоречат, а даже наоборот подтверждают моё представление о возможности низкоамперного разложения воды.
Если считать, что вода, используемая для разложения – это самое устойчивое, конечное химическое соединение, и её химические и физические свойства такие же, как у воды, высвобождаемой в виде пара из коллектора двигателя внутреннего сгорания, то какими производительными установки по разложению не были, нет смысла пытаться получать дополнительную энергию из воды. Это противоречит Закону сохранения энергии. И тогда, все попытки использовать воду в качестве источника энергии — бесполезны, а все статьи и публикации на эту тему не более чем заблуждения людей, или просто — обман.
И тогда, все попытки использовать воду в качестве источника энергии — бесполезны, а все статьи и публикации на эту тему не более чем заблуждения людей, или просто — обман.
Любое химическое соединение при определённых условиях распадается или соединяется вновь. Условием для этого может служить физическая среда, в которой находится это соединение – температура, давление, освещённость, электрическое, или магнитное воздействие, либо наличие катализаторов, других химических веществ, или соединений. Воду можно назвать аномальным химическим соединением, обладающую свойствами, не присущими всем остальным химическим соединениям. К этим свойствам (в том числе) относятся реакции на изменения температуры, давления, электрического тока. В естественных Земных условиях, вода – устойчивое и «конечное» химическое соединение. В этих условиях имеется определённая температура, давление, отсутствует какое либо магнитное, или электрическое поле. Существует много попыток и вариантов изменить эти естественные условия для того, чтобы разложить воду. Из них, наиболее привлекательно выглядит разложение посредством воздействия электрического тока. Полярная связь атомов в молекулах воды настолько сильна, что можно пренебречь магнитным полем Земли, которое не оказывает никакого влияния на молекулы воды.
Из них, наиболее привлекательно выглядит разложение посредством воздействия электрического тока. Полярная связь атомов в молекулах воды настолько сильна, что можно пренебречь магнитным полем Земли, которое не оказывает никакого влияния на молекулы воды.
Небольшое отступление от темы:
Есть предположение определённых деятелей науки, что Пирамиды Хеопса не что иное, как огромные установки для концентрации энергии Земли, которую неизвестная нам цивилизация использовала для разложения воды. Узкие наклонные тоннели в Пирамиде, назначение которых до настоящего времени не раскрыто, могли использоваться для движения воды и газов. Вот такое «фантастическое» отступление.
Продолжим. Если воду поместить в поле мощного постоянного магнита, ничего не произойдёт, связь атомов будет по-прежнему сильнее этого поля. Электрическое поле, образованное мощным источником электрического тока, приложенное к воде посредством электродов, погруженных в воду, вызывает электролиз воды (разложение на водород и кислород). При этом, затраты энергии источника тока огромны — не сопоставимы с энергией, которую можно получить от обратного процесса соединения. Здесь и возникает задача минимизировать затраты энергии, но для этого необходимо понять как происходит процесс разрыва молекул и на чём можно «сэкономить».
При этом, затраты энергии источника тока огромны — не сопоставимы с энергией, которую можно получить от обратного процесса соединения. Здесь и возникает задача минимизировать затраты энергии, но для этого необходимо понять как происходит процесс разрыва молекул и на чём можно «сэкономить».
Для того, чтобы верить в возможность использования воды, как источника энергии мы должны «оперировать» не только на уровне единичных молекул воды, а так же на уровне соединения большого числа молекул за счёт их взаимного притяжения и дипольного ориентирования. Мы должны учитывать межмолекулярные взаимодействия. Возникает резонный вопрос: Почему? А потому, что перед разрывом молекул необходимо их сначала сориентировать. Это, так же является ответом на вопрос «Почему в обычной электролизёрной установке используется постоянный электрический ток, а переменный – не работает?».
В соответствии с кластерной теорией, молекулы воды имеют положительные и отрицательные магнитные полюса. Вода в жидком состоянии имеет не плотную структуру, поэтому молекулы в ней, притягиваясь разноимёнными полюсами и отталкиваясь одноимёнными, взаимодействуют друг с другом, образуя кластеры. Если для воды, находящейся в жидком состоянии, представить оси координат и попытаться определить в каком направлении этих координат больше ориентированных молекул, у нас ничего не получится, потому что ориентация молекул воды без дополнительного внешнего воздействия — хаотична.
Если для воды, находящейся в жидком состоянии, представить оси координат и попытаться определить в каком направлении этих координат больше ориентированных молекул, у нас ничего не получится, потому что ориентация молекул воды без дополнительного внешнего воздействия — хаотична.
В твёрдом состоянии (состоянии льда) вода имеет структуру упорядоченных и точно ориентированных определённым образом друг относительно друга молекул. Сумма магнитных полей шести молекул H 2 O в состоянии льда в одной плоскости равна нулю, а связь с соседними «шестёрками» молекул в кристалле льда приводит к тому, что в целом, в определённом объёме (куске) льда отсутствует какая либо «общая» полярность.
Если лёд растает от повышения температуры, то многие связи молекул воды в «решётке» разрушатся и вода станет жидкой, но всё равно «разрушение» будет не полным. Большое количество связей молекул воды в «шестёрки» сохранится. Такая талая вода называется «структурированной», является полезной для всего живого, но для разложения на водород и кислород не подходит потому, что необходимо будет тратить дополнительную энергию на разрыв межмолекулярных связей, затрудняющих ориентацию молекул перед их «разрывом». Значительная потеря кластерных связей в талой воде произойдёт позже, естественным путём.
Значительная потеря кластерных связей в талой воде произойдёт позже, естественным путём.
Если в воде имеются химические примеси (соли, или кислоты), то эти примеси препятствуют соединению соседних молекул воды в кластерную решётку, отнимая у структуры воды водородные и кислородные связи, чем при низких температурах нарушают «твёрдую» структуру льда. Всем известно, что растворы кислотных и щелочных электролитов не замерзают при отрицательных температурах так же, как и солёная вода. Благодаря наличию примесей, молекулы воды становятся легко ориентируемыми под действием внешнего электрического поля. Это с одной стороны хорошо, не надо тратить лишнюю энергию на полярную ориентацию, но с другой стороны это плохо, потому, что эти растворы хорошо проводят электрический ток и в результате этого, в соответствии с Законом Ома, амплитуда тока необходимая на разрыв молекул оказывается значительной. Низкое межэлектродное напряжение приводит к низкой температуре электролиза, поэтому такая вода используется в электролизёрных установках, но для «лёгкого» разложения такая вода не годится.
Какая же вода должна применяться? Вода должна иметь минимальное количество межмолекулярных связей – для «лёгкости» полярной ориентации молекул, не должна иметь химических примесей, увеличивающих её проводимость – для уменьшения тока, используемого для разрыва молекул. Практически, такой воде соответствует дистиллированная вода.
Вы можете провести простой эксперимент сами
Налейте свеже-дистиллированную воду в пластиковую бутылку. Поместите бутылку в морозильную камеру. Выдержите бутылку около двух-трёх часов. Когда Вы достанете бутылку из морозильной камеры (трясти бутылкой нельзя), Вы увидите, что вода находится в жидком состоянии. Откройте бутылку и тонкой струйкой выливайте воду на наклонную поверхность из нетеплопроводного материала (например — широкую деревянную доску). На Ваших глазах вода будет превращаться в лёд. Если в бутылке осталась вода, закройте крышку, резким движением ударьте дном бутылки о стол. Вода в бутылке резко превратится в лёд.
Эксперимент может не получиться, если дистилляция воды была произведена более пяти суток назад, некачественно, или подвергалась тряске, в результате чего, в ней появились кластерные (межмолекулярные) связи. Время выдержки в морозильной камере, зависит от самой морозильной камеры, что так же может повлиять на «чистоту» эксперимента.
Время выдержки в морозильной камере, зависит от самой морозильной камеры, что так же может повлиять на «чистоту» эксперимента.
Этот эксперимент подтверждает, что минимальное количество межмолекулярных связей именно в дистиллированной воде.
Ещё один важный аргумент в пользу дистиллированной воды: Если Вы видели, как работает электролизёрная установка, то знаете, что использование водопроводной (даже очищенной через фильтр) воды загрязняет электролизёр так, что без регулярной его чистки снижается эффективность электролиза, а частая чистка сложного оборудования – лишние трудозатраты, да и оборудование из-за частых сборок – разборок придёт в негодное состояние. Поэтому даже и не думайте использовать для разложения на водород и кислород водопроводную воду. Стэнли Мэйер использовал водопроводную воду только для демонстрации, чтобы показать какая «крутая» у него установка.
Чтобы понять то, к чему нам необходимо стремиться, мы должны понять физику процессов, происходящих с молекулами воды во время воздействия электрического тока. В следующей статье мы вкратце, без «заумной нагрузки на мозг» ознакомимся с
В следующей статье мы вкратце, без «заумной нагрузки на мозг» ознакомимся с
Разделение воды, с целью получения водорода, является «священным Граалем» многих ученых, ведущих работы в направлении разработки практически неисчерпаемого источника экологически чистой энергии. Теперь, благодаря исследования ученых университета Монаша (Monash University) в Австрии, этот процесс будет реализовать гораздо проще, чем считалось ранее. Согласно профессору Леоне Спиччиа (Leone Spiccia), ключом к водородной энергетике будущего может стать природный минерал бернессит (Birnessite), который в природе придает черную окраску некоторым горным породам.
«Камнем преткновения процесса получения водорода является собственно разложение воды на кислород и водород. Используя традиционные способы на разрушение химических связей требуется очень много энергии, что делает эти процессы экономически невыгодными. Наша команда разработала процесс расщепления молекулы воды, основанный на марганцесодержащем катализаторе и использующий для этого солнечный свет» — говорит профессор Спиччиа. — «Основой минерала бернессита является марганец, который, как и все элементы из середины периодической системы, может существовать в нескольких состояниях, которые химики называют степенями окисления. Это соответствует количеству атомов кислорода, с которыми связан атом вещества».
— «Основой минерала бернессита является марганец, который, как и все элементы из середины периодической системы, может существовать в нескольких состояниях, которые химики называют степенями окисления. Это соответствует количеству атомов кислорода, с которыми связан атом вещества».
Изначально ученые пытались использовать весьма сложные катализаторы на основе того же марганца. После того, как им удалось получить достаточно эффективный каталитический процесс разложения воды на водород и кислород, используя электрический ток, они, используя совершенные спектроскопические методы анализа, обнаружили, что использованный ими сложный катализатор преобразовался в более простое соединение, аналогом которого является природный минерал бернессит. Работа этого катализатора полностью повторяет процессы, на которых основывается процесс расщепления воды под воздействием солнечных лучей в природе.
«Эти исследования позволили нам проникнуть глубже в тайны природы и выяснить как в действительности в природе работает естественный марганцевый катализатор» — рассказывает доктор Розали Хокинг (Dr Rosalie Hocking) из Австралийского центра изучения электроматериалов (Australian Centre for Electromaterials Science). — «Ученые приложили большие усилия к созданию сложных марганцесодержащих молекул для того что бы получить эффективный катализатор. Но все оказалось гораздо проще, самой большой эффективностью в области расщепления воды обладает естественный материал, который достаточно устойчив, что бы выдержать жесткие физические и химические нагрузки во время его использования».
— «Ученые приложили большие усилия к созданию сложных марганцесодержащих молекул для того что бы получить эффективный катализатор. Но все оказалось гораздо проще, самой большой эффективностью в области расщепления воды обладает естественный материал, который достаточно устойчив, что бы выдержать жесткие физические и химические нагрузки во время его использования».
Пока отвечу на вопросы.
С известняком пробовал – экономия не 300% а 20%.
Конечно я слишком упрощённо говорю – вода горит. Какая там вода? Там даже не пар!
Там на выходе уже газ – ВОДЯНОЙ ГАЗ! О горении которого известно уже 150 лет!
Вы что хотели в моей печки видеть факел? Я же сказал подача у меня слабая да и дырка большая – отверстия у меня по бокам 2мм, а сейчас трубка прогорела и давление слабое но эффект то виден!
Теперь о мировоззренческой психологии.
Вадим и другие, поймите что есть сила которая не хочет что бы люди ездили на воде и вместо угля, газа и дров топили водой.Это целые корпорации. И всем известно что при РАН есть специальный отдел уводящий в сторону тех кто близок к раскрытии «государственной тайны».
У них целый интернет цех который все силы бросил на эту ветку. В течении суток они мгновенно! Отвечают флудом на мои посты! Ты что не видишь!
Вначале просто грязью пытаются пресечь тему, потом просто флудом пытаются увести в сторону, понимая, что в таком случае нормальные люди – специалисты своего дела, участвовать не будут. А флуд размывает, рассеивает конструктивные вопросы отвлекая от сути.
Я предлагаю очистить от шлака до 2х стр. эту ветку и она станет ЗОЛОТОЙ на этом сайте, заблокировать хающих крикунов, которые знакомы лишь со школьной программой, но не знают что о горении Водяного газа было известно ещё 150 лет назад!
И тогда прейдут профессионалы умеющие обрабатывать металл – и начнём работать, хотя я уже начал…
И опять одно и то же о энергозатратах! Я то предлагаю подумать о том как это сделать без затрат, ведь в газогенераторах 200С в среднем вылетает в трубу.
Вообщем без психологических и философских аспектов делов не будит. Вадим – решай, или шлак или золото! И пойми мы затронули такую тему что на нас кинули всю армаду спецов, стоящих на защите нефтегазовой мафии.
И ещё в сотый раз повторяю, я ничего нового не придумал – это старо как мир, а вот с катализаторами………Не хотел вмешиваться, но придется.
Вадиму, модератору.
Когда прекратится клевета на науку, на нашу АН со стороны этого пользователя?
Сколько можно глумиться над здравым смыслом, над нашими предшественниками потом и кровью поливших алтарь науки?
Когда прекратится это шаманство?
Почему вы потакаете этом поруганию всех и вся?0 alex 0 сказал(а):
По моему на видео все видно и такДа, на видео четко видно, что исходящий из трубки пар эжектирует за собой воздух и этот воздух раздувает угли. Ни больше и не меньше.
Нет, это не фантастика. Это действительно факт.
Первая ссылка иллюстрирует как в 19 веке получали водород для дирижаблей. Несколько тонн угля при сжигании выдавали на гора до килограмма водорода… Несопоставимые по энергии вещи. В многие десятки раз больше энергии тратилось на получение водорода, чем можно было бы получить, если его сжигать…
Но вы эти факты тянете за уши, притягиваете из области реалий в область мечтаний…
Природу не обманешь. Закон сохранения энергии никто не отменял.
Водород — самое экологически чистое топливо на Земле: при его сгорании образуется только вода. В качестве энергоносителя водород можно использовать для получения электричества и тепла в промышленности, в быту, на транспорте. В частности, с помощью водородных топливных элементов, в которых происходит прямое преобразование химической энергии в электричество, уже созданы опытные образцы электромобилей (см. «Наука и жизнь № ). Существует также много способов безопасного хранения и транспортировки водорода. А не нанесут ли вреда природе технологические процессы получения водорода?
В настоящее время водород в промышленных масштабах получают паровой конверсией метана (природного газа). При температуре 750-850 о С в присутствии водяного пара метан и вода расщепляются на водород и монооксид углерода, затем при 200-250°С происходит превращение монооксида углерода и воды в водород и диоксид углерода. Оба процесса эндотермические, и для их поддержания приходится сжигать около половины объема исходного газа, из-за чего экологический эффект оказывается очень низким.
При температуре 750-850 о С в присутствии водяного пара метан и вода расщепляются на водород и монооксид углерода, затем при 200-250°С происходит превращение монооксида углерода и воды в водород и диоксид углерода. Оба процесса эндотермические, и для их поддержания приходится сжигать около половины объема исходного газа, из-за чего экологический эффект оказывается очень низким.
Предлагается использовать для нагрева и подвода тепла высокотемпературные ядерные реакторы с гелиевым теплоносителем. Таким образом можно экономить углеводородное сырье и поставлять на рынки развивающихся стран водородное топливо вместо ядерных реакторов.
Дальнейшее развитие атомно-водородной энергетики пойдет по пути использования в качестве сырья не метана, а воды. Здесь могут быть использованы электролиз, а также термохимические и комбинированные методы получения водорода.
Известный способ термического разложения воды, которое происходит при температуре 2500°С, вряд ли применим, поскольку сложно предотвратить последующую рекомбинацию молекул воды. Однако возможен термохимический процесс разложения воды при температурах порядка 1000°С в присутствии соединений брома и йода. Правда, здесь требуется подведение тепла, и кпд составляет около 50%. На отдельных стадиях процесса наряду с термическим воздействием используется электролиз.
Однако возможен термохимический процесс разложения воды при температурах порядка 1000°С в присутствии соединений брома и йода. Правда, здесь требуется подведение тепла, и кпд составляет около 50%. На отдельных стадиях процесса наряду с термическим воздействием используется электролиз.
Электролитический водород получить проще всего, но экономически это невыгодно: на получение одного кубометра водорода требуется 4,8 киловатт-часа энергии. Если проводить электролиз перегретого пара, то эффективность процесса повышается, и на получение кубометра водорода уходит около 2,5 киловатт-часа.
В настоящее время «Курчатовский институт» и американская компания «GA» совместно разрабатывают очень перспективный проект газовой турбины-модульного гелиевого реактора. При генерации электричества с использованием прямого газотурбинного цикла можно достичь кпд, равного 50%.
Бесс Руфф — аспирантка из Флориды, работает над получением степени PhD по географии. Получила степень магистра экологии и менеджмента в Бренской школе экологии и менеджмента Калифорнийского университета в Санта-Барбаре в 2016 году.
Количество источников, использованных в этой статье: . Вы найдете их список внизу страницы.
Процесс расщепления воды (H 2 O) на ее составляющие (водород и кислород) с помощью электричества называется электролизом. Полученные в результате электролиза газы можно использовать сами по себе — например, водород служит одним из чистейших источников энергии. Хотя название данного процесса, возможно, и звучит несколько заумно, на самом деле это проще, чем может показаться, если у вас есть подходящее оборудование, знания и немного опыта.
Шаги
Часть 1
Подготовьте оборудование
Возьмите стакан объемом 350 миллилитров и налейте в него теплую воду. Нет необходимости заполнять стакан до краев, хватит небольшого количества воды. Подойдет и холодная вода, хотя теплая лучше проводит электричество.
- Подойдет как водопроводная, так и бутилированная вода.
- Теплая вода имеет меньшую вязкость , благодаря чему в ней легче перемещаются ионы.

Растворите в воде 1 столовую ложку (20 граммов) поваренной соли. Насыпьте в стакан соль и перемешайте воду, чтобы она растворилась. В результате у вас получится солевой раствор.
- Хлорид натрия (то есть поваренная соль) является электролитом, который увеличивает электропроводность воды. Сама по себе вода плохо проводит электричество.
- После того как вы повысите электропроводность воды, созданный батарейкой ток будет легче проходить через раствор и эффективнее расщеплять молекулы на водород и кислород.
Заточите два твердо-мягких карандаша с обоих концов, чтобы обнажился графитовый стержень. Не забудьте снять с карандашей ластик. На обоих концах должен выступить графитовый стержень.
- Графитовые стержни послужат изолированными электродами, к которым вы подключите батарейку.
- Графит хорошо подходит для данного эксперимента, поскольку он не растворяется и не корродирует в воде.
Вырежьте достаточно большой лист картона, чтобы его можно было положить поверх стакана.
 Используйте довольно толстый картон, который не провиснет после того, как вы проделаете в нем два отверстия. Вырежьте квадратный кусок из коробки для обуви или чего-нибудь подобного.
Используйте довольно толстый картон, который не провиснет после того, как вы проделаете в нем два отверстия. Вырежьте квадратный кусок из коробки для обуви или чего-нибудь подобного.- Картон нужен для того, чтобы удерживать карандаши в воде, так чтобы они не касались стенок и дна стакана.
- Картон не проводит ток, поэтому его можно без опаски положить на стакан.
Проделайте с помощью карандашей два отверстия в картоне. Проткните картон карандашами — в этом случае они окажутся плотно зажатыми и не будут выскальзывать. Проследите, чтобы графит не касался стенок или дна стакана, иначе это помешает провести эксперимент.
Часть 2
Проведите экспериментПодсоедините к каждой клемме батарейки по одному проводу с зажимами «крокодил». Источником электрического тока послужит батарейка, и через провода с зажимами и графитовые стержни ток достигнет воды. Подключите один провод с зажимом к положительному, а второй — к отрицательному полюсу батарейки.

- Используйте 6-вольтовую батарейку. Если у вас нет такой батарейки, вместо нее можно взять 9-вольтовую батарейку.
- Подходящую батарейку можно приобрести в магазине электрических товаров или супермаркете.
Подсоедините вторые концы проводов к карандашам. Как следует закрепите металлические зажимы проводов на графитовых стержнях. Возможно, придется счистить с карандашей еще немного дерева, чтобы зажимы не соскальзывали с графитовых стержней.
- Таким образом вы замкнете цепь, и через воду потечет ток от батарейки.
Положите картон на стакан так, чтобы свободные концы карандашей погрузились в воду. Лист картона должен быть достаточно большим, чтобы устойчиво лежать на стакане. Действуйте аккуратно, чтобы не нарушить правильное расположение карандашей.
- Чтобы эксперимент удался, графит не должен касаться стенок и дна стакана. Еще раз проверьте это и при необходимости поправьте карандаши.
Понаблюдайте, как вода расщепляется на водород и кислород.
 От опущенных в воду графитовых стержней начнут подниматься пузырьки газа. Это водород и кислород. Водород будет выделяться на отрицательном, а кислород — на положительном полюсе.
От опущенных в воду графитовых стержней начнут подниматься пузырьки газа. Это водород и кислород. Водород будет выделяться на отрицательном, а кислород — на положительном полюсе.- Как только вы подключите провода к батарейке и графитовым стержням, через воду потечет электрический ток.
- Больше пузырьков газа будет образовываться на том карандаше, который подсоединен к отрицательному полюсу, поскольку каждая молекула воды состоит из двух атомов водорода и одного атома кислорода.
- Если у вас нет карандашей с графитовыми стержнями, вместо них можно использовать две небольшие проволочки. Просто оберните одним концом каждой проволочки соответствующий полюс батарейки, а второй опустите в воду. Получится тот же результат, что и с карандашами.
- Попробуйте использовать другую батарейку. От вольтажа батарейки зависит величина протекающего тока, которая, в свою очередь, влияет на скорость расщепления молекул воды.
Предупреждения
- Если вы добавите в воду электролит, например соль, то учтите, что в ходе эксперимента будет образовываться небольшое количество такого побочного продукта, как хлор.
 В таких малых количествах он безопасен, однако вы можете почувствовать легкий запах хлора.
В таких малых количествах он безопасен, однако вы можете почувствовать легкий запах хлора. - Проводите данный эксперимент под наблюдением взрослых. Он связан с электричеством и газами, поэтому может представлять опасность, хотя это маловероятно.
Как производить водород?
Перейти к основному содержанию
- Чистая транспортировка
- Энергии
- Логистика
- Ресурсы
- О нас
- Связаться с нами
Чистый транспорт
Открытый- Пассажирский транспорт
- Автомобильный грузовой транспорт
Пассажирский транспорт
Открытый- Водородная энергетика для транспортных средств
- Природный газ для легковых автомобилей
- Водородная энергия для аэрокосмической промышленности
Грузовой автомобильный транспорт
Открытый- Природный газ для грузовых автомобилей
- Рефрижераторный транспорт с blueeze
Энергетика
Открытая- Утилизация отходов
- Чистое энергоснабжение
- Вне сети
- Устойчивые решения для нефтегазовой отрасли
Чистая энергия
Открыть- Биометан
- Чистый водород
Автономный
Открытый- Сжиженный природный газ
- Завод по сжижению
Логистика
Открытая- Логистическая платформа
Ресурсы
Открыть- Документация
- Видеотека
- Планета Водород
Планета Водород
Открыть- Как производить водород?
- Как хранится водород?
- Использование водорода
- Чистая транспортировка
- Топливный элемент
- Стационарное использование
- Вектор чистой энергии
Быстрый доступ
- Паспорт безопасности
- Криоскоп
О нас
Открыто- Глобальные рынки и технологии
- Рынки
- Аксан
- Карьера
- Пресс
Пресса
Открыто- Центр новостей
- Пресс-кит
Быстрый доступ
- Группа Air Liquide
- Ресурсы org/Breadcrumb»> Планета Водород
- Как производить водород?
Как хранится водород ?Использование водородаЧистый транспортТопливный элементСтационарное использованиеВектор чистой энергии
В изобилии присутствующий на Солнце газообразный водород почти отсутствует в нашей собственной атмосфере. Поэтому он должен быть извлечен из молекул, которые его содержат, таких как вода и органические соединения.
Из органических соединений
Водород вместе с углеродом является основным компонентом всех органических соединений, включая углеводороды и биомассу.
Биогаз будущего, Спридлингтон, АнглияИзвлечение водорода из органических соединений требует разрыва твердых связей между углеродом и водородом. Это, в свою очередь, требует использования ряда высокотемпературных химических реакций при высокой температуре, часто в присутствии катализаторов.
Одной из используемых технологий является риформинг, который заключается в проведении реакции между метаном и водой для получения синтез-газа, содержащего водород. Это основная технология, используемая в промышленном производстве водорода. Источниками являются природный газ и биогаз.
Это основная технология, используемая в промышленном производстве водорода. Источниками являются природный газ и биогаз.
Газификация — это еще один процесс преобразования твердого соединения в газ, богатый водородом. Источниками в основном являются уголь и биомасса.
Эти технологии производства водорода являются выбросами CO 2 . Использование возобновляемых источников, включая биомассу и биогаз (из биомассы или отходов), или сочетание с технологиями улавливания и хранения CO 2 может привести к уменьшению углеродного следа производства.
Риформинг природного газа
Природный газ, состоящий в основном из метана (CH 4 ), содержит серу, которую необходимо удалить на стадии гидрообессеривания. После очистки метан реагирует с водяным паром с образованием синтез-газа, содержащего монооксид углерода (CO) и водород (H 2 ). Затем водяной пар реагирует с монооксидом углерода синтез-газа с образованием диоксида углерода (CO 2 ) и большего количества водорода. Эта смесь, богатая CO 2 и H 2 , затем очищается с получением примерно 99,9% водорода.
Эта смесь, богатая CO 2 и H 2 , затем очищается с получением примерно 99,9% водорода.
Водородная энергетика
Ваш браузер не поддерживает видео тег.Путем разложения воды
Разделение молекул воды на компоненты позволяет производить водород. Молекулы воды (H 2 O) состоят из двух атомов водорода (H) и одного атома кислорода (O). Для получения водорода необходимо разорвать связи этой молекулы. Существуют различные процессы с использованием электрического тока или последовательности химических реакций.
На Земле самым важным источником водорода является вода, которая покрывает более 70% ее поверхности.
Электролиз воды
Электрический ток разлагает молекулу воды на ионы гидроксида (OH)- на катоде и на протоны H+ на аноде. Протоны принимают электроны в реакции окисления, образуя газообразный водород.
Сам электролиз не выделяет CO 2 . Но в общем расчете необходимо учитывать производство электроэнергии. В случае, когда используемая электроэнергия производится из источников, не выделяющих CO 2 (возобновляемые источники энергии и т. д.), водород будет производиться без выделения парниковых газов. Этот метод обычно используется для производства небольших объемов водорода или вблизи недорогих источников электроэнергии (гидроэлектроэнергия). В настоящее время проводится множество исследований по повышению эффективности электролиза. Одной из областей усовершенствования является высокотемпературный электролиз водяного пара.
Но в общем расчете необходимо учитывать производство электроэнергии. В случае, когда используемая электроэнергия производится из источников, не выделяющих CO 2 (возобновляемые источники энергии и т. д.), водород будет производиться без выделения парниковых газов. Этот метод обычно используется для производства небольших объемов водорода или вблизи недорогих источников электроэнергии (гидроэлектроэнергия). В настоящее время проводится множество исследований по повышению эффективности электролиза. Одной из областей усовершенствования является высокотемпературный электролиз водяного пара.
При высокотемпературном паровом электролизе используется меньше энергии, поскольку, поскольку реакция происходит при температуре от 700 °C до 1 000 °C, производительность элемента (кинетика) значительно улучшается. Эта технология может, например, сочетаться с набором солнечных зеркал, которые концентрируют солнечные лучи для достижения очень высоких температур, что позволит производить водород практически без парниковых газов.
ch3ange — Можем ли мы хранить энергию солнца и ветра?
ch3ange – инициатива группы Air Liquide в социальных сетях. Этот проект вращается вокруг той роли, которую водород может сыграть в энергетическом переходе. Станьте частью перемен. Присоединяйтесь к нам на ch3ange.
Термохимические циклы
Термохимические циклы связаны с явлением разложения воды на водород и кислород, которое происходит самопроизвольно при очень высокой температуре. Это разложение может осуществляться при более низких температурах посредством циклов химических реакций.
Этот метод производства водорода находится в стадии исследования. Это должно позволить производить водород, ограничивая выбросы парниковых газов.
Путем фотосинтеза
Производство водорода с использованием только солнечного света и воды может показаться фантастикой. Но на самом деле многие микроорганизмы естественным образом производят водород с помощью света в процессе, известном как фотосинтез.
Это относится к различным одноклеточным зеленым водорослям и некоторым цианобактериям, которые имеют преимущество в производстве водорода из солнечной энергии, используя только воду.
Этот метод производства водорода не приводит к прямым выбросам парниковых газов. Сегодня он находится в стадии лабораторных экспериментов. Исследователи пытаются понять, скопировать и оптимизировать этот естественный процесс в надежде, возможно, индустриализировать его.
Химия для детей — Как разделить воду на водород и кислород с помощью электролиза
Нам всем говорили, что вода состоит из водорода и кислорода. Но как мы на самом деле знаешь что? Неужели это влажное вещество, утоляющее нашу жажду и охлаждающее наши тела в жаркие летние дни, действительно состоит из двух газов ?
Мы пытались разделить воду на кислород и водород с помощью электролиза. Нам удалось это сделать после серии экспериментов, которые оставили у нас еще больше вопросов, чем до того, как мы начали. Что не обязательно плохо — любопытство — отличное состояние обучения! (См. загадочный случай отсутствия кислорода, ниже.)
Что не обязательно плохо — любопытство — отличное состояние обучения! (См. загадочный случай отсутствия кислорода, ниже.)
Вы можете воспользоваться нашими ошибками и провести электролиз быстрее. Вот как можно разделить воду на водород и кислород с помощью электролиза. Потом я расскажу вам о том, что мы сделали сначала, что произвело совсем другой газ.
Как разделить воду на водород и кислород
Что вам понадобится
- стеклянная или пластиковая ванна
- 2 резинки
- 2 пробирки (по возможности с крышками)
- двууглекислая сода (1 ст.л.)
- графитовые грифели
- вода Батарейка
- (мы использовали 6В, примерно как эта)
- 2 пары зажимов типа «крокодил»
- водонепроницаемая лента
Чем вы занимаетесь
Подробные инструкции по установке смотрите в этом видео – эластичная лента идеально удерживает пробирки на месте.
Если вы не можете посмотреть видео, вот его суть: Подсоедините один конец каждого зажима-крокодила к кусочку графита, а другой — к батарейке. Прикрепите концы графита ко дну ванны так, чтобы графит торчал вверх, и поместите перевернутую пробирку на каждый кусок графита (удерживаемый эластичными лентами). Растворите бикарбонат соды в воде и наполните ванну. Наконец, выньте каждую пробирку, наполните ее водой и осторожно поставьте на графит. Любые газы, собранные во время электролиза, заменят воду в трубках, поэтому убедитесь, что нет пузырьков воздуха.
Прикрепите концы графита ко дну ванны так, чтобы графит торчал вверх, и поместите перевернутую пробирку на каждый кусок графита (удерживаемый эластичными лентами). Растворите бикарбонат соды в воде и наполните ванну. Наконец, выньте каждую пробирку, наполните ее водой и осторожно поставьте на графит. Любые газы, собранные во время электролиза, заменят воду в трубках, поэтому убедитесь, что нет пузырьков воздуха.
Что происходит
На каждом электроде быстро начинают образовываться пузырьки газа. На отрицательном электроде (катоде) собирается больше газа, чем на положительном (аноде).
Как проверить свои газы
Когда вы соберете достаточное количество газа на каждом электроде, осторожно закройте пробирки крышками (пока они находятся под водой).
Для проверки на водород
Мы предположили, что газ на нашем (отрицательном) катоде был (положительно заряженным) водородом. Водород взрывоопасен. В таких количествах он не разрушит ваш дом, но будет издавать прохладный хлопающий звук в присутствии зажженной щепки. Вы можете услышать это в видео ниже.
Вы можете услышать это в видео ниже.
Для проверки на кислород
Мы проверяем на кислород светящейся шиной. Если кислорода достаточно, шина воспламеняется. Газ, который мы собрали на нашем аноде, дал кратковременное свечение, которое подтвердило, что это кислород, но после возбуждения от взрыва водорода мы были немного разочарованы. Позже мы произвели намного больше кислорода, используя другой метод — см. ниже видео о нашей повторно зажженной шине.
Как работает электролиз?
Вода представляет собой ковалентную молекулу (h30), удерживаемую общими электронами в ковалентных связях.
Во время электролиза молекулы восстанавливаются на катоде до газообразного водорода и окисляются на аноде до газообразного кислорода.
Чистая вода не проводит электричество, поэтому нам нужно добавить электролит, например бикарбонат соды. (Вы не поверите, сколько веб-сайтов советуют использовать соль. Мы попробовали и получили совершенно другой газ. Подробнее об этом позже.)
Производится вдвое больше водорода, чем кислорода, что отражает молекулярный состав вода.
Credit – J Squish
Вот довольно простое объяснение электролиза воды.
Если вам нужно более подробное объяснение, см. Википедию.
{Большое спасибо, Сара, за то, что указали на мое прежнее недопонимание и сделали этот пост более точным!}
Загадочный случай отсутствия кислорода
(Или что происходит, когда вы используете соль в качестве электролита. )
)
Прежде чем мы успешно разделили воду на водород и кислород, используя описанный выше метод, мы пытались добавить соль, чтобы помочь нашей воде проводить электричество. И не только щепотку соли. Я решил, что если немного соли немного поможет, то много соли будет еще лучше. (В конце концов, это работает для кристаллов.)
Мы проводим наш электролиз, используя тот же аппарат, что и выше, но на этот раз с насыщенным раствором соли. И вот мы сидели, жадно выискивая наши пузыри водорода и кислорода.
Что случилось? Ну, много на нашем катоде. Газ быстро начал заполнять пробирку. Мы протестировали его и обнаружили, что это водород. А на положительном электроде? Ни единого пузырька газа! Что случилось с кислородом из наших молекул воды?
Ночью я провел небольшое исследование.
Похоже, что во время электролиза раствора хлорида натрия (соли) хлорид натрия распадается на положительном электроде с образованием газообразного хлора и раствора гидроксида натрия. (Нажмите на ссылку, чтобы получить более подробное объяснение.) Хлор легко растворяется в воде, поэтому не будет собираться в виде газа, пока раствор не станет насыщенным и не сможет больше поглощать хлор.
(Нажмите на ссылку, чтобы получить более подробное объяснение.) Хлор легко растворяется в воде, поэтому не будет собираться в виде газа, пока раствор не станет насыщенным и не сможет больше поглощать хлор.
Итак, если наш положительный электрод был занят притяжением хлора, а на катоде собирался водород… что случилось с кислородом? Или в натрий из нашего хлорида натрия (NaCl), если уж на то пошло? По словам химиков, натрий и кислород объединяются, образуя раствор гидроксида натрия. Требовалось дальнейшее расследование.
Мы оставили наш аппарат настроенным — отключенным от батареи — на ночь. Мы решили изучить его на наличие зацепок.
Дальнейшие исследования
Какие изменения произошли в результате электролиза?
Наш солевой раствор приобрел коричневатый цвет. Был ли это растворенный хлор? Сломанный графит? Проржавел зажим-крокодил (который был прикреплен к аноду)?
Фильтрация раствора .
Часть нашего положительного электрода (анода) сломалась, оставив в растворе черные частицы. Мы используем графит в электролизе, потому что это инертный (нереакционноспособный) металл, но, возможно, большое количество произведенного нами хлора вызвало его реакцию? Мы отфильтровали коричневый раствор, чтобы увидеть, остались ли какие-либо нерастворимые частицы. Они этого не сделали. Но мы заметили несколько белых пятен на фильтровальной бумаге — должно быть, хлор, образующийся на нашем положительном электроде, обесцветил бумагу!
Тестирование рН раствора
Мы предположили, что раствор будет слегка щелочным из-за гидроксида натрия. Но когда мы проверили его, мы обнаружили обратное. Он был слегка кислым — как хлор. Мы предположили, что это означает, что раствор должен содержать больше хлора, чем гидроксида.
Еще больше удовольствия от кислорода
Здесь я немного отклоняюсь от темы, но обещал рассказать, как мы создали достаточное количество кислорода, чтобы успешно протестировать его. Идея пришла к нам после перехода к 9 0288 Магия кислорода Шоу в Королевском институте. Я хотел бы поделиться с вами одной из демонстраций, которые мы там видели.
Идея пришла к нам после перехода к 9 0288 Магия кислорода Шоу в Королевском институте. Я хотел бы поделиться с вами одной из демонстраций, которые мы там видели.
Ведущие спросили меня, могут ли они одолжить у меня банкноту в 10 фунтов стерлингов, а затем подожгли ее! Вот видео моих пылающих денег.
Невредимая банкнота номиналом 10 фунтов стерлингов Магия кислорода Ученые также продемонстрировали, как сделать «зубную пасту для слонов», расщепляя перекись водорода. Мы вспомнили, как когда-то сами делали зубную пасту для слонов. Когда мы вернулись домой, мы решили снова сделать зубную пасту для слонов и использовать светящуюся шину для проверки на кислород.
Мы вспомнили, как когда-то сами делали зубную пасту для слонов. Когда мы вернулись домой, мы решили снова сделать зубную пасту для слонов и использовать светящуюся шину для проверки на кислород.
Когда вы помещаете светящуюся шину в кислород, она снова загорается.
Почему это мой любимый способ заниматься наукой на дому
Как вы понимаете, это была не та демонстрация науки на дому, где мама точно знает, что произойдет и почему. Я изучал химию до шестнадцати лет – почти тридцать лет назад! Я не знал ответов на многие вопросы, возникающие в результате этих экспериментов.
Я изучал химию до шестнадцати лет – почти тридцать лет назад! Я не знал ответов на многие вопросы, возникающие в результате этих экспериментов.
Но незнание того, что произойдет, вызвало у меня любопытство и вдохновило узнать больше, а дети определенно были увлечены моим волнением. И я рад, что мы совершили «ошибку», использовав сначала соль в качестве электролита, потому что иначе мы упустили бы очень интересную науку!
Занимались ли вы в последнее время какой-нибудь интересной наукой?
Вы когда-нибудь расследовали случай отсутствия кислорода?
***
С благодарностью связываюсь здесь:
Подведение итогов за неделю – Странные несоциализированные домашние школьники
Пятница с коллажами – Доморощенные ученики
The Home Ed Link Up #16 – Приключения в домашнем образовании Adventures in Mommydom
Сильный финиш – начинается в восемь
Хип-хоп на дому – Модные мамы на домашнем обучении
Следуйте
Диссоциация воды и образование гидроксила на Ni(110)
- Список журналов
- Выбор автора ACS
- PMC7604940
Журнал физической химии. C, Наноматериалы и интерфейсы
C, Наноматериалы и интерфейсы
Интерфейсы J Phys Chem C Nanomater. 2020 окт 29; 124 (43): 23815–23822.
Опубликовано в сети 15 октября 2020 г. doi: 10.1021/acs.jpcc.0c08708
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности
- Дополнительные материалы
Никель
является активным катализатором реакций гидрирования и риформинга,
при этом реакции показывают сильную зависимость от подвергаемой воздействию поверхности.
Здесь мы описываем смешанные гидроксильно-водные фазы, образующиеся при
диссоциация воды на Ni(110) с помощью сканирующей туннельной микроскопии
и дифракция слаботочных низкоэнергетических электронов. Диссоциация воды
начинается между 150 и 180 К, поскольку структура Н-связи развивается от
линейные одномерные (1D) цепочки неповрежденной воды в двумерные
(2D) сеть, содержащая короткие ряды гексагональных колец с общими гранями. По мере дальнейшей десорбции воды шестиугольные ряды принимают локальный (2 ×
3) расположение, образующее небольшие неупорядоченные домены, разделенные деформацией
особенности рельефа. Распад этой фазы происходит вблизи 220 К до
образуют линейные одномерные структуры, состоящие из плоских зигзагообразных цепей воды,
с каждой водой, стабилизированной путем отдачи одного H на гидроксил с образованием
разветвленная цепная структура. ОН–Н 2 О цепи отталкивают
друг друга, при этом слой насыщения упорядочивается в структуру (2 0, 1 4)
который разлагается до OH около 245 К по мере дальнейшей десорбции воды. Структура
смешанных фаз OH/H 2 O обсуждается и противопоставляется
с обнаруженными на родственной поверхности Cu(110), с различиями
объясняется напряжением в сетке двумерных Н-связей, вызванным коротким
Расстояние между решетками Ni и прочная связь с OH/H 2 O.
По мере дальнейшей десорбции воды шестиугольные ряды принимают локальный (2 ×
3) расположение, образующее небольшие неупорядоченные домены, разделенные деформацией
особенности рельефа. Распад этой фазы происходит вблизи 220 К до
образуют линейные одномерные структуры, состоящие из плоских зигзагообразных цепей воды,
с каждой водой, стабилизированной путем отдачи одного H на гидроксил с образованием
разветвленная цепная структура. ОН–Н 2 О цепи отталкивают
друг друга, при этом слой насыщения упорядочивается в структуру (2 0, 1 4)
который разлагается до OH около 245 К по мере дальнейшей десорбции воды. Структура
смешанных фаз OH/H 2 O обсуждается и противопоставляется
с обнаруженными на родственной поверхности Cu(110), с различиями
объясняется напряжением в сетке двумерных Н-связей, вызванным коротким
Расстояние между решетками Ni и прочная связь с OH/H 2 O.
Наряду с медью,
никель является важным катализатором в восстановлении
реакции, 1-3 находит применение в практических катализаторах для воды
диссоциация и переформирование. 4,5 Реакционная способность обоих
металлов чрезвычайно зависит от лица, с водой, остающейся нетронутой на
плотноупакованные грани 6−8 , но диссоциирующие при умеренных температурах на более
открытые поверхности 9,10 по мере увеличения энергии связи воды. 4,5,11−13 Открытый (110)
поверхность является наиболее широко изученной реактивной поверхностью, с ранними сообщениями
предполагая, что медь и никель образуют аналогичные структуры воды. 14−16 Однако эти два металла значительно различаются по своей реакционной способности
и шаг решетки, а более поздние исследования указывают на значительное
различия в их взаимодействии с водой. Например, вода впитывается
и десорбируется ниже комнатной температуры на Cu(110) без диссоциации, 17 образуя одномерные (1D) цепочки с общими гранями
пентамеры, которые объединяются только в двумерную (2D) сеть
при высоком охвате. 18 Поведение на Ni(110),
где вода имеет более высокую энергию связи, совсем другое.
4,5 Реакционная способность обоих
металлов чрезвычайно зависит от лица, с водой, остающейся нетронутой на
плотноупакованные грани 6−8 , но диссоциирующие при умеренных температурах на более
открытые поверхности 9,10 по мере увеличения энергии связи воды. 4,5,11−13 Открытый (110)
поверхность является наиболее широко изученной реактивной поверхностью, с ранними сообщениями
предполагая, что медь и никель образуют аналогичные структуры воды. 14−16 Однако эти два металла значительно различаются по своей реакционной способности
и шаг решетки, а более поздние исследования указывают на значительное
различия в их взаимодействии с водой. Например, вода впитывается
и десорбируется ниже комнатной температуры на Cu(110) без диссоциации, 17 образуя одномерные (1D) цепочки с общими гранями
пентамеры, которые объединяются только в двумерную (2D) сеть
при высоком охвате. 18 Поведение на Ni(110),
где вода имеет более высокую энергию связи, совсем другое. Вместо
образуя циклические водные кольца с общими гранями, вода вместо этого образует линейные,
двухкоординатные зигзагообразные цепочки вдоль плотноупакованных рядов Ni, максимизирующие
связывание с Ni за счет уменьшенной координации Н-связи. 19
Вместо
образуя циклические водные кольца с общими гранями, вода вместо этого образует линейные,
двухкоординатные зигзагообразные цепочки вдоль плотноупакованных рядов Ni, максимизирующие
связывание с Ni за счет уменьшенной координации Н-связи. 19
Высокая энергия связи воды с никелем
также находит отражение в
большая реакционная способность этой поверхности. Поверхности Cu(110) диссоциируют
вода только при адсорбции выше 255 K, 10 , но гидроксил также может образовываться в результате реакции с предварительно адсорбированными атомами O
при низкой температуре. 14,20,21 Используя поверхностную реакцию O для образования известных количеств гидроксила,
можно охарактеризовать три различные частично диссоциированные фазы
на Cu(110). Структурные формы A (2H 2 O + 1OH) c(2 × 2)
при низкой температуре, состоящий из искаженной двумерной гексагональной сети
содержащие дефекты OH Bjerrum. 22 Эта структура
разлагается при нагревании с образованием структуры (1H 2 O + 1OH),
содержащие 1D цепочки воды, декорированные OH, а затем чистую фазу OH
который в конечном итоге разлагается на O и воду. 22 Напротив, вода спонтанно диссоциирует на Ni(110) до того, как
десорбирует, 9,23 хотя были разногласия по поводу
как температура начала, так и степень диссоциации. 9,15,16,24−32 Хотя реакция O с водой стехиометрична при малом покрытии
температуры, Го и Заэра показали, что дополнительная вода диссоциирует
с образованием ОН и Н, поэтому эту реакцию нелегко использовать для получения
известный OH/H 2 Соотношения O на Ni(110). 23 Спектры термодесорбции воды из Ni(110) () аналогичны полученным
для H 2 O/OH на Cu(110), с появлением трех пиков десорбции
при температурах выше многослойного пика воды. 9,23,29 Высокотемпературный пик обусловлен диспропорционированием ОН
с образованием O и воды, 16,23,24 аналогично Cu(110), 33 , но неизвестно
если две более низкотемпературные характеристики десорбции соответствуют
такие же структуры, которые образуются на Cu или отличаются. Более того, тепловая
спектры десорбции после реакции воды с O на Ni (110) показывают
отличия от адсорбции чистой воды, 23 , где водород, образующийся при диссоциации, десорбируется только из
поверхность выше 250 K 34 и сама может реконструировать
поверхность, 35 т.
22 Напротив, вода спонтанно диссоциирует на Ni(110) до того, как
десорбирует, 9,23 хотя были разногласия по поводу
как температура начала, так и степень диссоциации. 9,15,16,24−32 Хотя реакция O с водой стехиометрична при малом покрытии
температуры, Го и Заэра показали, что дополнительная вода диссоциирует
с образованием ОН и Н, поэтому эту реакцию нелегко использовать для получения
известный OH/H 2 Соотношения O на Ni(110). 23 Спектры термодесорбции воды из Ni(110) () аналогичны полученным
для H 2 O/OH на Cu(110), с появлением трех пиков десорбции
при температурах выше многослойного пика воды. 9,23,29 Высокотемпературный пик обусловлен диспропорционированием ОН
с образованием O и воды, 16,23,24 аналогично Cu(110), 33 , но неизвестно
если две более низкотемпературные характеристики десорбции соответствуют
такие же структуры, которые образуются на Cu или отличаются. Более того, тепловая
спектры десорбции после реакции воды с O на Ni (110) показывают
отличия от адсорбции чистой воды, 23 , где водород, образующийся при диссоциации, десорбируется только из
поверхность выше 250 K 34 и сама может реконструировать
поверхность, 35 т. о. природа гидроксила
структур, сформированных на Ni(110), остается неясным. Поскольку гидроксил является
ключевые вещества в окислительно-восстановительной химии каталитической поверхности многих малых
молекул, 36 в том числе на Ni, 37−39 понимание различных степеней окисления воды на этой поверхности
остается важной целью. 40,41
о. природа гидроксила
структур, сформированных на Ni(110), остается неясным. Поскольку гидроксил является
ключевые вещества в окислительно-восстановительной химии каталитической поверхности многих малых
молекул, 36 в том числе на Ni, 37−39 понимание различных степеней окисления воды на этой поверхности
остается важной целью. 40,41
Открыть в отдельном окне
Термическая десорбция воды спектры, записанные для разных исходных покрытия (a) H 2 O и (b) D 2 O, адсорбированные на поверхность Ni(110) при 100 К и нагреве со скоростью 2 К с –1 . Пики помечены, как сообщалось ранее, 29 , а начальное покрытие составляет приблизительно 0,5, 1, 1,5, и 2 МС для H 2 O и 0,5, 1, 1,5 и 3 МС для D 2 O. Картина ДМЭ для обоих изотопов аналогична и обозначена схематически между спектрами.
В этом исследовании мы исследуем диссоциацию водной пленки на Ni(110)
с помощью низкотемпературной сканирующей туннельной микроскопии (СТМ). Термальный
десорбционная спектроскопия сочетается со слаботочной низкоэнергетической электронной
дифракция (ДМЭ) для определения латерального порядка различных структур
формируется без влияния электронной перестройки, 42 , что позволяет связать измерения СТМ с
предыдущие экспериментальные исследования. 9,15,16,24−32 Находим, что выше 150 К диссоциация происходит параллельно с водой
десорбция с образованием сначала неупорядоченной двумерной сети вода/гидроксил, с
переменная OH/H 2 O состав, а затем упорядоченный массив
1D (OH + H 2 O) цепей. Мы противопоставляем реактивность
открытые поверхности Ni и Cu и обсудить, как короткий период решетки Ni
влияет на структуры, образующиеся на Ni.
Термальный
десорбционная спектроскопия сочетается со слаботочной низкоэнергетической электронной
дифракция (ДМЭ) для определения латерального порядка различных структур
формируется без влияния электронной перестройки, 42 , что позволяет связать измерения СТМ с
предыдущие экспериментальные исследования. 9,15,16,24−32 Находим, что выше 150 К диссоциация происходит параллельно с водой
десорбция с образованием сначала неупорядоченной двумерной сети вода/гидроксил, с
переменная OH/H 2 O состав, а затем упорядоченный массив
1D (OH + H 2 O) цепей. Мы противопоставляем реактивность
открытые поверхности Ni и Cu и обсудить, как короткий период решетки Ni
влияет на структуры, образующиеся на Ni.
Никель(110)
поверхность (лаборатория подготовки поверхности) была очищена
ионным распылением Ar + и отжигом до 950 K. Адсорбция воды
был охарактеризован в двух отдельных камерах. LEED и программируемый по температуре
десорбционные измерения проводились в камере, оборудованной
калиброванный молекулярный пучок для дозирования известного количества воды на
поверхность. Поток воды был откалиброван по упорядоченному монослою.
структура, образованная на Cu(511), 43 разрешающий
покрытие поверхности должно быть выбрано с точностью ±2% монослоя. Термическая десорбция
спектры записывали в зависимости от начального покрытия и нагрева
скорости с использованием квадрупольного масс-спектрометра VG Micromass. Порядок поверхностей
определяли с помощью слаботочной системы ДМЭ с двойной микроканальной пластиной.
(OCI) работали при токах менее 1 нА, чтобы избежать индуцированного электронами
диссоциация или реструктуризация воды. СТМ измерения проводились
с помощью сканирующего туннельного микроскопа CreaTec с образцом
выдерживали при 80 К во время адсорбции и визуализации перед отжигом до
разные температуры. 43 Изображения были записаны
в режиме постоянного тока с электрохимически вытравленным вольфрамом
кончик. СТМ-изображения воды были практически нечувствительны к смещению наконечника.
условия между ±0,5 В и I < 250 пА
и были обработаны с помощью WSXM.
Поток воды был откалиброван по упорядоченному монослою.
структура, образованная на Cu(511), 43 разрешающий
покрытие поверхности должно быть выбрано с точностью ±2% монослоя. Термическая десорбция
спектры записывали в зависимости от начального покрытия и нагрева
скорости с использованием квадрупольного масс-спектрометра VG Micromass. Порядок поверхностей
определяли с помощью слаботочной системы ДМЭ с двойной микроканальной пластиной.
(OCI) работали при токах менее 1 нА, чтобы избежать индуцированного электронами
диссоциация или реструктуризация воды. СТМ измерения проводились
с помощью сканирующего туннельного микроскопа CreaTec с образцом
выдерживали при 80 К во время адсорбции и визуализации перед отжигом до
разные температуры. 43 Изображения были записаны
в режиме постоянного тока с электрохимически вытравленным вольфрамом
кончик. СТМ-изображения воды были практически нечувствительны к смещению наконечника.
условия между ±0,5 В и I < 250 пА
и были обработаны с помощью WSXM. 44
44
Нанесение воды на Ni(110) и нагревание поверхности для индуцирования
диссоциация или десорбция приводят к профилям термической десорбции воды
Показано в .
Спектры аналогичны тем, о которых сообщалось ранее, 16,27 с низкотемпературным пиком (С) около 155 К, связанным с многослойным
десорбция воды и три более высоких температурных пика при 215 K (A2),
245 К (А1) и 355 К (Б). Пики десорбции воды появляются при очень близких
температуры для H 2 O и D 2 O, но форма
пика A2 заметно различается между двумя изотопами, будучи
немного шире для D 2 O, а при малом покрытии A1
пик меньше для D 2 O, чем для H 2 O. Хотя
пики A1 и A2 не смещаются при покрытии, что позволяет предположить, что они
приблизительно нулевого порядка, их невозможно описать никакими
простая кинетическая схема или извлечение активационного барьера для десорбции воды.
Анализ переднего края пика A2 обнаруживает очевидную активацию
энергия для H 2 O десорбция увеличивается с ок. от 52 до 120 кДж моль –1 при увеличении охвата
от 0,25 до ≥1 МС, что отражает диссоциацию/десорбцию комплекса
кинетики, которые приводят к образованию фазы А2, в которой вода
стабилизирован Н-связью с ОН. Нарастающая кажущаяся активация
барьер согласуется с идеей о том, что вода стабилизируется при более высоких
покрытия и температуры по мере увеличения количества присутствующего ОН. 31 Как было отмечено ранее, десорбция
профиль воды от Ni(110) очень похож на три пика, образовавшиеся
реакцией O и воды на Cu(110), но соответствующие пики
на Ni(110) лежат на 25–75 К выше, чем на Cu(110), что указывает на
более высокая энергия связи на Ni. 45
от 52 до 120 кДж моль –1 при увеличении охвата
от 0,25 до ≥1 МС, что отражает диссоциацию/десорбцию комплекса
кинетики, которые приводят к образованию фазы А2, в которой вода
стабилизирован Н-связью с ОН. Нарастающая кажущаяся активация
барьер согласуется с идеей о том, что вода стабилизируется при более высоких
покрытия и температуры по мере увеличения количества присутствующего ОН. 31 Как было отмечено ранее, десорбция
профиль воды от Ni(110) очень похож на три пика, образовавшиеся
реакцией O и воды на Cu(110), но соответствующие пики
на Ni(110) лежат на 25–75 К выше, чем на Cu(110), что указывает на
более высокая энергия связи на Ni. 45
Заказ
поверхностных структур при диссоциации воды было
определяется путем записи картины ДМЭ при термодесорбции
и кратко изложен в , а дополнительные подробности приведены во вспомогательной информации. Неповрежденная фаза, образующаяся при 100 К, состоит из доменов
плоских зигзагообразных водяных цепей по схеме (2 × 2) или (4 × 4)
ниже 0,5 ML, с водой, украшающей оставшиеся открытые ряды Ni
по мере дальнейшего увеличения покрытия с образованием неупорядоченного монослоя,
с диффузной (2 × 2) картиной ДМЭ и слабыми деталями 1/4 порядка. 19 Нагрев поверхности выше 150 К для инициирования
диссоциация и десорбция избыточной воды вызывают лучи ДМЭ половинного порядка
для разделения по направлению [001] к повтору (2 × 3). В качестве
вода начинает десорбироваться в черте А2, появляется дополнительное расщепление
соответствует шкале длины ок. от 6 до 7 раз
повтор Ni вдоль [11̅0]. Наконец, когда пик А2 завершается
и формируется фаза A1, картина ДМЭ имеет полосы вдоль [001] и
появляется структура (2 × n ), где n зависит от начального покрытия водой. Десорбция из полностью насыщенного
водной поверхности (охват ≥1 ML) приводит к резкому, хорошо выраженному
(2 0, 1 4) ДМЭ, появляющийся для фазы A1. Предыдущий обычный
ДМЭ-исследования воды на Ni(110) могли быть скомпрометированы электронно-индуцированным
диссоциации и обычно сосредотачивались на диффузном c(2 × 2)
структура, хотя сообщалось и о других структурах, в том числе
(2 × 1), c (2 × 4) и c (2 × 6) структуры. 16,27,46 Шаблоны ДМЭ, описанные выше
могут быть непосредственно связаны с СТМ-изображениями частично диссоциированного
ОХ/Ч 2 Структуры O, образующиеся при десорбции воды в A2 и
Пики A1, как обсуждается ниже.
19 Нагрев поверхности выше 150 К для инициирования
диссоциация и десорбция избыточной воды вызывают лучи ДМЭ половинного порядка
для разделения по направлению [001] к повтору (2 × 3). В качестве
вода начинает десорбироваться в черте А2, появляется дополнительное расщепление
соответствует шкале длины ок. от 6 до 7 раз
повтор Ni вдоль [11̅0]. Наконец, когда пик А2 завершается
и формируется фаза A1, картина ДМЭ имеет полосы вдоль [001] и
появляется структура (2 × n ), где n зависит от начального покрытия водой. Десорбция из полностью насыщенного
водной поверхности (охват ≥1 ML) приводит к резкому, хорошо выраженному
(2 0, 1 4) ДМЭ, появляющийся для фазы A1. Предыдущий обычный
ДМЭ-исследования воды на Ni(110) могли быть скомпрометированы электронно-индуцированным
диссоциации и обычно сосредотачивались на диффузном c(2 × 2)
структура, хотя сообщалось и о других структурах, в том числе
(2 × 1), c (2 × 4) и c (2 × 6) структуры. 16,27,46 Шаблоны ДМЭ, описанные выше
могут быть непосредственно связаны с СТМ-изображениями частично диссоциированного
ОХ/Ч 2 Структуры O, образующиеся при десорбции воды в A2 и
Пики A1, как обсуждается ниже.
показывает
СТМ-изображение структур, образовавшихся после того, как поверхность была покрыта водой
отжигается до 183 К, чуть ниже температуры, при которой вода десорбируется
в пике А2 (). Обратите внимание, что нагрев в СТМ происходит в более длительном масштабе времени, чем тепловой.
десорбция, ок. 1 К мин –1 в СТМ
по сравнению с 2 K с –1 для , то есть для конкретной температуры отжига,
разложение и десорбция будут более продвинутыми в изображениях СТМ
чем в соответствующем термодесорбционном спектре. Поверхность
покрыт малоконтрастным ( ок. 20 часов) водные сооружения
которые демонстрируют локальный порядок, но остаются неупорядоченными на 10 с Å
шкала. Структуры, видимые в a, можно разбить на две категории в зависимости
от того, наблюдаются ли они при адсорбции воды нетронутыми 19 или они характерны только для отожженной поверхности.
Примеры особенностей, соответствующих неповрежденным водным сооружениям:
выделены синим цветом на а, а их структуры показаны на б, в. Неповрежденная вода образует одномерные цепочки вдоль чередующихся
плотно упакованные ряды Ni с 2-кратным повторением (зигзагообразные цепочки, c) или 4-кратным повторением
(извилистые цепочки, б). 1D-цепи более стабильны, чем 2D-водные сети с водородными связями.
или структуры с более чем 0,5 мл воды, и могут выравниваться по-разному
реестры вдоль [001]. 19 Хотя большая часть
поверхность можно отнести к неупорядоченной смеси неповрежденных
водные цепи, показанные на b, c, также появляются короткие ряды гексамеров с общими гранями, с
два примера выделены желтым цветом. В отличие от структур, связанных
с неповрежденной водой, где вода украшает чередующиеся плотноупакованные Ni
ряды, в этих шестиугольных рядах адсорбат связан с соседними рядами
Ni и появляются только после отжига выше 150 K.
шестиугольные ряды редко бывают длиннее 6 единиц (30 Å) перед
дефект или другая структура появляется и не формируется сразу
рядом друг с другом. На самом деле, существует сильное предпочтение
гексагональные цепочки появляются на расстоянии 3 Ni повторов друг от друга; показан пример
в области, выделенной внизу а, где две из этих шестиугольных цепочек образуют
локальное (2 × 3) расположение на Ni с более слабой структурой между
шестиугольные цепи.
Неповрежденная вода образует одномерные цепочки вдоль чередующихся
плотно упакованные ряды Ni с 2-кратным повторением (зигзагообразные цепочки, c) или 4-кратным повторением
(извилистые цепочки, б). 1D-цепи более стабильны, чем 2D-водные сети с водородными связями.
или структуры с более чем 0,5 мл воды, и могут выравниваться по-разному
реестры вдоль [001]. 19 Хотя большая часть
поверхность можно отнести к неупорядоченной смеси неповрежденных
водные цепи, показанные на b, c, также появляются короткие ряды гексамеров с общими гранями, с
два примера выделены желтым цветом. В отличие от структур, связанных
с неповрежденной водой, где вода украшает чередующиеся плотноупакованные Ni
ряды, в этих шестиугольных рядах адсорбат связан с соседними рядами
Ni и появляются только после отжига выше 150 K.
шестиугольные ряды редко бывают длиннее 6 единиц (30 Å) перед
дефект или другая структура появляется и не формируется сразу
рядом друг с другом. На самом деле, существует сильное предпочтение
гексагональные цепочки появляются на расстоянии 3 Ni повторов друг от друга; показан пример
в области, выделенной внизу а, где две из этих шестиугольных цепочек образуют
локальное (2 × 3) расположение на Ni с более слабой структурой между
шестиугольные цепи. Расположение (2 × 3) согласуется с
расщепление LEED, которое появляется между 150 и 210 K до завершения
пика десорбции А2.
Расположение (2 × 3) согласуется с
расщепление LEED, которое появляется между 150 и 210 K до завершения
пика десорбции А2.
Открыть в отдельном окне
(а) СТМ-изображение, показывающее сформированные структуры после нагрева воды до 183 К, непосредственно перед десорбцией воды в пике А2 (), а затем охлаждают до 80 К. Области, отмеченные синим, выделяют локальные структуры, соответствующие к (b) структуре (4 0, 2 2) и (c) повторению (2 0, 1 2), т.е. наблюдается для неповрежденной воды при покрытии 0,5 МС при 80 К. Кроме того, к этим неповрежденным водным структурам изображение (а) также содержит короткие цепочки гексамеров с общим лицом, примеры которых выделены желтым цветом и обсуждаются в тексте. Кадры (b,c) адаптированы из J. Phys. хим. лат. 2020, 11, 2121–2126. Условия изображения: (а) 183 К, 265 пА, -0,30 В, (б) 80 К, 240 пА, -0,38 В, и (в) 80 К, 175 пА, -0,09 В.
показывает
в
структуры, которые образуются при нагревании поверхности до 200 К, чтобы инициировать
десорбция воды через пик А2. Адсорбат образует
участки двумерной сети, которая постепенно исчезает (см. изображения a–d) по мере того, как вода десорбируется и диссоциирует в
образуют одномерные зигзагообразные цепи структуры A1 (обсуждается позже). 2D
острова плохо упорядочены, но содержат ряды одинаковых лиц
шестиугольные кольца, которые начали появляться при 180 К (а). Шестиугольные ряды
выровнены вдоль направления плотноупакованного Ni и обычно расположены на расстоянии 3 решетки
повторяется отдельно по [001], (см. напр. , а), в соответствии с (2
× 3) повторение увиденного в LEED. По мере десорбции воды и покрытия
2D-фаза уменьшается (б–г), 2D-структуры остаются довольно разупорядоченными, с
регулярные разрывы, разбивающие структуру на более мелкие домены
между каждыми пятью или шестью кольцами вдоль [11̅0] и во все возрастающем
небольшие (2 × 3) участки вдоль [001] по мере десорбции.
шестиугольные ряды, разделяющие грани, относительно хорошо определены, часто показывая
более контрастные черты внутри рядов, но структура между
шестиугольные ряды тусклые и кажутся беспорядочными.
Адсорбат образует
участки двумерной сети, которая постепенно исчезает (см. изображения a–d) по мере того, как вода десорбируется и диссоциирует в
образуют одномерные зигзагообразные цепи структуры A1 (обсуждается позже). 2D
острова плохо упорядочены, но содержат ряды одинаковых лиц
шестиугольные кольца, которые начали появляться при 180 К (а). Шестиугольные ряды
выровнены вдоль направления плотноупакованного Ni и обычно расположены на расстоянии 3 решетки
повторяется отдельно по [001], (см. напр. , а), в соответствии с (2
× 3) повторение увиденного в LEED. По мере десорбции воды и покрытия
2D-фаза уменьшается (б–г), 2D-структуры остаются довольно разупорядоченными, с
регулярные разрывы, разбивающие структуру на более мелкие домены
между каждыми пятью или шестью кольцами вдоль [11̅0] и во все возрастающем
небольшие (2 × 3) участки вдоль [001] по мере десорбции.
шестиугольные ряды, разделяющие грани, относительно хорошо определены, часто показывая
более контрастные черты внутри рядов, но структура между
шестиугольные ряды тусклые и кажутся беспорядочными. В конце концов,
2D-островки узкие, образуя первые небольшие (2 × 3) домены, охватывающие
шириной всего четыре ряда Ni (выделены желтыми эллипсами, c, d), а затем изолированы
ряды шестиугольников с общими гранями, соединенных зигзагообразными цепями (выделены
синим, г).
Наличие одиночных рядов гексагональных колец, разделяющих грани, в
слой с высоким покрытием, поскольку структура A2 первоначально формируется (а) и как последняя
циклическая структура остается, когда фаза A2 распадается на зигзагообразные цепочки
структуры A1 (d) предполагает, что сами шестиугольные ряды являются ключевыми
структурный элемент структуры A2, а не (2 × 3) парный
договоренность. Структура фазы А2 будет обсуждаться далее.
подробности позже, как только мы описали структуру A1, которая довольно
проще понять.
В конце концов,
2D-островки узкие, образуя первые небольшие (2 × 3) домены, охватывающие
шириной всего четыре ряда Ni (выделены желтыми эллипсами, c, d), а затем изолированы
ряды шестиугольников с общими гранями, соединенных зигзагообразными цепями (выделены
синим, г).
Наличие одиночных рядов гексагональных колец, разделяющих грани, в
слой с высоким покрытием, поскольку структура A2 первоначально формируется (а) и как последняя
циклическая структура остается, когда фаза A2 распадается на зигзагообразные цепочки
структуры A1 (d) предполагает, что сами шестиугольные ряды являются ключевыми
структурный элемент структуры A2, а не (2 × 3) парный
договоренность. Структура фазы А2 будет обсуждаться далее.
подробности позже, как только мы описали структуру A1, которая довольно
проще понять.
Открыть в отдельном окне
Водные структуры, образующиеся после отжига покрытого водой
поверхность
до 200 К и охлаждение до 80 К до изображения. Кадры (a–d) показывают регионы
уменьшения покрытия по мере десорбции воды в пике A2, превращая
из двумерной структуры в одномерные зигзагообразные цепочки, составляющие A1
фаза. Изображения СТМ довольно нечувствительны к условиям смещения и
показывают контраст 20–25 пм для зигзагообразных цепочек и 40 пм
для ярких деталей в шестиугольных рядах (, например, , в центре б). Выделенные области обсуждаются в тексте. Изображение
условия: (а) 175 пА, -56 мВ, (б) 2018 пА, -52 мВ,
(в) 180 пА, -43 мВ и (г) 215 пА, -54 мВ.
Изображения СТМ довольно нечувствительны к условиям смещения и
показывают контраст 20–25 пм для зигзагообразных цепочек и 40 пм
для ярких деталей в шестиугольных рядах (, например, , в центре б). Выделенные области обсуждаются в тексте. Изображение
условия: (а) 175 пА, -56 мВ, (б) 2018 пА, -52 мВ,
(в) 180 пА, -43 мВ и (г) 215 пА, -54 мВ.
Поскольку десорбция воды протекает медленно в пике А2 при 200
К,
Двумерные структуры постепенно исчезают, оставляя одномерные зигзагообразные цепочки, которые
бегут по плотно упакованному [11̅0] направлению (d). Отжиг поверхности до
220 К () полностью
удаляет оставшиеся участки 2D-структуры и зигзагообразные цепочки
порядок в регулярно расположенный массив, который характеризует фазу A1.
Начиная с монослоя или более воды, получается массив с
цепи расположены в четыре ряда Ni друг от друга в противофазе
чтобы получить структуру (2 0, 1 4) (b), наблюдаемую в ДМЭ. Нижний старт
покрытие приводит к большему расстоянию между цепями, ( напр. , см. а, где цепи разделены пятью рядами Ni), но они никогда не
кажутся ближе трех рядов никеля друг от друга, что указывает на преимущественно
отталкивающее взаимодействие между цепями. Зигзаг «Z»
цепи имеют открытые ответвления, направленные немного вверх или вниз по цепям
и подобны цепям OH/H 2 O, которые ранее
была охарактеризована на Cu(110), где эта структура отвечает
для эквивалентного пика термодесорбции. 33 Водяные связи в плоском зигзагообразном расположении с Н-связями вдоль плотной упаковки
Ni ряды по обе стороны от позиции Ni наверху (c). Атом H, направленный в сторону от
ось цепи образует Н-связь с ОН, связанную в узле мостика Ni, с
создают характерную разветвленную цепочку. В некоторых регионах,
например в верхней части, небольшие участки OH/H 2 O цепная структура
иногда располагают с водой чередующимися парами вдоль никелевых рядов
для формирования 4-кратной повторной структуры типа «щипок», обозначаемой
П; семя. Опять таки,
эта неосновная структура связывает воду вблизи атоп-сайта и ОН в
сайт мостика и подобен P-цепям, описанным для Cu(110).
, см. а, где цепи разделены пятью рядами Ni), но они никогда не
кажутся ближе трех рядов никеля друг от друга, что указывает на преимущественно
отталкивающее взаимодействие между цепями. Зигзаг «Z»
цепи имеют открытые ответвления, направленные немного вверх или вниз по цепям
и подобны цепям OH/H 2 O, которые ранее
была охарактеризована на Cu(110), где эта структура отвечает
для эквивалентного пика термодесорбции. 33 Водяные связи в плоском зигзагообразном расположении с Н-связями вдоль плотной упаковки
Ni ряды по обе стороны от позиции Ni наверху (c). Атом H, направленный в сторону от
ось цепи образует Н-связь с ОН, связанную в узле мостика Ni, с
создают характерную разветвленную цепочку. В некоторых регионах,
например в верхней части, небольшие участки OH/H 2 O цепная структура
иногда располагают с водой чередующимися парами вдоль никелевых рядов
для формирования 4-кратной повторной структуры типа «щипок», обозначаемой
П; семя. Опять таки,
эта неосновная структура связывает воду вблизи атоп-сайта и ОН в
сайт мостика и подобен P-цепям, описанным для Cu(110). 33,47
33,47
Открыть в отдельном окне
СТМ изображения структуры А1, сформированной после отжига до 220 К до полного разложения структуры А2. (a) Регион с низким уровнем покрытия с яркими (кажущаяся высота ~110 мкм) добавленными рядами Ni и слабее (20 часов) OH/H 2 О цепи. (b) Регион с высоким уровнем покрытия показаны упорядоченные зигзагообразные цепи OH/H 2 O в (2 0, 1 4) структура, образовавшаяся после диссоциации водного мультислоя. Два наблюдается несколько иное расположение цепи OH/H 2 O, зигзагообразная цепочка «Z», показанная на (c), и пинч меньшинства, Структура «P», показанная на (d), с 2× или 4× чередование воды по обе стороны от положения Ni вверху и ОН в соседней позиции короткого моста. 33 Условия изображения: (a,c,d) −83 мВ, 190 пА и (б) -65 мВ, 203 пА.
Открыть в отдельном окне
(а) СТМ изображение после продолжительного отжига воды
до 220 К, чтобы разрешить
частичное разложение структуры OH/H 2 O с образованием
избыток ОН. Модель конструкции наложена на два
цепи, чтобы показать дополнительные ОН-группы, украшающие некоторые цепи.
(б) СТМ-изображение после отжига до 270 К для разложения цепочек OH/H 2 O. Условия изображения: (а) 185 пА, -1,0 В и
(б) 115 пА, -0,16 В.
Модель конструкции наложена на два
цепи, чтобы показать дополнительные ОН-группы, украшающие некоторые цепи.
(б) СТМ-изображение после отжига до 270 К для разложения цепочек OH/H 2 O. Условия изображения: (а) 185 пА, -1,0 В и
(б) 115 пА, -0,16 В.
Помимо сходной структуры цепей OH/H 2 O-цепей
на Ni и Cu(110), мы также наблюдаем высококонтрастные (110 пм) линейные
особенности между некоторыми рядами никеля, которые мы приписываем одноатомным проволокам никеля,
подобные наблюдаемым после диссоциации воды на Cu(110). 47 Ni-провода иногда располагаются рядом с цепями OH/H 2 O, но также и рядом с открытыми участками Ni. Что касается Cu(110), 47 эти цепочки Ni не появляются на чистом Ni(110)
и, по-видимому, стабилизированы адсорбцией H, что может привести к
(1 × 2) реконструкция отсутствующих строк на обеих поверхностях. Несколько других
особенности, наблюдаемые на Ni (110), не описаны на Cu. Контраст
уменьшение наблюдается в никеле вокруг некоторых групп ОН вдоль
зигзаг OH/H 2 О-цепи по мере исчезновения 2D-фазы ( например, , см. темные углубления в форме буквы «С»
вокруг некоторых признаков ОН на c), тогда как b показывает (2 0, 1 4) упорядоченный домен, покрытый цепями OH/H 2 O с контрастным изменением ок. 20 пм по обнаженному Ni между цепочками. Хотя эта вариация
могут возникать из-за различий в локальном охвате H, изменяя
Ni рабочая функция, H подвижен при 80 K, а изображения с высоким разрешением предполагают
другое объяснение. а показывает структуру цепи после медленного отжига при
220 K, чтобы позволить некоторое разложение OH/H 2 О цепи.
Появляются дополнительные элементы, украшающие некоторые группы ОН по бокам.
цепей OH/H 2 O, окруженных малоконтрастной областью.
Дополнительные признаки отнесены к избыточным ОН-группам, образованным как
покрытие OH увеличивается за пределы соотношения 1:1 цепей OH/H 2 O. На Cu(110) чистая фаза OH состоит из димеров OH с
один ОН лежит плашмя на месте короткого моста, жертвуя второму ОН
на следующем ряду никеля, который наклонен наружу, в сторону от поверхности.
темные углубления в форме буквы «С»
вокруг некоторых признаков ОН на c), тогда как b показывает (2 0, 1 4) упорядоченный домен, покрытый цепями OH/H 2 O с контрастным изменением ок. 20 пм по обнаженному Ni между цепочками. Хотя эта вариация
могут возникать из-за различий в локальном охвате H, изменяя
Ni рабочая функция, H подвижен при 80 K, а изображения с высоким разрешением предполагают
другое объяснение. а показывает структуру цепи после медленного отжига при
220 K, чтобы позволить некоторое разложение OH/H 2 О цепи.
Появляются дополнительные элементы, украшающие некоторые группы ОН по бокам.
цепей OH/H 2 O, окруженных малоконтрастной областью.
Дополнительные признаки отнесены к избыточным ОН-группам, образованным как
покрытие OH увеличивается за пределы соотношения 1:1 цепей OH/H 2 O. На Cu(110) чистая фаза OH состоит из димеров OH с
один ОН лежит плашмя на месте короткого моста, жертвуя второму ОН
на следующем ряду никеля, который наклонен наружу, в сторону от поверхности. 33 Этот димер ОН изображен как два очень слабых выступа
на Cu(110), окруженном обширной малоконтрастной областью, 48 , похожей на детали, видимые на краю
цепи в c, d и a. Декорирование групп ОН вдоль
край цепи OH/H 2 O со вторым OH образует
Димер ОН с таким же расположением, как на Cu, но с первой плоской
ОН Н-связан с водной цепью, как показано схематически на
СТМ-изображение в формате a.
33 Этот димер ОН изображен как два очень слабых выступа
на Cu(110), окруженном обширной малоконтрастной областью, 48 , похожей на детали, видимые на краю
цепи в c, d и a. Декорирование групп ОН вдоль
край цепи OH/H 2 O со вторым OH образует
Димер ОН с таким же расположением, как на Cu, но с первой плоской
ОН Н-связан с водной цепью, как показано схематически на
СТМ-изображение в формате a.
Дальнейшее нагревание вызывает OH/H 2 O цепная структура
к
разложить около 245 К, как пик десорбции A1, чтобы оставить только ОН на
поверхность. Термическая десорбция показывает, что ОН стабилен до
350 K, прежде чем он диспропорционирует, выделяя больше воды (пик B, ), чтобы оставить O на
поверхность. 16,23,24 Отжиг
поверхность до 270 K приводит к поверхности, показанной на b. Поверхность чрезвычайно
гофрированный, с высокой плотностью добавленных никелевых рядов, предположительно стабилизированный
либо адсорбированным OH, либо H, который только десорбирует поверхность
медленно ниже 300 К. 34 Отдельные элементы
появляются вдоль рядов Ni (вверху в центре а) с контрастом ок. 15 пм, аналогично наблюдаемому для ОН в низкотемпературных фазах,
но большое гофрирование поверхности затрудняет подтверждение того,
это ОН или установить его локальную структуру с какой-либо уверенностью. Безусловно,
результаты СТМ не указывают на какую-либо четкую структуру, которая могла бы быть
приписывается структуре (2 × 1) -OH, о которой сообщалось после
реакция между водой и O, 24,46 и отсутствие упорядоченной сверхструктуры
был найден в LEED.
34 Отдельные элементы
появляются вдоль рядов Ni (вверху в центре а) с контрастом ок. 15 пм, аналогично наблюдаемому для ОН в низкотемпературных фазах,
но большое гофрирование поверхности затрудняет подтверждение того,
это ОН или установить его локальную структуру с какой-либо уверенностью. Безусловно,
результаты СТМ не указывают на какую-либо четкую структуру, которая могла бы быть
приписывается структуре (2 × 1) -OH, о которой сообщалось после
реакция между водой и O, 24,46 и отсутствие упорядоченной сверхструктуры
был найден в LEED.
Во время термической десорбции
спектры воды от Ni(110)
очень похоже на наблюдаемые для смешанных структур H 2 O/OH
образующийся на Cu(110) в результате реакции кислород-вода, настоящее
результаты показывают, что сформированная 2D-сеть (фаза A2) отличается
от найденного на Cu, отражая различия, обнаруженные ранее
для неповрежденных водных сооружений. Напротив, структура A1 (OH/H 2 O) кажется идентичной между двумя металлическими поверхностями, состоящей из
Н-связанного H 2 O цепочки, идущие зигзагами вдоль плотно упакованных
Ni-позиции, при этом второй атом H воды отдает OH-группам в
соседний участок моста. 33 При 2,5 Å,
расстояние Ni–Ni примерно на 0,3–0,4 Å короче, чем
типичное разделение O в кластерах воды с водородными связями, 8 , но открытая природа этих одномерных цепей, которые не содержат
циклические кольца, предположительно позволяет структуре Н-связи приспособиться
короткое расстояние Ni–Ni за счет увеличения зигзага воды
остов по сравнению с Cu. В то время как «Z» и «P»
Цепи типа обычно появляются на Cu(110), подавляющее большинство (OH/H 2 O) цепи, наблюдаемые на Ni, имеют форму «Z», где
вода O чередуется с одной стороны ряда Ni на другую в
каждой точке решетки, что позволяет увеличить расстояние между водородными связями O – O
чем расстояние между ближайшими соседями Ni. Напротив, размещение двух атомов O
воды на той же стороне цепи Ni (форма «P»)
либо требует довольно короткого разделения O–O, либо, что более вероятно,
создает увеличенный угол между Н-связями водной цепи.
Дальнейшее декорирование краевых ОН-групп вторым ОН происходит как
ОН/Ч 2 Соотношение O увеличивается на Ni(110), позволяя цепочке
структура для размещения избытка OH по мере десорбции воды, что-то
на Cu этого не наблюдалось.
33 При 2,5 Å,
расстояние Ni–Ni примерно на 0,3–0,4 Å короче, чем
типичное разделение O в кластерах воды с водородными связями, 8 , но открытая природа этих одномерных цепей, которые не содержат
циклические кольца, предположительно позволяет структуре Н-связи приспособиться
короткое расстояние Ni–Ni за счет увеличения зигзага воды
остов по сравнению с Cu. В то время как «Z» и «P»
Цепи типа обычно появляются на Cu(110), подавляющее большинство (OH/H 2 O) цепи, наблюдаемые на Ni, имеют форму «Z», где
вода O чередуется с одной стороны ряда Ni на другую в
каждой точке решетки, что позволяет увеличить расстояние между водородными связями O – O
чем расстояние между ближайшими соседями Ni. Напротив, размещение двух атомов O
воды на той же стороне цепи Ni (форма «P»)
либо требует довольно короткого разделения O–O, либо, что более вероятно,
создает увеличенный угол между Н-связями водной цепи.
Дальнейшее декорирование краевых ОН-групп вторым ОН происходит как
ОН/Ч 2 Соотношение O увеличивается на Ni(110), позволяя цепочке
структура для размещения избытка OH по мере десорбции воды, что-то
на Cu этого не наблюдалось. 33
33
Ситуация с фазой A2 совершенно иная. В то время как рано
измерения обычно обнаруживают структуру c(2 × 2) 9 или иногда c(2 × 4) или c(2 × 6), 16,27 современные измерения ДМЭ и СТМ-изображения находят
верхний слой (2 × 3) с некоторой дополнительной структурой (расщепление LEED)
вдоль [11̅0]. Изображения СТМ показывают, что двумерная сеть Н-связей содержит
короткие ряды шестиугольных колец с общими гранями, выровненные между двумя плотно упакованными
Ni строк, часто с повторением (2 × 3), как показано на рис. Эта фаза всегда
остается неупорядоченным с регулярными дефектами вдоль [11̅0], которые ограничивают
длина гексагональных цепочек не более 6-7 звеньев. Как
Фаза А2 распадается, распадается на мелкие (2×3) островки
рядов шестиугольников с общими гранями, разделенных регулярно расположенными дефектами.
Эти дефекты часто можно распознать как фрагменты цепи А1.
структура, как, например, в c, внизу слева, где цепь P-типа появляется между
два (2 × 3) домена. Структура между шестиугольными рядами
нечеткий и кажется изменчивым, с признаками обеих пар
маленькие кольца и большие пустоты между рядами, то что кажется
быть пустым каналом к следующему домену, как показано в .
Структура между шестиугольными рядами
нечеткий и кажется изменчивым, с признаками обеих пар
маленькие кольца и большие пустоты между рядами, то что кажется
быть пустым каналом к следующему домену, как показано в .
Открыть в отдельном окне
(a) Изображение СТМ, показывающее детали конструкции А2 подготовлены на 200 K. Шестиугольные ряды образуют небольшие домены в расположении (2 × 3). и показать несколько более ярких особенностей. (b) Схема, показывающая реестр из двух шестиугольных рядов (жирные шестиугольники) в ряды Ni. Схема также указывает на возможную промежуточную структуру, украшающую вакантное место. Строка Ni, выбранная так, чтобы быть похожей на 2D-область, показанную в центре. из (а). Вершины линий представляют сайт O (OH или H 2 О). Условия изображения: (а) 190 пА, -0,09 В.
Понимание структуры 2D-фазы на Ni(110)
сложный
как из-за его изменчивости, так и из-за неопределенности его состава.
появление коротких гексагональных цепочек с общими гранями выше 150 К
явно связано с началом диссоциации с образованием ОН, но
неясно, прекращается ли диссоциация с завершением (2 ×
3) структурируется или продолжается, пока на поверхности есть нетронутая вода. Небольшие различия между формой и шириной десорбции А2
пик, который меньше и шире для D 2 O, чем для H 2 O при низком покрытии, указывают на слегка отличающиеся скорости диссоциации
для двух изотопов во время десорбции (либо из-за более высокой туннельной
отношение H к D или к большему H 2 O нулевая вибрация
энергии), первоначально изменяя количество присутствующего OH(OD) для стабилизации
недиссоциированная вода. Эволюция фазы А2 между 180
и 220 К (см. и ), где порядок (2 × 3) сохраняется,
предполагает, что общий состав OH/H 2 O продолжает
изменяться в этой области и способствует изменениям в структуре.
Хотя измерения рентгеновской фотоэлектронной спектроскопии (XPS) с помощью Pirug и др. нашли смесь 1:1 OH и H 2 O 9 для этой фазы при 180 К можно уверенно отнести
этой стехиометрии к 1D-цепочкам фазы A1, представленным выше
220 K, что означает, что структура A2 содержит больше воды. На Cu(110),
где стехиометрию можно определить непосредственно, структура A2
имеет состав (1OH/2H 2 O) и образует упорядоченный c(2 ×
2) структура, состоящая из плоской двумерной сети искаженных шестиугольных
кольца, делящие лицо.
Небольшие различия между формой и шириной десорбции А2
пик, который меньше и шире для D 2 O, чем для H 2 O при низком покрытии, указывают на слегка отличающиеся скорости диссоциации
для двух изотопов во время десорбции (либо из-за более высокой туннельной
отношение H к D или к большему H 2 O нулевая вибрация
энергии), первоначально изменяя количество присутствующего OH(OD) для стабилизации
недиссоциированная вода. Эволюция фазы А2 между 180
и 220 К (см. и ), где порядок (2 × 3) сохраняется,
предполагает, что общий состав OH/H 2 O продолжает
изменяться в этой области и способствует изменениям в структуре.
Хотя измерения рентгеновской фотоэлектронной спектроскопии (XPS) с помощью Pirug и др. нашли смесь 1:1 OH и H 2 O 9 для этой фазы при 180 К можно уверенно отнести
этой стехиометрии к 1D-цепочкам фазы A1, представленным выше
220 K, что означает, что структура A2 содержит больше воды. На Cu(110),
где стехиометрию можно определить непосредственно, структура A2
имеет состав (1OH/2H 2 O) и образует упорядоченный c(2 ×
2) структура, состоящая из плоской двумерной сети искаженных шестиугольных
кольца, делящие лицо. Эта структура стабилизируется образованием
сильных водородных связей между водой и ОН, причем ОН расположены в виде димеров
дефекты Бьеррума. 22 Боковая плотность
воды в этой структуре на 4,3% меньше, чем в изогнутом шестиугольном
[0001] Самолет из насыпного льда I h , позволяющий
сеть, чтобы приспособить расстояние между водородными связями O–O и все еще
свяжите воду плоской, связанной с Cu. Хотя структура A2 сформировалась на
Ni также показывает ряды шестиугольных колец, которые прерываются правильными
дефекты вдоль направления плотной упаковки, в то время как гексагональные
строки не появляются рядом друг с другом в расположении c (2 × 2)
но отделены друг от друга дополнительной строкой вдоль [001]. Ni имеет 2,5%
шаг решетки меньше, чем у Cu, поэтому искаженный гексагонал c (2 ×
2) предложенная ранее структура 9 потребуется
большая плотность воды, чем в смятой ледяной пленке. Поверхностный повтор
короче, чем обычное разделение водородных связей O–O ранее
было показано, что это приводит к беспорядку и снятию напряжения в пленках воды.
Эта структура стабилизируется образованием
сильных водородных связей между водой и ОН, причем ОН расположены в виде димеров
дефекты Бьеррума. 22 Боковая плотность
воды в этой структуре на 4,3% меньше, чем в изогнутом шестиугольном
[0001] Самолет из насыпного льда I h , позволяющий
сеть, чтобы приспособить расстояние между водородными связями O–O и все еще
свяжите воду плоской, связанной с Cu. Хотя структура A2 сформировалась на
Ni также показывает ряды шестиугольных колец, которые прерываются правильными
дефекты вдоль направления плотной упаковки, в то время как гексагональные
строки не появляются рядом друг с другом в расположении c (2 × 2)
но отделены друг от друга дополнительной строкой вдоль [001]. Ni имеет 2,5%
шаг решетки меньше, чем у Cu, поэтому искаженный гексагонал c (2 ×
2) предложенная ранее структура 9 потребуется
большая плотность воды, чем в смятой ледяной пленке. Поверхностный повтор
короче, чем обычное разделение водородных связей O–O ранее
было показано, что это приводит к беспорядку и снятию напряжения в пленках воды. на Ру. 49,50 Расчеты теории функционала плотности показывают
что неповрежденная водопроводная сеть c (2 × 2) будет сильно изгибаться
и энергетически невыгодно, 19 при этом
образование плоской сетки c(2 × 2) OH–H 2 O
потребуется значительное боковое сжатие. Представлены результаты СТМ
здесь показано, что структура A2 на Ni(110) состоит из коротких совмещенных граней
шестиугольные ряды периодически прерываются для снятия напряжения вдоль [11̅0],
вызывая ок. 6 единиц LEED-расщепления, которые необходимо соблюдать,
с полной гексагональной структурой c (2 × 2), модифицированной в пользу
из более широко расположенных (2 × 3) шестиугольных рядов.
на Ру. 49,50 Расчеты теории функционала плотности показывают
что неповрежденная водопроводная сеть c (2 × 2) будет сильно изгибаться
и энергетически невыгодно, 19 при этом
образование плоской сетки c(2 × 2) OH–H 2 O
потребуется значительное боковое сжатие. Представлены результаты СТМ
здесь показано, что структура A2 на Ni(110) состоит из коротких совмещенных граней
шестиугольные ряды периодически прерываются для снятия напряжения вдоль [11̅0],
вызывая ок. 6 единиц LEED-расщепления, которые необходимо соблюдать,
с полной гексагональной структурой c (2 × 2), модифицированной в пользу
из более широко расположенных (2 × 3) шестиугольных рядов.
Несмотря на
беспорядок, присутствующий в структуре A2, и его неопределенная
Состав OH/H 2 O, полезно рассмотреть, как OH стабилизируется
эта двумерная структура. На основании состава 1:1, найденного с помощью XPS, Pirug et al. изначально предполагал искаженный шестиугольник c (2 × 2). сеть с чередованием OH и H 2 О группы, завершающие
Сеть Н-связей. 9 Это расположение аналогично
к плоской фазе OH/H 2 O, обнаруженной на гексагональных поверхностях, в том числе
Pt(111) 51−54 и Pd(111), 55 и сильно отличается от
дефекты ОН Бьеррума D-типа, присутствующие в структуре Cu(110). 22 В этом случае конструкция жертвует (слабо)
гидроксильных Н-связей с водой в пользу максимального количества сильных
вода Н-связями с гидроксилом. Короткие шестиугольные ряды, сформированные на Ni(110)
часто показывают яркие черты вдоль ряда, например в а, со структурой
между шестиугольными рядами с меньшим контрастом. Эти результаты предполагают
что сетка гофрированная, а шестиугольные ряды как-то
отличной от промежуточной структуры и содержащей некоторые особые,
периодические структуры Н-связей. На Cu(110) дефект OH Bjerrum, который
стабилизировать изображение водной сети ярче, чем плоская вода в STM, 22 , предполагая, что шестиугольные яркие черты
в гексагональных рядах на Ni(110) также могут быть дефекты Бьеррума, стабилизирующие
короткие шестиугольные водные ряды.
сеть с чередованием OH и H 2 О группы, завершающие
Сеть Н-связей. 9 Это расположение аналогично
к плоской фазе OH/H 2 O, обнаруженной на гексагональных поверхностях, в том числе
Pt(111) 51−54 и Pd(111), 55 и сильно отличается от
дефекты ОН Бьеррума D-типа, присутствующие в структуре Cu(110). 22 В этом случае конструкция жертвует (слабо)
гидроксильных Н-связей с водой в пользу максимального количества сильных
вода Н-связями с гидроксилом. Короткие шестиугольные ряды, сформированные на Ni(110)
часто показывают яркие черты вдоль ряда, например в а, со структурой
между шестиугольными рядами с меньшим контрастом. Эти результаты предполагают
что сетка гофрированная, а шестиугольные ряды как-то
отличной от промежуточной структуры и содержащей некоторые особые,
периодические структуры Н-связей. На Cu(110) дефект OH Bjerrum, который
стабилизировать изображение водной сети ярче, чем плоская вода в STM, 22 , предполагая, что шестиугольные яркие черты
в гексагональных рядах на Ni(110) также могут быть дефекты Бьеррума, стабилизирующие
короткие шестиугольные водные ряды. Хотя узлы Ni между парами
шестиугольных рядов также предлагают благоприятные места для связывания воды, это
невозможно устроить полный монослой без мучений
боковая деформация, описанная ранее. b предполагает возможное расположение воды
в этой области для создания пентамеров или октамерных колец с общим лицом, которые
в целом имитируют наблюдаемые кольца разного размера. Упорядоченные структуры
содержащие чередующиеся пентамерные и октамерные кольца, расположенные между
между протяженными шестиугольными водными рядами, обнаружены в первом
слой воды на Cu(511) 43 и как штамм
структура рельефа во втором слое воды по Pt и Ru. 49,56 Однако отсутствие дальнего порядка в структуре между
шестиугольные ряды на Ni(110) затрудняют точное определение
что поощряет их 3-кратный заказ. Ясно одно, что это
структура не является ни простым гексагональным дефектом Бьеррума c(2 × 2),
сеть, найденная на Cu(110) 22 , ни ранее
предлагаемая плоская сеть c(2 × 2) OH/H 2 O.
Хотя узлы Ni между парами
шестиугольных рядов также предлагают благоприятные места для связывания воды, это
невозможно устроить полный монослой без мучений
боковая деформация, описанная ранее. b предполагает возможное расположение воды
в этой области для создания пентамеров или октамерных колец с общим лицом, которые
в целом имитируют наблюдаемые кольца разного размера. Упорядоченные структуры
содержащие чередующиеся пентамерные и октамерные кольца, расположенные между
между протяженными шестиугольными водными рядами, обнаружены в первом
слой воды на Cu(511) 43 и как штамм
структура рельефа во втором слое воды по Pt и Ru. 49,56 Однако отсутствие дальнего порядка в структуре между
шестиугольные ряды на Ni(110) затрудняют точное определение
что поощряет их 3-кратный заказ. Ясно одно, что это
структура не является ни простым гексагональным дефектом Бьеррума c(2 × 2),
сеть, найденная на Cu(110) 22 , ни ранее
предлагаемая плоская сеть c(2 × 2) OH/H 2 O. 9
9
Вода самопроизвольно диссоциирует на Ni(110)
так как поверхность нагревается
от 150 до 180 К, стабилизация воды в короткие, совпадающие по граням шестиугольные
ряды внутри неупорядоченной (2 × 3) структуры. 2D сеть
прерывается обычными элементами снятия натяжения, которые делят пополам воду / гидроксил
сети в обоих направлениях, что позволяет конструкции разместить
от более длинного интервала O–O в шестиугольных рядах до короткого
Расстояние Ni–Ni шаблона. Эта конструкция вмещает
ряд составов вода / OH, возможно, за счет образования дефектов OH Bjerrum,
с неупорядоченной, изменчивой структурой между гексагональными рядами.
Двумерная сетка распадается при температуре выше 220 K с образованием (OH/H 2 О)
фазы, состоящей из зигзагообразных водных цепочек, стабилизированных донорством
ОЙ. Цепи (OH/H 2 O) отталкиваются друг от друга, упорядочиваясь в
структура (2 0, 1 4), которая разлагается до ОН около 245 К при дальнейшем
вода десорбируется.
Эта работа была поддерживается EPSRC через гранты EP/K039687/1 и SCG10020.
Опорный Информация доступна бесплатно по адресу https://pubs.acs.org/doi/10.1021/acs.jpcc.0c08708.
Авторы заявляют об отсутствии конкурирующие финансовые интересы.
jp0c08708_si_001.pdf (2.9M, pdf)
- Ван Д.; Астрюк Д. Недавнее развитие эффективных земных нанокатализаторы на основе переходных металлов. хим. соц. преп. 2017, 46, 816–854. 10.1039/c6cs00629a. [PubMed] [CrossRef] [Google Scholar]
- Азиз М.А.А.; Джалил А. А.; Тривахионо С.; Ахмад А. CO2 метанирование свыше гетерогенные катализаторы: недавний прогресс и перспективы на будущее. Зеленый хим. 2015, 17, 2647–2663. 10.1039/c5gc00119f. [Перекрестная ссылка] [Академия Google]
- Де С.; Чжан Дж.; Лук Р.; Ян Н. биметаллический на основе никеля гетерогенные катализаторы для энергетики и окружающей среды. Энергетическая среда. науч. 2016, 9, 3314–3347. 10.1039/c6ee02002j. [CrossRef] [Google Scholar]
- Pistonesi C.
 ; Хуан А.; Иригойен Б.; Амадео Н.
Теоретические и экспериментальные
исследование реакций паровой конверсии метана на никелевом катализаторе. заявл. Серф. науч.
2007, 253, 4427–4437. 10.1016/j.apsusc.2006.09.054. [CrossRef] [Google Scholar]
; Хуан А.; Иригойен Б.; Амадео Н.
Теоретические и экспериментальные
исследование реакций паровой конверсии метана на никелевом катализаторе. заявл. Серф. науч.
2007, 253, 4427–4437. 10.1016/j.apsusc.2006.09.054. [CrossRef] [Google Scholar] - Мохсензаде А.; Ричардс Т .; Болтон К. DFT-исследование конверсии водяного газа реакция на поверхности Ni(111), Ni(100) и Ni(110). Серф. науч. 2016, 644, 53–63. 10.1016/j.susc.2015.090,014. [CrossRef] [Google Scholar]
- Галлахер М. Э.; Хак С.; Омер А.; Ходжсон А. Монослой воды и многослойная адсорбция на Ni(111). Серф. науч. 2007, 601, 268–273. 10.1016/j.susc.2006.09.034. [CrossRef] [Google Scholar]
- Шиотари А.; Сугимото Ю.; Камио Х. Характеристика двух- и одномерные водные сети на Ni(111) методом атомно-силовой микроскопии. физ. Преподобный Матер. 2019, 3, 093001. 10.1103/физревматериалы.3.093001. [CrossRef] [Google Scholar]
- Михаэлидис А.; Моргенштерн К.
Ледяные нанокластеры
на гидрофобных металлических поверхностях.
 Нац. Матер.
2007, 6, 597–601. 10.1038/nmat1940. [PubMed] [CrossRef] [Google Scholar]
Нац. Матер.
2007, 6, 597–601. 10.1038/nmat1940. [PubMed] [CrossRef] [Google Scholar] - Пируг Г.; Кнауфф О.; Бонзель Х. П. Структурные и химические аспекты Адсорбция h3O на Ni(110). Серф. науч. 1994, 321, 58–70. 10.1016/0039-6028(94)-4. [CrossRef] [Google Scholar]
- Андерссон К.; Кеттелер Г.; Блюм Х .; Ямамото С.; Огасавара Х.; Петтерссон Л.Г.М.; Салмерон М.; Нильсон А. Автокаталитическая вода диссоциация на Cu(110) в условиях, близких к комнатной. Варенье. хим. соц. 2008, 130, 2793–2797. 10.1021/ja073727x. [PubMed] [CrossRef] [Академия Google]
- Мохсензаде А.; Болтон К.; Ричардс Т. DFT-исследование адсорбции и диссоциации воды на поверхности Ni(111), Ni(110) и Ni(100). Серф. науч. 2014, 627, 1–10. 10.1016/j.susc.2014.04.006. [CrossRef] [Google Scholar]
- Синивасан Х.; Тивари А.К. Адсорбция воды и диссоциация на Ni(110): как он отличается от своих плотно упакованных собратьев?. Дж. Хим. физ. 2014, 140, 174704. 10.1063/1.4873898. [PubMed] [CrossRef] [Google Scholar]
- Zhu L.
 ; Лю С .; Вен Х.; Ли Ю.-В.; Цзяо Х.
Зависит от покрытия
структура и энергия диссоциативной адсорбции воды на чистых и
Предварительно покрытые O Ni(100) и Ni(110). Катал. науч.
Технол.
2019, 9, 4725–4743. 10.1039/c9cy01251f. [CrossRef] [Google Scholar]
; Лю С .; Вен Х.; Ли Ю.-В.; Цзяо Х.
Зависит от покрытия
структура и энергия диссоциативной адсорбции воды на чистых и
Предварительно покрытые O Ni(100) и Ni(110). Катал. науч.
Технол.
2019, 9, 4725–4743. 10.1039/c9cy01251f. [CrossRef] [Google Scholar] - Банге К.; Гридер Д.Э.; Мэди Т.Е.; Сасс Дж. К. Химия поверхности h3O на чистой и покрытой кислородом Cu(110). Серф. науч. 1984, 137, 38–64. 10.1016/0039-6028(84)-7. [CrossRef] [Google Scholar]
- Nöbl C.; Бенндорф С.; Мэди Т. Э. адсорбция h3O на Ni(110) — свидетельство для ориентированных димеров воды. Серф. науч. 1985, 157, 29–42. 10.1016/0039-6028(85)-8. [CrossRef] [Google Scholar]
- Benndorf C.; Мэди Т. Э.
Адсорбция h3O
на чистом и предварительно дозированном кислородом Ni(110). Серф.
науч.
1988, 194, 63–91. 10.1016/0039-6028(94)
-9. [CrossRef] [Google Scholar] - Широс Т.; Хак С.; Огасавара Х.; Такахаши О .; Острём Х.; Андерссон К.; Петтерссон Л.Г.М.; Ходжсон А.; Нильсон А.
Структура
воды, адсорбированной на открытой поверхности Cu(110): H-вверх, H-вниз или и то, и другое? хим.
 физ. лат.
2006, 429, 415–419. 10.1016/j.cplett.2006.08.048. [CrossRef] [Google Scholar]
физ. лат.
2006, 429, 415–419. 10.1016/j.cplett.2006.08.048. [CrossRef] [Google Scholar] - Карраско Дж.; Михаэлидес А.; Форстер М.; Хак С.; Раваль Р.; Ходжсон А. Новый объемная ледяная конструкция, построенная из пятиугольников. Нац. Матер. 2009 г., 8, 427–431. 10.1038/nmat2403. [PubMed] [CrossRef] [Google Scholar]
- Джеррард Н.; Мистри К.; Дарлинг Г.Р.; Ходжсон А. Формирование линейных водные цепочки на Ni(110). Дж. Физ. хим. лат. 2020, 11, 2121–2126. 10.1021/acs.jpclett.0c00407. [PubMed] [CrossRef] [Google Scholar]
- Spitzer A.; Лют Х. XPS-исследование адсорбции воды на Cu(110). Серф. науч. 1985, 160, 353–361. 10.1016/0039-6028(85)-4. [CrossRef] [Google Scholar]
- Пан З.; Дюррбек С.; Ха С .; Бертель Э.; Соморжай Г. А.; Салмерон М. Адсорбция и реакции воды на предварительно кислородном Cu(110). Дж. Физ. хим. С 2016, 120, 9218–9222. 10.1021/acs.jpcc.6b00769. [CrossRef] [Google Scholar]
- Форстер М.; Раваль Р.; Ходжсон А.; Карраско Дж.; Михаэлидес А.
 c (2 x 2) вода-гидроксил
слой на Cu(110): смачивающий слой, стабилизированный дефектами Бьеррума. физ. Преподобный Летт.
2011, 106, 046103. 10.1103/физревлетт.106.046103. [PubMed] [CrossRef] [Google Scholar]
c (2 x 2) вода-гидроксил
слой на Cu(110): смачивающий слой, стабилизированный дефектами Бьеррума. физ. Преподобный Летт.
2011, 106, 046103. 10.1103/физревлетт.106.046103. [PubMed] [CrossRef] [Google Scholar] - Guo H. S.; Заера Ф. Реакционная способность гидроксила виды от совместной адсорбции кислорода и воды на монокристаллических поверхностях Ni(110). Катал. лат. 2003, 88, 95–104. [Академия Google]
- Бенндорф Г.; Нобл К.; Мэди Т. Э. Адсорбция h3O на Ni(110) с дозированием кислорода — образование и ориентация ОН(ад). Серф. науч. 1984, 138, 292–304. 10.1016/0039-6028(84)-8. [CrossRef] [Google Scholar]
- Олле Л.; Салмерон М.; Баро А. М. Адсорбция и разложение воды на Ni(110) методом спектроскопии потерь энергии электронов. Дж. Вак. науч. Техн., А 1985, 3, 1866–1870. 10.1116/1.572934. [CrossRef] [Google Scholar]
- Хок М.; Сейп У.; Бассиньяна И.; Вагеманн К.; Купперс Дж.
Соадсорбция
кислорода и воды на поверхности Ni(110). Серф.
науч.
1986, 177, L978–L982.
 10.1016/0167-2584(86)
10.1016/0167-2584(86) - -х. [CrossRef] [Google Scholar]
- Callen B.W.; Гриффитс К.; Меммерт У.; Харрингтон Д.А.; Бушби С.Дж.; Нортон П. Р.
Адсорбция
воды на Ni(110)
— монослой, бислой и родственные им явления. Серф. науч.
1990, 230, 159–174. 10.1016/0039-6028(90)
-3. [CrossRef] [Google Scholar]
- Callen B.W.; Гриффитс К.; Нортон П. Р. Переориентация хемосорбированной воды на Ni(110) путем водородной связи со 2-м слоем. физ. Преподобный Летт. 1991, 66, 1634–1637. 10.1103/физревлетт.66.1634. [PubMed] [CrossRef] [Академия Google]
- Каллен Б.В.; Гриффитс К.; Каша Р. В.; Дженсен М.Б.; Тиль П.А.; Нортон П. Р. Структурный явления, связанные с ассоциативными и диссоциативными адсорбция воды на Ni(110). Дж. Хим. физ. 1992, 97, 3760–3774. 10.1063/1.462957. [CrossRef] [Google Scholar]
- Callen B.W.; Гриффитс К.; Нортон П. Р.
Наблюдение за свободными гидроксильными группами
на поверхности сверхтонких слоев льда на Ni(110). Серф. науч.
1992, 261, Л44–Л48. 10.
 1016/0039-6028(92)-н. [CrossRef] [Академия Google]
1016/0039-6028(92)-н. [CrossRef] [Академия Google] - Каллен Б.В.; Гриффитс К.; Нортон П.Р.; Харрингтон Д. А. Автокаталитический разложение воды на Ni(110). Дж. Физ. хим. 1992, 96, 10905–10913. 10.1021/j100205a055. [CrossRef] [Google Scholar]
- Пангер Н.; Шмальц А.; Хаас Дж. Структура определение воды хемосорбировано на Ni (110) с использованием измерений тонкой структуры по поглощению рентгеновских лучей. хим. физ. лат. 1994, 221, 189–193. 10.1016/0009-2614(94)00250-9. [CrossRef] [Google Scholar]
- Форстер М.; Раваль Р.; Карраско Дж.; Михаэлидес А.; Ходжсон А. Водно-гидроксильные фазы на открытой металлическая поверхность: ломать лед рулит. хим. науч. 2012, 3, 93–102. 10.1039/c1sc00355k. [CrossRef] [Google Scholar]
- Винклер А.; Рендулич К. Д. Адсорбционная кинетика адсорбции водорода на никеле и коадсорбция водорода и кислорода. Серф. науч. 1982, 118, 19–31. 10.1016/0039-6028(82) -3. [CrossRef] [Google Scholar]
- Christmann K.; Чехаб Ф.
 ; Пенка В.; Эртл Г.
Реконструкция поверхности
явления поверхностного взрыва в системе никель (110) водород. Серф. науч.
1985, 152–153, 356–366. 10.1016/0039-6028(85)
; Пенка В.; Эртл Г.
Реконструкция поверхности
явления поверхностного взрыва в системе никель (110) водород. Серф. науч.
1985, 152–153, 356–366. 10.1016/0039-6028(85)- -7. [Перекрестная ссылка] [Академия Google]
- МакБрайд Ф.; Ходжсон А. Вода и ее части диссоциированные фрагменты на металле поверхности. Междунар. Преподобный физ. хим. 2017, 36, 1–38. 10.1080/0144235х.2016.1253244. [CrossRef] [Google Scholar]
- Guo H.; Заера Ф. Реакционная способность гидроксильных групп по отношению к аммиаку Поверхности Ni(110). Серф. науч. 2003, 524, 1–14. 10.1016/s0039-6028(02)02486-х. [CrossRef] [Google Scholar]
- Чжао В.; Байдич М.; Кэри С.; Воеводич А.; Норсков Дж. К.; Кэмпбелл С. Т. Вода Диссоциативная адсорбция на NiO(111): энергетика и структура гидроксилированной поверхности. СКУД Катал. 2016, 6, 7377–7384. 10.1021/acscatal.6b01997. [CrossRef] [Google Scholar]
- Юдзава Т.; Хигаси Т .; Кубота Дж.; Кондо Дж. Н.; Домен К.; Хиросе С.
CO-индуцированная коадсорбция
рекомбинация поверхностных гидроксилов
воды на поверхности Ni(110) методами IRAS и TPD.
 Серф. науч.
1995, 325, 223–229. 10.1016/0039-6028(94)00744-6. [CrossRef] [Google Scholar]
Серф. науч.
1995, 325, 223–229. 10.1016/0039-6028(94)00744-6. [CrossRef] [Google Scholar] - Seh Z. W.; Кибсгаард Дж.; Диккенс С.Ф.; Чоркендорф И.; Норсков Дж. К.; Джарамилло Т. Ф. Сочетание теории и эксперимента в электрокатализ: понимание дизайна материалов. Наука 2017, 355, eaad4998 10.1126/science.aad4998. [PubMed] [CrossRef] [Google Scholar]
- Цай С.; Лук-порей.; Ю Дж. С.; Лю Х.; Алджама Х.; Чен Л.Д.; Диккенс С.Ф.; Гейслер Т.С.; Гвидо CJ; Джозеф Т.М.; и другие. Прямое разложение воды на поверхностях из переходных металлов: конструкционные зависимость и каталитический скрининг. Катал. лат. 2016, 146, 718–724. 10.1007/s10562-016-1708-7. [CrossRef] [Google Scholar]
- Бертрам К.; Аубургер П.; Бокстед М.; Штелер Дж.; Бовензипен У.; Моргенштерн К. Влияние Сольватация электронов на льду Структуры на молекулярном уровне. Дж. Физ. хим. лат. 2020, 11, 1310–1316. 10.1021/acs.jpclett.9б03723. [PubMed] [CrossRef] [Google Scholar]
- Лин С.; Авидор Н.; Корем Г.
 ; Годси О.; Александрович Г.; Дарлинг Г.Р.; Ходжсон А.
Двумерный
смачивание ступенчатого
медная поверхность. физ. Преподобный Летт.
2018, 120, 076101. 10.1103/физревлетт.120.076101. [PubMed] [CrossRef] [Google Scholar]
; Годси О.; Александрович Г.; Дарлинг Г.Р.; Ходжсон А.
Двумерный
смачивание ступенчатого
медная поверхность. физ. Преподобный Летт.
2018, 120, 076101. 10.1103/физревлетт.120.076101. [PubMed] [CrossRef] [Google Scholar] - Horcas I.; Фернандес Р.; Гомес-Родригес Х.М.; Колчеро Дж.; Гомес-Эрреро Х.; Баро А. М. WSXM: А программное обеспечение для сканирующей зондовой микроскопии и инструмент для нанотехнологий. преподобный наук. Инструм. 2007, 78, 013705. 10.1063/1.2432410. [PubMed] [CrossRef] [Академия Google]
- Тиль П. А.; Мэди Т. Э. Взаимодействие воды с твердыми поверхностями: фундаментальные аспекты. Серф. науч. Респ. 1987, 7, 211–385. 10.1016/0167-5729(87)-х. [CrossRef] [Google Scholar]
- Roux C.D.; Бу Х.; Рабале Дж. В. Структура Поверхность Ni(110)-p(2 X 1)-OH по времени пролета спектрометрия рассеяния и отдачи. Серф. науч. 1992, 279, 1–12. 10.1016/0039-6028(92)-кв. [CrossRef] [Google Scholar]
- Ши Ю.; Чой Б.Ю.; Салмерон М.
Водяные цепи
направлять рост
одноатомные медные проволоки на Cu(110).
 Дж. Физ.
хим. С
2013, 117, 17119–17122. 10.1021/jp4057434. [CrossRef] [Google Scholar]
Дж. Физ.
хим. С
2013, 117, 17119–17122. 10.1021/jp4057434. [CrossRef] [Google Scholar] - Кумагаи Т.; Кайдзу М.; Окуяма Х .; Хатта С.; Аруга Т.; Хамада И.; Морикава Я. Туннелирование динамика гидроксила группа, адсорбированная на Cu(110). физ. Преп. B: Конденсирует. Материя Матер. физ. 2009, 79, 035423. 10.1103/физревб.79.035423. [CrossRef] [Google Scholar]
- Майер С.; Лехнер Б.А.Дж.; Соморжай Г. А.; Салмерон М. Рост и структура первых слоев льда на Ru(0001) и Pt(111). Варенье. хим. соц. 2016, 138, 3145–3151. 10.1021/jacs.5b13133. [PubMed] [CrossRef] [Академия Google]
- Галлахер М.; Омер А.; Дарлинг Г.Р.; Ходжсон А. Порядок и беспорядок в смачивающем слое на Ru(0001). Фарадей Обсудить. 2009, 141, 231–249. 10.1039/b807809b. [PubMed] [CrossRef] [Google Scholar]
- Михаэлидес А.; Ху П. Изучение теории функционала плотности гидроксила и промежуточного соединения в реакции образования воды на Pt. Дж. Хим. физ. 2001, 114, 513–519. 10.1063/1.1328746. [CrossRef] [Google Scholar]
- Хелд Г.
 ; Клэй С.; Барретт С.Д.; Хак С.; Ходжсон А.
Структура
смешанных оверслоев OH+h3O на Pt(111). Дж. Хим.
физ.
2005, 123, 064711. 10.1063/1.1996572. [PubMed] [CrossRef] [Google Scholar]
; Клэй С.; Барретт С.Д.; Хак С.; Ходжсон А.
Структура
смешанных оверслоев OH+h3O на Pt(111). Дж. Хим.
физ.
2005, 123, 064711. 10.1063/1.1996572. [PubMed] [CrossRef] [Google Scholar] - Карлберг Г. С.; Ванстрём Г. Модель взаимодействия OH+h3O-смешанного и чистого h3O верхние слои, адсорбированные на Pt(111). Дж. Хим. физ. 2005, 122, 194705. 10.1063/1.1
- 8. [PubMed] [CrossRef] [Google Scholar]
- Schiros T.; Огасавара Х.; Нэслунд Л.-Э.; Андерссон К.Дж.; Рен Дж .; Мэн С.; Карлберг Г.С.; Оделиус М.; Нильссон А.; Петтерссон Л. Г. М. Кооперативность в поверхностном связывании и водородном связывании воды и гидроксила на металлических поверхностях. Дж. физ. хим. С 2010, 114, 10240–10248. 10.1021/jp101855v. [Перекрестная ссылка] [Академия Google]
- Глина С.; Каммингс Л.; Ходжсон А. Смешанная вода/OH структуры на Pd(111). Серф. науч. 2007, 601, 562–568. 10.1016/j.susc.2006.10.024. [CrossRef] [Google Scholar]
- Джеррард Н.; Гаттинони К.; Макбрайд Ф.; Михаэлидес А.
 ; Ходжсон А.
Снятие напряжения во время
рост льда на шестиугольном шаблоне. Варенье. хим.
соц.
2019, 141, 8599–8607. 10.1021/jacs.9b03311. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
; Ходжсон А.
Снятие напряжения во время
рост льда на шестиугольном шаблоне. Варенье. хим.
соц.
2019, 141, 8599–8607. 10.1021/jacs.9b03311. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Разложение перекиси водорода
Перекись водорода (H 2 O 2 ) повсюду. Он содержится в вашем отбеливателе, краске для волос, чистящем шкафу и даже в ваших отбеливателях для зубов. Чего вы можете не знать, так это того, что это химическое вещество постоянно разлагается. Это происходит очень медленно, но с помощью магии науки мы можем ускорить это.
В этом посте:
Почему разлагается перекись водорода?Когда дело доходит до точного определения того, почему перекись водорода так легко разлагается, мы должны взглянуть на химическую структуру H 2 O 2 молекула.
Перекись водорода содержит одинарную кислород-кислородную связь. Иначе известная как перекисная связь, она невероятно слабая и нестабильная.
При разрыве связи кислород-кислород перекись водорода разлагается на воду и кислород. Когда это происходит, он высвобождает свободные радикалы, которые вступают в реакцию с другими веществами.
Хотя эту реакцию разложения можно ускорить с помощью катализатора, нестабильность пероксидной связи означает, что разложение также происходит естественным образом.
Естественное разложение перекиси водородаОт косметических до промышленных применений перекись водорода используется для самых разных целей. Но у этих отраслей всегда есть одна общая черта: как хранится перекись водорода.
Перекись водорода имеет ограниченный срок хранения, поскольку со временем она естественным образом разлагается на воду и газообразный кислород. Хотя это займет некоторое время, ультрафиолетовые лучи солнечного света, а также теплые условия могут фактически катализировать реакцию разложения.
Вот почему перекись водорода обычно хранят в темных пластиковых контейнерах. Непрозрачный цвет защищает химическое вещество от солнечного света, а пластиковый материал приспосабливается к любому накоплению газообразного кислорода, которое может возникнуть.
Непрозрачный цвет защищает химическое вещество от солнечного света, а пластиковый материал приспосабливается к любому накоплению газообразного кислорода, которое может возникнуть.
Стеклянный контейнер, например, может разбиться при повышении давления. Именно поэтому на контейнеры с перекисью водорода устанавливаются вентилируемые крышки, поскольку они обеспечивают выход любого выделяющегося кислорода.
Контейнеры из темного пластика используются для хранения перекиси водорода. Непрозрачный цвет защищает его от солнечного света, который может катализировать его разложение.Реакции с перекисью водорода
Перекись водорода вступает в химическую реакцию несколькими способами:
- Разложение : Как разлагается перекись водорода? Он термодинамически нестабилен. При более высоких температурах и концентрациях он разлагается с образованием воды и кислорода. Разложение перекиси водорода может катализироваться другими соединениями, такими как переходные металлы, такие как серебро и платина.

- Окислительно-восстановительные реакции: В зависимости от уровня pH перекись водорода обладает сильными восстановительными и окислительными (окислительно-восстановительными) свойствами. Как окислитель он может отбирать электроны у других веществ. В качестве восстановителя он может восстанавливать различные неорганические ионы.
- Предшественник других пероксидных соединений: Будучи слабой кислотой, пероксид водорода образует гидропероксид в сочетании с различными металлами и их соединениями.
Какой катализатор используется при разложении перекиси водорода?
Солнечный свет — не единственное, что может ускорить реакцию разложения перекиси водорода. В лаборатории можно использовать несколько катализаторов для ускорения реакции. К ним относятся:
- Оксид марганца (IV)
- Йодид калия
- Железо (III) хлорид
- Двуокись свинца
- Каталаза
В организме фермент каталаза катализирует разложение перекиси водорода на воду и газообразный кислород. Этот процесс происходит практически во всех живых организмах, в том числе и в пчелах.
Этот процесс происходит практически во всех живых организмах, в том числе и в пчелах.
При проведении реакции в лаборатории предпочтительным катализатором обычно является оксид марганца (IV). Однако существует широкий выбор катализаторов, и каждый из них будет иметь разную эффективность.
Почему катализаторы ускоряют реакции?Катализаторы способны снизить энергию активации, необходимую для реакции. Это означает, что они могут увеличить скорость реакции, не израсходовавшись.
Таким образом, в конце реакции оставшийся катализатор можно использовать повторно. Это очень удобно для коммерческих или промышленных процессов, поскольку потребляется меньше продукта.
Как перекись водорода разлагается в химических реакциях?Когда вы добавляете небольшое количество катализатора в колбу с водным раствором перекиси водорода, первое, что вы заметите, это мгновенное изменение цвета.
В присутствии оксида марганца (IV) или хлорида железа (III) прозрачный раствор немедленно становится черным. Поскольку катализатор творит чудеса, перекись водорода начнет очень быстро разлагаться.
Поскольку катализатор творит чудеса, перекись водорода начнет очень быстро разлагаться.
Когда это произойдет, раствор начнет быстро шипеть. Это вызвано двумя причинами:
- Быстрое разложение означает образование большого количества газообразного кислорода в виде пузырьков
- Реакция разложения высвобождает тепловую энергию, что делает ее экзотермической и шипящей реакцией
По мере того, как разложение перекиси водорода продолжается, в колбе быстро нарастает большое давление из-за объема образующегося газообразного кислорода. Реакция завершится бурным выбросом смеси вверх из колбы.
Слоновья зубная пастаЭту химическую реакцию можно превратить в веселый эксперимент для детей (и взрослых!). При добавлении жидкости для мытья посуды в раствор H 2 O 2 конечный продукт представляет собой густую пену, которая выливается из контейнера, как слоновья зубная паста.
Присутствие мыльной воды способно задерживать кислород, выделяющийся при разложении. Это создает густую пену, которая вытесняется из контейнера из-за повышения давления.
Это создает густую пену, которая вытесняется из контейнера из-за повышения давления.
Наиболее распространенным катализатором, используемым в этом эксперименте, является йодид калия, но большинство катализаторов достигают того же эффекта, если добавить средство для мытья посуды.
Измерение реакцииДобавляя катализатор в водный раствор H 2 O 2 и записывая скорость реакции через определенные промежутки времени, вы можете контролировать общий объем образующегося газообразного кислорода. . Вот как это сделать:
- Налейте немного водного раствора перекиси водорода в вертикальную колбу
- Добавить в раствор небольшое количество катализатора
- Быстро закройте колбу пробкой, чтобы предотвратить утечку выделяющегося кислорода
- Запишите объем кислорода через определенные промежутки времени на протяжении всей реакции
- Используя график, постройте объем произведенного кислорода в зависимости от определенного времени
Когда вы закончите свой график, у вас должна остаться кривая. Чтобы вычислить скорость реакции, просто выберите точку на кривой и проведите к ней касательную.
Чтобы вычислить скорость реакции, просто выберите точку на кривой и проведите к ней касательную.
Вычисление градиента касательной даст вам скорость разложения в конкретный момент времени. Чем круче градиент, тем выше скорость реакции.
ReAgent не только продает перекись водорода высшего качества в различных растворах, но и различные катализаторы для продажи в нашем интернет-магазине. От йодида калия до хлорида железа (III) — у нас есть ингредиенты, которые вам понадобятся, чтобы сделать собственную зубную пасту для слонов!
Отказ от ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения по поводу вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Если у вас есть какие-либо сомнения по поводу вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Получение воды из водорода и кислорода
Эта запись была опубликована автором Anne Helmenstine (обновлено )
Химическая реакция между кислородом и водородом образует воду. (Энн Хелменстин)
Сделать воду из водорода и кислорода так же просто, как смешать газообразный водород и газообразный кислород и добавить искру или тепло. Сбалансированное уравнение химической реакции:
2 H 2 + O 2 → 2 H 2 O
Это реакция синтеза, в результате которой вода образуется из ее элементов. Это тоже реакция горения. Сжигание водорода для получения воды дает яркое красное пламя и громкий звук.
Как водород и кислород создают воду
Простое смешивание водорода и кислорода не приведет к получению воды. Водород и кислород существуют в виде двухатомных газов. Реакция между ними требует энергии, чтобы разорвать связи между атомами, чтобы они могли образовать новый продукт. Когда связи разрываются, каждый атом водорода имеет положительный заряд +1, а каждый атом кислорода имеет отрицательный заряд -2. Два атома водорода, связанные с одним атомом кислорода, дают воду, электрически нейтральную. Электрическая искра работает, чтобы инициировать реакцию, как и тепло. Но как только реакция начинается, она сильно экзотермична и идет к завершению.
Водород и кислород существуют в виде двухатомных газов. Реакция между ними требует энергии, чтобы разорвать связи между атомами, чтобы они могли образовать новый продукт. Когда связи разрываются, каждый атом водорода имеет положительный заряд +1, а каждый атом кислорода имеет отрицательный заряд -2. Два атома водорода, связанные с одним атомом кислорода, дают воду, электрически нейтральную. Электрическая искра работает, чтобы инициировать реакцию, как и тепло. Но как только реакция начинается, она сильно экзотермична и идет к завершению.
Простые демонстрации получения воды
Легко продемонстрировать получение воды из водорода и кислорода. Главное, чтобы масштаб реакции был небольшим. В противном случае выделяется слишком много тепла.
Один из методов заключается в пропускании водорода через мыльную воду с образованием водородных мыльных пузырей. Эти пузырьки плавают, потому что они легче воздуха. Используйте зажигалку с длинной ручкой или горящую шину, прикрепленную к метровой палке, чтобы поджечь пузыри. Получите водород либо из баллона со сжатым газом, либо с помощью химической реакции.
Получите водород либо из баллона со сжатым газом, либо с помощью химической реакции.
Другой метод заключается в наполнении небольшого воздушного шара водородом и прикосновении к воздушному шару горящей щепкой, прикрепленной к измерительной палке. Водород в воздушном шаре реагирует с кислородом воздуха. Вы можете наполнить воздушный шар как водородом, так и кислородом и поджечь его, но только за защитным экраном и с использованием средств защиты органов слуха.
См. разницу между использованием чистого водорода и водорода с кислородом. Обратите внимание на красный цвет реакции (в 1:50).Питьевая вода и топливные элементы
Согласно Докладу ООН о развитии водных ресурсов за 2006 год, примерно каждый пятый человек не имеет доступа к чистой питьевой воде. Если воду так легко сделать, почему бы нам не использовать ее в качестве источника пресной воды? Есть две причины. Во-первых, опасно сочетать большое количество водорода и кислорода. Авария Гинденбурга является примером результата. Другая причина заключается в том, что это нецелесообразно с экономической или экологической точки зрения. Для производства водорода для производства воды требуется больше энергии, чем для получения воды из других источников.
Другая причина заключается в том, что это нецелесообразно с экономической или экологической точки зрения. Для производства водорода для производства воды требуется больше энергии, чем для получения воды из других источников.
Однако реакция между водородом и кислородом находит практическое применение в топливных элементах. В топливном элементе водород (или другое топливо) вступает в реакцию с кислородом (или другим окислителем), производя электричество и тепло. Топливные элементы используют катализаторы для снижения энергии активации реакции, поэтому ее легче инициировать. Никель является распространенным катализатором, а вода является наиболее распространенным «отходным» продуктом. Водородные топливные элементы используются для резервного производства электроэнергии, питания космических кораблей и удаленных объектов, а также в водородных автомобилях.
Почему водород и кислород образуют воду, а не перекись водорода
Вода — не единственное обычное химическое вещество, получаемое из водорода и кислорода. Вы можете задаться вопросом, почему водород и кислород образуют воду (H 2 O), а не перекись водорода (H 2 O 2 ). Самое простое объяснение состоит в том, что для двух атомов водорода гораздо выгоднее прореагировать с одним атомом кислорода, чем добавить в смесь еще один кислород. Несмотря на то, что газообразный кислород представляет собой O 2 , связь между атомами должна разорваться, чтобы кислород образовал связи с водородом и образовал воду. Помните, что хотя обычная степень окисления кислорода равна -2, на самом деле он показывает другие состояния. Иногда водород и кислород образуют перекись водорода, но молекула по своей природе нестабильна и в конечном итоге распадается на воду и кислород.
Вы можете задаться вопросом, почему водород и кислород образуют воду (H 2 O), а не перекись водорода (H 2 O 2 ). Самое простое объяснение состоит в том, что для двух атомов водорода гораздо выгоднее прореагировать с одним атомом кислорода, чем добавить в смесь еще один кислород. Несмотря на то, что газообразный кислород представляет собой O 2 , связь между атомами должна разорваться, чтобы кислород образовал связи с водородом и образовал воду. Помните, что хотя обычная степень окисления кислорода равна -2, на самом деле он показывает другие состояния. Иногда водород и кислород образуют перекись водорода, но молекула по своей природе нестабильна и в конечном итоге распадается на воду и кислород.
Лавуазье создает воду
Ученые знали, что кислород и водород создают воду задолго до того, как они поняли молекулярную основу химических реакций. Французский химик Антуан Лавуазье даже назвал эту реакцию водородом. Название водорода происходит от греческих слов, означающих «водообразующий». Лавуазье открыл роль кислорода в горении, в конечном итоге используя реакцию между водородом и кислородом, чтобы продемонстрировать сохранение массы для реакций горения и опровергнуть теорию флогистона.
Лавуазье открыл роль кислорода в горении, в конечном итоге используя реакцию между водородом и кислородом, чтобы продемонстрировать сохранение массы для реакций горения и опровергнуть теорию флогистона.
Ссылки
- Гроув, Уильям Роберт (1839 г.). «О вольтовых рядах и соединении газов платиной». Философский журнал и научный журнал . XIV (86–87): 127–130. doi:10.1080/14786443 9684
- Хаух, Энн; Эббесен, Суне Далгаард; и другие. (2008). «Высокоэффективный высокотемпературный электролиз». Журнал химии материалов . 18 (20): 2331. doi:10.1039/b718822f
- Хурми, Р. С. (2014). Материаловедение . С. Чанд и компания.
- Шмидт-Рор, К. (2015). «Почему сгорание всегда экзотермическое, дающее около 418 кДж на моль O 2 ». J. Chem. Образование . 92: 2094–2099. doi:10.1021/acs.jchemed.5b00333
Составление и разложение материи | manoa.hawaii.edu/ExploringOurFluidEarth
Химические реакции
Соединения состоят из атомов двух или более элементов, соединенных химически. Это химическое соединение называется соединением 9.0258 . Существует много типов химических реакций, в результате которых образуются химические соединения, некоторые из них описаны в таблице 1.4. В химической реакции одно или несколько веществ подвергаются химическому изменению с образованием другого вещества или веществ. Исходными веществами являются реагентов . Новое вещество, полученное в результате химической реакции, — продукт . Химическая реакция обычно записывается в следующем формате:
Это химическое соединение называется соединением 9.0258 . Существует много типов химических реакций, в результате которых образуются химические соединения, некоторые из них описаны в таблице 1.4. В химической реакции одно или несколько веществ подвергаются химическому изменению с образованием другого вещества или веществ. Исходными веществами являются реагентов . Новое вещество, полученное в результате химической реакции, — продукт . Химическая реакция обычно записывается в следующем формате:
реагент + реагент → продукт + продукт
Стрелка указывает на то, что произошла химическая реакция. Вышеприведенное утверждение следует читать как «реагент плюс реагент дает продукт и продукт».
Примером химической реакции является нейтрализация желудочной кислоты антацидом. Химическая формула антацида Ca(OH) 2 . Желудочная кислота представляет собой соляную кислоту (HCl). Когда эти два реагента объединяются, они реагируют с образованием хлорида кальция (CaCl 2 ) и воды (H 2 О). Вода образуется из OH в Ca(OH) 2 и H в HCl, чтобы получить HOH, другой способ записи H 2 O. Химическая реакция записывается в следующем формате:
Когда эти два реагента объединяются, они реагируют с образованием хлорида кальция (CaCl 2 ) и воды (H 2 О). Вода образуется из OH в Ca(OH) 2 и H в HCl, чтобы получить HOH, другой способ записи H 2 O. Химическая реакция записывается в следующем формате:
Ca( OH) 2 + 2 HCl → CaCl 2 + 2 H 2 O
Эта реакция гласит: гидроксид кальция плюс соляная кислота дает хлорид кальция плюс вода . Примеры химических реакций приведены в таблице 1.4.
| Тип реакции | Модель Реакция | Пример реакции |
|---|---|---|
| Состав | А + В → АВ
Два или более реагента соединяются с образованием продукта | 4 Fe + O 2 → 2 Fe 2 O 3
железо плюс кислород дает оксид железа упрощенная реакция на образование ржавчины |
| Одиночная замена | А + ХУ → АУ + Х
Производится однократное переключение между компонентами двух реагентов | 3 Ag 2 S + 2 Al → 6 Ag + Al 2 S 3
сульфид серебра плюс алюминий дает сульфид серебра и алюминия реакция для полировки потускневшего серебра в ванне с алюминиевой фольгой |
| Двойная замена | AB + XY → AY + XB
Производится двойной переход между компонентами двух реагентов | Ca(OH) 2 + 2 HCl → CaCl 2 + 2 H 2 O
гидроксид кальция плюс соляная кислота дает хлорид кальция плюс вода реакция на нейтрализацию желудочной кислоты антацидом |
| Горение | C i H j +O 2 → CO 2 + H 2 O
Реагент, состоящий из углерода и водорода (углеводород), реагирует с кислородом с образованием двуокиси углерода и воды.
| CH 4 + 2 O 2 → CO 2 + 2 H 2 O
метан плюс кислород дает углекислый газ и воду реакция сжигания метана (основного компонента природного газа) |
| Разложение | АВ → А + В
Реагент распадается на два или более продуктов | 2 Н 2 О 2 → 2 Н 2 О + О 2
перекись водорода дает воду и газообразный кислород реакция на разложение перекиси водорода |
Соединения могут быть разложены на более простые соединения или их элементарные компоненты путем разрыва связей. Некоторые соединения разлагаются при нагревании или под воздействием солнечного света. Например, карбонат кальция (известняк) при нагревании разлагается на оксид кальция (негашеную известь) и углекислый газ. Свет разлагает перекись водорода на воду и кислород (рис. 1.8). Поскольку вода является чрезвычайно стабильным соединением, она не разлагается легко.
Например, карбонат кальция (известняк) при нагревании разлагается на оксид кальция (негашеную известь) и углекислый газ. Свет разлагает перекись водорода на воду и кислород (рис. 1.8). Поскольку вода является чрезвычайно стабильным соединением, она не разлагается легко.
В процессе электролиза используется электричество для разрыва связей, что приводит к разложению материи. Электричество — это поток электронов, отрицательно заряженных частиц в атомах. При электролизе химическое изменение вызывается электричеством, протекающим через химическое соединение.
Задание
Исследование состава воды с помощью электролиза. Чтобы электрический ток протекал, цепь должна быть замкнутой. Цепь может состоять из батареи и двух проводов, соединенных с электродами, которые уходят в раствор.
Аппарат Хоффмана
Аппарат Хоффмана используется для электролиза воды. Это стеклянная U-образная трубка, заполненная трубкой чертополоха (рис. 1.11). В таблице 1.5 поясняются части аппарата Хоффмана.
1.11). В таблице 1.5 поясняются части аппарата Хоффмана.
| Помеченные детали на рис. 1.11 | Имя | Описание |
|---|---|---|
| А | Трубка чертополоха | Средняя трубка имеет наверху воронкообразную секцию, называемую трубкой чертополоха, которая используется для заполнения аппарата водой, которая будет подвергаться электролизу. |
| Б | U-образная трубка | U-образная трубка состоит из двух вертикальных цилиндров, соединенных горизонтальной трубкой. Маркировка на баллонах позволяет точно измерять объемы газов и жидкостей. |
| С | Платиновые электроды | Платиновые электродынаходятся на дне цилиндров. Платиновые электроды проводят электричество и не подвержены коррозии. |
| Д | Запорные краны | Запорные краны можно открывать или закрывать для сбора газов. |
Мероприятие
Наблюдать за демонстрацией испытания пламенем для изучения газообразных продуктов электролиза. Демонстрационные материалы и процедура написаны в этом упражнении.
Электролиз
Электролиз использует электричество для расщепления воды на водород и кислород. На отрицательном полюсе батареи образуются электроны. Эти электроны текут по проводу к электроду в растворе (рис. 1.12). На отрицательном (-) электроде электроны передаются воде и подхватываются атомами водорода в воде. Это позволяет водороду отделяться от остальной части молекулы воды и образовывать молекулы h3. На другом электроде, положительном (+), электроны отдаются кислородом в молекуле воды, что позволяет кислороду отделяться от воды и образовывать молекулы O2. Электроны текут от этого электрода обратно к положительной клемме батареи.
Химическая реакция, которая произошла на положительном электроде:
2 H 2 O → O 2 + 4H + + 4E —
. Ciemical Recement, это произошло в Chemical Recement The Ciemical Recement The Ciemical. электрод был:
Ciemical Recement, это произошло в Chemical Recement The Ciemical Recement The Ciemical. электрод был:
2 H 2 O + 2e — → H 2 + 2OH —
Физические и химические изменения воды при кипячении
Физическое изменение происходит, когда жидкая вода испаряется в газообразный водяной пар. Кипение — это физическое изменение, потому что, хотя вода из жидкого состояния переходит в газообразное, и жидкость, и газ состоят из молекул воды. Молекула воды не распалась.
При электролизе воды (рис. 1.13 Б) из жидкой воды образуются газообразные водород и кислород. Электролиз воды вызывает химическое изменение, при котором молекулы воды расщепляются с образованием водорода и кислорода — двух веществ, которые химически отличаются от воды. Разложение воды затруднено и не может быть достигнуто только путем нагревания. Воду не разбивает даже жар вулканического извержения!
Сохранение материи
Важной характеристикой материи является то, что она никогда не может быть создана или уничтожена, а только преобразована.


 (107 196)
(107 196)