системные аспекты и ключевые проблемы. — 2008 — Электронная библиотека «История Росатома»
Пономарев-Степной Н. Н. и др. Атомно-водородная энергетика: системные аспекты и ключевые проблемы. — 2008 — Электронная библиотека «История Росатома»Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
Обложка123456789101112131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384858687888990919293949596979899100101102103104105106107108Обложка (с. 4)
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
1Титульные листы
3Содержание
4Глава 1. Атомно-водородная энергетика — необходимый компонент будущего энергообеспечения России и мира
4§ 1.1. Развитие концепции атомно-водородной энергетики
9§ 1.2. Работы по атомно-водородным программам
19Глава 2. Потребности и рынок водорода
19[Введение]
19§ 2.1. Потребители водорода
21§ 2.2. Водород как энергоноситель
30§ 2.3. Прогнозы мировых потребностей и рыночного потенциала водорода
36Глава 3. Технологии производства водорода
36[Введение]
43§ З.1. Водород из воды — термохимический цикл
56§ 3.2. Паровая адиабатическая конверсия метана
67§ 3.3. Высокотемпературный электролиз воды
76Глава 4. Потенциал применения ВТГР
90Глава 5. Хемотермические системы на базе МГР-Т
96Глава 6. АЭТС с блоком МГР-Т
105Список литературы
108Концевая страница
Обложка (с. 4)Обложка
Обращаясь к сайту «История Росатома — Электронная библиотека»,

Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок взаимодействия с Администрацией Сайта.
- Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации). Права Администрации Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
- Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей
или в соответствии с условиями, установленными такими правообладателями.

- Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также индивидуальные предприниматели (далее — «Пользователи»).
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные способы использования, предусмотренные действующим законодательством Российской Федерации.
- Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.

- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям (третьим лицам).
- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в
непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.

- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома» (www.biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт —
электронная
библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован
материал.

- Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-, видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.
- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от
них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения.

- Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:
- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
- Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте.
 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
- Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.

- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения вступают в силу с момента их опубликования на Сайте.
- По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: [email protected]
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
СогласенНе согласен
Исследование методов получения водорода в соответствии с принципами «зелёной химии»
Говоря о водороде как о экологически чистом топливе будущего, считается, что его производство не наносит вреда окружающей среде. Однако это не всегда так. Поэтому возникла потребность в реорганизации производственных процессов для прекращения зависимости от невозобновляемых ресурсов, сведения к минимуму отходов, повышения энергоэффективности и экологичности. Систематический подход «Зелёная Химия», основанных на 12 принципах, может в этом помочь. Настоящая работа направлена на исследование способов получения водорода в соответствии с принципами «зелёной химии». Исследованные способы получения водорода были разделены на 4 группы по источникам энергии: электрические, тепловые, смешенные и биологические. После обзора основных процессов производства водорода, мы заключаем, что электролиз воды среди электрических методов, газификация биомассы, будучи нейтральной по СО2, среди термических методов, фотоэлектрохимическое производство среди гибридных методов, а также биофотолиз и фотоферментация среди биологических методов, делают производство водорода «зелёным».
Однако это не всегда так. Поэтому возникла потребность в реорганизации производственных процессов для прекращения зависимости от невозобновляемых ресурсов, сведения к минимуму отходов, повышения энергоэффективности и экологичности. Систематический подход «Зелёная Химия», основанных на 12 принципах, может в этом помочь. Настоящая работа направлена на исследование способов получения водорода в соответствии с принципами «зелёной химии». Исследованные способы получения водорода были разделены на 4 группы по источникам энергии: электрические, тепловые, смешенные и биологические. После обзора основных процессов производства водорода, мы заключаем, что электролиз воды среди электрических методов, газификация биомассы, будучи нейтральной по СО2, среди термических методов, фотоэлектрохимическое производство среди гибридных методов, а также биофотолиз и фотоферментация среди биологических методов, делают производство водорода «зелёным».
В последние годы принципы «зелёной химии» приобрели большое значение при проектировании химических процессов, чтобы сделать их более экологически безопасными. Термин «Зелёная Химия» был впервые предложен в 1991 году Полом Анастасом и Джоном Уорнером из Агентства по охране окружающей среды (АООС), а в 1998 году теми же исследователями были разработаны 12 основополагающих принципов [1]. «Зелёная химия» — это производство химических продуктов и разработка химических процессов, которые уменьшают или исключают использование и производство экологически опасных веществ. В 12 принципов «зелёной химии» входят: предотвращение образованию отходов, атомная эффективность, более безопасный синтез, более безопасные продукты, энергоэффективность, более безопасные вспомогательные вещества, использование возобновляемого сырья, сокращение побочных продуктов, использование катализа, способность к биологическому разложению, предотвращение загрязнений и аварий [2].
Термин «Зелёная Химия» был впервые предложен в 1991 году Полом Анастасом и Джоном Уорнером из Агентства по охране окружающей среды (АООС), а в 1998 году теми же исследователями были разработаны 12 основополагающих принципов [1]. «Зелёная химия» — это производство химических продуктов и разработка химических процессов, которые уменьшают или исключают использование и производство экологически опасных веществ. В 12 принципов «зелёной химии» входят: предотвращение образованию отходов, атомная эффективность, более безопасный синтез, более безопасные продукты, энергоэффективность, более безопасные вспомогательные вещества, использование возобновляемого сырья, сокращение побочных продуктов, использование катализа, способность к биологическому разложению, предотвращение загрязнений и аварий [2].
Сегодня, выброс в атмосферу СО2 является серьезной экологической проблемой [3]. На протяжении веков, уголь, природный газ и нефть были основными энергетическими ресурсами в мире; Но сейчас к ним предъявляются всё более жесткие экологические и энергетические требования, а потребление ископаемого топлива сокращается [4]. Цель производства водорода как «зелёного водорода» в том, чтобы снизить или нивелировать пагубное влияние на окружающую среду. Для этого при извлечении водорода из природных топлив необходимо удалить весь СО2 и другие вредные для экологии примеси.
Цель производства водорода как «зелёного водорода» в том, чтобы снизить или нивелировать пагубное влияние на окружающую среду. Для этого при извлечении водорода из природных топлив необходимо удалить весь СО2 и другие вредные для экологии примеси.
Водород — перспективный энергоноситель будущего, поскольку он является важной и экологически чистой альтернативой ископаемым видам топлива [6]. Тем не менее, он может быть получен из широкого спектра различного сырья, поэтому метод производства водорода определяет выбросы, которые будут происходить.
Производство водорода не всегда является свободным от СО2. Существуют различные способы производства, такие как газификация, электролиз и некоторые биологические методы, в то же время может использоваться различное сырьё, как вода, биомасса или уголь. Некоторые пути производства используют невозобновляемые ресурсы, другие — опасные химические вещества. Для достижения цели очистить весь производственный маршрут от начала до конца необходимо провести систематический анализ. Такой анализ должен рассматривать всё производство в контексте прекращения зависимости от невозобновляемых ресурсов, минимизации отходов, повышения КПД или внедрение возобновляемых ресурсов в процесс.
Такой анализ должен рассматривать всё производство в контексте прекращения зависимости от невозобновляемых ресурсов, минимизации отходов, повышения КПД или внедрение возобновляемых ресурсов в процесс.
В данном исследовании представлен всеобъемлющий список способов производства водорода из возобновляемых и невозобновляемых ресурсов, независимо от того, отвечают ли они принципам «зелёной химии». С этой целью 13 хорошо известных способов производства водорода разделены по четырём группам в соответствии с источниками энергии, и каждый из них анализируется на основе 12 принципов «зелёной химии» [7]. Каждый из принципов кратко объяснён в Таблице 1. Исследование нацелено на определение производств водорода, наиболее соответствующих этим принципам.
Сырьё иметоды
Существует множество методов получения водорода отличающихся как сырьевой базой, так и способом подвода энергии. Главной причиной сосредоточения внимания на водороде как альтернативном топливе является его экологичность. Сжигание углеводородного топлива оказывает негативное влияние на окружающую среду, но в настоящее время более 85 % общей потребляемой энергии получают таким образом. Потому, предпочтительнее использовать водород как альтернативное топливо, поскольку он не является вредным или токсичным.
Сжигание углеводородного топлива оказывает негативное влияние на окружающую среду, но в настоящее время более 85 % общей потребляемой энергии получают таким образом. Потому, предпочтительнее использовать водород как альтернативное топливо, поскольку он не является вредным или токсичным.
Таблица 1
12 принципов «зелёной химии» и краткое пояснение к ним
Принцип | Пояснение |
1. Предотвращение образования отходов | Лучше предотвращать отходы, чем избавляться от них. |
2. Атомная эффективность | Полнота использования исходного вещества. |
3. Более безопасный синтез | Менее вредные сырьё для синтеза и его продукты. |
4. Более безопасные продукты | Минимизировать токсичность продуктов на стадии проектирования. |
5. Более безопасные вспомогательные вещества | Такие вещества как растворители должны быть заменены на более безвредные альтернативы. |
6. Энергоэффективность | Синтез при температуре и давлении окружающей среды. |
7. Использование возобновляемого сырья | Не использовать в синтезе невозобновляемые ресурсы. |
8. Снижение получения сопродуктов | Минимизировать или исключить затраты реагентов на производство побочных или промежуточных продуктов. |
9. Катализ | Следует отдавать предпочтение каталитическим процессам. |
10. Разлагающиеся продукты | По окончанию использования, продукт должен легко разлагаться в окружающей среде |
11. Анализ в реальном времени | Обеспечить слежение в реальном времени за образованием опасных продуктов |
12. | Исключить или минимизировать риск химической опасности, включая утечки, взрывы и пожары |
В данном исследовании 13 различных методов производства водорода были сгруппированы по четырём основным группам: электрические, тепловые, смешанные и биологические. Их классификация представлена в Таблице 2.
Электрические: | Плазменно-дуговое разложение Электролиз |
Термические: | Термолиз Термическое разложение воды Преобразование биомассы Паровой риформинг Газификация |
Смешанные: | Фотоэлектрохимический метод Смешанный термохимический метод расщепления воды Высокотемпературный электролиз |
Биологические: | Темновая ферментация Биофотолиз Фотоферментация |
Результаты иобсуждения
Электрические методы
В качестве электрических способов производства водорода рассматриваются плазменно-дуговое разложение и электролиз.
Плазменно-дуговое разложение
В процессе производства водорода методом плазменно-дугового разложения природный газ (главным образом метан) распадается на водород и углекислый газ в результате воздействия на него высоктемпературной плазмы. Образование водорода и углерода в результате реакции разложения метана можно записать в виде:
CH4 → C(c)+ 2H2(г)
При таком производстве используется высокое напряжение для разложения природного газа/метана на сажу и газообразный водород.
При рассмотрении реакции выше, можно сделать вывод, что данный метод удовлетворяет таким принципам «зелёной химии», как атомная эффективность и сокращение побочных продуктов: принципам 2 и 8 соответственно. Тем не менее, производство сажи противоречит первому принципу — предотвращение образования отходов. Необходимость в источниках высокого напряжения не соответствует принципу энергоэффективности (6-й), к тому же, сырьё не является возобновляемым, следовательно, принцип 7 также не выполняется. Оставшиеся принципы «зелёной химии» невозможно рассматривать в контексте данного метода.
Оставшиеся принципы «зелёной химии» невозможно рассматривать в контексте данного метода.
Электролиз
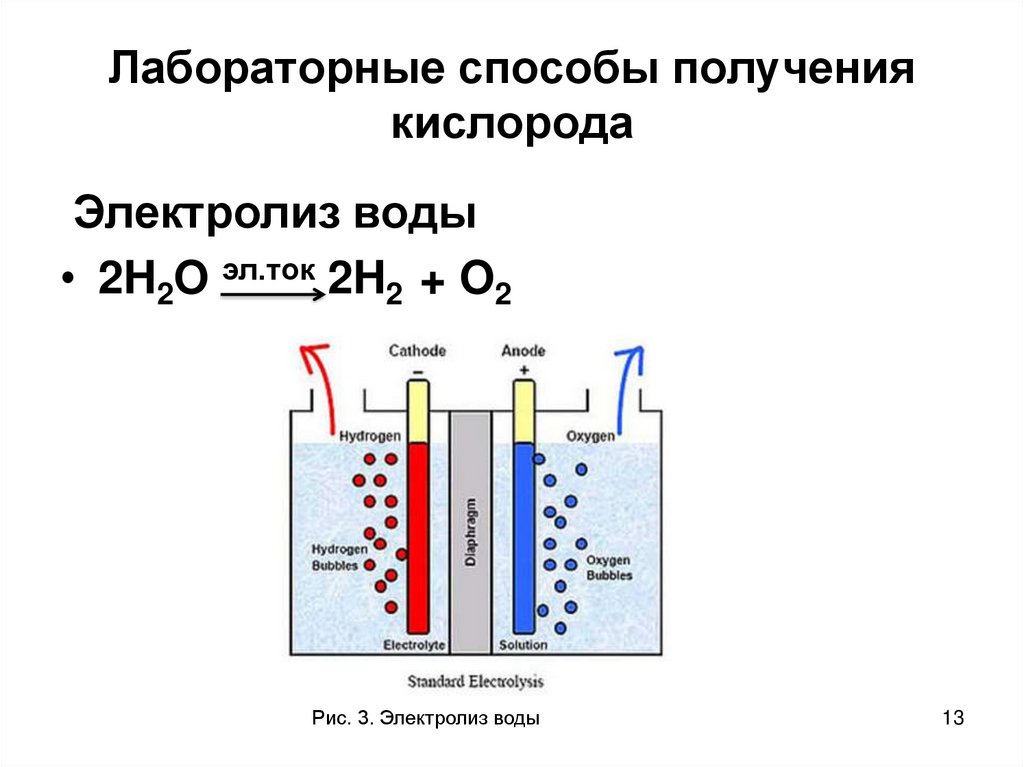
Электролиз — наиболее эффективный и хорошо известный метод разложения воды; Сегодня широко применяется в промышленности [8]. Реакцию можно записать так:
H2O H2(г) + 1/2O2(г)
В промышленных электролизерах используется 30 % KOH (щелочной электролиз), поскольку имеется возможность восстановление с последующим повторным использованием. Однако KOH имеет ограничения по хранению, обработке и утилизации. Получение водорода методами электролиза не требует экстремальных условий, потому имеется возможность использования возобновляемых источников энергии, таких как ветер, солнечная энергия, геотермальная энергия, что способствует более экологичному производству [8].
Метод щелочного электролиза полностью удовлетворяет принципам: 1 — безотходное производство, 2- атомная эффективность, 7 — использование воды как возобновляемого сырья, 8 — отсутствие побочных продуктов. В то же время использование KOH нарушает 3-й и 12-й принципы. Помимо этого, продукты не являются полностью биоразлагаемыми, что противоречит принципу 10.
В то же время использование KOH нарушает 3-й и 12-й принципы. Помимо этого, продукты не являются полностью биоразлагаемыми, что противоречит принципу 10.
Термические методы
В качестве термических методов рассматриваются: термолиз, термохимическое разложение воды, паровой риформинг и газификация.
Термолиз
Под воздействием одноступенчатой термической диссоциации воды (термолиз) вода расщепляется на атомы водорода и кислорода только за счёт тепловой энергии. Для этого используются чрезвычайно высокие температуры: 2500 K и выше [13]. Реакция термолиза выглядит следующим образом:
H2OH2 + 1/2O2
Этот способ получения водорода соответствует принципам: 1, 2, 7, 8. Однако, из-за необходимости поддержания экстремально высоких температур, ярко выражено нарушение принципа 6.
Термическое разложение воды
Метод термохимического разделения воды использует сложные химические циклы для проведения термического крекинга воды в более приемлемых температурных диапазонах.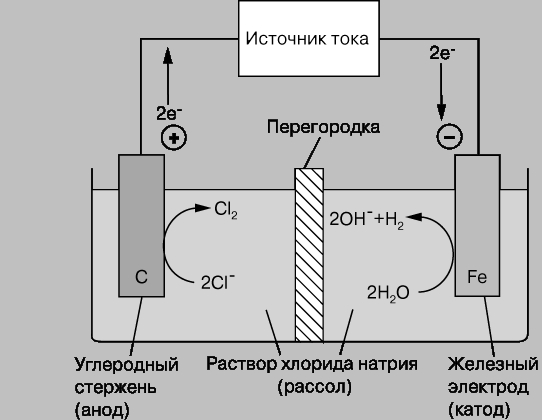 К преимуществам данного метода можно отнести: отсутствие необходимости в кислородно-водородной разделительной мембране, температурный интервал около 600–1200 K, что ниже, чем у термолиза, а также невысокое потребление электроэнергии.
К преимуществам данного метода можно отнести: отсутствие необходимости в кислородно-водородной разделительной мембране, температурный интервал около 600–1200 K, что ниже, чем у термолиза, а также невысокое потребление электроэнергии.
Общий вид реакции: H2O H2(г) + 1/2O2(г)
Все химические вещества, используемые в данном способе получения водорода, могут быть отправлены на рецикл. Метод соответствует принципам 1, 2 и 7. Но использование опасных химических веществ, необходимость в высоких температурах и многостадийность процесса противоречат принципам 5, 3, 6, 8 и 12.
Преобразование биомассы
Основными источниками биомассы в качестве топлива являются энергетические культуры (растения, выращенные для использования в энергетических целях), сельскохозяйственные отходы, промышленные и бытовые отходы. Биомасса считается нейтральной по CO2, потому как весь выделяемый при сжигании или преобразовании CO2 поглощается в процессе фотосинтеза [8]. Общая реакция выглядит следующим образом:
Общая реакция выглядит следующим образом:
CxHyOz+ H2O H2 + CO + CO2 + CH4 + C + смоляные остатки
Итак, имеются отходы и сопродукты, неудовлетворенна атомная эффективность, но используется исключительно возобновляемое сырьё. Метод выполняет требования принципов 7 и 9, и не выполняет 1, 2 и 8.
Паровой риформинг
При паровом риформинге газ или жидкое природное топливо преобразуется в сингтез-газ. Риформинг метана паром — наиболее дешёвый и популярный в промышленности метод. Пар и метан реагируют с образованием водорода и монооксида углерода в эндотермической реакции:
CH4 + H2O ↔ CO + 3H2
Реакцию обычно проводят при температурах 500–900°С, под давлением 20–35 атм. [5].
Данный метод удовлетворяет принципам 7, 8 и 9, и не удовлетворяет принципам 1, 2 и 6.
Газификация
Твёрдое топливо, такое как уголь или биомасса, может быть преобразовано в водород путём газификации. В этом способе твёрдое топливо реагирует с кислородом и паром при высоких температуре и давлении. Механизм реакции является многоступенчатым, в процессе которого выделяются CO и CO2 [5]. Стадию получения водорода можно записать так:
В этом способе твёрдое топливо реагирует с кислородом и паром при высоких температуре и давлении. Механизм реакции является многоступенчатым, в процессе которого выделяются CO и CO2 [5]. Стадию получения водорода можно записать так:
C(тв.) + H2O ↔ CO + H2
Использование в качестве твёрдого топлива биомассы удовлетворяет принципу 7. Минимизировать побочные продукты можно с помощью катализаторов, но образование отходов неизбежно, а использование высоких давления и температуры противоречат эффективности использования энергии. В результате исследования сделан вывод, что данный метод соответствует принципам 7, 8 и 9 и нарушает 1, 2 и 6.
Смешанные методы
В качестве смешанных методов получения водорода были рассмотрены фотоэлектрохимический и смешанный термохимический методы расщепления воды, а также высокотемпературный электролиз.
Фотоэлектрохимический метод
Производство водорода фотоэлектрохимическим методом представляет собой электролиз воды с использованием полупроводниковых фотоэлектродов в едином блоке. Во время фотокатализа фотон попадает на фотокатализатор и генерирует электронную пару для получения электрического заряда. Фотоэлектрохимическая ячейка похожа на электролизную, но конструкция её конструкция отличается тем, что один или оба электрода являются фотоэлектродами, и как минимум один из них также является полупроводником [10].
Во время фотокатализа фотон попадает на фотокатализатор и генерирует электронную пару для получения электрического заряда. Фотоэлектрохимическая ячейка похожа на электролизную, но конструкция её конструкция отличается тем, что один или оба электрода являются фотоэлектродами, и как минимум один из них также является полупроводником [10].
H2O H2(г) + 1/2O2(г)
Фотоэлектрохимический метод не вызывает отходов (принцип 1), согласуется с принципом 2, не использует KOH, как в щелочном катализе (принцип 5), осуществляется при температуре окружающей среды (принцип 6), использует возобновляемые ресурсы и проходит в одну ступень (принципы 7 и 8), использует фотокатализаторы (принцип 9). В то же время не соответствует принципам 10 и 12.
Смешанный термохимический метод расщепления воды
Данный метод объединяет в себе термохимический и фотоэлектрохимический методы. Общая реакция разложения воды на компоненты выглядит так:
H2O H2(г) + 1/2O2(г)
Производство водорода таким способом позволяет работать при более низких температурах по сравнению с несмешанными методами [10]. Тем не менее, температура всё же выше температуры окружающей среды. Все химические вещества отправляются на рецикл, потому можно принять, что отходы не производятся. В качестве возобновляемого сырья используется вода. Но систему нельзя назвать энергоэффективной, она многоступенчата и использует небезопасные химические вещества. В результате, метод соответствует принципам 1, 2 и 7, но не соответствует принципам 6, 8, 10 и 12.
Тем не менее, температура всё же выше температуры окружающей среды. Все химические вещества отправляются на рецикл, потому можно принять, что отходы не производятся. В качестве возобновляемого сырья используется вода. Но систему нельзя назвать энергоэффективной, она многоступенчата и использует небезопасные химические вещества. В результате, метод соответствует принципам 1, 2 и 7, но не соответствует принципам 6, 8, 10 и 12.
Высокотемпературный электролиз
Пар может быть диссоциирован в водород и кислород посредством воздействия высокой температуры (вплоть до 1123 K) [9]. В данном случае потребность в электроэнергии не такая высокая, как при обычном электролизе.
H2O H2(г) + 1/2O2(г)
Такой способ не производит отходов (принцип 1), обеспечивает принцип атомной эффективности, предотвращает использование KOH в сравнении с обычным щелочным катализом (принцип 5), использует возобновляемое сырьё и одноступенчатое производство (принципы 7 и 8). Но принципы 6 и 10 не могут быть удовлетворены.
Но принципы 6 и 10 не могут быть удовлетворены.
Биологические методы
В качестве биологических способов получения водорода рассмотрены методы темновой ферментации, биофотолиза и фотоферментации.
Темновая ферментация
Наиболее перспективный метод производства водорода из биомассы [10]. Биохимическая энергия биомассы (глюкоза, органические отходы и т. д.) может быть преобразована в другие формы энергии с получением водорода, органических кислот и двуокиси углерода. Для темновой ферментации используются анаэробные бактерии в темных и бескислородных условиях. Общая несбалансированная реакция может быть записана так:
CxHyOz(биомасса) Органическая кислота + H2 + CO2
В данном методе в качестве сырья используется биомасса, а процесс идёт при температуре и давлении окружающей среды, но имеет место производство CO2, а также органических кислот, которые могут образовывать побочные продукты. Метод соответствует принципам 6, 7, 9 и 10, но не соответствует принципам 1, 2 и 8.
Метод соответствует принципам 6, 7, 9 и 10, но не соответствует принципам 1, 2 и 8.
Биофотолиз
Биофотолиз представляет собой способ получения водорода путём разложения воды в анаэробной среде с использованием солнечной энергии с помощью цианобактерий или микроводорослей [10].
H2O H2(г) + O2(г)
Такой метод не согласуется с 8-ым принципом «зелёной химии» из-за наличия сложного биологического пути. В то же время, он осуществляется при температуре и давлении окружающей среды, не образует отходов, использует воду в качестве сырья; также применяются биокатализаторы. Можно утверждать, что принципы 1, 2, 6, 7, 9 и 10 удовлетворены.
Фотоферментация
Реакция фотоферментации — биохимический процесс получения водорода из воды. Водород получают в водной среде при температуре и давлении окружающей среды в присутствии светочувствительных механизмов [11].
C6H12O6 + 6H2O 6CO2 + 12H2
Данный метод удовлетворяет большинству из принципов «зелёной химии». Единственным неудовлетворённым принципом является 8-ой, так как система реакций является сложной, и имеют место побочные реакции, как и во всех биологических процессах.
Единственным неудовлетворённым принципом является 8-ой, так как система реакций является сложной, и имеют место побочные реакции, как и во всех биологических процессах.
Таблица 3
Результаты анализа
Методы | Принципы | |||||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
Плазменно-дуговое разложение | — | + | н/д | н/д | н/д | — | — | + | н/д | н/д | н/д | н/д |
Электролиз | + | + | — | н/д | н/д | н/д | + | + | н/д | — | н/д | — |
Термолиз | + | + | н/д | н/д | н/д | — | + | + | н/д | н/д | н/д | н/д |
Термическое разложение воды | + | + | — | н/д | — | — | + | — | н/д | н/д | н/д | — |
Преобразование биомассы | — | — | н/д | н/д | н/д | — | + | — | + | н/д | н/д | н/д |
Паровой риформинг | — | — | н/д | н/д | н/д | — | + | + | + | н/д | н/д | н/д |
Газификация | — | — | н/д | н/д | н/д | — | + | + | + | н/д | н/д | н/д |
Фотоэлектрохимический метод | + | + | н/д | н/д | + | + | + | + | + | — | н/д | — |
Смешанный термохимический метод | + | + | н/д | н/д | н/д | — | + | — | н/д | — | н/д | — |
Высокотемпературный электролиз | + | + | н/д | н/д | + | — | + | + | н/д | — | н/д | н/д |
Темновая ферментация | — | — | н/д | н/д | н/д | + | + | — | + | + | н/д | н/д |
Биофотолиз | + | + | н/д | н/д | н/д | + | + | — | + | + | н/д | н/д |
Фотоферментация | + | + | н/д | н/д | н/д | + | + | — | + | + | н/д | н/д |
Заключение
Основная цель настоящего исследования — связать методы производства водорода с 12 принципами «зелёной химии».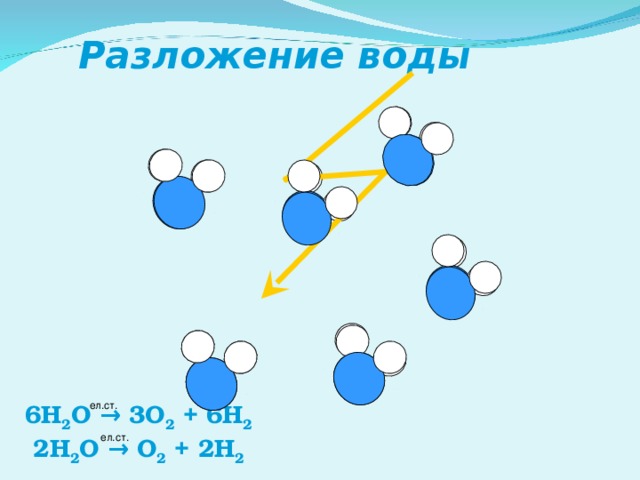 По каждому принципу были оценены 13 методов производства водорода, а результаты пояснены. В этой оценке отсутствует экономический аспект; с точки зрения производственной эффективности методы также не рассматривались. Только лишь воздействие на окружающую среду.
По каждому принципу были оценены 13 методов производства водорода, а результаты пояснены. В этой оценке отсутствует экономический аспект; с точки зрения производственной эффективности методы также не рассматривались. Только лишь воздействие на окружающую среду.
Из анализа были получены следующие выводы:
– Среди электрических методов электролиз является наиболее «зелёной» альтернативой плазменно-дуговому разложению.
– Сравнение термических методов показало, что наиболее приемлемым для окружающей среды является метод термического разложения при использовании чистой энергии. Необходимые высокие температуры могут быть достигнуты только с использованием ядерных энергетических ресурсов, что является неоднозначной решением. Поэтому альтернативой может быть паровой риформинг или газификация с использованием биомассы.
– Среди смешанных методов самым экологически безопасным является фотоэлектрохимическое разложение воды.
– Поскольку все биологические методы используют или имитируют естественный путь, они практически полностью безвредны для окружающей среды.
Мы верим, что в ближайшем будущем водород будет производиться экологически безопасными методами в соответствии с принципами «зелёной химии».
Литература:
- Anastas P.T, Warner J. C. Green chemistry: theory and practice. — New York: Oxford University Press, 1998. — 148 с.
- Sanderson K. It’s not easy being green // Nature. — 2011. — № 469. — С. 18–20.
- Sandy Thomas C.E, Lloyd A. C. Stopping climate change: the case for coal and hydrogen. // International Journal of Hydrogen Energy. — 2017. — № 42(16). — С. 8406–8407.
- Veras T.S, Mozer T.S, Santos D. C. R.M, Cesar A. S. Hydrogen: Trends, production and characterization of the main process worldwide. // International Journal of Hydrogen Energy. — 2017. — № 42(4). — С. 2018–2033.
- Voldsund M, Jordal K, Anantharaman R. Hydrogen production with CO2 capture. // International Journal of Hydrogen Energy. — 2016. — № 41(9). — С. 4969–4992.
- Weger L, Abanedes A, Butler T.
 Methane cracking as a bridge technology to the hydrogen economy. // International Journal of Hydrogen Energy. — 2017. — № 42(1). — С. 720–731.
Methane cracking as a bridge technology to the hydrogen economy. // International Journal of Hydrogen Energy. — 2017. — № 42(1). — С. 720–731. - Valavaniidis A, Vlachogianni T. Green chemistry and green engineering.. — Athens-Greece: Synchrona Themata; 2012. — 244 с.
- Nikolaidis P, Poullikkas A. A comparative overview of hydrogen production processes. // Renewable and Sustainable Energy Reviews. — 2017. — № 67. — С. 597–611.
- Bartels J.R, Pate M.B, Olson N. K. An economic survey of hydrogen production from conventional and alternative energy sources. // International Journal of Hydrogen Energy. — 2010. — № 35(16). — С. 8371–8384.
- Balat H, Kırtay E. Hydrogen from biomass — Present scenario and future prospects. // International Journal of Hydrogen Energy. — 2010. — № 35(14). — С. 7416–7426.
- Hu J, Zhang Q, Jing Y, Lee D. Photosynthetic hydrogen production from enzyme-hydrolyzed micro-grinded maize straws. // International Journal of Hydrogen Energy.
 — 2016. — № 41(46). — С. 21665–21669.
— 2016. — № 41(46). — С. 21665–21669.
Основные термины (генерируются автоматически): принцип, окружающая среда, KOH, атомная эффективность, паровой риформинг, плазменно-дуговое разложение, производство водорода, фотоэлектрохимический метод, продукт, температура.
Расщепление воды — Википедия
Схема химическое уравнение из электролиз воды, форма расщепления воды.
Расщепление воды это химическая реакция в котором воды разбивается на кислород и водород:
- 2 ч2O → 2 H2 + O2
Эффективное и экономичное фотохимическое расщепление воды стало бы технологическим прорывом, который мог бы подкрепить водородная экономика. Никакой промышленно практический вариант расщепления воды с чистой водой не был продемонстрирован, но двухкомпонентные реакции (H2 производство и O2 продукция) хорошо известны. Расщепление воды морская вода и другие соленая вода используется в промышленности для изготовления хлор Однако собранный отработанный водород составляет около пяти процентов мировых запасов. Вариант расщепления воды происходит в фотосинтез, но водород не производится. Обратное расщепление воды является основой водородный топливный элемент.
Вариант расщепления воды происходит в фотосинтез, но водород не производится. Обратное расщепление воды является основой водородный топливный элемент.
Содержание
- 1 Электролиз
- 2 Расщепление воды при фотосинтезе
- 3 Фотоэлектрохимическое расщепление воды
- 4 Фотокаталитическое расщепление воды
- 5 Радиолиз
- 6 Наногальванический порошок алюминиевого сплава
- 7 Термическое разложение воды
- 7.1 Ядерно-тепловой
- 7.2 Солнечно-тепловая
- 8 Исследование
- 9 Смотрите также
- 10 Рекомендации
- 11 внешняя ссылка
Электролиз
Основная статья: Электролиз воды
Передняя часть электролизера с электрической панелью на переднем плане
Электролиз воды это разложение воды (ЧАС2O) в кислород (O2) и водород (ЧАС2) из-за электрический ток проходя через воду.[1]
Атмосферное электричество использование для химической реакции, в которой вода разделяется на кислород и водород.
 (Изображение взято: Vion, патент США 28793. Июнь 1860 г.)
(Изображение взято: Vion, патент США 28793. Июнь 1860 г.)
- Вион, Патент США 28,793, «Усовершенствованный метод использования атмосферного электричества», июнь 1860 г.
В мощность на газ В производственных схемах избыточная мощность или внепиковая мощность, создаваемая ветряными генераторами или солнечными батареями, используется для балансировки нагрузки энергосистемы путем хранения, а затем закачки водорода в сеть природного газа.
Электролиз водного корабля Водород Челленджер
Производство водорода из воды энергоемко. Потенциальные источники электроэнергии включают гидроэнергетику, ветряные турбины или фотоэлектрические элементы. Обычно потребляемая электроэнергия более ценится, чем произведенный водород, поэтому этот метод не получил широкого распространения. В отличие от низкотемпературного электролиза, высокотемпературный электролиз (HTE) воды преобразует больше начального высокая температура энергию в химическую энергию (водород), потенциально удваивая эффективность примерно до 50%.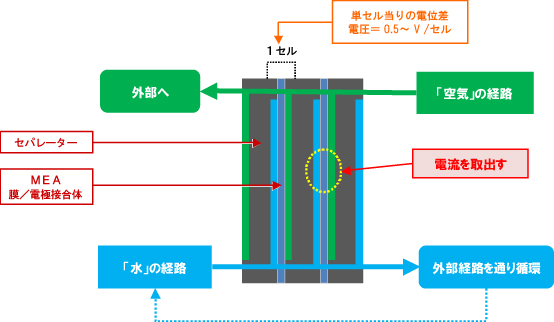 Поскольку часть энергии в HTE поставляется в виде тепла, меньшая часть энергии должна быть преобразована дважды (из тепла в электричество, а затем в химическую форму), поэтому процесс более эффективен.
Поскольку часть энергии в HTE поставляется в виде тепла, меньшая часть энергии должна быть преобразована дважды (из тепла в электричество, а затем в химическую форму), поэтому процесс более эффективен.
Расщепление воды при фотосинтезе
Вариант расщепления воды происходит в фотосинтез, но электроны шунтируются не на протоны, а на транспортную цепь электронов в фотосистема II. Электроны используются для преобразования диоксида углерода в сахара.
Когда фотосистема I возбуждается фотовозбуждением, инициируются реакции переноса электронов, что приводит к уменьшению ряда акцепторов электронов, что в конечном итоге снижает НАДФ.+ до НАДФН и PS I окисляется. Окисленная фотосистема I захватывает электроны из фотосистемы II через ряд этапов с участием таких агентов, как пластохинон, цитохромы и пластоцианин. Фотосистема II затем вызывает окисление воды, что приводит к выделению кислорода, причем реакция катализируется CaMn.4О5 кластеры, встроенные в сложную белковую среду; комплекс известен как комплекс с выделением кислорода (OEC). [2][3]
[2][3]
An биореактор водорослей для производства водорода.
В производство биологического водорода, электроны, произведенные фотосистемой, шунтируются не в аппарат химического синтеза, а в гидрогеназы, в результате чего образуется H2. Этот биоводород производится в биореактор.[4]
Фотоэлектрохимическое расщепление воды
Основные статьи: фотоэлектрохимическая ячейка и искусственный фотосинтез
Использование электроэнергии, произведенной фотоэлектрический потенциально предлагает самый чистый способ производства водорода, кроме ядерных, ветровых, геотермальных и гидроэлектрических. Опять же, вода распадается на водород и кислород при электролизе, но электрическая энергия получается за счет фотоэлектрохимическая ячейка (PEC) процесс. Система также называется искусственный фотосинтез.[5][6][7][8]
Фотокаталитическое расщепление воды
Основная статья: Фотокаталитическое расщепление воды
Преобразование солнечной энергии в водород посредством процесса расщепления воды — один из самых интересных способов. [нужна цитата ] для достижения чистой и возобновляемой энергии. Этот процесс может быть более эффективным, если ему помогают фотокатализаторы, взвешенные непосредственно в воде, а не фотоэлектрическая или электролитическая система, так что реакция протекает в один этап.[9][10]
[нужна цитата ] для достижения чистой и возобновляемой энергии. Этот процесс может быть более эффективным, если ему помогают фотокатализаторы, взвешенные непосредственно в воде, а не фотоэлектрическая или электролитическая система, так что реакция протекает в один этап.[9][10]
Радиолиз
Основная статья: Радиолиз § Производство водорода
Ядерное излучение обычно разрывает водные связи в Мпоненг Золотой рудник, Южная Африка, исследователи обнаружили в зона естественно высокой радиации, сообщество, в котором преобладают новые филотип из Desulfotomaculum, питаясь в первую очередь радиолитически произведено ЧАС2.[11]Отработавшее ядерное топливо / «Ядерные отходы» также рассматриваются как потенциальный источник водорода.
Наногальванический порошок алюминиевого сплава
Основная статья: Наногальванические сплавы на основе алюминия
Порошок из алюминиевого сплава, изобретенный Исследовательская лаборатория армии США в 2017 году было показано, что он способен производить водород при контакте с водой или любой жидкостью, содержащей воду, благодаря своей уникальной наноразмерной гальванической микроструктуре. Сообщается, что он производит водород с выходом 100 процентов от теоретического без использования каких-либо катализаторов, химикатов или внешней энергии.[12][13]
Сообщается, что он производит водород с выходом 100 процентов от теоретического без использования каких-либо катализаторов, химикатов или внешней энергии.[12][13]
Нано-гальванический порошок на основе алюминия, разработанный Исследовательская лаборатория армии США
Термическое разложение воды
Основная статья: Термохимический цикл
В термолиз молекулы воды расщепляются на атомные составляющие водород и кислород. Например, при 2200 ° C около трех процентов всего H2O диссоциируют на различные комбинации атомов водорода и кислорода, в основном H, H2, О, О2, и ОН. Другие продукты реакции, такие как H2О2 или HO2 остаются второстепенными. При очень высокой температуре 3000 ° C более половины молекул воды разлагается, но при температуре окружающей среды только одна молекула из 100 триллионов диссоциирует под действием тепла.[14] Высокие температуры и материальные ограничения ограничивают возможности применения этого подхода.
Ядерно-тепловой
Смотрите также: NGNP
Одно побочное преимущество ядерного реактора, которое производит и то, и другое электричество а водород заключается в том, что он может переключать производство между ними. Например, электростанция может производить электричество днем и водород ночью, согласовывая свой профиль выработки электроэнергии с дневными колебаниями спроса. Если водород можно производить экономично, эта схема будет выгодно конкурировать с существующими сетевое хранилище энергии схемы. Более того, потребность в водороде в Соединенные Штаты что вся суточная пиковая выработка может быть обработана такими установками.[15]
Гибридный термоэлектрический Медно-хлорный цикл это когенерация система с использованием отходящее тепло от ядерных реакторов, в частности КАНДУ реактор со сверхкритической водой.[16]
Солнечно-тепловая
Высокие температуры, необходимые для разделения воды, могут быть достигнуты за счет использования концентрация солнечной энергии. Гидрозоль-2 это опытная 100-киловаттная установка на Plataforma Solar de Almería в Испания который использует солнечный свет для получения необходимой температуры от 800 до 1200 ° C для разделения воды. Hydrosol II находится в эксплуатации с 2008 года. Проект этой 100-киловаттной опытной установки основан на модульной концепции. В результате может оказаться возможным, что эту технологию можно будет легко расширить до мегаваттного диапазона путем умножения имеющихся реакторных блоков и подключения станции к гелиостат поля (поля солнцезащитных зеркал) подходящего размера.[17]
Гидрозоль-2 это опытная 100-киловаттная установка на Plataforma Solar de Almería в Испания который использует солнечный свет для получения необходимой температуры от 800 до 1200 ° C для разделения воды. Hydrosol II находится в эксплуатации с 2008 года. Проект этой 100-киловаттной опытной установки основан на модульной концепции. В результате может оказаться возможным, что эту технологию можно будет легко расширить до мегаваттного диапазона путем умножения имеющихся реакторных блоков и подключения станции к гелиостат поля (поля солнцезащитных зеркал) подходящего размера.[17]
Материальные ограничения из-за требуемых высоких температур уменьшаются за счет конструкции мембранного реактора с одновременным извлечением водорода и кислорода, который использует определенный тепловой градиент и быструю диффузию водорода. Благодаря концентрированному солнечному свету в качестве источника тепла и только воде в реакционной камере получаемые газы очень чистые, и единственным возможным загрязнителем является вода. «Солнечная установка для взлома воды» с концентратором площадью около 100 м² может производить почти один килограмм водорода за один солнечный час.[18]
«Солнечная установка для взлома воды» с концентратором площадью около 100 м² может производить почти один килограмм водорода за один солнечный час.[18]
Исследование
Основная статья: Фотокаталитическое расщепление воды
Исследования ведутся над фотокатализ,[19][20] ускорение фотореакции в присутствии катализатора. Его понимание стало возможным с момента открытия электролиза воды с помощью диоксида титана. Искусственный фотосинтез это область исследований, которая пытается воспроизвести естественный процесс фотосинтеза, превращая солнечный свет, воду и углекислый газ в углеводы и кислород. Недавно это было успешным в расщеплении воды на водород и кислород с использованием искусственного соединения под названием Нафион.[21]
Высокотемпературный электролиз (также HTE или паровой электролиз ) — это метод, который в настоящее время исследуется для производства водорода из воды с кислородом в качестве побочного продукта. Другое исследование включает термолиз на дефектном углерод подложки, что делает возможным производство водорода при температурах чуть ниже 1000 ° C. [22]
[22]
В цикл оксида железа это серия термохимический процессы, используемые для производить водород. Цикл оксида железа состоит из двух химические реакции чей чистый реагент воды и чьи чистые продукты водород и кислород. Все остальные химические вещества перерабатываются. Процесс оксида железа требует эффективного источника тепла.
В серно-йодный цикл (Цикл S-I) представляет собой серию термохимический процессы, используемые для производить водород. Цикл S-I состоит из трех химические реакции чей чистый реагент — вода, а чистые продукты — водород и кислород. Все остальные химические вещества перерабатываются. Процесс S-I требует эффективного источника тепла.
Более 352 термохимический были описаны циклы для разделения воды или термолиз.,[23] Эти циклы обещают производить водородный кислород из воды и тепла без использования электричества.[24] Поскольку вся энергия для таких процессов — тепло, они могут быть более эффективными, чем высокотемпературный электролиз.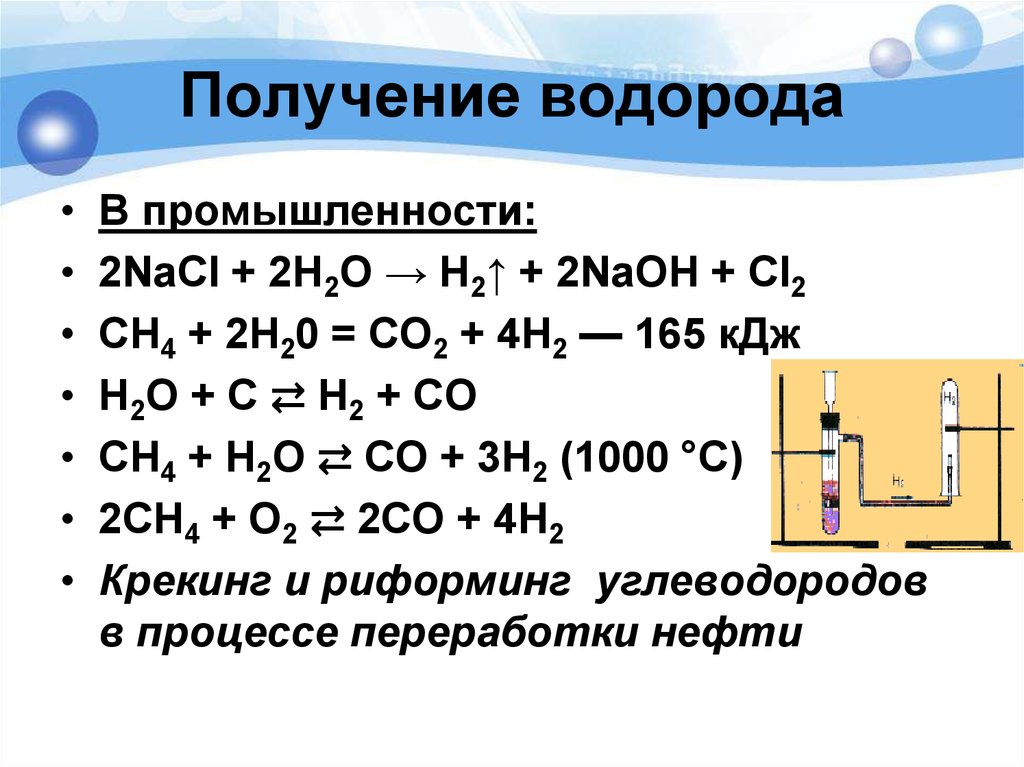 Это связано с тем, что эффективность производства электроэнергии ограничена по своей природе. Термохимическое производство водорода с использованием химической энергии из угля или природного газа обычно не рассматривается, поскольку прямой химический путь более эффективен.
Это связано с тем, что эффективность производства электроэнергии ограничена по своей природе. Термохимическое производство водорода с использованием химической энергии из угля или природного газа обычно не рассматривается, поскольку прямой химический путь более эффективен.
Для всех термохимических процессов суммарная реакция — это реакция разложения воды:
- 2ЧАС2О⇌Высокая температура2ЧАС2+О2{ displaystyle { ce {2h3O [{ ce {Heat}}] 2h3 {} + O2}}}
Все остальные реагенты перерабатываются. Ни один из процессов термохимического производства водорода не был продемонстрирован на уровне производства, хотя некоторые из них были продемонстрированы в лабораториях.
Также проводятся исследования способности наночастиц и катализаторов снижать температуру расщепления воды.[25][26]
Недавно Металлоорганический каркас Материалы на основе (MOF) оказались очень многообещающими кандидатами для расщепления воды дешевыми переходными металлами первого ряда;[27][28]
Исследования сосредоточены на следующих циклах:[24]
| Термохимический цикл | LHV Эффективность | Температура (° C / F) |
|---|---|---|
| Цикл оксид церия (IV) — оксид церия (III) (Исполнительный директор2/ Ce2О3) | ? % | 2000 ° C (3630 ° F) |
| Гибридный цикл серы (HyS) | 43% | 900 ° C (1650 ° F) |
| Серно-йодный цикл (Цикл S-I) | 38% | 900 ° C (1650 ° F) |
| Цикл сульфата кадмия | 46% | 1000 ° C (1830 ° F) |
| Цикл сульфата бария | 39% | 1000 ° C (1830 ° F) |
| Цикл сульфата марганца | 35% | 1100 ° C (2010 ° F) |
| Цинк цинк-оксидный цикл (Zn / ZnO) | 44% | 1900 ° C (3450 ° F) |
| Гибридный кадмиевый цикл | 42% | 1600 ° C (2910 ° F) |
| Карбонатный цикл кадмия | 43% | 1600 ° C (2910 ° F) |
| Цикл оксида железа (Fe3О4/FeO{ Displaystyle { ce {Fe3O4 / FeO}}}) | 42% | 2200 ° C (3990 ° F) |
| Натрий-марганцевый цикл | 49% | 1560 ° С (2840 ° F) |
| Никель-марганцево-ферритный цикл | 43% | 1800 ° C (3270 ° F) |
| Цикл феррита цинка марганца | 43% | 1800 ° C (3270 ° F) |
| Медно-хлорный цикл (Cu-Cl) | 41% | 550 ° С (1022 ° F) |
Смотрите также
- Фотокаталитическое расщепление воды
- Реакция конверсии водяного газа
Рекомендации
- ^ Хауч, Энн; Эббесен, Сун Далгаард; Йенсен, Сорен Хойгаард; Могенсен, Могенс (2008).
 Хансен; Дас (2014). «Текст». Энергетика и экология. 7 (1): 317–322. Дои:10.1039 / C3EE43040E.
Хансен; Дас (2014). «Текст». Энергетика и экология. 7 (1): 317–322. Дои:10.1039 / C3EE43040E.
внешняя ссылка
- JEAC
РАЗЛОЖЕНИЕ ОКСИДА ТРИТИЯ ПОД СОБСТВЕННЫМ ИЗЛУЧЕНИЕМ (Технический отчет)
РАЗЛОЖЕНИЕ ОКСИДА ТРИТИЯ ПОД СОБСТВЕННЫМ ИЗЛУЧЕНИЕМ (Технический отчет) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
Вода, в которой от 2 до 19% водорода замещено тритиурой, под действием бета-лучей трития разлагается на водород и кислород. Разложение прекращается в результате обратной реакции, когда давление газообразных продуктов достигает значений, варьирующих от 20 до 600 и более см рт. ст., в зависимости, по-видимому, от природы и количества присутствующих примесей. Стационарное давление электролитического газа обычно снижается за счет повышения температуры (до степени, разной для разных образцов) и воздействия геймма-лучей. Разложение продолжается, когда вода замерзает и хранится при температуре жидкого азота. He/sup 3/, образующийся при распаде трития, диффундирует через стенки сосудов из плавленого кварца, но не через мягкое стекло; и активность образца оксида трития может быть легко определена путем сбора и измерения чистого гелия, который выходит через стенки контейнера с кремнеземом. (авт.)
ст., в зависимости, по-видимому, от природы и количества присутствующих примесей. Стационарное давление электролитического газа обычно снижается за счет повышения температуры (до степени, разной для разных образцов) и воздействия геймма-лучей. Разложение продолжается, когда вода замерзает и хранится при температуре жидкого азота. He/sup 3/, образующийся при распаде трития, диффундирует через стенки сосудов из плавленого кварца, но не через мягкое стекло; и активность образца оксида трития может быть легко определена путем сбора и измерения чистого гелия, который выходит через стенки контейнера с кремнеземом. (авт.)
- Авторов:
- Гормли, Дж. А.; Аллен, А.О.
- Дата публикации:
- Исследовательская организация:
- Национальная лаборатория Ок-Ридж, Теннесси,
- Идентификатор ОСТИ:
- 4287302
- Номер(а) отчета:
- ОРНЛ-128
- Номер АНБ:
- НСА-13-009793
- Номер контракта с Министерством энергетики:
- W-7405-ENG-26
- Тип ресурса:
- Технический отчет
- Отношение ресурсов:
- Прочая информация: ориг.
 Дата поступления: 31 декабря 1959 г.
Дата поступления: 31 декабря 1959 г.
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- ХИМИЯ; БЕТА-РАСПАД; РАЗЛОЖЕНИЕ; ДИФФУЗИЯ; ЭЛЕКТРОЛИЗ; ГАММА-ИЗЛУЧЕНИЕ; ГАЗЫ; СТАКАН; ГЕЛИЙ 3; ВОДОРОД; ПРИМЕСИ; НИЗКАЯ ТЕМПЕРАТУРА; ОКСИДЫ; КИСЛОРОД; ДАВЛЕНИЕ; ПРОИЗВОДСТВО; КОЛИЧЕСТВЕННЫЙ АНАЛИЗ; КОЛИЧЕСТВЕННОЕ СООТНОШЕНИЕ; РАДИАЦИОННОЕ ВОЗДЕЙСТВИЕ; ОКСИДА КРЕМНИЯ; ЗАТВЕРЖДЕНИЕ; ТРИТИЙ; СУДЫ; ВОДА
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Гормли, Дж. А., и Аллен, А. О. РАЗЛОЖЕНИЕ ОКСИДА ТРИТИЯ ПОД СОБСТВЕННЫМ ИЗЛУЧЕНИЕМ США: Н. П., 1948.
Веб. дои: 10.2172/4287302.
дои: 10.2172/4287302.
Копировать в буфер обмена
Гормли, Дж. А., и Аллен, А. О. РАЗЛОЖЕНИЕ ОКСИДА ТРИТИЯ ПОД СОБСТВЕННЫМ ИЗЛУЧЕНИЕМ . Соединенные Штаты. https://doi.org/10.2172/4287302
Копировать в буфер обмена
Гормли, Дж. А., и Аллен, АО. 1948.
«РАЗЛОЖЕНИЕ ОКСИДА ТРИТИЯ ПОД СОБСТВЕННЫМ ИЗЛУЧЕНИЕМ». Соединенные Штаты. https://doi.org/10.2172/4287302. https://www.osti.gov/servlets/purl/4287302.
Копировать в буфер обмена
@статья{osti_4287302,
title = {РАЗЛОЖЕНИЕ ОКСИДА ТРИТИЯ ПОД СОБСТВЕННЫМ ИЗЛУЧЕНИЕМ},
автор = {Гормли, Дж. А. и Аллен, А. О.},
abstractNote = {Вода, в которой от 2 до 19% водорода заменено тритиурой, разлагается на водород и кислород в результате бомбардировки бета-лучами трития.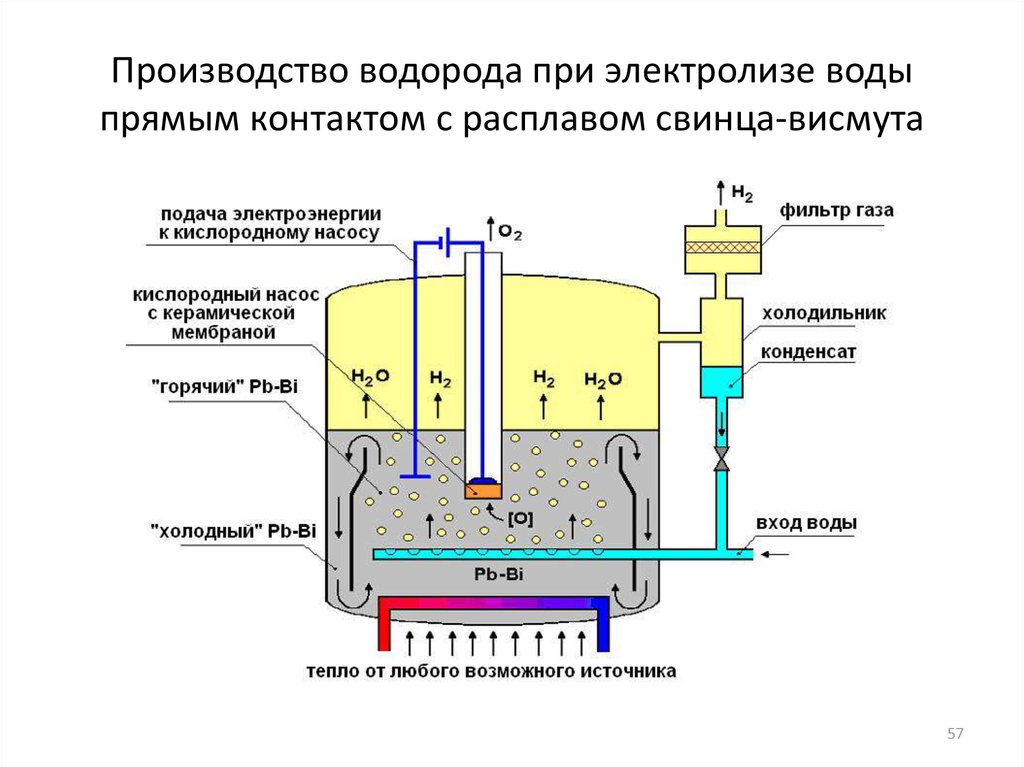 Разложение прекращается в результате обратной реакции, когда давление газообразных продуктов достигает значений, варьирующих от 20 до 600 и более см рт. ст., в зависимости, по-видимому, от природы и количества присутствующих примесей. Стационарное давление электролитического газа обычно снижается за счет повышения температуры (до степени, разной для разных образцов) и воздействия геймма-лучей. Разложение продолжается, когда вода замерзает и хранится при температуре жидкого азота. He/sup 3/, образующийся при распаде трития, диффундирует через стенки сосудов из плавленого кварца, но не через мягкое стекло; и активность образца оксида трития может быть легко определена путем сбора и измерения чистого гелия, который выходит через стенки контейнера с кремнеземом. (авт.)},
Разложение прекращается в результате обратной реакции, когда давление газообразных продуктов достигает значений, варьирующих от 20 до 600 и более см рт. ст., в зависимости, по-видимому, от природы и количества присутствующих примесей. Стационарное давление электролитического газа обычно снижается за счет повышения температуры (до степени, разной для разных образцов) и воздействия геймма-лучей. Разложение продолжается, когда вода замерзает и хранится при температуре жидкого азота. He/sup 3/, образующийся при распаде трития, диффундирует через стенки сосудов из плавленого кварца, но не через мягкое стекло; и активность образца оксида трития может быть легко определена путем сбора и измерения чистого гелия, который выходит через стенки контейнера с кремнеземом. (авт.)},
дои = {10.2172/4287302},
URL = {https://www.osti.gov/biblio/4287302},
журнал = {},
номер =,
объем = ,
место = {США},
год = {1948},
месяц = {9}
}
Копировать в буфер обмена
Посмотреть технический отчет (3,56 МБ)
https://doi. org/10.2172/4287302
org/10.2172/4287302
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
Разложение воды, происходящее при лазерном пробое водных растворов, содержащих индивидуальные наночастицы золота, циркония, молибдена, железа или никеля
Введение
первые мощные лазеры. В настоящее время интенсивно исследуется оптический пробой жидкостей [1–3]. Эта тема в основном связана с технологиями лазерной абляции в жидкостях [4–6] и технологией лазерно-индуцированной спектроскопии пробоя (LIBS) [7–9].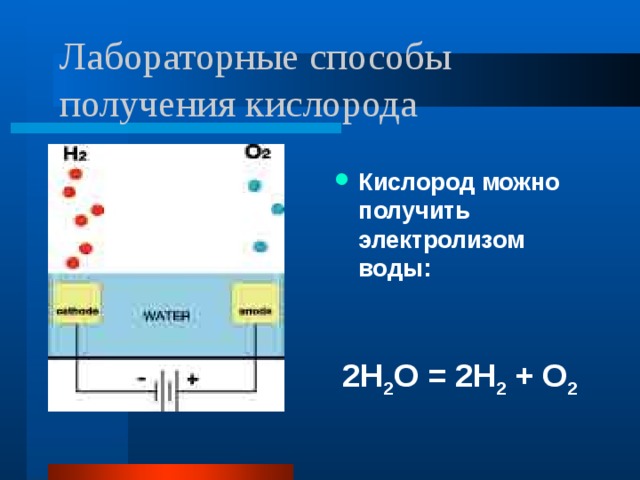 ].
].
Известно, что интенсивность процессов, происходящих при оптическом пробое жидкостей, может значительно возрастать при добавлении в жидкость наночастиц. Например, показано, что скорость генерации H 2 и O 2 при оптическом пробое жидкости, содержащей наночастицы, значительно возрастает [10, 11]. В случае оптического пробоя в присутствии наночастиц золота в воде скорость генерации гидроксильных радикалов увеличивается почти на два порядка [12]; аналогичные результаты были получены для перекиси водорода. Установлено, что на скорость образования продуктов разложения воды существенное влияние оказывает концентрация наночастиц в водном растворе.
Обычно зависимость эффективности оптического пробоя от концентрации наночастиц имеет один экстремум, хотя встречаются и более сложные зависимости [13]. Поэтому в данной работе мы использовали одну и ту же концентрацию наночастиц для всех экспериментальных групп. Также известно, что на эффективность оптического пробоя влияет размер наночастиц, присутствующих в коллоидном растворе [14]. Таким образом, в данной работе мы использовали наночастицы близких размеров для всех экспериментальных групп. Известно, что скорость образования пероксида водорода, молекулярного водорода или молекулярного кислорода при абляции массивных мишеней из разных металлов существенно различается [15]. Предполагается, что скорость образования продуктов разложения воды напрямую связана с окислительно-восстановительным потенциалом материала мишени. Можно предположить, что влияние материала наночастиц на образование продуктов разложения воды также может быть связано с окислительно-восстановительным потенциалом; однако, в отличие от металлов, наночастицы часто имеют на поверхности оксидный слой [16]. Такой слой может возникать даже на золоте [17] и других инертных материалах [18]. Поверхностный оксидный слой наночастицы не позволяет с необходимой точностью оценить ее окислительно-восстановительный потенциал, хотя исследования в этой области интенсивно ведутся [19].].
Таким образом, в данной работе мы использовали наночастицы близких размеров для всех экспериментальных групп. Известно, что скорость образования пероксида водорода, молекулярного водорода или молекулярного кислорода при абляции массивных мишеней из разных металлов существенно различается [15]. Предполагается, что скорость образования продуктов разложения воды напрямую связана с окислительно-восстановительным потенциалом материала мишени. Можно предположить, что влияние материала наночастиц на образование продуктов разложения воды также может быть связано с окислительно-восстановительным потенциалом; однако, в отличие от металлов, наночастицы часто имеют на поверхности оксидный слой [16]. Такой слой может возникать даже на золоте [17] и других инертных материалах [18]. Поверхностный оксидный слой наночастицы не позволяет с необходимой точностью оценить ее окислительно-восстановительный потенциал, хотя исследования в этой области интенсивно ведутся [19].].
На сегодняшний день недостаточно информации о влиянии материала наночастиц на процессы, сопровождающие лазерный пробой в коллоидных системах. В связи с этим целью данной работы является выявление и характеристика влияния материала наночастиц на процессы, сопровождающие лазерный пробой в коллоидных системах. Исследование проводилось с использованием наиболее близких переходных металлов четвертого периода (Fe, Ni) и пятого периода (Zr, Mo). Золото, переходный элемент шестого периода, использовалось в качестве сравнения. Золото является хорошим маркером для сравнения из-за его относительной инертности и широкой распространенности в исследованиях.
В связи с этим целью данной работы является выявление и характеристика влияния материала наночастиц на процессы, сопровождающие лазерный пробой в коллоидных системах. Исследование проводилось с использованием наиболее близких переходных металлов четвертого периода (Fe, Ni) и пятого периода (Zr, Mo). Золото, переходный элемент шестого периода, использовалось в качестве сравнения. Золото является хорошим маркером для сравнения из-за его относительной инертности и широкой распространенности в исследованиях.
Методы
Наночастицы различных металлов получены методом лазерной абляции в жидкости, подробности опубликованы ранее [20, 21]. Распределение по размерам и концентрацию наночастиц в полученных коллоидах определяли с помощью дисковой центрифуги CPS. В экспериментах использовались наночастицы со следующими средними размерами: Au — 23 ± 3 нм, Zr — 20 ± 5 нм, Mo — 25 ± 3 нм, Fe — 29 ± 3 нм, Ni — 22 ± 2 нм. Наночастицы имели металлическое ядро. На поверхности наночастиц наблюдался оксидный слой толщиной не более нескольких нанометров.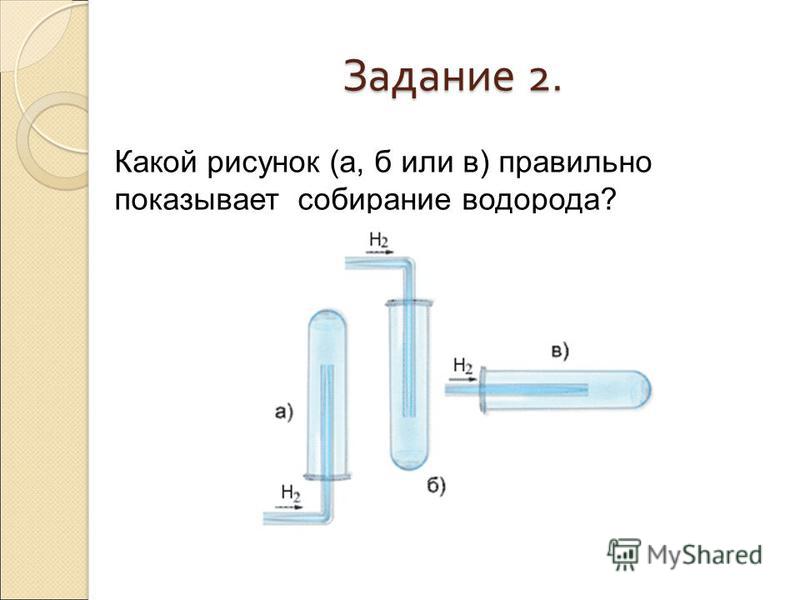
Экспериментальная установка показана на рис. 1. Nd:YAG-лазер с длиной волны λ = 1,064 нм, длительностью импульса τ = 10 нс, частотой ν = 10 кГц, средней энергией импульса ε = В качестве источника лазерного излучения использовали 1,25 мДж. Лазерный луч фокусировался внутри кюветы с помощью моторизованной системы линз и зеркал и перемещался в фиксированном направлении. Перемещение лазерного луча необходимо по следующей причине. Ранее мы обнаружили, что оптический пробой отдельных наночастиц происходит только в невозмущенной среде. После оптического пробоя лазерный импульс не может произвести пробой в одном и том же месте в течение нескольких десятков микросекунд; это связано с появлением пузырьков воздуха и тепловой дефокусировкой. Внутри кюветы были установлены амперометрические датчики молекулярного кислорода и водорода, подключенные к портативным анализаторам. Экспериментальная кювета была заполнена 20 мл деионизированной воды. Кювета охлаждалась снаружи, 20 мл — оптимальный объем для контроля температуры и измерений. Затем в кювету добавляли наночастицы определенного металла до конечной концентрации n = 10 10 шт/мл. Ранее нами было установлено, что при заданной концентрации наночастиц в водных растворах наблюдается наибольшая скорость образования продуктов разложения воды [22]. При облучении коллоидного раствора наночастиц регистрировали концентрацию молекулярного водорода и молекулярного кислорода, растворенных в воде.
Затем в кювету добавляли наночастицы определенного металла до конечной концентрации n = 10 10 шт/мл. Ранее нами было установлено, что при заданной концентрации наночастиц в водных растворах наблюдается наибольшая скорость образования продуктов разложения воды [22]. При облучении коллоидного раствора наночастиц регистрировали концентрацию молекулярного водорода и молекулярного кислорода, растворенных в воде.
РИСУНОК 1 . Схема экспериментальной установки. 1) Nd:YAG-лазер, λ = 1064 нм, τ = 100 нс, ν = 10 кГц, 2) лазерное излучение, 3) моторизованная система отражающих зеркал и линз, 4) кювета с водным раствором наночастиц, 5) H 2 и О 2 анализатор.
Регистрация пероксида водорода проводилась сразу после воздействия лазерного излучения. Из экспериментальной кюветы отбирали около 1 мл коллоидного раствора. Концентрацию пероксида водорода измеряли методом усиленной хемилюминесценции в системе люминол-4-йодофенол-пероксидаза хрена.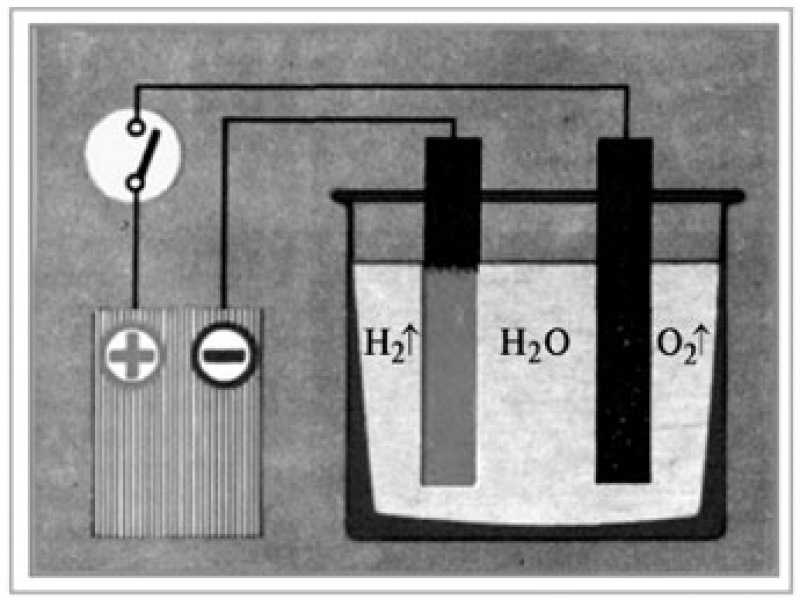 Использовали высокочувствительный люминометр Биотокс 7А УЗЭ (сверхчувствительная редакция). Все детали эксперимента описаны ранее [23].
Использовали высокочувствительный люминометр Биотокс 7А УЗЭ (сверхчувствительная редакция). Все детали эксперимента описаны ранее [23].
Концентрацию короткоживущих гидроксильных радикалов измеряли с помощью флуоресцентного зонда кумарин-3-карбоновой кислоты (CCA). При взаимодействии молекул гидроксильных радикалов с молекулами кумарин-3-карбоновой кислоты образуется 7-ОН-кумарин-3-карбоновая кислота с интенсивной флуоресценцией (λ ex = 410 нм, λ em = 475 нм). Отклик флуоресценции измеряли с помощью высокочувствительного спектрофлуориметра. Все детали эксперимента описаны ранее [22].
Результаты и обсуждение
На рис. 2А представлена зависимость концентрации молекулярного кислорода от времени облучения коллоидных растворов наночастиц Au, Zr, Mo, Fe и Ni. Как видно из рисунка, концентрация молекулярного кислорода в экспериментальной кювете в первые минуты не претерпевает никаких изменений. После установления равновесия между смесью атмосферных газов (N 2 + O 2 ) и новообразованных газов (H 2 + O 2 ) концентрация молекулярного кислорода в коллоиде начинает монотонно возрастать. со временем облучения. Наклон прямой линии использовали для расчета скорости образования молекулярного кислорода. Аппроксимация площади в интервале от 10 до 15 мин, что соответствует максимальному наклону, т. е. максимальной скорости генерации молекулярного кислорода.
со временем облучения. Наклон прямой линии использовали для расчета скорости образования молекулярного кислорода. Аппроксимация площади в интервале от 10 до 15 мин, что соответствует максимальному наклону, т. е. максимальной скорости генерации молекулярного кислорода.
РИСУНОК 2 . Изменение концентрации в зависимости от времени облучения коллоидного раствора наночастиц (A) молекулярный кислород (B) молекулярный водород (C) перекись водорода (D) гидроксильные радикалы.
Исследована зависимость концентрации молекулярного водорода от времени облучения коллоидных растворов наночастиц Au, Zr, Mo, Fe и Ni, рис. 2Б. Представленные зависимости характеризуются нелинейными кривыми с монотонным ростом концентрации на протяжении всего времени воздействия. Скорость образования молекулярного водорода определяли по наклону прямой, аппроксимирующей участок экспериментальной кривой в интервале от 10 до 20 мин. Как видно из рисунка 2Б, скорость генерации молекулярного водорода максимальна при использовании наночастиц никеля и минимальна при использовании наночастиц золота.
Как видно из рисунка 2Б, скорость генерации молекулярного водорода максимальна при использовании наночастиц никеля и минимальна при использовании наночастиц золота.
На рис. 2В представлена зависимость концентрации пероксида водорода от времени облучения коллоида. Как видно из рисунка, зависимость концентрации перекиси водорода от времени имеет линейный вид. Зависимости, соответствующие разным материалам наночастиц, характеризуются разной скоростью образования пероксида водорода. Показано, что при облучении коллоидных растворов наночастиц никеля наблюдается высокая скорость образования пероксида водорода. Наименьшая скорость образования пероксида водорода наблюдается при облучении наночастиц Au.
На рис. 2Г показана зависимость концентрации гидроксильных радикалов от времени облучения. Представленные зависимости аппроксимированы прямыми линиями с различным наклоном, соответствующими определенному материалу наночастиц. Так же, как и в случае перекиси водорода, наибольшая скорость генерации гидроксильных радикалов наблюдается при облучении наночастиц никеля, наименьшая — наночастиц золота.
Установлено, что концентрация перекиси водорода и гидроксильных радикалов увеличивается линейно со временем воздействия лазерного излучения. Напротив, концентрация газов (молекулярного водорода и молекулярного кислорода) не изменяется линейно. На начальных этапах наблюдается лаг-фаза, при длительном воздействии наблюдается насыщение. Очевидно, что генерация газов при оптическом пробое происходит с той же скоростью; изменение концентрации газов в жидкости связано прежде всего с их растворимостью. На начальных стадиях атмосферные газы (молекулярный азот и молекулярный кислород) находятся в коллоидном растворе. Молекулярный кислород и молекулярный водород, образующиеся при оптическом пробое, начинают вытеснять атмосферные газы из системы. В этом случае молекулярный водород вытесняет молекулярный кислород и молекулярный азот. В связи с этим в системе формируется квазиравновесие, которое смещается в сторону накопления газов в системе при вытеснении молекулярного азота [10]. На более поздних стадиях лазерного воздействия концентрация газов достигает предела растворимости и происходит насыщение.
На рис. 3 представлены значения скоростей образования различных продуктов разложения воды в зависимости от используемого материала наночастиц. Как видно из рисунка 3, наличие в растворе разных наночастиц приводит к разной скорости образования всех продуктов. Очевидно, это связано с увеличением вероятности поломки и, как следствие, количества поломок в ячейке. Самые высокие скорости образования всех зарегистрированных продуктов разложения воды наблюдаются при использовании коллоидных растворов, содержащих наночастицы никеля, самые низкие — при использовании наночастиц золота. Соотношение скоростей образования H 2 /H 2 O 2 /O 2 можно с некоторыми допущениями записать как 4/2/1. Отсюда следует, что при определенном количестве молекул воды образуется четыре молекулы водорода, две молекулы перекиси водорода и одна молекула кислорода.
РИСУНОК 3 . Влияние материала наночастиц на процессы генерации. (A) скорости генерации перекиси водорода (B) скорости генерации гидроксильных радикалов (C) скорости генерации молекулярного водорода (D) скорости генерации молекулярного кислорода.
Интересно, что при использовании всех наночастиц полное уравнение разложения воды имеет вид, близкий к следующему: . Это означает, что материал наночастиц не вносит существенного вклада в общий баланс уравнения. Другими словами, материал наночастиц практически не участвует в химических превращениях. Под влиянием различных металлов чаще всего наблюдается реакция Фентона (реакция разложения перекиси водорода): H 2 O 2 + Me → — OH + • OH + Me + [24].
В отдельной серии экспериментов было проверено действие полученных наночастиц. Наночастицы добавляли к 100 мкМ раствору перекиси водорода до конечной концентрации 10 10 шт/мл и оставляли на 30 мин при 20 ° С. Было показано, что все используемые наночастицы не оказывали существенного влияния на концентрацию перекиси водорода. . Наибольшее разложение пероксида водорода (около 10%) зафиксировано в коллоидных растворах наночастиц железа и никеля.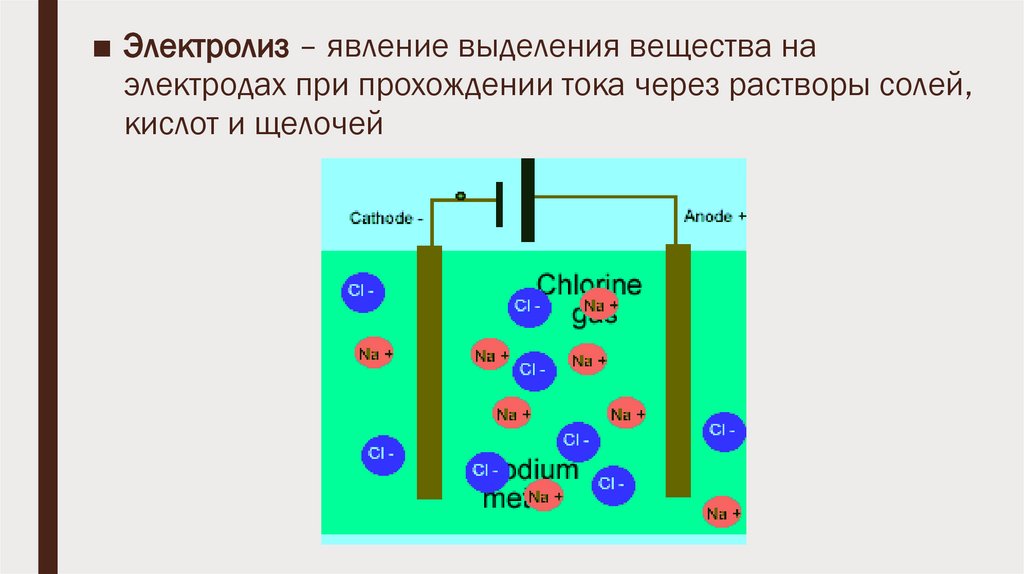 В принципе такой результат предсказуем, так как в мольном соотношении в коллоиде ионов металлов было значительно меньше, чем молекул перекиси водорода.
В принципе такой результат предсказуем, так как в мольном соотношении в коллоиде ионов металлов было значительно меньше, чем молекул перекиси водорода.
Расположение материалов наночастиц в представленном порядке можно объяснить разницей в коэффициенте поглощения выбранных материалов. Действительно, доля излучения, поглощаемая наночастицей, определяется коэффициентом поглощения соответствующего металла. При прочих равных параметрах большее количество поглощенного излучения приводит к образованию плазмы пробоя с более высокой температурой и большей областью локализации. В результате интенсивность распада молекул воды и скорость образования новых химических соединений напрямую связаны с долей энергии лазерного излучения, поглощаемой наночастицами. Значения коэффициента поглощения каждого материала при длинах волн излучения лазера, использованного в эксперименте (1064 нм), взяты из ссылки. 25 и показаны на рис. 4. Как видно, порядок расположения материалов соответствует полученному в эксперименте.
РИСУНОК 4 . Показатель преломления и коэффициент поглощения металлов при длине волны 1064 нм. Данные получены из базы данных https://refractiveindex.info.
Расхождения с экспериментальными данными можно объяснить тем, что точные значения коэффициентов поглощения для наночастиц могут отличаться. Также следует учитывать, что материалы наночастиц в большинстве своем представляют собой оксид того или иного материала, что также влияет на величину коэффициента поглощения.
Заключение
Экспериментально исследованы концентрационные зависимости перекиси водорода, гидроксильных радикалов, молекулярного водорода и кислорода от времени облучения водных коллоидных растворов наночастиц Au, Mo, Zr, Fe и Ni. Установлено, что при добавлении в раствор фиксированной концентрации наночастиц ( n = 10 10 шт/мл) и облучении полученного раствора скорость образования химических продуктов изменяется для различных материалов наночастиц. Наблюдаемые изменения скоростей генерации, по-видимому, зависят от оптических свойств конкретного материала и могут существенно меняться при окислении наночастиц.
Наблюдаемые изменения скоростей генерации, по-видимому, зависят от оптических свойств конкретного материала и могут существенно меняться при окислении наночастиц.
Заявление о доступности данных
Необработанные данные, подтверждающие выводы этой статьи, будут предоставлены авторами без неоправданных оговорок.
Вклад авторов
IB и SG провели эксперименты. И.Б., А.Л. и С.Г. участвовали в обработке результатов и их обсуждении. И.Б. и С.Г. участвовали в написании текста рукописи.
Финансирование
Работа выполнена при поддержке гранта Министерства науки и высшего образования Российской Федерации на крупные научные проекты по приоритетным направлениям научно-технического развития (Грант № 075-15-2020-775).
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы выражают благодарность Центру коллективного пользования ИОФ РАН за предоставленное оборудование.
Ссылки
1. Канитц А., Калус М., Гуревич Э., Остендорф А., Барциковски С., Аманс Д. Обзор экспериментальных и теоретических исследований ранней стадии процессов от фемтосекунд до микросекунд во время лазерной абляции в жидкой фазе для синтеза коллоидных наночастиц. Источники плазмы Sci. Технол (2019) 28:103001. doi:10.1088/1361-6595/ab3dbe
CrossRef Full Text | Google Scholar
2. Фогель А., Линц Н., Фрейданк С., Пальтауф Г. Нанокавитация в воде, индуцированная фемтосекундным лазером: последствия для порога оптического пробоя и клеточной хирургии. Физ. Rev. Lett (2008) 100:038102. doi:10.1103/PHYSREVLETT.100.038102
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
3. Lama J, Lombard J, Dujardin C, Ledoux G, Merabia S, Amans D. Динамическое исследование расширения пузырьков после лазерной абляции в жидкостях. заявл. физ. Письмо (2016) 108:074104. doi:10.1063/1.4942389
Полный текст CrossRef | Google Scholar
4. Zhang D, Ranjan B, Tanaka T, Sugioka K. Многоуровневые иерархические микро/наноструктуры, созданные фемтосекундной лазерной абляцией в жидкостях для поляризационно-зависимого широкополосного просветления. Наноматериалы (2020) 10(8):1573. дои: 10. 1573. 10.3390/nano10081573
Zhang D, Ranjan B, Tanaka T, Sugioka K. Многоуровневые иерархические микро/наноструктуры, созданные фемтосекундной лазерной абляцией в жидкостях для поляризационно-зависимого широкополосного просветления. Наноматериалы (2020) 10(8):1573. дои: 10. 1573. 10.3390/nano10081573
CrossRef Полный текст | Google Scholar
5. Fernández Arias M, Boutinguiza M, Del Val J, Covarrubias C, Bastias F, Gómez L, et al. Наночастицы меди, полученные методом лазерной абляции в жидкостях, в качестве бактерицидного агента для применения в стоматологии. заявл. Серф. Наука (2019) 507:145032. doi:10.1016/j.apsusc.2019.145032
Полный текст CrossRef | Google Scholar
6. Ши С.Ю., Шугаев М., Ву С., Жигилей Л. Влияние длительности импульса на генерацию наночастиц при импульсной лазерной абляции в жидкостях: результаты крупномасштабного атомистического моделирования. Физ. хим. хим. Phys (2020) 22:7077–99. doi:10.1039/D0CP00608D
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
7. Хан Д., Оменетто Н. Спектроскопия лазерно-индуцированного пробоя (LIBS), часть II: обзор инструментальных и методологических подходов к анализу материалов и приложений в различных областях. заявл. Spectrosc (2012) 66:347–419. doi:10.1366/11-06574
Хан Д., Оменетто Н. Спектроскопия лазерно-индуцированного пробоя (LIBS), часть II: обзор инструментальных и методологических подходов к анализу материалов и приложений в различных областях. заявл. Spectrosc (2012) 66:347–419. doi:10.1366/11-06574
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
8. Сдвиженский П., Леднев В., Асютин Р., Гришин М., Третьяков Р., Першин С. Исправление: онлайн-спектроскопия лазерного пробоя для анализа течения металлических частиц порошка при аддитивном производстве. Дж. Анал. В. Спектр (2020) 35:632. doi:10.1039/D0JA
A
Полный текст CrossRef | Google Scholar
9. Леднев В., Сдвиженский П., Асютин Р., Третьяков Р., Гришин М., Ставертий А. и др. Элементный анализ на месте и обнаружение отказов в процессе аддитивного производства с использованием спектроскопии лазерного пробоя. Optic Express (2019) 27:4612–28. doi:10.1364/OE.27.004612
Полный текст CrossRef | Google Scholar
10. Бармина Э., Симакин А., Шафеев Г. Эмиссия водорода при лазерном воздействии на коллоидные растворы наночастиц. Хим. физ. Lett (2016) 655-656:35–8. doi:10.1016/j.cplett.2016.05.020
Бармина Э., Симакин А., Шафеев Г. Эмиссия водорода при лазерном воздействии на коллоидные растворы наночастиц. Хим. физ. Lett (2016) 655-656:35–8. doi:10.1016/j.cplett.2016.05.020
Полный текст CrossRef | Академия Google
11. Сухов И.И., Шафеев Г.В., Бармина Е.В., Симакин А.В., Воронов В.В., Уваров О.Г. Генерация водорода лазерным облучением коллоидов железа и бериллия в воде. Кв. Электрон (2017) 47: 533–8. doi:10.1070/QEL16325
Полный текст CrossRef | Google Scholar
12. Симакин А., Асташев М., Баймлер И., Уваров О., Воронов В., Ведунова М. и др. Влияние концентрации наночастиц золота и плотности потока лазерного излучения на лазерно-индуцированное разложение воды. J. Phys. хим. Б (2019) 123(8):1869–80. doi:10.1021/acs.jpcb.8b11087
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Бармина Э., Гудков С., Симакин А., Шафеев Г. Стабильные продукты лазерно-индуцированного распада водных коллоидных растворов наночастиц. J. Laser Micro Nanoeng (2019) 12:254–7. doi:10.2961/jlmn.2017.03.0014
J. Laser Micro Nanoeng (2019) 12:254–7. doi:10.2961/jlmn.2017.03.0014
Полный текст CrossRef | Google Scholar
14. Баймлер И., Симакин А., Уваров О., Волков М., Гудков С. Генерация гидроксильных радикалов при лазерном пробое водных растворов в присутствии наночастиц Fe и Cu разного размера. Физ. Wave Phenom (2020) 28: 107–10. doi:10.3103/S1541308X20020028
Полный текст CrossRef | Google Scholar
15. Kalus M, Lanyumba R, Lorenzo-Parodi N, Jochmann M, Kerpen K, Hagemann U, et al. Определение роли редокс-активных материалов при лазерно-индуцированном разложении воды. Физ. хим. хим. Phys (2019) 21:18636–51. doi:10.1039/C9CP02663K
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Ziefuss AR, Haxhiaj I, Müller S, Gharib M, Gridina O, Rehbock C, et al. Происхождение индуцированного лазером окисления поверхности коллоидного золота и плотности заряда, а также его роль в катализе окисления. J. Phys. хим. C (2020) 124:20981–90. doi:10.1021/acs.jpcc.0c06257
Phys. хим. C (2020) 124:20981–90. doi:10.1021/acs.jpcc.0c06257
Полный текст CrossRef | Google Scholar
17. Batista L, Meader V, Romero K, Kunzler K, Kabir F, Bullock A, et al. Кинетический контроль фотохимического восстановления [AuCl 4 ] и размера наночастиц золота с помощью поглотителей гидроксильных радикалов. J. Phys. хим. B (2019) 123:7204–13. doi:10.1021/acs.jpcb.9b04643
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
18. Николс В., Сасаки Т., Кошизаки Н. Лазерная абляция платиновой мишени в воде. III. Лазерно-индуцированные реакции. J. Appl. Phys (2006) 100:114913. doi:10.1063/1.23
Полный текст CrossRef | Google Scholar
19. Маркхэм Дж., Янг Н., Бэтчелор-Маколи С., Комптон Р. Биполярные наноударные переходные процессы: контроль окислительно-восстановительного потенциала наночастиц в растворе. J. Phys. хим. C (2020) 124:14043–53. doi:10.1021/acs.jpcc.0c03316
Полный текст CrossRef | Google Scholar
20. Серков А., Бармина Е., Шафеев Г., Воронов В. Лазерная абляция титана в жидкости во внешнем электрическом поле. заявл. Серф. Sci (2015) 348:16–21. doi:10.1016/j.apsusc.2014.12.139
Серков А., Бармина Е., Шафеев Г., Воронов В. Лазерная абляция титана в жидкости во внешнем электрическом поле. заявл. Серф. Sci (2015) 348:16–21. doi:10.1016/j.apsusc.2014.12.139
Полный текст CrossRef | Google Scholar
21. Шафеев Г., Раков И., Айыыжы К., Михайлова Г., Троицкий А., Уваров О. Генерация наностержней Au методом лазерной абляции в жидкости и их дальнейшее удлинение во внешнем магнитном поле. Заяв. Серф. Sci (2018) 466: 477–82. doi:10.1016/j.apsusc.2018.10.062
CrossRef Полный текст | Google Scholar
22. Гудков С., Гурьев Е., Гапеев А., Шарапов М., Бункин Н., Шкирин А. и др. Немодифицированные гидратированные молекулы фуллерена С60 обладают антиоксидантными свойствами, предотвращают повреждение ДНК и белков, индуцированное активными формами кислорода, и защищают мышей от повреждений, вызванных радиационно-индуцированным окислительным стрессом. Наномедицина (2019) 15:37–46. doi:10.1016/j.nano.2018.09.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23.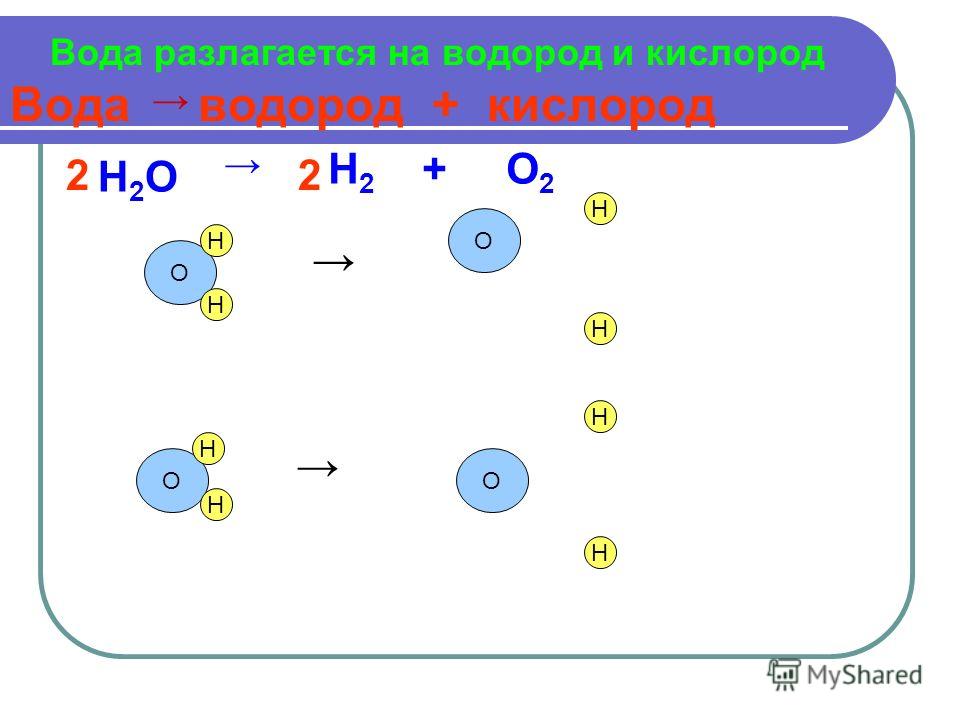 Штаркман И., Гудков С., Черников А., Брусков В. Образование перекиси водорода и гидроксильных радикалов в водных растворах L-аминокислот под действием рентгеновских лучей и тепла. Биофизика (2008) 53:5–13. doi:10.1134/S0006350
Штаркман И., Гудков С., Черников А., Брусков В. Образование перекиси водорода и гидроксильных радикалов в водных растворах L-аминокислот под действием рентгеновских лучей и тепла. Биофизика (2008) 53:5–13. doi:10.1134/S0006350
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
24. Фентон Х.Дж.Х. Окисление винной кислоты в присутствии железа. J. Chem. соц. Транс (1894) 65: 899–910. doi:10.1039/ct8946500899
Полный текст CrossRef | Google Scholar
25. Полянский М.Н. База данных показателей преломления. Доступно по адресу: https://refractiveindex.info (по состоянию на 20 октября 2020 г.).
Полнотекстовая перекрестная ссылка | Google Scholar
химическая реакция | Определение, уравнения, примеры и типы
сжигание
Посмотреть все СМИ
- Ключевые люди:
- Антуан Лавуазье
Клод-Луи Бертолле
Вильгельм Оствальд
Анри-Луи Ле Шателье
Сэр Дерек Х.
 Р. Бартон
Р. Бартон
- Похожие темы:
- кислотно-основная реакция механизм реакции окислительно-восстановительная реакция ионообменная реакция фотохимическая реакция
Просмотреть весь связанный контент →
Популярные вопросы
Каковы основы химических реакций?
- Химическая реакция — это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты. Вещества – это либо химические элементы, либо соединения.
- Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.

Подробнее ниже: Основные понятия о химических реакциях
химический элемент
Узнайте об этом типе вещества, которое не может быть разложено на более простые вещества обычными химическими процессами.химическое соединение
Узнайте об этом типе вещества, которое можно разложить на более простые вещества с помощью обычных химических процессов.Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современному взгляду на химические реакции, связи между атомами в реагентах должны быть разорваны, и атомы или части молекул снова собираются в продукты, образуя новые связи. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
химическая связь
Узнайте о различных типах химической связи.кислотно-основная реакция: реакции кислот Льюиса
Узнайте о кислотно-основных реакциях Льюиса.Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типу реагентов, по результату реакции и по механизму реакции. Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Подробнее читайте ниже: Классификация химических реакций
кислотно-щелочные реакции
Узнать о кислотно-щелочных реакциях.окислительно-восстановительная реакция
Узнайте об окислительно-восстановительных или окислительно-восстановительных реакциях.цепная реакция
Узнайте о цепных или самоподдерживающихся реакциях.Сводка
Прочтите краткий обзор этой темы
химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов. Вещества – это либо химические элементы, либо соединения. Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов.
Вещества – это либо химические элементы, либо соединения. Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и самой жизни. Сжигание топлива, выплавка железа, изготовление стекла и керамики, пивоварение, производство вина и сыра — вот лишь некоторые примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий. Химические реакции изобилуют в геологии Земли, в атмосфере и океанах, а также в огромном количестве сложных процессов, происходящих во всех живых системах.
Химические реакции следует отличать от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. В любом физическом состоянии вода (H 2 O) — одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода. Однако если вода в виде льда, жидкости или пара встречается с металлическим натрием (Na), атомы перераспределяются с образованием новых веществ: молекулярного водорода (H 2 ) и гидроксида натрия (NaOH). Таким образом, мы знаем, что произошло химическое изменение или реакция.
Однако если вода в виде льда, жидкости или пара встречается с металлическим натрием (Na), атомы перераспределяются с образованием новых веществ: молекулярного водорода (H 2 ) и гидроксида натрия (NaOH). Таким образом, мы знаем, что произошло химическое изменение или реакция.
Исторический обзор
Концепция химической реакции возникла примерно 250 лет назад. Он берет свое начало в ранних экспериментах, которые классифицировали вещества как элементы и соединения, а также в теориях, объясняющих эти процессы. Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Викторина «Британника»
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Первые серьезные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в 18 веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли. Влияние французского химика Антуана-Лорана Лавуазье было особенно заметным, поскольку его идеи подтвердили важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Elementary Treatise on Chemistry ) Лавуазье определил 33 «элемента» — вещества, не разделенные на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, прибавляемый при окислении элементов, и приписал результат соединению элемента с кислородом. Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Влияние французского химика Антуана-Лорана Лавуазье было особенно заметным, поскольку его идеи подтвердили важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Elementary Treatise on Chemistry ) Лавуазье определил 33 «элемента» — вещества, не разделенные на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, прибавляемый при окислении элементов, и приписал результат соединению элемента с кислородом. Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Другим событием исторического значения, касающимся химических реакций, было развитие атомной теории. Большая заслуга в этом принадлежит английскому химику Джону Дальтону, постулировавшему свою атомную теорию в начале XIX века. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции связаны с перестройкой атомов с образованием новых веществ. Этот взгляд на химические реакции точно определяет текущий предмет. Теория Дальтона послужила основой для понимания результатов более ранних экспериментаторов, в том числе закона сохранения материи (материя не создается и не разрушается) и закона постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Этот взгляд на химические реакции точно определяет текущий предмет. Теория Дальтона послужила основой для понимания результатов более ранних экспериментаторов, в том числе закона сохранения материи (материя не создается и не разрушается) и закона постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили концепцию химических реакций. Сегодня экспериментальная химия дает бесчисленное множество примеров, а теоретическая химия позволяет понять их значение.
Основные понятия о химических реакциях
Создавая новое вещество из других веществ, химики говорят, что либо проводят синтез, либо синтезируют новый материал. Реагенты превращаются в продукты, и процесс символизируется химическим уравнением. Например, железо (Fe) и сера (S) объединяются, образуя сульфид железа (FeS).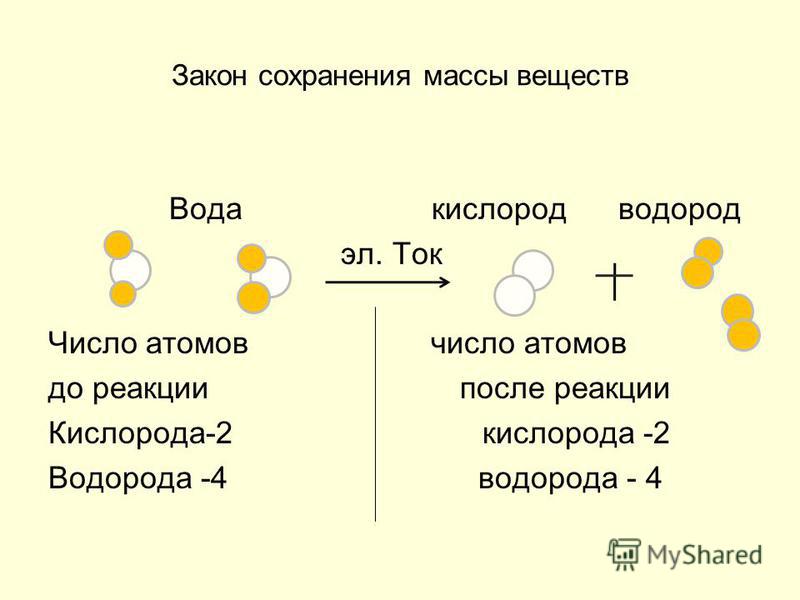 Fe(s) + S(s) → FeS(s) Знак плюс указывает на то, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт. Вещественное состояние реагентов и продуктов обозначается символами (s) для твердых тел, (l) для жидкостей и (g) для газов.
Fe(s) + S(s) → FeS(s) Знак плюс указывает на то, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт. Вещественное состояние реагентов и продуктов обозначается символами (s) для твердых тел, (l) для жидкостей и (g) для газов.
Реакция разложения в химии | ChemTalk
Учебные пособия
- Сообщение от Эндрю Дао
18 Jul
Основные понятия
В этом уроке вы узнаете, что такое реакция разложения и ее виды. Вы также сможете изучить некоторые из его увлекательных примеров!
Темы, освещенные в других статьях
- Что такое химическая реакция?
- Типы химических реакций
- Балансировка химических уравнений
- Эндотермические и экзотермические реакции
- Физические и химические свойства
Что такое реакция разложения?
Реакции разложения — это химические реакции, в которых исходное соединение распадается на два или более простых компонента.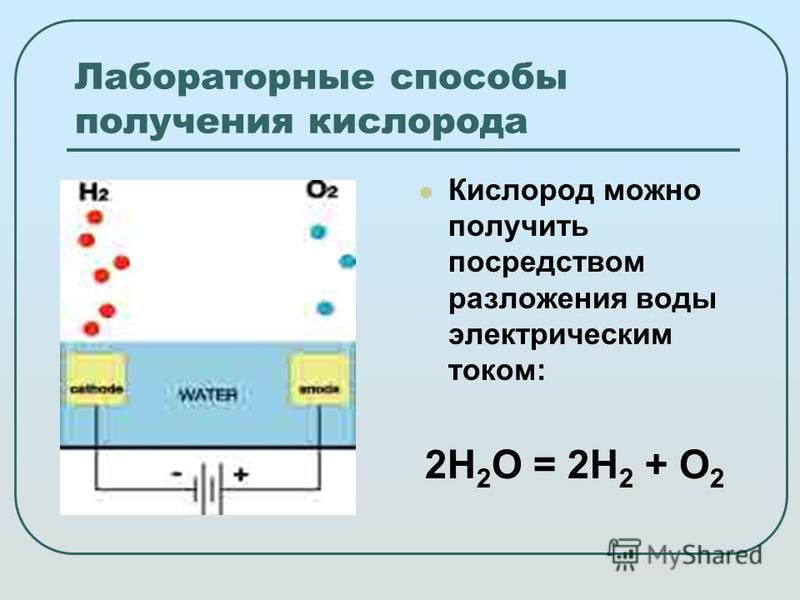 Эти более простые составляющие могут быть либо элементами, либо соединениями, либо и тем, и другим. Вот общая формула реакции разложения:
Эти более простые составляющие могут быть либо элементами, либо соединениями, либо и тем, и другим. Вот общая формула реакции разложения:
AB → A + B
(AB — реагент. A и B — продукты)
Реакции разложения обычно эндотермические , поскольку для разрыва химических связей требуется затрата энергии. Да, образование продуктов действительно высвобождает энергию, когда они образуют новые связи, но этой энергии обычно недостаточно, чтобы компенсировать первоначальную энергию, затраченную на разрыв связей реагента.
Однако в редких случаях, когда энергия образования связи продуктов превышает энергию разрыва связи реагента (вероятно, из-за высокой реакционной способности реагента), реакция разложения может быть экзотермической. Разложение перекиси водорода, которое мы рассмотрим позже, является одним из таких случаев.
Типы реакций разложения
Помните, я говорил, что для того, чтобы начать реакцию разложения, вам нужен подвод энергии? Ну, этот ввод энергии может быть теплом, светом или электричеством.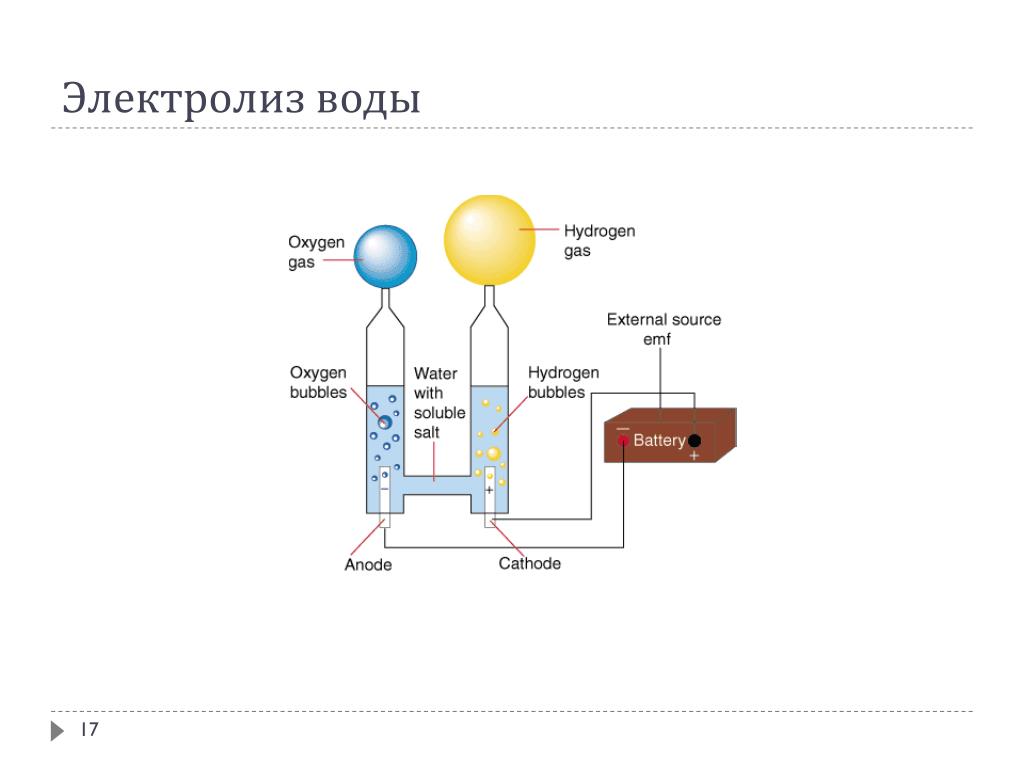
Термическое разложение (термолиз)
Термолиз происходит при химическом разрушении соединения под воздействием тепла. То есть теплота является реагентом; мы подводим тепло, чтобы запустить реакцию.
Давайте рассмотрим пример: разложение карбоната кальция (CaCO 3 ).
CaCO 3 (т) + Δ → CaO (т) + CO 2 (г) (Δ означает тепло)
(в качестве реагента я поставил Δ, потому что это проще сделать на компьютере . Вы совершенно правильно ставите Δ на стрелке реакции. То же верно и для hν ниже.)
Если бы вам пришлось провести эту реакцию в реальной жизни, вы бы заметили, что ваш первоначальный твердый образец CaCO 3 станет довольно рассыпчатым после того, как вы нагреете его, и в процессе будет подниматься некоторое количество газа. Это признаки того, что произошли некоторые химические изменения. Действительно, ваш CaCO 3 разложился на рассыпчатый газ CaO и CO 2 .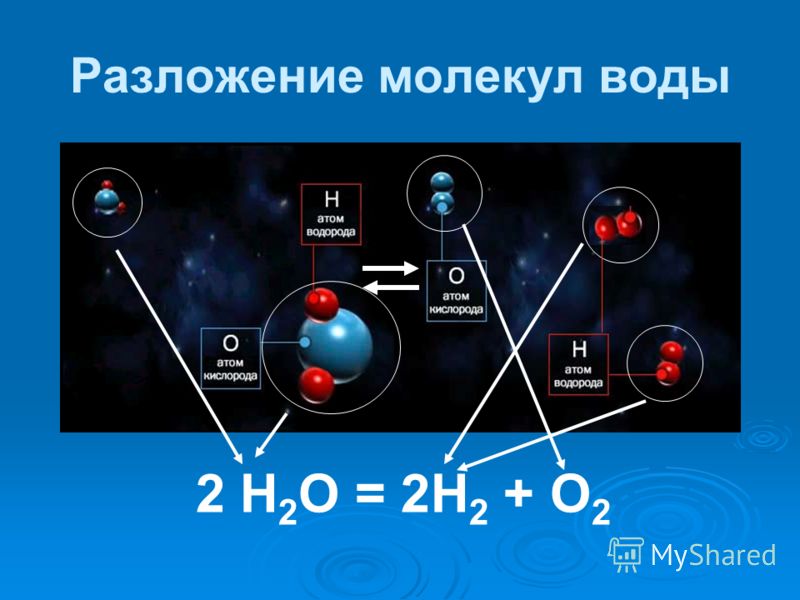
Фоторазложение (фотолиз)
Фотолиз происходит, когда свет (точнее, фотоны) химически разрушает соединение. Пример фотолиза можно найти среди светозависимых реакций процесса фотосинтеза растений:
H 2 O + hν → 2 H + + 2 e – + 1/2 O 2 (hν означает свет)
Здесь вода поглощает свет (в частности, 2 фотона) и распадается на протоны (H + ), электроны (e – ) и молекулярный кислород.
Хлоропласт растения, в котором происходит фотолиз воды.Источник: Викисклад.
Электролиз
У нас есть целая статья, посвященная электролизу: Электролитические ячейки и электролиз! Проверьте это, если вы хотите узнать больше об этой электрифицирующей технике (каламбур)!
В любом случае, электролиз происходит, когда электричество химически разрушает соединение. Реакция электролиза представляет собой комбинацию двух одновременных полуреакций (реакции восстановления и реакции окисления).
Давайте рассмотрим пример: электролиз хлорида натрия (NaCl).
2 NaCl (ж) → 2 Na (ж) + Cl 2 (ж)
В этой реакции NaCl разлагается на жидкий металлический натрий и газообразный хлор. Происходят две полуреакции: восстановление ионов Na + и окисление ионов Cl – .
Установка для электролиза NaCl.Источник: Викисклад.
Примеры реакций разложения
Как и было обещано ранее, давайте исследуем разложение перекиси водорода (H 2 O 2 ).
2 H 2 O 2 (водн.) → 2 H 2 O (ж) + O 2 (ж)
Так как в перекисно-кислородной связи Крайне нестабильная перекись водорода, хранящаяся в бутылках, постоянно разлагается на воду и газообразный кислород. Однако, если вы хотите чего-то более интересного (и опасного), вы можете попробовать ускорить его разложение, используя катализатор, такой как перманганат калия (KMnO 9).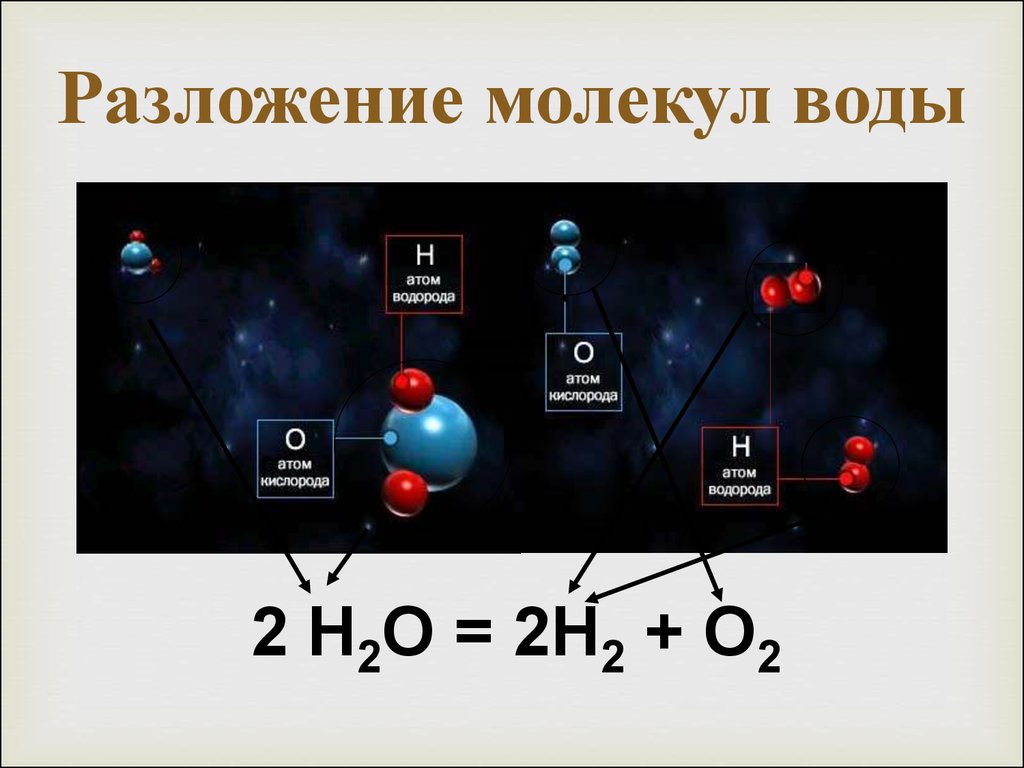 0163 4 ), как показано на видео ниже. Такая реакция сильно экзотермична — она может достигать очень высоких температур и выделять много газа (большую часть которого составляет водяной пар). Поэтому, пожалуйста, не проводите реакцию дома, если вы не имеете на это права.
0163 4 ), как показано на видео ниже. Такая реакция сильно экзотермична — она может достигать очень высоких температур и выделять много газа (большую часть которого составляет водяной пар). Поэтому, пожалуйста, не проводите реакцию дома, если вы не имеете на это права.
Кстати, разложение перекиси водорода также играет решающую роль в изготовлении зубной пасты «Слон»!
Другой популярной реакцией разложения является разложение гидроксидов металлов . Гидроксиды металлов при нагревании разлагаются на оксиды металлов и воду. Вот несколько примеров:
- Разложение гидроксида натрия : 2 NaOH (т) + Δ → Na 2 O (т) + H 2 O (г)
- Гидроксид кальция: Ca(OH) ) 2 + Δ → CaO + H 2 O
- Железа (III) гидроксид : 2 Fe(OH) 3 + Δ → Fe 2 O 90 + H 4 O 90 +
4 3 9016 3 9016
Дополнительная литература
- Реакции горения
- Химические реакции Инфографика
- Что такое электрохимия?
- Меловой элемент Кальций
Реакция распада перекиси водорода и ее особенности
[Депозитные фотографии] Перекись водорода – нестабильное вещество.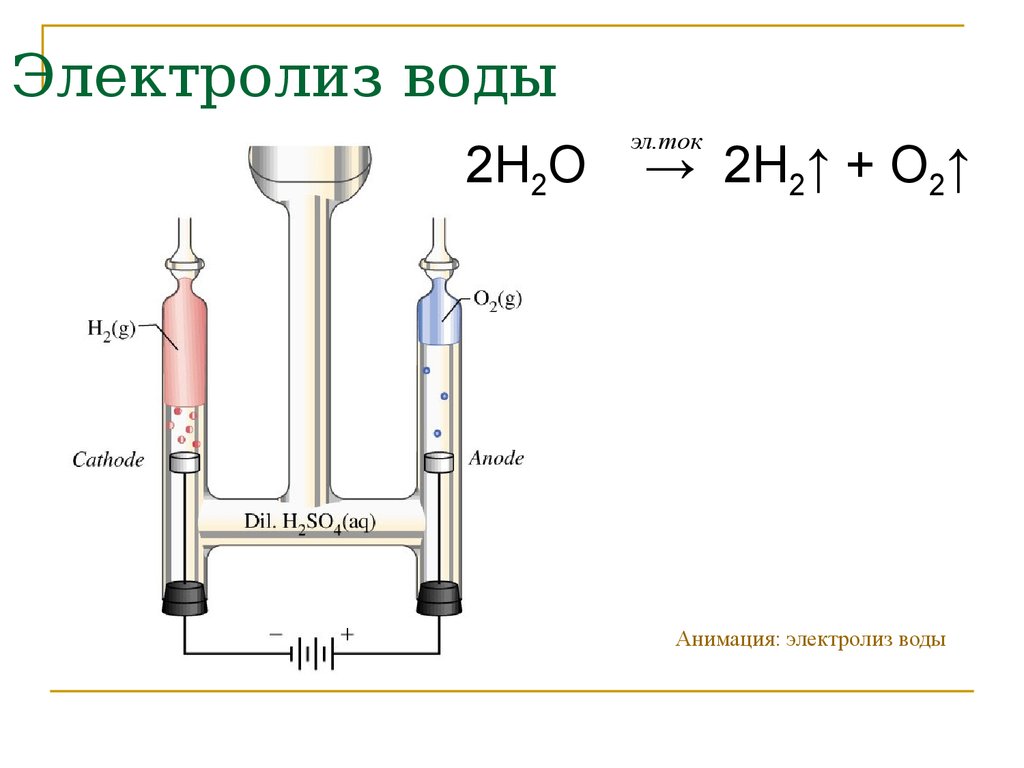 В чистом виде он нестабилен, легко разрушается, причем процесс часто сопровождается взрывом. В водных растворах он более стабилен, но при хранении растворов постоянно выделяется кислород. Этот процесс ускоряется от воздействия света, катализаторов или нагревания. Катализаторами могут быть соединения железа, меди, диоксида марганца, кобальта, ферменты каталазы и другие вещества
В чистом виде он нестабилен, легко разрушается, причем процесс часто сопровождается взрывом. В водных растворах он более стабилен, но при хранении растворов постоянно выделяется кислород. Этот процесс ускоряется от воздействия света, катализаторов или нагревания. Катализаторами могут быть соединения железа, меди, диоксида марганца, кобальта, ферменты каталазы и другие вещества
Химическая характеристика перекиси водорода
Перекись водорода представляет собой прозрачную, бесцветную и маловязкую жидкость без вкуса и запаха, которая в больших объемах имеет голубоватый оттенок. Вещество также известно как гидроперит и пергидроль. Он в 1,5 раза тяжелее воды и может смешиваться с ней в любых соотношениях. Молекулярная масса перекиси водорода 34,02, температура замерзания 0,5 градуса Цельсия, температура кипения 67 градусов. Химическая формула: Н₂О₂.
Перекись водорода — негорючая жидкость, пожаровзрывоопасная, сильный окислитель, вступает в реакции со многими веществами: перекись водорода легко распадается на кислород и воду при воздействии света, а также при попадании света при контакте с восстановителями и окислителями, при взаимодействии со щелочью или при нагревании. В идеальных условиях Н₂О₂ распадается медленно, со скоростью 1% в месяц. Скорость распада замедляется на морозе, поэтому вещество может длительное время храниться в замороженном состоянии – от минус 0,5 градуса по Цельсию. В природе Н₂О₂ встречается в незначительных количествах – например, в снеговой или дождевой воде.
В идеальных условиях Н₂О₂ распадается медленно, со скоростью 1% в месяц. Скорость распада замедляется на морозе, поэтому вещество может длительное время храниться в замороженном состоянии – от минус 0,5 градуса по Цельсию. В природе Н₂О₂ встречается в незначительных количествах – например, в снеговой или дождевой воде.
Разложение перекиси водорода — реакция в лаборатории
Каталитическое разложение перекиси водорода в этом эксперименте выглядит очень эффективно. Возьмите коническую колбу емкостью 300 мл и налейте в нее 15 мл жидкости для мытья посуды любой марки. В другой колбе растворить 4 грамма медного купороса большим количеством крепкого раствора аммиака – добавить раствор до полного растворения медного купороса. В реакции образуется синий аммиак меди.
Раствор аммиачной меди налить в колбу с жидкостью для мытья посуды и тщательно перемешать.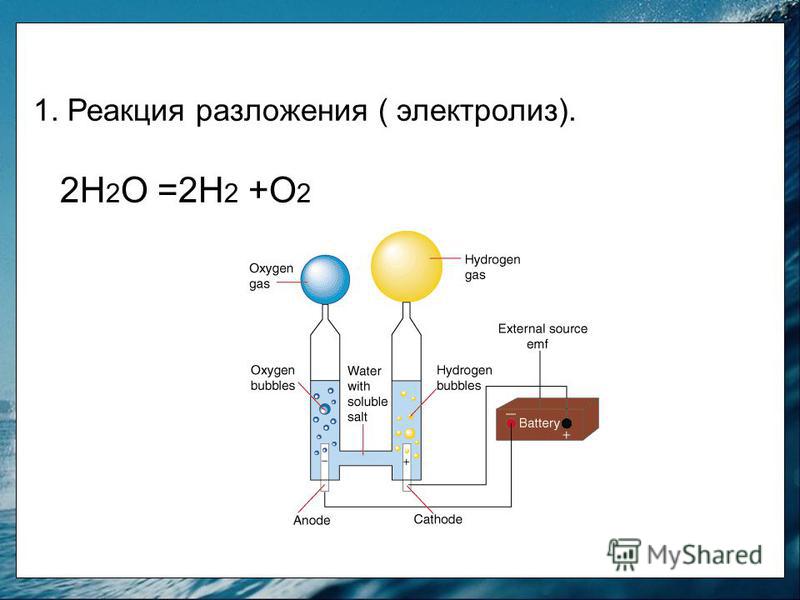 Затем поставьте колбу на стол и быстро добавьте 70 мл 30-50% раствора перекиси водорода. Выделяется большое количество газа, и из колбы бьет фонтан пены. Все рабочее пространство покрыто большими комками пены. Так как реакция разложения перекиси водорода протекает с выделением тепла, из пены поднимается пар.
Затем поставьте колбу на стол и быстро добавьте 70 мл 30-50% раствора перекиси водорода. Выделяется большое количество газа, и из колбы бьет фонтан пены. Все рабочее пространство покрыто большими комками пены. Так как реакция разложения перекиси водорода протекает с выделением тепла, из пены поднимается пар.
30-50% перекись водорода можно заменить раствором перекиси водорода, который продается в аптеках. Чтобы убедиться, что расщепление перекиси водорода происходит быстро, мы рекомендуем вам использовать высокую концентрацию H₂O₂. С другой стороны, катализатор разложения H₂O₂ должен быть достаточно активным — можно использовать аммиак меди или перманганат калия. Иногда используют йодистый калий, но эксперименты с этим веществом не всегда удачны.
Внимание! Не пытайтесь повторить этот эксперимент без профессионального присмотра! Рекомендуем провести безопасный, но в то же время удивительный эксперимент — «Египетская ночь».
Изучение реакции распада перекиси водорода
Жидкая перекись водорода имеет большую энергию, чем жидкая вода и газообразный кислород на 23 ккал, т.е. разлагается экзотермически. Жидкий Н₂О₂ при реакции распада на кислород и пары воды выделяет 13 ккал. С помощью простой арифметики легко подсчитать, что при распаде одного кубического сантиметра чистой жидкой перекиси водорода на кислород и воду происходит самонагревание, при котором вся вода переходит в парообразное состояние, а образующаяся смесь газообразного кислорода и воды молекул достигает температуры около 1000 градусов Цельсия.
[Фликр] В результате повышения температуры газы расширяются, а 1 см жидкой перекиси водорода при распаде дает 7000 см горячих газов. Так как пробой происходит мгновенно при расширении в 7000 раз, происходит очень опасный взрыв. Как только небольшое количество этой перекиси водорода распадается, выделяющиеся при распаде вещества нагревают соседние частицы перекиси водорода, которые, в свою очередь, разрушаются от нагревания, выделяют больше тепла и т. д. Реакция, начавшаяся в одной точке или маленькой капле перекиси водорода, сразу же распространяется на всю массу вещества, и происходит взрыв, а при наличии горючих веществ — вспышка.
д. Реакция, начавшаяся в одной точке или маленькой капле перекиси водорода, сразу же распространяется на всю массу вещества, и происходит взрыв, а при наличии горючих веществ — вспышка.
Например, даже 60% раствор перекиси водорода при комнатной температуре воспламеняет древесную стружку и бумагу при контакте с ними. Чем ниже концентрация перекиси водорода, тем она менее опасна, так как теплота химической реакции распада идет на испарение большой массы воды, обладающей значительной теплоемкостью и теплотой испарения. Понятно, что 10-процентный раствор перекиси водорода при разрушении может нагреться до температуры кипения, и даже 3-процентный раствор перекиси водорода при разрушении может нагреться на 20 градусов выше начальной температуры.
При сильном загрязнении концентрированной перекиси водорода реакция разложения может ускориться из-за самонагревания вещества. Этот процесс, сначала медленный, может достигать экстремальной скорости, сопровождающейся взрывом контейнера, несмотря на наличие вентиляционного отверстия. Возможные несчастные случаи можно предотвратить, постоянно повышая температуру продукта в течение определенного периода времени. Скорость повышения температуры зависит от степени загрязнения. Если нагрев не прекращается, загрязненную перекись водорода следует быстро разбавить водой и слить. Большие резервуары для хранения концентрированной перекиси водорода должны быть оснащены термометрами, чтобы предупреждать о возможной поломке.
Возможные несчастные случаи можно предотвратить, постоянно повышая температуру продукта в течение определенного периода времени. Скорость повышения температуры зависит от степени загрязнения. Если нагрев не прекращается, загрязненную перекись водорода следует быстро разбавить водой и слить. Большие резервуары для хранения концентрированной перекиси водорода должны быть оснащены термометрами, чтобы предупреждать о возможной поломке.
Химическое разложение — Энциклопедия Нового Света
Из Энциклопедии Нового Света
Перейти к:навигация, поиск
Предыдущая (Химическая связь)
Следующая (Химический элемент)
Химическое разложение — это разделение (или расщепление) химическое соединение на более мелкие соединения или элементы. Иногда его определяют как противоположность химическому синтезу. Стабильность, которой обычно обладает химическое соединение, в конечном итоге ограничивается при воздействии экстремальных условий окружающей среды, таких как тепло, радиация, влажность или кислотность растворителя. Детали процессов разложения, как правило, четко не определены, поскольку молекула может распадаться на множество более мелких фрагментов. Обычно выделяют три типа реакций разложения: термические, электролитические и каталитические.
Детали процессов разложения, как правило, четко не определены, поскольку молекула может распадаться на множество более мелких фрагментов. Обычно выделяют три типа реакций разложения: термические, электролитические и каталитические.
Содержание
- 1 Более широкое определение
- 2 Формулы реакций
- 2.1 Дополнительные примеры
- 3 Термическое разложение
- 4 См. также
- 5 Примечания
- 6 Каталожные номера
- 7 кредитов
Химическое разложение часто является нежелательной химической реакцией. Однако химическое разложение используется в нескольких аналитических методах, особенно в масс-спектрометрии, традиционном гравиметрическом анализе и термогравиметрическом анализе.
Более широкое определение
Более широкое определение термина разложение также включает разбиение одной фазы на две или более фаз. [1]
Формулы реакций
Обобщенная формула реакции химического разложения:
- AB → A + B
, на конкретном примере электролиз воды до газообразного водорода и кислорода:
- 2Н 2 О → 2Н 2 + О 2
Дополнительные примеры
Примером самопроизвольного разложения является перекись водорода, которая медленно разлагается на воду и кислород:
- 2H 2 O 2 → 2H 2 O + O 2
Углезаты будут разъединяться при нагревании, причем известным исключением является то, что из карбоновой кислоты, H 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 .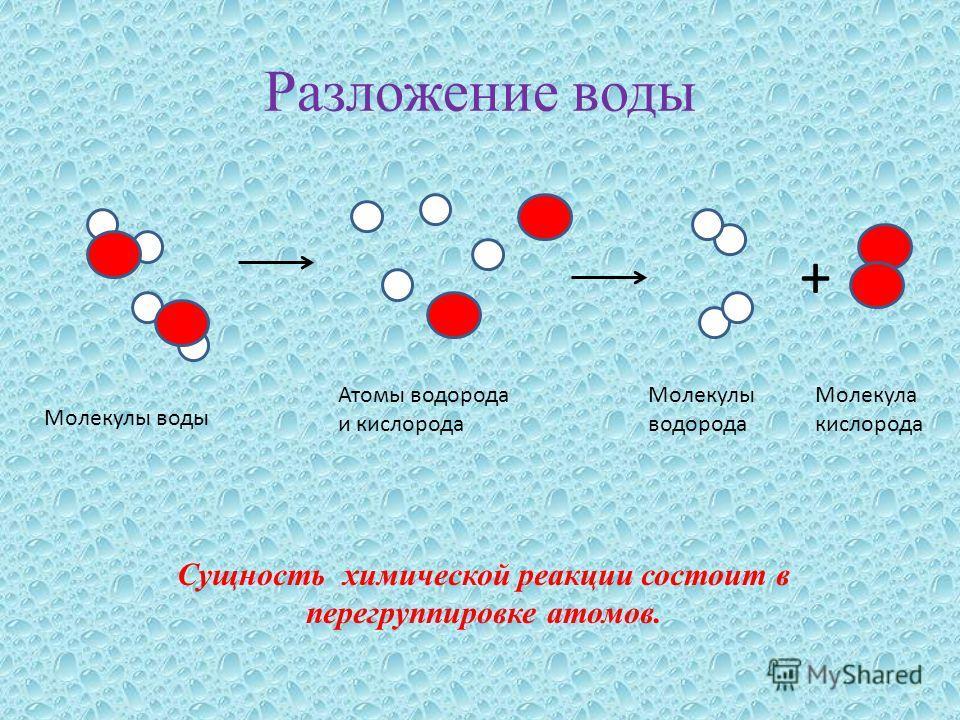 Угольная кислота, «шипучая» газировка, банки из-под газированных напитков и другие газированные напитки, со временем (самопроизвольно) разлагается на углекислый газ и воду.
Угольная кислота, «шипучая» газировка, банки из-под газированных напитков и другие газированные напитки, со временем (самопроизвольно) разлагается на углекислый газ и воду.
- H 2 CO 3 → H 2 O + CO 2
Другие карбонаты разлагаются при нагревании с образованием соответствующего оксида металла и углекислого газа. В следующем уравнении M представляет собой металл:
- MCO 3 → MO + CO 2
Конкретный пример с карбонатом кальция:
- CaCO 3 → CaO + CO 2
Хлораты металлов также разлагаются при нагревании. Продуктами являются хлорид металла и газообразный кислород.
- MClO 3 → MCl + O 2
Обычное разложение хлората с выделением кислорода использует хлорат калия следующим образом:
- 2KClO 3 → 2KCl + 3O 2
Thermal decomposition
Thermal decomposition , also called thermolysis, is defined as a chemical reaction whereby a chemical substance breaks up into at least two chemical substances при нагреве. Реакция обычно эндотермическая, так как для разрыва химических связей в разлагающемся соединении требуется тепло. температура разложения вещества – это температура, при которой вещество разлагается на более мелкие вещества или на составляющие его атомы.
Реакция обычно эндотермическая, так как для разрыва химических связей в разлагающемся соединении требуется тепло. температура разложения вещества – это температура, при которой вещество разлагается на более мелкие вещества или на составляющие его атомы.
Например, карбонат кальция разлагается на оксид кальция и диоксид углерода. Некоторые соединения, с другой стороны, просто разлагаются на составляющие их элементы. Вода при нагревании значительно выше 2000 градусов по Цельсию распадается на свои составляющие – водород и кислород.
Типичным примером является разложение карбоната меди на оксид меди и диоксид углерода, показанное здесь:
- CuCO 3 → CuO + CO 2
Карбонат меди из зеленого порошка превращается в черный оксид меди, а углекислый газ выделяется в газообразном состоянии.
Разложению может способствовать присутствие катализатора. Например, перекись водорода быстрее разлагается при использовании оксида марганца (IV):
- 2H 2 O 2 (водн.
 ) → 2H 2 O(ж) + O 2 (г)
) → 2H 2 O(ж) + O 2 (г)
Высокие температуры также могут вызвать полимеризацию, что также может привести к термическому образованию молекул разложение и испарение более мелких молекул в процессе. Такие реакции называются реакциями пиролиза. Типичным примером является коксование, которое представляет собой образование аморфной углеродной структуры наряду с испарением водорода и других пиролизных газов.
Если термическое разложение вещества существенно экзотермическое, то вещество термодинамически неустойчиво. Если его инициировать, его разложение образует петлю положительной обратной связи и подвергается тепловому разгону вплоть до взрыва.
Этот процесс можно увидеть практически в каждом офисе, когда на плите оставляют кофейник. При осмотре можно увидеть маслянистое вещество сверху, которое представляет собой органические компоненты кофе, выходящие из раствора из-за перегрева или повторного нагревания.
См. также
- Аналитическая химия
- Карбонат
- Катализ
- Химическая реакция
- Горение
- Электролиз
- Тепло
Примечания
- ↑ Золотая Книга, Разложение.
 Проверено 25 февраля 2009 г.
Проверено 25 февраля 2009 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Макмерри, Джон. 2004. Органическая химия, 6-е изд. Бельмонт, Калифорния: Брукс/Коул. ISBN 0534420052.
- Соломоновы острова, Т.В. Грэм и Крейг Б. Фрайл. 2004. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: Джон Уайли. ISBN 0471417998.
- Zumdahl, Steven S. 2005. Химические принципы . Нью-Йорк, штат Нью-Йорк: Хоутон Миффлин. ISBN 0618372067.
Авторы
New World Encyclopedia авторы и редакторы переписали и дополнили статью Wikipedia в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участника и самоотверженные добровольные участники Фонда Викимедиа.






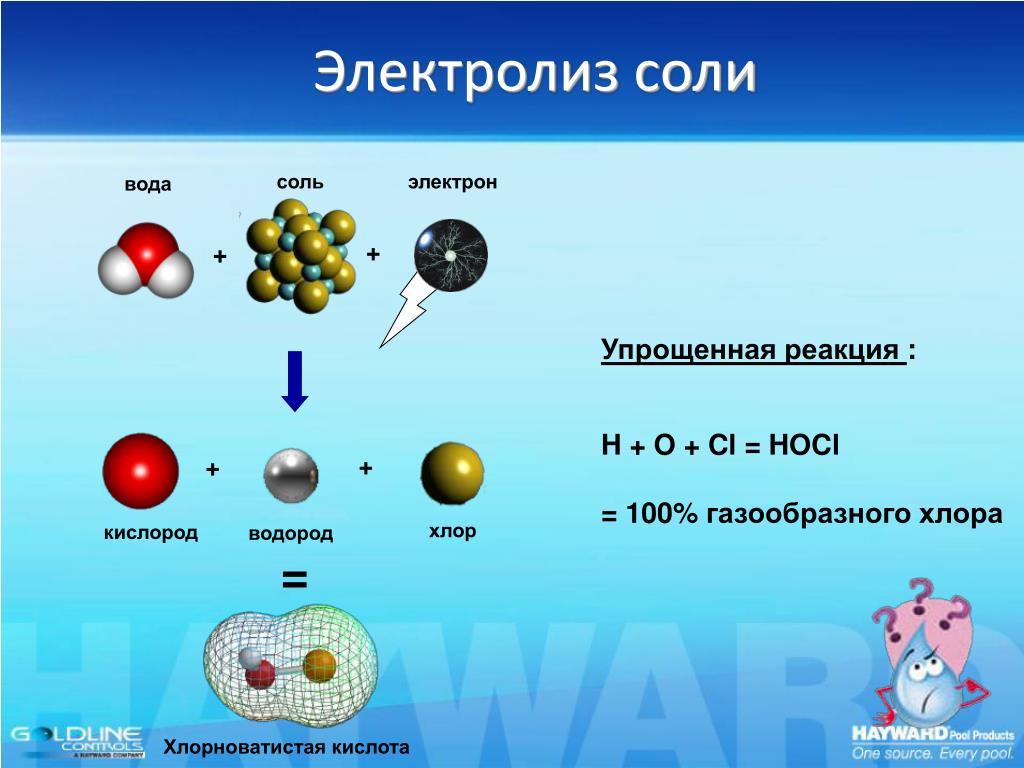 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
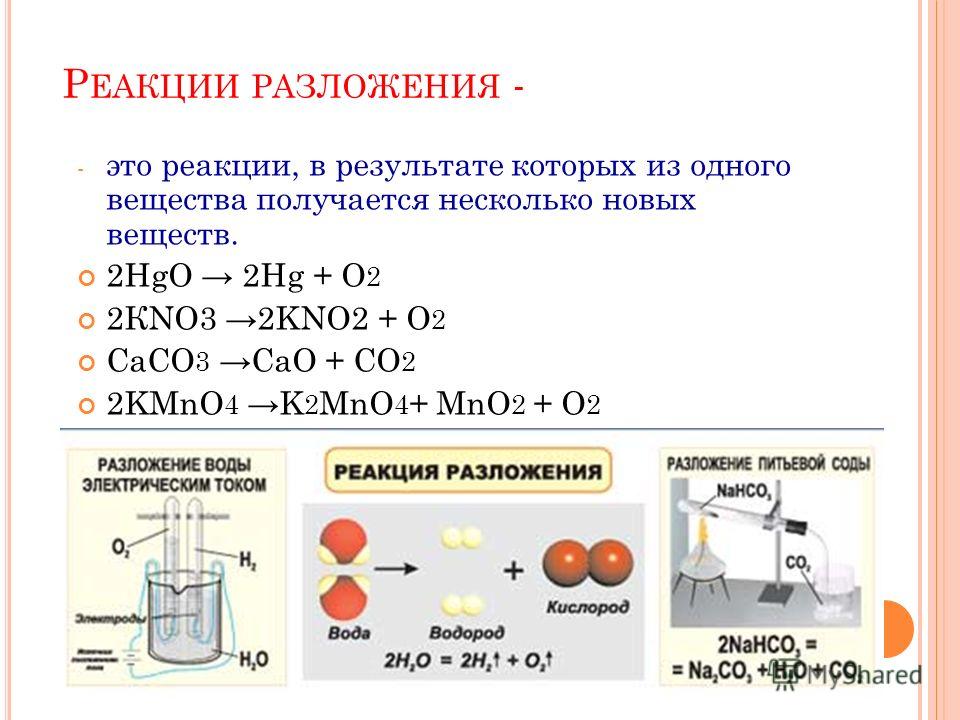
 Более безопасная химия
Более безопасная химия Methane cracking as a bridge technology to the hydrogen economy. // International Journal of Hydrogen Energy. — 2017. — № 42(1). — С. 720–731.
Methane cracking as a bridge technology to the hydrogen economy. // International Journal of Hydrogen Energy. — 2017. — № 42(1). — С. 720–731. — 2016. — № 41(46). — С. 21665–21669.
— 2016. — № 41(46). — С. 21665–21669. (Изображение взято: Vion, патент США 28793. Июнь 1860 г.)
(Изображение взято: Vion, патент США 28793. Июнь 1860 г.) Хансен; Дас (2014). «Текст». Энергетика и экология. 7 (1): 317–322. Дои:10.1039 / C3EE43040E.
Хансен; Дас (2014). «Текст». Энергетика и экология. 7 (1): 317–322. Дои:10.1039 / C3EE43040E. Дата поступления: 31 декабря 1959 г.
Дата поступления: 31 декабря 1959 г. Р. Бартон
Р. Бартон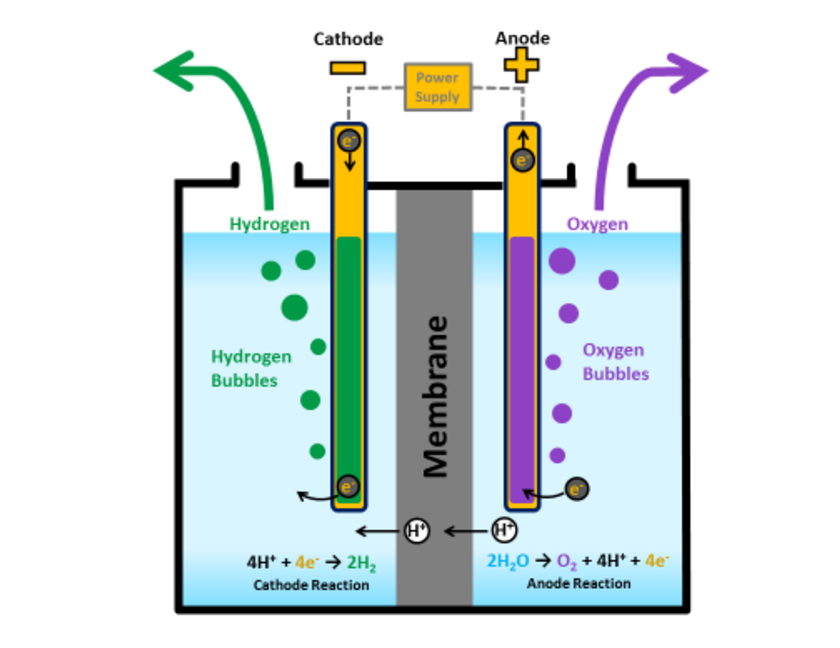
 ) → 2H 2 O(ж) + O 2 (г)
) → 2H 2 O(ж) + O 2 (г) Проверено 25 февраля 2009 г.
Проверено 25 февраля 2009 г.