Водородная связь | CHEMEGE.RU
Рассмотрим взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не образуются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
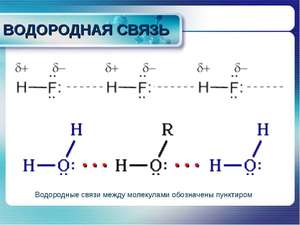
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
- фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота),
- вода H2O (пар, лед, жидкая вода):
- раствор аммиака и органических аминов — между молекулами аммиака и воды;
- органические соединения, в которых есть связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью.
Поделиться ссылкой:
Металлическая и водородная химические связи. Видеоурок. Химия 11 Класс
Тема: Типы химической связи
Урок: Металлическая и водородная химические связи
Металлическая связьэто тип связи в металлах и их сплавах между атомами или ионами металлов и относительно свободными электронами (электронным газом) в кристаллической решетке.
Металлы – это химические элементы с низкой электроотрицательностью, поэтому они легко отдают свои валентные электроны. Если рядом с элементом металлом находится неметалл, то электроны от атома металла переходят к неметаллу. Такой тип связи называется ионный (рис. 1).

Рис. 1. Образование ионной связи
В случае простых веществ металлов или их сплавов, ситуация меняется.
При образовании молекул электронные орбитали металлов не остаются неизменными. Они взаимодействуют между собой, образуя новую молекулярную орбиталь. В зависимости от состава и строения соединения, молекулярные орбитали могут быть как близки к совокупности атомных орбиталей, так и значительно от них отличаться. При взаимодействии электронных орбиталей атомов металла образуются молекулярные орбитали. Такие, что валентные электроны атома металла, могут свободно перемещаться по этим молекулярным орбиталям. Не происходит полное разделение, заряда, т. е.
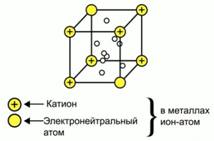
Рис. 2
Сущность образования металлической связи состоит в следующем: атомы металлов отдают наружные электроны, и некоторые из них превращаются в положительно заряженные ионы. Оторвавшиеся от атомов электроны относительно свободно перемещаются между возникшими положительными ионами металлов. Между этими частицами возникает металлическая связь, т. е. электроны как бы цементируют положительные ионы в металлической решетке (рис. 2).
Наличие металлической связи обуславливает физические свойства металлов:
· Высокая пластичность
· Тепло и электропроводность
· Металлический блеск
Пластичность – это способность материала легко деформироваться под действием механической нагрузки. Металлическая связь реализуется между всеми атомами металла одновременно, поэтому при механическом воздействии на металл не разрываются конкретные связи, а только меняется положение атома. Атомы металла, не связанные жесткими связями между собой, могут как бы скользить по слою электронного газа, как это происходит при скольжении одного стекла по другому с прослойкой воды между ними. Благодаря этому металлы можно легко деформировать или раскатывать в тонкую фольгу. Наиболее пластичные металлы – чистое золото, серебро и медь. Все эти металлы встречаются в природе в самородном виде в той или иной степени чистоты. Рис. 3.

Рис. 3. Металлы, встречающиеся в природе в самородном виде
Из них, особенно из золота, изготавливаются различные украшения. Благодаря своей удивительной пластичности, золото применяется при отделке дворцов. Из него можно раскатать фольгу толщиной всего 3.10-3 мм. Она называется сусальное золото, наносится на гипсовые, лепные украшения или другие предметы.
Тепло- и электропроводность. Лучше всего электрический ток проводят медь, серебро, золото и алюминий. Но так как золото и серебро – дорогие металлы, то для изготовления кабелей используются более дешевые медь и алюминий. Самыми плохими электрическими проводниками являются марганец, свинец, ртуть и вольфрам. У вольфрама электрическое сопротивление столь велико, что при прохождении электрического тока он начинает светиться. Это свойство используется при изготовлении ламп накаливания.
Температура тела – это мера энергии составляющих его атомов или молекул. Электронный газ металла может довольно быстро передавать избыточную энергию с одного иона или атома к другому. Температура металла быстро выравнивается по всему объёму, даже если нагревание идет с одной стороны. Это наблюдается, например, если опустить металлическую ложку в чай.
Металлический блеск. Блеск – это способность тела отражать световые лучи. Высокой световой отражательной способностью обладают серебро, алюминий и палладий. Поэтому именно эти металлы наносят тонким слоем на поверхность стекла при изготовлении фар, прожекторов и зеркал.
Водородная связь
Рассмотрим температуры кипения и плавления водородных соединений халькогенов: кислорода, серы, селена и теллура. Рис. 4.
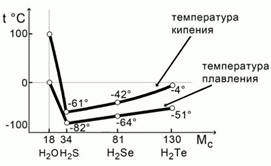
Рис. 4
Если мысленно экстраполировать прямые температур кипения и плавления водородных соединений серы, селена и теллура, то мы увидим, что температура плавления воды должна примерно составлять -1000С, а кипения – примерно -800С. Происходит это потому, что между молекулами воды существует взаимодействие – водородная связь, которая объединяет молекулы воды в ассоциацию. Для разрушения этих ассоциатов требуется дополнительная энергия.
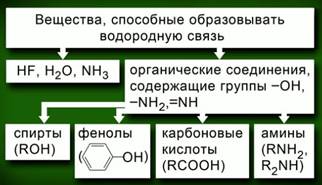
Рис. 5
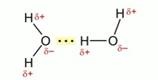
Рассмотрим образование водородных связей между молекулами воды. Водородная связь изображается тремя точками. Возникновение водородной связи обусловлено уникальной особенностью атома водорода. Т. к. атом водорода содержит только один электрон, то при оттягивании общей электронной пары другим атомом, оголяется ядро атома водорода, положительный заряд которого действует на электроотрицательные элементы в молекулах веществ.
Сравним свойства этилового спирта и диметилового эфира. Исходя из строения этих веществ, следует, что этиловый спирт может образовывать межмолекулярные водородные связи. Это обусловлено наличием гидроксогруппы. Диметиловый эфир межмолекулярных водородных связей образовывать не может.
Сопоставим их свойства в таблице 1.
|
Вещество |
Т кип. |
Т пл. |
Растворимость в воде |
|
Этиловый спирт |
+78,150С |
-114,150С |
В любых пропорциях |
|
Диметиловый эфир |
-29,90С |
-138,50С |
Ограничена |
Табл. 1
Т кип., Т пл, растворимость в воде выше у этилового спирта. Это общая закономерность для веществ, между молекулами которых образуется водородная связь. Эти вещества характеризуются более высокой Т кип.,Т пл, растворимостью в воде и более низкой летучестью.
Физические свойства соединений зависят также и от молекулярной массы вещества. Поэтому проводить сравнение физических свойств веществ с водородными связями, правомерно только для веществ с близкими молекулярными массами.
Энергия одной водородной связи примерно в 10 раз меньше энергии ковалентной связи. Если в органических молекулах сложного состава имеется несколько функциональных групп, способных к образованию водородной связи, то в них могут образовываться внутримолекулярные водородные связи (белки, ДНК, аминокислоты, ортонитрофенол и др.). За счет водородной связи образуется вторичная структура белков, двойная спираль ДНК.
Ван-дер-Ваальсовая связь.
Вспомним благородные газы. Соединения гелия до сих пор не получены. Он не способен образовывать обычные химические связи.
При сильно отрицательных температурах можно получить жидкий и даже твердый гелий. В жидком состоянии атомы гелия удерживаются при помощи сил электростатического притяжения. Существует три варианта этих сил:
· ориентационные силы. Это взаимодействие между двумя диполями (НСl)
· индукционное притяжение. Это притяжение диполя и неполярной молекулы.
· дисперсионное притяжение. Это взаимодействие между двумя неполярными молекулами (He). Возникает за счет неравномерности движения электронов вокруг ядра.
Подведение итога урока
На уроке рассмотрены три типа химической связи: металлическая, водородная и Ван-дер-Ваальсовая. Объяснялась зависимость физических и химических свойств от разных типов химических связей в веществе.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Internerurok.ru (Источник).
2. Hemi.nsu.ru (Источник).
3. Chemport.ru (Источник).
4. Химик (Источник).
Домашнее задание
1. №№2, 4, 6 (с. 41) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Почему для изготовления волосков ламп накаливания используют вольфрам?
3. Чем объясняется отсутствие водородной связи в молекулах альдегидов?
2.1.3. Водородная связь.
Структуру водородной связи мы с вами разберём на примере взаимодействия молекул воды между собой.
Молекула воды является диполем. Это объясняется тем, что атом водорода, связанный с более электроотрицательным элементом кислородом, имеющим неподелённую электронную пару, испытывает недостаток электронов и поэтому способен взаимодействовать с атомом кислорода другой молекулы воды.
В результате этого взаимодействия возникает водородная связь (Рис. 2.1):
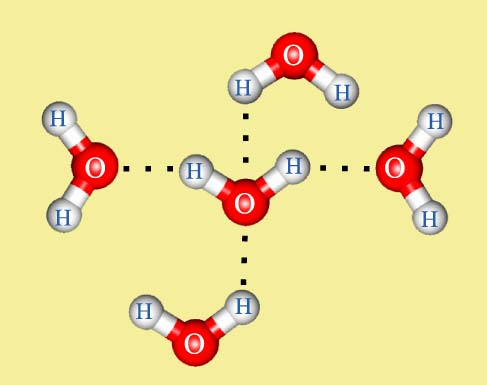
2.1. Механизм образования водородной связи между молекулами воды
Это объясняется тем, что атом водорода, связанный с более электроотрицательным элементом, имеющим неподелённую электронную пару (азотом, кислородом, фтором и др.), испытывает недостаток электронов и поэтому способен взаимодействовать с неподелённой парой электронов другого электроотрицательного атома этой же или другой молекулы.
В результате также возникает водородная связь, которая графически обозначается тремя точками (Рис. ):
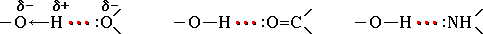
Рис. 2.2. Механизм образования водородной связи между протоном (Н.δ+) и более электроотрицательными атомами серы(:Sδ—), кислорода (:Oδ—) и азота (:Nδ—)
Эта связь значительно слабее других химических связей (энергия ее образования 10-40 кДж/моль), и, в основном, определяется электростатическим и донорно-акцепторным взаимодействиями.
Водородная связь может быть как внутримолекулярной, так и межмолекулярной.
2.1.4. Гидрофобные взаимодействия
Прежде, чем рассматривать природу гидрофобного взаимодействия, необходимо ввести понятие «гидрофильных» и «гидрофобных» функциональных групп.
Группы, которые могут образовывать водородные связи с молекулами воды, называются гидрофильными.
К этим группам относятся полярные группы: аминогруппа (-NH2), карбоксильная (—COOH), карбонильная группы (—CHO) и сульфгидрильная группа (—SH).
Как правило, гидрофильные соединения хорошо растворимы в воде. !!! Это обусловлено тем, что полярные группы способны образовывать водородные связи с молекулами воды.
Появление таких связей сопровождается выделением энергии, поэтому и возникает тенденция к максимальному увеличению поверхности контакта заряженных групп и воды (Рис. 2.3):

Рис. 2.3. Механизм образования гидрофобных и гидрофильных взаимодействий
Молекулы или части молекул, неспособные образовывать водородные связи с водой называются гидрофобными группами.
К этим группам относятся алкильные и ароматические радикалы, которые неполярны и не несут электрического заряда.
Гидрофобные группы – плохо или вовсе не растворимы в воде.
Это объясняется тем, что атомы и группы атомов, входящие в состав гидрофобных групп, являются электронейтральными и (поэтому) не могут образовывать водородных связей с водой.
!!! Гидрофобные взаимодействия возникают в результате контакта между неполярными радикалами, неспособными разорвать водородные связи между молекулами воды.
В результате этого молекулы воды вытесняются на поверхность гидрофильных молекул (Рис. 2.3).
2.1.5. Ван-дер-ваальсовы взаимодействия.
В молекулах существуют также весьма слабые и короткодействующие силы притяжения между электрически нейтральными атомами и функциональными группами.
Это так называемые ван-дер-ваальсовые взаимодействия.
Они обусловлены электростатическим взаимодействием между отрицательно заряженными электронами одного атома и положительно заряженным ядром другого атома.
Так как ядра атомов экранированы окружающими их собственными электронами от ядер соседних атомов, то возникающие между различными атомами ван-дер-ваальсовы взаимодействия весьма невелики.
Все эти типы взаимодействий принимают участие в формировании, поддержании и стабилизации пространственной структуры (конформации) белковых молекул (Рис. 2.4):
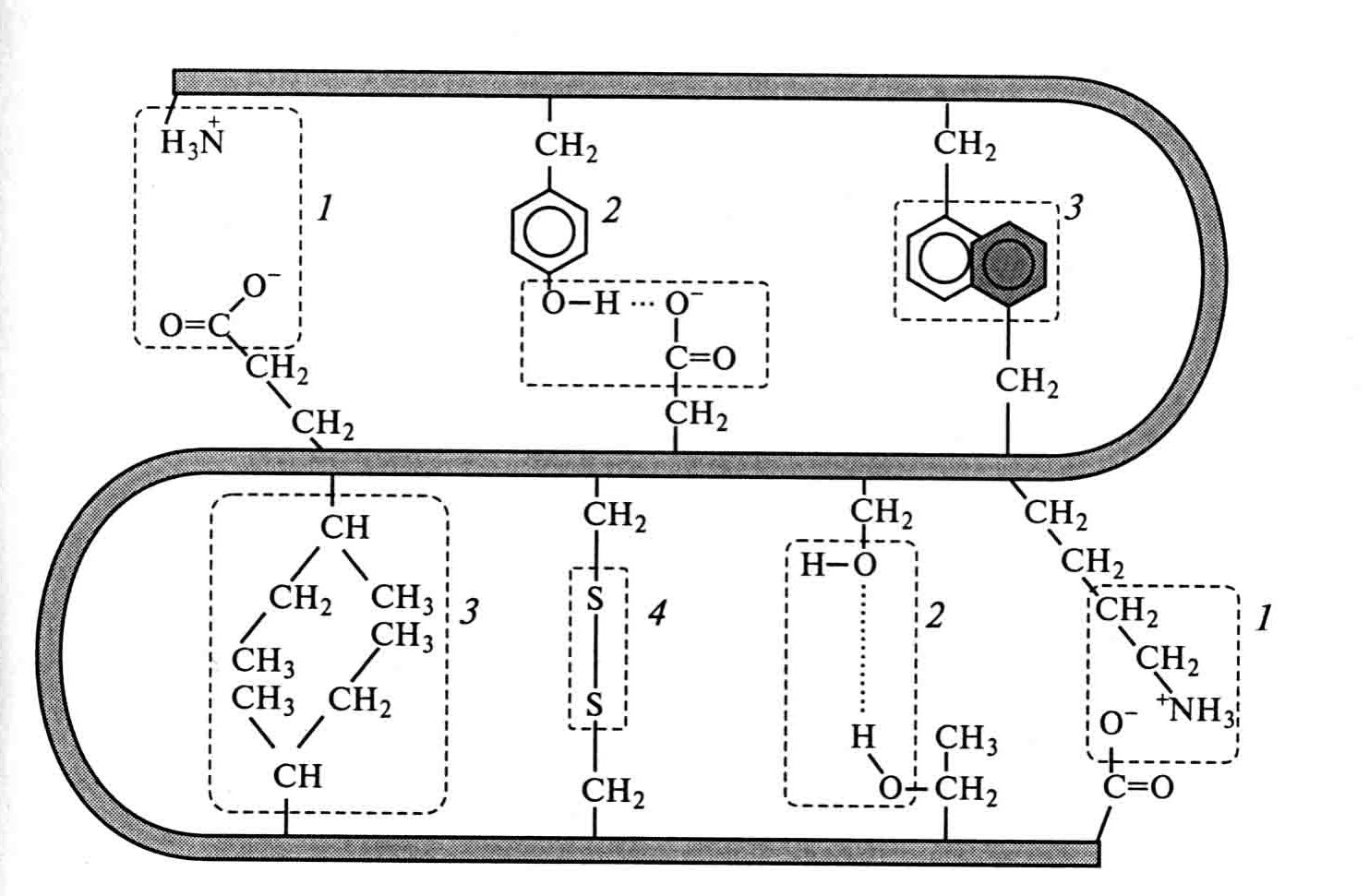
Рис. 2.4. Механизм образования ковалентных связей и слабых нековалентных взаимодействий: 1 — электро-статические взаимодействия; 2 – водородные связи; 3 – гидрофобные взаимодействия, 4 – дисульфидные связи
Силы, которые способствуют формированию пространственной структуры белков и удерживающие её в стабильном состоянии, являются очень слабыми силами. Энергия этих сил на 2-3 порядка меньше энергии ковалентных связей. Они действуют между отдельными атомами и группами атомов.
Однако, огромное число атомов в молекулах биополимеров (белков), приводит к тому, что суммарная энергия этих слабых взаимодействий становится сравнима с энергией ковалентных связей.
механизм образования ее между молекулами, примеры
 Гидрогенная связь — образовывается между «+» заряженными атомами водорода и «-» заряженными атомами других молекул.
Гидрогенная связь — образовывается между «+» заряженными атомами водорода и «-» заряженными атомами других молекул.
Очень часто эта взаимосвязь возникает и существует из-за взаимодействия атома водорода с такими атомами: оксиген (О), нитроген (N). Это происходит вследствие того, что данные элементы имеют небольшой удельный вес и характеризуются высокой электроотрицательностью. Элементы, которые имеют больший удельный вес — сера S или хлор Cl—связываются с водородом менее прочно, хотя их электроотрицательность сравнима с нитрогеном.
…
Вконтакте
Google+
Мой мир
Типы гидрогенной связи
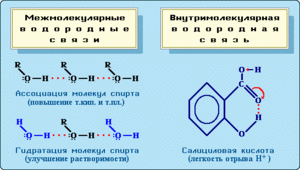
- Межмолекулярная водородная — возникает между двумя элементами, пример: метиловый спирт.
- Водородная (гидрогенная) внутримолекулярная — образуется внутри элемента, пример: 2-нитрофенол.
Это интересно: механизм образования металлической химической связи, примеры.
Межмолекулярная гидрогенная связь

 Совместная электронная пара смещается от атома водорода к отрицательно заряженному атому. При этом водород входит в комплекс с неразделенной электронной парой другого атома или иона.
Совместная электронная пара смещается от атома водорода к отрицательно заряженному атому. При этом водород входит в комплекс с неразделенной электронной парой другого атома или иона.Н-связь графически изображают в виде точек, тем самым показывая, что она слабее ковалентной (примерно в 10−15 раз).
Молекулы воды (две) и молекулы уксусной кислоты (две)
Внутримолекулярная гидрогенная взаимосвязь. Ей свойственно находиться в таких структурах, как многоатомные спирты, углеводы, белки.
Это интересно: типы кристаллических решеток — таблица различных материалов.
Молекула салициловой кислоты
Химические взаимодействия делятся на слабые и сильные. Их отличие состоит в том, что при разрыве они выделяют разную энергию и у них различные по длине (расстояние между атомами):
1. Слабые. Содержание энергии — 15−25 кдж/моль, длина равна 30.
2. Сильные. Энергия — 300 кдж/моль, длина 22−23.
Для образования Н-св. характерно два типа отдачи ионов — электростатический и донорно — акцепторный. Интересно то, что донором выступает более сильный элемент (F, O, N), а акцептором — атом водорода.
Это интересно: как определить валентность по таблице Менделеева?
Механизм образования водородной связи
Хорошо разбирать механизм образования водородной связи на примере её между молекулами воды. Н-св. на рисунках обозначается 3 точками. Атом гидрогена имеет всего лишь один электрон, который при взаимодействии с атомом большей электроотрицательности может условно оголять ядро, что, в свою очередь, образует дополнительную взаимосвязь с другим атомом. Это и есть водородная связь.
Вода — это вещество, между молекулами которого образуются водородные связи.


Кластеры из нескольких молекул воды
Благодаря водородным взаимосвязям молекулы воды взаимодействуют друг с другом, что приводит к образованию кластеров или комплексов воды. Одним из ярких примеров является димер воды.
Н-св. считаются довольно слабыми и неустойчивыми: считается, что они легко возникают, но и также легко разрушаются. Для водородных связей характерен симптом тепловой флюктуации. Вода представляет собой сеть из молекул, связанных водородными связями.
Аномальные свойства, обеспеченные водородной взаимосвязью
 Молекула воды состоит из трёх молекул и содержит 4 Н-св. Здесь присутствуют 2 атома водорода , а кислород, имея две неподеленные электронные пары, связывается с атомами Н ближайших молекул Н2О.
Молекула воды состоит из трёх молекул и содержит 4 Н-св. Здесь присутствуют 2 атома водорода , а кислород, имея две неподеленные электронные пары, связывается с атомами Н ближайших молекул Н2О.Н-св. обеспечивают высокие температуры кипения и плавления. Без них эти показатели были бы намного меньше.
Н-св. в молекулах воды обладают достаточной силой и препятствуют её плавлению и испарению.
А также они обеспечивают ещё одно свойство Н2О, которое характеризуется тем, что при плавлении воды её плотность повышается.
Наибольшее значение имеет плотность воды (1,00 г/мл) при температуре 4 градуса Цельсия. Эта температура характерна для зимнего времени и находится на дне пресных водоёмов, там же и находится вода с максимальной плотностью.
Как изменяются свойства веществ в зависимости от водородной связи
Наиболее достоверным признаком наличия в веществе межмолекулярной Н-св. является показатель кипения вещества. Одна из высоких температур кипения у воды (100 oC так как для того чтобы разрушить межмолекулярные связи в h3O нужно затратить больше энергии). Н-св. сильно может влиять на физические и химические свойства вещества. Межмолекулярная связь обеспечивает повышение температуры плавления и кипения различных веществ. Вещества, которые содержат ОН-группы —моносахариды, дисахариды, как правило, обладают отличной гидрофильностью.
Взаимодействие между молекулами воды — Справочник химика 21
Механизм мицеллообразования в принципе родствен механизму адсорбции ПАВ силы взаимодействия между молекулами воды больше, чем между молекулами воды н ПАВ молекулы ПАВ выталкиваются из воды вначале в поверхностный слой, где они адсорбируются и ориентируются (в соответствии to своей дифильной 13 187 [c.187]При растворении в воде органических веществ, молекулы которых имеют неполярную часть—углеводородный радикал и полярную часть—группу ОН (спирты), СООН (кислоты), NHj (амн-ны) и т. п. (т. е. веществ, дающих водные растворы с положительными отклонениями от закона Рауля), взаимодействие между молекулами воды в объеме раствора больше взаимодействий между молекулами воды и молекулами (в целом) этих веществ, поэтому эти вещества будут преимущественно выталкиваться из объема раствора на поверхность, т. е. их адсорбция Г2>0. Вследствие накопления на поверхности этих веществ, молекулярное взаимодействие в поверхностном слое уменьшается и поверхностное натяжение о с ростом концентрации падает. [c.471]
На рис. 7.1 для рассмотренных в табл. 7.1 моделей показано распределение вероятности встретить заданное число К ближайших соседей для выделенной молекулы воды. Как видно, эти модели правильно отражают анизотропный характер взаимодействия между молекулами воды максимум распределений находится при 7С=4, в соответствии с числом направлений, по которым может образоваться водородная связь. [c.121]
Нами было предпринято моделирование кластеров (НгО) (п = 2- 20) с помощью одного из наиболее распространенных методов численного эксперимента — метода Монте-Карло. При этом использовалась стандартная процедура Метрополиса и др. [393]. Конкретный вариант этой процедуры описан в других наших публикациях [386, 394—396]. Расчеты проводили с помощью потенциалов, характеризующих взаимодействие между молекулами воды потенциалов (1), ([394], см. также [386]) и потенциалов (2), описанных в работе [397]. В первом случае молекулы воды представлены системой четырех точечных зарядов 0,195 е (е — заряд электрона), расположенных в верши- [c.137]
При этом предполагается, что процесс проникновения влаги в полимер не осложнен сильным взаимодействием между молекулами воды и функциональными группами в полимере, а сорбционное равновесие устанавливается достаточно быстро. [c.26]
Механизм мицеллообразования в принципе родственен механизму адсорбции ПАВ силы взаимодействия между молекулами воды больше, чем между молекулами воды и ПАВ. Молекулы пав выталкиваются из воды вначале в поверхностный слой, где они адсорбируются и ориентируются ( в соответствии со своей дифильной природой) углеводородными цепями в неполярную среду. Затем при [c.74]
В табл. 3 приведены системы, для которых соотношение (20.14) выполняется с достаточно высокой точностью. Однако если энергии связи молекул растворителя с поверхностями двух металлов существенно различаются, то нарушается приближенное соотношение Д1л Д2 и экспериментальные данные уже не согласуются с уравнением (20.14). Так, например, галлий является значительно более гидрофильным металлом, нежели ртуть, а потому для этих двух металлов расхождение между Д о и составляет 0,2—0,3 В. Еще более существенным оказывается взаимодействие между молекулами воды и поверхностью железного электрода. В результате этого для пары металлов Hg—Ре разность достигает около 0,7 В. [c.100]
Самойлов считает, что, хотя полная энергия взаимодействия иона с молекулами воды очень велика и заметно больше энергии взаимодействия между молекулами воды, процесс обмена с ближайшими молекулами воды никак не связан с энергией удаления молекул воды из сольватной оболочки. [c.149]
Кроме того, имеет место еще один эффект С/д п — изменение энергии ири взаимодействии между молекулами воды слоя сольватного комплекса и окружающей водой. Это — сложный эффект, состоящий из трех слагаемых электростатического взаимодействия диполей, взаимной поляризации диполей и дисперсионного взаимодействия между ними. Приближенно он определяется выражением [c.177]
Соли, молекулы кислот и оснований в водном растворе диссоциируют (распадаются) на положительно и отрицательно заряженные частицы — ионы. Положительные ионы называются катионами, а отрицательные — анионами. Распад молекул на ионы объясняется электростатическим взаимодействием между молекулами воды и молекулами кислот и оснований и солями. [c.129]
Своеобразная картина наблюдается при смешивании неполярной жидкости с полярной (например, бензола с водой). В этом случае взаимодействие между молекулами воды выражено значительно сильнее, чем силы между молекулами воды и бензола. Поэтому последний не гидратируется и в воде практически не растворяется. [c.162]
Вода относится к амфотерным [амфипротным) растворителям, молекулы которых могут как присоединять, так и отдавать протоны. В результате протолитического взаимодействия между молекулами воды появляются ионы ОН- и Н3О+ [c.593]
Было показано, что сильные взаимодействия между молекулами воды обусловлены структурой молекул этого соединения (рис. 27). Расстояние между ядром кислорода и ядрами каждого из двух атомов водорода равно примерно 0,099 нм, а угол между связями Н—О—Н равен примерно 105°. Атом кислорода обладает сильной электроотрицательностью и стремится оттянуть электроны от атомов водорода. Благодаря этому на атоме кислорода возникает частичный отрицательный заряд, в то время как два атома водо- рода приобретают частич- [c.46]
Денатурация может происходить а) при повышении температуры б) при изменении pH среды в) в присутствии окислителей или восстановителей, которые разрушают дисульфидные связи г) при внесении детергентов, нарушающих гидрофобные взаимодействия между молекулами воды и белка д) при добавлении сильных акцепторов водородных связей, например, мочевины, и е) при физических воздействиях (например, под действием ультразвука). [c.412]
В табл. 8.7 суммируются результаты наших численных экспериментов по моделированию кластеров Na(h30) и К (НгО) . Энергия выражена в кДж/моль. Для /-структур координационное число равно среднему числу молекул в сфере радиусом 310 пм для Ыа(НгО)л и 350 пм для К(НгО) . Критерий водородных связей геометрический i oo = 330 пм, / он = 260 пм полн, вв, ви — полная потенциальная энергия кластера и вклады в нее взаимодействий между молекулами воды и ионами со всеми молекулами воды. Все /-структуры получены для температуры 300 К. [c.145]
Одним из основных, но наименее изученных вопросов теории растворов является вопрос о природе сил, обусловливающих взаимодействие между молекулами воды и ионами. Несмотря на многочисленные работы в этом направлении [27, 161, 258—260], проблема является [c.88]
Ни метан, ни четыреххлористый углерод нерастворимы в воде. Сильнополярные молекулы воды связаны друг с другом очень сильными диполь-дипольными вза
Урок 4. Взаимодействие молекул – HIMI4KA
В уроке 4 «Взаимодействие молекул» из курса «Химия для чайников» выясним что из себя представляет межмолекулярное взаимодействие; рассмотрим влияние сил Ван-дер-Ваальса на температуры плавления и кипения; определим роль электроотрицательности в образовании ковалентной полярной и водородной связи. Но нельзя обсуждать взаимодействие молекул, не зная их строения, поэтому не пройдите мимо прошлого урока «Схема образования молекул».


Межмолекулярное взаимодействие
Между молекулами в веществе всегда присутствует некоторое притяжение друг к другу, которое называется межмолекулярным взаимодействием. Притяжение молекул друг к другу не такое сильное, как взаимодействие между атомами в молекуле, и недостаточно для образования химических связей, но достаточно для того, чтобы сделать их слегка «клейкими» друг к другу.
Силы Ван-дер-Ваальса
Силы взаимодействия молекул, вызываемые мгновенными флюктуациями распределения электронов в атомах, называются силами Ван-дер-Ваальса. Заумно прозвучало? Далее все встанет на свои места. Силы Ван-дер-Ваальса являются одним из видов межмолекулярного взаимодействия, но можно считать эти силы взаимодействия молекул основными. Просто запомните, что именно благодаря силам Ван-дер-Ваальса в природе существуют три агрегатных состояния вещества.


Температура плавления и кипения
Возможно вы уже слышали, что температура представляет собой меру энергии теплового движения молекул, т.е. скорость движения и колебаний молекул (и атомов) зависит от температуры. При низких температурах энергия теплового движения молекул очень мала, поэтому молекулы как бы «сонные» и Ван-дер-Ваальсовы силы без труда удерживают их вместе в упорядоченной плотноупакованной кристаллической решетке. Очевидно, что эта ситуация описывает твердое кристаллическое состояние. Если к телу в твердом кристаллическом состоянии подводится тепло, то молекулы «просыпаются» и начинают все сильнее колебаться относительно своих равновесных положений в кристаллической решетке. В том случае, если к кристаллу подведено достаточное количество энергии, молекулы начинают «бодрствовать»: они разрушают кристаллическую решетку и начинают свободно скользить одна вдоль другой, но пока еще соприкасаются друг с другом. Эта ситуация иллюстрирует жидкое состояние, а температура перехода из твердого состояние в жидкое называется температурой плавления вещества. Но молекулы жидкости по-прежнему удерживается силами Ван-дер-Ваальса, хотя уже имеют достаточную энергию, чтобы не оставаться в фиксированном положении. Если к жидкости подводится дополнительная энергия, молекулы превращаются в суперменов и начинают двигаться очень быстро и даже способны преодолевать Ван-дер-Ваальсовы силы притяжения, полностью отдаляясь одна от другой. Это соответствует переходу жидкости в газовую фазу. Молекулы в газе двигаются хаотично (по независимым молекулярным траекториям). Температура кипения вещества – это температура, которая необходима для полного преодоления сил Ван-дер-Ваальса в жидкости.


В таблице, которая расположена ниже, сопоставлены температуры плавления и кипения некоторых веществ, состоящих из простых молекул. Как правило, большим по размеру молекулам соответствуют более высокие температуры плавления и кипения, потому что такие молекулы обладают бОльшей поверхностью, что приводит к большим силам Ван-дер-Ваальса. Вот почему при одном и том же давлении H2 кипит при -252°С, а CH4 при -164°C, а C8H18 следует нагреть до +125,7°C, чтобы его молекулы отделились одна от другой и перешли в газовую фазу.


Ковалентная полярная химическая связь
Помимо Ван-дер-Ваальсовых сил есть и другие силы межмолекулярного взаимодействия, связанные с типом химической связи, а именно с полярностью молекул. Если два атома связаны друг с другом ковалентной связью, но один из них притягивает к себе электронную пару сильнее, чем другой атом, то электронная пара смещается в сторону более «сильного» атома. На «сильном» атоме возникает некоторый избыток отрицательного заряда, записываемый символом δ— (а не знаком минус, так как это означало бы полный электронный заряд), а на другом появляется небольшой положительный заряд δ+, и подобно разноименным зарядам они начинают притягиваться друг к другу, образуя ковалентную полярную химическую связь.
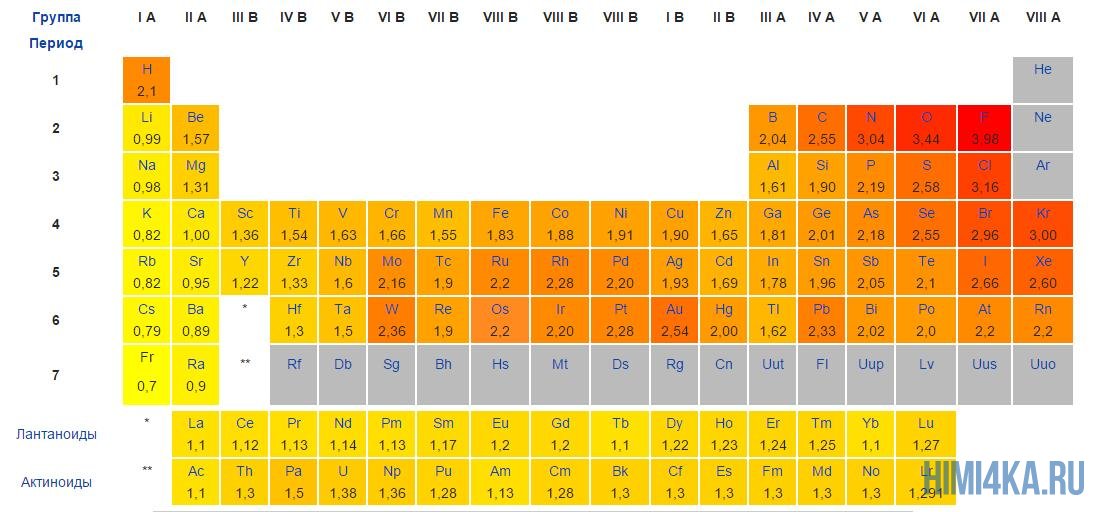
«Силу» атома определяет его электроотрицательность: чем больше электроотрицательность химического элемента, тем сильнее он притягивает к себе электроны.
Приведем примеры молекул, образованных ковалентной полярной связью: CO, H2O, HCl. Из примеров видно что, ковалентная полярная химическая связь, как и неполярная, возникает только между атомами неметаллов и разница в электроотрицательности между ними должна быть более 0.4, но менее 2.0. Если разница в электроотрицательности атомов менее 0.4, то связь между ними считается ковалентной неполярной. Думаю, что теперь у вас сложилось некоторое представление о различиях ковалентной полярной и ковалентной неполярной химической связи.
Постарайтесь запомнить самые электроотрицательные химические элементы в порядке возрастания их электроотрицательности: I, Br, N, Cl, O, F. За помощью вы всегда можете обратиться к таблице электроотрицательности, которая расположена ниже.

Образование водородной связи
Очевидно, что молекулы воды образованы ковалентной полярной химической связью, поскольку электроотрицательность кислорода больше, чем у водорода. Поэтому атом кислорода в молекуле воды несет в себе небольшой отрицательный заряд, а атомы водорода — небольшие положительные заряды.
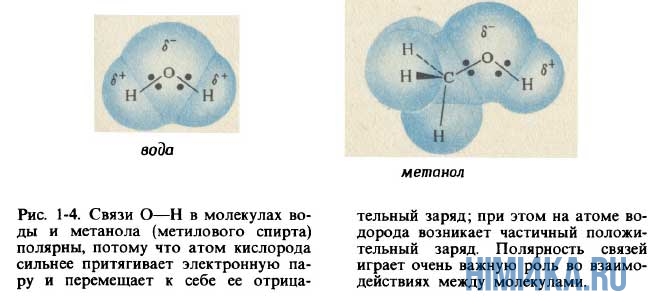

Подобные молекулы называются полярными, поскольку они ведут себя как крошечные электрические диполи; другими словами, отрицательный заряд на атоме кислорода притягивает расположенные поблизости положительные заряды, а положительно заряженные атомы водорода притягивают другие отрицательные заряды. Так возникает еще один тип сил притяжения между молекулами, помимо вандерваальсовых сил притяжения. Вследствие наличия дополнительных сил взаимодействия между полярными молекулами метанола CH3OH (метилового спирта) он плавится и кипит при гораздо более высоких температурах, чем метан CH4, который имеет сходные с метанолом размеры молекул. При комнатной температуре метанол представляет собой жидкость, а метан — газ. В воде силы притяжения между атомами водорода и кислорода, принадлежащими различным молекулам, столь велики, что получили название водородных связей. Водородные связи играют чрезвычайно важную роль в белках и других гигантских молекулах, из которых построены живые организмы. Если бы не полярность молекул воды и наличие между ними водородных связей, вода плавилась бы и кипела при более низких температурах, чем даже сероводород (см. табл. в начале урока). При комнатной температуре она находилась бы в газообразном состоянии, а не в виде наиболее распространенной на Земле жидкости.
Надеюсь урок 4 «Взаимодействие молекул» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.

