Вода и ее роль в жизнедеятельности
Вода и ее роль в жизнедеятельности клетки
Теория:
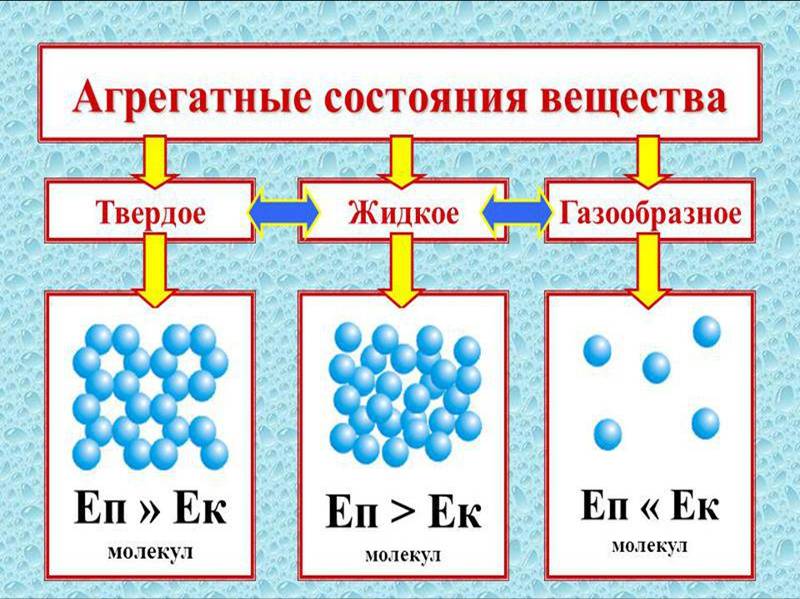
Вода (h3O) — важнейшее неорганическое вещество клетки. В клетке в количественном отношении вода занимает первое место среди других химических соединений. Вода выполняет различные функции: сохранение объема, упругости клетки, участие во всех химических реакциях. Все биохимические реакции происходят в водных растворах. Чем выше интенсивность обмена веществ в той или иной клетке, тем больше в ней содержится воды.
Обрати внимание!
Вода в клетке находится в двух формах: свободной и связанной.
Свободная вода находится в межклеточных пространствах, сосудах, вакуолях, полостях органов. Она служит для переноса веществ из окружающей среды в клетку и наоборот.
Связанная вода входит в состав некоторых клеточных структур, находясь между молекулами белка, мембранами, волокнами и соединена с некоторыми белками.
Вода обладает рядом свойств, имеющих исключительно важное значение для живых организмов.
Структура молекулы воды
Уникальные свойства воды определяются структурой ее молекулы.
Между отдельными молекулами воды образуются водородные связи, определяющие физические и химические свойства воды.
Характерное расположение электронов в молекуле воды придает ей электрическую асимметрию. Более электроотрицательный атом кислорода притягивает электроны атомов водорода сильнее, в результате молекула воды является диполем (обладает полярностью). Каждый из двух атомов водорода обладает частично положительным зарядом, а атом кислорода несет частично отрицательный заряд.
Частично отрицательный заряд атома кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул. Таким образом, каждая молекула воды стремится связаться водородной связью с четырьмя соседними молекулами воды.
Свойства воды
Так как молекулы воды полярны, то вода обладает свойством растворять полярные молекулы других веществ.
Вещества, растворимые в воде, называются гидрофильными (соли, сахара, простые спирты, аминокислоты, неорганические кислоты). Когда вещество переходит в раствор, его молекулы или ионы могут двигаться более свободно и, следовательно, реакционная способность вещества возрастает.
Вещества, нерастворимые в воде называются гидрофобными (жиры, нуклеиновые кислоты, некоторые белки). Такие вещества могут образовывать с водой поверхности раздела, на которых протекают многие химические реакции. Следовательно, тот факт, что вода не растворяет некоторые вещества, для живых организмов также очень важен.
Вода обладает высокой удельной теплоёмкостью, т.е. способностью поглощать тепловую энергию при минимальном повышении собственной температуры. Чтобы разорвать многочисленные водородные связи, имеющиеся между молекулами воды, требуется поглотить большое количество энергии. Это свойство воды обеспечивает поддержание теплового баланса в организме. Большая теплоёмкость воды защищает ткани организма от быстрого и сильного повышения температуры.
Для испарения воды необходима достаточно большая энергия. Использование значительного количества энергии на разрыв водородных связей при испарении способствует его охлаждению. Это свойство воды предохраняет организм от перегрева.
Пример:
Примерами этого могут являться транспирация у растений и потоотделение у животных.
Вода обладает также высокой теплопроводностью, обеспечивая равномерное распределение тепла по всему организму.
Обрати внимание!
Высокая удельная теплоемкость и высокая теплопроводность делает воду идеальной жидкостью для поддержания теплового равновесия клетки и организма.
Вода практически не сжимается, создавая тургорное давление, определяя объем и упругость клеток и тканей.
Пример:
Гидростатический скелет поддерживает форму у круглых червей, медуз и других организмов.
Благодаря силам сцепления молекул на поверхности воды создается плёнка, обладающая такой характеристикой, как поверхностное натяжение.
Пример:
Благодаря силе поверхностного натяжения происходит капиллярный кровоток, восходящий и нисходящий токи растворов в растениях.
К числу важных в физиологическом отношении свойств воды относится её способность растворять газы (O2, CO2 и др.).
Вода является также источником кислорода и водорода, выделяемых при фотолизе в световую фазу фотосинтеза.
Биологические функции воды
Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма. В природе вода переносит продукты жизнедеятельности в почвы и к водоемам.
Вода — активный участник реакций обмена веществ.
Вода участвует в образовании смазывающих жидкостей и слизей, секретов и соков в организме (эти жидкости находятся в суставах позвоночных животных, в плевральной полости, в околосердечной сумке).
Вода входит в состав слизей, которые облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей.
 Водную основу имеют и секреты, выделяемые некоторыми железами и органами: слюна, слёзы, желчь, сперма и т.д.
Водную основу имеют и секреты, выделяемые некоторыми железами и органами: слюна, слёзы, желчь, сперма и т.д.
Структура и уникальные свойства воды – AllinWeb
Одно из самых распространенных веществ на Земле — вода. Вода покрывает большую часть поверхности нашей планеты, из нее в основном состоят почти все живые существа. Свойства воды настолько важны для живых организмов, что известная нам форма жизни без нее вообще невозможна (рис. 7.9). Уникальные свойства воды объясняются структурой ее молекул: атом кислорода связан ковалентно с двумя атомами водорода, молекула изогнута под углом, в вершине которого и находится кислород. Из-за того, что кислород притягивает электроны сильнее, чем водород, молекула воды всегда полярна: кислород частично заряжен отрицательно, водород — положительно, поэтому молекула воды удерживается водородными связями. Когда вода находится в жидкой фазе, эти слабые связи легко рвутся и разрушаются при столкно-
вениях молекул, тем не менее водородные связи играют большую роль, обеспечивая особое значение воды для жизни (рис. 7.10).
7.10).
Тепловые свойства воды уникальны для обеспечения жизни. Испарение требует значительной траты энергии, так как температура кипения воды достаточно высока. Скрытая теплота испарения (количество теплоты, необходимой для превращения воды в пар или преодоления сил молекулярного сцепления в воде, обусловленных водородными связями) необычайно велика относительно других веществ. Ее приходится брать из среды, и испарение воды сопровождается охлаждением.
Пример — потоотделение у животных или тепловая одышка у млекопитающих или рептилий (сидят на солнцепеке с разинутым ртом). Относительно большая энергия требуется воде и при плавлении (таянии льда). И наоборот, при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания и клеток, и их окружения. Кристаллизация воды в клетках губительна для жизни, и большая теплота плавления обеспечивает стабильность внешних условий, т.е. жизнедеятельности.
Плотность воды в жидком состоянии больше, чем в твердом, и лед не тонет в ней. Кроме воды таким свойством обладают лишь висмут и чугун. Так как плотность воды при температуре от 4 до 0 °С понижается, лед образуется сначала у поверхности воды и
Кроме воды таким свойством обладают лишь висмут и чугун. Так как плотность воды при температуре от 4 до 0 °С понижается, лед образуется сначала у поверхности воды и
только под конец — около дна. Это обеспечивает сохранение жизни в водоемах: лед покрывает толщу воды, как одеяло, и тает быстрее, находясь на поверхности. Слои воды при температуре, меньшей 4°С, поднимаются вверх, перемешиваются и переносят питательные вещества по всей толще, что позволяет распространяться живому на больших диапазонах глубин. Высокая теплопроводность воды, достаточно высокие температуры кипения и замерзания, понижение температуры тел при испа-
рении воды с их поверхности — все это важно для стабильности условий жизни. Даже тот факт, что плотность воды максимальна при температуре 4 °С, что несколько выше точки ее замерзания (т.е. при охлаждении от 4 до О °С вода расширяется), и лед легче жидкой воды, играет важную роль — предотвращает образование кристаллов в клетках и не повреждает ткани. Низкая плотность льда спасает водных животных — лед плавает на поверхности и не допускает холодный воздух вглубь, где находятся живые организмы. Поэтому вода является вместе с растворенными в ней солями необходимой средой для химических процессов, составляющих жизнь.
Поэтому вода является вместе с растворенными в ней солями необходимой средой для химических процессов, составляющих жизнь.
Из-за большой теплоемкости воды требуется большое количество энергии даже для небольшого повышения ее температуры. Объясняется это тем, что энергия расходуется на разрыв водородных связей, обеспечивающих ее «клейкость». Поэтому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью. Вода служит стабильной средой обитания для многих клеток и организмов, обеспечивая значительное постоянство внешних условий.
Она обладает большим поверхностным натяжением, поскольку ее молекулы слипаются друг с другом (когезия) посредством водородных связей. Полярные молекулы притягиваются любой поверхностью, несущей электрический заряд, отсюда ее способность подниматься по тонкой трубке или порам, называемая капиллярностью (адгезия). Кроме того, у воды самое большое поверхностное натяжение по сравнению с другими жидкостями — сильное сцепление между молекулами. Многие мелкие организмы поэтому могут скользить по водяной поверхности. Это уникальное свойство играет важную роль в живых клетках и при движении воды по сосудам ксилемы у растений.
Многие мелкие организмы поэтому могут скользить по водяной поверхности. Это уникальное свойство играет важную роль в живых клетках и при движении воды по сосудам ксилемы у растений.
Вода — активный участник процессов метаболизма. При фотосинтезе она — источник водорода, участвует в реакциях гидролиза. Вода — наиболее важный по объему компонент тканей животных и растений: она является средой, в которой происходят все биохимические реакции, и одновременно их участником. Было установлено, что фазовые переходы в воде могут управлять скоростью протекания биохимических реакций. После открытия По-лингом (1961) взаимосвязи между явлением наркоза и кристаллизацией гидратов наркотических веществ прояснилась роль перестроек связанной воды в явлениях наркоза, а в последнее время — и в возникновении важнейших свойств гидратированных веществ: глины, гипса, цемента, некоторых типов сегнетоэлектриков.
Вода имеет огромное значение при естественном отборе и видообразовании в живой природе. Все наземные организмы приспособились к добыванию и сбереганию воды, даже в пустынях. Не вызывает сомнения тот факт, что жизнь зародилась на Земле в водной среде.
Все наземные организмы приспособились к добыванию и сбереганию воды, даже в пустынях. Не вызывает сомнения тот факт, что жизнь зародилась на Земле в водной среде.
Примерно из ста химических элементов, встречающихся в земной коре, для жизни необходимы только шестнадцать, причем четыре из них — водород (Н), углерод (С), кислород (О) и азот (N) наиболее распространены в живых организмах и составляют 99 % массы живого. Биологическое значение этих элементов связано с их валентностью (1, 2, 3, 4) и способностью образовывать прочные ковалентные связи, которые оказываются прочнее связей, образуемых другими элементами той же валентности. Следующими по важности являются фосфор (Р), сера (S), ионы натрия, магния, хлора, калия и кальция (Na, Mg, Cl, К, Са). В качестве микроэлементов в живых организмах присутствуют также железо (Fe), кобальт (Со), медь (Си), цинк (Zn), бор (В), алюминий (А1), кремний (Si), ванадий (V), молибден (Мо), иод (I), марганец (Мn).
С точки зрения химии жизнь — это всевозможные превращения разнообразных крупных и сложных молекул, главным элементом которых является углерод. Он важен не с точки зрения распространенности на Земле, в земной коре углерода всего 0,055 %, в то время как кислорода 60,50, кремния 20,45 и даже титана 0,27 %. В атмосфере двуокиси углерода содержится 0,03 %, т. е. углерода всего 0,008 %. Все биологически функциональные вещества (белки, жиры, углеводы, гормоны, витамины), кроме нескольких солей и воды, содержат углерод. Число соединений углерода огромно. Они называются органическими соединениями, поскольку когда-то считалось, что такие молекулы могут образовываться только в живых организмах.
Он важен не с точки зрения распространенности на Земле, в земной коре углерода всего 0,055 %, в то время как кислорода 60,50, кремния 20,45 и даже титана 0,27 %. В атмосфере двуокиси углерода содержится 0,03 %, т. е. углерода всего 0,008 %. Все биологически функциональные вещества (белки, жиры, углеводы, гормоны, витамины), кроме нескольких солей и воды, содержат углерод. Число соединений углерода огромно. Они называются органическими соединениями, поскольку когда-то считалось, что такие молекулы могут образовываться только в живых организмах.
Соединениями углерода занимается органическая химия — одна из важнейших областей химии. Органика разлагается, горит при не очень высокой температуре, при сгорании в воздухе углерод окисляется до СO2. Большинство органических соединений содержат водород, который окисляется до воды. Чистый углерод встречается в природе в виде графита и алмаза. До 1829 г. сторонники витализма считали, что без участия живого нельзя получить органические соединения, только «жизненная сила» способна изготовить уксусную кислоту или спирт. Немецкий химик Ф. Велер доказал ложность этого учения. Он получил мочевину выпариванием раствора цианово-кислого аммония NH4NCO — соли, которую можно изготовить из простых веществ, не связанных с жизнедеятельностью организмов. Этот синтез был первым примером искусственного получения органики.
Немецкий химик Ф. Велер доказал ложность этого учения. Он получил мочевину выпариванием раствора цианово-кислого аммония NH4NCO — соли, которую можно изготовить из простых веществ, не связанных с жизнедеятельностью организмов. Этот синтез был первым примером искусственного получения органики.
Сегодня синтезированы сложнейшие вещества, которых нет в природе. Углерод занимает все большее место в технике: природные и синтетические волокна, природный и синтетический кау-
чук, пластмассы, нефтепродукты, бумага, красители, чугун, медикаменты.
Идею о четырехатомности углерода высказал Купер (1858), его поддержал Кекуле в статье «О строении и превращениях химических соединений и химической природе углерода». У Кекуле формула С6Н6 превратилась в структурную формулу бензола, знаменитое «бензольное кольцо», наглядно отражающее четырехва-лентность углерода. Без этого невозможно было понять строение сложных углеводородов, их соединений и производных. Правда, структурные формулы Кекуле были двухмерными и не могли отразить такое свойство молекул, как изомерия. Бутлеров сформулировал определение понятия химического строения как способа связей в молекуле. С помощью структурной теории развивалась систематика органических соединений. Структурные формулы наглядно отражали связь формулы со свойствами вещества, объяснили изомерию и предсказали свойства неизвестных еще соединений.
Правда, структурные формулы Кекуле были двухмерными и не могли отразить такое свойство молекул, как изомерия. Бутлеров сформулировал определение понятия химического строения как способа связей в молекуле. С помощью структурной теории развивалась систематика органических соединений. Структурные формулы наглядно отражали связь формулы со свойствами вещества, объяснили изомерию и предсказали свойства неизвестных еще соединений.
Атомный номер углерода — 6, ядро содержит 6 протонов и 6 нейтронов, вокруг ядра вращаются 6 электронов, масса атома равна 12. При химических реакциях углерод способен присоединить 4 электрона и образовать устойчивую оболочку из 8 электронов, т. е. имеет валентность, равную четырем, и способен к прочной кова-лентной (присоединением электронов) связи. Например, эмпирическая формула одного из таких прочных соединений, метана, — СН4, а в структурном изображении — это тетраэдр (четыре симметричные связи углерода).
Зная валентность углерода, можно достаточно просто изобразить положение всех недостающих водородных атомов, что позволяет сосредоточить внимание на наиболее важных связях и химических группах. Такие прочные ковалентные связи углерод может образовывать и с атомами других элементов (Н, О, Р, N, S), и с углеродными (С—С-связь). Внутреннее отличие органики от большинства неорганических соединений выражается в том, что химические связи, как правило, в органических соединениях валентные, а ионные связи — очень редки.
Такие прочные ковалентные связи углерод может образовывать и с атомами других элементов (Н, О, Р, N, S), и с углеродными (С—С-связь). Внутреннее отличие органики от большинства неорганических соединений выражается в том, что химические связи, как правило, в органических соединениях валентные, а ионные связи — очень редки.
Уникальным свойством углерода является его способность образовывать стабильные цепи и кольца (рис. 7.11), которые обеспечивают разнообразие органических соединений, и эти связи могут быть кратными.
Октан — это восемь атомов углерода в окружении атомов водорода, образующих цепочку, в которой атомы лежат не на прямой, а зигзагообразно, свободно вращаясь в местах сочленения. Октан и его изомеры, состоящие из того же числа атомов, но имеющие разветвленную структуру из-за боковых углеводородных групп, входят в состав бензина. Маленькая капелька этой жидкости имеет больше молекул, чем Галактика звезд. Некоторые молекулы свернуты в клубок, некоторые вытянуты в
длину, большинство же находятся в промежуточном состоянии.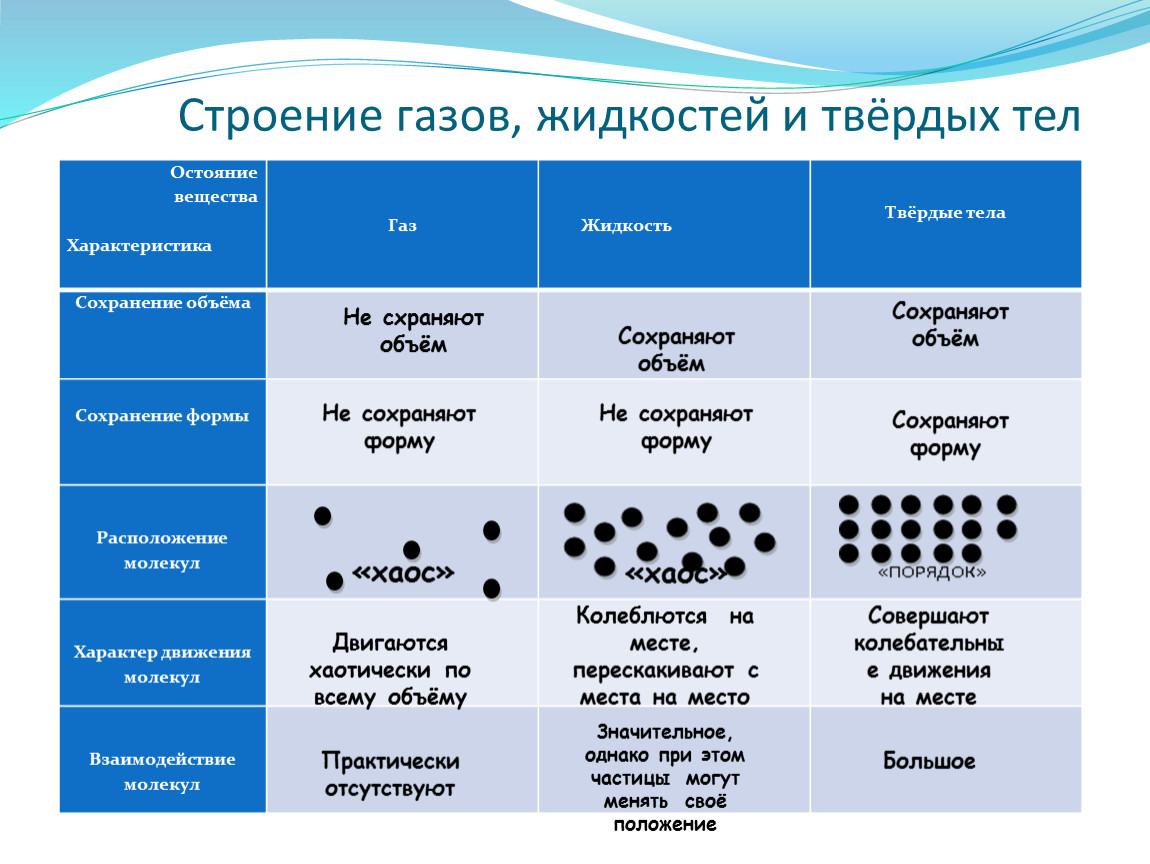 Молекула тринитротолуола симметрична. Ее шесть атомов кислорода готовы к окислению: реакция внутримолекулярного высвобождения энергии происходит мгновенно и начинается от легкого толчка.
Молекула тринитротолуола симметрична. Ее шесть атомов кислорода готовы к окислению: реакция внутримолекулярного высвобождения энергии происходит мгновенно и начинается от легкого толчка.
Разница в строении молекул крахмала (источника энергии) и целлюлозы (строительного материала клеток растений) заключается лишь в небольшом изменении конфигурации водородной связи между мономерными звеньями в цепи. Другой пример: отличие в окраске алых маков от синих васильков связано с отличием одного атома из тридцати, составляющих пигмент окраски. Фиолетовый краситель цианидин, которым особенно богата ежевика, входит в состав обоих цветов. Кислый сок васильков богат ионами водорода, способными в определенном месте присоединяться к молекулам цианидина. Насыщенная водородом молекула активно поглощает красные лучи, отражая синие. У маков щелочная среда практически не содержит свободных катионов водорода, краситель оказывается ненасыщенным, поэтому они поглощают синие лучи, отражая красные. Отличие мужских половых гормонов (тестостеронов) от женских (экстрадиолов) состоит в замене атома кислорода молекулой гидроксильной группы (ОН) и убирании метильной группы (СН3) в одном из нескольких колец, состоящих из десятков атомов молекулы холестерина.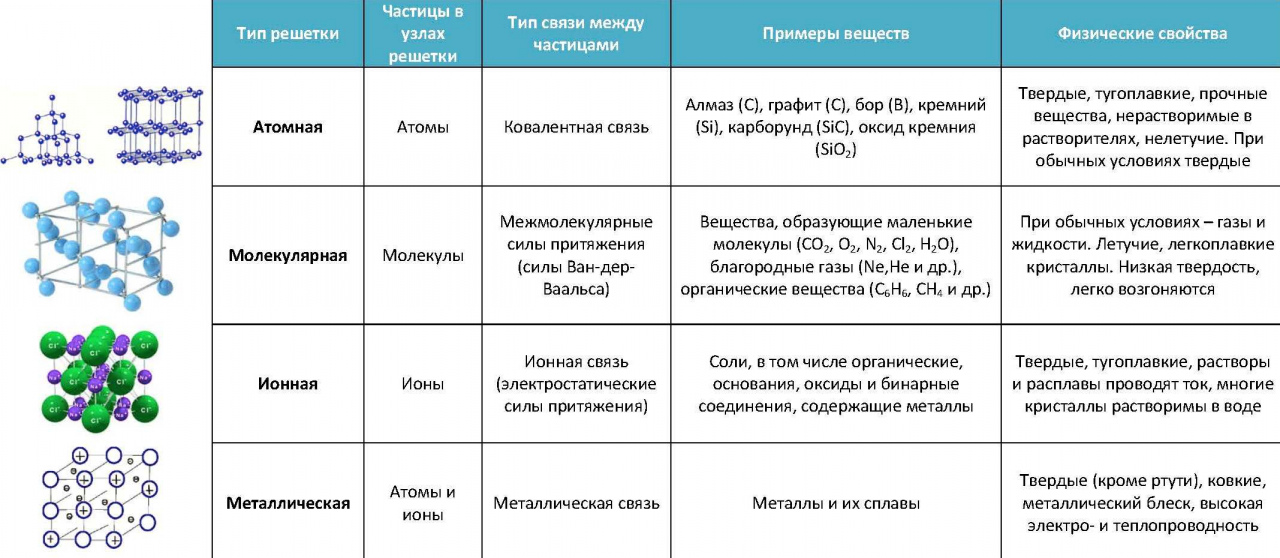
Сравнивая оптические свойства винной и виноградной кислот, Л. Пастер (1848) заметил, что кристаллы двойных солей виноградной кислоты вращают плоскость поляризации на одну и ту же величину, но одни — вправо, а другие — влево. Отсюда он сделал вывод об асимметричном строении кристаллов и о различном
пространственном строении образующих их молекул. После установления строения бензола и создания структурной теории на изомерию обратили особое внимание.
Немецкий химик-органик Й. Вислиценус обнаружил существование двух форм молочной кислоты — оптически активной и неактивной. Он попытался объяснить это явление на основе геометрической изомерии и писал (1875), что это связано, вероятно, с неодинаковым пространственным расположением атомов. Асимметричное расположение атома углерода в это же время отметил и Я. Вант-Гофф, расположив четыре валентности углерода в направлении вершин тетраэдра и поместив атом С в центре. В 1888 г. также немецкий химик-органик В. Мейер назвал такое построение стереохимическим строением и дал тем самым название новой области химии.
В 1890 г. А. Ганч и швейцарский химик-неорганик А Вернер распространили такое изображение на азот, посчитав атом азота находящимся в одной из вершин тетраэдра, а его валентные связи направленными к трем другим вершинам. Впоследствии гипотеза Вернера о координационных соединениях металлов была подтверждена результатами рентгеноструктурного анализа. Явление «обращения» знака оптической активности (можно изменить направление вращения плоскости поляризации заменой одного из атомов (или радикалов) при тетраэдрическом асимметричном атоме углерода) открыл петербургский академик П. Вальден (1896). Так структурная химия перешла от изображения формул на плоскости к их изображению в трехмерном пространстве.
Кратные связи, кроме углерода, могут образовывать фосфор и кислород. Размеры органических молекул определяются углеродным скелетом, а химические свойства — присоединенными к нему элементами и химическими группами, насыщенностью скелета и формой молекул, которая зависит от углов связей. Среди «строительных блоков» — простых органических соединений — крупных молекул можно выделить аминокислоты, из которых синтезированы белки; моносахариды и азотистые основания, синтезирующие нуклеиновые кислоты; жирные кислоты, глицерол и холин, синтезирующие липиды. Таким образом, небольшое число органических молекул дает начало крупным молекулам и структурам живых клеток. Эти немногие виды молекул могли синтезироваться в «первичном бульоне» Мирового океана еще до появления жизни на Земле из простых неорганических молекул — диоксида углерода, азота и воды.
Среди «строительных блоков» — простых органических соединений — крупных молекул можно выделить аминокислоты, из которых синтезированы белки; моносахариды и азотистые основания, синтезирующие нуклеиновые кислоты; жирные кислоты, глицерол и холин, синтезирующие липиды. Таким образом, небольшое число органических молекул дает начало крупным молекулам и структурам живых клеток. Эти немногие виды молекул могли синтезироваться в «первичном бульоне» Мирового океана еще до появления жизни на Земле из простых неорганических молекул — диоксида углерода, азота и воды.
Биохимия, или химия живых организмов, которая сначала развивалась как подспорье медицины, со временем выделилась в отдельную область знания. Она является не только фундаментом физиологии, объясняя работу биосистем, но играет объединяющую роль для всей биологии.
Вопросы для самопроверки и повторения
- Как развивались представления о составе веществ? Какие основные законы определяют состав веществ? Каково значение закона Авогадро?
- Дайте определения понятиям «молекула», «химический элемент», «химическое соединение».
 Как они формировались? Как связываются атомы в молекулы?
Как они формировались? Как связываются атомы в молекулы? - Приведите отличия теоретического уровня познания от эмпирического (на примерах развития учения о составе веществ). Как точность науки связана с наглядностью моделей?
- Что изучает химия, каковы основные этапы ее развития? Дайте основные понятия структурной химии.
- Определите понятие валентности в развитии. Что такое «насыщаемость» связей?
- Опишите виды химических связей, соединяющих атомы в молекулы и молекулы между собой.
- Какие формы записи состава веществ существуют и как в них отражаются свойства веществ?
- С чем связано обилие соединений углерода с точки зрения строения его атома? В каких формах он встречается в природе?
- Что такое зонная теория? Как она объясняет существование проводников, полупроводников и диэлектриков? Что такое электронный газ?
10. Объясните с позиций структуры воды ее уникальные физические
свойства, важные для живой природы.
2.11: Биохимические свойства воды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 30616
- Сюзанна Ваким и Мандип Грюал
- Колледж Бьютт
Голубой мрамор
Его часто называют «водной планетой», и ему дали прозвище «голубой мрамор». Вы, наверное, просто называете это «домом». Почти три четверти нашей родной планеты покрыты водой, и без нее жизнь на Земле, какой мы ее знаем, не могла бы существовать. Вода, как и углерод, играет особую роль в живых существах. Он необходим всем известным формам жизни. Хотя вода состоит из простых молекул, каждая из которых содержит всего три атома, ее структура придает ей уникальные свойства, которые помогают объяснить, почему она жизненно важна для всех живых организмов.
Вы, наверное, просто называете это «домом». Почти три четверти нашей родной планеты покрыты водой, и без нее жизнь на Земле, какой мы ее знаем, не могла бы существовать. Вода, как и углерод, играет особую роль в живых существах. Он необходим всем известным формам жизни. Хотя вода состоит из простых молекул, каждая из которых содержит всего три атома, ее структура придает ей уникальные свойства, которые помогают объяснить, почему она жизненно важна для всех живых организмов.
Химическая структура и свойства воды
Вероятно, вы уже знакомы со многими свойствами воды. Например, вы наверняка знаете, что вода без вкуса, без запаха и прозрачна. В небольших количествах он также бесцветен. Однако, когда наблюдается большое количество воды, например, в озере или океане, она на самом деле светло-голубого цвета. Синий оттенок воды является внутренним свойством и вызван избирательным поглощением и рассеянием белого света. Эти и другие свойства воды зависят от ее химического строения.
Прозрачность воды важна для организмов, живущих в воде. Поскольку вода прозрачна, через нее может проходить солнечный свет. Солнечный свет необходим водным растениям и другим водным организмам для фотосинтеза.
Химическая структура воды
Каждая молекула воды состоит из одного атома кислорода и двух атомов водорода, поэтому она имеет химическую формулу H 2 O. Расположение атомов в молекуле воды показано на рисунке \( \PageIndex{2}\), объясняет многие химические свойства воды. В каждой молекуле воды ядро атома кислорода (с 8 положительно заряженными протонами) притягивает электроны гораздо сильнее, чем ядра водорода (только с одним положительно заряженным протоном). Это приводит к отрицательному электрическому заряду вблизи атома кислорода (из-за «притяжения» отрицательно заряженных электронов к ядру кислорода) и положительному электрическому заряду вблизи атомов водорода. Разница в электрическом заряде между различными частями молекулы называется 9.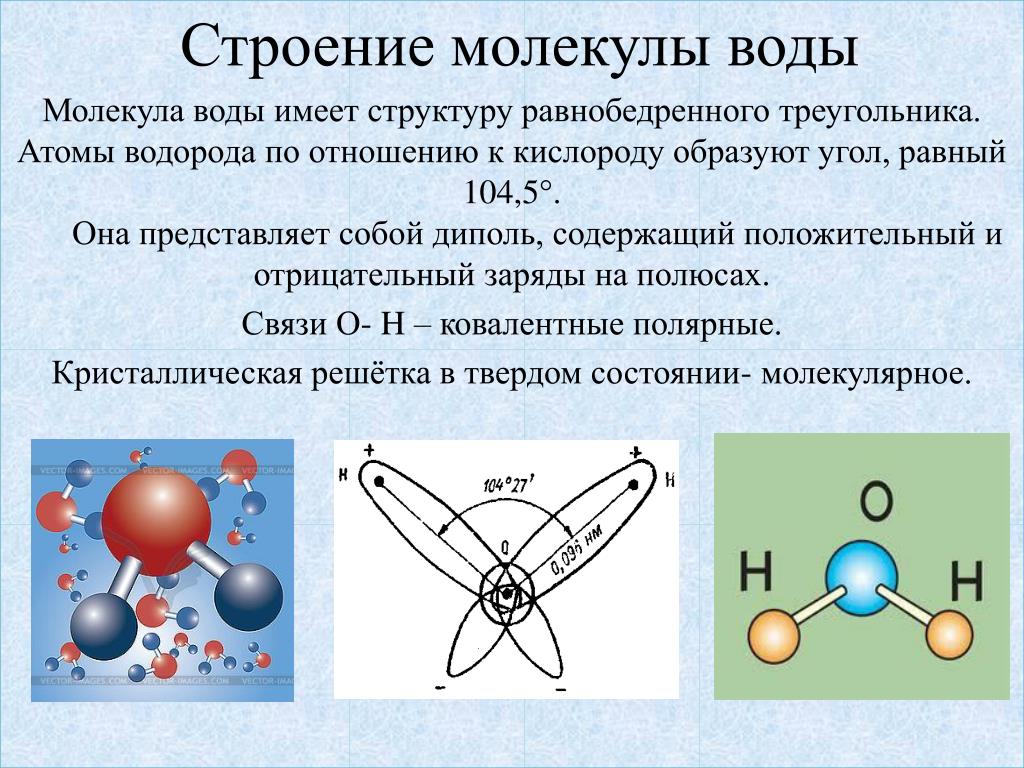
Вода является хорошим растворителем
Вода считается очень хорошим растворителем в биохимических реакциях. На рисунке \(\PageIndex{3}\) показано, как вода растворяет соли. Поваренная соль (NaCl) состоит из положительно заряженного иона натрия и отрицательно заряженного иона хлорида. Кислород воды притягивается к положительному иону Na. Водороды воды притягиваются к отрицательному иону Cl.
Рисунок \(\PageIndex{3}\): На этой диаграмме показаны положительные и отрицательные части молекулы воды. На нем также показано, как заряд, например, иона (например, Na или Cl) может взаимодействовать с молекулой воды.Водородная связь
Противоположные электрические заряды притягиваются друг к другу. Поэтому положительная часть одной молекулы воды притягивается к отрицательным частям других молекул воды. Из-за этого притяжения между атомами водорода и кислорода соседних молекул воды образуются связи, как показано на рисунке \(\PageIndex{4}\). В этом типе связи всегда участвует атом водорода, поэтому он называется 9.0046 водородная связь .
Поэтому положительная часть одной молекулы воды притягивается к отрицательным частям других молекул воды. Из-за этого притяжения между атомами водорода и кислорода соседних молекул воды образуются связи, как показано на рисунке \(\PageIndex{4}\). В этом типе связи всегда участвует атом водорода, поэтому он называется 9.0046 водородная связь .
Водородные связи также могут образовываться внутри одной большой органической молекулы. Например, водородные связи, которые образуются между различными частями белковой молекулы, изгибают молекулу, придавая ей характерную форму, что важно для функций белка. Водородные связи также удерживают вместе две нуклеотидные цепи молекулы ДНК.
Рисунок \(\PageIndex{4}\): Водородные связи образуются между положительно и отрицательно заряженными частями молекул воды. Связи удерживают молекулы воды вместе. Как вы думаете, как это может повлиять на свойства воды?Липкая, влажная вода
Вода обладает некоторыми необычными свойствами из-за наличия в ней водородных связей. Одним из свойств является когезия , склонность молекул воды слипаться. Силы сцепления между молекулами воды ответственны за явление, известное как поверхностное натяжение . Молекулы на поверхности не имеют других подобных молекул со всех сторон и, следовательно, они сильнее связываются с молекулами, непосредственно связанными с ними на поверхности. Например, если вы капнете небольшое количество воды на очень гладкую поверхность, молекулы воды будут слипаться и образовывать капли, а не растекаться по поверхности. То же самое происходит, когда вода медленно капает из прохудившегося крана. Вода падает из крана не в виде отдельных молекул воды, а в виде капель воды. Склонность воды слипаться в капли также иллюстрируется каплями росы на рисунке \(\PageIndex{5}\).
Одним из свойств является когезия , склонность молекул воды слипаться. Силы сцепления между молекулами воды ответственны за явление, известное как поверхностное натяжение . Молекулы на поверхности не имеют других подобных молекул со всех сторон и, следовательно, они сильнее связываются с молекулами, непосредственно связанными с ними на поверхности. Например, если вы капнете небольшое количество воды на очень гладкую поверхность, молекулы воды будут слипаться и образовывать капли, а не растекаться по поверхности. То же самое происходит, когда вода медленно капает из прохудившегося крана. Вода падает из крана не в виде отдельных молекул воды, а в виде капель воды. Склонность воды слипаться в капли также иллюстрируется каплями росы на рисунке \(\PageIndex{5}\).
Другим важным физическим свойством воды является адгезия . С точки зрения воды адгезия — это соединение молекулы воды с другим веществом, например, с боковыми сторонами жилок листа. Этот процесс происходит потому, что водородные связи уникальны тем, что они разрываются и восстанавливаются с большой частотой. Эта постоянная перегруппировка водородных связей позволяет определенному проценту всех молекул в данном образце связываться с другим веществом. Эта характеристика захвата, которую образуют молекулы воды, вызывает капиллярность способность жидкости течь против силы тяжести в узком пространстве. Примером капиллярного действия является ситуация, когда вы опускаете соломинку в стакан с водой. Кажется, что вода поднимается вверх по соломинке еще до того, как вы кладете рот на соломинку. Вода создала водородные связи с поверхностью соломинки, заставляя воду прилипать к краям соломинки. Поскольку водородные связи продолжают меняться местами на поверхности соломинки, молекулы воды меняются местами, и некоторые из них начинают подниматься по соломинке.
С точки зрения воды адгезия — это соединение молекулы воды с другим веществом, например, с боковыми сторонами жилок листа. Этот процесс происходит потому, что водородные связи уникальны тем, что они разрываются и восстанавливаются с большой частотой. Эта постоянная перегруппировка водородных связей позволяет определенному проценту всех молекул в данном образце связываться с другим веществом. Эта характеристика захвата, которую образуют молекулы воды, вызывает капиллярность способность жидкости течь против силы тяжести в узком пространстве. Примером капиллярного действия является ситуация, когда вы опускаете соломинку в стакан с водой. Кажется, что вода поднимается вверх по соломинке еще до того, как вы кладете рот на соломинку. Вода создала водородные связи с поверхностью соломинки, заставляя воду прилипать к краям соломинки. Поскольку водородные связи продолжают меняться местами на поверхности соломинки, молекулы воды меняются местами, и некоторые из них начинают подниматься по соломинке.
Адгезия и капиллярное действие необходимы для выживания большинства организмов. Именно этот механизм отвечает за транспорт воды у растений через корни и стебли, а у животных — через мелкие кровеносные сосуды.
Водородные связи также объясняют, почему температура кипения воды (100°C) выше, чем у аналогичных веществ без водородных связей. Из-за относительно высокой температуры кипения воды большая часть воды существует на Земле в жидком состоянии. Жидкая вода необходима всем живым организмам. Следовательно, наличие жидкой воды позволяет жизни выжить на большей части планеты.
Кроме того, вода имеет высокую удельную теплоемкость, поскольку для повышения или понижения температуры воды требуется много энергии. В результате вода играет очень важную роль в регулировании температуры. Поскольку клетки состоят из воды, это свойство помогает поддерживать гомеостаз.
Плотность льда и воды
Температура плавления воды равна 0°C. Ниже этой температуры вода находится в твердом состоянии (лед). В отличие от большинства химических веществ, вода в твердом состоянии имеет меньшую плотность, чем вода в жидком состоянии. Это происходит потому, что вода расширяется при замерзании. Опять же, причиной является водородная связь. Водородные связи заставляют молекулы воды менее эффективно выстраиваться во льду, чем в жидкой воде. В результате молекулы воды во льду разнесены дальше друг от друга, что придает льду меньшую плотность, чем жидкая вода. Вещество с меньшей плотностью плавает на веществе с большей плотностью. Это объясняет, почему лед плавает в жидкой воде, тогда как многие другие твердые тела опускаются на дно жидкой воды.
В отличие от большинства химических веществ, вода в твердом состоянии имеет меньшую плотность, чем вода в жидком состоянии. Это происходит потому, что вода расширяется при замерзании. Опять же, причиной является водородная связь. Водородные связи заставляют молекулы воды менее эффективно выстраиваться во льду, чем в жидкой воде. В результате молекулы воды во льду разнесены дальше друг от друга, что придает льду меньшую плотность, чем жидкая вода. Вещество с меньшей плотностью плавает на веществе с большей плотностью. Это объясняет, почему лед плавает в жидкой воде, тогда как многие другие твердые тела опускаются на дно жидкой воды.
В большом водоеме, таком как озеро или океан, вода с наибольшей плотностью всегда опускается на дно. Вода наиболее плотная при температуре около 4°С. В результате вода на дне озера или океана обычно имеет температуру около 4°С. В климате с холодными зимами этот слой воды температурой 4°C изолирует дно озера от отрицательных температур. Озерные организмы, такие как рыбы, могут пережить зиму, оставаясь в этой холодной, но незамерзшей воде на дне озера.
Обзор
- Опишите строение молекулы воды. Что такое полярность и почему вода полярна?
- Объясните, как внутренняя полярность молекулы воды делает ее хорошим растворителем?
- Объясните, как водородные связи заставляют молекулы жидкой воды слипаться.
- Что такое капиллярное действие? Приведите пример.
- Какое свойство воды помогает поддерживать гомеостаз и каким образом?
Принадлежности
- Water Planet от НАСА/Роберта Симмона и Марит Джентофт-Нильсен, общественное достояние через Wikimedia Commons
- Water by Lumen Learning, лицензия CC BY 2.0
- Растворяющаяся соль Чарльза Молнара и Джейн Гейр, лицензия CC BY 4.0
- Водородное связывание от Lumen Learning с лицензией CC BY 2.0
- Капли воды Службы охраны рыбных ресурсов и дикой природы США, общественное достояние на Викискладе .
- Текст адаптирован из книги «Биология человека» по лицензии CK-12, лицензия CC BY-NC 3.
 0
0
Эта страница под названием 2.11: Биохимические свойства воды распространяется под лицензией CK-12 и была создана, изменена и/или курирована Сюзанной Ваким и Мандипом Грюалом с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts. ; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Сюзанна Ваким и Мандип Гревал
- Количество столбцов печати
- Два
- Печать CSS
- Плотный
- Лицензия
- CC BY-SA
- Лицензия
- СК-12
- Показать оглавление
- нет
- Включено
- да
- Теги
- адгезия
- капиллярное действие
- точка плавления
- полярная молекула
- полярность
- источник@https://www.
 ck12.org/book/ck-12-human-biology/
ck12.org/book/ck-12-human-biology/ - источник[1]-био-17004
- поверхностное натяжение
Свойства воды — Уроки Византа
Автор: Сара В.
Вода встречается повсюду в природе и является необходимым компонентом почти всех органических
реакций. Это самое распространенное соединение на поверхности планеты. Большая часть воды на Земле 90 226 — это морская вода, а вода также присутствует в виде твердого льда и невидимых газообразных облаков. Вся жизнь на Земле
нуждается в воде, чтобы выжить, и предполагается, что внеземная вода может быть признаком жизни (или, по крайней мере,
предшественником жизни) где-то еще во Вселенной. Наряду с обеспечением жизни вода оказывает влияние на неживые объекты, например, на выветривание и эрозию горных пород и почвы. Вода также действует как поглотитель тепла, поглощая избыточное тепло и защищая температуру Земли от экстремальных изменений. Вода является жизненно важной частью любой живой системы, от всей среды обитания до отдельных клеток. Так что же такое вода?
Вода является жизненно важной частью любой живой системы, от всей среды обитания до отдельных клеток. Так что же такое вода?
Химические свойства воды
Вода (также известная как H 2 O) представляет собой полярное химическое соединение, содержащее один атом кислорода (O) и два атома водорода (H) (как показано на первом рисунке). Эти три атома связаны вместе ковалентными связями, что означает, что они делят свои пары валентных или внешних электронов вместе. Каждый атом водорода отдельно связан с центральным атомом кислорода, а кислород также имеет две пары неподеленных электронов, что дает одной молекуле воды в общей сложности четыре общих и четыре неподеленных валентных электрона. Молекулы воды имеют изогнутую форму с углом 104,45° между двумя атомами водорода.
Несмотря на общие электроны, молекулы воды полярны, потому что валентные электроны
распределены неравномерно между атомами кислорода и водорода. Кислород имеет большую электроотрицательность 90 226, чем водород, а это означает, что он сильно притягивает электроны, поэтому он сильнее притягивает общие 90 226 электронов и удерживает их ближе к себе. Это создает дипольный момент, то есть два электрических полюса. Это 90 226 неравное распределение электронов означает, что отрицательные заряды электронов группируются на кислородном конце 9-й цепи.0226, оставляя водородный конец молекулы частично положительным, а кислородный конец
Это создает дипольный момент, то есть два электрических полюса. Это 90 226 неравное распределение электронов означает, что отрицательные заряды электронов группируются на кислородном конце 9-й цепи.0226, оставляя водородный конец молекулы частично положительным, а кислородный конец
частично отрицательным. Полярность воды приводит к тому, что она прилипает ко многим другим веществам, что делает
отличным растворителем.
Полярные вещества хорошо растворяются в воде, поскольку «подобное растворяется в подобном», но неполярные
вещества растворяются не так легко (или вообще не растворяются). Распространенным примером такой растворимости является растворение поваренной соли (NaCl) в воде с образованием Na + и Cl – , окруженные молекулами воды, причем их положительные и отрицательные полюса ориентированы к ионам или от них в зависимости от заряда иона. Когда полярное растворенное вещество, такое как соль, растворяется в положительных и отрицательных ионах, молекулы воды ориентируются, окружая отдельные ионы, и направляют свои соответствующие полюса на ион в зависимости от его заряда; отрицательные полюса воды указывают на положительные ионы и наоборот.
При смешивании неполярного вещества с водой оно не растворяется, а остается в комках
вместе и по возможности отдельно от молекул воды. Вот почему вода и масло остаются отдельными при смешивании. Вода является хорошим растворителем гидрофильных веществ, таких как соли, в то время как
плохо растворяет гидрофобные вещества, такие как жиры и масла. Вещество не может растворяться в воде, если его притяжение к молекулам воды не превышает их притяжения друг к другу; он
разрушает межмолекулярные связи воды, не заменяя их, и поэтому энергетически
неблагоприятный. Гидрофильное растворенное вещество, напротив, быстро окружается молекулами воды и образует с ними
новых тонких связей.
Вода является амфотерным соединением, что означает, что она может действовать как основание или кислота в химической реакции
. Это позволяет ему участвовать в большом количестве реакций как в лаборатории, так и в природе. Вода также плохо поддается сжатию, а это означает, что ее (как жидкость) нельзя легко сжать в
меньший объем. Эти различные свойства воды очень важны в жизни Земли и в
Эти различные свойства воды очень важны в жизни Земли и в
жизнь отдельных организмов.
Физические свойства воды
Вода является жидкостью при стандартной температуре и давлении, но также встречается в природе в твердой
(замороженной) и газообразной фазах. Температура кипения воды (точка перехода из жидкого состояния в газообразное или
наоборот) равна 100° Цельсия, а точка замерзания (при котором вода переходит из жидкого состояния в твердое или наоборот) равна 0 °С. Вода обладает высокой теплоемкостью, что означает, что она может поглощать большое количество энергии без значительного повышения ее температуры. Вода также имеет относительно высокую температуру кипения по сравнению с температурами кипения аналогичных соединений, а это означает, что в воду необходимо вложить больше энергии, чтобы разделить молекулы и превратить ее из жидкости в газ. Эти два свойства обусловлены его многочисленными межмолекулярными водородными связями (обсуждается ниже в параграфе «Особые свойства»). 0034
0034
В чистом виде вода не имеет вкуса и запаха, однако вода является универсальным растворителем и поэтому
часто встречается с растворенными в ней веществами, меняющими свои физические характеристики. Минералы
и другие примеси придают бутилированной воде ее вкус, а присутствие растворенных веществ придает воде
способность хорошо проводить электричество. Если бы в воде не было растворенных ионов, она была бы плохим проводником электричества. Однако никакая вода не может быть полностью свободной от ионов, и даже в отсутствие растворенного вещества она может автоматически очищаться.0226 ионизируются с образованием отрицательных гидроксид-анионов (OH – ) и положительных катионов гидроксония (H 3 O + ). Эти ионы позволяют воде проводить некоторое количество электричества, даже если она чистая или «деионизированная». Электропроводность воды, а также ее способность растворять гидрофильные вещества имеют большое значение в химии и биологических науках.
Особые свойства воды
Многие особые свойства воды обусловлены водородными связями. Благодаря их атомной
. Эта слабая связь возникает, когда атом водорода, ковалентно связанный с более электроотрицательным атомом
, затем кратковременно электрически притягивается ко второму сильно электроотрицательному атому другой отдельной молекулы
. Водород действует как липкое, привлекательное арахисовое масло между двумя кусками электроотрицательного хлеба
. Это сближает две молекулы благодаря двойному притяжению водорода. Таким образом, молекулы воды работают как крошечные магниты, их частично положительные и отрицательные полюса
взаимодействуют друг с другом через водородные связи. Молекулы воды могут образовывать до четырех водородных связей каждая, 90 226 создавая локальную тетраэдрическую структуру из пяти молекул воды, связанных водородными связями (как показано на втором рисунке 90 226).

также сильно влияет на замерзание и плотность воды.
Плотность жидкой воды составляет примерно 1 грамм на кубический сантиметр (1 г/см 3 .) В отличие от большинства веществ, плотность воды в жидкой фазе выше, чем в твердой; это связано с тем, что молекулы воды образуют рыхлую гексагональную кристаллическую структуру по мере того, как они охлаждаются и замерзают вместе, запирая их в расширенной и менее плотной форме, чем их свободно движущаяся жидкая форма. При замораживании временные водородные связи между молекулами стабилизируются, создавая решетку из молекул воды, слегка отстоящих друг от друга. Из-за этой разницы в плотности твердый лед может плавать в жидкой воде. Благодаря этому свойству, а также высокой теплоемкости воды (хорошая теплоизоляция) озера и пруды на Земле медленно замерзают сверху вниз и редко полностью замерзают, что позволяет организмам в незамерзшей воде пережить зиму.


 Водную основу имеют и секреты, выделяемые некоторыми железами и органами: слюна, слёзы, желчь, сперма и т.д.
Водную основу имеют и секреты, выделяемые некоторыми железами и органами: слюна, слёзы, желчь, сперма и т.д. Как они формировались? Как связываются атомы в молекулы?
Как они формировались? Как связываются атомы в молекулы? 0
0 ck12.org/book/ck-12-human-biology/
ck12.org/book/ck-12-human-biology/