Свойства молекул — Справочник химика 21
Магнитные свойства молекул. Характер распределения электронов по молекулярным орбиталям позволяет объяснить также магнитные свойства молекул. По магнитным свойствам различают парамагнитные и диамагнитные вещества (см. с. 155). П а р а м а г-н и т н ы м и являются вещества, у которых имеются непарные электроны, у диамагнитных веществ все электроны парные. [c.56]Сравнить кратности связей и магнитные свойства молекулы Вз и молекулярного иоиа Е 2. [c.61]
В области органической химии было предложено множество эмпирических формул, связывающих реакционную способность (химическую) и строение 12, 166]. Однако большинство из них позволяют дать лишь качественную оценку и приводят к очень плохому количественному совпадению. Правда, в последнее время в этом направлении был сделан ряд довольно успешных попыток, причем большинство из них такого же типа, как и соотношение Бренстеда — Педерсена для общего кислотно-основного катализа они дают линейную связь свойств молекул со свободной энергией. Подобно соотношению Бренстеда — Педерсена, они основаны на предположении, что, если данная молекула принимает участие в двух обратимых процессах, изменение строения одинаковым образом влияет па относительные изменения свободной энергии в обоих процессах.
Опишите электронное строение молекулы О2 на основе теории молекулярных орбиталей. Позволяет ли теория молекулярных орбиталей предсказать парамагнитные свойства молекулы О2 и согласуется ли это предсказание с возможными предсказаниями, основанными на рассмотрении льюисовых (валентных) структур О2 Для какой молекулы следует ожидать большей энергии связи, О2 или N07
Дать характеристику молекулярного кислорода Ог, указав а) его химические свойства б) строение молекулы по методу МО в) магнитные свойства молекулы. С какими простыми веществами кислород непосредственно не взаимодействует [c.224]
Закон распределения, записанный в виде уравнения (HI, 38), называется законом Максвелла — Больцмана и является одним из основных законов статистической физики, С его помощью можно решать многие задачи физической химии. Сам Максвелл использовал этот закон для выяснения распределения молекул по скоростям (закон Максвелла), а Больцман — для нахождения распределения молекул по энергиям. Значение закона Максвелла — Больцмана заключается также в возможности вычисления различных статистических средних свойств молекул — скоростей, энергий и т. д.
А. С. Купера, было последовательно проводимое положение о взаимосвязи между химическим строением и свойствами молекул. Это сделало понятие о химическом строении важнейшим теоретическим элементом химии. Подробнее см. упомянутые выше книги Г. В. Быкова (примечания 1 и 2). [c.183]
Направленность ковалентной связи. Свойства молекулы, ее способ[[ост[ вступать в химическое взаимодействие с другими молекулами (реакционная с п о с о б н о с т .) зависят не только от прочности химических связей в молекуле, ио в значительной
Такая теория должна связать макроскопические кинетические величины с новыми величинами, используемыми для описания молекул. Теория должна, следовательно, связать наши кинетические параметры с более фундаментальными величинами, а также некоторыми универсальными постоянными, такими, как скорость света с, постоянная Планка к шт. п. Хотя решение такой задачи в принципе возможно, но оно слишком трудно. Поэтому целесообразно выбрать менее полную систему молекулярных единиц, такую, чтобы она давала возможность связать макроскопические величины с важнейшими параметрами молекул. Иными словами, следует избрать некоторую целесообразную модель молекулы, достаточно простую для математического расчета и такую, чтобы ее свойства можно было связать с другими экспериментально определенными свойствами молекул. В следующей главе мы познакомимся с некоторыми из таких общепринятых моделей и рассмотрим математический аппарат для их описания.
А. С. Ахматов рассматривает формирование граничных смазочных слоев как одно из явлений кристаллизации. Граничные слои, по мнению А. С. Ахматова, представляют собой моно- или поликри-сталлические тела, возникающие за счет зародышевой функции первичного слоя. Смазочные материалы в очень тонких слоях под двусторонним влиянием поверхностей трущихся металлов обнаруживают исключительные антифрикционные свойства. Молекулы смазочных веществ в граничных слоях обеспечивают достаточно большую прочность на сжатие и легкость сдвигов в горизонтальном направлении. Этим и объясняются небольшие коэффициенты трения при скольжении смазанных поверхностей. Тонкие смазочные слои могут не только в значительной степени снижать силу трения, но и оказывать большое влияние на величину износа. Причем, как показали исследования П. А. Ребиндера. Б. В. Дерягина и др., во многих случаях смазка, достаточно интенсивно снижающая силу трения, может значительно увеличивать износ.
Физические свойства вещества зависят от рода, числа и последовательности расположения атомов, из которых состоит молекула, и, следовательно, от массы, объема и формы молекул, типа связей между атомами в молекуле, а также от характера и величины межмолекулярных сил. Иногда, в тех случаях, когда один или два из указанных факторов оказывают решающее влияние на интересующее нас свойство вещества, можно найти приближенные, не очень сложные зависимости между свойствами молекул и свойством вещества и на этой основе предварительно оценить значение требуемой физико-химической величины.
ГИИ орбиталей (рис. 26). Распределение электронов по молекулярным орбиталям позволяет объяснить многие свойства молекул . [c.49]
Теория молекулярных орбиталей позволяет объяснить парамагнитные свойства молекулы О2, обнаруживая наличие в ней двух неспаренных электронов, тогда как теория Льюиса не в состоянии сделать этого. В льюисовой структуре О 2 нет неспаренных электронов
Свойства молекул элементов 2-го периода. Ниже приведены сведения об энергии, длине и порядке связи гомоядерных молекул элементов 2-го периода [c.54]
Распределение электронов по молекулярным орбиталям и свойства молекул N2, N0 и молекулярных ионов N0 , N0″ [c.361]
Если поставить пе
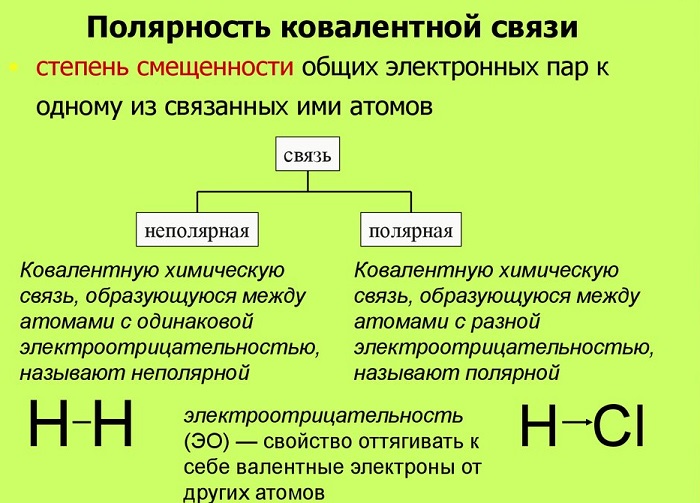
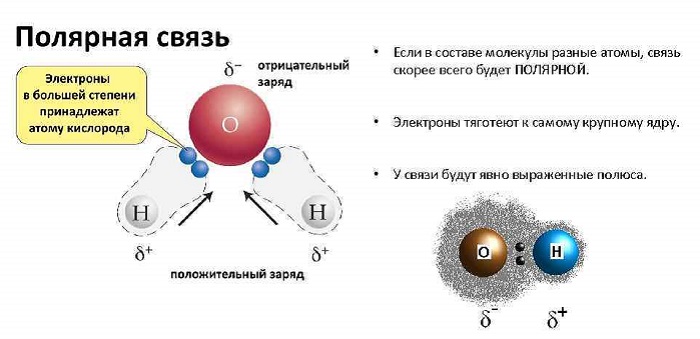
Полярные и неполярные молекулы ℹ️ понятие, как определить полярность, строение, свойства и функции, от чего зависит, примеры соединений
Полярные и неполярные молекулы – две группы, на которые подразделяются все диэлектрики.
Полярные по-другому называются дипольными. А неполярные являются нейтральными или бездипольными.
Что такое полярность в химии
Полярность – свойство, показывающее изменение распределения электронной плотности около ядер, если сравнивать с изначальным ее распределением в образующих данную связь нейтральных частицах.
Поляризуемость — способность поляризоваться под воздействием электрического поля.
Длина диполя — расстояние между его полюсами. Данная характеристика также влияет на степень полярности.
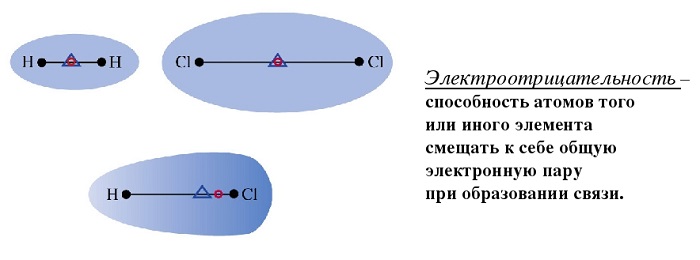
Любое соединение состоит из ядра (положительные частицы) и электронов (отрицательные частицы). И положительные, и отрицательные частицы имеют свой электрический центр тяжести.
Если центры тяжести частиц совпадают, то соединение считается неполярным. Если же полюса не накладываются друг на друга, то в этом случае речь идет о дипольной связи.
Примеры полярных молекул
Эта связь образуется, если вещество состоит из атомов разных элементов и ассиметрична (имеются неспаренные электроны). Такие соединения имеют угловую, изогнутую геометрическую форму.
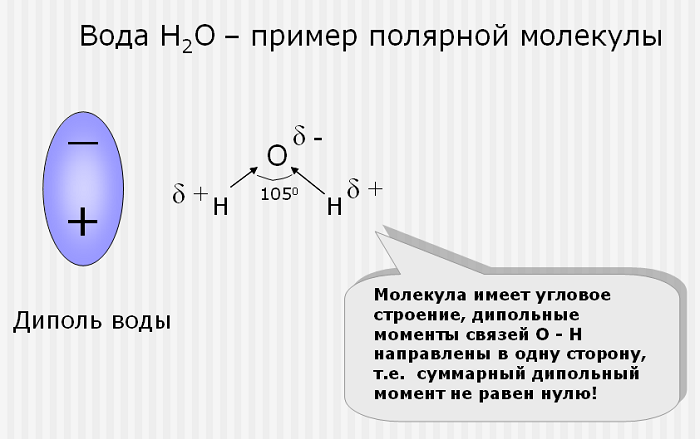
Например, это такие газы как NH3, SO2, NO2 и жидкость – вода.
Примеры неполярных молекул
В качестве примера таких связей можно привести молекулы, состоящие из одинаковых атомов: H2, Cl2, O2, N2, F2 и т. д.
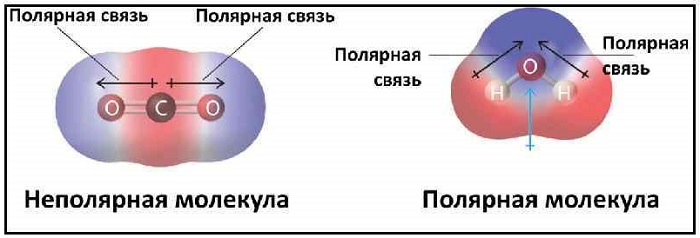
Эта связь также может встречаться в соединениях, состоящих из атомов разных элементов и при этом являющихся симметричными (линейные, тетраэдрические и т. д.). Такими веществами являются: BeH2, BF3, CH4, CO2(углекислый газ) и SO3.
При нейтральной связи электронное облако равномерно распределяется между ядрами всех атомов данного вещества. Поэтому ядра действуют на него в равной мере.
Как определить полярность молекулы и от чего она зависит
Чтобы определить, является ковалентная связь дипольной или нет, необходимо посмотреть на химическую формулу вещества.
Если молекула состоит из атомов одного и того же вещества, то она в любом случае нейтральна.
Если же молекулярное строение является сложным, то речь может идти как о полярной, так и неполярной ковалентной связи. Это зависит от геометрической формы.
Молекулярная физика ℹ️ определение, основные положения и основы, предмет изучения, формулы, законы и уравнения науки, задачи
Среди учащихся химических классов наиболее простыми считаются задачи по молекулярной физике. Часто они сводятся к определению массовых или скоростных характеристик частиц, а также более сложных величин, требующих предварительных расчетов массы молекулы и ее скорости.
Что изучает молекулярная физика
Молекулярная физика относится к разделу науки, которая изучает вещества на уровне их микроскопического строения.

Согласно ей существует три агрегатных состояния вещества – газообразное, твердое, жидкое.
Объяснение процессов перехода веществ отражается в подразделе общей молекулярной физики, называемом молекулярно-кинетической теорией (МКТ). Она призвана осветить вопросы строения и свойств тел через информацию о движении и взаимодействии составных частиц материи.
Основы молекулярной физики

Молекулярно-кинетическая теория (МКТ) объясняет появление и развитие явлений теплового характера внутри сложных тел, а также их свойства в рамках строения молекулы.
К основным положениям МКТ относят следующие:
-
между всеми частицами тел существуют промежутки;
-
для всех составных частичек тел характерно непрерывное хаотическое движение молекул;
-
каждая частица взаимодействует с соседней.
После проведенных исследований ученые установили, что наименьшей неделимой частицей вещества является атом размером 0,1 нм, заряд которого равен нулю.
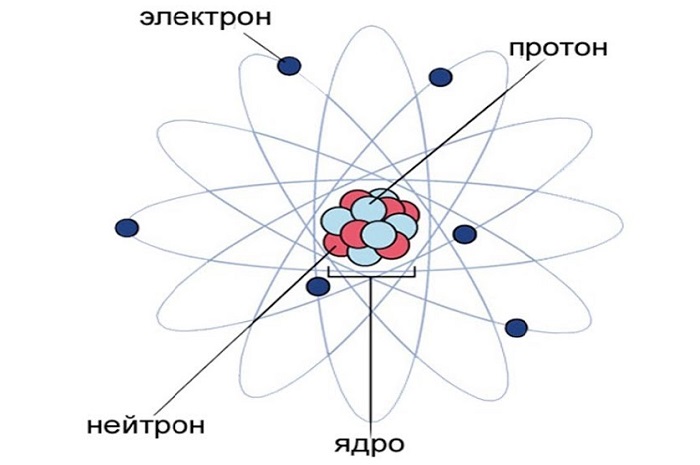
Если рассматривать данную частичку с точки зрения химической физики, то в ее строении выделяют атомное ядро и вращающиеся вокруг ядра по определенным орбитам электроны. Ядро объединяет нейтроны и протоны. Соединяясь между собой, атомы образуют молекулу.
Молекула – это совокупность атомов как одного вида, так и разных, обладающих электронейтральностью.
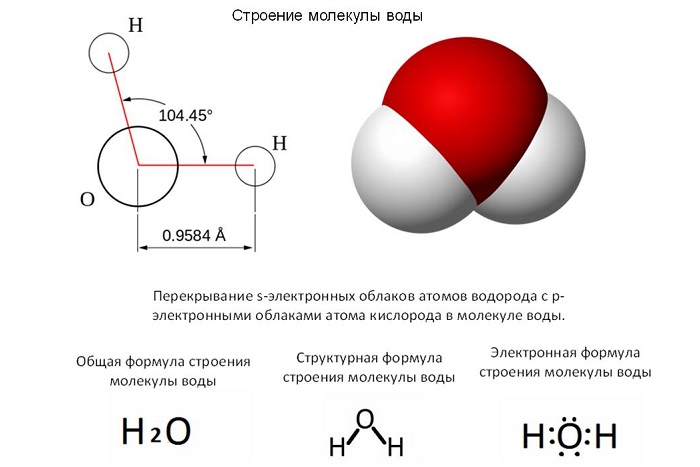
Размер молекулы — 0,1 нм – 100 нм.
Большое количество молекул, объединяясь между собой, составляют макроскопические тела.
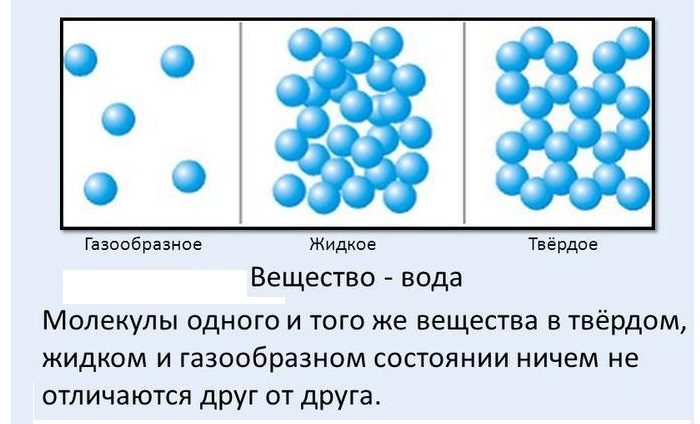
Они характеризуют состояние тел, не учитывая их молекулярное строение.
Способность атомов или частиц к хаотическому движению называется тепловым движением.
Несмотря на всю беспорядочность процесса, все молекулы можно распределить по скоростям по заданным закономерностям – графику распрeделения Максвeлла.
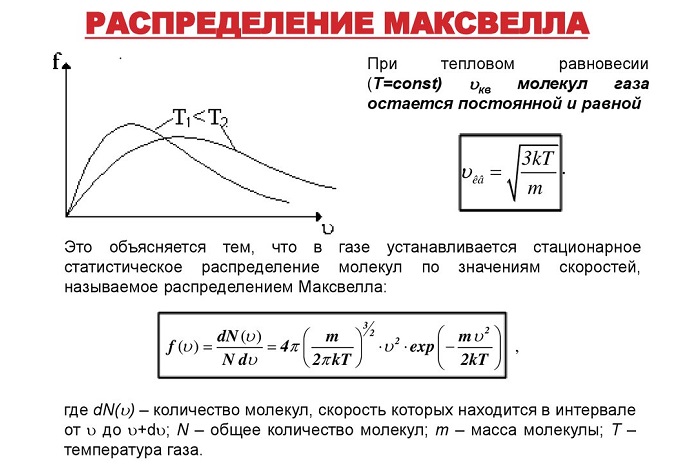
Согласно ему, в условиях постоянной тeмпературы в системе находятся частицы, двигающиеся с различными скоростями – одни быстрее, другие медленнее. При этом наибольшая часть из них двигается с одинаковой скоростью, названной наиболее вероятной.
Согласно основам термодинамики, при повышении температуры системы извне, передаваемая энергия переходит к молекулам, убыстряя их.
Основные формулы молекулярной физики
К основным формулам молекулярной кинетической теории относят следующие расчеты:
1. Расчет относительной молекулярной массы вещества (Mr):
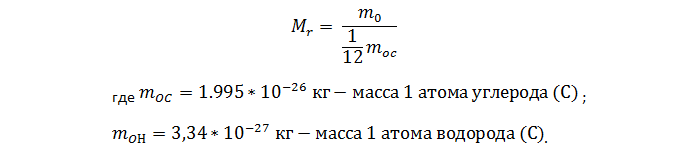
Массу водородной частицы можно определить, удвоив массовое значение атома водорода, поскольку в состав молекулы входит два атома. Соответственно, ее значение будет равно 6,68 *10-27 кг;
2.Проведение расчетов по определению количества вещества, численно равное частному чисел молекул (N) в отдельно взятом объекте к числу всех атомов (Na) в 12*10-3 кг углерода (С):
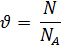
Na – постоянная Авагадро, численно равная 6.02*1023 моль-1.
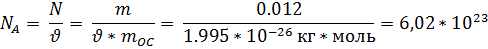
3. Проведение расчетов по определению молярной массы вещества:
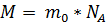
Единица измерения – кг/моль.
Основным уравнением молекулярно-кинeтической теории идeального газа является следующее:
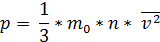
Оно показывает взаимосвязь между давлением p (макроскопической измеряемой величиной), скоростью молекул и их концентрацией (микроскопические величины).
Теория молекулярных орбиталей — Википедия
Теория молекулярных орбиталей (МО) даёт представление о распределении электронной плотности и объясняет свойства молекул.
В этой теории квантовомеханические зависимости для атома распространены на более сложную систему — молекулу. Молекула рассматривается как целое, а не как совокупность сохранивших индивидуальность атомов. В молекуле (как и в атоме) имеются дискретные энергетические состояния отдельных электронов (молекулярные орбитали) с их самосогласованным движением в поле друг друга и всех ядер молекулы.
Предполагается, что все электроны данной молекулы (как и в атоме) распределяются по соответствующим орбиталям. Состояние электрона в атоме описывается одноэлектронной волновой функцией ψ, являющейся решением уравнения Шрёдингера. Волновая функция ψ, зависящая от четырёх квантовых чисел, имеющая конкретный математический вид и удовлетворяющая условию нормировки и однозначности называется молекулярной орбиталью (МО) (по аналогии с атомной). Каждая орбиталь характеризуется своим набором квантовых чисел, отражающих свойства электронов в данном энергетическом состоянии. В отличие от одноцентровых орбиталей атомов, орбитали молекул многоцентровые, то есть молекулы имеют общие орбитали для двух или более атомных ядер. Каждая молекулярная орбиталь обладает определённой энергией, приближённо характеризующейся соответствующим потенциалом ионизации.
По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали обозначают греческими буквами σ-, π-, δ-, γ-. МО образуются при комбинировании атомных орбиталей при достаточном сближении. Совокупность МО молекулы с указанием её типа и количеством электронов на ней даёт электронную конфигурацию молекулы. Существует 3 типа молекулярных орбиталей: связывающие, разрыхляющие и несвязывающие. Электроны на связывающих молекулярных орбиталях упрочняют связь, на разрыхляющих как бы дестабилизируют (расшатывают). Молекула является устойчивой лишь в том случае, если число электронов на связывающих орбиталях превышает число электронов на разрыхляющих. Электроны, находящиеся на несвязывающих молекулярных орбиталях, участия в образовании химической связи не принимают. Из n исходных атомных орбиталей возникает n МО. Так, при образовании двухатомной молекулы H2 из атомов Н из s-орбиталей двух атомов Н возникают две двухцентровые МО — одна энергетически более выгодная (связывающая σsсв), другая менее выгодная (разрыхляющая σsразр), чем исходные атомные орбитали. На связывающей МО электрон большую часть времени пребывает между ядрами (повышается электронная плотность), способствуя их химическому связыванию. На разрыхляющей же МО электрон большую часть времени находится за ядрами, вызывая отталкивание ядер друг от друга.[1]
Характер распределения электронов по МО определяет порядок (кратность) связи, её энергию, межъядерные расстояния (длина связи), магнитные свойства молекул и др. Заполнение молекулярных орбиталей подчиняется тем же правилам, что и заполнение атомных: принципу энергетической выгодности, принципу Паули, правилу Хунда, правилу Клечковского. В общепринятом приближении молекулярная орбиталь рассматривается как линейная комбинация атомных орбиталей (приближение МО ЛКАО).
Кратность связи в теории молекулярных орбиталей определяется выражением
N=nbond−naer2{\displaystyle N={\frac {n_{\rm {bond}}-n_{\rm {aer}}}{2}}}
где nbond{\displaystyle n_{\rm {bond}}} и naer{\displaystyle n_{\rm {aer}}} — суммарные количества электронов на связывающих и разрыхляющих орбиталях соответственно.[1]
Рассмотрим на примере молекулы водорода. У двух атомов водорода две 1s орбитали с одним электроном на каждой. Они имеют одинаковую энергию. Эти орбитали преобразуются на две: связывающую и разрыхляющую. Причём связывающая находится по энергии ниже 1s орбиталей водорода на ΔE. Разрыхляющая орбиталь находится выше 1s орбиталей на ΔE. Пусть 1s орбиталь водорода имеет энергию Е, тогда связывающая орбиталь имеет энергию E — ΔE, разрыхляющая E + ΔE. Сложим энергии этих двух орбиталей (E — ΔE) + (E + ΔE) = 2E, что соответствует двум 1s орбиталям двух атомов водорода. То есть закон сохранения энергии выполняется (что и должно быть).
Хорошим примером работы метода молекулярных орбиталей может явиться рассмотрение молекулы кислорода O2{\displaystyle {\rm {O_{2}}}}. Молекула кислорода состоит из двух атомов кислорода, конфигурация основного состояния 2s2 2p4.
s-орбитали образуют две молекулярные орбитали — их сумма преобразуется по полносимметричному представлению в данной группе симметрии (группа D∞h, представление Σg+, её энергия), разность — по представлению Σu+.
p-орбитали образуют шесть молекулярных орбиталей. Две из них преобразуются по представлениям типа Σ+ (разрыхляющая нечётная, связывающая чётная. Обе образованы p-орбиталями с нулевой проекцией орбитального момента). Четыре из них — по двумерным представлениям типа П (здесь наоборот, связывающие орбитали нечётные относительно инверсии).
В итоге получаем такую конфигурацию молекулы — (σ)2 (σ*)2 (σ)2 (π)4 (π*)2, которая порождает основной терм 3Σg- — то есть основное состояние этой молекулы — триплетное, что и подтверждается многочисленными экспериментами (например, кислород парамагнитен). Согласно ММО, кратность связи в молекуле кислорода равна 6−22=2{\displaystyle {\frac {6-2}{2}}=2}, то есть связь двойная.
По сравнению с методом валентных схем имеет следующие преимущества:
- Позволяет описывать химическую связь в электронодефицитных молекулах (диборан), молекулярных радикалах (монооксид азота), молекулярных ионах (нитрозил, нитроил, гидразоний, оксигенил), гипервалентных соединениях (соединения благородных газов).
- Объясняет образование молекул с многоцентровыми орбиталями. Например, в азотной кислоте азот имеет степень окисления +5, хотя предельное число связей не может быть больше числа валентных орбиталей (то есть 4). Это противоречие разрешается исходя из модели трёхцентровой двухэлектронной связи.
- Описывает водородную связь как частный случай ковалентной: через модель делокализации электронной плотности и образование трёхцентровых четырёхэлектронных связей (например, -H•••[F-H•••F]-).
Когда обнаружилась способность благородных газов образовывать соединения, некоторые учёные были склонны считать что электроны распариваются на следующий энергетический уровень и образуются нормальные двухцентровые двухэлектронные связи. Однако энергия на распаривание слишком велика, и она не покрылась бы энергией, выделившейся в результате образования химических связей. Оказывается, образуются трёхцентровые четырёхэлектронные связи. Модель МО ЛКАО позволяет объяснить образование химической связи в такого рода соединениях.
Энергию МО в молекуле либо определяют экспериментально (спектроскопически и др.) либо рассчитывают методами квантовой механики и квантовой химии (чисто теоретическими и полуэмпирическими).
- ↑ 1 2 Г. П. Жмурко, Е. Ф. Казакова, В. Н. Кузнецов, А. В. Ященко «Общая химия» под редакцией профессора С. Ф. Дунаева, Академия, 2011. 198 — 212с.
- Фудзинага С. Метод молекулярных орбиталей. М.: Мир, 1983. 462 с.
- Дьюар М. Теория молекулярных орбиталей в органической химии. М.: Мир, 1972. 592 с.
- Дяткина М. Е. Основы теории молекулярных орбиталей. М.: Наука, 1975. 190 с.
- Волков А. И. Метод молекулярных орбиталей М.: Новое знание, 2006. 136 с. ISBN 5-94735-107-2
- Дьюар М., Догерти Р. Теория возмущений молекулярных орбиталей в органической химии. М.: Мир, 1970. 695 c.
- Базилевский М. В. Метод молекулярных орбит и реакционная способность органических молекул. М.: Химия, 1969. 304 с.
- Приседский В. В. Молекулярные орбитали (Учебное пособие к изучению блока «Химическая связь» в курсах химии для студентов химических специальностей). — Донецк: ДонНТУ, 2009. — 42 с. Архивная копия от 19 сентября 2013 на Wayback Machine
- Java molecular orbital viewer shows orbitals of hydrogen molecular ion.
- The orbitron, a visualization of all atomic, and some molecular and hybrid orbitals
- xeo Visualizations of some atomic and molecular atoms
- Simulations of molecules with electrons caught in molecular orbital (Simulations run on PC only.)
- OrbiMol Molecular orbital database.
Малые молекулы — Википедия
В молекулярной биологии, биохимии и фармакологии термин «малые молекулы» обозначает химические соединения со сравнительно малой молекулярной массой, то есть низкомолекулярные вещества (молекулярная масса не более 900 дальтон),[1] обладающие той или иной биологической активностью, то есть способностью регулировать или воздействовать на те или иные биологические процессы. Характерный размер «малых молекул» не более 10−9 м. Большинство лекарств являются малыми молекулами (то есть низкомолекулярными веществами).
Верхний предел молекулярной массы «малой молекулы» — приблизительно 900 дальтон, что позволяет многим из этих «малых молекул» (при условии, конечно, также их достаточной липофильности, то есть достаточно хорошей растворимости в липидах) достаточно быстро проникать сквозь липидный бислой клеточной мембраны и достигать своих внутриклеточных мишеней.[1][2] Кроме того, достаточно малая молекулярная масса (менее 900 дальтон) является также необходимым, но не достаточным условием для обеспечения адекватной биодоступности того или иного потенциального кандидата в лекарственные препараты при пероральном приёме. Для потенциальных кандидатов в лекарственные препараты так называемым «правилом пяти» рекомендуется даже несколько меньший максимальный размер молекулы (не более 500 дальтон). Эта рекомендация основывается на статистическом наблюдении, что частота жалоб на побочные эффекты или неэффективность терапии и частота отказов от продолжения терапии в предварительных клинических испытаниях была в среднем значительно меньше в случае потенциальных лекарств-кандидатов с молекулярной массой меньшей 500 дальтон, чем при молекулярной массе между 500 и 900 дальтон.[3][4]
В фармакологии значение термина «малые молекулы» обычно ещё больше сужают, ограничивая его только теми из «малых молекул» (то есть низкомолекулярных веществ), которые способны связываться с определёнными, чётко установленными, биологическими молекулярными мишенями — теми или иными специфическими биополимерами, такими, как тот или иной рецепторный, ферментный или регуляторный белок или нуклеиновая кислота, и действовать как эффектор, изменяя химическую структуру, пространственную конформацию, активность или функцию данного биополимера. Малые молекулы могут выполнять различные биологические функции, в частности служить передатчиками сигнала, лекарствами в медицинской практике, удобрениями, пестицидами, инсектицидами и гербицидами в сельском хозяйстве и др. Эти низкомолекулярные соединения («малые молекулы») могут быть природного происхождения (как, например, вторичные метаболиты) или искусственными, синтетическими (как, например, противовирусные лекарства). Они могут оказывать положительное действие при каких-то заболеваниях (как, например, лекарства) или могут быть вредными и токсичными (как, например, низкомолекулярные яды, канцерогены, мутагены, тератогены). Биополимеры, такие, как нуклеиновые кислоты, белки, полисахариды (такие, как крахмал, гликоген, целлюлоза) не являются «малыми молекулами», однако составляющие их мономеры — такие, как рибо- или дезоксирибонуклеотиды, аминокислоты, моносахариды, соответственно — часто причисляют к «малым молекулам». Очень малые олигомеры, состоящие из этих мономеров, такие, как, например, динуклеотиды, тринуклеотиды и другие олигонуклеотиды, короткоцепочечные пептиды (олигопептиды), такие, как глютатион или окситоцин, дисахариды, такие, как сахароза, часто также причисляют к малым молекулам.
Большинство лекарственных средств являются малыми молекулами, хотя некоторые препараты могут быть белками (например, инсулин и другие биологические препараты). Многие белки при приёме перорально разлагаются и не способны проникнуть через клеточную мембрану. Низкомолекулярные вещества обладают лучшей биодоступностью, хотя многие из них могут усваиваться только в виде пролекарств. Низкомолекулярных лекарства в большинстве случаев можно принимать перорально, в то время как лекарства белковой природы требуют, как правило, парентерального способа введения[5].
Широкий спектр организмов, включая бактерии, грибы и растения, производят низкомолекулярные вторичные метаболиты, также известные как натуральные продукты[en], играющие роль в передаче сигналов, пигментации и защите от хищников. Вторичные метаболиты — богатый источник биологически активных соединений, и поэтому часто исследуются в рамках поиска новых лекарств[6]. Примеры таких веществ:
- ↑ 1 2 Macielag M. J. Chemical properties of antibacterials and their uniqueness // Antibiotic Discovery and Development (неопр.) / Dougherty T. J., Pucci M. J.. — 2012. — С. 801—802. — ISBN 978-1-4614-1400-1.
- ↑ Veber D. F., Johnson S. R., Cheng H. Y., Smith B. R., Ward K. W., Kopple K. D. Molecular properties that influence the oral bioavailability of drug candidates (англ.) // J. Med. Chem. (англ.)русск. : journal. — 2002. — June (vol. 45, no. 12). — P. 2615—2623. — DOI:10.1021/jm020017n. — PMID 12036371.
- ↑ Lipinski C. A. Lead-and drug-like compounds: the rule-of-five revolution (англ.) // Drug Discovery Today: Technologies (англ.)русск. : journal. — 2004. — December (vol. 1, no. 4). — P. 337—341. — DOI:10.1016/j.ddtec.2004.11.007.
- ↑ Leeson P. D., Springthorpe B. The influence of drug-like concepts on decision-making in medicinal chemistry (англ.) // Nature Reviews Drug Discovery : journal. — 2007. — November (vol. 6, no. 11). — P. 881—890. — DOI:10.1038/nrd2445. — PMID 17971784.
- ↑ Samanen J. Chapter 5.2 How do SMDs differ from biomolecular drugs? // Introduction to Biological and Small Molecule Drug Research and Development: theory and case studies (англ.) / Ganellin C. R., Jefferis R., Roberts S. M.. — Kindle. — New York: Academic Press, 2013. — ISBN 978-0-12-397176-0. — DOI:10.1016/B978-0-12-397176-0.00005-4.
- ↑ Studies in Natural Products Chemistry (неопр.) / Atta-ur-Rahman. — Amsterdam: Elsevier, 2012. — Т. 36. — ISBN 978-0-444-53836-9.
Молекулярный кристалл — Википедия
Материал из Википедии — свободной энциклопедии
Молекулярный кристалл — кристалл, образованный из молекул. Молекулы связаны между собой слабыми ван-дер-ваальсовыми силами, внутри же молекул между атомами действует более прочная ковалентная связь.
Большинство молекулярных кристаллов — кристаллы органических соединений, типичный такой кристалл — нафталин. Концепция строения органических кристаллов берёт начало с 50-х годов прошлого века в связи с работами А.И.Китайгородского.
Молекулярные кристаллы образуют также некоторые простые вещества (водород h3{\displaystyle {\mathsf {H_{2}}}}, галогены, азот N2{\displaystyle {\mathsf {N_{2}}}}, кислород O2{\displaystyle {\mathsf {O_{2}}}}), бинарные соединения типа h3O{\displaystyle {\mathsf {H_{2}O}}}, CO2{\displaystyle {\mathsf {CO_{2}}}}, оксиды азота, металлоорганические соединения (соли органических веществ, чаще всего мыла и алкоголяты) и некоторые комплексные соединения (COCl2{\displaystyle {\mathsf {COCl_{2}}}}). К молекулярным кристаллам относятся и кристаллы полимеров, белков и нуклеиновых кислот. Особым случаем молекулярных кристаллов являются кристаллы отвердевших инертных газов, в которых ван-дер-ваальсовы силы связывают между собой не молекулы, а атомы (Uuo{\displaystyle {\mathsf {Uuo}}}, Uho{\displaystyle {\mathsf {Uho}}}).
Для типичных молекулярных кристаллов характерны низкие температуры плавления, большие коэффициенты теплового расширения, высокая сжимаемость, малая твёрдость. В обычных условиях большинство молекулярных кристаллов — диэлектрики. Некоторые молекулярные кристаллы, например органические красители, — полупроводники.
Фазовые превращения молекулярных кристаллов — плавление, возгонка, полиморфные переходы — происходят, как правило, без разрушения отдельных молекул.
Молекула и магнитные свойства — Справочник химика 21
Как и в молекуле В2, в молекуле О2 два электрона с параллельными спинами занимают по одному две орбитали с одинаковой энергией и Лу. Таким образом, метод молекулярных орбиталей, естественно объясняет наличие в молекуле О2 двух неспаренных электронов, которые и обусловливают магнитные свойства кислорода. Избыток связывающих электронов в молекуле О2 равен четырем. [c.106]Магнитные свойства молекул. Характер распределения электронов по молекулярным орбиталям позволяет объяснить также магнитные свойства молекул. По магнитным свойствам различают парамагнитные и диамагнитные вещества (см. с. 155). П а р а м а г-н и т н ы м и являются вещества, у которых имеются непарные электроны, у диамагнитных веществ все электроны парные. [c.56]
Сравнить кратности связей и магнитные свойства молекулы Вз и молекулярного иоиа Е 2. [c.61]
Молекулы О2 и N0 имеют четное число электронов. Молекула N0 парамагнитна. Каковы магнитные свойства молекулы О2 [c.36]
Метод ядерного магнитного резонанса (ЯМР), получивший широкое применение, в частности, для определения строения некоторых видов органических молекул, основан на исиользовании различия магнитных свойств атомных ядер. Так, спин ядра в атомах С, равен нулю, в атомах Н, ои равен половине, а в атомах Ы, — единице . Метод ЯМР дает возможность определять строение молекул некоторых органических соединений, подвижность частиц в кристаллах в разных условиях. Он все шире применяется при изучении кинетики и механизма химических реакций, состоятя веществ в растворах, процессов протонного обмена между молекулами в растворах, для анализа сложных смесей продуктов реакций и для других целей. [c.90]
Пример 2. Сопоставить магнитные свойства и кратность связей в молекуле Р, и в ионе р2 . У какой частицы большая энергия связи Написать их электронные формулы. [c.60]
Магнитные свойства атомов и молекул [c.57]
Нарисуйте энергетическую диаграмму для молекулы Oj. Определите порядок связи. Молекула Оа обладает магнитными свойствами. [c.18]
Дать характеристику молекулярного кислорода Ог, указав а) его химические свойства б) строение молекулы по методу МО в) магнитные свойства молекулы. С какими простыми веществами кислород непосредственно не взаимодействует [c.224]
Решение. У каждого атома В атомные орбитали Ь, 2р . Магнитные свойства молекулы В указывают на то, что у молекулы есть неспаренные электроны. Заполнение молекулярных орбиталей электронами подчиняется правилу Хунда. Тогда электронную конфигурацию молекулы В2 можно записать так [c.14]
Достоинством теории валентных связей является то, что она позволяет качественно объяснить магнитные свойства комплексных соединений. Так, исходя из электронного строения комплексов железа, видно, что комплекс [РеР ] — содержит четыре неспаренных электрона и поэтому парамагнитен. В комплексе [Ре(СМ)б] все электроны спарены. Поэтому этот комплексный ион диамагнитен. При помощи теории валентных связей можно предсказать реакционную способность комплексных соединений. Последняя в значительной степени определяется скоростью обмена лигандов комплекса на другие ионы или молекулы, находящиеся в растворе. Условия, благоприятствующие обмену лигандов, — внешняя гибридизация и наличие у комплексообразователя свободных внутренних -орбиталей. [c.45]
О появятся две электронные пары и неспаренных электронов в молекуле О2 не будет. Однако исследование магнитных свойств кислорода свидетельствует о том, что в молекуле О2 имеются два неспаренных электрона. Ряд исследователей предприняли попытки усовершенствовать метод валентных связей и сделать его пригодным для истолкования этих ф актов. Однако более плодотворным оказался другой подход к объяснению и расчету ковалентной связи, получивший название метода молекулярных орбиталей (сокращенное обозначение метод МО). Значительный вклад в его [c.99]
В табл. 6 собраны данные по энергиям связи, межъядерным расстояниям и магнитным свойствам двухатомных молекул II периода. Сделайте как [c.35]
Наличие у поверхностно-активных ингибиторов коррозии различных активных групп вызывает статические и динамические эффекты, определяющие дипольный момент, полярность и поляризуемость молекул в целом, их магнитные свойства [307]. [c.298]
Нарисуйте энергетическую диаграмму молекулы ВЫ. Определите порядок связи в молекуле. Молекула ВЫ обладает магнитными свойствами. Электроотрицательность атома М больше электроотрицательности атома В. [c.15]
Метод валентных связей дает теоретическое обоснование широко применяемым химиками структурным формулам. Большое достоинство метода заключается в его наглядности. Однако представление о локализованных (двухцентровых, двухэлектронных) химических связях оказывается слишком узким для объяснения многих экспериментальных фактов. В частности, метод валентных связей несостоятелен для описания молекул с нечетным числом электронов, большой группы молекул с дефицитом электронов, свойств соединений, синтезированных в последнее время. Большие трудности испытывает этот метод при объяснении магнитных свойств соединений, их окраски, энергетических характеристик молекул и многих других важных экспериментальных фактов. [c.83]
Нечетный электрон в молекуле СН так и остается неспаренным. Наличие у атома или молекулы одного или нескольких неспаренных электронов обусловливает физическое свойство, называемое парамагнетиз.чо.ч мы будем обсуждать его подробнее в следующей главе. Эксперимент показывает, что молекула СН парамагнитна, и это согласуется с наличием в ней неспаренного электрона, предсказываемым льюисовой структурой молекулы. Однако не все парамагнитные молекулы легко описать при помощи льюисовых структур. Молекулой с кратными связями и особенно труднообъяснимым (в рамках теории Льюиса) парамагнетизмом является О2, которая имеет в основном состоянии два неспаренных электрона и, следовательно, должна быть парамагнитной. Для объяснения таких магнитных свойств молекулярному кислороду пришлось бы приписать необычные структуры [c.470]
Назовите двухатомные молекулы. элементов I и И периодов, у которых а) отрыв элект1рона приводит к усилению связи, б) прибавление электрона приводит к ослаблению связи. Объясните причины. Нарисуйте энергетические диаграммы молекулярных ррбиталей ионов и молекул. Предскажите магнитные свойства ионов и молекул. [c.36]
Как меняются магнитные свойства двухатомных молекул элементов второго периода периодической системы, находящихся в газовой фазе [c.35]
Какими магнитными свойствами обладает молекула Ог а) диамагиитиа б) парамагнитна [c.62]
Постройте энергетические уровни молекулярных орбиталей молекулы бора Ва. Определите порядок связи. Молекула бора обладает магнитными свойствами. [c.14]
Остановимся на схеме заполнения электронами молекулярных орбиталей кислорода (рис. А.40). Мы видим, что оба электрона на орбитали 2pяg в соответствии с правилом Хунда имеют параллельные спины. Это является причиной парамагнетизма кислорода (магнитные свойства веществ см. в разд. 6.5.3), который с трудом поддается объяснению с помощью других теорий строения. Парамагнетизм N0 также легко понять, если рассмотреть заполнение его молекулярных орбиталей электронами. Естественно, для молекулы, составленной из разных атомов, атомные волновые функции вступают в линейную комбинацию с различным весом . Весовые коэффициенты С1 и сг в линейной комбинации [c.98]
Так

