Строение молекул | Открытые видеолекции учебных курсов МГУ
Курс «Строение молекул» читается студентам третьего курса химического факультета МГУ имени М. В. Ломоносова в 5 семестре.
В рамках курса рассматриваются следующие вопросы:
1. Квантово-механическая модель молекулы.
Гамильтониан и уравнение Шрёдингера для свободной молекулы. Адиабатическое приближение. Электронное волновое уравнение. Приближенные методы решения электронного волнового уравнения. Метод Хартри-Фока. Полуэмпирические методы решения электронного уравнения. Метод Хюккеля. Общие свойства симметрии молекулярных систем. Точечные группы симметрии молекул. Симметрия молекулярных орбиталей. Потенциальная поверхность. Приближенные методы решения ядерного волнового уравнения. Общий вид вращательного гамильтониана свободной молекулы. Электронно-колебательное взаимодействие. Эффекты Яна-Теллера. Электрические свойства молекул. Магнитные свойства молекул. Испускание, поглощение и рассеяние излучения. Дипольное приближение.
Дипольное приближение.
2. Электронно-колебательно-вращательные состояния молекул и переходы между ними.
Классификация состояний двух- и многоатомных молекул. Электронные, колебательные и вращательные состояния. Электронно-колебательно-вращательные спектры. Спектра комбинационного рассеяния. Правила отбора. Магнитно-резонансные методы исследования строения молекул.
3. Механическая модель молекулы.
Механическая модель молекулы. Примеры парных потенциалов взаимодействия атомов в молекулах. Межмолекулярные взаимодействия. Классификация типов взаимодействий. Молекулярная механика и молекулярная динамика.
Список всех тем лекций
Лекция 1. Молекулярная задача.
Принципы решения уравнения Шредингера для свободной молекулы в вакууме — общая и частная дифференциальные задачи и их физический смысл
Адиабатическое приближение
Приближение Борна -Оппенгеймера
Теорема Гельмана — Фейнмана и принцип соответствия.
Лекция 2.
Составляющие движения. Условия отделения поступательного движения от колебательного и вращательного. Условия Эккарта. Естественные (внутренние) переменные (координаты) Взаимодействие колебательного и вращательного взаимодействий. Тензор инерции, его диагонализация.
Лекция 3. Вращение молекул.
Основные результаты предыдущей лекции.
Вращательные постоянные.
Коммутационные соотношения операторов полного момента и его проекций в лабораторной и молекулярной системах координат.
Собственные значения операторов момента и вращательные состояния.
Лекция 4. Колебания молекул.
Выражение для энергии колебаний.
Упрощение колебательной задачи: матрицы кинематических коэффициентов и силовых постоянных.
Упрощение колебательной задачи: переход к нормальным координатам.
Нормальные координаты и нормальные колебания.
Формы нормальных колебаний.
Лекция 5. Ангармонизм и взаимодействие колебаний.
Применимость модели.
Решение уточненной задачи для небольшой молекулы (на примере воды) с далеко расположенными энергетическими уровнями.
Разложение энергии колебаний в ряд по степеням колебательного квантового числа. Резонансы (резонанс Ферми и др), связь резонансов с симметрией колебаний
Резонансы (резонанс Ферми и др), связь резонансов с симметрией колебаний
Лекция 6. Движения большой амплитуды.
Движения малых амплитуд — основные положения.
Опорная конфигурация.
Условие Сейвеца.
Задача о внутреннем вращении — зависимость потенциальной энергии от угла поворота.
Постоянная внутреннего вращения.
Решение задачи о внутреннем вращении: свободное вращение, крутильные колебания.
Заторможенное вращение.
Лекция 7. Электронно-колебательное взаимодействие.
Учет смещений ядер в электронной задаче.
Формы нормальных колебаний (на примере молекулы аммиака)
Симметрия произведения двух функций (на примере молекулы воды)
Анализ симметрии в случае невырожденного электронного состояния. Теорема Яна-Теллера.
Теорема Яна-Теллера.
Лекция 8. Молекулярные состояния.
Подведение итогов по пройденной части курса — самые главные результаты и приближения
Взаимодействие колебаний.
Вклад внутреннего вращения в состояние молекулярной системы.
Вращательные постоянные для разных молекул.
Постоянная колебательно-вращательного взаимодействия.
Влияние электронно-колебательных и электронно-вращательные взаимодействий на молекулярные состояния.
Лекция 9. Молекулы во внешнем электромагнитном поле.
Временное уравнение для описания состояния системы при воздействии внешнего поля.
Решение временного уравнения с помощью теории возмущений.
Лекция 10. Вероятности излучательных переходов.
Оператор Гамильтона системы заряженных частиц в поле внешней электромагнитной волны.
Свойства излучения, рассматриваемого в задаче о молекуле в поле.
Коэффициенты перехода (первый порядок теории возмущений) — поглощение и испускание.
Дипольное приближение.
Система в постоянном однородном электрическом поле — дипольный момент и поляризуемость.
Лекция 11. Правила отбора в спектрах поглощения.
Волновые функции в интеграле, определяющем правила отбора.
Частные правила отбора.
Фактор Франка-Кондона. Правила отбора для колебательных переходов в неизменных электронных состояниях.
Правила отбора для чисто вращательных переходов.
Правила отбора для колебательных переходов в неизменных электронных состояниях.
Правила отбора для чисто вращательных переходов.
Лекция 12. Колебательные спектры поглощения.
Что такое правила отбора — основные результаты предыдущей лекции.
Колебательная функция и колебательные энергии.
Условия колебательного перехода.
Вращательная структура колебательных полос в спектре.
Обертоны.
Колебательно — вращательный спектр двухатомной молекулы, сферического волчка.
Лекция 13. Взаимодействие молекул с электромагнитным полем: процессы второго порядка; рассеяние.
 Поле волны.
Полное выражение для коэффициента вероятности перехода во втором порядке теории возмущений..
Вероятность процессов рассеяния.
Поле волны.
Полное выражение для коэффициента вероятности перехода во втором порядке теории возмущений..
Вероятность процессов рассеяния. Лекция 14. Спектры рассеяния в сравнении со спектрами поглощения.
Сравнение выражений для вероятностей перехода при рассеянии и поглощении.
Рассеяние и поглощение: электронные переходы.
Рассеяние и поглощение: колебательные переходы.
Типы колебаний, наблюдаемых в спектрах поглощения и рассеяния (на примерах молекул водорода, хлороводорода, метана).
Рассеяние и поглощение: вращательные переходы.
Лекция 15. Состояния молекул в магнитных полях.
Оператор орбитального магнитного момента. Магнетон Бора, ядерный магнетон, гиромагнитное отношение ядра.
Эффект Зеемана.
Константы спин-спинового взаимодействия ядер и электронов, сверхтонкого взаимодействия.
Магнетон Бора, ядерный магнетон, гиромагнитное отношение ядра.
Эффект Зеемана.
Константы спин-спинового взаимодействия ядер и электронов, сверхтонкого взаимодействия.
Лекция 16. Электронный парамагнитный резонанс и ядерный магнитный резонанс.
Константа экранирования.
Фундаментальное различие электронного и ядерного магнитного резонанса.
Состояния модельных систем для изучения электронных и ядерных состояний — энергии и собственные функции.
Энергии переходов, мультиплетность сигналов в спектре ЭПР.
Мультиплетность сигналов в спектрах ЯМР.
Реальная структура сигнала ЯМР.
Алгоритм физиков способен предсказать оптические свойства молекул
5 марта, 2018 11:44
Источник: Пресс-служба ТГУ
Ученые кафедры оптики и спектроскопии физического факультета ТГУ с коллегами из Швеции и Финляндии создали алгоритм для расчета фотофизических и люминесцентных характеристик молекул. Благодаря этому алгоритму можно вычислять оптические, люминесцентные (светимость, квантовый выход флуоресценции) свойства молекул и веществ с использованием высокоточных методов квантовой химии. Результаты опубликованы в журнале королевского химического общества Physical Chemistry Chemical Physics.
Благодаря этому алгоритму можно вычислять оптические, люминесцентные (светимость, квантовый выход флуоресценции) свойства молекул и веществ с использованием высокоточных методов квантовой химии. Результаты опубликованы в журнале королевского химического общества Physical Chemistry Chemical Physics.
– С помощью этого алгоритма мы можем предсказывать свойства молекул и веществ на компьютере, и это намного дешевле, чем закупать оборудование для их синтеза и измерения их свойств, – рассказывает один из авторов исследования, доцент ФФ ТГУ Рашид Валиев. – Это дает доступный инструмент для анализа и предсказания. А уже на основе нашего предсказания можно синтезировать более конкретные запросы и с желаемыми свойствами в различных областях. Сейчас в рамках другого проекта мы, например, планируем исследования по научному предсказанию свойств лекарств народной медицины.

В коллектив ученых, создавших алгоритм, также вошли Виктор Черепанов (ТГУ), Глеб Барышников (ТГУ и Королевский Технологический Университет, Швеция) и Даге Сундхольм (Университет Хельсинки, Финляндия). Для расчетов они использовали фотофизическую теорию и модель Биксона-Джортнера, в качестве инструмента вычисления необходимых величин – современные неэмпирические методы квантовой химии без подгоночных экспериментальных коэффициентов. Таким образом получилось предсказывать свойства органических и металлорганических молекул, не синтезируя их предварительно.
Алгоритм позволит разрабатывать дизайн молекул и веществ, на основе которых в дальнейшем могут быть созданы оптические устройства подобно органическим светодиодам, лазерам. Все исследования ученые вели в рамках проекта РНФ «Новые электролюминесцентные материалы для создания высокоэффективных органических светодиодов (OLEDs)». Руководитель проекта – Рашид Валиев.
Органические светоизлучающие диоды (Organic Light-Emitting Diode – OLEDs) являются более дешевой и экологически безопасной альтернативой традиционным неорганическим источникам света.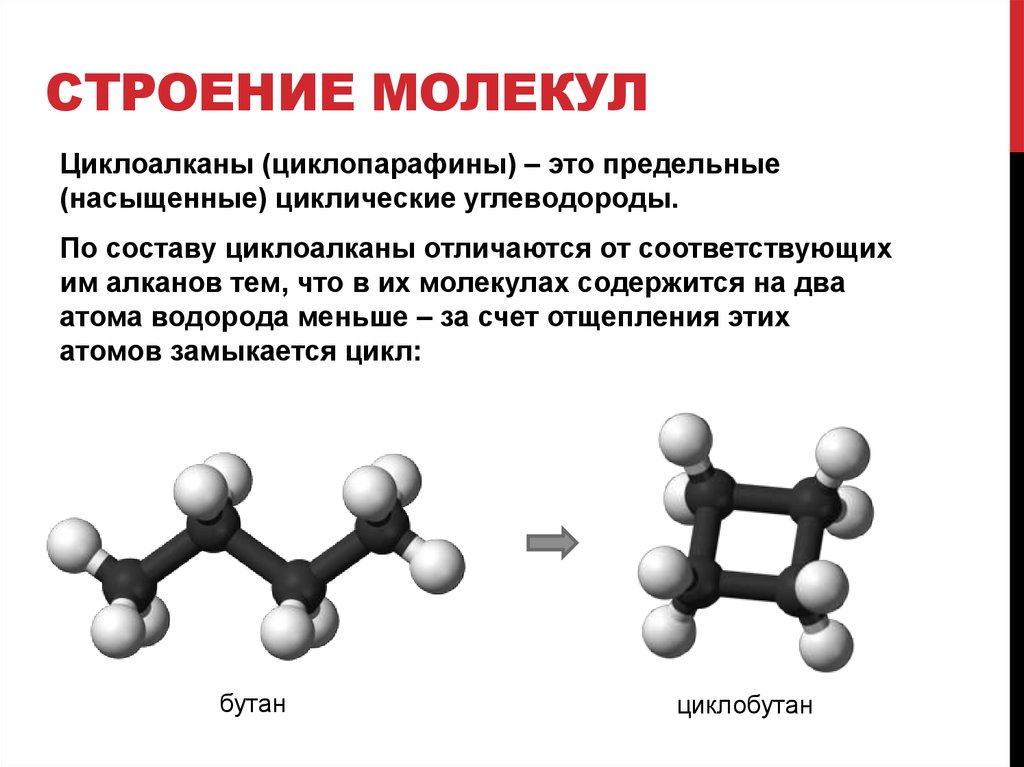 Сравнительно проще и процесс изготовления OLEDs. Органические светодиоды имеют преимущество перед обычными лампами накаливания, так как работают при низкой мощности питания и при этом обладают высокой эффективностью. Они излучают свет и практически не нагреваются, более того, позволяют освещать намного большую поверхность по сравнению с лампами накаливания благодаря контролируемой направленности излучения.
Сравнительно проще и процесс изготовления OLEDs. Органические светодиоды имеют преимущество перед обычными лампами накаливания, так как работают при низкой мощности питания и при этом обладают высокой эффективностью. Они излучают свет и практически не нагреваются, более того, позволяют освещать намного большую поверхность по сравнению с лампами накаливания благодаря контролируемой направленности излучения.
В качестве апробации алгоритма ученые вычислили оптические характеристики известных и важных молекул, которые используются в технологии OLEDs (Alq3, Ir(ppy)3, гетеро[8]циркулены), в фотодинамической терапии (псорален), в лазерной технологии (PM567), в различных приложениях нанотехнологий (полиацены и порфирины).
В настоящее время с помощью этого алгоритма коллектив исследует люминесцентные свойства производных карбазола, гетеро[8]циркуленов, чтобы получить рецепт создания высокоэффективных OLEDs-устройств на базе этих соединений.
Добавим, что по итогам 2017 года Рашид Валиевбыл признан «Молодым ученым года» ТГУ – за активную научно-исследовательскую работу и публикации в журналах с высоким импакт-фактором.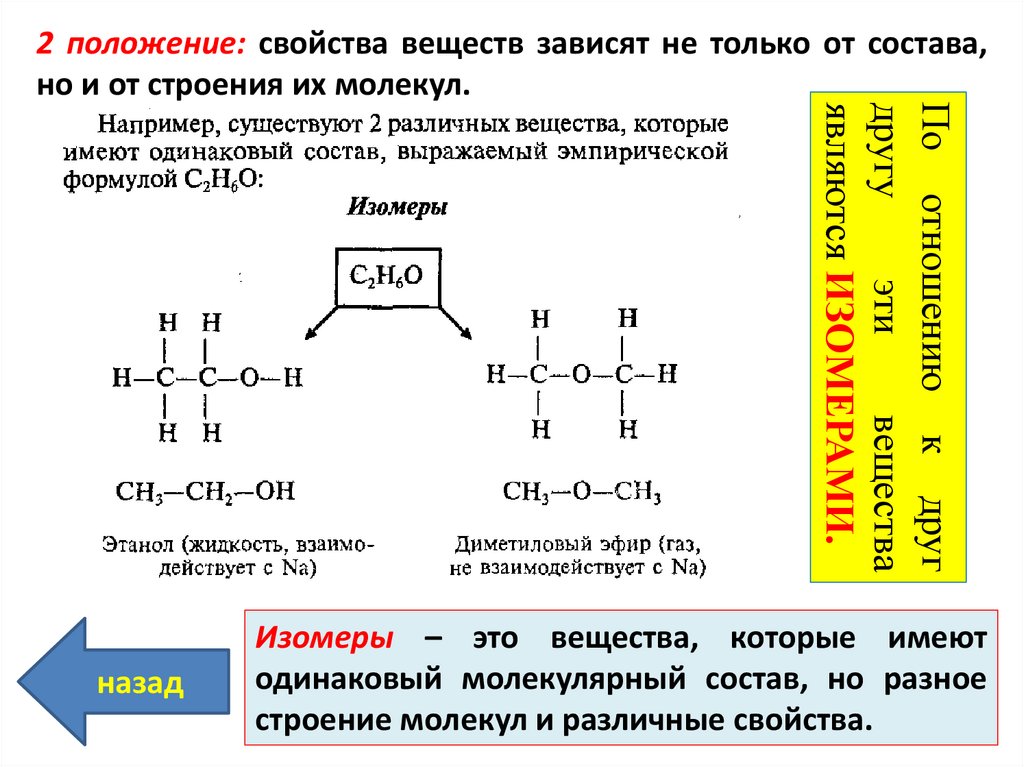 Среди его работ – исследования о химических процессах в экзосферах Луны и Меркурия, открытие нового вида редких молекул, свойствами которых можно управлять путем изменения индукции внешнего магнитного поля, расчеты параметров новых апконверсных наночастиц.
Среди его работ – исследования о химических процессах в экзосферах Луны и Меркурия, открытие нового вида редких молекул, свойствами которых можно управлять путем изменения индукции внешнего магнитного поля, расчеты параметров новых апконверсных наночастиц.
– Мы все состоим из молекул, и в основе всего заложена физика, даже в химии и биологии. В основном моя работа происходит на стыке трех наук – физики, химии и биологии. Еще рядом астрономия, а конкретно, астрохимия. Открытия и достижения сейчас делаются на стыке наук, а не в узкой специализированной области; любая наука развивается в коллаборации, – объясняет Рашид широкий спектр своих научных работ.
Теги
СМИ о Фонде, Президентская программа, Химия и материалы, Молодежные группы
Атомные и молекулярные свойства — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1493
Атомные и молекулярные свойства — это внутренние характеристики, связанные с системой на атомном и субатомном уровне.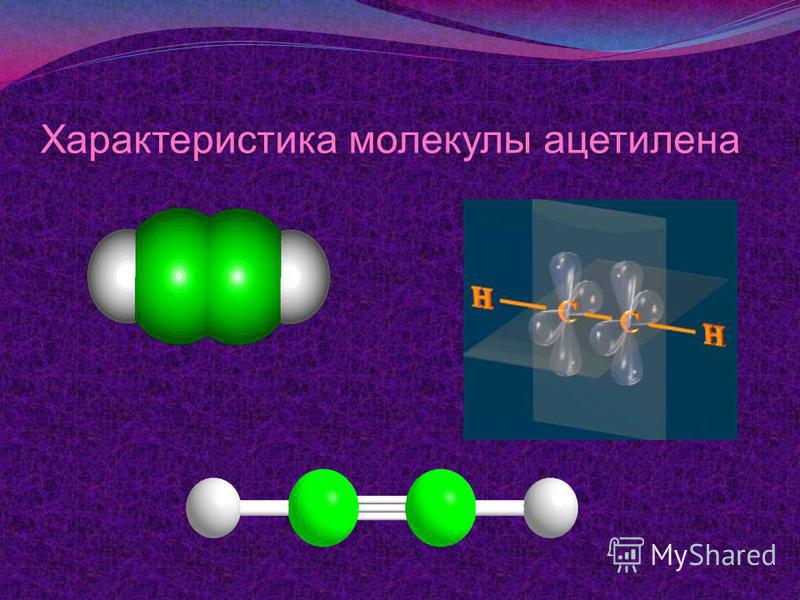
- Атомный и ионный радиусы
- На этой странице объясняются различные меры атомного радиуса, а затем рассматривается, как он меняется в периодической таблице — по периодам и группам вниз. Предполагается, что вы понимаете электронные структуры простых атомов, записанных в нотации s, p, d.
- Атомные радиусы
- Атомные радиусы полезны для определения многих аспектов химии, таких как различные физические и химические свойства. Периодическая таблица очень помогает в определении атомного радиуса и представляет ряд тенденций.
- Дипольные моменты
- Дипольные моменты возникают при разделении зарядов. Они могут возникать между двумя ионами в ионной связи или между атомами в ковалентной связи; дипольные моменты возникают из-за различий в электроотрицательности. Чем больше разница в электроотрицательности, тем больше дипольный момент.
 Расстояние между разделением зарядов также является решающим фактором в размере дипольного момента. Дипольный момент является мерой полярности молекулы.
Расстояние между разделением зарядов также является решающим фактором в размере дипольного момента. Дипольный момент является мерой полярности молекулы.
- Электроотрицательность
- Электроотрицательность – это мера тенденции атома притягивать связывающую пару электронов. Наиболее часто используется шкала Полинга. Фтору (наиболее электроотрицательному элементу) присвоено значение 4,0, а значения варьируются до цезия и франция, которые являются наименее электроотрицательными (0,7).
- Электроотрицательность Оллреда-Рохова
- Электроотрицательность Малликена
- Электроотрицательность Полинга
- Сродство к электрону
- Сродство к электрону определяется как изменение энергии (в кДж/моль) нейтрального атома (в газовой фазе), когда электрон присоединяется к атому с образованием отрицательного иона . Другими словами, вероятность нейтрального атома получить электрон.

- Формальные заряды
- Знание формальных зарядов определенных атомов в молекуле является важным шагом в сохранении пути электронов и определении химической активности молекулы. Формальные расходы можно рассчитать математически, но их можно определить и интуитивно. Инстинктивный метод быстрее, но требует больше навыков и знаний об общих структурах.
- Формальный заряд
- Межмолекулярные силы
- Межмолекулярные силы — это силы притяжения или отталкивания между молекулами. Они разделены на две группы; короткодействующие и дальнодействующие силы. Короткодействующие силы возникают, когда центры молекул разделены тремя ангстремами (10-8 см) или меньше. Силы ближнего действия имеют тенденцию быть отталкивающими, в то время как силы дальнего действия, действующие вне диапазона трех ангстрем, являются привлекательными. Силы дальнего действия также известны как силы Ван-дер-Ваальса.
 Они отвечают за поверхностное натяжение, трение,
Они отвечают за поверхностное натяжение, трение, - водородные связывания
- Гидрофобные связи
- Гидрод-связь I
- Гидрофобные взаимодействия
- МЛИПОЛОЛЬ ЭКСПАСНАЯ
- Обзор межмолевых сил
- Специфические взаимодействия
- Диполевые межобороты 9003 9003 9003 Dipole Dipole-Dipole-Dipole Interactions. Связывание
- Ионно-индуцированные дипольные взаимодействия
- Ионно-ионные взаимодействия
- Потенциал Леннарда-Джонса
- Лондонские дисперсионные взаимодействия
- Поляризуемость
- Ван Дер Ваальс. атом в основном электронном состоянии должен поглотить, чтобы разрядить электрон, в результате чего образуется катион.
- Разложение стандартного восстановительного потенциала
- Энергии ионизации
- Структуры Льюиса
- Структура Льюиса представляет собой очень упрощенное представление электронов валентной оболочки в молекуле.
 Он используется, чтобы показать, как электроны расположены вокруг отдельных атомов в молекуле. Электроны показаны как «точки» или связывающие электроны как линия между двумя атомами. Цель состоит в том, чтобы получить «лучшую» электронную конфигурацию, т. е. необходимо соблюдать правило октетов и формальные заряды.
Он используется, чтобы показать, как электроны расположены вокруг отдельных атомов в молекуле. Электроны показаны как «точки» или связывающие электроны как линия между двумя атомами. Цель состоит в том, чтобы получить «лучшую» электронную конфигурацию, т. е. необходимо соблюдать правило октетов и формальные заряды. - Структуры Льюиса: резонанс
- Магнитные свойства
- Все, что является магнитным, например стержневой магнит или петля электрического тока, обладает магнитным моментом. Магнитный момент является векторной величиной, имеющей величину и направление. Электрон обладает магнитным дипольным моментом электрона, создаваемым собственным свойством вращения электрона, что делает его движущимся электрическим зарядом. Существует множество различных магнитных форм: в том числе парамагнетизм и диамагнетизм, ферромагнетизм и антиферромагнетизм. Здесь обсуждаются только парамагнетизм и диамагнетизм.
- Молекулярная полярность
- Полярность — это физическое свойство соединений, которое связано с другими физическими свойствами, такими как температуры плавления и кипения, растворимость и межмолекулярные взаимодействия между молекулами.
 По большей части существует прямая корреляция между полярностью молекулы и количеством и типами присутствующих полярных или неполярных ковалентных связей. В некоторых случаях молекула может иметь полярные связи, но в симметричном расположении, которое затем приводит к неполярной молекуле, такой как двуокись углерода.
По большей части существует прямая корреляция между полярностью молекулы и количеством и типами присутствующих полярных или неполярных ковалентных связей. В некоторых случаях молекула может иметь полярные связи, но в симметричном расположении, которое затем приводит к неполярной молекуле, такой как двуокись углерода.
- Поляризуемость
- Теперь, пересмотрев основы тенденций по Периодической таблице и вниз, мы можем использовать концепции эффективного заряда ядер и электроотрицательности для обсуждения факторов, влияющих на типы связей, образованных между элементами.
Миниатюра: pixabay.com/illustrations/mo…ry-3d-1818492/
Atomic and Molecular Properties распространяется по незадекларированной лицензии и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Показать страницу TOC
- № на стр.

- Теги
Свойства молекулы | Определение, типы и структура
Вы студент-химик? Посетите сайт A-Level Chemistry, чтобы загрузить исчерпывающие материалы для повторения — для студентов из Великобритании и других стран!
Молекула
Определение
А молекула – это мельчайшая частица чистого вещества, которая может существовать независимо. Его можно разделить, но сохранить свой состав и химический состав. свойства этого вещества.
Когда атомы соединяются, образуя ковалентные связи, тогда совокупность атомов называется молекула. Его также называют простейшей единицей ковалентного соединения [1].
Пояснение
Это
может содержать более одного числа атомов. Количество атомов, присутствующих в
молекулы определяют ее атомность. Таким образом, молекулы могут быть одноатомными, двухатомными
и трехатомные, если они содержат соответственно один, два и три атома. Молекулы
элемента может содержать один, два или более атомов одного типа, таких как He, Cl 2 ,
O 3, P 4 , S 8. С другой стороны, молекулы
соединения состоят из различных типов атомов. Например, HCl, NH 3, H 2 SO 4 ,
С 6, Н 12 О 6 .
Количество атомов, присутствующих в
молекулы определяют ее атомность. Таким образом, молекулы могут быть одноатомными, двухатомными
и трехатомные, если они содержат соответственно один, два и три атома. Молекулы
элемента может содержать один, два или более атомов одного типа, таких как He, Cl 2 ,
O 3, P 4 , S 8. С другой стороны, молекулы
соединения состоят из различных типов атомов. Например, HCl, NH 3, H 2 SO 4 ,
С 6, Н 12 О 6 .
размер молекул больше атомов. Размер зависит от количества атомов настоящее и их формы. Некоторые молекулы настолько велики, что их называют макромолекулы, такие как гемоглобин, присутствующие в крови. Он помогает переносить кислород из легких ко всем частям нашего тела. Каждая молекула состоит примерно из 10 000 атомов и в 68 000 раз тяжелее водорода.
Типы молекул
На
со структурной точки зрения молекула состоит из атомов, которые удерживаются
вместе через силу валентности. Существуют различные типы молекул:
Существуют различные типы молекул:
Двухатомная молекула:
молекулы, состоящие из двух атомов и химически связанные друг с другом. Если два атома одинаковы или идентичны, как кислород O 2 , они известны как гомоядерная двухатомная молекула, но если атомы не идентичны, как углерод монооксид СО тогда называли гетероядерной двухатомной молекулой.
Многоатомная молекула
молекулы, содержащие более двух атомов, называются многоатомными. Например, двуокись углерода CO 2 .
Макромолекула
Это представляет собой большую молекулу, подобную белку, полученную путем полимеризации более мелких субъединиц. Они состоят из тысяч атомов или более.
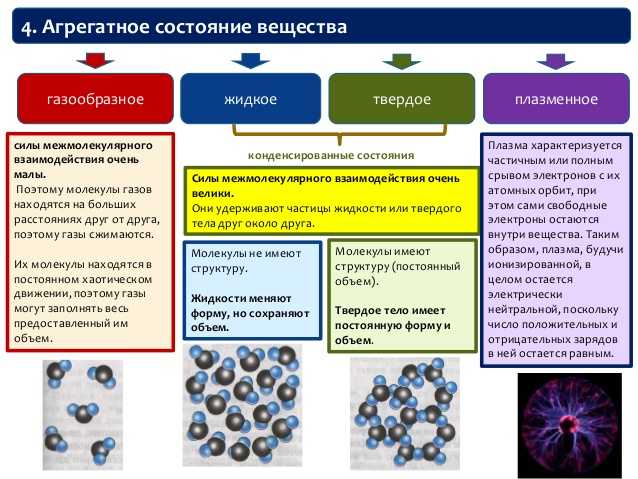
Свойства
Физические свойства молекул зависят от сил межмолекулярного притяжения. Это следующие свойства:
1. Температуры плавления и кипения
Молекулярная
такие соединения, как жидкости и газы, имеют низкую температуру плавления и кипения, потому что
их атомы связаны ковалентной связью, которая может отделяться друг от друга при
к ним прикладывается небольшое количество энергии.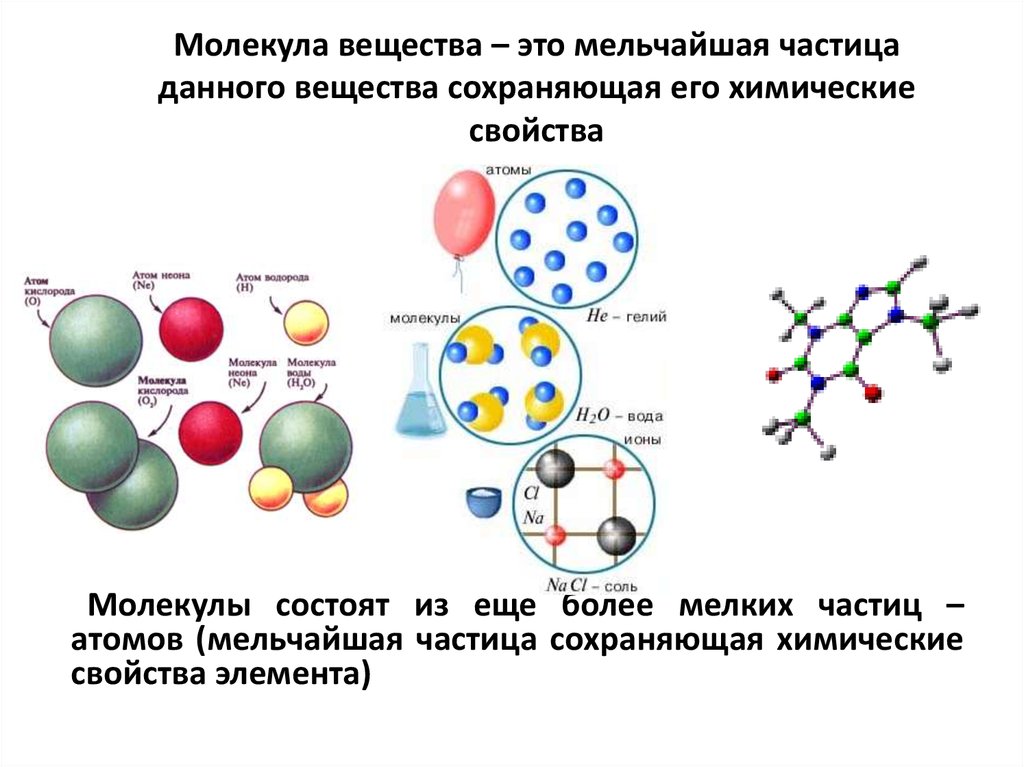 Температура плавления и кипения зависит
силой межмолекулярных сил. Большие молекулы имеют больше ван-дер-
Ваальсова сила притяжения, поэтому для разрыва им требовалось больше энергии [2].
Температура плавления и кипения зависит
силой межмолекулярных сил. Большие молекулы имеют больше ван-дер-
Ваальсова сила притяжения, поэтому для разрыва им требовалось больше энергии [2].
2. Растворимость
Молекулярный соединения нерастворимы или иногда малорастворимы в воде, они обычно реагируют и образуют с ними водородные связи. Метан растворим в воде, потому что он это газ и более слабые силы Ван-дер-Ваальса, поэтому выделяется небольшое количество энергии как результат. Аммиак также обладает способностью образовывать водородные связи. Когда аммиак реагирует с водой, образуя ионы аммония и гидроксид-ионы. вещества хорошо растворимыми в воде являются этанол и сахароза. Некоторые молекулярные соединения растворимы в органическом растворителе. И растворенное вещество, и растворитель притягиваются друг друга силами Ван-дер-Ваальса.
3. Электропроводность
Молекулярная
соединения не диссоциируют на ионы, а растворяются в молекулы, т. не проводят электричество [3]. Электроны делокализованы внутри молекулы, т.
недостаточной связи между молекулами являются электроны, которые позволяют им
свободно перемещаться во всем твердом теле или жидкости.
не проводят электричество [3]. Электроны делокализованы внутри молекулы, т.
недостаточной связи между молекулами являются электроны, которые позволяют им
свободно перемещаться во всем твердом теле или жидкости.
Структура молекул
структурная химия молекул связана с валентной оболочкой электронов, он определяет, как атомы объединяются вместе в правильных соотношениях. это также связаны с типом связи, направлением и ее длиной. Свойства связаны со структурой, как вода имеет водородные связи и изгибается структуры, однако дипольный момент диоксида углерода отсутствует, поэтому он имеет линейную структура. Но некоторые молекулы, такие как этан (H 3 CCH 3 ) есть свободное вращение вокруг углерод-углеродной одинарной связи, они не могут быть жесткими в структура [4].
В
в молекуле положение ядра определяется микроволновыми колебаниями
спектры вращения или дифракцию нейтронов. Молекулярная структура найдена
теоретически путем решения квантово-механического уравнения для движения
электроны. Численно это можно выяснить с помощью уравнения Шредингера, которое
является высокоразвитым процессом использования компьютеров и суперкомпьютеров.
Численно это можно выяснить с помощью уравнения Шредингера, которое
является высокоразвитым процессом использования компьютеров и суперкомпьютеров.
Теория VSPER (отталкивание пар электронов валентной оболочки) определила геометрию молекул, а также геометрию электронной группы. Эта теория определяет, что пары электронов отталкиваются друг от друга, либо они находятся в паре связей, либо в одиночной паре, поэтому пары электронов распространяются до отталкивания. Он также фокусируется на электронной группе, которая может быть двойной связью или тройной связью на центральном атоме, электронной паре, одиночной паре. Через пару связей теория VSPER предсказывает форму молекулы.
Форма молекулы определяется расположением ядер и ее электрона. Они минимизируют отталкивание и усиливают притяжение. Таким образом, форма молекулы показывает ее равновесное состояние. Он также предсказывает распределение электрона. Это также зависит от пространственной ориентации ковалентных связей с атомами и наличия двух или более партнеров по связыванию.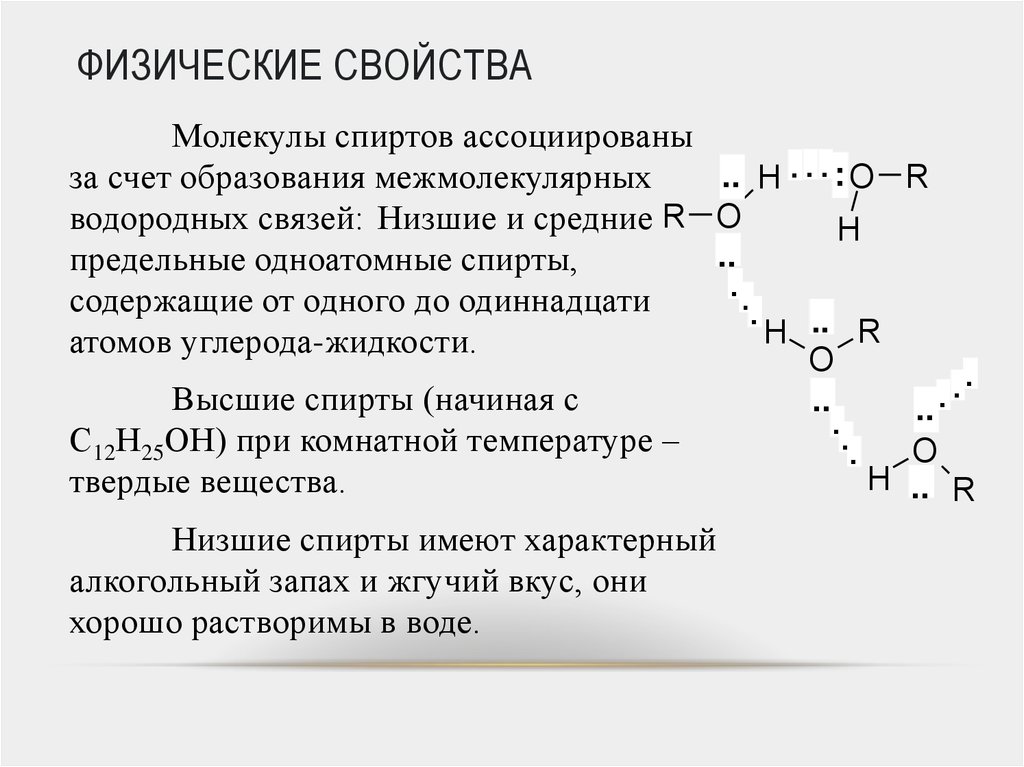 Конфигурация молекулы трехмерна. Связь углерода очень легко запомнить O=C=O.
Конфигурация молекулы трехмерна. Связь углерода очень легко запомнить O=C=O.
Молекула, которая имеет одну или несколько ковалентных связей, которые являются полярными, поэтому они имеют дипольный момент из-за накопления диполей связи. В O-H ковалентная связь полярна из-за разницы в электроотрицательности кислорода и водорода.
Молекулярная масса представляет собой сумму атомных масс ее компонентов, молекулярная масса называется моль. Его можно определить с помощью масс-спектрометрии и некоторых методов, основанных на явлениях термодинамики или кинетического переноса.
Отдельные примеры
Йод (I 2 )
Он
представляет собой темно-серое кристаллическое твердое вещество. Его температура плавления составляет 114 o C и
температура кипения 184 o С. Йод очень мало растворим в воде, но
легко растворяются в органических растворителях. Его структура определяется как гранецентрированная.
кубическая, в центре каждой грани прикреплена еще одна молекула йода. Ориентацию со структурой очень сложно нарисовать. Расстояние между
центры атомов в кристалле показывают два разных значения, атомы, которые
находятся на более коротком расстоянии, имеют ковалентную связь, а те, которые находятся на большем
расстояние имеет ван-дер-ваальсову силу притяжения, намного слабее по сравнению с
другая сила притяжения.
Ориентацию со структурой очень сложно нарисовать. Расстояние между
центры атомов в кристалле показывают два разных значения, атомы, которые
находятся на более коротком расстоянии, имеют ковалентную связь, а те, которые находятся на большем
расстояние имеет ван-дер-ваальсову силу притяжения, намного слабее по сравнению с
другая сила притяжения.
Лед
Лед
молекулы могут быть расположены по-разному, это хороший пример водорода
связанное твердое тело. Огромное количество молекул расположены в трех измерениях. в
на диаграмме водородные связи представлены прямыми линиями, а неподеленные пары
прикреплен с левой стороны. Лед в кубической форме устойчив при температуре ниже -80 o C. Лед в форме шестиугольника под названием «лёд слева». Есть большое количество
пустого пространства между молекулами в структуре, поэтому, когда лед тает
молекулы помещаются в пустые места. Большая часть твердого вещества будет увеличиваться в объеме на
тает, но лед ведет себя в этом отношении очень необычно. Противоположный
ситуация произошла, когда вода замерзает, структура водородных связей расширяется, но
ликвидный контракт на заморозку.
Противоположный
ситуация произошла, когда вода замерзает, структура водородных связей расширяется, но
ликвидный контракт на заморозку.
Плотность воды увеличивается от 0 o C до 4 o C Молекулы освобождаются от открытой структуры и занимают меньше места. Но после 4 o С плотность падает из-за движения молекул [5].
Полимеры
Связывание в полимерах
Полимеры состоят из молекул с очень длинной цепью, таких как полиэтилен, который также называют полиэтилен. Они состоят из длинных цепочек молекул этана, в которых атомы водорода и углерода связаны ковалентно. Вместе с основной цепью короткой также присутствуют ответвления, углеродная цепь с присоединенным водородом.
Это также содержат еще две отдельные ветви, контролируя условия, в которых этан полимеризуется.
Полиэтилен высокой плотности
It
имеет очень мало ответвлений, поэтому молекулы располагаются очень близко друг к другу
как хрусталь.


 Расстояние между разделением зарядов также является решающим фактором в размере дипольного момента. Дипольный момент является мерой полярности молекулы.
Расстояние между разделением зарядов также является решающим фактором в размере дипольного момента. Дипольный момент является мерой полярности молекулы.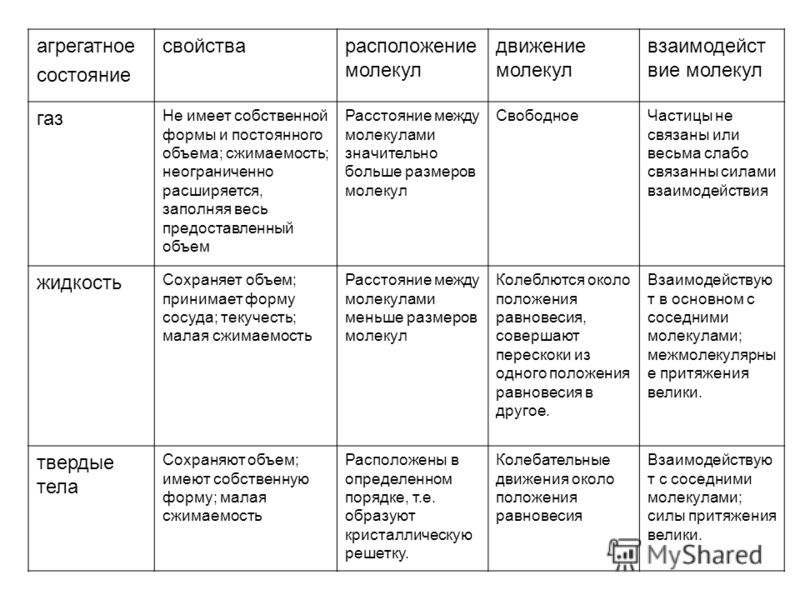
 Они отвечают за поверхностное натяжение, трение,
Они отвечают за поверхностное натяжение, трение, Он используется, чтобы показать, как электроны расположены вокруг отдельных атомов в молекуле. Электроны показаны как «точки» или связывающие электроны как линия между двумя атомами. Цель состоит в том, чтобы получить «лучшую» электронную конфигурацию, т. е. необходимо соблюдать правило октетов и формальные заряды.
Он используется, чтобы показать, как электроны расположены вокруг отдельных атомов в молекуле. Электроны показаны как «точки» или связывающие электроны как линия между двумя атомами. Цель состоит в том, чтобы получить «лучшую» электронную конфигурацию, т. е. необходимо соблюдать правило октетов и формальные заряды. По большей части существует прямая корреляция между полярностью молекулы и количеством и типами присутствующих полярных или неполярных ковалентных связей. В некоторых случаях молекула может иметь полярные связи, но в симметричном расположении, которое затем приводит к неполярной молекуле, такой как двуокись углерода.
По большей части существует прямая корреляция между полярностью молекулы и количеством и типами присутствующих полярных или неполярных ковалентных связей. В некоторых случаях молекула может иметь полярные связи, но в симметричном расположении, которое затем приводит к неполярной молекуле, такой как двуокись углерода.