2.3 Пространственная структура молекул — ЗФТШ, МФТИ
Одним из важнейших свойств ковалентной связи является её направленность. Она определяет пространственную структуру молекул. Если в молекуле имеется больше одной ковалентной связи, то двухэлектронные облака связей вступают во взаимодействие друг с другом. Представляя собой заряды одного знака, они отталкиваются друг от друга, стремясь занять такое положение в пространстве, когда их взаимное отталкивание будет минимальным. Если в первом приближении считать отталкивание всех облаков одинаковым, то в зависимости от числа взаимодействующих облаков (связей) наиболее выгодным расположением будет:
для `2` облаков — линейное расположение,
для `3` облаков — плоский треугольник,
для `4` облаков — тетраэдр,
для `5` облаков — тригональная бипирамида,
для `6` облаков — октаэдр.
Это наиболее распространенные геометрические формы многоатомных молекул (рис. 8).
Часто в образовании связей участвуют различные электроны, например `s` и `p`—электроны. Казалось бы, образующиеся связи тоже должны быть неравноценными. Однако опыт показывает, что все связи одинаковы. Теоретическое обоснование этого факта было предложено Слейтером и Полингом, которые ввели понятие гибридизации атомных орбиталей. Они показали, что при участии в образовании связей нескольких различных орбиталей, незначительно отличающихся по энергии, можно заменить их тем же количеством одинаковых орбиталей, называемых гибридными. При этом орбитали смешиваются и выравниваются по энергии. Изменяется и первона-чальная форма электронных облаков: гибридные орбитали асимметричны и сильно вытянуты по одну сторону от ядра.
Казалось бы, образующиеся связи тоже должны быть неравноценными. Однако опыт показывает, что все связи одинаковы. Теоретическое обоснование этого факта было предложено Слейтером и Полингом, которые ввели понятие гибридизации атомных орбиталей. Они показали, что при участии в образовании связей нескольких различных орбиталей, незначительно отличающихся по энергии, можно заменить их тем же количеством одинаковых орбиталей, называемых гибридными. При этом орбитали смешиваются и выравниваются по энергии. Изменяется и первона-чальная форма электронных облаков: гибридные орбитали асимметричны и сильно вытянуты по одну сторону от ядра.
Если гибридизуются две орбитали — `s`- и `p`- — тип гибридизации так и называется: `sp`-гибридизация. Он реализуется, например, в молекуле $$ {\mathrm{BeCl}}_{2}$$:
В этом соединении атому бериллия нужно образовать две связи с атомами хлора. Он переходит в возбужденное состояние и его электронная пара, находящаяся на `2s`-орбитали, распаривается:
Орбитали, занятые валентными электронами, гибридизуются по типу `sp`-гибридизации, в результате чего изменяется их первоначальная форма, они становятся одинаковыми как по форме, так и по энергии, и в таком состоянии способны образовывать более прочные связи за счёт наиболее полного перекрывания с `p`-орбиталями атомов хлора:
Таким образом, геометрия этой молекулы — линейная, валентный угол связи `180^@`. {2}$$-гибридизация формирует октаэдрическую структуру молекулы.
{2}$$-гибридизация формирует октаэдрическую структуру молекулы.
Строение молекулы – физические и химические свойства, определение (физика, 7 класс)
4.1
Средняя оценка: 4.1
Всего получено оценок: 115.
Обновлено 30 Июля, 2021
4.1
Средняя оценка: 4.1
Всего получено оценок: 115.
Обновлено 30 Июля, 2021
Идея о том, что всё вещество состоит из мельчайших частиц и не делится бесконечно, высказывалась ещё в античности. Однако строгое доказательство существования мельчайших частиц вещества — молекул — было получено лишь в середине XIX в. Тогда же было установлено и сложное строение молекулы. Рассмотрим эту тему более подробно, дадим определение молекулы и атома.
Атомы и молекулы
Из курса физики 7 класса известно, что все тела состоят из молекул. Молекула является наименьшей частью вещества, определяющей его физические и химические свойства. Все огромное разнообразие веществ в природе — это следствие огромного числа различных видов молекул.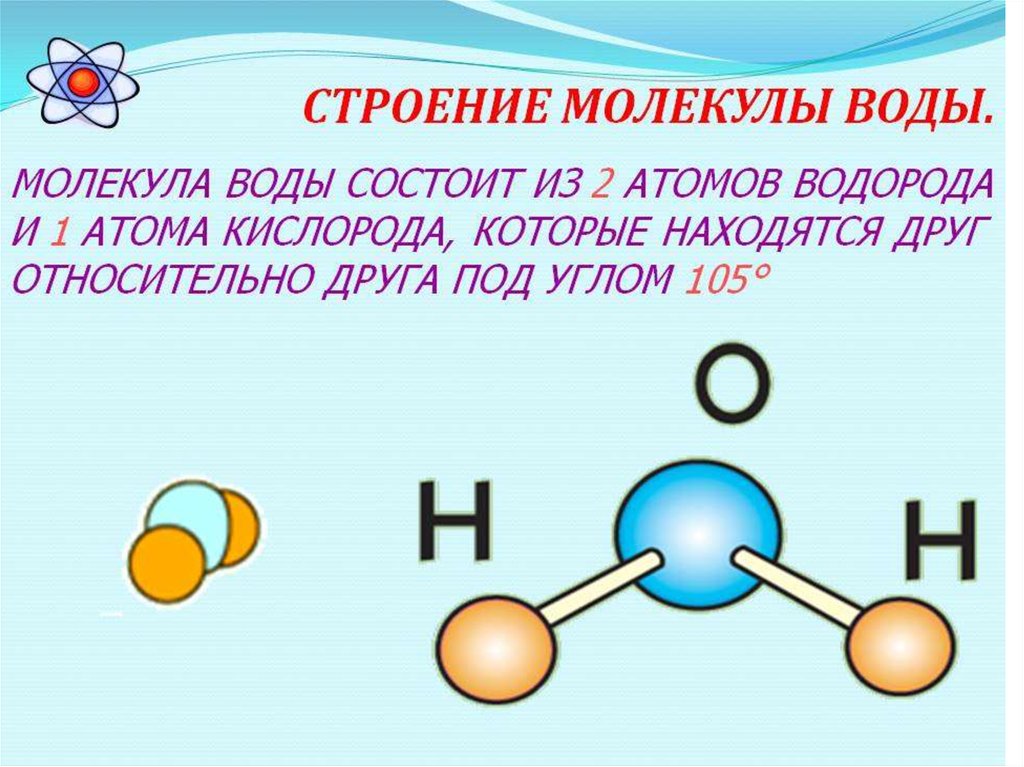
Но молекула не является наименьшей частью вещества. Химические превращения веществ (а значит, и молекул) доказывают, что молекулы имеют сложное строение. Большинство молекул могут быть разложены или синтезированы с помощью химических воздействий.
Мельчайшая частица вещества, которая не может быть разложена с помощью любых химических воздействий, называется атомом. Каждая молекула состоит из одного и более атомов. Все молекулы одного вещества имеют одинаковый состав и строение.
В отличие от многих миллионов видов молекул, число видов атомов в природе невелико. К середине XIX в. их было известно менее сотни. К настоящему времени в природе было найдено 94 элемента, и ещё 24 синтезированы искусственно.
Рис. 1. Атомы и молекулы.Строение молекулы
 Большая часть молекул состоит из нескольких атомов, при этом атомы могут быть одинаковы, такими, к примеру, являются двухатомные молекулы кислорода, азота, многих других газов. Но чаще каждая молекула состоит из атомов различных видов (элементов).
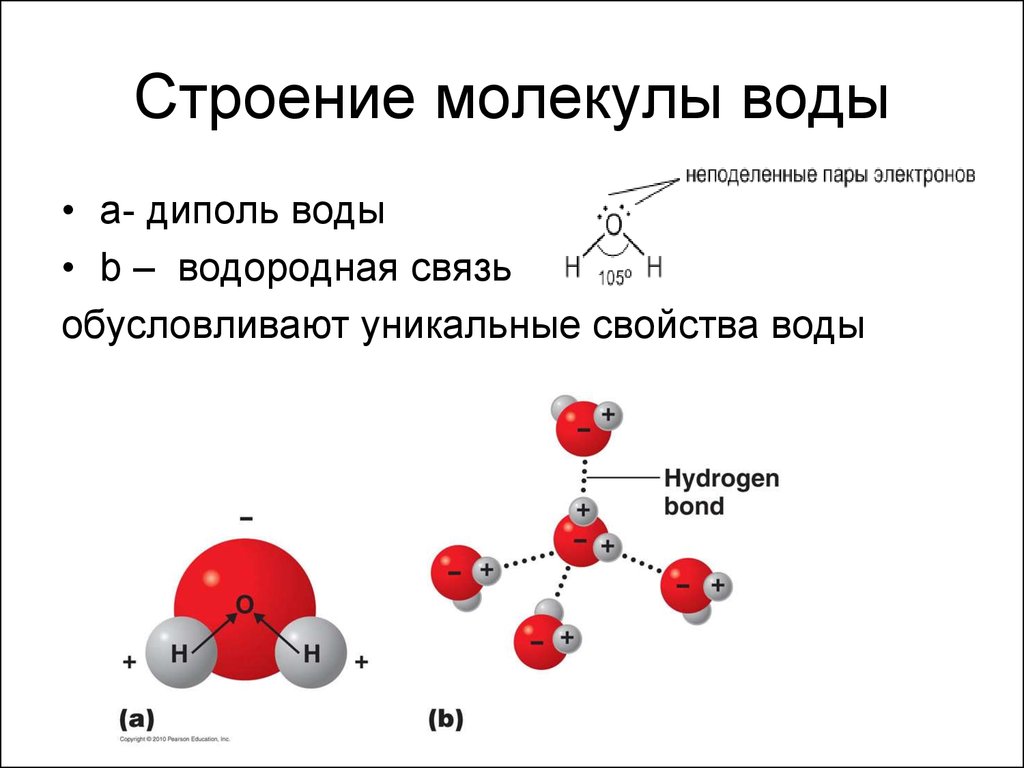
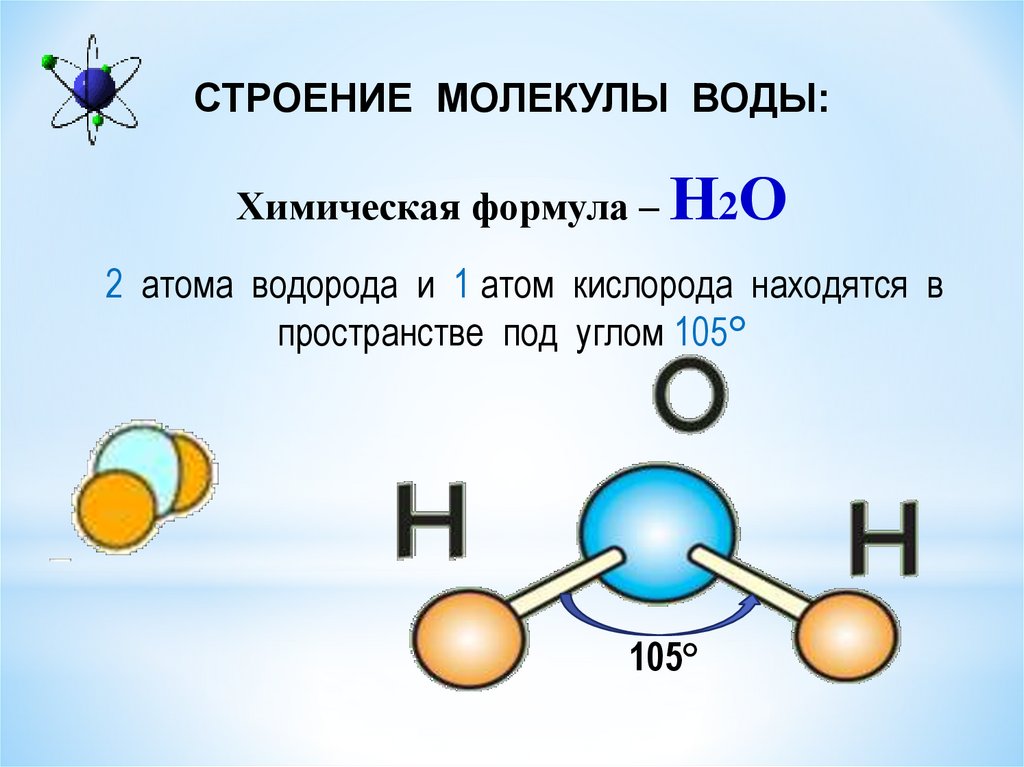
Большая часть молекул состоит из нескольких атомов, при этом атомы могут быть одинаковы, такими, к примеру, являются двухатомные молекулы кислорода, азота, многих других газов. Но чаще каждая молекула состоит из атомов различных видов (элементов).Атомы внутри молекулы удерживаются электростатическими силами на определённых расстояниях, в зависимости от видов этих атомов. Более того, каждая молекула имеет свою пространственную структуру. Например, молекула углекислого газа состоит из трёх атомов, лежащих на одной прямой. А молекула воды — из трёх атомов, лежащих в вершинах равнобедренного треугольника, причём угол при вершине (атоме кислорода) составляет около 105 градусов.
При сжатии молекулы возрастают силы отталкивания между атомами, при растяжении молекулы возрастают силы притяжения. Это обеспечивает стабильность молекул. Чтобы её разрушить, необходимо приложить энергию — химическую, термическую или электрическую.
Наиболее сложно устроены молекулы органических веществ.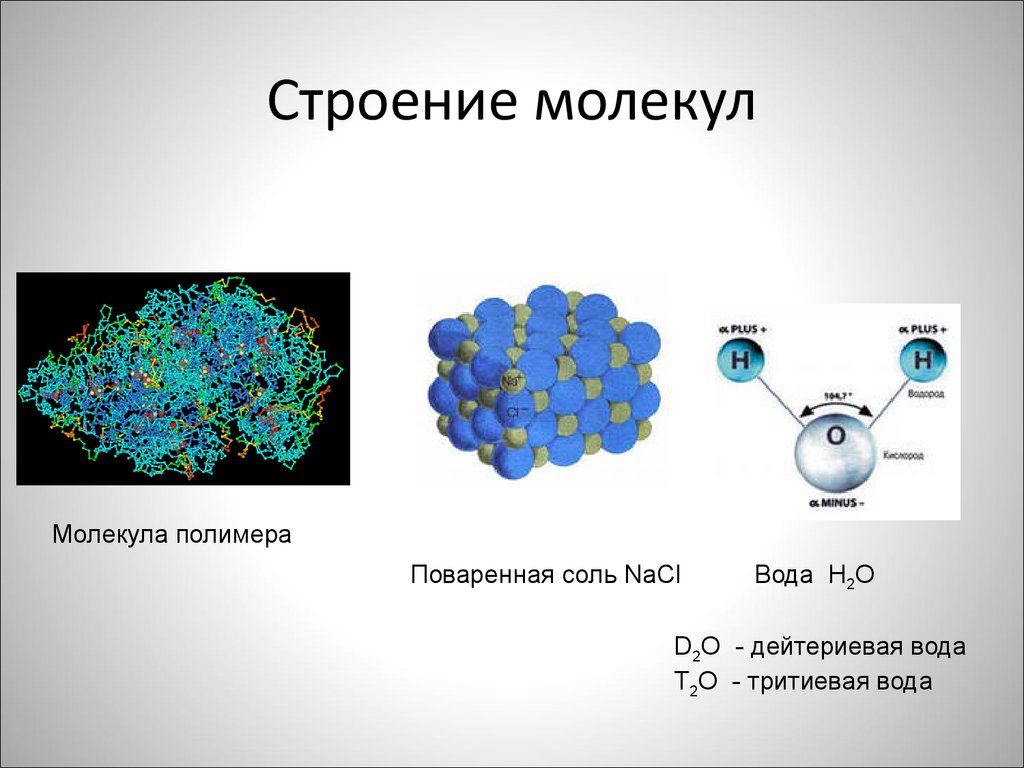
Что мы узнали?
Молекула — это мельчайшая частица вещества, сохраняющая физические и химические свойства. Она состоит из одного и более атомов. Атомы образуют определённую пространственную структуру молекулы и удерживаются в таком виде электростатическими силами.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Катя Зысман
5/5
Оценка доклада
4.1
Средняя оценка: 4.1
Всего получено оценок: 115.
А какая ваша оценка?
Молекула | Определение, примеры, структуры и факты
представления молекулярной структуры
Просмотреть все средства массовой информации
- Ключевые люди:
- Дж. Фрейзер Стоддарт
Джозеф Лошмидт
Курт Вютрих
Бернард Феринга
Герберт А.
 Хауптман
Хауптман
- Похожие темы:
- радикальный биомолекула конфигурация конформация гомоядерная молекула
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
молекула , группа из двух или более атомов, которые образуют наименьшую идентифицируемую единицу, на которую можно разделить чистое вещество, сохраняя при этом состав и химические свойства этого вещества.
Характеристики молекул
Деление образца вещества на все более мелкие части не приводит ни к изменению его состава, ни к химическим свойствам до тех пор, пока не будут получены части, состоящие из отдельных молекул. Дальнейшее подразделение вещества приводит к еще более мелким частям, которые обычно отличаются от исходного вещества по составу и всегда отличаются от него химическими свойствами. На этой последней стадии фрагментации химические связи, удерживающие атомы в молекуле, разрываются.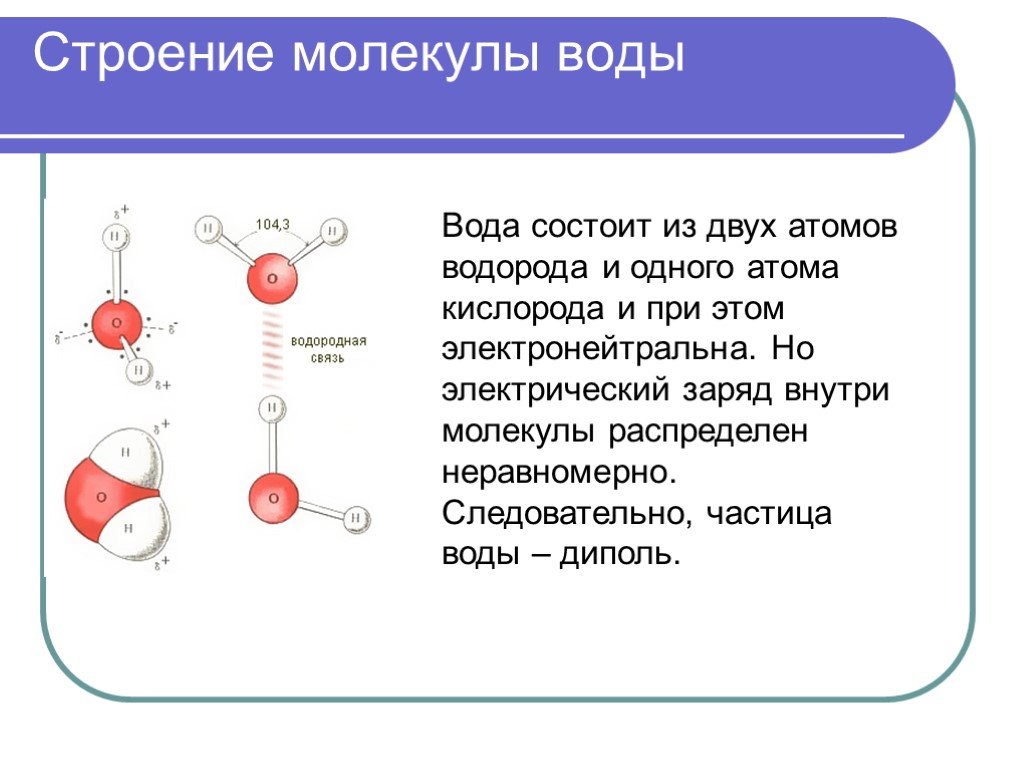
Атомы состоят из одного ядра с положительным зарядом, окруженного облаком отрицательно заряженных электронов. Когда атомы близко подходят друг к другу, электронные облака взаимодействуют друг с другом и с ядрами. Если это взаимодействие таково, что общая энергия системы снижается, то атомы связываются вместе, образуя молекулу. Таким образом, со структурной точки зрения молекула состоит из скопления атомов, удерживаемых вместе валентными силами. Двухатомные молекулы содержат два атома, которые химически связаны. Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они составляют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (СО), то составляют гетероядерную двухатомную молекулу. Молекулы, содержащие более двух атомов, называются многоатомными, например, двуокись углерода (CO 2 ) и вода (H 2 O). Молекулы полимеров могут содержать многие тысячи атомов компонентов.
Молекулярная связь
Отношение числа атомов, которые могут быть связаны друг с другом для образования молекул, является фиксированным; например, каждая молекула воды содержит два атома водорода и один атом кислорода. Именно эта особенность отличает химические соединения от растворов и других механических смесей. Таким образом, водород и кислород могут присутствовать в любых произвольных пропорциях в механических смесях, но при искровом разряде они будут соединяться только в определенных пропорциях, образуя химическое соединение вода (H
Именно эта особенность отличает химические соединения от растворов и других механических смесей. Таким образом, водород и кислород могут присутствовать в любых произвольных пропорциях в механических смесях, но при искровом разряде они будут соединяться только в определенных пропорциях, образуя химическое соединение вода (H 
Britannica Quiz
Все тонкости химии
Не все вещества состоят из отдельных молекулярных единиц. Хлорид натрия (поваренная соль), например, состоит из ионов натрия и ионов хлора, расположенных в решетке так, что каждый ион натрия окружен шестью равноудаленными ионами хлора, а каждый ион хлора окружен шестью равноудаленными ионами натрия. Силы, действующие между любым натрием и любым соседним ионом хлора, равны. Следовательно, не существует отдельного агрегата, идентифицируемого как молекула хлорида натрия. Следовательно, в хлориде натрия и во всех твердых телах подобного рода понятие химической молекулы не имеет значения. Поэтому формула такого соединения дается как простейшее соотношение атомов, называемое формульной единицей, в случае хлорида натрия — NaCl.
Молекулы удерживаются вместе общими электронными парами или ковалентными связями. Такие связи являются направленными, что означает, что атомы занимают определенное положение относительно друг друга, чтобы максимизировать силу связи.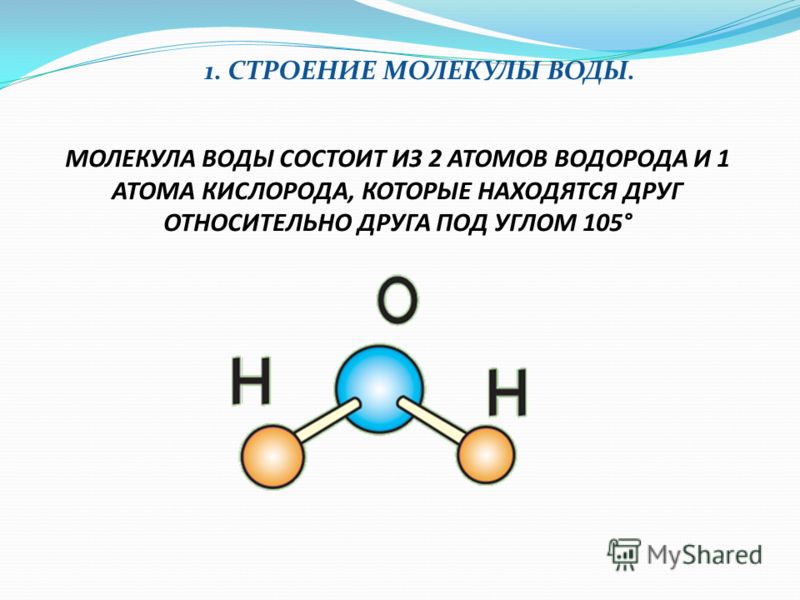
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Характеристика молекулярной структуры и выяснение структуры
Экспертиза по выяснению молекулярной структуры и подтверждению химической структуры для определения связи атомов и состава химических соединений
Выяснение молекулярной структуры необходимо для идентификации или подтверждения структурной идентичности химического соединения во время химические исследования или разработка продукта.
Неизвестные вещества или примеси трудно идентифицировать. Выяснение химической структуры примесей необходимо для поддержки нормативных требований к соединениям для ряда промышленных секторов, таких как агрохимия, фармацевтика и регистрация новых химических объектов.
Мы применяем наш экспертный анализ для выяснения структуры новых химических соединений, выявления примесей и проведения характеристики химического состава.
Наши специалисты используют методы масс-спектрометрии для определения молекулярной массы и применяют подходы тандемной МС/МС для получения ценных данных при идентификации неизвестной молекулы. В ходе этого процесса наши ученые-спектроскописты применяют такие методы, как ядерно-магнитный резонанс (ЯМР) 1H и 13C, чтобы исследовать и подтвердить связь атомов в молекуле. Методы элементного анализа, такие как спектроскопия с индуктивно-связанной плазмой (ICP-OES), эффективно помогают определить элементы, присутствующие в рассматриваемом химическом соединении.
Наши специалисты также могут применять ряд методов, включая методы ЯМР и хроматографии, для изучения и подтверждения оптических изомеров хиральных молекул.
Structural elucidation techniques include
- HPLC/MS/MS
- GCMS
- Nuclear magnetic resonance (NMR) spectroscopy
- Mass spectrometry
- FTIR spectroscopy
- Elemental Analysis
With Intertek as your partner, you получат преимущества профессионального применения самых точных методов, подкрепленных нашим опытом. Наша глобальная сеть лабораторий химического анализа использует ряд технологий во время проектов по выяснению структуры для поддержки идентификации и подтверждения молекул.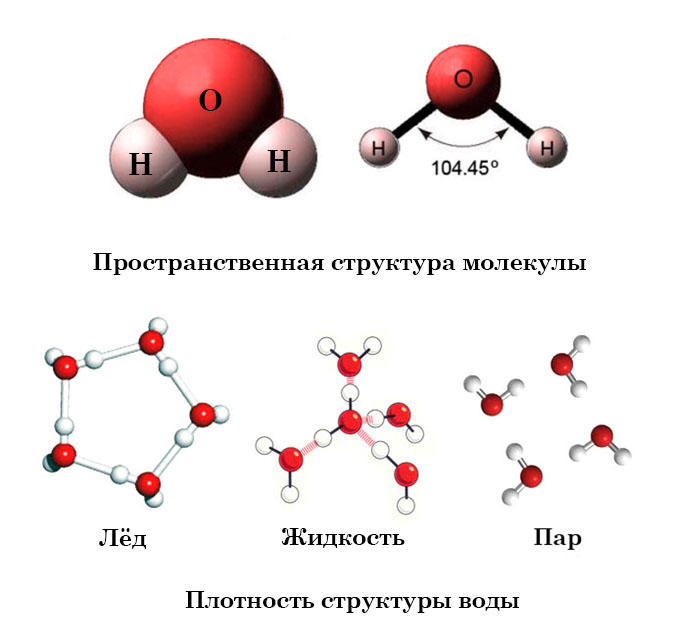


 Хауптман
Хауптман