Вода и ее химические свойства
Понять воду, значит понять Вселенную.
Масару Эмото (1943–2014), японский исследователь
Вода — один из самых распространённых соединений на нашей планете. Именно она является главной составляющей всего живого на планете, но также вода входит в состав комет, большинства планет солнечной системы и их спутников. Без воды нет жизни: ведь жизнь на Земле появилась только тогда, когда на ней появилась вода. Вся жизнь зародилась в воде, поскольку она является естественным универсальным растворителем, а значит вода растворяет питательные вещества и обеспечивает ими клетки живых организмов. Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75 % от общей массы. По примерным подсчетам ученых на планете 1.4087 млрд. км3 воды (причем соленой воды от общего объема примерно 97 %, пресной всего 3 %).
Да и сам человек на 60–80 % (в зависимости от возраста) состоит из воды. Большая часть воды — это кровь, жидкость в выделительной системе, мускулах, мозге и других органах, а также в костях и коже.
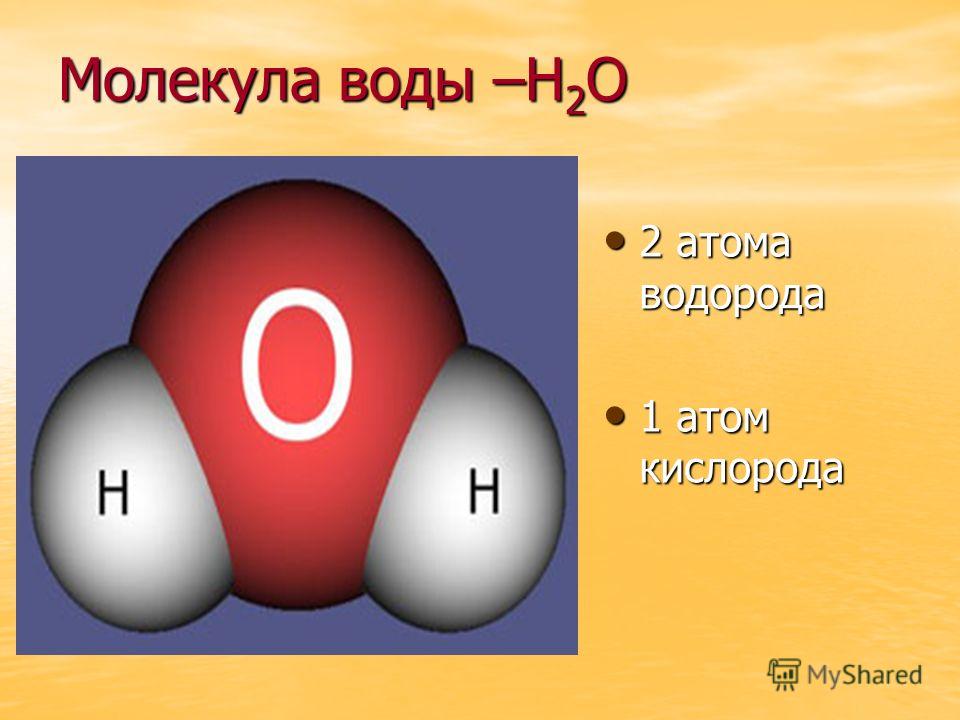
В понятии химии вода — это H2O, то есть две молекулы водорода и одна молекула кислорода. Но это дистиллированная вода. В природе вода содержит различные примеси и очень редко встречается в чистом виде. При взаимодействии водорода с кислородом происходит выделение большого количества тепла. Это соединение очень устойчивое, молекулы которого распадаются только при температуре 1500°С.
Каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Оксид построен в форме тетраэдра — атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма.
Рис. 1 Строение атома воды и оксид в виде тетраэдра
Вода — весьма активное в химическом отношении вещество. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ, именно поэтому вода — это определяющий характер химии. Вода имеет различные физические и химические свойства, но посмотрим на воду с химической точки зрения.
-
Биохимические свойства воды.

Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой. Вода способна растворять некоторые кислоты, основания и соли, представляющие ионные соединения и некоторые полярные неионные образования (простые спирты, сахара и аминокислоты). Благодаря воде сохраняется упругость и объем живой клетки, многие химические процессы организма протекают именно в водных растворах. Эти свойства дают клеткам теплопроводимость и теплоемкость, обеспечивающие терморегуляцию и защищает от температурных перепадов.
Без воды невозможен гидролиз — химическая реакция, которая сопровождает усвоение белков, жиров, углеводов, а ведь именно они являются обязательным компонентом нашей пищи, так, например, белок распадается на аминокислоты, углевод на глюкозу, жиры на глицерин. В результате этого процесса сложные органические вещества распадаются до простых веществ, которые, легко усваиваются живым организмом.
- Вода-растворитель
Вода является наиболее распространённым растворителем на нашей планете. По растворимости в воде вещества делятся на три группы:
1) Хорошо растворимые: (сахар (С12Н22О11), гидроксид натрия (NaOH), спирт (C2H5OH), хлороводород (HCl).
2) Мало растворимые: (гипс, сульфат свинца (PbSO4), бензол (C6H6), метан (СH4), кислород).
3) Практически не растворимые: (стекло, серебро (Ag), золото (Au), керосин, растительное масло).
Из этого можно сделать вывод, что растворимость вещества прежде всего зависит от природы этого вещества, а также от температуры и давления окружающей среды. Сам процесс растворения обуславливается взаимодействием частиц растворителя и растворяемого вещества.
- Вода — активное химическое вещество.
Вода может взаимодействовать:
1) с металлами с выделением водорода:
− с активными 2Na + 2H2O → H2 + 2NaOH (бурно)
− со средней активностью до H 3Fe + 4H2O → 4H2 + Fe3O4 (только при нагревании)
− с малоактивными после H (не взаимодействуют) Cu+ H2O ≠
Достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
2) с неметаллами:
Из неметаллов с водой реагируют углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O → H2 + CO (при сильном нагревании)
CH4 + 2H2O → 4H2 + CO2(при сильном нагревании)
3) с оксидами неметаллов:
Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
SO2+H2O → H2SO3 — сернистая кислота
SO3+H2O → H2SO4 — серная кислота
CO2+H2O → H2CO3 — угольная кислота
4) с оксидами металлов
Некоторые оксиды металлов также могут вступать в реакции соединения с водой.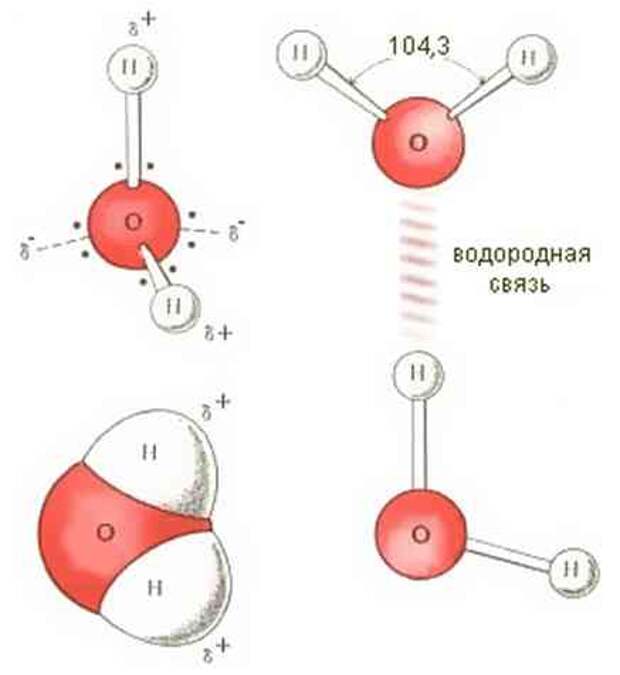
CaO+ H2O → Ca(OH)2 гидроксид кальция (гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует: ZnO, TiO2, Cr2O3, из которых изготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) с газами
Как говорилось в подпункте 4 вода взаимодействует с оксидами неметаллов. В данном случае CO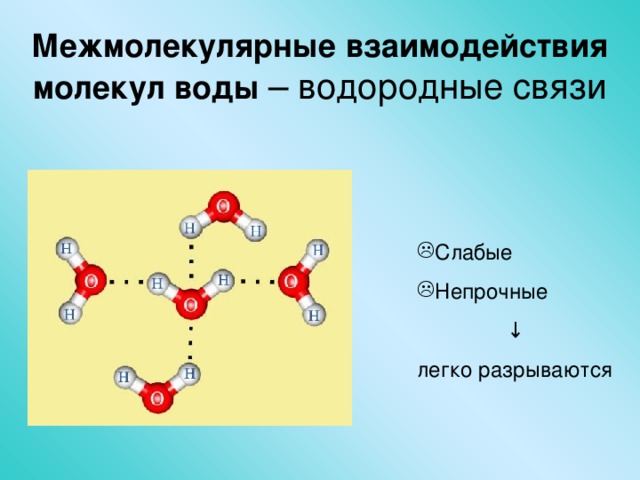 По сути, Пристли впервые получил напиток газированный или содовой воды. Позже ученый Торберн Бергман создал аппарат, позволяющий насыщать жидкость углекислым газом под давлением и назвав его сатуратором.
По сути, Пристли впервые получил напиток газированный или содовой воды. Позже ученый Торберн Бергман создал аппарат, позволяющий насыщать жидкость углекислым газом под давлением и назвав его сатуратором.
Рис. 2 Джозеф Пристли и его прибор для исследования газов.
6) Гидраты.
Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом.
H2SO4 + H2O → H2SO4.H2O (гидрат серной кислоты)
NaOH + H2O → NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью удаляют водяные пары из влажного атмосферного воздуха.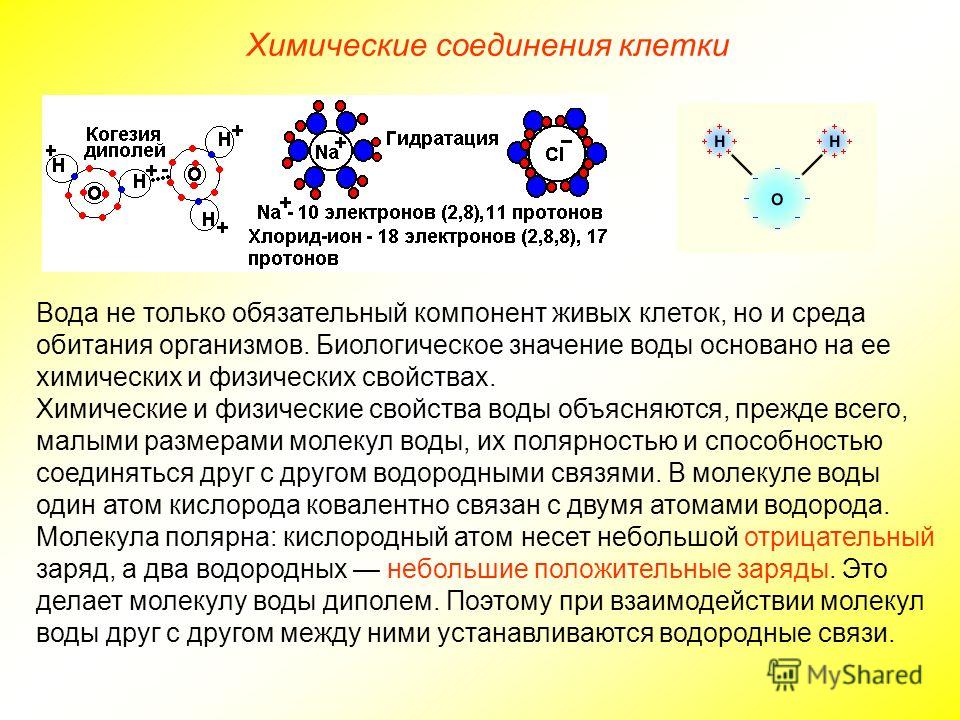
7) Фотосинтез растений.
Фотосинтез — процесс, протекающий в зеленных листьях растений с использованием энергии света, при котором из углекислого газа и воды образуются органические вещества и кислород. Синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O → (C6H10O5)n + 6n O2 (при действии света)
Рис. 3. Фотосинтез растений, как химическая реакция.
8) Электролиз воды.
Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду — отрицательно заряженные анионы.
Схема электролиза воды:
Анод 2H2O → O2 + 4H+ + 4e–
Катод 4H+ + 4e– → 2H2.
Вода — слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока, катионы которого будут иметь меньший электродный потенциал, чем H+ воды.
- Минерализация воды
Минерализация — это показатель количества содержащихся в воде растворенных веществ (неорганические соли неорганические вещества). Как правило, это бикарбонаты, хлориды, сульфаты кальция, магния, калия, натрия и других веществ. Минерализацию считают в грамм на литр (г/л) или грамм на дециметр в кубе (г/дм3). С точки зрения бальнеологии по степени минерализации воду классифицируют на:
Как правило, это бикарбонаты, хлориды, сульфаты кальция, магния, калия, натрия и других веществ. Минерализацию считают в грамм на литр (г/л) или грамм на дециметр в кубе (г/дм3). С точки зрения бальнеологии по степени минерализации воду классифицируют на:
− Столовую — минерализация до 1 г/л
− Лечебно-столовую — минерализация от 1 г/л до 10 г/л
− Лечебная — минерализация более 10 г/л или высокое содержание биологически активных элементов: железо, брома, йода, сероводорода, фтора и т. д., при этом общая минерализация может быть невысокой.
Свойство минерализации основано на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
-
Жесткость воды.

Жесткость воды — совокупность свойств, обусловленных содержанием в воде катионов кальция Ca2+ и магния Mg2+ (так называемых солей жесткости).
Из-за разного объема различных примесей в воде, она делится на два типа-жесткую и мягкую. Соли попадают в воду из-за того, что часть дождевых вод превращаются в грунтовую воду. Они протекают в недрах Земли, соприкасаются с минералами кальция и магния, вымывая из них мелкие частички. В воде, насыщенной углекислотой, карбонаты калия и магния растворяются, так как превращаются в кислые соли. В таком растворимом виде гидрокарбонаты металлов остаются в воде и обуславливают временную жесткость. При кипячении такой воды гидрокарбонаты разлагаются и выпадают в осадок. Но также существует постоянная жесткость, обуславливая присутствием в природной воде растворимых хлоридов и сульфатом кальция и магния. Жесткость воды количественно выражают числом ммоль эквивалентов (ммоль/экв) ионов кальция Ca2+ и магния Mg2+.
В жесткой воде плохо мылится мыло, которое представляет собой натриевые соли высших карбонатных кислот. Для устранения жесткости воды (ее умягчения) необходимы ионы Ca2+ и Mg2+ перевести в осадок. Временную карбонатную жесткость устраняют кипячение:
Ca(HCO3)2CaCO3 ↓ + H2O + CO2↑
Постоянную жесткость кипячением устранить нельзя. Для этого добавляют в воду смесь гашенной извести Ca(OH)2 или соды Na2CO3
Са(НСО3)2 + Са(ОН)2 → 2СаСO3↓ + 2Н2O
- Теория Льюиса
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. С точки зрения теории Льюиса — вода — это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоторой амфотерности воды в химических свойствах.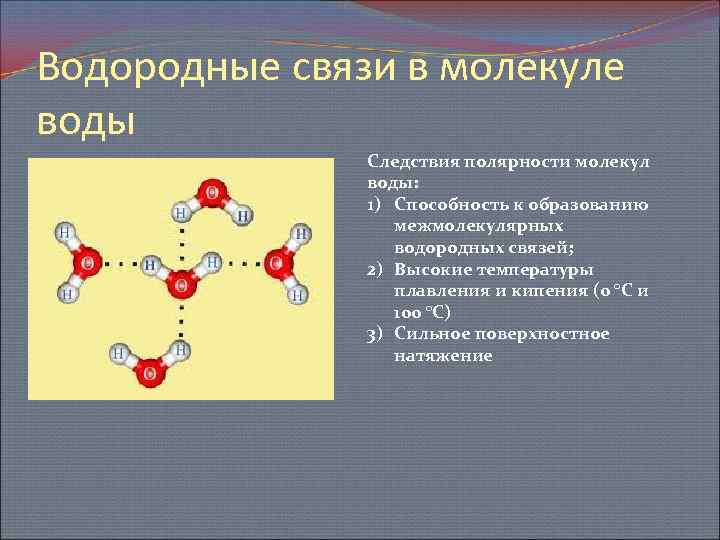
Подводя итог вышесказанного можно сказать, что вода — это самое уникальное вещество на земле. Академик Владимир Иванович Вернадский писал: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы с ней сравниться по влиянию на ход основных, самых грандиозных, геологических процессов. Не только земная поверхность, но и глубокие — в масштабе биосферы — части планеты определяются, в самых существенных своих проявлениях, ее существованием и ее свойствами». Действительно, нет более важного для нас вещества на Земле, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, как в свойствах воды.
Литература:
- Репетитор по химии / под. Ред. А. С. Егорова. –изд. 58-е- Ростов н/Д: Феникс, 2018
-
Пособие по химии для поступающих в вузы.
 — 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
— 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
- https://www.syl.ru/article/172000/new_voda-i-ee-svoystva-fizicheskie-i-himicheskie-struktura-vodyi
- http://www.hemi.nsu.ru/ucheb175.htm
- https://ru.wikipedia.org
- https://obrazovaka.ru/himiya/elektroliz-vody-shema-processa.html
- http://www.cawater-info.net/bk/12–7.htm
состав, таблица, основные свойства природных вод, строение молекулы, изменение подземных вод
Вода – второе по значимости, после воздуха, вещество для человеческого организма. Прожить без нее человек может не более, чем 8 суток. Все химико-биологические реакции проходят с участием данного вещества. В природе вода пребывает с трех агрегатных состояниях – в твердом, жидком и газообразном. Таким разнообразием обладает только она. Многие физические и химические свойства воды удивляют и поражают. Еще великий ученый Вернадский писал о том, что нет на Земле такого компонента, который мог бы сравниться с ней по влиянию на основные процессы, происходящие в природе.
Многие физические и химические свойства воды удивляют и поражают. Еще великий ученый Вернадский писал о том, что нет на Земле такого компонента, который мог бы сравниться с ней по влиянию на основные процессы, происходящие в природе.
Изучение
Благодаря своим уникальным физическим и химическим свойствам, вода сделала возможным зарождение и развитие жизни на планете. Многие ученые посвятили свою жизнь изучению данной жидкости. На протяжении нескольких столетий проводились эксперименты с целью узнать все химические и физические свойства воды. Даже сейчас интерес к этому веществу не угасает.
Формула воды известна каждому школьнику. Это три простых знака, но содержатся они в 75% от общей массы всего на планете.
Н2О – это два атома водорода и один — кислорода. Структура молекулы имеет эмпирическую форму, поэтому свойства жидкости такие многообразные, несмотря на простой состав. Каждая из молекул находится в окружении соседей. Они связаны одной кристаллической решеткой.
Простота строения позволяет жидкости существовать в нескольких агрегатных состояниях. Ни одно вещество на планете не может этим похвастаться. Н2О очень подвижна, она уступает в этом свойстве лишь воздуху. Каждый осведомлен о круговороте воды, о том, что после испарения ее с поверхности земли, где-то далеко проходит дождь или снег. Климат регулируется именно благодаря свойствам жидкости, которая может отдавать тепло, а сама при этом практически не изменяет свою температуру.
Физические свойства
Н2О и физические ее свойства зависят от многих ключевых факторов. Основные из них:
- Кристаллическая решетка. Строение воды, а точнее ее кристаллической решетки, обусловлено агрегатным состоянием. Она имеет рыхлое, но очень прочное строение. Снежинки показывают решетку в твердом состоянии, а вот в привычном – жидком, у воды нет четкости в строении кристаллов, они подвижны и изменчивы.
- Строение молекулы – шар. Но влияние земного притяжения заставляет воду принимать форму сосуда, в котором находится.
 Это интересное ее физическое свойство. Если притяжение есть, она будет подстраивать форму под сосуд, а в космосе будет геометрически правильной формы.
Это интересное ее физическое свойство. Если притяжение есть, она будет подстраивать форму под сосуд, а в космосе будет геометрически правильной формы. - Следующее физическое свойство — реагирует вода с другими веществами, в том числе с теми, кто обладает неразделенными электронными парами, среди них спирт и аммиак.
- Обладает высокой теплоемкостью и теплопроводностью, быстро нагревается и долго не остывает.
- Еще со школы известно и такое физическое свойство воды — температура ее кипения — 100 градусов Цельсия. В жидкости появляются кристаллы при понижении до +4 градусов, а вот лед образуется при еще большем снижении. Температура кипения зависит от давления, в которое поместить Н2О. Чтобы определить физические свойства воды при нагревании был проведен эксперимент, при котором температура химического соединения достигает 300 градусов, при этом жидкость не кипит, а плавит свинец.
- Еще одним важным физическим свойством является поверхностное натяжение. Формула воды позволяет ему быть очень прочным.
 Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Особое биологическое значение имеет такое физическое свойство воды как поверхностное напряжение. Объяснить это просто. Если налить немного жидкости на гладкую поверхность, то она не растечется по ней, а образует сферические капли. Это физическое свойство объясняет высокую биологическую активность воды. Поверхностное напряжение дает возможность всем растениям на планете поглощать жидкость, находящуюся в почве, своей корневой системой. Это же физическое свойство помогает крови человека проникать через все ткани организма.
[warning] Интересное физическое свойство — Н2О, очищенная от примесей (дистиллированная), не может проводить ток. Это свойство оксида водорода появляется лишь при наличии растворенных в нем солей.[/warning]
Другие особенности и физические свойства
Лед – это состояние, которое свойственно оксиду водорода. Он образует рыхлые связи, которые легко деформируются.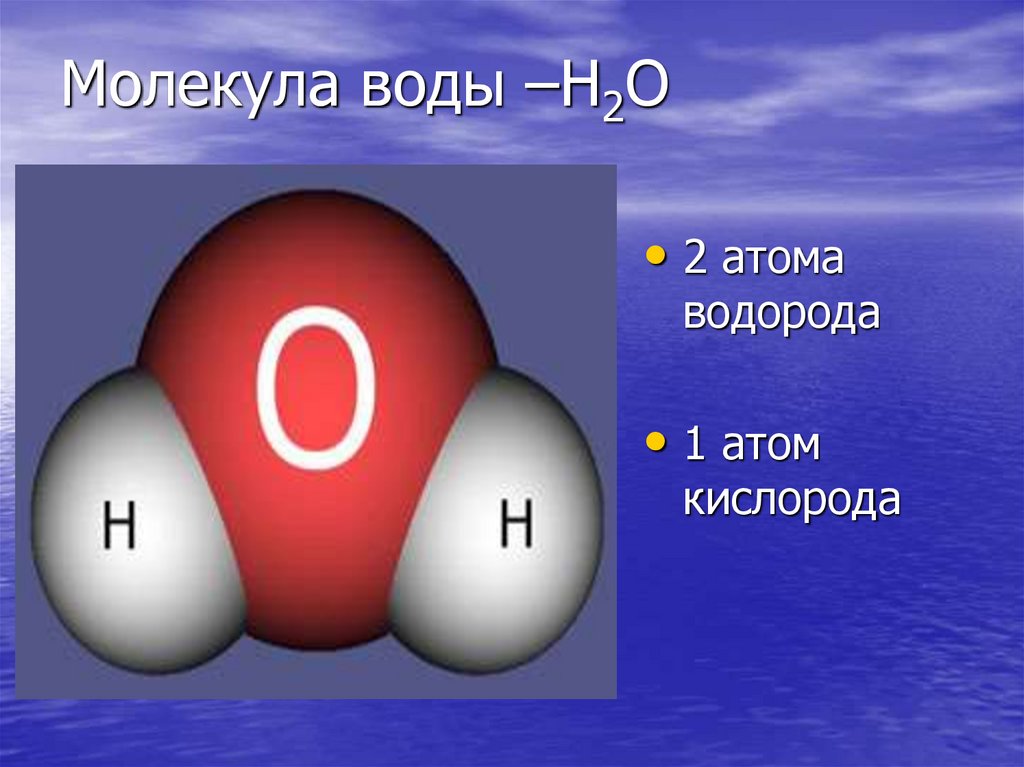 Кроме того, расстояние между частицами увеличивается, делая плотность льда намного ниже жидкости. Это позволяет водоемам не промерзать полностью в зимний период, сохраняя жизнь под слоем льда. Ледники – большой запас пресной воды.
Кроме того, расстояние между частицами увеличивается, делая плотность льда намного ниже жидкости. Это позволяет водоемам не промерзать полностью в зимний период, сохраняя жизнь под слоем льда. Ледники – большой запас пресной воды.
[warning]У воды есть уникальное физическое свойство, которое называется явлением тройной точки. Это когда она находится сразу в трех своих состояниях. Возможно это условие, лишь при температуре 0,01 градус и давлении 610 Па.[/warning]
Химические свойства
Химические свойства воды:
- Разделяют воду по жесткости, от мягкой и средней — до жесткой. Этот показатель зависит от содержания солей магния и калия в растворе. Есть также такие металлы, которые находятся в жидкости постоянно, а от некоторых можно избавиться кипячением.
- Следующие важные химические свойства воды — окисление и восстановление. Вода влияет на процессы, изучаемые в химии, происходящие с другими веществами: одни она растворяет, с другими вступает в реакцию. Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит.

- Влияние на биохимические процессы. Вода основная часть любой клетки, в ней как в среде, происходят все реакции в организме.
- Интересное химическое свойство воды — жидком состоянии впитывает в себя газы, которые неактивны. Их молекулы располагаются между молекулами Н2О внутри полостей. Так образуются клатраты.
- При помощи оксида водорода образуются новые вещества, которые не связаны с окислительно-восстановительным процессом. Речь идет о щелочах, кислотах и основаниях.
- Еще одно химическое свойство воды — это способность образовывать кристаллогидраты. Оксид водорода при этом остается в неизменном виде. Среди обычных гидратов можно выделить медный купорос.
- Если через соединение пропустить электрический ток, то можно разложить молекулу на газы.
Важность физических и химических свойств воды для человека
Давно люди поняли значение жидкости для всего живого и планеты. Без нее человек не может прожить и недели. Вода — вещество, обладающее уникальными физическими и химическими свойствами. Она участвует во всех процессах внутри человеческого организма. Положительное воздействие жидкости:
Она участвует во всех процессах внутри человеческого организма. Положительное воздействие жидкости:
- Главное применение — это наличие в организме, в клетках, где проходят все реакции.
- Образование водородных связей благоприятно сказывается на живых существах, ведь при изменении температуры жидкость в теле не замерзает.
- Человек давно применяет воду в бытовых нуждах, кроме приготовления пищи, это: стирка, уборка, купание.
- Ни один промышленный завод не может работать без жидкости.
- Н2О – источник жизни и здоровья, она является лекарством.
- Растения используют ее на всех этапах развития и жизни. С ее помощью они производят кислород, такой необходимый для жизни живых существ, газ.
Важность воды для человека
Критическая температура
У Н2О, как и у всех веществ, есть температура, которая называется критической. Критическая температура воды определяется методом нагрева. До 374 градусов по Цельсию жидкость называют паром, она еще может превратиться обратно в привычное жидкое состояние, при определенном давлении.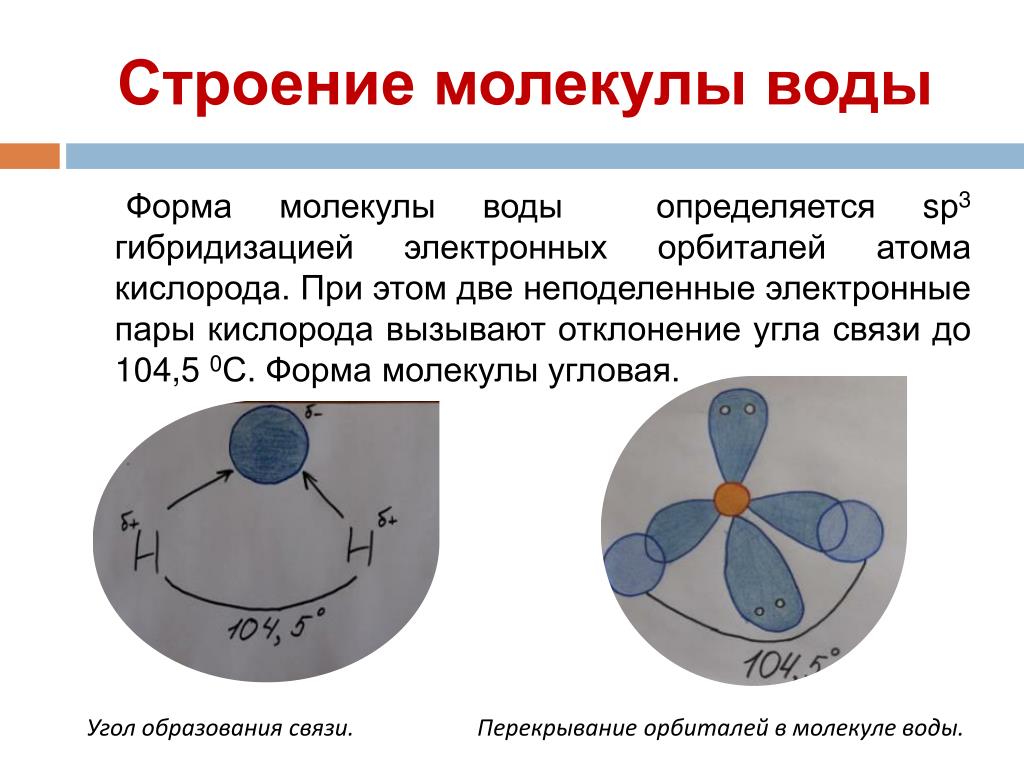 Когда температура вышей этой критической отметки, то вода как химический элемент, превращается в газ безвозвратно (химическое свойство жидкости).
Когда температура вышей этой критической отметки, то вода как химический элемент, превращается в газ безвозвратно (химическое свойство жидкости).
Применение в химии
Интерес у химиков вода вызывает благодаря своему умению растворять (одно из химических свойств). Часто ученые ею очищают вещества, чем создают благоприятные условия для проведения экспериментов. Она является средой, в которой можно провести опытные испытания. Кроме того, Н2О сама участвует в химических процессах, влияя на тот или иной химический эксперимент. Она соединяется с неметаллическими и металлическими веществами.
Три состояния
Вода предстает перед людьми в трех состояниях, называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по физическим и химическим особенностям. Умение перевоплощаться – важная характеристика воды для планеты, таким образом, происходит ее круговорот.
Сравнивая три состояния, человек чаще видит химическое соединение все же в жидком виде. Вода не имеет вкуса и запаха, а то, что ощущается в ней, это из-за наличия примесей, растворенных веществ.
Вода не имеет вкуса и запаха, а то, что ощущается в ней, это из-за наличия примесей, растворенных веществ.
Физические и химические свойства воды в жидком состоянии — это: сила, позволяющая точить камни и рушить скалы, а также возможность принимать любую форму.
Мелкие частицы при замерзании сокращают скорость сдвижения и увеличивают дистанцию, поэтому структура льда пористая и по плотности ниже жидкости. Лед применяется в холодильных установках, для бытовых и промышленных целей. В природе лед несет разрушения, выпадая в виде града или лавины.
Газ – еще одно состояние, который образуется, когда не достигается критическая температура воды. Обычно при температуре больше 100 градусов, или испаряясь с поверхности (физическая особенность). В природе это облака, туманы и испарения. Большую роль искусственное газообразование сыграло в техническом прогрессе в 19 веке, когда были изобретены паровые двигатели.
Количество вещества в природе
75% — такая цифра покажется огромной, но это вся вода на планете, даже та, которая находится в разных агрегатных состояниях, в живых существах и органических соединениях. Если же учесть лишь жидкое, то есть воду, находящуюся в морях и океанах, а также в твердую – в ледниках, то процент становится 70,8%.
Если же учесть лишь жидкое, то есть воду, находящуюся в морях и океанах, а также в твердую – в ледниках, то процент становится 70,8%.
Распределение процентного содержания такое:
- моря и океаны – 74,8%
- Н2О пресных источников, распределенная неравномерно по планете, в ледниках составляет — 3,4%, а в озерах, болотах и реках 1,1%.
- На подземные источники приходится 20,7% от всего количества.
Характеристика тяжелой воды
Природное вещество – водород встречается в виде трех изотопов, в таком же количестве форм есть и кислород. Это позволяет выделять кроме обычной питьевой воды еще дейтериевую и тритиевую.
Дейтериевая имеет самую устойчивую форму, она встречается во всех природных источниках, но в малом количестве. Жидкость с такой формулой обладает рядом отличий от легкой, и иными физическими и химическими свойствами. Так, образование кристаллов начинается уже при температуре 3,82 градуса. А вот температура кипения (физическое свойство) выше — 101,42 градуса Цельсия.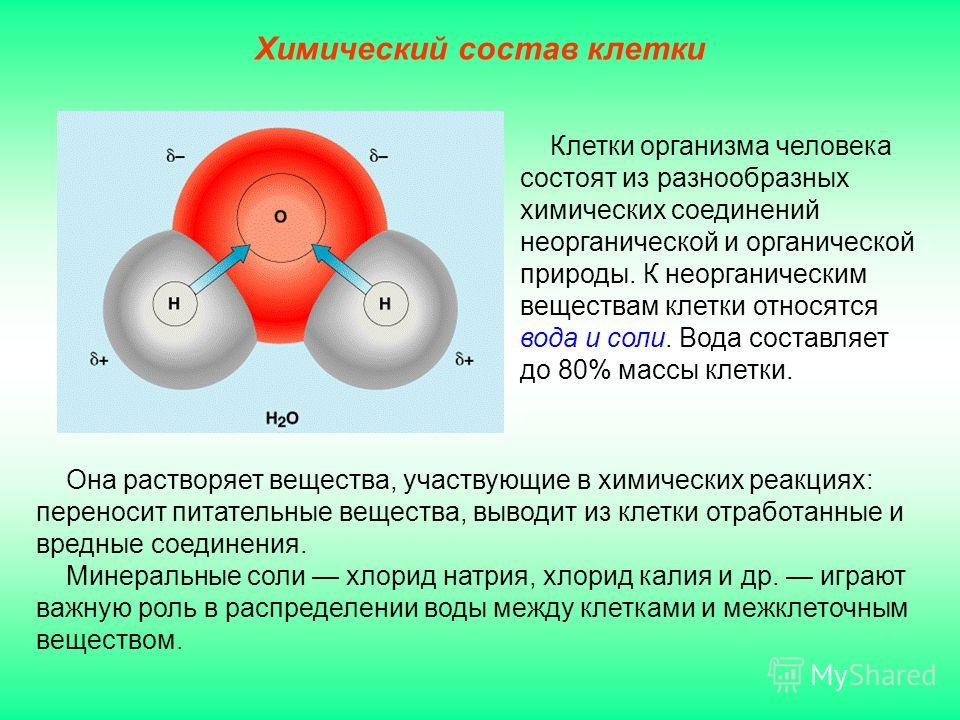 У нее больше плотность и способность к растворению веществ снижена (химическое свойство). Кроме того, ее обозначают другой формулой (D2O).
У нее больше плотность и способность к растворению веществ снижена (химическое свойство). Кроме того, ее обозначают другой формулой (D2O).
Живые системы реагируют на такое химическое соединение плохо. Лишь некоторые виды бактерий смогли в нем приспособиться к жизни. Рыбы и вовсе не выдержали такого эксперимента. В организме человека, дейтерий может находиться несколько недель, а после выводится, не причиняя вреда.
[stop]Пить дейтериевую воду – нельзя![/stop]
Свойства воды:
Химические свойства воды:
За счет иных физических и химических свойств применение тяжелая вода нашла в ядерной и атомной промышленности, а обычная — в повсеместном.
Физические и химические свойства, формула воды: строение и какова критическая температура
Основное вещество, которое позволяет существовать жизни на планете – это вода. Она необходима в любом состоянии. Изучение свойств жидкости привело к образованию целой науки – гидрологии. Предмет изучения большинства ученых – это физические и химические свойства воды. Они понимают под этими свойствами: критические температуры, кристаллическую решетку, примеси и другие индивидуальные особенности химического соединения….
Она необходима в любом состоянии. Изучение свойств жидкости привело к образованию целой науки – гидрологии. Предмет изучения большинства ученых – это физические и химические свойства воды. Они понимают под этими свойствами: критические температуры, кристаллическую решетку, примеси и другие индивидуальные особенности химического соединения….
Содержание
Изучение
Формула воды известна каждому школьнику. Это три простых знака, но содержатся они в 75% от общей массы всего на планете.
Н2О – это два атома водорода и один кислорода. Структура молекулы имеет эмпирическую форму, поэтому свойства жидкости такие многообразные, несмотря на простой состав. Каждая из молекул находится в окружении соседей. Они связаны одной кристаллической решеткой.
Простота строения позволяет жидкости существовать в нескольких агрегатных состояниях. Ни одно вещество на планете не может этим похвастаться. Н2О очень подвижна, она уступает в этом свойстве лишь воздуху. Каждый осведомлен о круговороте воды, о том, что после испарения ее с поверхности земли, где-то далеко проходит дождь или снег. Климат регулируется именно благодаря свойствам жидкости, которая может отдавать тепло, а сама при этом практически не изменяет свою температуру.
Каждый осведомлен о круговороте воды, о том, что после испарения ее с поверхности земли, где-то далеко проходит дождь или снег. Климат регулируется именно благодаря свойствам жидкости, которая может отдавать тепло, а сама при этом практически не изменяет свою температуру.
Физические свойства
Н2О и ее свойства зависят от многих ключевых факторов. Основные из них:
- Кристаллическая решетка. Строение воды, а точнее ее кристаллической решетки, обусловлено агрегатным состоянием. Она имеет рыхлое, но очень прочное строение. Снежинки показывают решетку в твердом состоянии, а вот в привычном – жидком, у воды нет четкости в строении кристаллов, они подвижны и изменчивы.
- Строение молекулы – шар. Но влияние земного притяжения заставляет воду принимать форму сосуда, в котором находится. В космосе она будет геометрически правильной формы.
- Реагирует вода с другими веществами, в том числе с теми, кто обладает неразделенными электронными парами, среди них спирт и аммиак.

- Обладает высокой теплоемкостью и теплопроводностью, быстро нагревается и долго не остывает.
- Еще со школы известно, что температура кипения 100 градусов Цельсия. В жидкости появляются кристаллы при понижении до +4 градусов, а вот лед образуется при еще большем снижении. Температура кипения зависит от давления, в которое поместить Н2О. Есть эксперимент, при котором температура химического соединения достигает 300 градусов, при этом жидкость не кипит, а плавит свинец.
- Еще одним важным свойством является поверхностное натяжение. Формула воды позволяет ему быть очень прочным. Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Интересно! Н2О, очищенная от примесей (дистиллированная), не может проводить ток. Это свойство оксида водорода появляется лишь при наличии растворенных в нем солей.
Другие особенности
Лед – это уникальное состояние, которое свойственно оксиду водорода. Он образует рыхлые связи, которые легко деформируются. Кроме того, расстояние между частицами значительно увеличивается, делая плотность льда намного ниже жидкости. Это позволяет водоемам не промерзать полностью в зимний период, сохраняя жизнь под слоем льда. Ледники – большой запас пресной воды.
Он образует рыхлые связи, которые легко деформируются. Кроме того, расстояние между частицами значительно увеличивается, делая плотность льда намного ниже жидкости. Это позволяет водоемам не промерзать полностью в зимний период, сохраняя жизнь под слоем льда. Ледники – большой запас пресной воды.
Интересно! У Н2О есть уникальное состояние, которое называется явлением тройной точки. Это когда она находится сразу в трех своих состояниях. Возможно это условие, лишь при температуре 0,01 градус и давлении 610 Па.
Химические свойства
Основные химические свойства:
- Разделяют воду по жесткости, от мягкой и средней до жесткой. Этот показатель зависит от содержания солей магния и калия в растворе. Есть также такие металлы, которые находятся в жидкости постоянно, а от некоторых можно избавиться кипячением.
- Окисление и восстановление. Н2О влияет на процессы, изучаемые в химии, происходящие с другими веществами: одни она растворяет, с другими вступает в реакцию.
 Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит.
Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит. - Влияние на биохимические процессы. Вода основная часть любой клетки, в ней как в среде, происходят все реакции в организме.
- В жидком состоянии впитывает в себя газы, которые неактивны. Их молекулы располагаются между молекулами Н2О внутри полостей. Так образуются клатраты.
- При помощи оксида водорода образуются новые вещества, которые не связаны с окислительно-восстановительным процессом. Речь идет о щелочах, кислотах и основаниях.
- Еще одна характеристика воды это способность образовывать кристаллогидраты. Оксид водорода при этом остается в неизменном виде. Среди обычных гидратов можно выделить медный купорос.
- Если через соединение пропустить электрический ток, то можно разложить молекулу на газы.
Важность для человека
Очень давно люди поняли неоценимое значение жидкости для всего живого и планеты в целом. Без нее человек не может прожить и недели. Какого же полезное действие от этого самого распространенного на Земле вещества?
Без нее человек не может прожить и недели. Какого же полезное действие от этого самого распространенного на Земле вещества?
- Самое главное применение это наличие в организме, в клетках, где проходят все важнейшие реакции.
- Образование водородных связей благоприятно сказывается на живых существах, ведь при изменении температуры жидкость в теле не замерзает.
- Человек давно применяет Н2О в бытовых нуждах, кроме приготовления пищи, это: стирка, уборка, купание.
- Ни один промышленный завод не может работать без жидкости.
- Н2О – источник жизни и здоровья, она является лекарством.
- Растения используют ее на всех этапах своего развития и жизни. С ее помощью они производят кислород, такой необходимый для жизни живых существ, газ.
Кроме самых очевидных полезных свойств, их имеется еще очень много.
Важность воды для человека
Критическая температура
У Н2О, как и у всех веществ, есть температура, которая называется критической. Критическая температура воды определяется методом ее нагрева. До 374 градусов по Цельсию жидкость называют паром, она еще может превратиться обратно в привычное жидкое состояние, при определенном давлении. Когда температура вышей этой критической отметки, то вода как химический элемент, превращается в газ безвозвратно.
Критическая температура воды определяется методом ее нагрева. До 374 градусов по Цельсию жидкость называют паром, она еще может превратиться обратно в привычное жидкое состояние, при определенном давлении. Когда температура вышей этой критической отметки, то вода как химический элемент, превращается в газ безвозвратно.
Применение в химии
Большой интерес у химиков Н2О вызывает благодаря основному своему свойству – умению растворять. Часто ученые ею очищают вещества, чем создают благоприятные условия для проведения экспериментов. Во многих случаях она является средой, в которой можно провести опытные испытания. Кроме того, Н2О сама участвует в химических процессах, влияя на тот или иной химический эксперимент. Она соединяется с неметаллическими и металлическими веществами.
Три состояния
Вода предстает перед людьми в трех состояниях, называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по свойствам. У
мение перевоплощаться – очень важная характеристика воды для всей планеты, таким образом, происходит ее круговорот.
Сравнивая все три состояния, человек чаще видит химическое соединение все же в жидком виде. Вода не имеет вкуса и запаха, а то, что ощущается в ней, это из-за наличия примесей, растворенных в ней веществ.
Основные свойства воды в жидком состоянии это: огромная сила, позволяющая точить камни и рушить скалы, а также возможность принимать любую форму.
Мелкие частицы при замерзании сокращают скорость своего движения и увеличивают дистанцию, поэтому структура льда пористая и по плотности ниже жидкости. Лед применяется в холодильных установках, для различных бытовых и промышленных целей. В природе лед несет лишь разрушения, выпадая в виде града или лавины.
Газ – еще одно состояние, который образуется, когда не достигается критическая температура воды. Обычно при температуре больше 100 градусов, или испаряясь с поверхности. В природе это облака, туманы и испарения. Большую роль искусственное газообразование сыграло в техническом прогрессе в 19 веке, когда были изобретены паровые двигатели.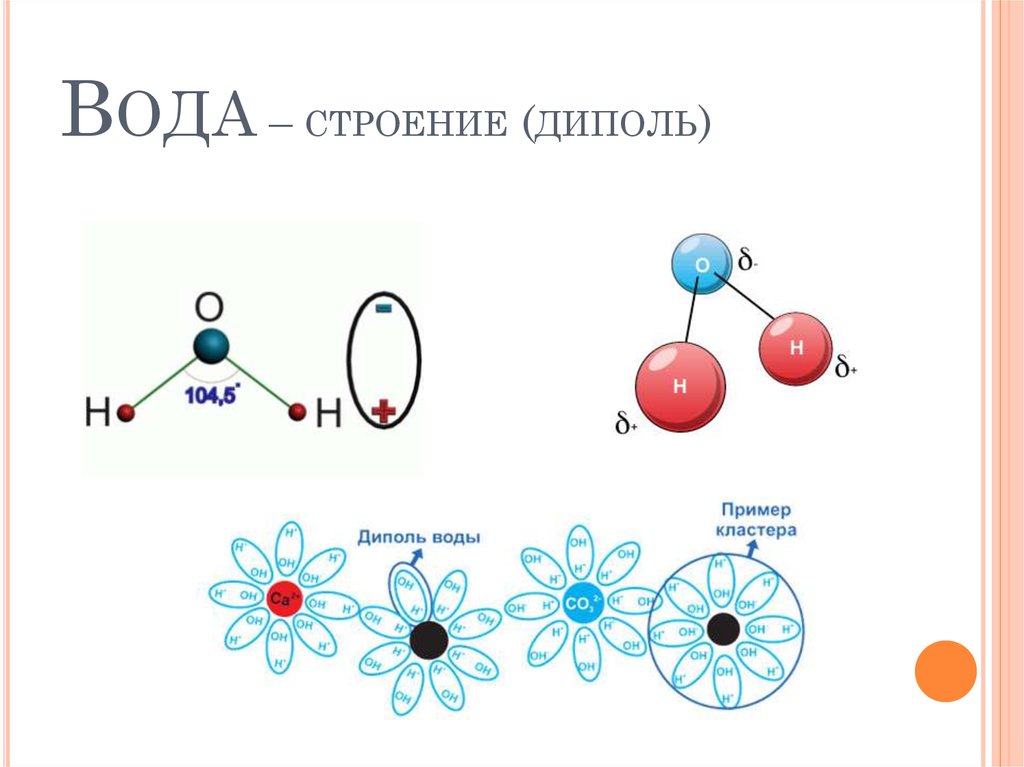
Количество вещества в природе
75% такая цифра покажется огромной, но это вся вода на планете, даже та, которая находится в разных агрегатных состояниях, в живых существах и органических соединениях. Если же учесть лишь жидкое, то есть воду, находящуюся в морях и океанах, а также в твердую – в ледниках, то процент становится 70,8%.
Распределение процентного содержания примерно такое:
- моря и океаны – 74,8%
- Н2О пресных источников, распределенная неравномерно по планете, в ледниках составляет 3,4%, а в озерах, болотах и реках лишь 1,1%.
- На подземные источники приходится примерно 20,7% от всего количества.
Характеристика тяжелой воды
Природное вещество – водород встречается в виде трех изотопов, в таком же количестве форм есть и кислород. Это позволяет выделять кроме обычной питьевой воды еще дейтериевую и тритиевую.
Дейтериевая имеет самую устойчивую форму, она встречается во всех природных источниках, но в очень малом количестве. Жидкость с такой формулой обладает рядом отличий от простой и легкой. Так, образование кристаллов в ней начинается уже при температуре 3,82 градуса. А вот температура кипения немного выше 101,42 градуса Цельсия. У нее больше плотность и способность к растворению веществ значительно снижена. Кроме того, ее обозначают другой формулой (D2O).
Жидкость с такой формулой обладает рядом отличий от простой и легкой. Так, образование кристаллов в ней начинается уже при температуре 3,82 градуса. А вот температура кипения немного выше 101,42 градуса Цельсия. У нее больше плотность и способность к растворению веществ значительно снижена. Кроме того, ее обозначают другой формулой (D2O).
Живые системы реагируют на такое химическое соединение плохо. Лишь некоторые виды бактерий смогли в нем приспособиться к жизни. Рыбы и вовсе не выдержали такого эксперимента. В организме человека, дейтерий может находиться несколько недель, а после выводится, не причиняя вреда.
Важно! Пить дейтериевую воду – нельзя!
Уникальные свойства воды. Химия – просто.
Химические свойства воды
Вывод
Широкое применение тяжелая вода нашла в ядерной и атомной промышленности, а обычная в повсеместном.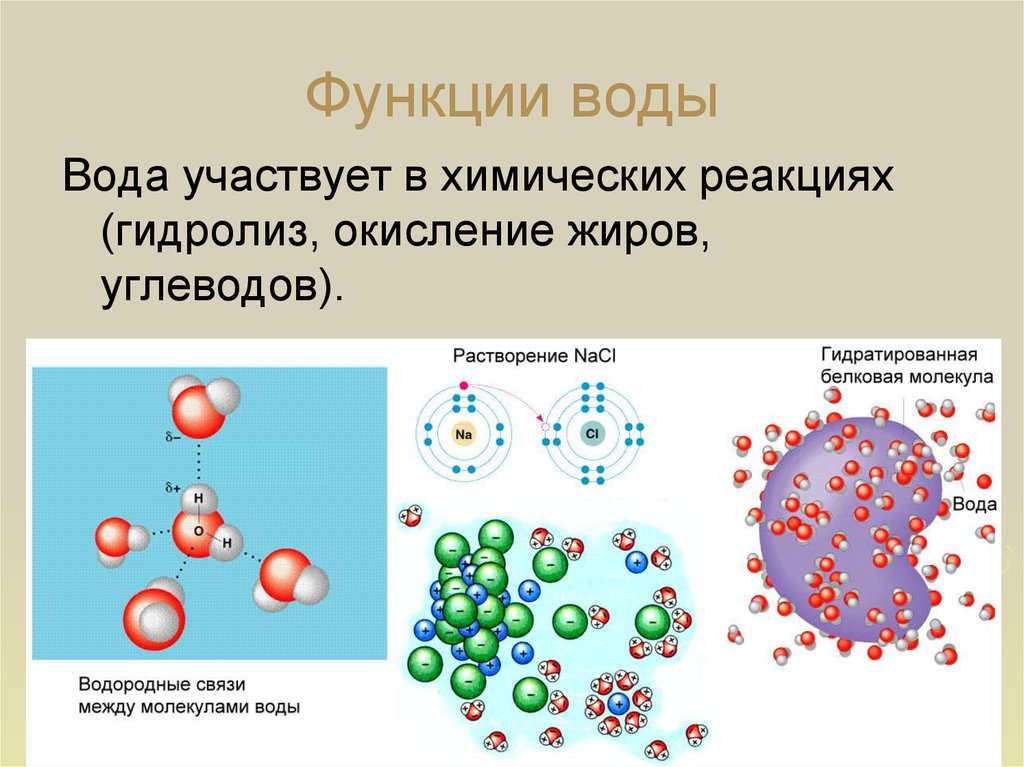
Физические и химические свойства воды. Показатели качества воды : Farmf
Физические и химические свойства воды. Показатели качества воды
- 1.1. Состав воды и ее строение
- 1.2. Особенности физико-химических свойств воды
- 1.3. Диаграмма состояния воды
- 1.4. Структура и свойства льда
- 1.5. Физические свойства воды
- 1.6. Химические свойства воды
- 1.7. Вода в связанном состоянии
- 1.8. Замерзание воды и водных растворов в различных условиях
- 1.9. Показатели качества воды
Одним из важнейших химических соединений для человечества является вода. Вода, занимая почти 75 % поверхности Земли, является самым обильным и ценным ресурсом. Мировые запасы воды огромны – около 1389 млн. км 3 . Если распределить их поровну, то на каждого жителя планеты пришлось бы по 280 млрд. литров. Однако 97 % водных ресурсов приходится на долю океанов и морей, в которых вода слишком соленая. Оставшиеся 3% – пресные воды.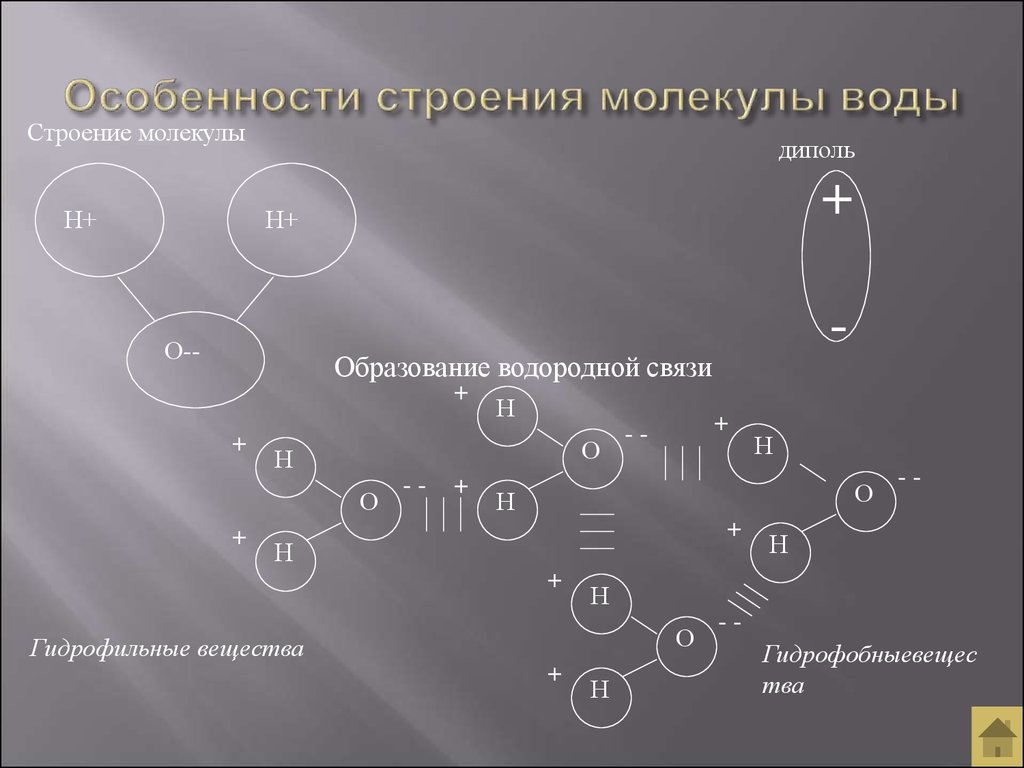 Вода составляет от 50-97 % веса всех растений и животных и около 70 % веса человеческого тела. Все химические реакции в организме протекают только в водной среде.
Вода составляет от 50-97 % веса всех растений и животных и около 70 % веса человеческого тела. Все химические реакции в организме протекают только в водной среде.
Из всей пресной воды человечество может использовать лишь 0,003%, так как она либо сильно загрязнена, либо залегает на больших глубинах и ее нельзя извлечь по приемлемым ценам, либо содержится в айсбергах, полярных льдах, в атмосфере и в почве.
Вода находится в постоянном круговороте (рис.1). Этот естественный процесс рециркуляции происходит до тех пор, пока потребление воды не становится интенсивнее, чем восполняются ее запасы и пока не превышен объем отходов, делающий воду непригодной. Существует два источника пресной воды поверхностные воды и грунтовые воды.
Рис. 1. Круговорот воды в биосфере
Критериями использования воды служат показатели водозабора и водопотребления. Почти три четверти добываемой в мире воды идет на орошение, остальная вода используется в промышленности и коммунальном хозяйстве, для охлаждения оборудования на электростанциях и т. д.
д.
На выращивание одной тонны пшеницы необходимо 1500 тонн воды, одной тонны риса – более 7000 тонн, одной тонны хлопка – 10000 тонн. Огромное количество воды требуется для производства продовольствия и различной промышленной продукции. Прежде чем в магазине появится литровая банка консервов из фруктов или овощей, на нее будет истрачено 40 литров воды. Для производства суточной нормы пищевых продуктов на одного человека требуется около 6 м 3 воды.
Различают природную, сточную и денатурированную воду.
- Природная вода – это вода, которая качественно и количественно формируется под влиянием естественных процессов при отсутствии антропогенного воздействия и качественные показатели которой находятся на естественном среднемноголетнем уровне.
- Сточная вода – это вода, бывшая в бытовом, производственном или сельскохозяйственном употреблении, а также прошедшая через какую-либо загрязненную территорию, в том числе населенного пункта.
- Денатурированная или природно-антропогенная вода — природная вода, подвергаемая антропогенному загрязнению, например, путем смешивания со сточной водой.

Человек может существовать без пищи несколько недель, а без воды лишь несколько дней. От поступления воды в живой организм зависит переваривание пищи, циркуляция крови, удаление распадающихся клеток, регуляция кислотно-основного баланса и температура тела. Несмотря на активное участие в процессах обмена вода инертна в физиологическом отношении. Вода участвует в таких процессах, как перестройка молекул и ионов, образование сложных органических молекул, выполняющих биохимические функции, диссоциация молекул, гидролиз соединений, окислительно-восстановительные реакции и т.д. Для инженеров-строителей представляют интерес свойства жидкой воды и льда и особенности их внутреннего строения, формы связанной воды, образование кристаллогидратов и гидрогелей, составляющих основу при твердении вяжущих материалов.
В современном строительстве широко применяются различные вяжущие материалы (цемент, гипс, известь и др.). Вяжущие необходимы для изготовления бетона, строительных деталей и конструкций, скрепления отдельных элементов сооружений, камней, кирпичей. Строительные растворы готовят смешивая с водой вяжущие материалы, пластичность растворов которых обеспечивает их применение для различных строительных работ. Пластичная масса со временем загустевает и превращается в твердое камневидное тело. При замешивании порошкового гипса (СаSО 4 * 0,5Н2О) получают тесто, затвердевающее за счет присоединения воды и образования двухводного гипса:
Строительные растворы готовят смешивая с водой вяжущие материалы, пластичность растворов которых обеспечивает их применение для различных строительных работ. Пластичная масса со временем загустевает и превращается в твердое камневидное тело. При замешивании порошкового гипса (СаSО 4 * 0,5Н2О) получают тесто, затвердевающее за счет присоединения воды и образования двухводного гипса:
2(СаSО 4 * 0,5Н2О) + 3 Н2О) =2(СаSО 4 * 2Н2О)
Этот процесс используется для получения перегородочных плит, панелей, слепков с различных предметов и получения известковогипсовых растворов для штукатурных работ. Известковый раствор – смесь гашеной извести с песком и водой, также используют в качестве вяжущего материала. Но в отличие от гипса он затвердевает в результате отщепления воды и образования кристаллического карбоната кальция по схеме:
Са(ОН)2+ СО2= СаСО 3 + Н2О
Сложные процессы гидратации и поликонденсации составных частей цементного клинкера происходят только при его смешивании с водой и способствуют постепенному затвердеванию и образованию высокомолекулярных силикатов и алюминатов кальция.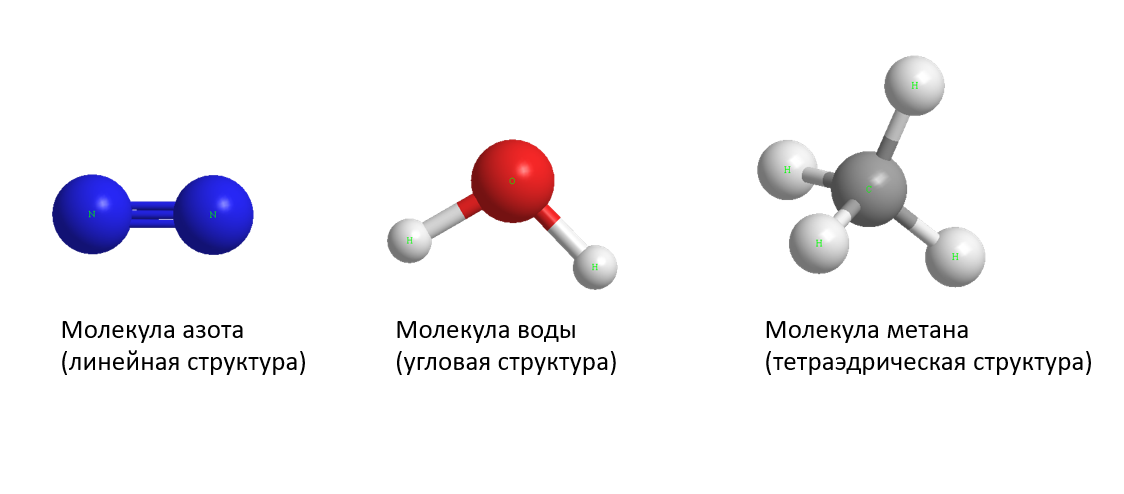 Например, однокальциевый алюминат сначала гидратируется:
Например, однокальциевый алюминат сначала гидратируется:
СаО * А12О 3 + 10 Н2О = СаО * А12О 3 *10Н2О
Образовавшийся гидроалюминат кальция переходит в более устойчивый кристаллический двухкальциевый гидроалюминат с выделением гидроксида алюминия:2(СаО * А12О 3 *10Н2О) + Н2О =2СаО * А12О 3 * 8Н2О +2А1(ОН) 3
Прочность цементного камня нарастает с большой скоростью.
Свойства воды
1.1. Состав воды и ее строение
Н2О (оксид водорода) – устойчивое соединение, с массовой долей водорода 11,10 % и кислорода – 88,91 %. Известно до 36 разновидностей молекул воды, состоящих из сочетаний изотопов водорода (протия – 1 1 Н; дейтерия – 21 D и трития – 3 1 Т) и кислорода с массовыми числами от 14 до 19. На долю стабильного изотопа Н2О (где кислород с массовым числом 16) приходится 99,73 % от массы воды. Тяжелая вода D2О получается в результате многократного электролиза обычной воды и отличается по свойствам от обычной воды.
Таблица 1.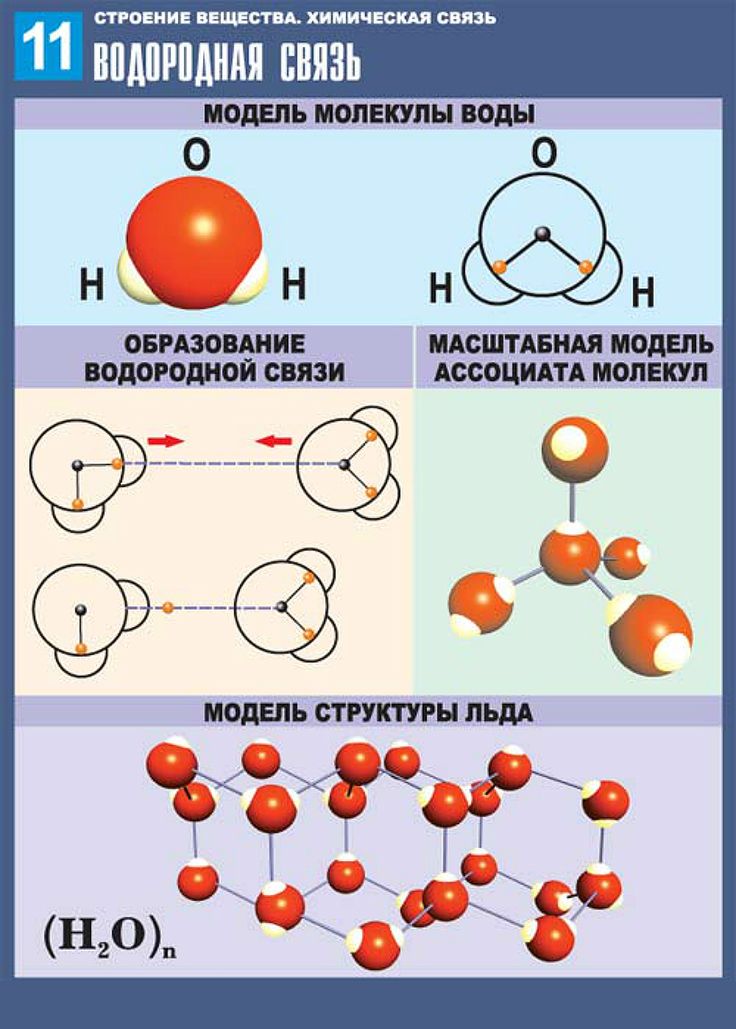 Свойства обычной и тяжелой воды
Свойства обычной и тяжелой воды
Реакции с тяжелой водой происходят значительно медленнее, чем с обычной водой. Тяжелая вода оказывает сильное биологическое воздействие на живые организмы и непригодна для жизненных процессов, так как более прочные связи О – Д изменяют скорости биологических процессов и приводят к смещению равновесия этих процессов. Тяжелую воду применяют в качестве замедлителя нейтронов в ядерных реакторах, а также как источник дейтронов Д + для ядерных и термоядерных реакций, для получения искусственных радиоактивных изотопов, используемых при исследовании механизмов протекания реакций.
Между атомами водорода (1s1) и кислорода (1s2 2s2 2р4) в молекуле воды образуются две ковалентные полярные связи по обменному механизму.
По методу ВС (валентных связей) атом кислорода в молекуле воы находится в состоянии sр 3 -гибридизации. Две гибридные орбитали атома кислорода перекрываются с s-орбиталями двух атомов водорода, а на двух других гибридных орбиталях кислорода располагаются две несвязывающие электронные пары (рис. 2а). В результате отталкивания связывающих и несвязывающих электронных пар валентный угол в молекуле жидкой воды равен 105о.
2а). В результате отталкивания связывающих и несвязывающих электронных пар валентный угол в молекуле жидкой воды равен 105о.
Неподеленные пары электронов кислорода влияют на строение молекулы воды, придавая ей тетраэдрическую структуру (рис. 2б). Орбитали, с неподеленными электронными парами, направлены к противоположным от протонов вершинам тетраэдра. Поэтому около протонов создается пониженная электронная плотность (+), а вокруг орбиталей с неподеленной парой электронов – повышенная электронная плотность (-). а) б)
Рис. 2. Схема структуры молекулы воды
В молекуле воды ядерные центры атомов водорода и кислорода образуют равнобедренный треугольник (рис.3)
Рис. 3. Расстояние между ядрами и угол связи в молекуле жидкой воды
Параметры молекул воды зависят от ее агрегатного состояния (табл. 2).
Таблица 2. Параметры молекул воды
1.2. Особенности физико-химических свойств воды
1. Полярность. Высокая полярность молекул воды объясняется несовпадением центров тяжести ее положительных и отрицательных зарядов. Благодаря необычно большому дипольному моменту (μ (Н2О) = 1,85 Д) вода является химически активным соединением, обусловливающим электролитическую диссоциацию солей кислот, оснований и имеет аномально большую диэлектрическую постоянную, равную 79,5 при 25 о С, т.е. в воде два электрических заряда притягиваются или отталкиваются с силой приблизительно в 80 раз меньшей, чем в вакууме.
Полярность. Высокая полярность молекул воды объясняется несовпадением центров тяжести ее положительных и отрицательных зарядов. Благодаря необычно большому дипольному моменту (μ (Н2О) = 1,85 Д) вода является химически активным соединением, обусловливающим электролитическую диссоциацию солей кислот, оснований и имеет аномально большую диэлектрическую постоянную, равную 79,5 при 25 о С, т.е. в воде два электрических заряда притягиваются или отталкиваются с силой приблизительно в 80 раз меньшей, чем в вакууме.
2. Наличие водородных связей. Молекулы воды связаны между собой водородными связями. По прочности они занимают промежуточное положение между ковалентными и межмолекулярными связями. Причиной образования водородной связи является смещение единственного электрона водорода к сильно электроотрицательному атому кислорода. При этом водород превращается в частицу с уникальными свойствами:
а) не имеет электрона, а поэтому не отталкивается, а притягивается электронными оболочками других частиц;
б) обладает ничтожно малым размером и, следовательно, большим поляризующим действием. Энергия водородной связи в воде равна 29 кДж/моль. Водородные связи объединяют молекулы воды в ассоциаты (рис.4.)
Энергия водородной связи в воде равна 29 кДж/моль. Водородные связи объединяют молекулы воды в ассоциаты (рис.4.)
Ассоциация молекул воды является причиной аномально высоких температур ее кипения, плавления, теплоты парообразования. Известно, что в ряду аналогичных соединений с увеличением молярной массы возрастают температуры плавления и кипения. Однако в случае воды при сопоставлении ее с аналогами эта закономерность нарушается (рис. 5).
Рис. 5. Зависимость температур кипения (I) и замерзания (II) от величины молярной массы вещества для водородных соединений р-элементов (VI) группы
Молекулы воды не образуют ассоциатов в парообразном состоянии. В жидкой воде ассоциированные молекулы могут находиться в равновесии с неассоциированными молекулами. Среднее координационное число молекул в жидкой фазе близко к четырем. В 1932 году Бернал и Фаулер (Англия), основываясь на данных рентгеноструктурного анализа, установили, что связь между молекулами и относительное расположение их в жидкой воде подобно расположению молекул воды в структуре льда. Определить процентное содержание свободных молекул не удалось. Очевидно, что с повышением температуры усиливается тепловое движение и уменьшается степень связанности молекул.
Определить процентное содержание свободных молекул не удалось. Очевидно, что с повышением температуры усиливается тепловое движение и уменьшается степень связанности молекул.
Притяжение молекул воды друг к другу обусловливает большую величину поверхностного натяжения 72,7 мДж/м2. Это значит, что для разрыва водяного столбика диаметром 2,5 см потребуется усилие в 90 тонн. Схема возникновения поверхностного натяжения такова:
молекула А, расположенная внутри жидкости, притягивается соседними частицами с одинаковой силой, т.е. межмолекулярные силы, действующие на молекулу воды, расположенную в объеме фазы, распределены равномерно со стороны соседних молекул;
молекула Б, расположенная на поверхности жидкости, испытывает действие межмолекулярных сил в большей степени со стороны жидкой фазы и почти не взаимодействует с молекулами газообразной фазы. Поэтому каждая отдельная молекула на поверхности жидкости обладает большей энергией по сравнению с энергией молекулы в объеме фазы. Она находится в неравновесном состоянии и стремится втянуться в объем жидкости (рис. 6).
Она находится в неравновесном состоянии и стремится втянуться в объем жидкости (рис. 6).
Поэтому небольшие количества воды принимают шарообразную форму, так как из всех геометрических тел одинакового объема шар имеет наименьшую поверхность.
Рис. 6. Схема возникновения поверхностного натяжения на границе раздела двух фаз
Водородные связи влияют на растворимость веществ. В воде хорошо растворяются вещества, имеющие в составе полярные группы или ионную связь, например, спирты, амины, сахара, соли, кислоты, основания, а также некоторые газы NН 3 , СО2, SО2и другие. Структура льда и его свойства также обусловлены водородными связями.
3. Способность к донорно-акцепторному взаимодействию. Вода проявляет свойства донора за счет неподеленной пары электронов атома кислорода. Этим объясняется высокая химическая активность воды и способность ее к комплексообразованию в качестве лигандов. Вода относится к слабым электролитам и поэтому ионизирует в небольшой степени по следующей схеме:
В одной тонне чистой воды содержится 0,1 мг-иона водорода и 1,7 мг-иона гидроксила. Время пребывания водорода в одной из молекул не превышает 10 -8 сек, что указывает на большую скорость диссоциации.
Время пребывания водорода в одной из молекул не превышает 10 -8 сек, что указывает на большую скорость диссоциации.
1.3. Диаграмма состояния воды
Вода при 0оС и давлении насыщенного пара 600,5 Па образует три фазы в состоянии равновесия (рис. 7):
ПАР <=> ЛЕД <=> ВОДА
С повышением температуры исчезает твердая фаза – лед, с понижением температуры – жидкая фаза – вода. Система из трехфазной системы становится двухфазной. Тройная точка (0) – место пересечения трех кривых 1, 2, 3 – соответствует нонвариантной системе, т.е. число ее степеней свободы равно нулю. Изобара с давлением 1,013 * 105 Па пересекает кривую I при температуре кипения воды. Точки кривой I соответствуют таким значениям температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии (кривая кипения). Аналогично кривая II – кривая плавления, III – кривая сублимации. Отклонение кривой II к оси ординат с повышением давления указывает на снижение температуры плавления, что обусловлено меньшей плотностью льда по сравнению с водой.
Рис. 7. Схема фазовой диаграммы воды
1.4. Структура и свойства льда
Кристаллы льда имеют гексагональную структуру (рис. 8,а)
Как видно из рисунка 8а в структуре льда есть пустоты, которые могут заполняться другими соединениями, например, одноатомными молекулами газов с образованием соединений включения или клатратов. Каждый атом кислорода тетраэдрически связан с четырьмя другими атомами кислорода (рис. 8б). Между ними располагаются атомы водорода. Два атома водорода соединены с атомом кислорода ковалентной полярной связью (длина связи – 0,099 нм), а два других – соединены водородной связью (длина связи – 0,176 нм), т.е. принадлежат двум другим молекулам воды. В результате образуется рыхлая структура с небольшой плотностью. При плавлении льда водородные связи частично разрушаются (примерно на 10 %), молекулы воды сближаются и плотность воды немного возрастает. При нагревании воды происходит ее расширение, увеличивается расстояние между молекулами и одновременно разрушаются водородные связи, что приводит к уменьшению объема. Поэтому плотность воды проходит через максимум при температуре 3,98оС (рис. 9).
Поэтому плотность воды проходит через максимум при температуре 3,98оС (рис. 9).
Рис. 9. Изменение плотности воды с температурой (dv/dt – изменение объема данного количества воды с температурой)
Благодаря аномалии в плотности лед плавает на воде. При замерзании на глубине водоемов сохраняется относительно теплая вода (не ниже 4оС), что позволяет существовать живым организмам.
По мере замерзания воды происходит увеличение ее объема (~10 %). Это может привести к нежелательным последствиям, например, к разрыву стальных труб, развитию трещин в скальных породах, разрушению стройматериалов. Наибольший вред приносит периодическое замораживание и оттаивание воды. Учитывая свойства воды, строительные материалы и сооружения из них защищают различными способами.
Необычным свойством льда является его пластичность. Примером проявления пластичности может служить течение горных ледников. Это свойство льда объясняется наличием в его структуре таких сечений, вдоль которых снежные слои кристалла оказываются слабее связанными водородными связями.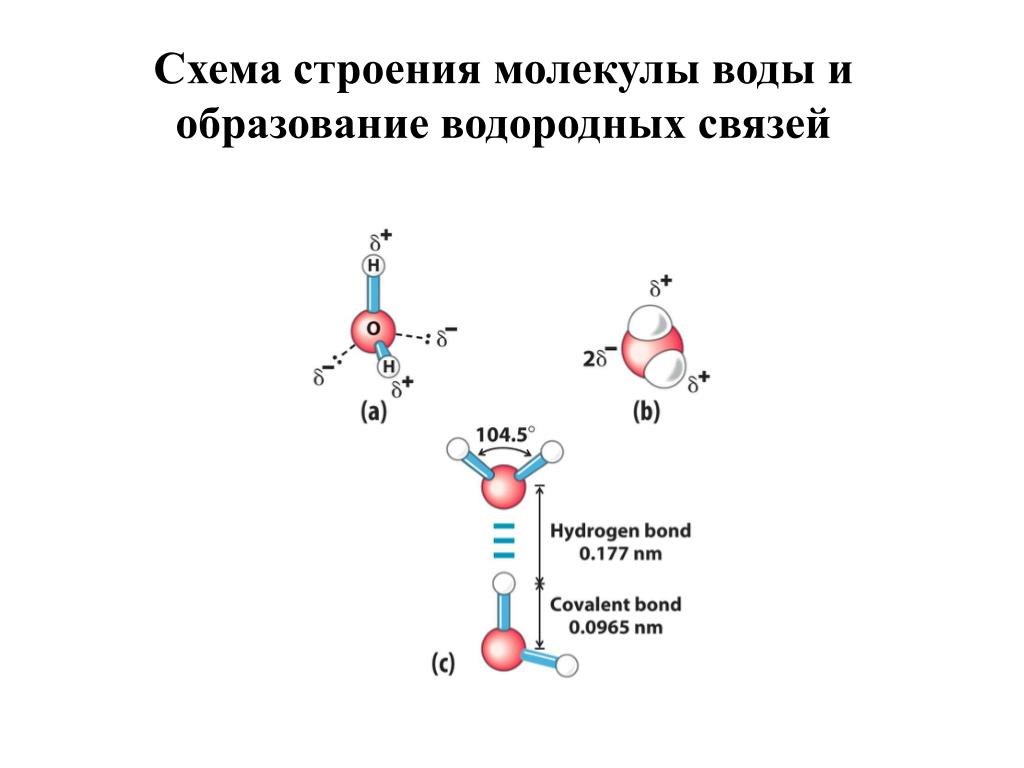
1.5. Физические свойства воды
Вода – прозрачная текучая жидкость, не имеющая в чистом виде вкуса, запаха, цвета. Синий цвет морей, озер обусловлен присутствием в воде тонко измельченных твердых веществ. Некоторые свойства воды используются для определения единиц измерения фундаментальных физических величин. Например, в основу стоградусной термометрической шкалы положен интервал между точками замерзания (0оС) и кипения (100оС) воды при давлении 101,3 кПа.
Плотность веществ сравнивают с плотностью воды, выбранной в качестве стандартной. Плотность чистой воды равна 1 г/см 3 при 3,98оС. Благодаря высокой теплоемкости воды 4,18 кДж/(г . град), она выполняет функции регулятора температуры на земном шаре. Вода медленно нагревается и медленно остывает. Поэтому, например, отсутствие воды в пустыне приводит к резким суточным колебаниям температуры (жара днем и холод ночью).
1.6. Химические свойства воды
Наличие неподеленных пар электронов и высокий дипольный момент воды придают ей химическую активность.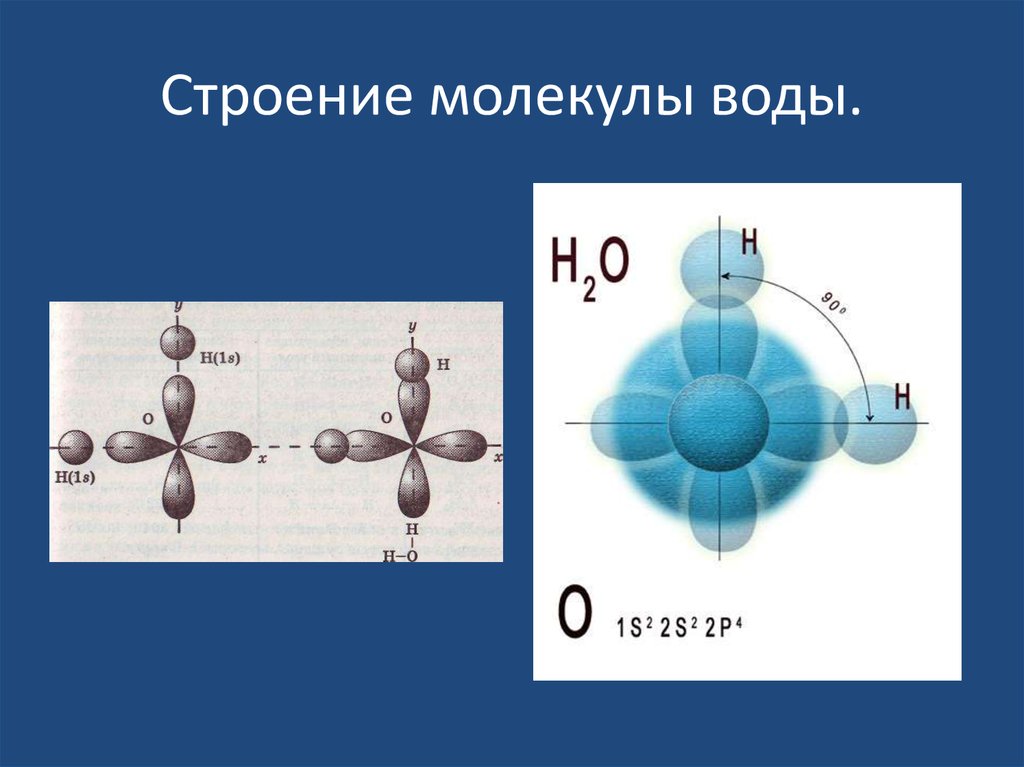 Вода взаимодействует с большим количеством разнообразных веществ:
Вода взаимодействует с большим количеством разнообразных веществ:
1. С инертными газами. При пропускании инертных газов над переохлажденной водой под давлением 150 атм. образуются клатраты или соединения включения типа Ar * 6Н2О, Xе *6Н2О, Кr *6Н2О, устойчивые при низких температурах.
2. С галогенами. Реакции галогенов с водой зависят от окислительной активности галогенов. В ряду F2 – С12– Вr2– I2окислительные свойства уменьшаются, поэтому реакции взаимодействия с водой протекают следующим образом:
Н2О + F2=2НF + О (реакция протекает при обычной температуре)
Н2О + С12<=> НС1 + НС1О (система находится в равновесии)
Н2О + Вr2(I2) <=> НВr + НвrО (равновесие смещено в сторону исходных веществ)
2 Н2О + С12= 4 НС1 + О2(при нагревании)
3. С атомарным кислородом. Н2О + О = Н2О2
4. С фосфором. 6 Н2О +2Р =2НРО 3 + 5 Н2(давление, катализатор)
5. С углеродом и его соединениями. В промышленности эти реакции используются для получения водорода. Н2О (пар) + С (раскаленный) = СО + Н2(смесь СО + Н2– водяной газ) Н2О + СО = СО2+ Н2(катализатор – Fе, 450оС) Н2О + СН4 = СО + 3 Н2(1200 – 1400оС)
В промышленности эти реакции используются для получения водорода. Н2О (пар) + С (раскаленный) = СО + Н2(смесь СО + Н2– водяной газ) Н2О + СО = СО2+ Н2(катализатор – Fе, 450оС) Н2О + СН4 = СО + 3 Н2(1200 – 1400оС)
6. С металлами.
а) С s-элементами. Реакция протекает при обычных условиях (кроме магния, с которым реакция протекает при 100оС, и бериллия, покрытого прочной оксидной пленкой)2Н2О +2Nа =2NаОН + Н2
б) С металлами средней активности (Fе, Сd, Со, Ni т.д.) Н2О + Fе = FеО + 3Н2(при температуре красного каления)
в)С благородными металлами (Аg, Аu, Рt) и ртутью вода не взаимодействует.
7. С гидридами s-элементов. Н2О + NаН = NаОН + Н2
8. С основными и кислотными оксидами. Н2О + СаО = Са(ОН)2Н2О + SO 3 = Н2SО 4
9. С солями (гидролиз солей) СuС12+ Н2О <=> СuОНС1 + НС1 Сu 2+ + Н2О <=> СuОН + + Н +
10. С различными веществами с образованием гидратов Nа2СО 3 + 10 Н2О = Nа2СО 3 .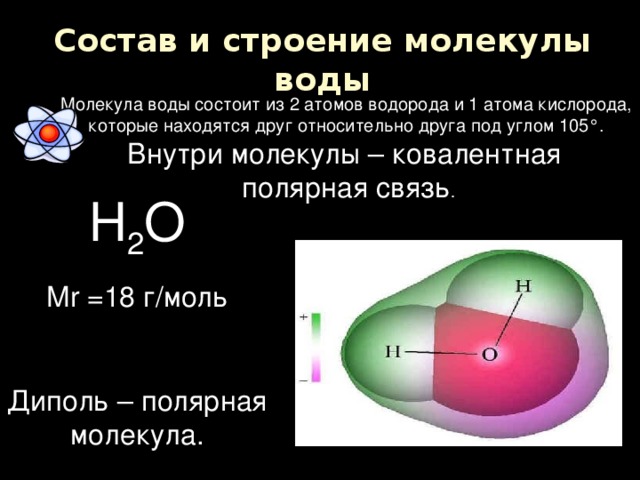 10 Н2О
10 Н2О
11. С органическими веществами (реакции гидратирования) С2Н 4 + Н2О = С2Н 5 ОН
Термическая устойчивость воды. Вода устойчива к нагреванию, но свыше 1000оС происходит ее термическая диссоциация.
2Н2О <=>2Н2+ О2
Каталитические свойства воды. Некоторые металлы не реагируют с сухим хлором, натрий не окисляется в атмосфере воздуха без следов влаги. Фтороводород в отсутствии влаги не разъедает стекло и т. д.
1.7. Вода в связанном состоянии
Формы состояния связанной воды довольно многообразны. Для строительных специальностей интерес представляют следующие формы: химически связанная вода, вода в кристаллогидратах, вода в гидрогелях, вода, адсорбированная на поверхности твердых тел и капиллярная вода. Рассмотрим более подробно состояния связанной воды без учета переходных форм.
1. Химически связанная вода. В такой форме вода не существует самостоятельно, но может выделиться в свободном виде Например, при нагревании гидроксида кальция происходит диссоциация по следующей схеме:
Са(ОН)2<=> СаО + Н2О
Это гетерогенная реакция с участием твердых веществ — Са(ОН)2, СаО и паров воды. Поэтому константа равновесия определяется концентрацией паров воды или их давлением К = С(Н2О) или К = Р(Н2О)
Поэтому константа равновесия определяется концентрацией паров воды или их давлением К = С(Н2О) или К = Р(Н2О)
Иными словами при любой температуре равновесное давление водяного пара является постоянной величиной и не зависит от количеств Са(ОН)2и СаО. Согласно принципу Ле-Шателье равновесие смещается в сторону прямой реакции как при повышении температуры (прямая реакция – эндотермическая), так и при уменьшении влажности воздуха. Зависимость давления диссоциации Са(ОН)2от температуры смещена в сторону высоких температур, что свидетельствует о больших затратах энергии для выделения водяного пара из Са(ОН)2, чем из свободной воды (рис. 10)
Рис. 10. Влияние температуры на давление диссоциации Са(ОН)2
Химически связанная вода содержится в большинстве вяжущих строительных материалов, во многих горных породах, а также в кислородсодержащих кислотах, основных и кислых солях.
2. Вода в кристаллогидратах. Вода, содержащаяся в кристаллогидратах называется кристаллизационной.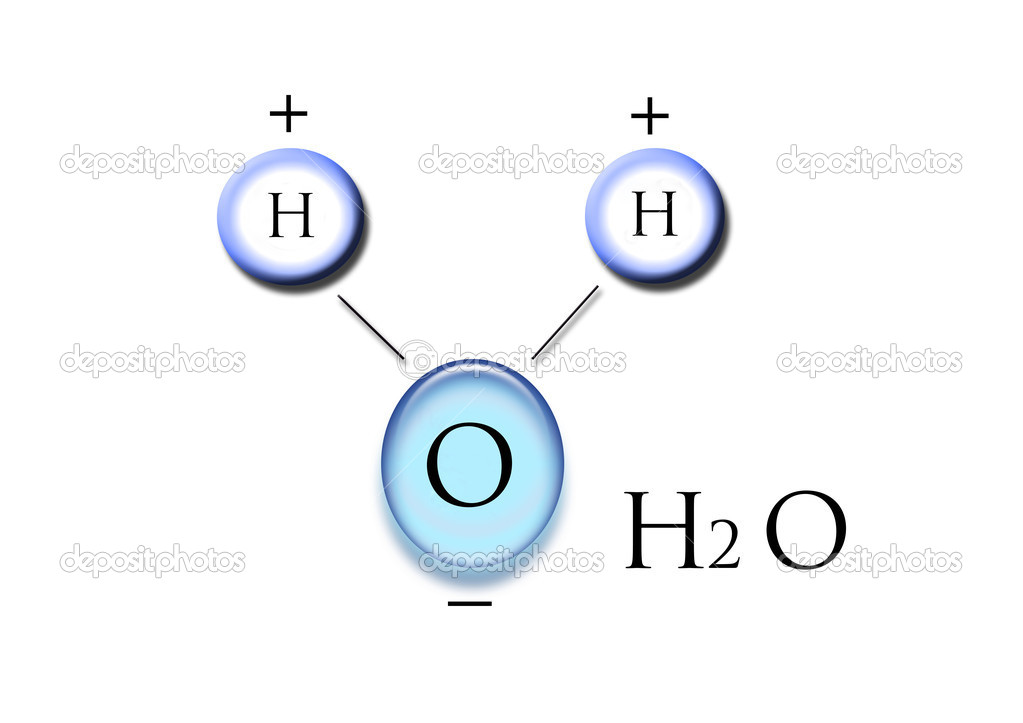 Количество кристаллизационной воды влияет на устойчивость соединения. Кристаллогидрат с большим содержанием воды устойчив при низких температурах и разлагается при ее повышении, образуя менее гидратированные соединения. Например, при дегидратации гексагидрата хлорида кальция происходят следующие процессы:
Количество кристаллизационной воды влияет на устойчивость соединения. Кристаллогидрат с большим содержанием воды устойчив при низких температурах и разлагается при ее повышении, образуя менее гидратированные соединения. Например, при дегидратации гексагидрата хлорида кальция происходят следующие процессы:
В кристаллической решетке молекулы воды связаны и с анионами, и с катионами, кроме того они могут располагаться между слоями, одновременно взаимодействуя с двумя-тремя ионами. Так, слоистая структура двухводного гипса СаSО4 *2Н2О состоит из небольших по размеру катионов Са2+ и крупных анионов SО42-. Молекулы воды располагаются в этом «шахматном поле» через два слоя. С ионом Са2+ вода связывается через атом кислорода (донор), а через водород (акцептор) с кислородом, содержащимся в ионах SО42-.
В условиях высокой температуры устойчивы менее гидратированные или безводные соединения, поэтому при получении вяжущих материалов образуются именно такие формы. При обычной температуре идет гидратация вяжущих материалов в результате взаимодействия как с жидкой водой или водными растворами, так и с водяным паром. Этот процесс способствует образованию пластичной массы вяжущих материалов. Со временем вяжущие материалы превращаются в камневидное тело, твердеют, так как образуются кристаллогидраты (гипс, портландцемент и др.).
При обычной температуре идет гидратация вяжущих материалов в результате взаимодействия как с жидкой водой или водными растворами, так и с водяным паром. Этот процесс способствует образованию пластичной массы вяжущих материалов. Со временем вяжущие материалы превращаются в камневидное тело, твердеют, так как образуются кристаллогидраты (гипс, портландцемент и др.).
3. Вода в гидрогелях. Твердение вяжущих строительных материалов проходит через стадию образования геля – студнеобразной массы. Это полужидкое – полутвердое состояние. Дегидратация геля (его обезвоживание) происходит по-разному: при обычной температуре или при нагревании вода испаряется или вступает в химическое взаимодействие с другими веществами. При этом давление водяного пара над гелем по мере его обезвоживания понижается непрерывно. При одинаковом количестве воды в геле давление водяного пара зависит от его структуры, которая может измениться со временем.
По мере обезвоживания геля изменяются его свойства, пористость.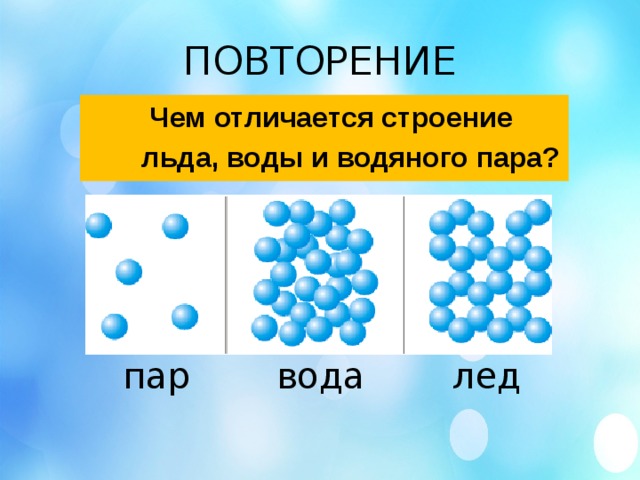 Постепенно гель переходит в твердое камневидное тело с высокой прочностью. Некоторые гели обладают способностью разжижаться при механических воздействиях – перемешивании, вибрировании и т.п. Неоднократное обратимое разжижение геля называют тиксотропией. Процесс тиксотропии используют при твердении бетона.
Постепенно гель переходит в твердое камневидное тело с высокой прочностью. Некоторые гели обладают способностью разжижаться при механических воздействиях – перемешивании, вибрировании и т.п. Неоднократное обратимое разжижение геля называют тиксотропией. Процесс тиксотропии используют при твердении бетона.
4. Адсорбированная вода. Многие строительные материалы поглощают своей поверхностью влагу из окружающей среды, в первую очередь из воздуха. Это явление называют адсорбцией. Адсорбция зависит от химического состава, состояния поверхности и от внешних условий (температуры, влажности и т.д.).
Если молекулы воды вступают в химическое взаимодействие с веществами поверхности, то это способствует образованию прочных соединений – хемосорбция. Однако в таком процессе участвует лишь часть воды, так как он ограничен доступной частью поверхности. С помощью специальной обработки состояние поверхности твердого вещества можно изменить таким образом, что оно будет отличаться от внутренних слоев.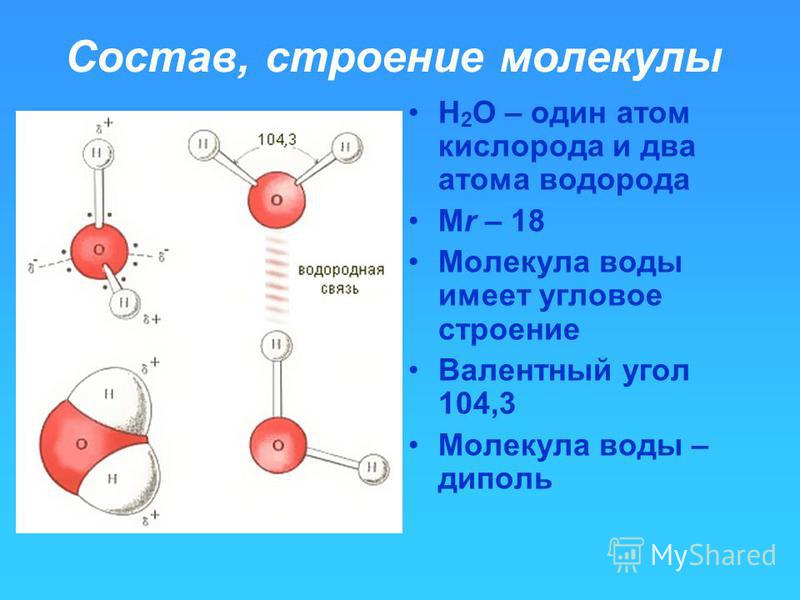 Это изменение называют химическим модифицированием. Вещества разделяют по отношению к воде на гидрофильные (хорошо смачиваются водой) и гидрофобные (не смачиваются водой) вещества. Соответствующая обработка строительных материалов изменяет их свойства по отношению к воде. С помощью химически модифицированных поверхностей уменьшают или увеличивают гидрофильность или гидрофобность поверхности строительной конструкции, что широко используется в строительной промышленности.
Это изменение называют химическим модифицированием. Вещества разделяют по отношению к воде на гидрофильные (хорошо смачиваются водой) и гидрофобные (не смачиваются водой) вещества. Соответствующая обработка строительных материалов изменяет их свойства по отношению к воде. С помощью химически модифицированных поверхностей уменьшают или увеличивают гидрофильность или гидрофобность поверхности строительной конструкции, что широко используется в строительной промышленности.
Под влиянием физических факторов вода непрочно адсорбируется поверхностью твердого вещества (физическая адсорбция). Поверхностные частицы твердого вещества (атомы, ионы, молекулы) притягивают подобные им частицы из окружающей среды, создавая силовое поле. Выход частиц из этого поля требует затраты энергии, т.е. «испарение» частиц с поверхности не является свободным. Так как поверхность твердого вещества неоднородна и имеет более или менее активные участки, по отношению к водяным парам, то при небольшой концентрации паров именно они участвуют в поглощении. Однако при повышении концентрации водяных паров оказываются задействованными и другие участки. Следовательно, повышение концентрации водяных паров в окружающей среде способствует увеличению количества адсорбированной воды, которое сильно различается для разных веществ.
Однако при повышении концентрации водяных паров оказываются задействованными и другие участки. Следовательно, повышение концентрации водяных паров в окружающей среде способствует увеличению количества адсорбированной воды, которое сильно различается для разных веществ.
Адсорбция – экзотермический процесс, поэтому с повышением температуры количество адсорбированной воды уменьшается. При хемосорбции влияние температуры может быть незначительным. Увеличение поверхности (внутренние поры, капилляры, повышение степени дисперсности) способствует увеличению количества адсорбированной воды, что следует учитывать при использовании строительных материалов.
5. Капиллярная вода. Жидкость, находящаяся в трубке, взаимодействует с ее поверхностью. В стеклянной трубке, опущенной одним концом в воду, столбик воды поднимается выше уровня воды в сосуде, образуя вогнутый мениск (рис. 11).
Рис.11. Стеклянная трубка, опущенная в воду (а) и ртуть(б)
Ртуть в таких же условиях опускается ниже своего уровня в сосуде, образуя выпуклый мениск. Это означает, что поверхность стекла смачивается водой и не смачивается ртутью. Чем меньше диаметр трубки, тем значительнее вышеописанный эффект. Различие уровней воды в трубке и сосуде означает, что давление ее насыщенного пара над этими поверхностями неодинаково. Давление пара над вогнутым мениском в капилляре, стенки которого смачиваются водой, меньше, чем над плоской поверхностью воды во внешнем сосуде. Это приводит к тому, что пар не конденсируется в жидкость на ее плоской поверхности, но конденсируется в капилляре, являясь насыщенным или пересыщенным по отношению к вогнутой поверхности мениска. Это явление называют капиллярной конденсацией, и оно возможно для любой жидкости. На практике роль капилляров могут выполнять поры разного размера и формы. Способность поверхности смачиваться той или иной жидкостью играет решающую роль в капиллярной конденсации.
Это означает, что поверхность стекла смачивается водой и не смачивается ртутью. Чем меньше диаметр трубки, тем значительнее вышеописанный эффект. Различие уровней воды в трубке и сосуде означает, что давление ее насыщенного пара над этими поверхностями неодинаково. Давление пара над вогнутым мениском в капилляре, стенки которого смачиваются водой, меньше, чем над плоской поверхностью воды во внешнем сосуде. Это приводит к тому, что пар не конденсируется в жидкость на ее плоской поверхности, но конденсируется в капилляре, являясь насыщенным или пересыщенным по отношению к вогнутой поверхности мениска. Это явление называют капиллярной конденсацией, и оно возможно для любой жидкости. На практике роль капилляров могут выполнять поры разного размера и формы. Способность поверхности смачиваться той или иной жидкостью играет решающую роль в капиллярной конденсации.
Перемещение влаги (миграция) в пористых и сыпучих материалах, грунте возможно за счет капиллярной конденсации. При этом в результате миграции система в естественных условиях переходит в более равновесное состояние.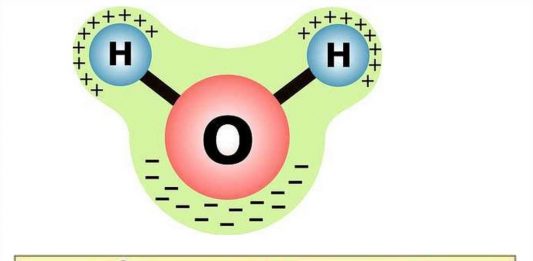 Внутри системы достигается одинаковое парциальное давление водяного пара. Если подвергнуть нагреванию часть системы, то происходит перенос конденсированной влаги в более холодные части системы.
Внутри системы достигается одинаковое парциальное давление водяного пара. Если подвергнуть нагреванию часть системы, то происходит перенос конденсированной влаги в более холодные части системы.
1.8. Замерзание воды и водных растворов в различных условиях
В строительстве необходимо учитывать климатические условия и зависимость от них процессов замерзания воды или таяния льда. Замерзание воды в порах строительных материалов при бетонировании, кирпичной кладке и т.п. влияет на их морозостойкость. Природная вода, содержащая различные примеси, при низких температурах ведет себя иначе, чем чистая вода, представляя собой растворы разбавленных электролитов. Следует учитывать и то, что большая часть воды в твердеющих вяжущих материалах находится в связанном состоянии и условия ее замерзания также отличаются от обычной воды.
В результате исследований было доказано, что часть воды в мерзлых грунтах при температуре более низкой, чем 0оС, находится в жидком состоянии, и при нагревании в области низких температур количество такой воды обратимо возрастает. Это свидетельствует о том, что в процессе участвует как свободная, так и связанная вода. В отличие от чистой воды кристаллизация природной воды происходит в некотором интервале низких температур, который может достигать несколько десятков градусов. Между различными формами состояния воды возможно достижение равновесия. Связанная вода обладает давлением равновесного пара (Р), но более низким давлением, чем давление насыщенного пара свободной воды (Р нас. ) при той же температуре. Поэтому температура, при которой связанная вода может находиться в равновесии со льдом, всегда ниже 0 о С (рис.12). Чем сильнее связана вода и, чем ниже поэтому давление равновесного с ней пара, тем ниже температура ее замерзания.
Это свидетельствует о том, что в процессе участвует как свободная, так и связанная вода. В отличие от чистой воды кристаллизация природной воды происходит в некотором интервале низких температур, который может достигать несколько десятков градусов. Между различными формами состояния воды возможно достижение равновесия. Связанная вода обладает давлением равновесного пара (Р), но более низким давлением, чем давление насыщенного пара свободной воды (Р нас. ) при той же температуре. Поэтому температура, при которой связанная вода может находиться в равновесии со льдом, всегда ниже 0 о С (рис.12). Чем сильнее связана вода и, чем ниже поэтому давление равновесного с ней пара, тем ниже температура ее замерзания.
Капиллярная вода обладает давлением пара Р, близким к Р нас. и замерзает почти при 0 о С в относительно широких капиллярах. В более узких капиллярах этот эффект еще заметнее. Можно утверждать, что чем больше отношение Р/Р нас. отличается от единицы, тем больше понижается температура замерзания воды.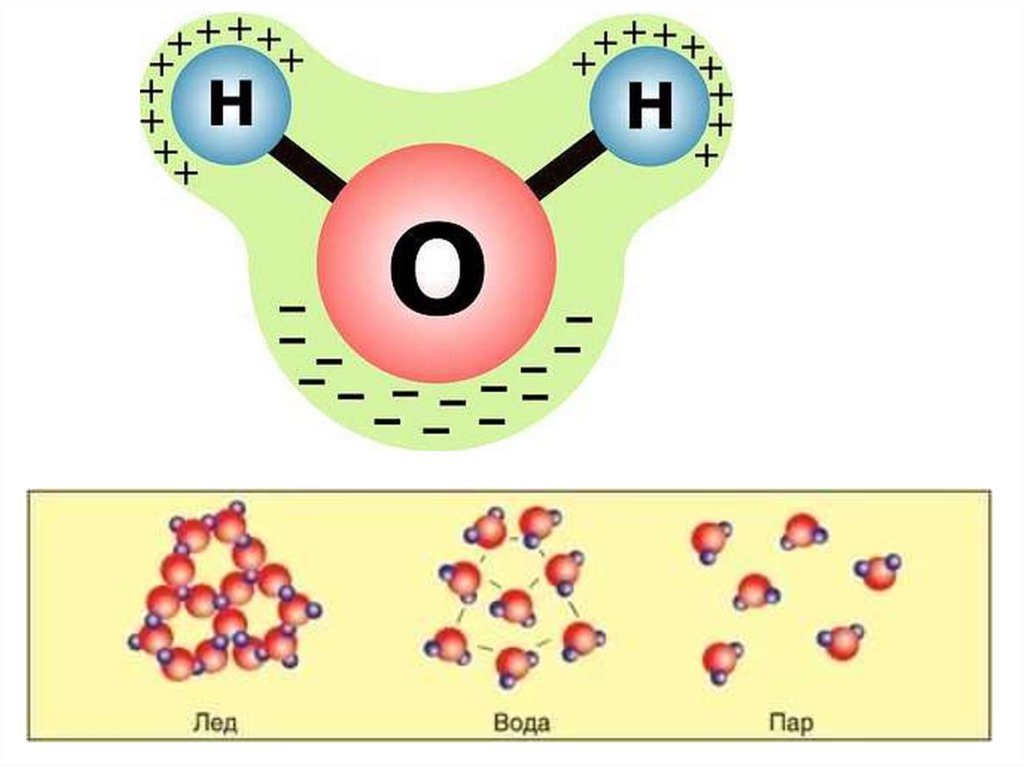 То же происходит и с адсорбированной водой. При этом следует учесть, что и капиллярная, и адсорбированная вода, находясь в жидком состоянии при температуре ниже 0 о С, является устойчивой равновесной системой и никакие «затравки» в виде льда не способствуют ее кристаллизации. Количество жидкой воды зависит от температуры, а также и от химического состава и структуры грунта. Вода находясь на расстоянии полмикрона от поверхности грунтовых частиц, является свободной и может замерзать и оттаивать почти при 0оС. Исследования показали, что образующаяся при твердении цемента вода в гидрогелях увеличивается в объеме при охлаждении в интервалах 5 – 8оС и –20 –50оС.
То же происходит и с адсорбированной водой. При этом следует учесть, что и капиллярная, и адсорбированная вода, находясь в жидком состоянии при температуре ниже 0 о С, является устойчивой равновесной системой и никакие «затравки» в виде льда не способствуют ее кристаллизации. Количество жидкой воды зависит от температуры, а также и от химического состава и структуры грунта. Вода находясь на расстоянии полмикрона от поверхности грунтовых частиц, является свободной и может замерзать и оттаивать почти при 0оС. Исследования показали, что образующаяся при твердении цемента вода в гидрогелях увеличивается в объеме при охлаждении в интервалах 5 – 8оС и –20 –50оС.
1.9. Показатели качества воды
Основными показателями качества воды различных источников являются: физические, химические, биологические и бактериологические. Физические показатели характеризуются как общесанитарные. К ним относятся:
- содержание взвешенных веществ (частиц песка, ила, планктона), которые определяются взвешиванием осадка после его выпаривания, мг/л;
- цветность (окраска) оценивается в условных единицах;
- вкус и запах (обуславливаются растворенными солями, газами, органическими соединениями) оцениваются в баллах (органолептически), либо по порогу разбавления.

Химические показатели условно делятся на пять групп:
1) Основные ионы. Наиболее распространены в природных водах анионы HCO — 3 , SO 4 2- , Cl — , CO 3 2- , HSiO — 3 и катионы Na + ,K + ,Ca 2+ , Mg 2+ , Fe 2+ , они составляют 90-95% от общего содержания ионов в воде. Содержание в воде растворимых солей кальция и магния характеризуют жесткость воды. Различают жесткость карбонатную (Са(НСО 3 )2, Mg(НСО3)2) и некарбонатную (СаSO 4 , MgSO 4 , CaCl2, MgCl2, Ca(NO3)2, Mg(NO 3 )2).
2) Растворенные газы : O2, CO2, h3S и др. Содержание кислорода в воде определяется поступлением его из воздуха и образованием в результате фотосинтеза. Растворимость кислорода зависит от температуры воды, и его концентрация в воде зимой меньше. СО2находится как в растворенном виде, так и в виде углекислоты. Основными источниками СО2являются процессы распада биохимических веществ. h3S бывает органического (продукт распада) и неорганического (растворение минеральных солей) происхождения.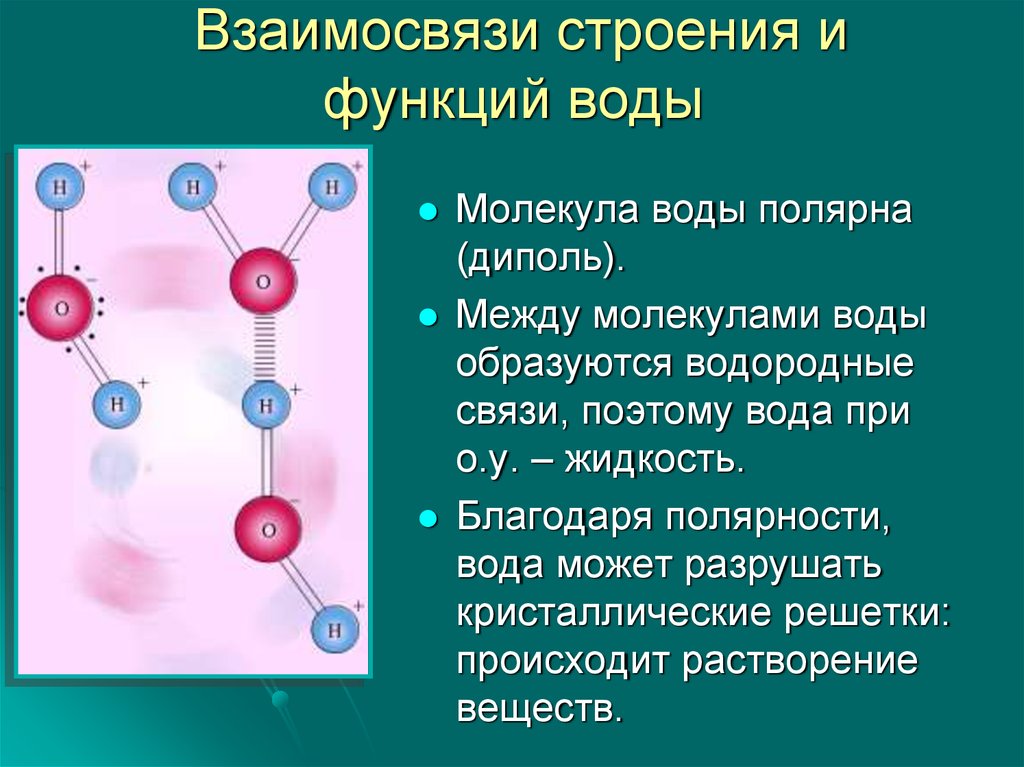 h3S придает воде неприятный запах и вызывает коррозию металла.
h3S придает воде неприятный запах и вызывает коррозию металла.
3) Биогенные вещества. К этой группе относятся необходимые для жизнедеятельности водных организмов и образующиеся в процессе обмена веществ соединения азота и фосфора.
4) Микроэлементы — элементы, содержание которых в воде менее 1 мг/л. Наиболее важные из них йод и фтор.
5) Органические вещества присутствуют в виде гуминовых соединений образующихся при разложении растительных остатков и органических соединений, поступающих со стоком. Их определяют показателями: ХПК (химическое потребление кислорода) и БПК (биологическое потребление кислорода). ХПК – это количество кислорода, которое идет на окисление органики химическим путем в присутствии катализатора (сульфата серебра или дихромата калия), мг/л. БПК – это количество кислорода, которое идет на окисление органики естественным путем (биологическое окисление веществ), мг/л.
К химическим показателям воды относится водородный показатель – рН.
Биологическими показателями качества воды являются гидробионты и гидрофлора. Гидробионты – обитатели от дна до поверхности. Гидрофлора – растительность макро- и микрофиты. Макрофиты – высшая форма растительности. Микрофиты – водоросли. При отмирании макрофитов вода обогащается органическими веществами, ухудшающими органолептические показатели. Микрофиты – продуцируют кислород.
Гидробионты – обитатели от дна до поверхности. Гидрофлора – растительность макро- и микрофиты. Макрофиты – высшая форма растительности. Микрофиты – водоросли. При отмирании макрофитов вода обогащается органическими веществами, ухудшающими органолептические показатели. Микрофиты – продуцируют кислород.
Бактериологические показатели – присутствие болезнетворных микроорганизмов (кишечной палочки). Содержание бактерий группы кишечной палочки в 1 литре воды определяет ее коли-индекс. наименьший объем воды (мл), приходящийся на 1 кишечную палочку называется коли-титром.
Природная вода, как правило, содержит различные примеси: грубодисперсные (песок, глина и т.д.) и коллоидные частицы, органического и минерального происхождения, растворимые и нерастворимые соединения, в том числе и соли. Для получения питьевой и технической воды, используемой в различных отраслях народного хозяйства, необходимо провести ее обработку. Процесс обработки воды обусловлен ее целевым назначением. Так питьевая вода должна соответствовать стандартным требованиям: полная безвредность, приятные органолептические свойства, бактериальная безопасность, жесткость не более 7 ммоль/л. К воде, применяемой для промышленных целей предъявляются менее жесткие требования.
Так питьевая вода должна соответствовать стандартным требованиям: полная безвредность, приятные органолептические свойства, бактериальная безопасность, жесткость не более 7 ммоль/л. К воде, применяемой для промышленных целей предъявляются менее жесткие требования.
Требования к качеству воды зависят от цели ее использования. В табл. 3 приведены требования к качеству питьевых вод.
Таблица 3 Требования, предъявляемые к качеству воды
Новости Фонда
Новости ФондаКатегория
30 сентября, 2022
Научные коллективы разных стран совершенствуют диагностику редкой хромосомной аномалии
Ученые НИИ медицинской генетики Томского НИМЦ в консорциуме с коллегами из Германии, Италии, США и…
30 сентября, 2022
Российские ученые впервые показали возможность динамического разупорядочения в структурах боратов
Динамическое разупорядочивание – состояние кристалла, в котором под воздействием температуры жестк.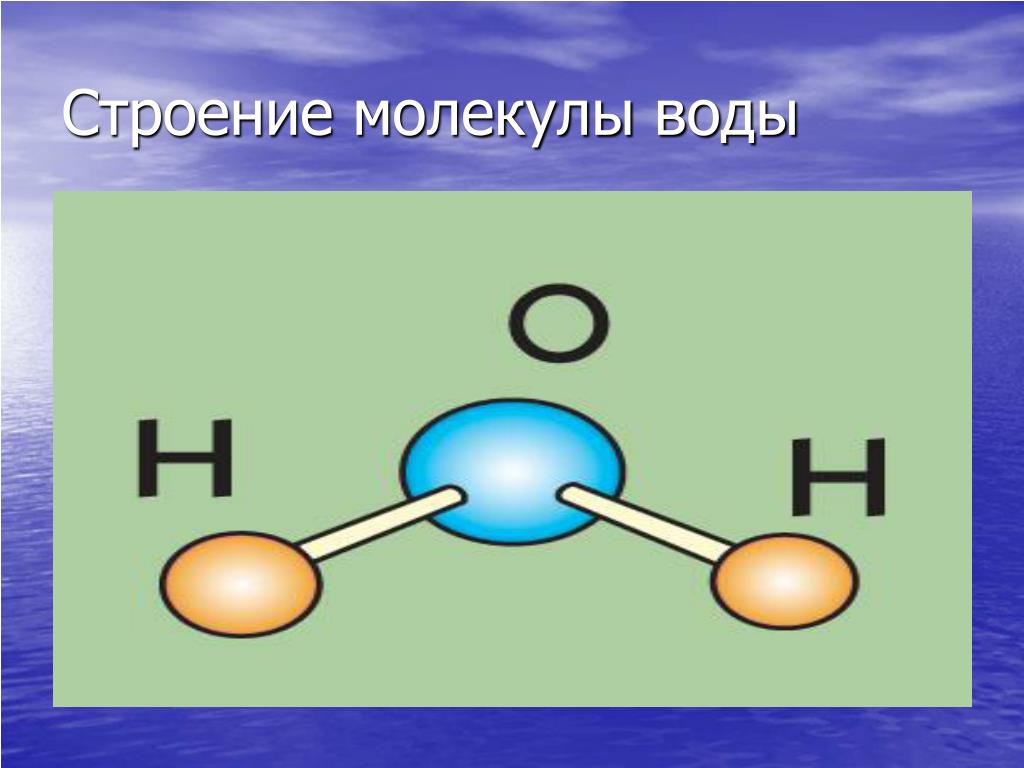 ..
..
30 сентября, 2022
Среди байкальских уток выявили опасные для домашней птицы патогены
Российские ученые впервые изучили вирусы, поражающие байкальских пернатых, и обнаружили среди них …
29 сентября, 2022
Российские ученые разработали безопасное для людей и животных средство от сорняков
Ученые из Института фундаментальных биологических проблем Российской академии наук …
28 сентября, 2022
Биологи назвали новый род цианобактерий в честь города Апатиты
Ученые проанализировали видовое разнообразие цианобактерий из рода Phormidesmis и обнаружили среди в…
28 сентября, 2022
Дыхание почв: российские ученые определили связь между засухами и содержанием CO₂ в атмосфере
Российские ученые подвели итоги эксперимента, который длился 24 года в лесах Подмосковья.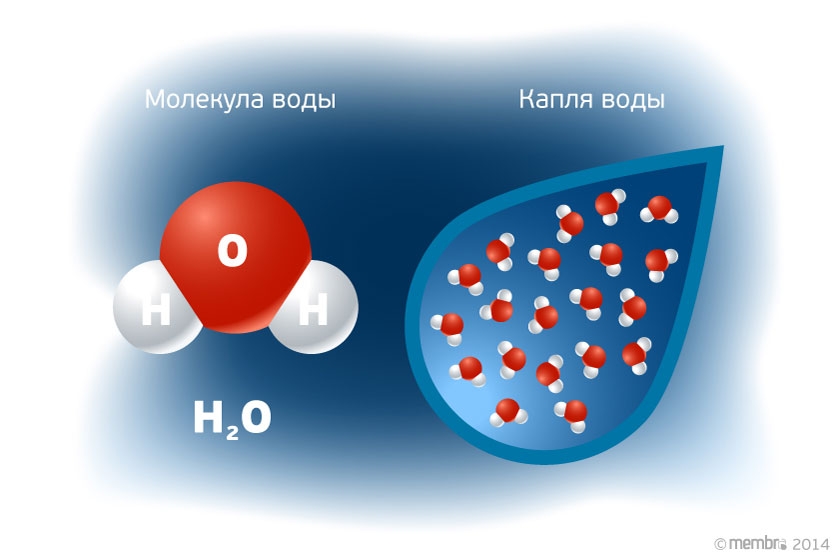 На протяже…
На протяже…
27 сентября, 2022
Реализация поддержанных Российским научным фондом проектов в условиях частичной мобилизации
В связи с поступающими обращениями, РНФ разъясняет свою позицию о реализации поддержанных проектов…
27 сентября, 2022
Продлят жизнь техники. Ученые получили материалы с уникальными свойствами
Продлить срок службы ценных деталей в авиакосмической отрасли и защитить металлические покрытия от к…
26 сентября, 2022
Химики рассчитали, как увеличить срок годности препаратов от эпилепсии
Российские химики рассчитали, как противоэпилептический препарат карбамазепин соединяется в единый к…
26 сентября, 2022
Защитная акция: ученые предложили новый подход к лечению ВИЧ
Российские ученые предложили новый подход к лечению ВИЧ. Он заключается в применении особых белков д…
Он заключается в применении особых белков д…
26 сентября, 2022
Зачем в России редактируют геномы коров и баранов
Клонированная корова Цветочек принесет потомство в декабре, а уникальному гибридному клонированному …
26 сентября, 2022
Новую технологию восстановления сосудов предложили в Кемерове
Сердечно-сосудистые заболевания недаром сохраняют печальную известность как основная причина смерт…
26 сентября, 2022
В ЛЭТИ разработали акселерометр для высоких ускорений
Ученые Санкт-Петербургского государственного электротехнического университета (СПбГЭТУ «ЛЭТИ») разра…
23 сентября, 2022
В России повысили активность катализаторов на базе фосфора, мышьяка и сурьмы
Российские химики изучили свойства и структуру разных типов катализаторов, ускоряющих органические р. ..
..
23 сентября, 2022
Ученые выяснили, как сохранить устойчивость к скольжению у гладких покрытий
В лаборатории поверхностных сил подведомственного Минобрнауки России Института физической химии и эл…
22 сентября, 2022
Ученый КНИТУ впервые описал различные режимы образования плазмы в атмосферных условиях
Российский ученый впервые описал механизмы образования различных форм газовых разрядов постоянного т…
21 сентября, 2022
Вакцина от рака
Ученые НМИЦ онкологии имени Н. Н. Петрова разработали уникальную технологию создания противоопухолев…
21 сентября, 2022
Ученые объяснили, чем многокомпонентные топливные смеси лучше простого угля
Сибирские исследователи изучили процессы горения двух- и трехкомпонентных твердотопливных смесей, ко. ..
..
Вода: физические и химические свойства
Не обращали ли вы внимание на то, что все или почти все происходящее в мире вокруг нас, так или иначе связано с водой? Вода — это гидросфера Земли: ее океаны, реки, озера. Три процента всей массы воды на планете содержится в атмосфере. При извержениях из земных глубин вырываются водяные пары…
Вода есть не только на Земле. Недавно в нашей галактике обнаружили огромные скопления водяных паров — настоящие космические облака, размеры которых достигают сотен миллионов километров. Вода входит в состав комет. Следы ее найдены в атмосфере Марса и некоторых звезд…
Однако самое главное — это то, что вода связана с существованием жизни. Колыбелью жизни, ее первичных форм, по-видимому, был океан. Дальнейший ход биологической эволюции тесно связан с превращениями, идущими в водной среде. Удаление воды означает гибель либо прекращение процессов обмена. Высушенные семена растений могут сохраняться тысячелетиями, но в таком состоянии они не проявляют признаков жизни. Но стоит их смочить, и огонек жизни делается заметным — начинается прорастание, и жизненные процессы возобновляются.
Но стоит их смочить, и огонек жизни делается заметным — начинается прорастание, и жизненные процессы возобновляются.
Планеты, где, по всем данным, нет воды,— безжизненны. Если можно говорить о каких-то формах жизни на других космических телах, то лишь в том случае, если там будет обнаружена вода, именно вода, а не кислород, так как нам известны формы жизни, не требующие кислорода, но не известны ее «сухие» формы. Чем замечательна вода? Почему она играет такую важную роль во всем на нашей планете? (А еще вода обладает целительными свойствами для человеческого организма, такая к примеру минеральная вода, имеющая в своем составе некоторые полезные минералы).
Химические свойства воды
После, того, как Менделеев сформулировал свой периодический закон, стало невозможным порознь рассматривать свойства простых веществ. Таблица Менделеева связала различные вещества одной общей закономерностью. Эта закономерность проявляет себя во множестве частных связей. Например, свойства водородных соединений ряда металлоидных элементов, образующих вертикальные столбцы, в таблице Менделеева, изменяются с ростом массы атома. Можно четко проследить эти изменения: прочность соединений убывает, плотность увеличивается, повышается температура кипения и плавления и т. д.
Можно четко проследить эти изменения: прочность соединений убывает, плотность увеличивается, повышается температура кипения и плавления и т. д.
Вода — это водородное соединение кислорода. Кислород — элемент шестой группы таблицы Менделеева. В той же группе (и подгруппе) находятся сера, селен, теллур. Если сравнить свойства их соединений с водородом (гидридов), то увидим, что температура кипения понижается при переходе от теллура к сере. Сероводород кипит уже при минус 60 градусах. Значит, соединение кислорода с водородом при нормальных условиях — при нуле градусов — должно быть газом. Вода — газ! Это и было бы нормой, но, к счастью для нас, вода почему-то отклоняется от правила.
Такая странность воды не единственна. Вода необычна и в других отношениях. У нее очень велика теплота испарения, теплоемкость, водяной пар при быстром расширении конденсируется, вместо того чтобы переходить в состояние ненасыщенного пара, плотность воды увеличивается при изменении температуры от 0° до +4°С, а затем снова падает; затвердевая, вода расширяется.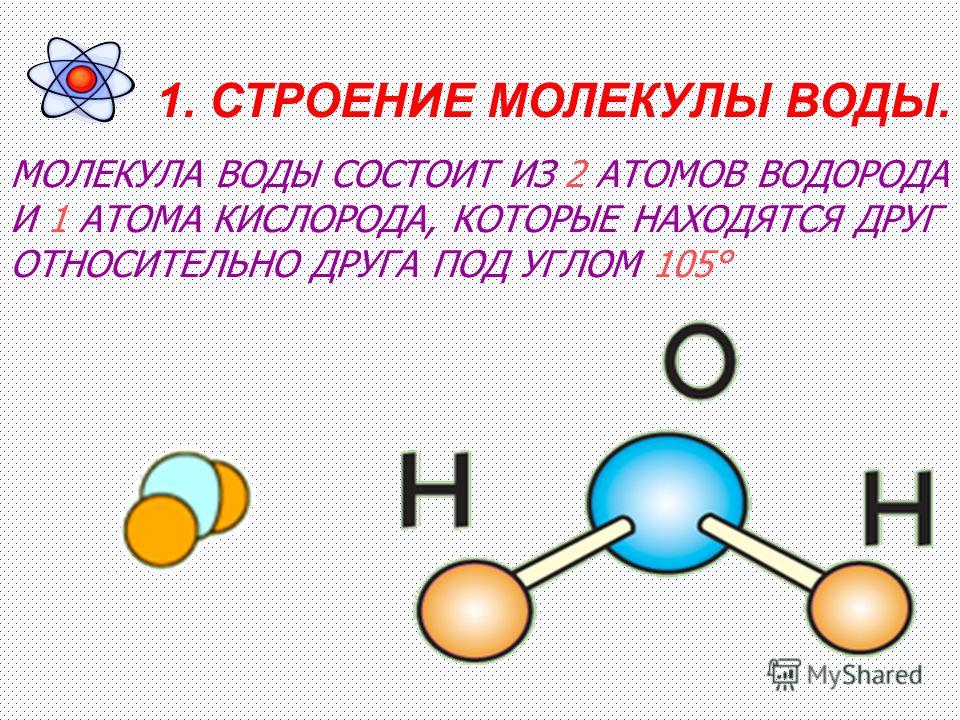
Перечень странностей воды не исчерпан, но для нас достаточно и этого. Подумаем о том, что значат для жизни удивительные ее свойства. Попробуем представить себе Землю и жизнь на ней при условии, что вода — вещество «нормальное».
Нет морей и океанов, нет рек и озер, все растения и животные обезвожены, а атмосфера насыщена газом Н20.
Предположим, что ненормально высокая теплоемкость воды тоже понизилась — например, в 20—30 раз. Тогда воды океанов и морей уже не смогут накапливать достаточное количество теплоты — они станут быстро нагреваться летом и сильно охлаждаться зимой. Резкие колебания температуры вызовут растрескивание горных пород, изменят рельеф земной поверхности. Но растрескивание пород — результат расширения воды при замерзании, это ведь тоже аномалия! Допустим, что нет и ее, — горным породам от этого, конечно, будет легче, но лед начнет образовываться на дне водоемов, и они станут промерзать полностью. Следствием окажется гибель и рыбы, и всей жизни в реках и озерах.
Невеселая получается картина, не правда ли? Но и это не все. Есть у воды еще одно удивительное качество: в ней резко ослабляется сила взаимодействия между электрическими зарядами. Например, если заряженные тела перенести из воздуха в воду, эта сила упадет в 80 раз!
А результат! Какие грандиозные последствия имеет такое, казалось бы, сугубо специальное обстоятельство.
Ослабляя взаимодействие электрических зарядов, вода поддерживает растворенные в ней соли, кислоты и основания в ионизированном состоянии. А быстро протекающие химические реакции чаще всего совершаются как раз между ионами.
Вот мы и добрались до самых глубин жизни; ведь ионы — это одна из главных сил в жизненных процессах. Ионы регулируют действие множества биологических катализаторов — ферментов, без которых немыслима жизнь; перемещение ионов через биологические мембраны обуславливает передачу нервного возбуждения; концентрация ионов в почве дает возможность нормального роста растений и т. д. Вывод: вода не могла бы стать средой для жизни, если бы она не вызывала образования ионов.
Жизнь зародилась в воде; вполне естественно, что вся химия жизни неразрывно связана с маленькими молекулами Н20; все формы, все типы реакций, направление развития и формирование функций живых систем так же, как и величественные картины неживой природы, несут на себе отпечаток свойств и деятельности молекул воды!
Молекула воды
Странности воды, сейчас изучены достаточно основательно. Главный секрет таится в конструкции молекулы воды. В этой молекуле атом кислорода двумя отдельными связями сцеплен с двумя атомами водорода. Связи мы можем изобразить в виде палочек, и можно представить себе много способов их взаимного расположения.
На самом же деле в молекуле воды реализован только один — палочки расположены в одной плоскости с углом между ними примерно в 105°. На скрещении палочек-связей находится атом кислорода, на противоположных концах палочек помещаются атомы водорода. Но палочки, хоть они и разведены друг от друга, все-таки направлены в одну сторону. И, значит, у молекулы воды одна сторона — кислородная, а другая — водородная. В этом все дело.
И, значит, у молекулы воды одна сторона — кислородная, а другая — водородная. В этом все дело.
Но расскажем сначала о некоторых тонкостях в том, как возникает эта конструкция. Читатель, которого отпугивают сложности атомной физики, может пропустить следующую главу.
Электронные тонкости
Образуя молекулу воды, атомы кислорода и водорода схватываются, сцепляются своими электронными оболочками. У атома кислорода есть так называемые р-электроны — их четыре и распределение их плотности можно представить себе в виде фигур (объемных тел), напоминающих гантели. Кроме того, у кислорода есть еще два электрона, расположенных так, что распределение их заряда имеет сферическую симметрию (электроны э-типа).
Атомы водорода имеют электроны, плотность которых тоже распределена сферически. Для образования связи нужно, чтобы электронные облака атомов кислорода и водорода перекрылись, то есть их электроны стали общими, как на этом рисунке.
Перекрытие и происходит между гантелеобразными облаками р-электронов кислорода и сферическими облаками атомов водорода. На образование связи нужно два электрона — по одному, от каждого атома; эта пара электронов и образует общее зарядовое облако. После образования связей у кислорода остается два электрона р-типа и два э-типа, которые не были использованы. Какова роль этих неиспользованных электронов?
На образование связи нужно два электрона — по одному, от каждого атома; эта пара электронов и образует общее зарядовое облако. После образования связей у кислорода остается два электрона р-типа и два э-типа, которые не были использованы. Какова роль этих неиспользованных электронов?
Две связи в молекуле воды, две палочки Н = 0 имеют на одном конце положительный, а на другом — кислородном конце — отрицательный заряд. Такая конструкция называется диполем. Если бы палочки-диполи были расположены на одной прямой — как продолжение друг друга с атомом кислорода посредине, они взаимно компенсировались бы, и общий дипольный момент молекулы был бы равен нулю.
Однако этого нет. Палочки-связи разведены на угол в 105°, и такая конструкция молекулы электрически активна. Два электрона в-типа влияют на величину угла между связями. Но дипольный момент молекулы воды очень велик и, чтобы создать его, одной изогнутости молекулы мало. В дело вступают два других неиспользованных для связей р-электрона атома кислорода.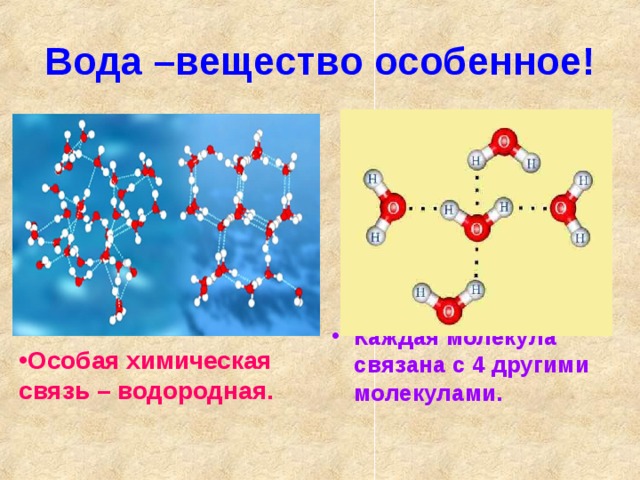 Вращаясь вокруг своего ядра, они на кислородном, «боку» молекулы создают дополнительный отрицательный заряд.
Вращаясь вокруг своего ядра, они на кислородном, «боку» молекулы создают дополнительный отрицательный заряд.
Физические свойства воды
Итак, природа «согнула» молекулу воды и сделала ее активным диполем. Диполи же, как известно, энергично притягиваются друг к другу. Но чем отличается жидкость от газа? Прежде всего, именно силой взаимодействия между молекулами. Чем сильнее сцепляются друг с другом диполи-молекулы, тем большую надо затратить работу, чтобы их разделить,— тем выше теплота испарения…
При испарении вода должна поглощать огромную энергию. При испарении! А значит, в обычных условиях она должна быть именно жидкостью: ведь дополнительная гигантская энергия в обычных условиях отсутствует.
А у молекул сероводорода — для сравнения — дипольный момент вдвое меньше, сила притяжения между ними слабее, и в обычных условиях сероводород — газ.
Но дело не только в величине дипольного момента. Молекулы воды соединяются друг с другом еще и так называемыми водородными связями.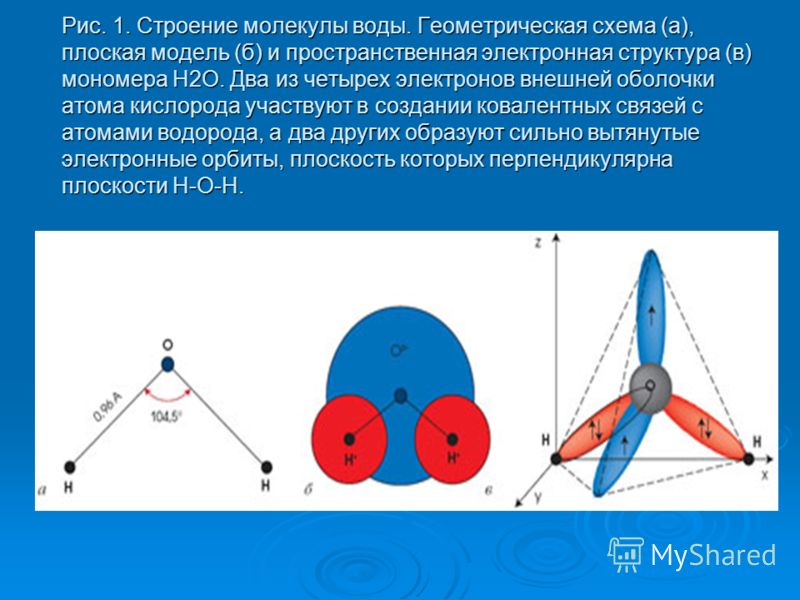 Что это такое? Ядра водорода в молекуле воды «тянутся» не только к «своему» кислороду, но и к электронам кислорода у соседей. Конечно, к своему «хозяину» — кислороду протон притягивается сильнее, чем к «чужаку». Поэтому водородные связи не строго симметричны.
Что это такое? Ядра водорода в молекуле воды «тянутся» не только к «своему» кислороду, но и к электронам кислорода у соседей. Конечно, к своему «хозяину» — кислороду протон притягивается сильнее, чем к «чужаку». Поэтому водородные связи не строго симметричны.
У других гидридов они тоже есть. Но они слабы, так как расстояния между молекулами, например, сероводорода больше (связи длиннее), чем у воды. Большое число электронных оболочек не позволяет молекулам других гидридов сблизиться, а значит, не позволяет водородным связям проявить себя. А в молекулах воды электронных оболочек немного, и водородные связи очень энергичны в своей совокупности.
Молекулы воды крепко сцеплены друг с другом; так крепко, что в ней рождается огромное внутреннее давление: приблизительно 20 000 атмосфер. С такой силой слои молекул воды прижаты друг к другу; не удивительно, что это практически несжимаемая жидкость.
Вода: порядок или хаос? Структура воды.
Но если диполи так крепко сцепляются друг с другом, то как же выглядит структура воды, да и можно ли вообще говорить о ней? Расположены ли диполи в воде беспорядочно или в их пространственном размещении есть какая-то правильность? На первый взгляд, ответ очевиден. Ведь молекулы движутся и притом хаотически, о каком же регулярном расположении вообще идет речь? Однако данные, полученные с помощью рентгенографического анализа, говорят о другом: в воде есть явные признаки упорядоченной структуры.
Ведь молекулы движутся и притом хаотически, о каком же регулярном расположении вообще идет речь? Однако данные, полученные с помощью рентгенографического анализа, говорят о другом: в воде есть явные признаки упорядоченной структуры.
Предположим, что все движения молекул воды на мгновение прекратились, и допустим, что мы в состоянии видеть каждую молекулу. Тогда, взглянув на воду, мы обнаружим в ней так называемый ближний порядок. В непосредственной близости от выбранной нами молекулы воды другие молекулы расположены по определенному закону.
Особенность жидкостей не в том, что в них нет упорядоченности, а в том, что этот порядок не выдерживается строго во времени и в пространстве. Если отодвинуться подальше от избранной молекулы, то мы попадем в область, где порядок уже нарушен. А если подождать некоторое время, то окажется, что и ближние молекулы обмениваются местами. В воде нет хаоса, но порядок вновь и вновь нарушается, а затем восстанавливается. Огромные силы внутреннего давления, сжимающие воду, ограничивают возможности быстрых перемещений — одна молекула «топчется» около другой, пока ей удастся покинуть свое место и сделать более или менее значительный скачок в сторону.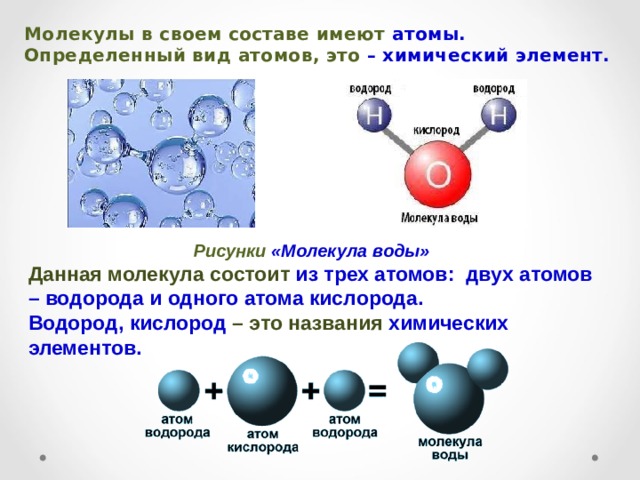 Правда, продолжительность «топтания» велика лишь по молекулярным масштабам.
Правда, продолжительность «топтания» велика лишь по молекулярным масштабам.
Значит, и у воды есть внутренняя структура. Самое же поразительное в ней то, что она очень похожа на структуру льда. Лед построен так. Каждая молекула воды в нем окружена четырьмя соседними.
Молекула льда.
В этой кристаллической решетке есть полости — пустоты. Такие же пустоты сохраняются и в структуре воды. Как мы увидим далее, они играют важную роль — это молекулярные «ловушки», куда попадают молекулы различных веществ, ионы, а иногда и молекулы самой воды. В кристалле льда такая структура распространяется на весь кристалл. В жидкой воде, охлажденной до температуры, близкой к нулю, тоже есть подобие правильного расположения молекул, но уже с некоторыми нарушениями порядка, или, как говорят, с «дефектами»: то одна молекула попадет в полость, то обнаружится недостача молекулы в окружении этой полости и т. д.
Значит, чем больше порядка в расположении молекул воды, тем больше «пустот» и меньше плотность. Когда же молекулы расположены беспорядочно, плотность увеличивается — ведь все большее число молекул попадает в «пустоты». Понятно, почему при плавлении льда наблюдается сжатие, а замерзание жидкой воды, наоборот, сопровождается расширением.
Когда же молекулы расположены беспорядочно, плотность увеличивается — ведь все большее число молекул попадает в «пустоты». Понятно, почему при плавлении льда наблюдается сжатие, а замерзание жидкой воды, наоборот, сопровождается расширением.
Сокращается объем воды и при нагревании ее от 0° до +4°: в этом температурном интервале молекулы воды интенсивнее всего внедряются в пустоты решетки, и плотность возрастает.
Чем выше температура воды, тем, конечно, меньше порядка в расположении молекул, и тем менее структура жидкой воды похожа на структуру льда. Но есть условия, в которых жидкая вода особенно похожа на лед, — условия, когда молекулы воды снова приобретают упорядоченное расположение. Как ни странно, но, по-видимому, этот эффект вполне четко выражен в биологических системах — около белковых молекул, на поверхности клеточных мембран и т. д.
Наше тело на 70 процентов состоит из воды; неужели мы на 70 процентов состоим изо льда? Не совсем так, но все-таки очень похоже на это…
Чисто физические исследования показали: тонкие слои воды, зажатые между двумя пластинками из слюды, проявляют свойства, характерные не для жидкой воды, а для льда! На поверхности различных твердых тел вода, по последним данным, тоже структурно упорядочена и имеет сходство со льдом.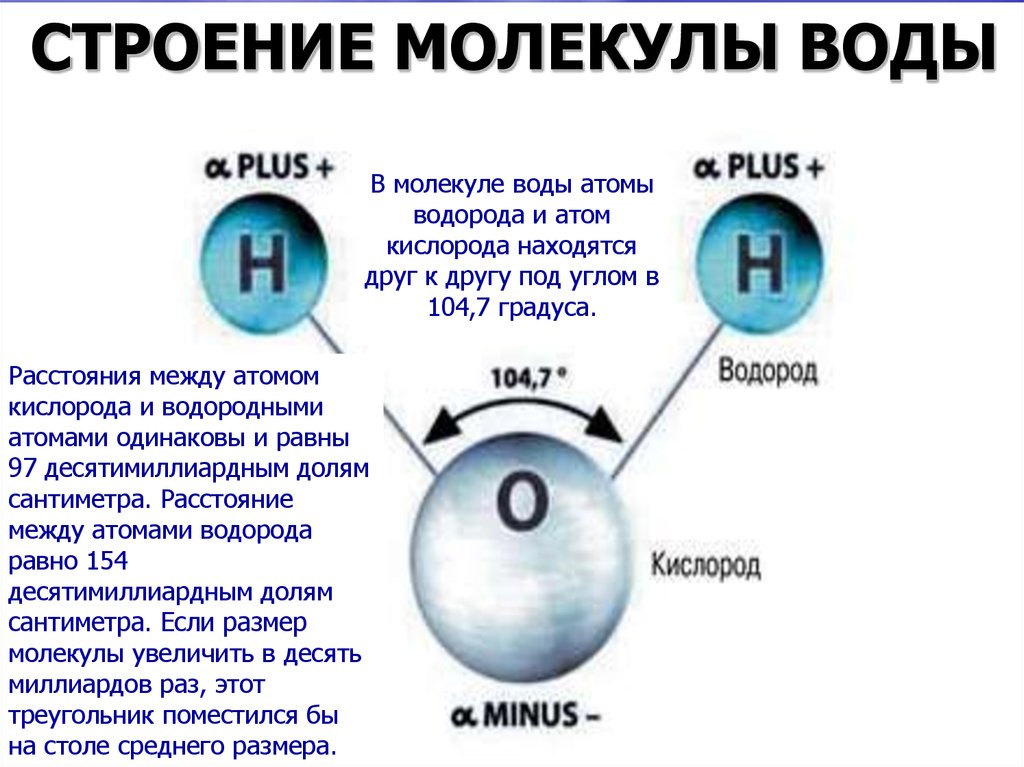
Во-вторых. Активность молекул воды и их стремление «организоваться» находит своеобразное выражение во взаимодействиях между водой и различными веществами. Когда в воду попадает кристалл соли, молекулы воды немедленно притягиваются к ионам на поверхности кристалла. Энергия их взаимодействия так велика, что ионы покидают свои места в кристаллической решетке и уходят в водную среду, окруженные оболочками из молекул воды: соль начинает растворяться.
Водяная «шуба» состоит не из одного слоя, но чем дальше от иона, тем слабее связь, и ее границы довольно «пушисты» и расплывчаты — по-видимому, лишь 4—6 молекул воды вполне связаны с ионом.
Так же, как и вокруг ионов, молекулы воды могут ориентироваться, например, около молекулы метана — тогда возникает гидрат этого газа. Грозди молекул воды в гидрате получили название «айсбергов» — состояние воды в них напоминает строение кристаллов льда.
В трубопроводах газовых сетей не раз находили скопления снега и льда, причем они оставались твердыми и при температуре +20°. Это и были «айсберги», выросшие вокруг молекул метана.
Это и были «айсберги», выросшие вокруг молекул метана.
Затравкой для таких соединений может быть не только метан: этан, этилен, хлор, двуокись серы и даже инертные газы (аргон, криптон) образуют подобные гидраты. Загадка «айсбергов» разъясняется неожиданно просто. Молекулы газов попадают в пустоты между молекулами воды. Застряв в них, они упорядочивают окружающие молекулы воды. Предполагают, что в гидратах молекулы воды расположены по углам пятиугольников, а из пятиугольников строятся сложные многогранники — пространство внутри них заполнено газом. Если газ удалить, устойчивость всего каркаса уменьшается, и он начинает разрушаться и перестраиваться. Некоторые исследователи считают, что точно так же, окружая углеводородные группы, входящие в состав белков, вода стабилизует молекулы белка. А это означает, что формы, в которых белковые молекулы находятся и действуют в организмах, в значительной степени связаны с влиянием воды.
Вода в тканях животных и растений не представляет собой хаоса; молекулы ее расположены относительно упорядоченно, и действительно можно сказать, что у воды в нашем организме есть определенное сходство со льдом.
Активность и холод
Оледенение, замерзание, застывание — слова, с которыми у нас прочно связано представление о понижении активности; жизнь замирает при понижении температуры, скорость химических реакций как будто тоже уменьшается. Но дело не так просто. Вода и лед и здесь обнаруживают своеобразие.
Вода, как известно из школьного курса химии, плохой электролит. Лишь небольшая доля ее молекул диссоциирует на ионы Н+ и ОН-. Лед диссоциирован еще менее, и, если литр воды замерзнет, в нем останется только тысячная доля от того количества ионов, которое было в жидкой воде.
Но поразительно: резкое уменьшение концентрации ионов очень слабо отражается на электропроводности. У льда она всего в три раза меньше, чем у воды, — в три, а не в тысячу! Между тем электрические заряды переносятся именно ионами Н+ и ОН-, и следовало бы ожидать, что уменьшение их числа скажется на способности проводить ток.
Однако электропроводность зависит не только от числа ионов, но и от их подвижности.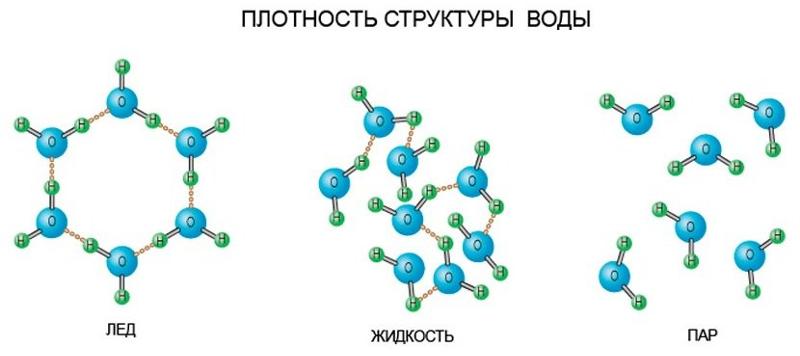 В кристаллической решетке льда ионы становятся «стремительными» — и эта стремительность возмещает резкое падение их числа.
В кристаллической решетке льда ионы становятся «стремительными» — и эта стремительность возмещает резкое падение их числа.
Впрочем, «стремительность» — это грубо метафорическое выражение. Дело не только в том, что ионы ускоряют свой бег — дело в том, что во льду возникает особый механизм, который организует движение ионов. Механизм этот называют цепным, или эстафетным. Вот как он действует. Ион водорода приближается к молекуле воды, возникает водородная связь. Затем эта связь переходит в обычную химическую, а другой ион водорода, ранее принадлежавший молекуле, отщепляется. Он присоединяется к следующей молекуле, от которой так же одновременно отделится новый ион водорода, и, двигаясь по цепи, процесс будет продолжаться.
Быстрота, с которой он совершится, зависит не от индивидуальной скорости ионов, а от быстроты обмена ими между молекулами воды. В кристалле льда царит внутренний порядок, и обмен идет легко. А в жидкой воде, то и дело, натыкаясь на зоны нарушений или на пустоты, ионы будут терять скорость своего бега вдоль по цепочке молекул.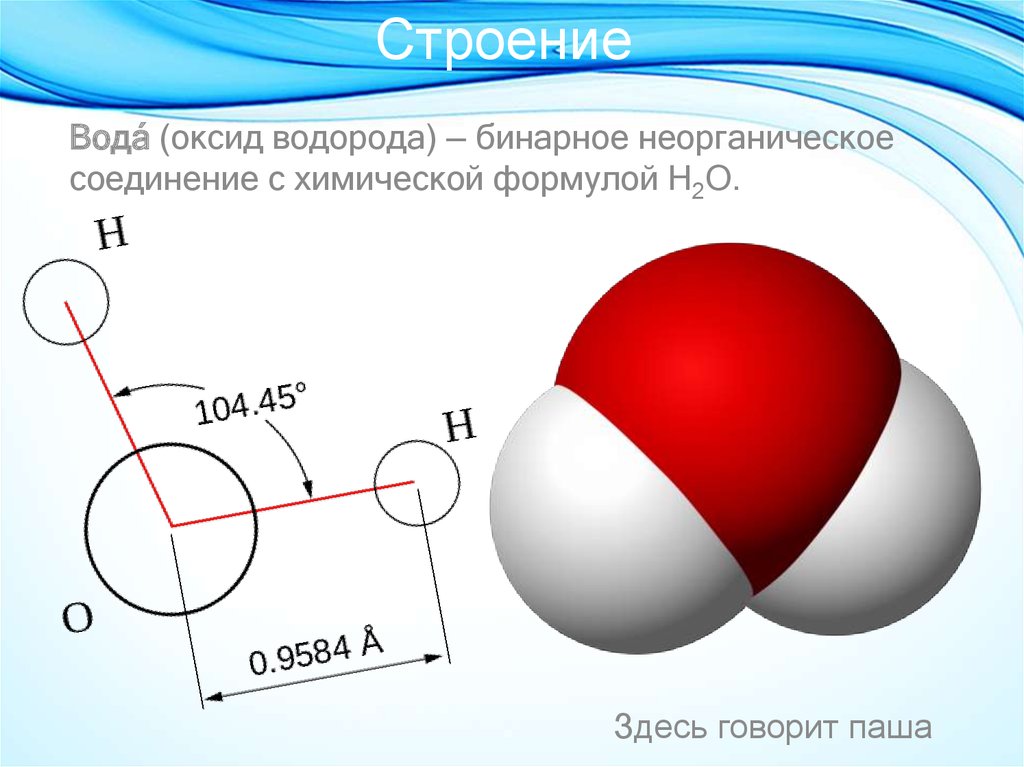 Итак, во льду на самом деле, оказывается, «двигаться» легче, чем в воде, поэтому лед и ускоряет многие реакции. Лед — настоящий катализатор!
Итак, во льду на самом деле, оказывается, «двигаться» легче, чем в воде, поэтому лед и ускоряет многие реакции. Лед — настоящий катализатор!
Но ведь похожие на лед «айсберги» есть и в организмах, и в них, значит, тоже легче протекают различные реакции. Перенос ионов играет важную роль в действии ферментов и в работе белковых мембран различного типа — и в оболочке клетки, и в оболочке ее ядра, и в митохондриях (энергетических станциях клетки), и в рибосомах, где строятся новые молекулы белков, словом, повсюду. Поэтому вода не просто среда, это, по Сьент- Дьерди, — неотъемлемая часть живой машины.
Мы подошли к концу рассказа… Каков итог? Что же, вода и впрямь какое-то «ненормальное» вещество, на «ненормальных» свойствах которого (как физических, так и химических) держится привычная картина природы?
Нет, конечно. «Необычность» воды более чем обычна, она естественна. Она — свидетельство того, что при переходе от одного атома к другому в подгруппе периодической системы происходят изменения. Накапливаясь, эти изменения становятся все более ощутимыми, и вдруг резкий скачок.
Накапливаясь, эти изменения становятся все более ощутимыми, и вдруг резкий скачок.
Вернемся снова к диполям воды. Их тесно сцепляют друг с другом мощная электрическая активность и действие водородной связи.
У других элементов шестой группы очень велико экранирующее действие электронных облаков — водородная связь не может «пробиться» сквозь них. У теллура, и у селена, серы слишком много свободных, незанятых электронов. Окутанные ими, тяжелые молекулы гидридов слабо связаны друг с другом. И все они при нормальных условиях — газы.
Однако при движении от одного элемента группы к другому электронов в атомах становится все меньше, и у кислорода их уже так мало, что водородная связь начинает пробиваться, активно проявляя себя.
Так, порой медленно и постепенно, рассеиваются тучи, пока не разорвется серый пласт. И тут же блеснет луч солнца. И неожиданный скачок — из пасмурной погода стала ясной, все засияло другими красками.
Электронное «небо» при переходе к кислороду на самом деле проясняется, и в мире гидридов неожиданно наступает другая погода.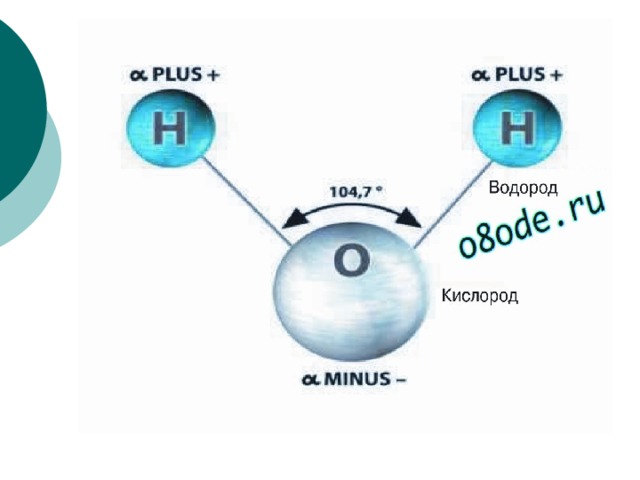 Во всем блеске своих необычных свойств на сцене мира появляется Вода.
Во всем блеске своих необычных свойств на сцене мира появляется Вода.
Автор: Л. Николаев.
Химические свойства воды — Eniscuola
Вода как ресурс
Химические свойства воды
Химическая формула молекулы воды h3O: два атома водорода (h3) связаны с одним атомом кислорода (O). Электроны атома (частицы с отрицательным зарядом) устанавливают связи между собой. Кислород лучше удерживает их рядом с собой, чем водород. В результате молекула воды заряжается отрицательно вблизи атома кислорода и положительно вблизи атома водорода. Поскольку противоположности притягиваются, молекулы воды имеют тенденцию соединяться вместе, как магниты.
Вода может растворить многие вещества.
Воду называют универсальным растворителем, так как она может растворять больше веществ, чем любая другая жидкость. И нам очень повезло, что он может: если бы он не мог, мы не смогли бы выпить чашку горячего чая с сахаром, потому что сахар остался бы на дне чашки. Вот почему кажущиеся чистыми на первый взгляд воды рек, ручьев, озер, морей и океанов на самом деле содержат огромное количество растворенных элементов и минералов, выделяемых горными породами или атмосферой. Куда бы она ни текла, над землей, под землей или внутри нашего тела, вода растворяет и переносит чрезвычайно большое количество веществ. Таким образом, вода выполняет драгоценную задачу: переносит, иногда на большие расстояния, вещества, встречающиеся на ее пути. Чистая вода, как и дистиллированная вода, имеет рН 7 (нейтральный). Морская вода в основном щелочная, ее рН составляет около 8. Большинство пресных вод имеют рН от 6 до 8, за исключением, конечно, кислотных дождей, рН которых ниже 7.
Вот почему кажущиеся чистыми на первый взгляд воды рек, ручьев, озер, морей и океанов на самом деле содержат огромное количество растворенных элементов и минералов, выделяемых горными породами или атмосферой. Куда бы она ни текла, над землей, под землей или внутри нашего тела, вода растворяет и переносит чрезвычайно большое количество веществ. Таким образом, вода выполняет драгоценную задачу: переносит, иногда на большие расстояния, вещества, встречающиеся на ее пути. Чистая вода, как и дистиллированная вода, имеет рН 7 (нейтральный). Морская вода в основном щелочная, ее рН составляет около 8. Большинство пресных вод имеют рН от 6 до 8, за исключением, конечно, кислотных дождей, рН которых ниже 7.
Специальные отчеты
15 апреля 2014 г.

Водный след, водообеспеченность и использование в планетарном масштабе…
26 февраля 2014 г.
Водный след и водопотребление…
8 июля 2022
Акула в моем гамбургере Наконец-то наступило лето! Как обычно, мы ждали его целый год и…
13 мая 2018
Задумывались ли вы, сколько места занимает яблоко или стейк?…
7 октября 2021
«Чистая, сладкая пресная вода», — писал Петрарка, которого многие считают предшественником итальянской литературы. До него святой Франциск посвятил два…
17 мая 2021
Согласно исследованию, проведенному французской и швейцарской исследовательской группой, недавно опубликованному в ведущем журнале Nature, континентальный…
15 апреля 2021 г.

Невидимое вторжение микропластика…
26 декабря 2019
Как можно жить и работать в Антарктиде…
10 декабря 2019 г.
Антарктида — континент с особым очарованием…
15 апреля 2014 г.
Водный след, доступность воды и ее использование в планетарном масштабе…
26 февраля 2014 г.
Водный след и водопотребление…
8 июля 2022
Акула в моем гамбургере Наконец-то наступило лето! Как обычно, мы ждали его целый год и…
13 мая 2018 г.

Задумывались ли вы, сколько места занимает яблоко или стейк?…
7 октября 2021
«Чистая, сладкая пресная вода», — писал Петрарка, которого многие считают предшественником итальянской литературы. До него святой Франциск посвятил два…
17 мая 2021
Согласно исследованию, проведенному французской и швейцарской исследовательской группой, недавно опубликованному в ведущем журнале Nature, континентальный…
15 апреля 2014 г.
Водный след, водообеспеченность и использование в планетарном масштабе…
26 февраля 2014 г.

Водный след и водопотребление…
8 июля 2022
Акула в моем гамбургере Наконец-то наступило лето! Как обычно, мы ждали его целый год и…
Из раздела Мультимедиа
вода
Наличие водных ресурсов
Смотреть
вода
Круговорот воды
Слушать
вода
Карта нехватки воды
Смотреть
вода
Годовое наличие пресной воды
Смотреть
вода
Поверхностное натяжение
Смотреть
вода
Наличие водных ресурсов
Смотреть
вода
Круговорот воды
Слушать
вода
Карта дефицита воды
Смотреть
Факты
В некоторых организмах вода может составлять до 90% их общего веса.
 ..
..Океанское течение Гумбольта идет на север вдоль побережья Перу и…
Только 3% общих запасов воды составляют пресные воды…
Самые высокие водопады в мире находятся в Венесуэле…
Волновой дракон, который поглощает волны и вырабатывает электричество, является растением…
В Италии явление «кобыла в любви» встречается очень часто: часть морского побережья, где это происходит,…
Даже большие озера могут образовываться на поверхности, внутри или при контакте с…
Исландия характеризуется многочисленными ледяными щитами…
Очарование ледниковых пещер вдохновило исследователя.
 ..
..
13 мая 2011 г.
В некоторых организмах вода может составлять до 90% их общего веса…
Океанское течение Гумбольта идет на север вдоль побережья Перу и…
Только 3% общих запасов воды составляют пресные воды…
Самые высокие водопады в мире находятся в Венесуэле…
16 мая 2011 г.
Волновой Дракон, который поглощает волны и генерирует электричество, является растением…
11 мая 2011 г.
В Италии явление «кобыла в любви» встречается очень часто: часть морского побережья, где это происходит,…
13 мая 2011 г.

В некоторых организмах вода может составлять до 90% их общего веса…
Океанское течение Гумбольта идет на север вдоль побережья Перу и…
Только 3% общих запасов воды составляют пресные воды…
Эни С.п.А. — P.IVA 001006
Химическая формула воды – структура, свойства, использование, примеры вопросов
Водород (H) обладает уникальными добрыми свойствами, не похожими ни на один другой компонент на нашей планете, около 66% массы нашей Вселенной состоит из этого уникального компонента. Он является как электроположительным, так и электроотрицательным, поскольку структурирует частицы водорода (H + ), а также частицы гидрида (H – ). Соединения водорода являются основными окислителями для некоторых синтетических веществ в воздухе и связаны с образцами многочисленных семейств веществ. Водород используется для получения аммиака (NH 3 ).
Соединения водорода являются основными окислителями для некоторых синтетических веществ в воздухе и связаны с образцами многочисленных семейств веществ. Водород используется для получения аммиака (NH 3 ).
Кислород (O) — химический элемент с атомным номером 8 в периодической таблице. Это очень реакционноспособный неметалл и окислитель, который легко образует оксиды с большинством элементов, а также с другими соединениями.
Вода — самое важное соединение в нашей жизни, необходимое для выживания жизни на нашей планете. Вода содержит два атома водорода (H) и один атом кислорода (O) . Между атомами водорода (H) и кислорода (O) существует ковалентная связь. Его называют универсальным растворителем. Это очень полезно в нашей жизни, без которого мы не можем жить.
Химическая формула воды: H 2 O . Его химическое название — монооксид дигидрогена. Он получается из
Он получается из
2H 2 + O 2 ⇒ 2H 2 O
2 и имеет два атома водорода и кислорода. Он имеет ковалентную связь, удерживающую его атомы. Он имеет
угловую решетчатую структуру . Вода имеет изогнутую форму или форму V .Физические свойства воды
Некоторые из физических свойств воды:
- Это бесцветная жидкость без запаха и вкуса.
- Молекулярная масса воды 18,01528 г/моль.
- Плотность воды 997 кг/м 3 при 25°C.
- Температура кипения 100°C.
- Температура плавления воды 0°C.
- Может растворять практически любое вещество, поэтому известен как Универсальный Растворитель.
Химические свойства воды
- Вода по своей природе не является ни кислотной, ни щелочной, поэтому она действует как кислота и как основание. Так что у него есть способность принимать и отдавать протоны.
 Когда Вода вступает в реакцию с Соляной кислотой (HCl), мы получаем Hydronium (H 3 O + ) и Хлор (Cl).
Когда Вода вступает в реакцию с Соляной кислотой (HCl), мы получаем Hydronium (H 3 O + ) и Хлор (Cl).
H 2 O (л) + HCl (водн.) ⇌ H 3 O + + Cl – .
- Вода может сильно реагировать с ионами солей. Когда вода реагирует с Тетрахлорид кремния (SiCl 4 ), получаем Диоксид кремния (SiO 2 ) и Соляная кислота (HCl).
SiCl 4 + 2H 2 O → SiO 2 + 4HCl.
- Вода также может реагировать с металлами с высокой электроположительностью, такими как натрий. Получаем Гидроксид натрия (NaOH) и Водород (H 2 ).
Н 2 O + Na → 2NaOH + H 2 .

Использование воды
Вода имеет множество применений, некоторые из которых перечислены ниже:
- Она может использоваться для прямых и косвенных целей.
- Используется для питья, приготовления пищи, стирки и купания.
- Используется при обработке древесины для производства бумаги.
- Используется для производства электроэнергии.
- Используется в сельском хозяйстве и ирригации.
- Используется в производстве стали для автомобилей.
- Обладает сильной склонностью к увлажнению.
- Используется в качестве лабораторного реактива.
Часто задаваемые вопросы о воде и ее свойствах
Вопрос 1: Является ли вода полярной или неполярной?
Ответ:
Вода полярна по своей природе, потому что в воде существует разница электроотрицательностей между атомами H и O. Имеет изогнутую форму. Он также не является проводником электричества.
Вопрос 2: Вода имеет ковалентную или ионную связь?
Ответ:
Вода имеет ковалентную связь. Вода имеет ковалентную связь между водородом и кислородом, которая образует V-образную форму. Это нелинейная молекула.
Вопрос 3: Что происходит, когда вода реагирует с аммиаком?
Answer:
When water reacts with ammonia, we get Ammonium ion (NH + 4 ) and Hydroxide ion (OH – )
H 2 O (ж) + NH 3 (водн.) ⇌ NH + 4 + OH –
940257 Что происходит при взаимодействии воды с диоксидом углерода?
Ответ:
При взаимодействии воды с Углекислым газом (CO 2 ), мы получаем Углекислоту (H 2 CO 4 3 ).

H 2 O + CO 2 ⟶ H 2 CO 3
Вопрос 5: Напишите два примера реакции воды с металлами?
Ответ:
Когда вода реагирует с металлами, мы получаем оксид металла и газообразный водород.
Пример 1: Когда Магний (Mg) реагирует с водой, мы получаем Оксид магния (MgO) и Газообразный водород (H 2 ).
Mg + H 2 O ⇒ MgO + H 2
Пример 2: Когда калий (K) реагирует с водой, мы получаем оксид калия (KOH) и газообразный водород (H 2 ).
2K + 2H 2 O ⇒ 2KOH + H 2
Вода — универсальный растворитель | Геологическая служба США
Школа водных наук
9 июня 2018 г.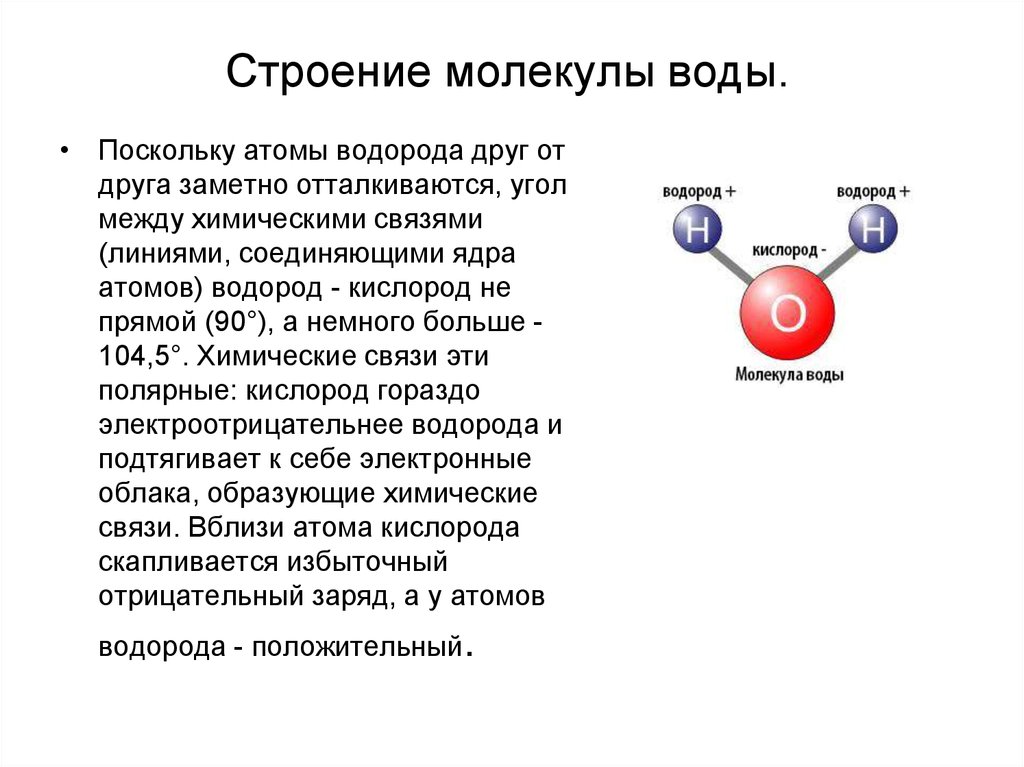
Свойства воды Фотогалерея
Узнайте о свойствах воды по картинкам
Дом школы водных наук
- Обзор
Мы должны принять заявление «Вода является универсальным растворителем» с долей скептицизма (каламбур). Конечно, она не может растворить все, но она растворяет больше веществ, чем любая другая жидкость, так что этот термин вполне подходит. Растворяющие свойства воды влияют на всю жизнь на Земле, поэтому вода важна для всех нас.
• Школа водных наук ГЛАВНАЯ • Темы о свойствах воды •
Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Знаете ли вы, что можно растворить M из M&M? Все, что вам нужно сделать, это положить несколько M&Ms в воду стороной M вверх и наблюдать, что происходит!Фото: coffeecupsandcrayons.com
Воду называют «универсальным растворителем», потому что она способна растворять больше веществ, чем любая другая жидкость.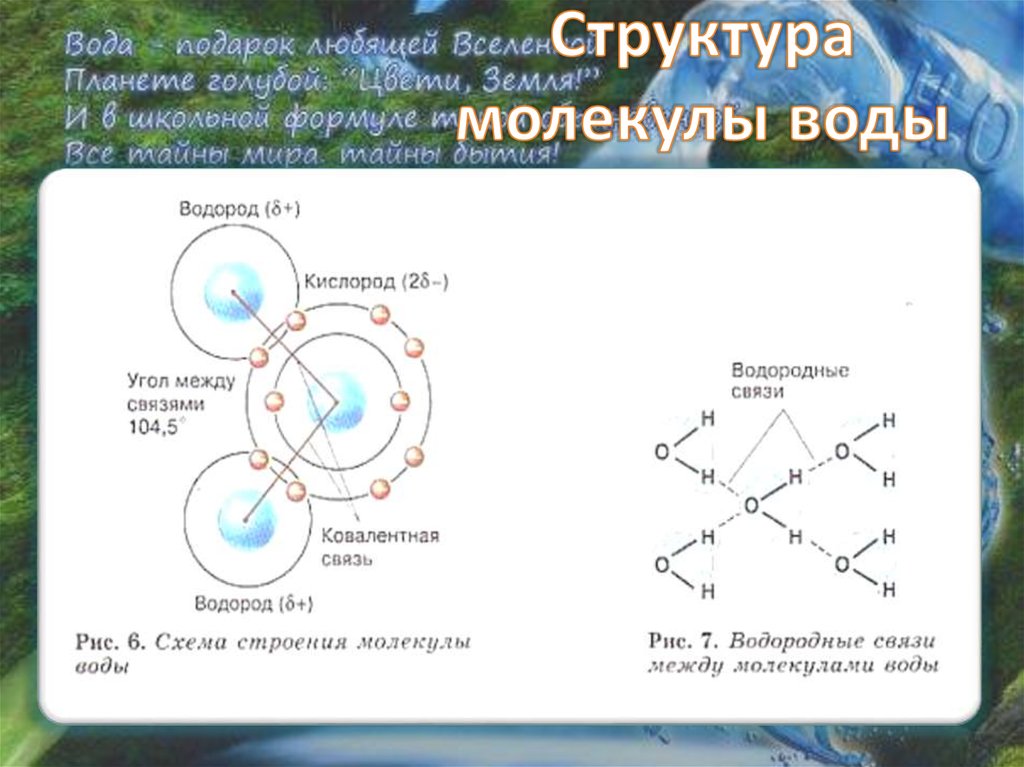 Это важно для всего живого на земле. Это означает, что куда бы ни попадала вода, будь то по воздуху, земле или через наши тела, она уносит с собой ценные химические вещества, минералы и питательные вещества.
Это важно для всего живого на земле. Это означает, что куда бы ни попадала вода, будь то по воздуху, земле или через наши тела, она уносит с собой ценные химические вещества, минералы и питательные вещества.
Химический состав и физические свойства воды делают ее таким превосходным растворителем. Молекулы воды имеют полярное расположение атомов кислорода и водорода — одна сторона (водород) имеет положительный электрический заряд, а другая сторона (кислород) — отрицательный. Это позволяет молекуле воды притягиваться ко многим другим типам молекул . Вода может настолько сильно притягиваться к другому соединению, например к соли (NaCl), что может нарушить силы притяжения, удерживающие вместе натрий и хлорид в солевом соединении, и, таким образом, растворить его.
Наши почки и вода — отличная пара
Наши почки и растворяющие свойства воды — отличная пара, поддерживающая нашу жизнь и здоровье. Почки отвечают за фильтрацию веществ, которые попадают в наш организм из продуктов и напитков, которые мы потребляем.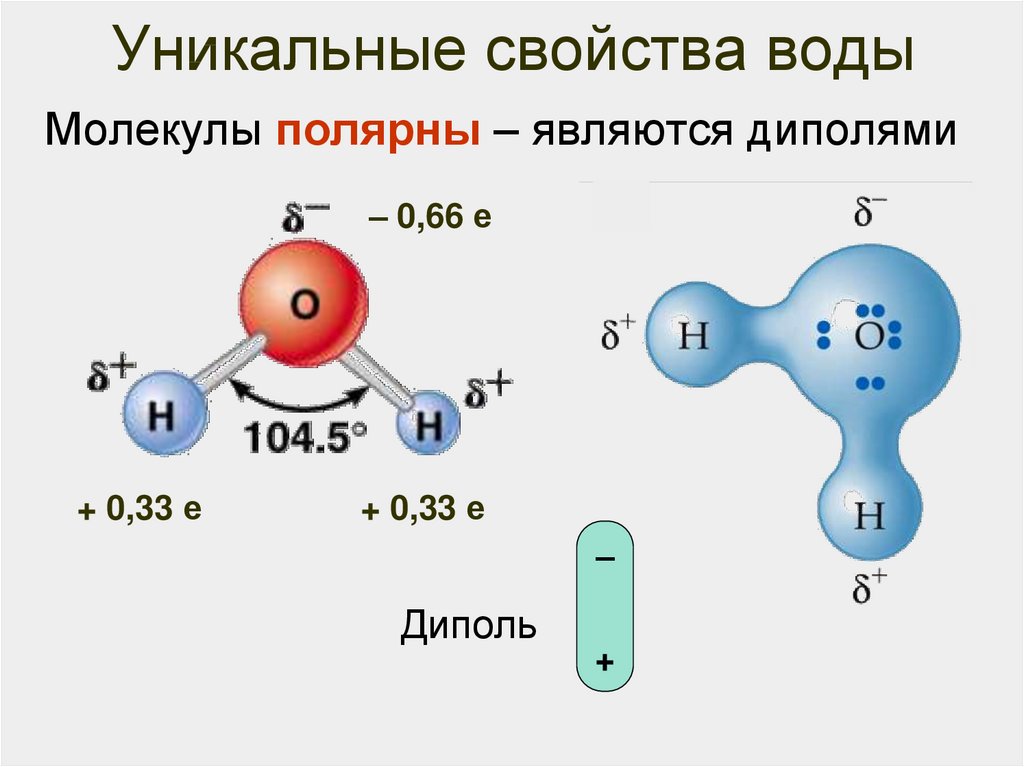 Но почки должны избавляться от этих веществ после их накопления. Вот где вода помогает; Будучи таким прекрасным растворителем, вода, промывая почки, растворяет эти вещества и выводит их из нашего тела.
Но почки должны избавляться от этих веществ после их накопления. Вот где вода помогает; Будучи таким прекрасным растворителем, вода, промывая почки, растворяет эти вещества и выводит их из нашего тела.
Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
На этой диаграмме показаны положительные и отрицательные части молекулы воды. На нем также показано, как заряд, например, иона (например, Na или Cl) может взаимодействовать с молекулой воды.Авторы и права: Мариана Руис Вильярреал, Фонд CK-12
Почему соль растворяется в воде
На молекулярном уровне соль растворяется в воде благодаря электрическим зарядам и тому факту, что и вода, и солевые соединения полярны, причем положительные и отрицательные заряды на противоположных сторонах молекулы. Связи в соединениях солей называются ионными, потому что обе они имеют электрический заряд: ион хлорида заряжен отрицательно, а ион натрия — положительно.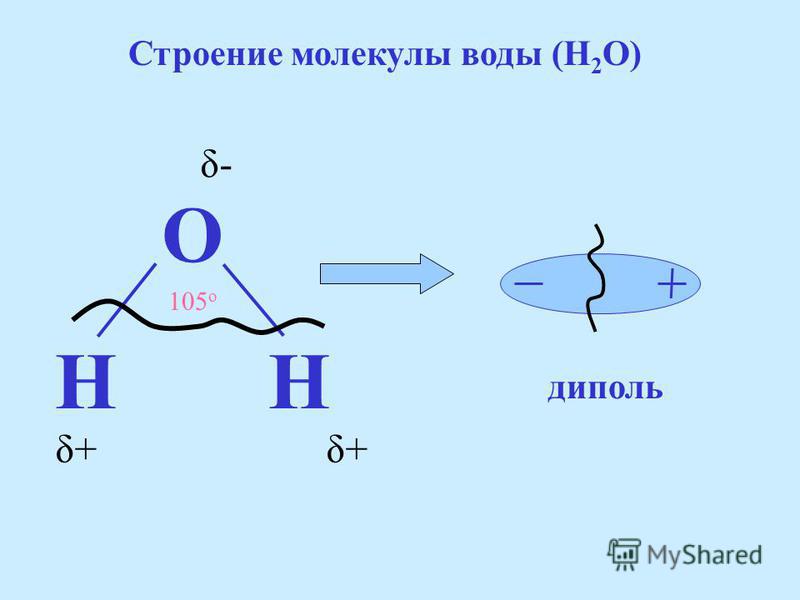 Точно так же молекула воды имеет ионную природу, но связь называется ковалентной, при этом два атома водорода располагаются со своим положительным зарядом по одну сторону от атома кислорода, который имеет отрицательный заряд. Когда соль смешивается с водой, соль растворяется, потому что ковалентные связи воды сильнее, чем ионные связи в молекулах соли.
Точно так же молекула воды имеет ионную природу, но связь называется ковалентной, при этом два атома водорода располагаются со своим положительным зарядом по одну сторону от атома кислорода, который имеет отрицательный заряд. Когда соль смешивается с водой, соль растворяется, потому что ковалентные связи воды сильнее, чем ионные связи в молекулах соли.
Положительно заряженная сторона молекул воды притягивается к отрицательно заряженным ионам хлора, а отрицательно заряженная сторона молекул воды притягивается к положительно заряженным ионам натрия. По сути, происходит перетягивание каната, когда молекулы воды побеждают в матче. Молекулы воды раздвигают ионы натрия и хлорида, разрывая ионную связь, удерживающую их вместе. После того, как солевые соединения разделены, атомы натрия и хлорида окружены молекулами воды, как показано на этой диаграмме. Как только это произойдет, соль растворится, в результате чего получится однородный раствор.
- Обзор
Мы должны принять заявление «Вода является универсальным растворителем» с долей скептицизма (каламбур).
 Конечно, она не может растворить все, но она растворяет больше веществ, чем любая другая жидкость, так что этот термин вполне подходит. Растворяющие свойства воды влияют на всю жизнь на Земле, поэтому вода важна для всех нас.
Конечно, она не может растворить все, но она растворяет больше веществ, чем любая другая жидкость, так что этот термин вполне подходит. Растворяющие свойства воды влияют на всю жизнь на Земле, поэтому вода важна для всех нас.• Школа наук о воде ГЛАВНАЯ • Темы о свойствах воды •
Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Знаете ли вы, что можно растворить M из M&M? Все, что вам нужно сделать, это положить несколько M&Ms в воду стороной M вверх и наблюдать, что происходит!
Фото: coffeecupsandcrayons.comВоду называют «универсальным растворителем», потому что она способна растворять больше веществ, чем любая другая жидкость. Это важно для всего живого на земле. Это означает, что куда бы ни попадала вода, будь то по воздуху, земле или через наши тела, она уносит с собой ценные химические вещества, минералы и питательные вещества.
Химический состав и физические свойства воды делают ее таким превосходным растворителем.
 Молекулы воды имеют полярное расположение атомов кислорода и водорода — одна сторона (водород) имеет положительный электрический заряд, а другая сторона (кислород) — отрицательный. Это позволяет молекуле воды притягиваться ко многим другим типам молекул . Вода может настолько сильно притягиваться к другому соединению, например к соли (NaCl), что может нарушить силы притяжения, удерживающие вместе натрий и хлорид в солевом соединении, и, таким образом, растворить его.
Молекулы воды имеют полярное расположение атомов кислорода и водорода — одна сторона (водород) имеет положительный электрический заряд, а другая сторона (кислород) — отрицательный. Это позволяет молекуле воды притягиваться ко многим другим типам молекул . Вода может настолько сильно притягиваться к другому соединению, например к соли (NaCl), что может нарушить силы притяжения, удерживающие вместе натрий и хлорид в солевом соединении, и, таким образом, растворить его.Наши почки и вода — отличная пара
Наши почки и растворяющие свойства воды — отличная пара, поддерживающая нашу жизнь и здоровье. Почки отвечают за фильтрацию веществ, которые попадают в наш организм из продуктов и напитков, которые мы потребляем. Но почки должны избавляться от этих веществ после их накопления. Вот где вода помогает; Будучи таким прекрасным растворителем, вода, промывая почки, растворяет эти вещества и выводит их из нашего тела.
Источники/Использование: Некоторое содержимое может иметь ограничения.
На этой диаграмме показаны положительные и отрицательные части молекулы воды. На нем также показано, как заряд, например, иона (например, Na или Cl) может взаимодействовать с молекулой воды. Посетите СМИ, чтобы узнать подробности.
Посетите СМИ, чтобы узнать подробности.Авторы и права: Мариана Руис Вильярреал, Фонд CK-12
Почему соль растворяется в воде
На молекулярном уровне соль растворяется в воде благодаря электрическим зарядам и тому факту, что и вода, и солевые соединения полярны, причем положительные и отрицательные заряды на противоположных сторонах молекулы. Связи в соединениях солей называются ионными, потому что обе они имеют электрический заряд: ион хлорида заряжен отрицательно, а ион натрия — положительно. Точно так же молекула воды имеет ионную природу, но связь называется ковалентной, при этом два атома водорода располагаются со своим положительным зарядом по одну сторону от атома кислорода, который имеет отрицательный заряд. Когда соль смешивается с водой, соль растворяется, потому что ковалентные связи воды сильнее, чем ионные связи в молекулах соли.

Положительно заряженная сторона молекул воды притягивается к отрицательно заряженным ионам хлора, а отрицательно заряженная сторона молекул воды притягивается к положительно заряженным ионам натрия. По сути, происходит перетягивание каната, когда молекулы воды побеждают в матче. Молекулы воды раздвигают ионы натрия и хлорида, разрывая ионную связь, удерживающую их вместе. После того, как солевые соединения разделены, атомы натрия и хлорида окружены молекулами воды, как показано на этой диаграмме. Как только это произойдет, соль растворится, в результате чего получится однородный раствор.
Химические характеристики и функции воды в физиологии
Если бы кто-то спросил, какая молекула самая важная в вашем организме, большинство из нас ответило бы, что это вода. Он составляет примерно 2/3 веса нашего тела! Вот почему борец, пытающийся «набрать вес» для матча, может сбросить несколько фунтов, просто потея от воды (кстати, не очень хорошая идея). Всякий раз, когда возникают предположения о жизни на других планетах, всегда возникает вопрос, есть ли на планете вода? Что такого особенного в воде, что делает ее незаменимой для жизни? Не подойдет ли и другая жидкость? Вот некоторые из вопросов, на которые мы попытаемся ответить в этом блоке.
Всякий раз, когда возникают предположения о жизни на других планетах, всегда возникает вопрос, есть ли на планете вода? Что такого особенного в воде, что делает ее незаменимой для жизни? Не подойдет ли и другая жидкость? Вот некоторые из вопросов, на которые мы попытаемся ответить в этом блоке.
Химические характеристики воды
Напомним, что молекула воды H 2 O удерживается вместе полярными ковалентными связями . Поскольку кислород притягивает электроны в ковалентных связях сильнее, чем водород, кислородный конец молекулы имеет небольшой отрицательный заряд, а водородный конец молекулы имеет небольшой положительный заряд. Также вспомните, что молекулы, состоящие из полярных ковалентных связей, могут участвовать в слабых взаимодействиях с другими полярными молекулами, называемых водородными связями. На рисунке ниже показано, как молекулы воды образуют водородные связи друг с другом. Каждая молекула воды может образовать максимум 4 водородные связи с другими молекулами воды.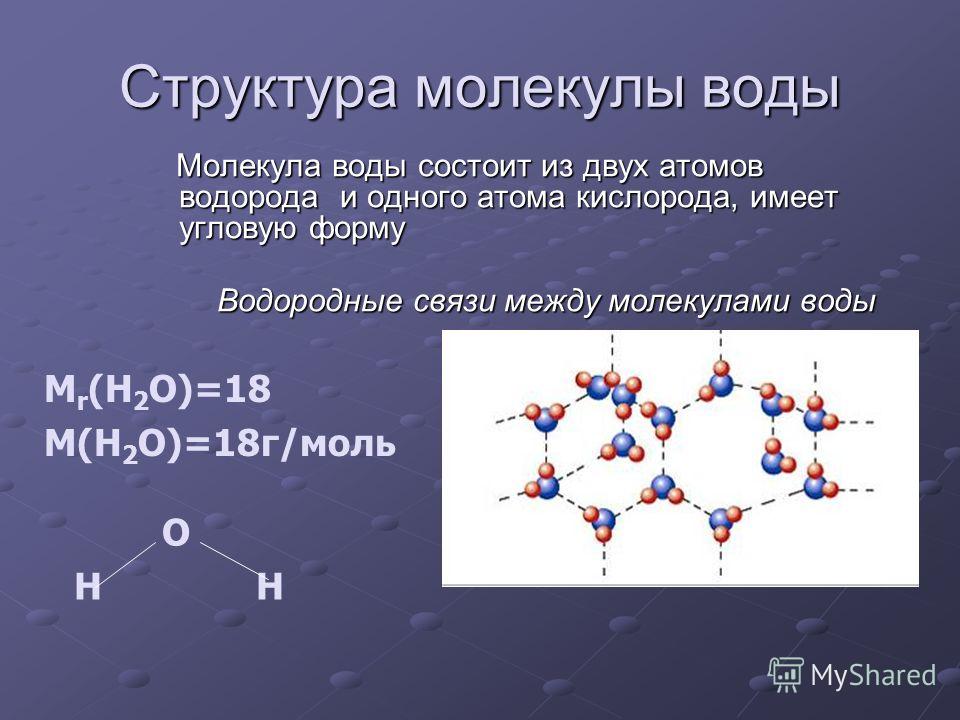 Большинство характеристик воды, о которых мы будем говорить, являются результатом полярной природы молекулы воды и ее способности образовывать водородные связи с собой и другими полярными молекулами. Помните, что водородные связи являются очень слабыми взаимодействиями и могут образовываться и разрываться относительно легко. Однако, как и в случае со всеми связями, для их разрыва требуется энергия, а энергия высвобождается при образовании новых связей. Именно количество этих связей определяет физическое состояние воды. Например, в твердом состоянии каждая молекула воды образует водородные связи с четырьмя другими молекулами, что приводит к образованию стабильной кристаллической структуры, известной как лед. В жидком состоянии каждая молекула воды образует менее четырех связей (в среднем 3,4), которые постоянно перестраиваются. Вода становится паром, когда энергии достаточно, чтобы разорвать все водородные связи между молекулами воды, и они могут выйти в виде газа.
Большинство характеристик воды, о которых мы будем говорить, являются результатом полярной природы молекулы воды и ее способности образовывать водородные связи с собой и другими полярными молекулами. Помните, что водородные связи являются очень слабыми взаимодействиями и могут образовываться и разрываться относительно легко. Однако, как и в случае со всеми связями, для их разрыва требуется энергия, а энергия высвобождается при образовании новых связей. Именно количество этих связей определяет физическое состояние воды. Например, в твердом состоянии каждая молекула воды образует водородные связи с четырьмя другими молекулами, что приводит к образованию стабильной кристаллической структуры, известной как лед. В жидком состоянии каждая молекула воды образует менее четырех связей (в среднем 3,4), которые постоянно перестраиваются. Вода становится паром, когда энергии достаточно, чтобы разорвать все водородные связи между молекулами воды, и они могут выйти в виде газа.
изображение создано студенткой BYU-I Ханной Краудер, осень 2013 г.
На изображении выше показаны водородные связи между молекулами воды.
Стабилизация температуры тела
Количество энергии в виде тепла, которое необходимо добавить к веществу или отнять от него, чтобы изменить его температуру, называется теплоемкостью вещества. Вода обладает очень высокой теплоемкостью. Для повышения температуры одного грамма воды на один градус Цельсия требуется одна калория энергии. На самом деле, мы определяем калорию на основе теплоемкости воды (Одна калория — это количество тепловой энергии, необходимое для повышения температуры 1 грамма воды на 1° Цельсия. Примечание: при указании калорийности пищи калорией является пишется с большой буквы. Эти «большие» калории на самом деле составляют килокалории или 1000 калорий). Точно так же 1 калория энергии должна быть изъята из воды, чтобы понизить температуру 1 грамма воды на 1 градус Цельсия. Сравните это с теплоемкостью воздуха, которая составляет 0,24 калории на грамм.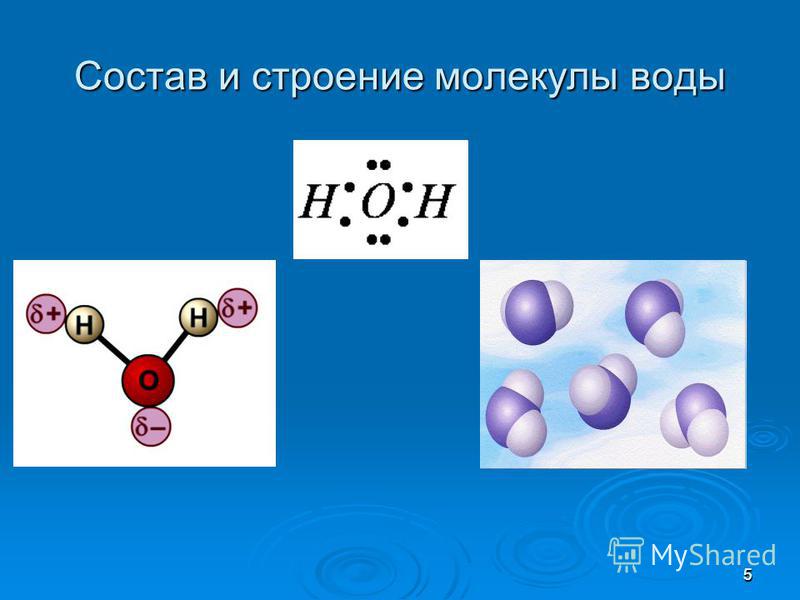 Высокая теплоемкость обусловлена водородными связями между молекулами воды. Температура является мерой полной кинетической энергии (движения) материала. Прежде чем молекулы воды смогут начать двигаться быстрее, водородные связи между молекулами должны быть разрушены, что требует затрат энергии. Следовательно, большая часть энергии (тепла) используется для разрыва связей, а не для повышения температуры (движения) молекул воды. Точно так же, когда тепло отводится и молекулы воды начинают замедляться, образуются новые водородные связи, высвобождая энергию, что помогает предотвратить сильное падение температуры. Поскольку тело человека примерно на 2/3 состоит из воды, это помогает предотвратить резкие изменения температуры тела.
Высокая теплоемкость обусловлена водородными связями между молекулами воды. Температура является мерой полной кинетической энергии (движения) материала. Прежде чем молекулы воды смогут начать двигаться быстрее, водородные связи между молекулами должны быть разрушены, что требует затрат энергии. Следовательно, большая часть энергии (тепла) используется для разрыва связей, а не для повышения температуры (движения) молекул воды. Точно так же, когда тепло отводится и молекулы воды начинают замедляться, образуются новые водородные связи, высвобождая энергию, что помогает предотвратить сильное падение температуры. Поскольку тело человека примерно на 2/3 состоит из воды, это помогает предотвратить резкие изменения температуры тела.
Еще одним свойством воды, помогающим стабилизировать температуру тела, является ее высокая теплота парообразования . Это означает, что для превращения воды из жидкости в газ требуется затратить относительно большое количество энергии, чтобы увеличить движение молекул воды, достаточное для того, чтобы они освободились от молекул воды вокруг них.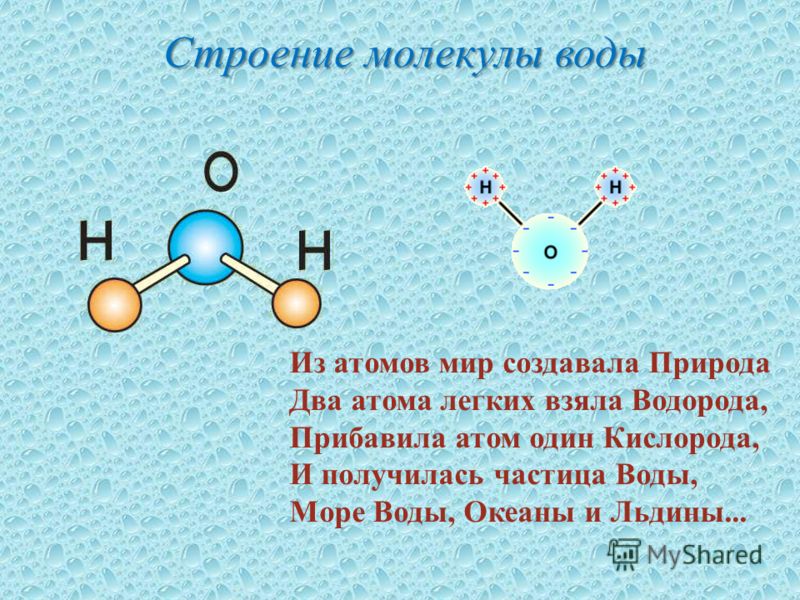 Поскольку эти молекулы воды движутся все быстрее и быстрее, у них в конечном итоге будет достаточно энергии, чтобы полностью отделиться от жидкости и превратиться в газ (водяной пар). Когда самые быстро движущиеся молекулы вырываются на свободу, их кинетическая энергия уходит вместе с ними, отводя тепло. На этом основан охлаждающий эффект испарения пота с нашей кожи.
Поскольку эти молекулы воды движутся все быстрее и быстрее, у них в конечном итоге будет достаточно энергии, чтобы полностью отделиться от жидкости и превратиться в газ (водяной пар). Когда самые быстро движущиеся молекулы вырываются на свободу, их кинетическая энергия уходит вместе с ними, отводя тепло. На этом основан охлаждающий эффект испарения пота с нашей кожи.
Адгезия, когезия и смазка
Вода способна прилипать к другим полярным веществам. Это свойство называется адгезией . Отличным примером важности этого свойства для организма являются легкие. Тонкая прослойка воды между наружной поверхностью легких и стенками грудной полости «приклеивает» легкие к стенкам и препятствует их коллапсу. Когезия — это слипание молекул воды. Это свойство препятствует отделению крови при движении по кровеносным сосудам. Наконец, вода может действовать как смазка и находится в тех частях тела, где структуры должны скользить друг относительно друга. Например, синовиальные суставы (колено, плечо, лодыжка и т. д.) имеют тонкий слой воды (синовиальной жидкости) между противолежащими структурами, что позволяет им легко скользить друг относительно друга при движении сустава.
Например, синовиальные суставы (колено, плечо, лодыжка и т. д.) имеют тонкий слой воды (синовиальной жидкости) между противолежащими структурами, что позволяет им легко скользить друг относительно друга при движении сустава.
Химические реакции
Все тысячи химических реакций, протекающих в нашем организме, требуют воды. Это связано с тем, что для реакции химические вещества должны находиться в водном растворе. Также вода принимает непосредственное участие во многих важных реакциях, протекающих в организме.
**Вы можете использовать кнопки ниже, чтобы перейти к следующему или предыдущему чтению в этом модуле**
h3O Температура кипения, Молярная масса
- Автор Sahana Soma Kodarkar
- Последнее изменение 19-07-2022
- Автор Сахана Сома Кодаркар
- Последнее изменение 19-07-2022
Химическая формула воды: Большая часть всех живых организмов состоит из воды.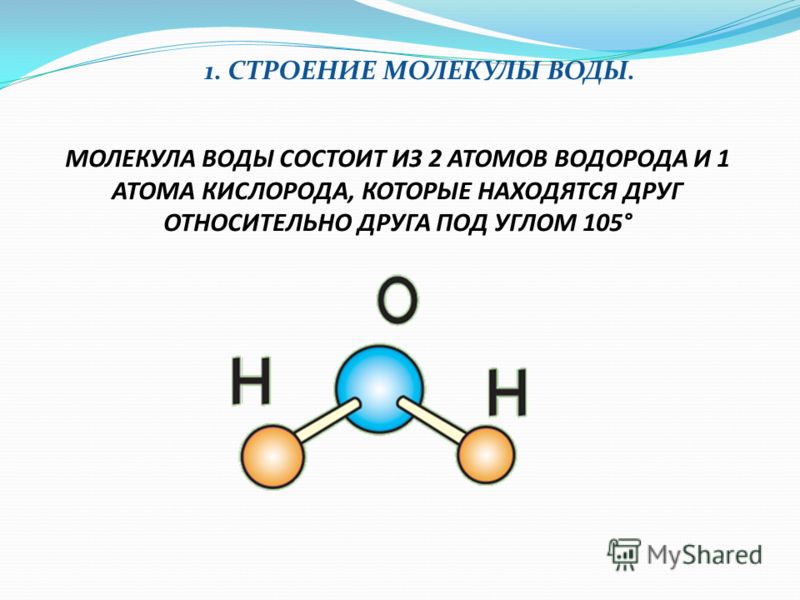 В человеческом теле около \(65\% {\rm{}},\), а в некоторых растениях — до \(95\% \) воды. Это важнейшее соединение для выживания всех форм жизни. Это растворитель большой важности. Распределение воды по земной поверхности неравномерно. Чтобы узнать больше о химической формуле воды, прочитайте статью ниже.
В человеческом теле около \(65\% {\rm{}},\), а в некоторых растениях — до \(95\% \) воды. Это важнейшее соединение для выживания всех форм жизни. Это растворитель большой важности. Распределение воды по земной поверхности неравномерно. Чтобы узнать больше о химической формуле воды, прочитайте статью ниже.
Определение воды
Вода — это вещество, которое существует в газообразном, жидком и твердом состояниях и состоит из химических элементов водорода и кислорода, которые удерживаются вместе ковалентными связями. Химическая формула воды \({{\text{H}}_2}{\text{O}}.\) Это одно из самых распространенных и необходимых соединений. Наряду с кислородом, вода является наиболее важной для жизни человека. Без еды можно прожить несколько дней, но не без воды. Он также используется в качестве растворителя для многих веществ и участвует в широком спектре химических реакций. Вода также является источником тяжелой воды \(\left({{{\text{D}}_2}{\text{O}}} \right),\), которая имеет решающее значение для ядерных реакторов для контроля скорости нейтронов.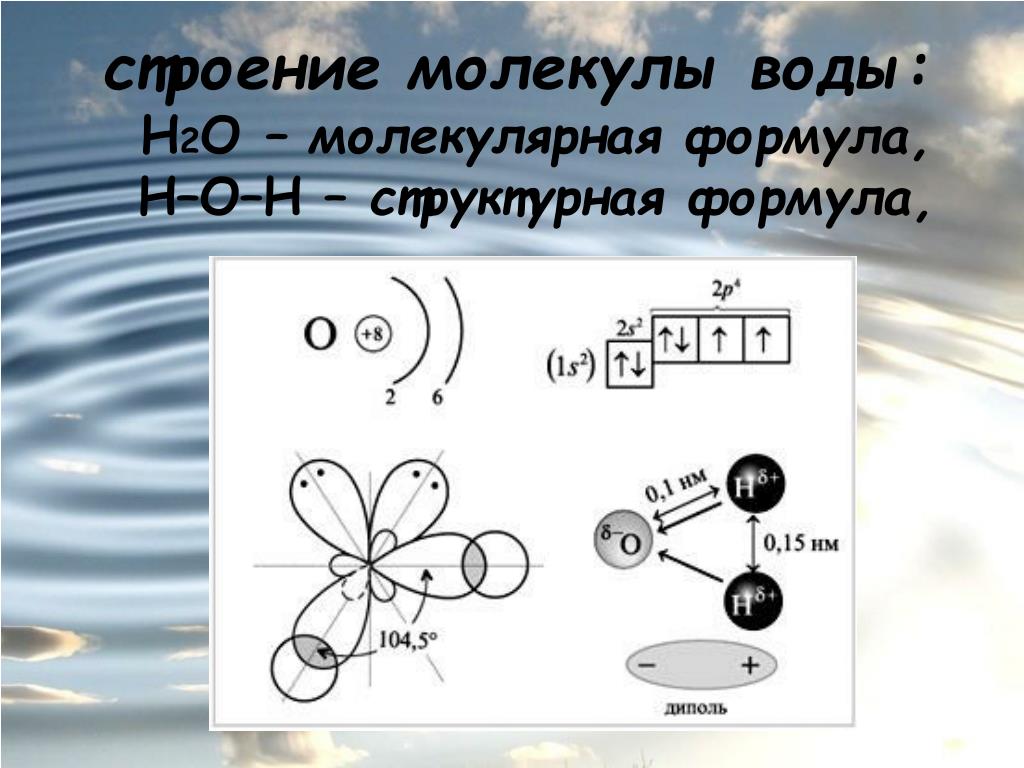 9\circ }\) и длиной связи \(95,7\,{\text{pm}}.\)
9\circ }\) и длиной связи \(95,7\,{\text{pm}}.\)
Структура льда
Лед имеет высокоупорядоченную трехмерную структуру с водородными связями. \({\text{X}}\)-лучевой анализ кристаллов льда показывает, что четыре других атома кислорода окружают каждый атом кислорода в тетраэдрическом расположении на расстоянии \(276\,{\text{pm}}.\ ) Водородные связи придают льду достаточно открытую структуру с широкими отверстиями. Эти отверстия могут междоузельно содержать некоторые другие молекулы соответствующего размера.
Водородная связь в воде и льду
Молекула \({{\text{H}}_2}{\text{O}}\) обладает высокой полярностью. В результате полярности молекулы \({{\text{H}}_2}{\text{O}}\) образуют межмолекулярные водородные связи во льду и жидкой воде. Наличие водородной связи объясняет некоторые уникальные свойства, которые обсуждаются ниже:
A. Лед плавает на воде Во льду (твердая форма воды) молекулы \({{\text{H}}_2}{\text{O}}\) расположены в пространстве тетраэдрически.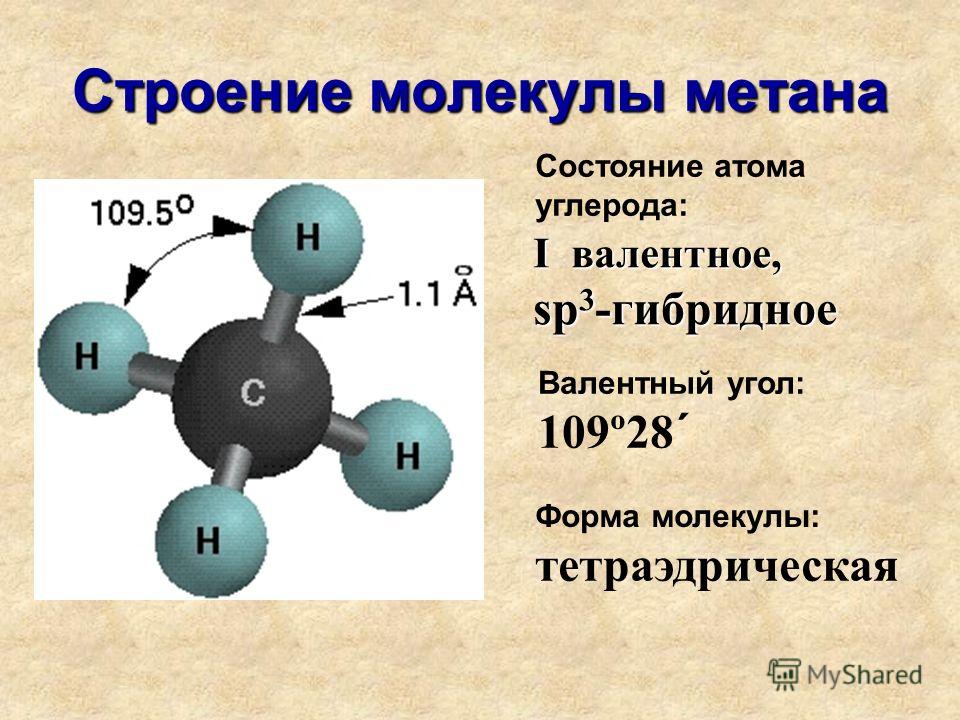 Атом кислорода в каждой молекуле \({{\text{H}}_2}{\text{O}}\) связан с двумя атомами водорода ковалентными связями и в то же время образует водородные связи с водородом атомов соседних \({{\text{H}}_2}{\text{O}}\) молекул. В результате получается структура, напоминающая клетку.
Атом кислорода в каждой молекуле \({{\text{H}}_2}{\text{O}}\) связан с двумя атомами водорода ковалентными связями и в то же время образует водородные связи с водородом атомов соседних \({{\text{H}}_2}{\text{O}}\) молекул. В результате получается структура, напоминающая клетку.
Структура также пористая из-за пустот. Когда лед превращается в жидкую воду, добавленная тепловая энергия имеет тенденцию разрывать некоторые водородные связи между молекулами \({{\text{H}}_2}{\text{O}}\) во льду. В результате тетраэдрические структуры начинают разрушаться, и молекулы \({{\text{H}}_2}{\text{O}}\) в воде сближаются. Количество пустот также начинает уменьшаться, поэтому плотность воды больше, чем у льда, а значит, лед всегда плавает на воде. 9\ circ {\ rm {C}} \)
При \(273\,{\text{k}},\) лед и вода сосуществуют. С повышением температуры подводимая тепловая энергия будет еще больше разрушать тетраэдрические структуры из-за уменьшения водородных связей. Следовательно, ожидается, что плотность воды увеличится. \circ {\rm{C}},\), эффект увеличения кинетической энергии становится больше, чем эффект увеличения плотности. Вероятно, это связано с тем, что объем воды увеличивается, а ее плотность уменьшается. 9\circ {\rm{C}}.\) Водные животные могут безопасно жить в воде при такой температуре.
\circ {\rm{C}},\), эффект увеличения кинетической энергии становится больше, чем эффект увеличения плотности. Вероятно, это связано с тем, что объем воды увеличивается, а ее плотность уменьшается. 9\circ {\rm{C}}.\) Водные животные могут безопасно жить в воде при такой температуре.
Важность структуры воды
Жидкое состояние воды имеет очень сложную структуру, которая, несомненно, включает значительную ассоциацию молекул. Из-за обширных водородных связей между молекулами в жидкой воде значения таких свойств, как вязкость, поверхностное натяжение и температура кипения, намного выше, чем можно было бы ожидать для типичной жидкости, содержащей небольшие молекулы. 9\circ {\rm{C}},\) выше, чем температура кипения, ожидаемая исходя из размера его молекул. В отличие от конденсированных состояний (твердого и жидкого) воды, которые имеют обширную ассоциацию между молекулами воды, газообразная (парообразная) фаза имеет относительно независимые молекулы воды, разделенные большими расстояниями.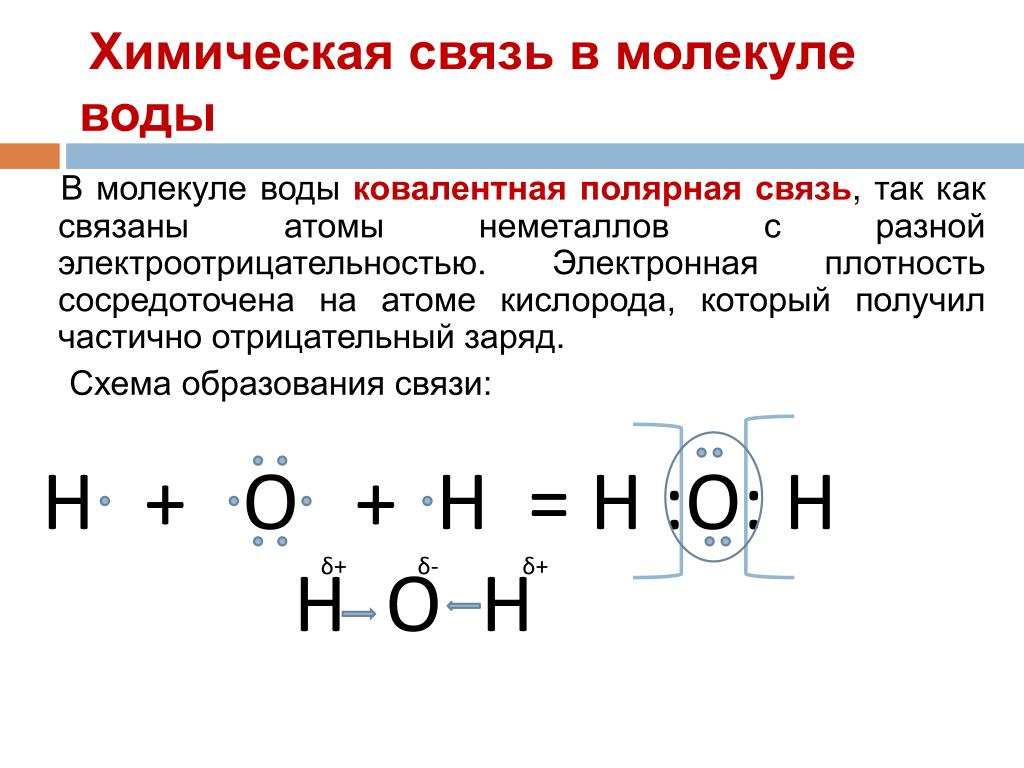
Физические свойства воды
- 1. Вода – это жидкость с температурой замерзания \(273,15\,{\text{K}}\) и точкой кипения \(373,15\,{\text{K}}{\text{.} }\) 9\circ {\rm{C}}} \right),{\rm{i}}{\rm{.e}}.,{\mkern 1mu} 1{\mkern 1mu} {\rm{g}}/ {\rm{ml}}.\)
- 3. В воде молекулы связаны водородными связями. Водородная связь влияет на все физические свойства, такие как состояние, теплота плавления, теплота парообразования, температура плавления и кипения и т. д.
- 4. Вода является естественным полярным соединением. В результате большинство неорганических веществ и многие органические вещества с полярными связями в их молекулах растворимы в воде за счет межмолекулярных водородных связей.
- 5. Из-за своей полярной природы в молекулах \({{\text{H}}_2}{\text{O}}\) присутствуют сильные межмолекулярные силы притяжения и водородные связи.
Химические свойства воды
Важными химическими свойствами воды являются следующие:
1.
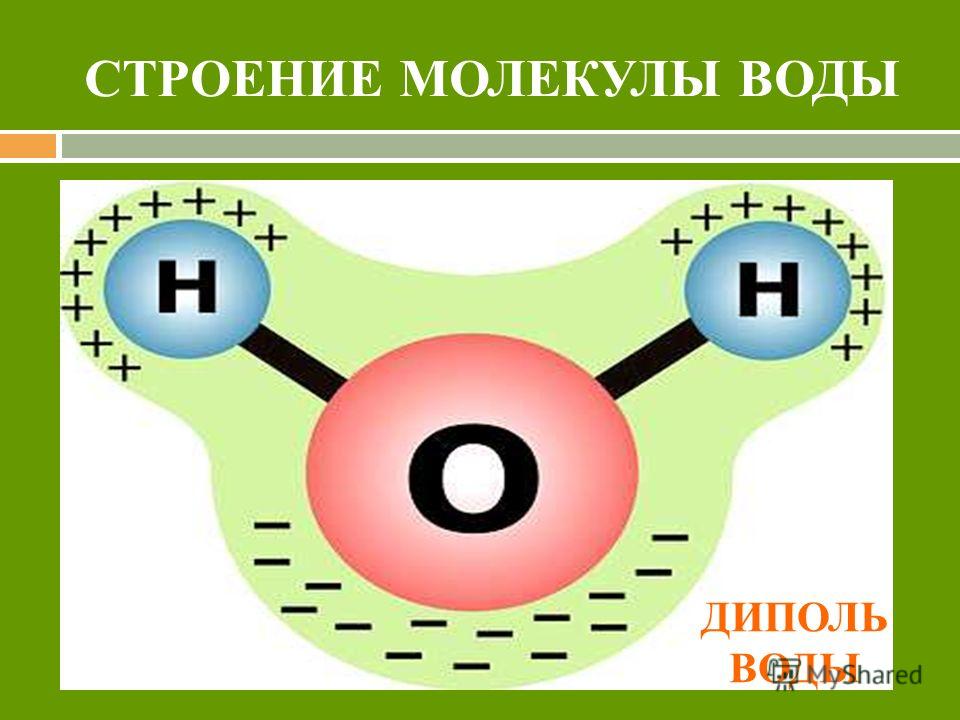 Амфотерная природа
Амфотерная природа Может действовать как кислота и как основание; ведет себя как амфотерное вещество. В смысле Бренстеда он действует как кислота с \({\text{N}}{{\text{H}}_3}\) и как основание с \({{\text{H}}_2}{ \text{S}}.\) 9– }\) ионы воды взаимодействуют с анионами или катионами соединения соответственно, что приводит к образованию кислоты или основания или того и другого, как показано ниже:
\({\text{CaO}} +{{\text{H}}_2}{\text{O}} \to {\text{Ca}}{\left({{\text{OH}}} \справа)_2}\)
\({\text{S}}{{\text{O}}_2} + {{\text{H}}_2}{\text{O}} \to {{\text{H}}_2} {\text{S}}{{\text{O}}_3}\)
\({{\text{P}}_4}{{\text{O}}_{10}} + 6{{\text{H}}_2}{\text{O}} \to \underset{ {{\text{Фосфорная}}\,{\text{кислота}}}}{\mathop {4{{\text{H}}_3}{\text{P}}{{\text{O}}_4 }}} \)
4.
Вода как катализатор Вода также катализирует некоторые химические реакции. Например, совершенно сухой газ, такой как \({\text{N}}{{\text{H}}_3}\left({\text{g}} \right)\) и \({\text{HCl} }\left({\text{g}} \right)\) не реагирует. Однако в присутствии следов влаги они объединяются, образуя \({\text{N}}{{\text{H}}_4}{\text{Cl}}.\)
Однако в присутствии следов влаги они объединяются, образуя \({\text{N}}{{\text{H}}_4}{\text{Cl}}.\)
Вода – это вещество, которое существует в газообразном, жидком и твердом состояниях и состоит из химических элементов водорода и кислорода. Химическая формула воды: \({{\text{H}}_2}{\text{O}}{\text{.}}\) Вода представляет собой жидкость с температурой замерзания \(273,15\,{\ text{K}},\) и температурой кипения \(373,15\,{\text{K}}{\text{.}}\) Вода является полярным растворителем. Вода амфотерна по своей природе и действует как окислитель и восстановитель. Без еды можно прожить несколько дней, но не без воды. Вода также используется в качестве растворителя для широкого круга веществ и участвует в широком спектре химических реакций.
Часто задаваемые вопросы о химической формуле воды
Q.1. Каково полное имя \({{\text{H}}_2}{\text{O}}\)?
Ответ: Полное название \({{\text{H}}_2}{\text{O}}\) – вода.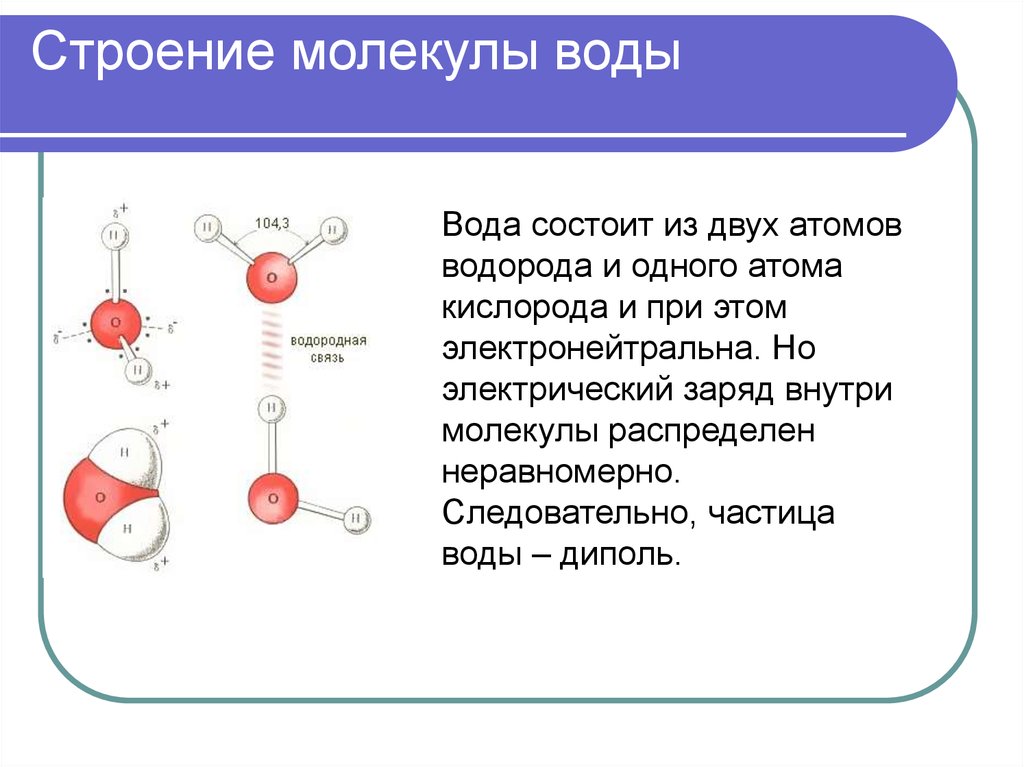 Он также известен как монооксид дигидрогена.
Он также известен как монооксид дигидрогена.
Q.2. Какая формула воды в химии?
Ответ: Химическая формула воды в химии: \({{\text{H}}_2}{\text{O}}.\)
Q.3. Что такое \({{\text{H}}_2}{\text{O}}\) называется по химии?
Ответ: В химии \({{\text{H}}_2}{\text{O}}\) называется водой.
Q.4. Как пишется вода?
Ответ: Молекула воды состоит из двух атомов водорода, обозначаемых буквой \({\text{H,}}\), и одного атома кислорода, обозначаемого буквой \({\text{O}}{\ text{.}}\) Таким образом, вода может быть записана как \({{\text{H}}_2}{\text{O}}.\)
Q.5. Каковы три правила написания химической формулы?
Ответ: Три правила написания химической формулы следующие:
1) Сначала мы пишем символы элементов, из которых состоит соединение.
2) Под символом каждого элемента пишем его валентность.
3) Наконец, мы пересекаем валентности атомов, которые объединяются.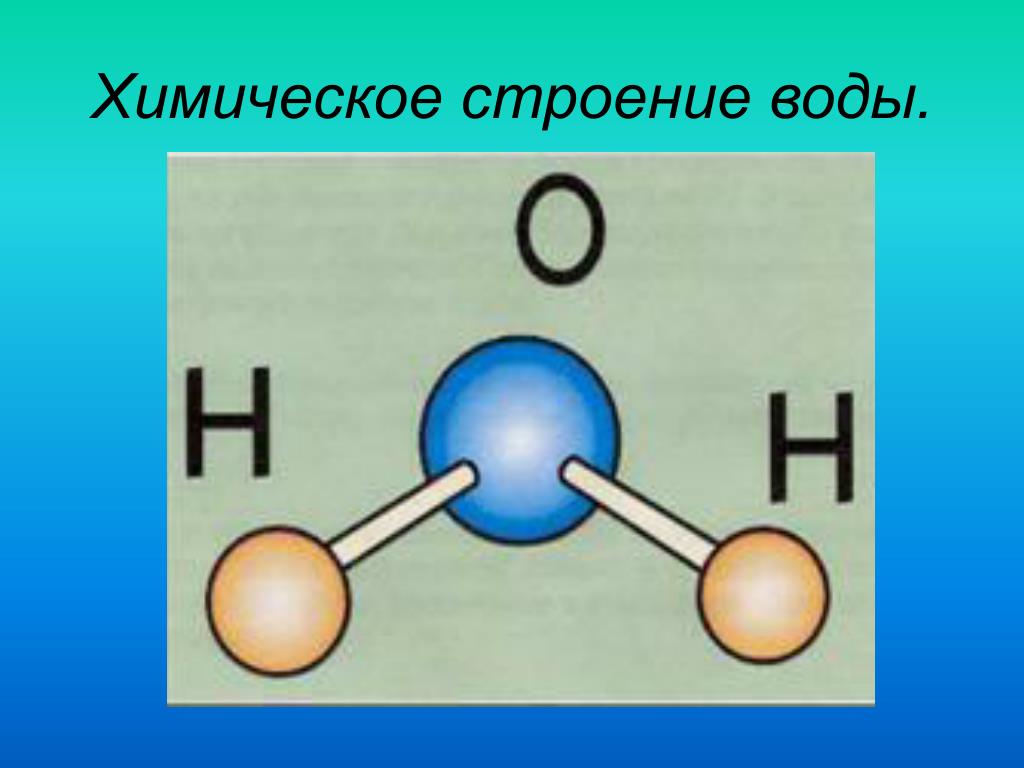
В.6. Является ли \({{\text{H}}_2}{\text{O}}\) кислотой или основанием?
Ответ: \({{\text{H}}_2}{\text{O}}\) может действовать как кислота, так и как основание в химических реакциях. Следовательно, вода амфотерна по своей природе.
Изучение важности воды здесь
Мы надеемся, что эта статья «Химическая формула воды» помогла вам. Если у вас есть какие-либо вопросы, оставьте комментарий ниже, и мы свяжемся с вами.
Практические вопросы о воде с советами и решениями
Факты о воде
Вот 18 интересных фактов о воде, одном из самых простых и самых распространенных соединений во Вселенной.
Доктор Дуг Стюарт
1. Вода представляет собой соединение двух наиболее распространенных во Вселенной элементов: водорода и кислорода. (Только гелия больше, чем кислорода во Вселенной, но гелий не образует соединений.)
2. Химическая формула воды H 2 O известна лучше, чем формула любого другого соединения.
3. Скорость света в воде составляет три четверти скорости света в воздухе. Эта разница скоростей заставляет свет преломляться (менять направление), когда он проходит между воздухом и водой. Результатом этого является то, что предметы под водой, рассматриваемые под углом с суши, на самом деле не находятся в точном месте, которое предполагают наши глаза и мозг.
4. Скорость звука в воде в 4,3 раза больше, чем в воздухе при 20 °С. За одну секунду звук проходит:
- 344 метра по сухому воздуху
- 1483 метра по пресной воде
- 1522 метра по морской воде
5. Низкочастотные звуки могут распространяться в воде на огромные расстояния с небольшим уменьшением громкости. Это позволяет китам общаться на огромных расстояниях в океанах.
Низкочастотные крики горбатых китов могут при благоприятных условиях распространяться в океане на тысячи миль.
6. Твердое состояние воды менее плотное, чем жидкое. В результате лед плавает на воде. Это крайне необычно — противоположное справедливо почти для всех других веществ. Если бы лед тонул в воде, наш мир был бы очень другое место. Лед будет накапливаться на дне моря, что будет иметь огромные последствия для климата и жизни.
Это крайне необычно — противоположное справедливо почти для всех других веществ. Если бы лед тонул в воде, наш мир был бы очень другое место. Лед будет накапливаться на дне моря, что будет иметь огромные последствия для климата и жизни.
Айсберги, плавающие на воде, возможны только из-за необычного поведения воды.
7. Необычно то, что повышение давления на лед снижает его температуру плавления. Когда фигурист движется по льду, высокое давление лезвий коньков плавит тонкий слой льда прямо под ними. Этот тонкий слой воды на льду имеет очень низкое трение, в результате чего фигуристу очень легко двигаться — либо изящно в случае опытных фигуристов, либо часто некрасиво падая для неопытных фигуристов.
8. Вода имеет рН 7. Она нейтральна по кислотно-щелочной шкале.
Вода нейтральна по шкале pH.
9. Вода имеет очень низкую молекулярную массу, всего 18, и состоит из двух атомов водорода и одного кислорода (1 + 1 + 16 = 18). Исходя из этого, кислород должен быть газом комнатной температуры. Если бы это было так, жизнь была бы невозможна.
Если бы это было так, жизнь была бы невозможна.
Однако электрический заряд в молекуле воды распределен неравномерно. Хотя в целом каждая молекула воды электрически нейтральна, атом кислорода имеет слегка отрицательный заряд, а атомы водорода — слегка положительный. Это приводит к образованию водородных связей между молекулами воды, резко повышая температуру плавления и кипения воды до их хорошо известных значений.
Водородные связи между отдельными молекулами сильно влияют на свойства воды.
10. Полярные связи воды позволяют ей растворять многие вещества, что делает ее идеальным растворителем для химии жизни.
11. Вода покрывает 71 процент поверхности нашей планеты, поэтому ее цвет, если смотреть из космоса, синий.
Наша голубая планета с пересечением Луны.
12. Вода действует как растворитель газообразного кислорода. Если бы не это, не было бы и рыбы. Чем холоднее вода, тем больше кислорода она может удерживать.
13. Вода необходима для всех известных форм жизни. У людей более половины массы тела — это просто вода. Взрослым самцам требуется около 3 литров воды в день, а самкам около 2 литров воды. Это не обязательно должно происходить из чистой воды: это может происходить из других напитков и, конечно же, большая часть пищи, которую мы едим, состоит в основном из воды.
У людей более половины массы тела — это просто вода. Взрослым самцам требуется около 3 литров воды в день, а самкам около 2 литров воды. Это не обязательно должно происходить из чистой воды: это может происходить из других напитков и, конечно же, большая часть пищи, которую мы едим, состоит в основном из воды.
Вода является основным компонентом большинства частей нашего тела.
14. Хотя чистая вода выглядит прозрачной, на самом деле она слегка голубая.
15. Вода обладает высоким поверхностным натяжением, что позволяет плавать предметам, плотность которых должна заставить их тонуть.
Сталь плотнее воды и обычно тонет. Если сталь достаточно легкая, как, например, скрепка здесь, поверхностное натяжение воды удерживает сталь снаружи воды.
16. Помимо высокого поверхностного натяжения, вода довольно липкая, что позволяет ее каплям собираться в самых разных местах.
Поверхностное натяжение и липкость воды позволяют каплям росы образовываться и собираться, например, на этой паутине.


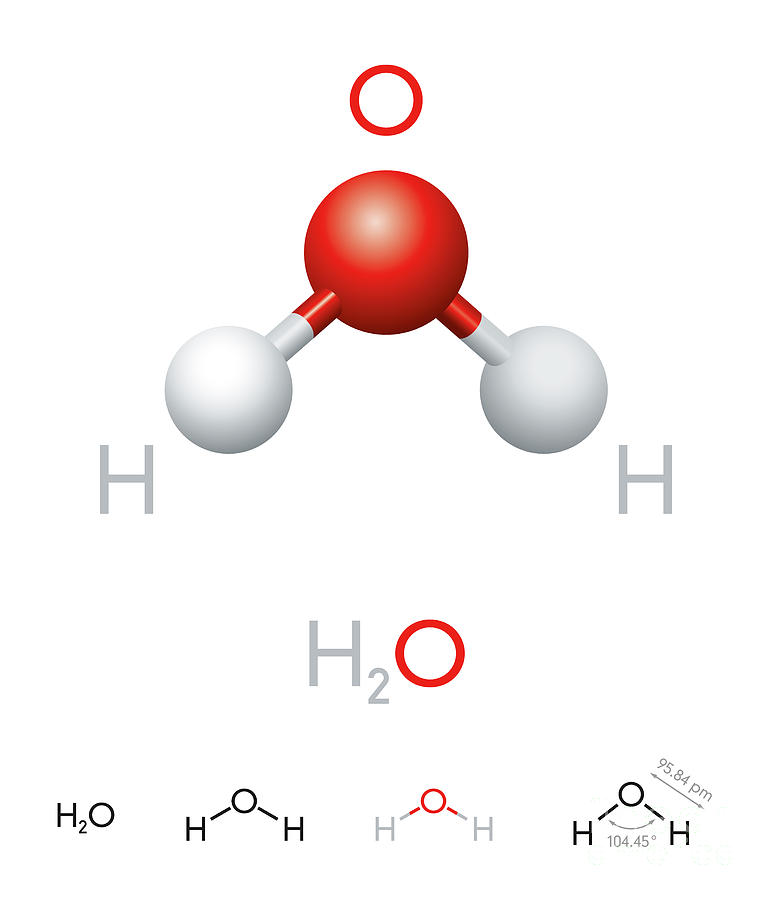

 — 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
— 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
 Это интересное ее физическое свойство. Если притяжение есть, она будет подстраивать форму под сосуд, а в космосе будет геометрически правильной формы.
Это интересное ее физическое свойство. Если притяжение есть, она будет подстраивать форму под сосуд, а в космосе будет геометрически правильной формы.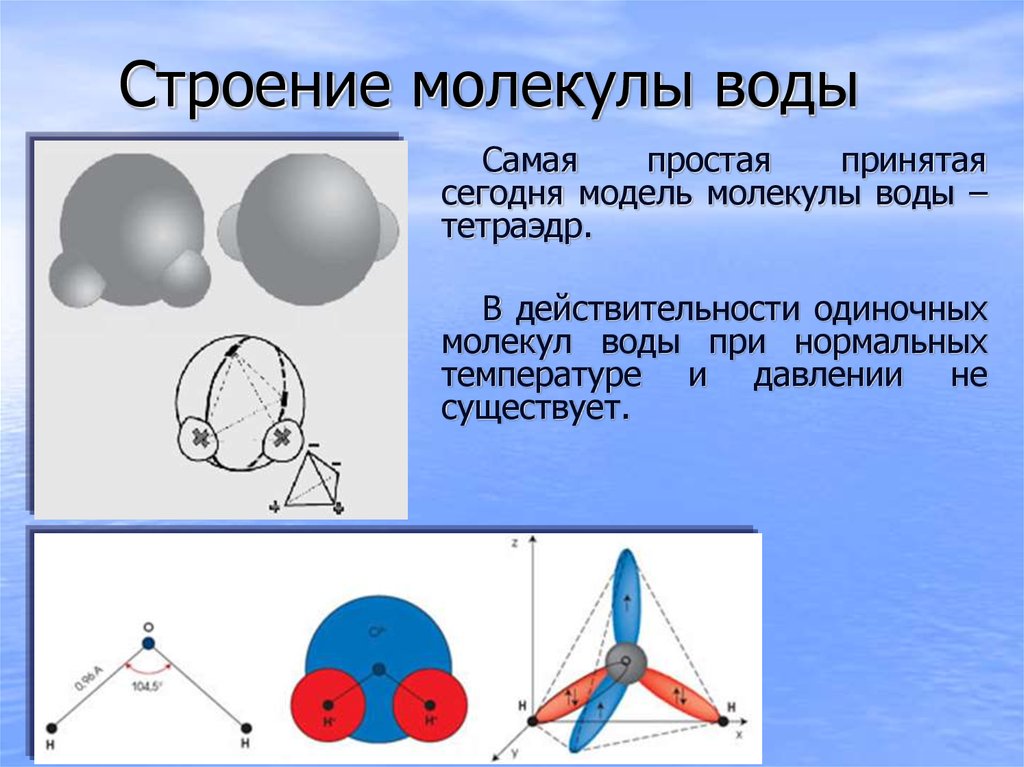 Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
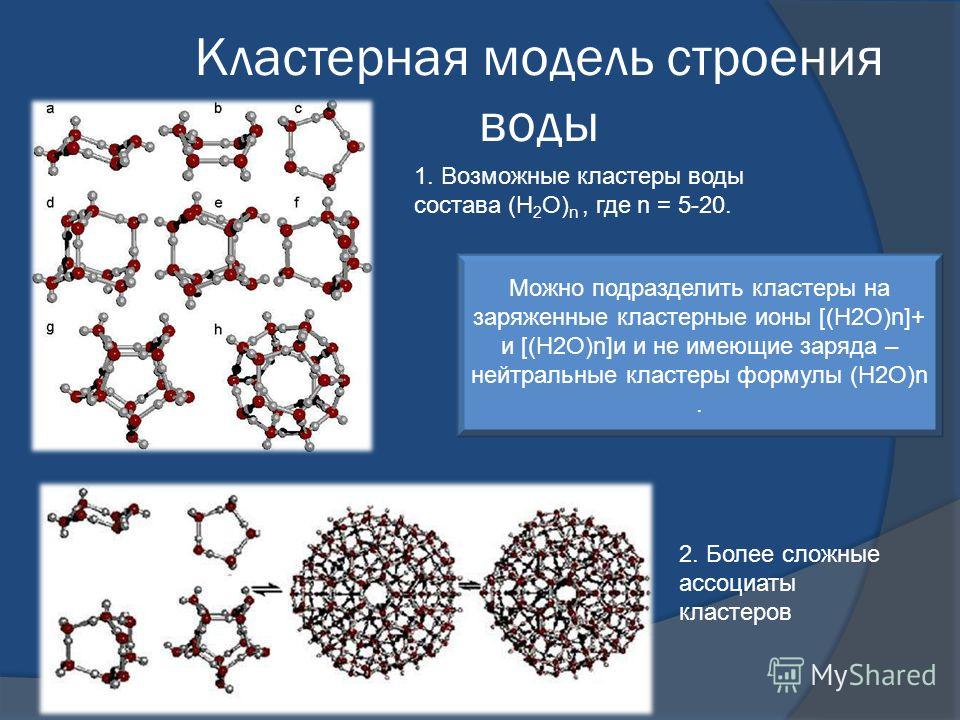
 Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит.
Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит.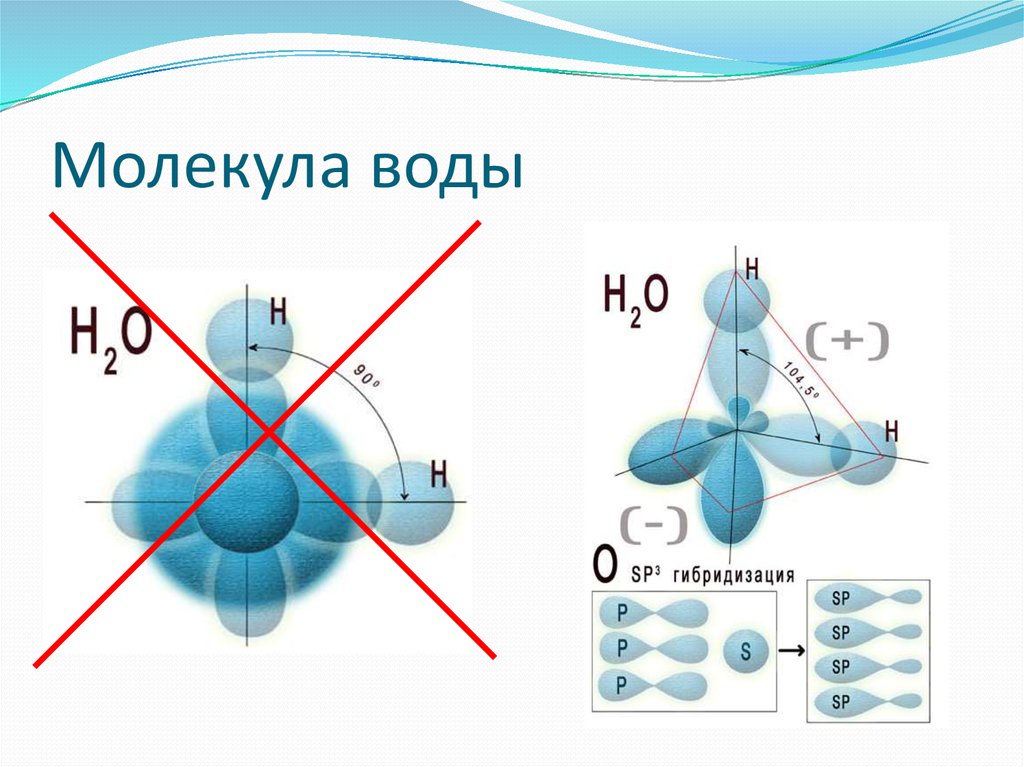

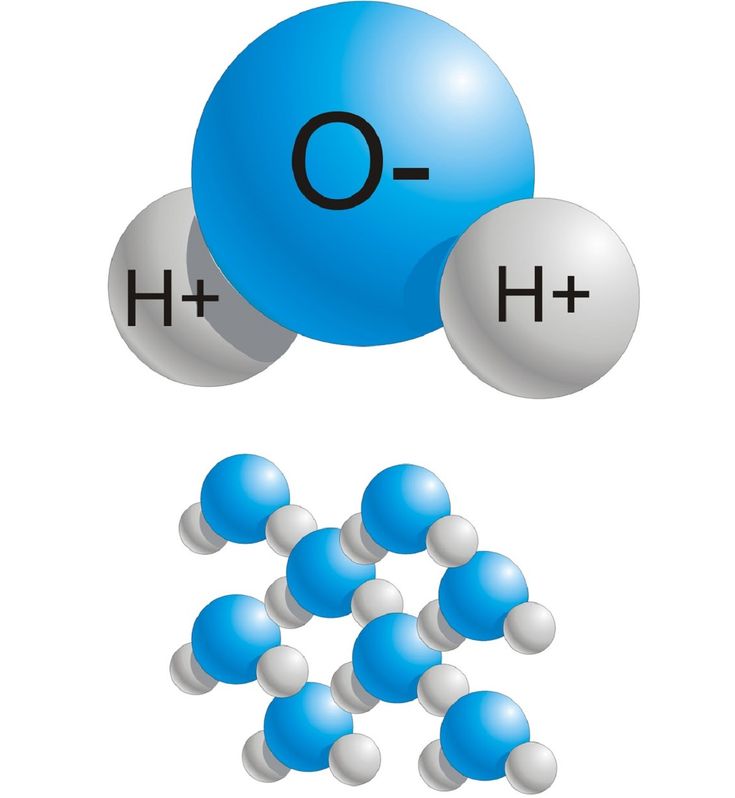

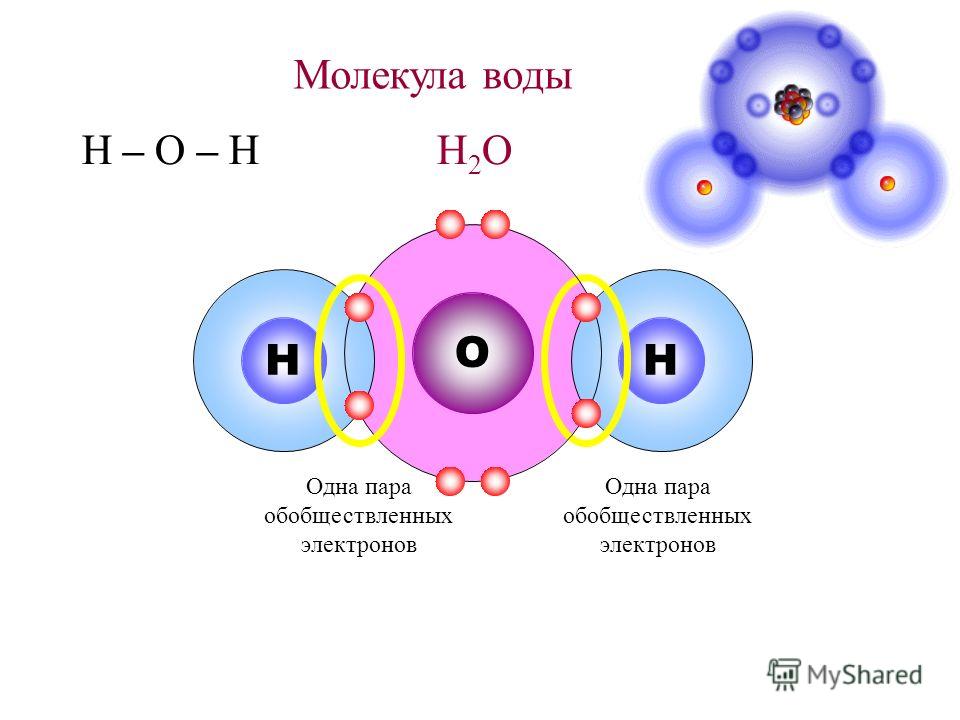

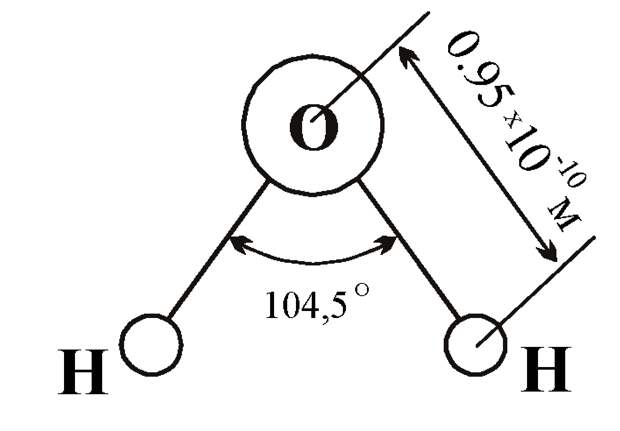 ..
..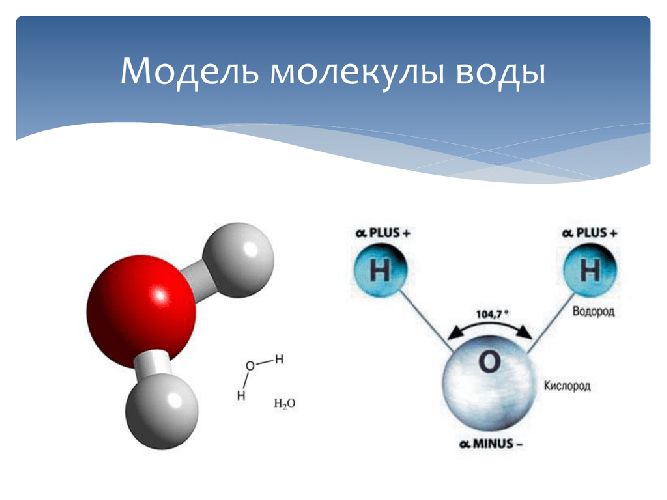 ..
..
 Когда Вода вступает в реакцию с Соляной кислотой (HCl), мы получаем Hydronium (H 3 O + ) и Хлор (Cl).
Когда Вода вступает в реакцию с Соляной кислотой (HCl), мы получаем Hydronium (H 3 O + ) и Хлор (Cl). 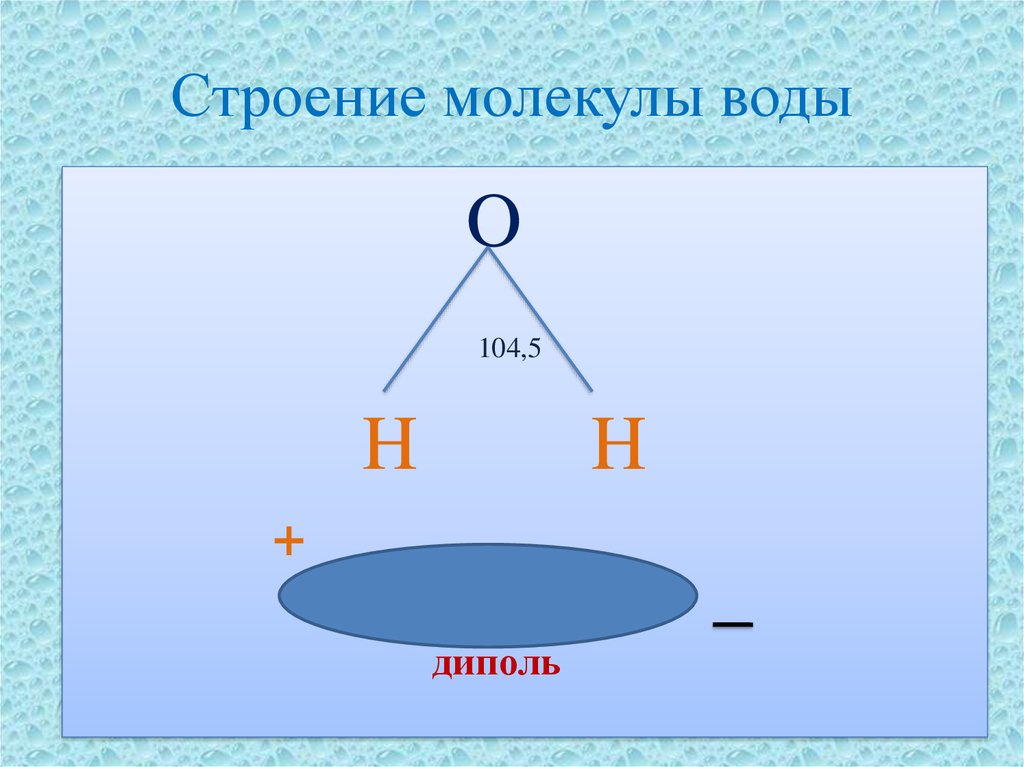
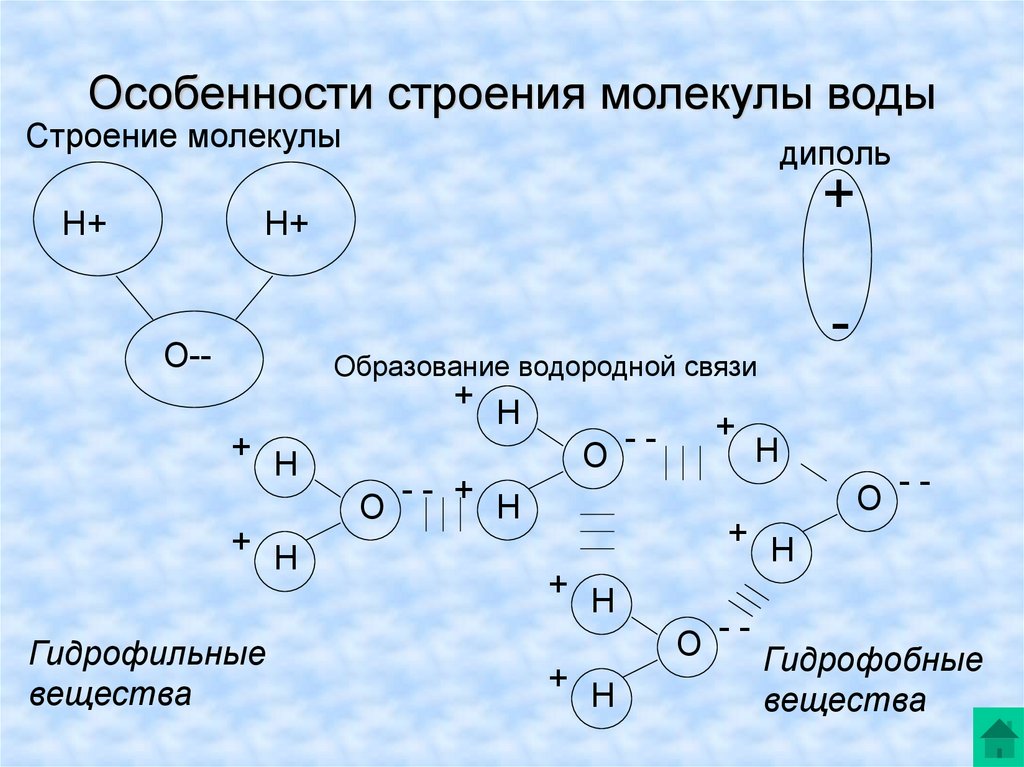

 Конечно, она не может растворить все, но она растворяет больше веществ, чем любая другая жидкость, так что этот термин вполне подходит. Растворяющие свойства воды влияют на всю жизнь на Земле, поэтому вода важна для всех нас.
Конечно, она не может растворить все, но она растворяет больше веществ, чем любая другая жидкость, так что этот термин вполне подходит. Растворяющие свойства воды влияют на всю жизнь на Земле, поэтому вода важна для всех нас.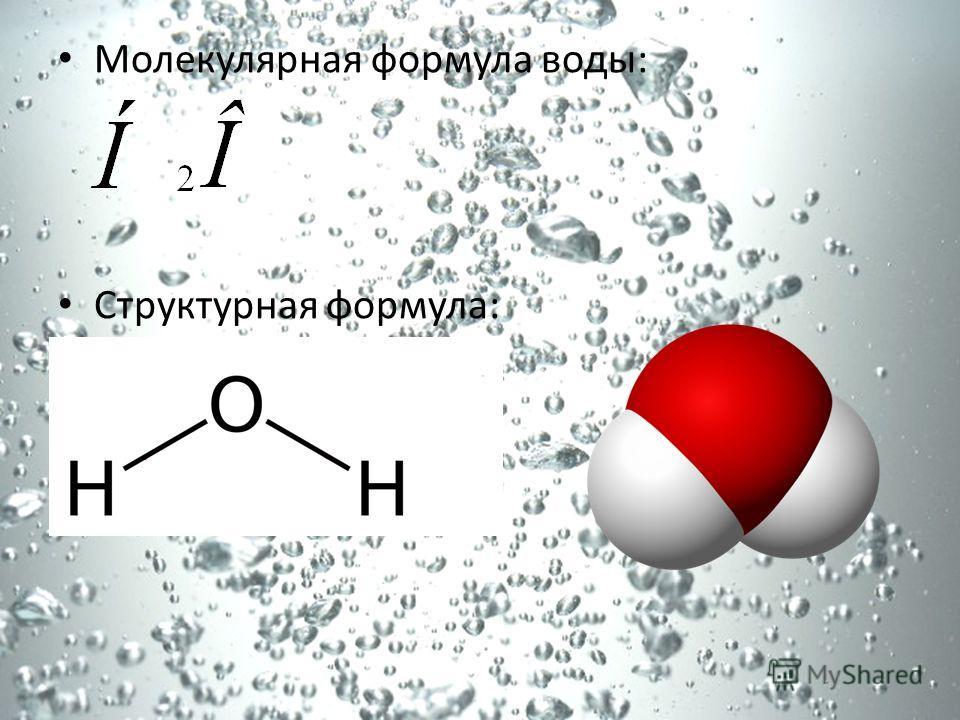 Молекулы воды имеют полярное расположение атомов кислорода и водорода — одна сторона (водород) имеет положительный электрический заряд, а другая сторона (кислород) — отрицательный. Это позволяет молекуле воды притягиваться ко многим другим типам молекул . Вода может настолько сильно притягиваться к другому соединению, например к соли (NaCl), что может нарушить силы притяжения, удерживающие вместе натрий и хлорид в солевом соединении, и, таким образом, растворить его.
Молекулы воды имеют полярное расположение атомов кислорода и водорода — одна сторона (водород) имеет положительный электрический заряд, а другая сторона (кислород) — отрицательный. Это позволяет молекуле воды притягиваться ко многим другим типам молекул . Вода может настолько сильно притягиваться к другому соединению, например к соли (NaCl), что может нарушить силы притяжения, удерживающие вместе натрий и хлорид в солевом соединении, и, таким образом, растворить его.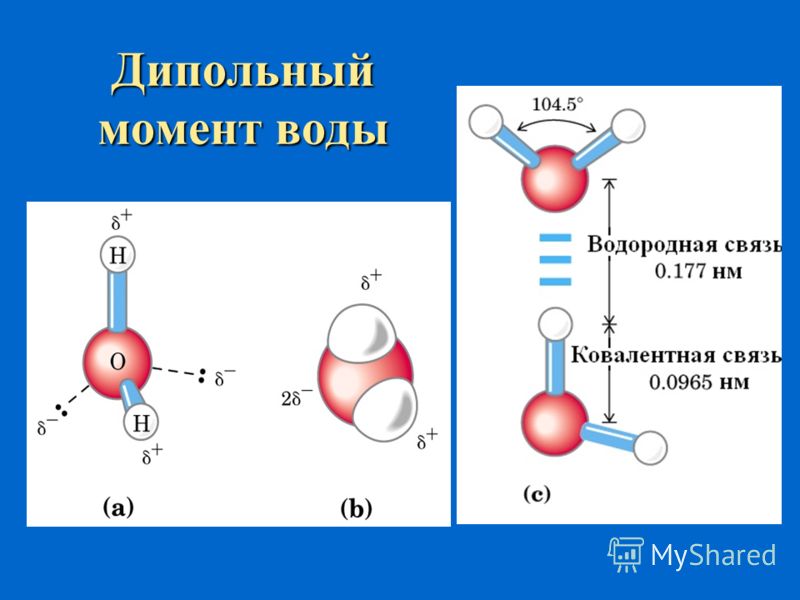 Посетите СМИ, чтобы узнать подробности.
Посетите СМИ, чтобы узнать подробности.