Модель молекулы водорода, химические связи в молекулах разного типа
Home / Учебник ОБЩАЯ ХИМИЯ / Глава 3. Молекула / Связь в молекуле водорода
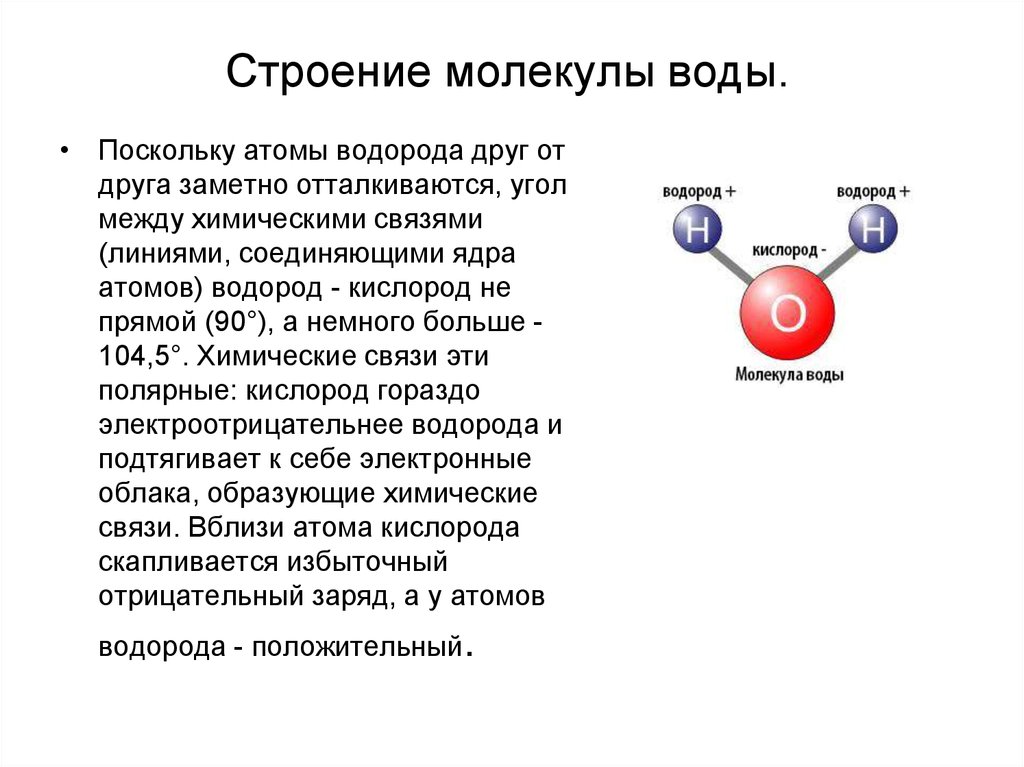
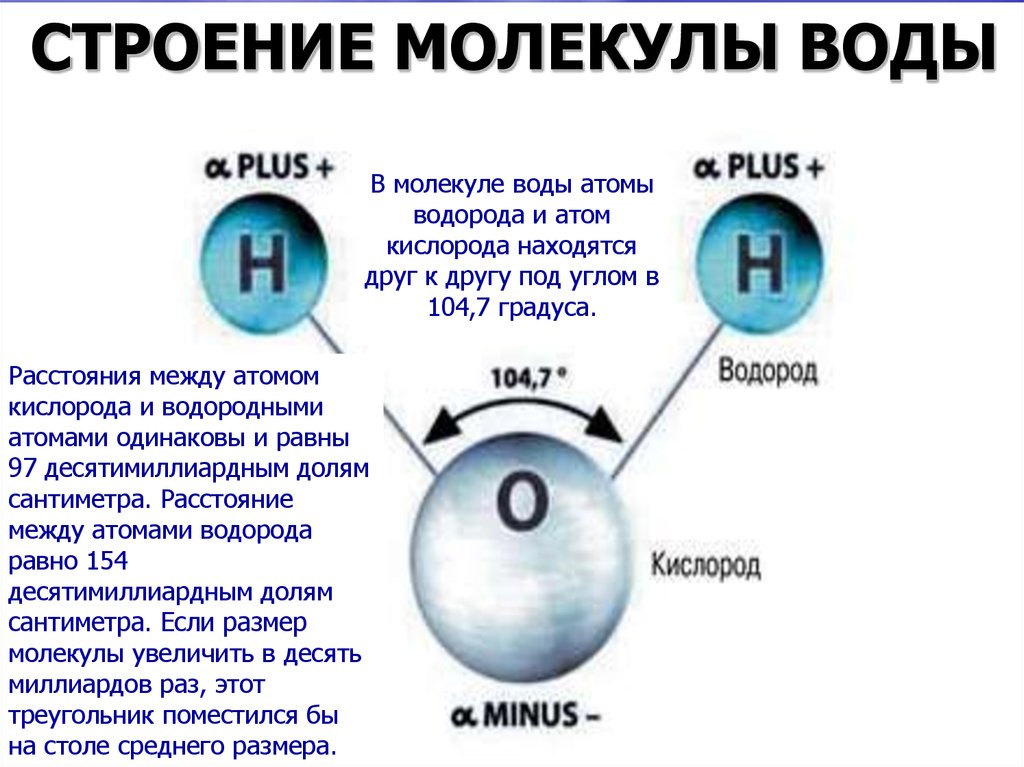
Молекула водорода — это простейшая молекула, которая образуется из двух атомов водорода. Атомы, составляющие молекулу водорода, абсолютно одинаковы, поэтому связывающая пара электронов должна находиться не только на внешних оболочках обоих связываемых атомов, но также на одинаковом расстоянии от ядер. Таким образом, для электронов остается только одно место — между ядрами, на равном расстоянии от них.
До того, как образовалась связь в молекуле водорода (т.е. у разделенных атомов), электроны вращались вокруг своих ядер, теперь электроны вращаются посередине между двумя ядрами водорода. По схеме химической связи, в случае с молекулой водорода, связывающая пара электронов вращается в плоскости, перпендикулярной оси, связывающей ядра атомов. Центр вращения электронов находится на одинаковом расстоянии от связываемых ядер. Только так электроны могут одновременно перейти на внешние электронные оболочки обоих связываемых атомов.
Центр вращения электронов находится на одинаковом расстоянии от связываемых ядер. Только так электроны могут одновременно перейти на внешние электронные оболочки обоих связываемых атомов.
Итак, молекулу водорода можно проиллюстрировать следующим образом:
Рисунок 3.2. Модель химической связи в молекуле водорода
Молекула водорода состоит из 2 ядер атома водорода, расположенных на расстоянии около 0.7Å друг от друга. Два электрона вращаются по круговой орбите в плоскости, перпендикулярной к оси, соединяющей ядра. Эта электронная пара сближает ядра за счет электростатических сил и сил притяжения ядер к двум электронам, вращающимся между ними. Центр круга, вокруг которого вращаются электроны в молекуле водорода, находится в середине оси, связывающей ядра водорода.
То есть, при образовании связи в молекуле водорода, электроны располагаются на равном расстоянии от связываемых ядер.
Связь, образуемая из разных атомов
Когда атомы одного вида связаны химически (такую же как связь в молекуле водорода образуют атомы Na-Na, F-F, Cl-Cl и т. д.), связывающие электроны, как и в молекуле водорода, находятся на одинаковом расстоянии от связываемых ими ядер. Когда химически связаны разные атомы, например, Na-Cl, то центр круга, в котором вращаются связывающие электроны, находится ближе к ядру атома хлора
д.), связывающие электроны, как и в молекуле водорода, находятся на одинаковом расстоянии от связываемых ими ядер. Когда химически связаны разные атомы, например, Na-Cl, то центр круга, в котором вращаются связывающие электроны, находится ближе к ядру атома хлора
Связывающие электроны располагаются примерно на одинаковом расстоянии от ядер, связываемых ими, как и несвязывающие электроны. То есть, когда связывающие электроны образуют химические связи, они переходят на внешние оболочки связываемых атомов. Электроны внутренней оболочки часто называют внутренними электронами (см. рис. 3.3).
Рисунок 3.3 Вращение электронов вокруг ядра атома
Точки на кругах — это электроны. Круги меньшего размера — это остов атома. Помимо ядра, остов атома включает в себя все внутренние электронные оболочки, т.е. все электроны внутренних слоев вокруг ядра (эта область окрашена в коричневый цвет). Таким образом, у атома хлора (Cl) этот остов состоит из ядра с 17 протонами и 10 электронами (2 электрона в слое, ближайшем к ядру, и 8 электронов в следующем ближайшем слое). Эти внутренние электроны, подобно ядру атома, не принимают участия в химических трансформациях, поэтому, для удобства, на рисунке они показаны вместе с ядром.
Помимо ядра, остов атома включает в себя все внутренние электронные оболочки, т.е. все электроны внутренних слоев вокруг ядра (эта область окрашена в коричневый цвет). Таким образом, у атома хлора (Cl) этот остов состоит из ядра с 17 протонами и 10 электронами (2 электрона в слое, ближайшем к ядру, и 8 электронов в следующем ближайшем слое). Эти внутренние электроны, подобно ядру атома, не принимают участия в химических трансформациях, поэтому, для удобства, на рисунке они показаны вместе с ядром.
Таким образом, остов хлора (Cl) несет на себе избыточный положительный заряд, равный 17-10 = 7 протонных единиц. Компенсируют этот положительный заряд семь электронов, расположенных на внешней оболочке и показанных на рисунке точками. Они называются валентными электронами, так как только эти электроны в атоме принимают участие в образовании химической связи и химических преобразованиях.
При формировании молекулы хлора Cl2, оба атома хлора (Cl) принимают участие в формировании связи и увеличивают количество электронов на своих внешних оболочках на 1; то есть, обе внешние оболочки содержат 8 электронов.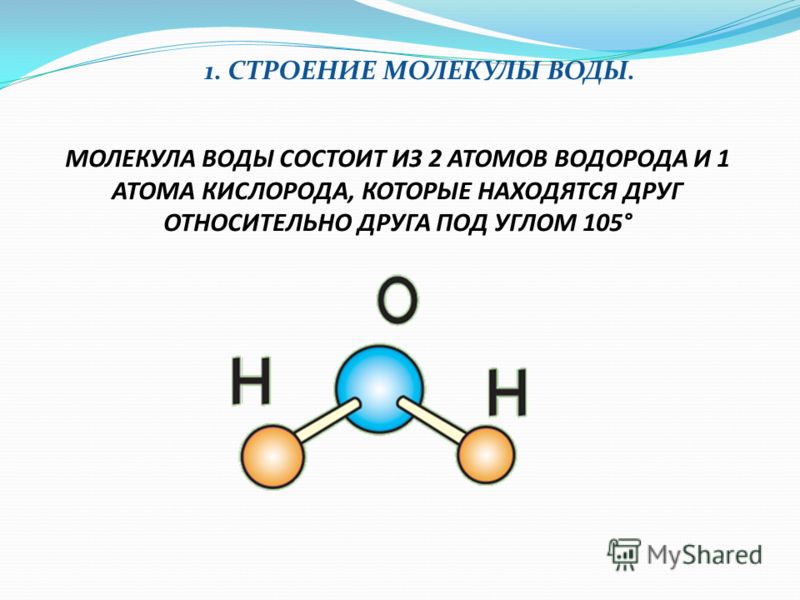
Связь, образовавшаяся между такими атомами, — ковалентная связь. Соответственно, связь в молекуле водорода тоже ковалентная. |
Строение молекулы.Химическая связь >>
Ковалентная связь >>
Модель молекулы водорода
Энергия молекулы водорода >>
Энергия иона водорода Н
Выводы >>
диаметр, формула, строение. Чему равна масса молекулы водорода?
В периодической таблице Менделеева под номером 1 расположен самый часто встречающийся элемент во Вселенной — водород. Его распространение, в процентном соотношении, приближается к 75%.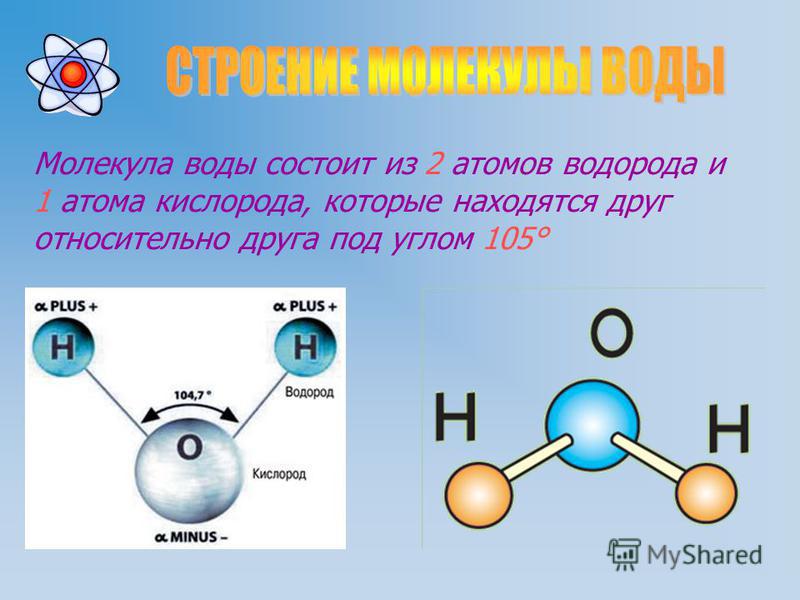 Самое низкое его содержание отмечено в слоях атмосферы – 0,0001%. В коре Земли содержится 1% газа по массе. Наибольшее его количество отмечается в воде: 12%. На нашей планете это третий по распространению химический элемент.
Самое низкое его содержание отмечено в слоях атмосферы – 0,0001%. В коре Земли содержится 1% газа по массе. Наибольшее его количество отмечается в воде: 12%. На нашей планете это третий по распространению химический элемент.
Описание элемента
Молекула водорода, формула которого Н-Н или Н2, наделена физическими и химическими свойствами.
Водород является газом, который не наделен ни цветом, ни запахом. Расположение водорода в таблице на 1 месте обусловлено тем, что в различных условиях этот элемент может проявлять себя как металл или как газ. На его внешней орбитали расположен 1 электрон, который водород может отдавать (металлические свойства) или же принимать еще один (качества газа).
Диаметр водородной молекулы равняется 27 нм.
Диаметр атома водорода равен 1А, радиус – 0, 41 А.
Свойства
К физическим относятся следующие:
- Температура кипения – 256оС.
- Температура плавления -259,2оС.
- Масса по воздуху (D) — 0,069.

- Водород плохо растворим в воде.
Химические свойства таковы:
- Неполярная связь между частицами молекулы обладает энергией в 436 кДж/моль.
- Температура тепловой диссоциации равна 2000оС.
- Реагирует с:
- галогенами;
- кислородом;
- серой;
- азотом;
- оксидом азота;
- активными металлами.
В условиях природы, водород встречается как в естественном виде, так и в форме изотопов: протий, дейтерий и тритий.
Строение молекулы
Молекула элемента имеет простое строение. Состав молекулы водорода представлен двумя атомами, которые, сближаясь, образуют ковалентную неполярную связь, а также одну электронную пару. Строение одного атома представляет: 1 положительно заряженное ядро, вокруг которого передвигается 1 отрицательно заряженный электрон. Этот электрон располагается на 1s орбитали.
Н — 1е = Н+ этот ион водорода является положительным.
Это выражение указывает на то, что водород обладает схожими параметрами с элементами 1 группы в периодической системе, которые являются щелочными металлами (литий, натрий, калий), отдающими свой единственный электрон на внешней орбитали.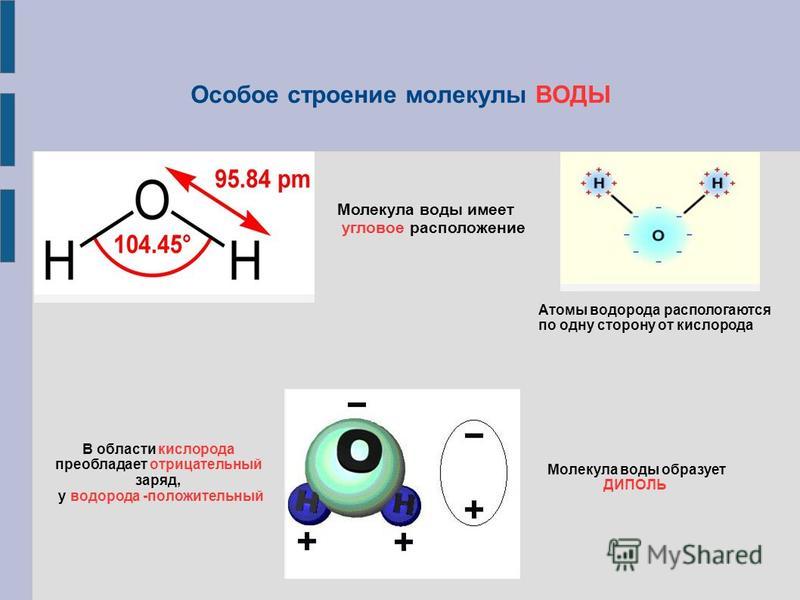
Н + 1е = Н– ион водорода отрицательный.
Это уравнение показывает, что водород является родственным с аналогичными элементами из 7-й группы, которые являются газом и способны принимать недостающие электроны на свой внешний электронный уровень. К таким газам относятся: фтор, хлор, бром и т. д.
Состав молекулы водорода графически представлена далее.
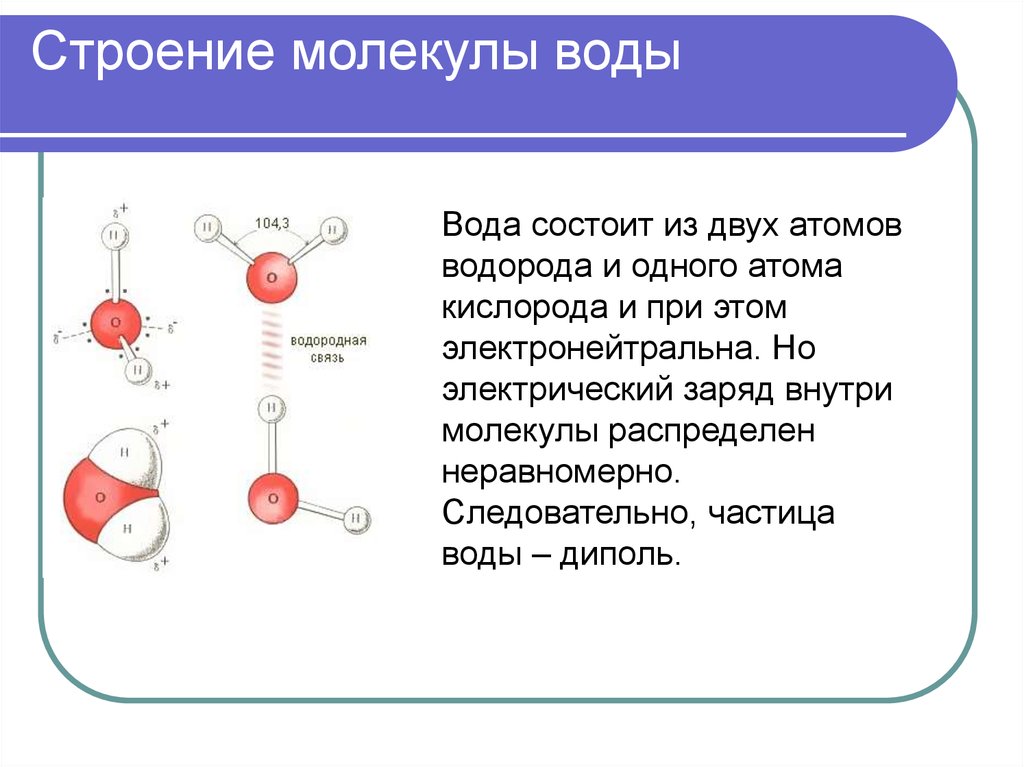
Расстояние между водородными атомами r=0,74 А, в то время, как сумма орбитальных радиусов составляет 1,06 А. Это влияет на глубину перекрывания электронных облаков и на прочную, устойчивую водородную связь.
Атом водорода является самым элементарным атомом в природе. Размер атомного протона равен 10,5 А, а диаметр одного атома равен 0,1 нм.
Молекулы изотопов имеют особое строение. Атомное ядро протия состоит из одного лишь протона. Обозначается изотоп: 1Н.
Ядерное строение выглядит как комплекс из протона и нейтрона (2Н).
3Н — тритий — в своем атомном строении наделен ядром с 1 протоном и двумя нейтронами.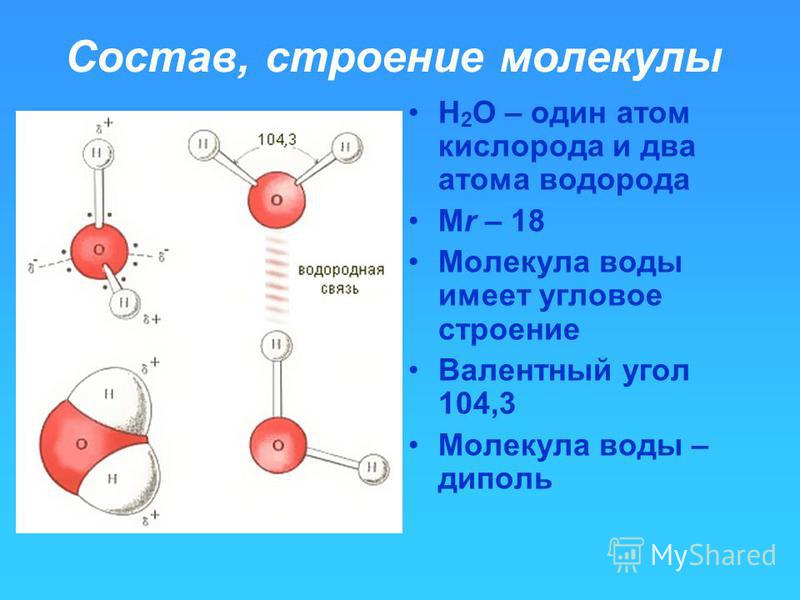
Масса
В науке существуют формулы, вычисляющие, чему равна масса молекулы водорода. По отношению к элементу, определяют молекулярную и атомную массы.
Молярная масса молекулы водорода вычисляется по общей формуле:
M = m / n, где m — это масса вещества, n — его количество.
Масса атома равна 1,008 а.е.м. Следовательно, относительная масса молекулы будет также равна 1,008. Поскольку молекула водорода состоит из двух атомов, то относительный атомный вес равен 2,016 а. е. м. Масса молекулы водорода выражается в граммах на моль (г/моль).
Значение в природе
Наиболее значимым в природе веществом, которое образует водород в комплексе с кислородом, является вода. Вода – источник жизни, поэтому водород – это жизненно необходимый элемент.
Из 100% всех химических элементов, которые составляют организменную среду, 1/10 часть, или 10%, приходится на водород. Помимо воды, он способен поддерживать четвертичную белковую структуру, что является возможным, благодаря водородной связи.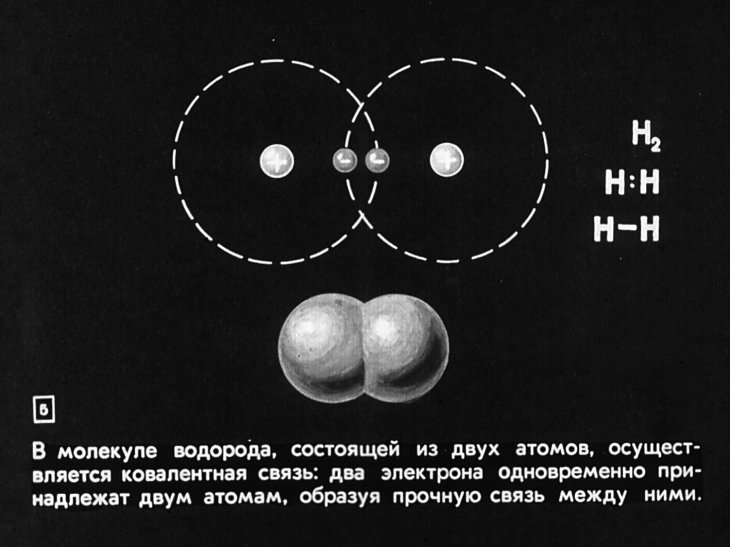
Принцип комплементарности нуклеиновых кислот также происходит с действием водородной молекулы. В растительной клетке Н принимает участие в процессе фотосинтеза, биосинтеза, в переносе энергии по мембранным каналам.
Применение
В химической промышленности водород достаточно широко применим. Его добавляют при изготовлении пластмассовых изделий, в мыловарении, а также при аммиачном и ментоловом производстве.
Пищевая промышленность: при выработке продуктов питания, водород добавляют в качестве пищевой добавки Е949. Такой компонент можно увидеть на упаковке маргарина, растительных масел. Добавка Е949 разрешена пищевой промышленностью РФ.
Водород некогда был задействован и в промышленности воздухоплавания, поскольку вещество легче воздуха. Так, в 30-е годы прошлого века этим вида газа наполняли воздушные шары и дирижабли. Несмотря на его дешевизну и удобство использования, водород вскоре прекратили использовать в качестве наполнителя, поскольку участились случаи взрывов летательных аппаратов.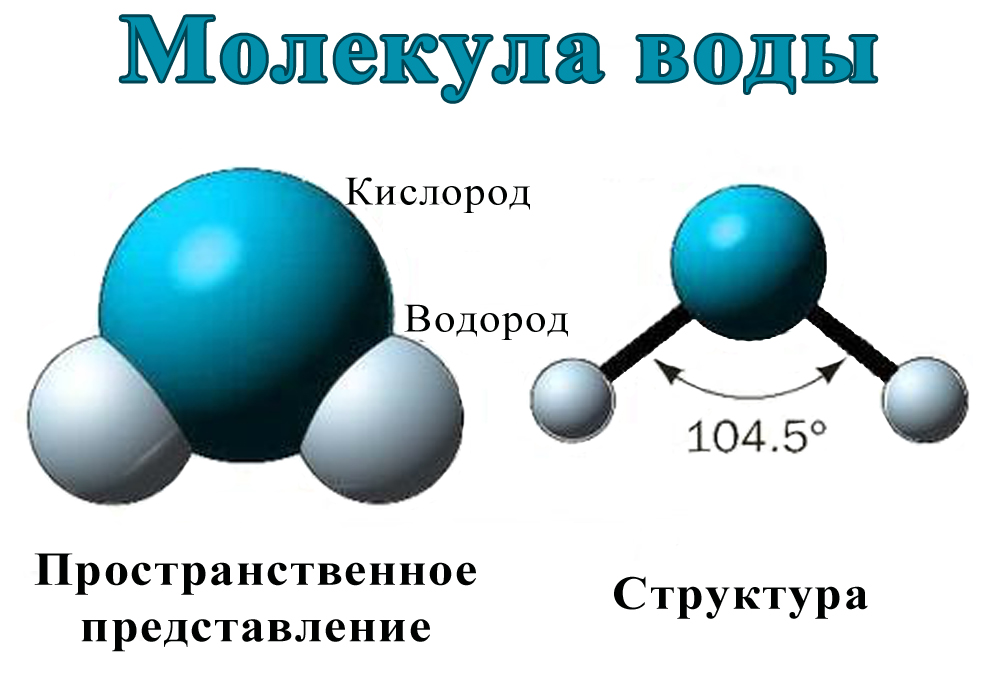
В наши дни газ применяют, как топливо, используемое в космической промышленности. Однако рассматриваются методы применения его для работы двигателей легковых и грузовых автомобилей, поскольку элемент при сгорании не выделяет в атмосферу вредных примесей, а, значит, является экологически чистым.
Неотъемлемым компонентом изотопы водорода выступают в составе многих медикаментозных средств. Дейтерий применяют в фармакологических исследованиях, для определения поведения и воздействия лекарственного препарата в организме. Тритий используется в радиодиагностике, как элемент, определяющий биохимические реакции метаболизма ферментов. Водород входит в состав перекиси, которая является дезинфицирующим средством.
9.5: Электронно-точечные структуры Льюиса — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53745
Как на самом деле выглядит холестерин?
Структуру молекулы холестерина можно записать несколькими способами. Самый простой способ – написать \(\ce{C_{27}H_{46}O}\). Эта «структура» не очень полезна, потому что она не говорит нам, как углерод, водород и кислород связаны друг с другом. Структура на рисунке выше гораздо полезнее — мы видим, как разные атомы соединяются вместе, образуя молекулу.
Электронно-точечные структуры Льюиса
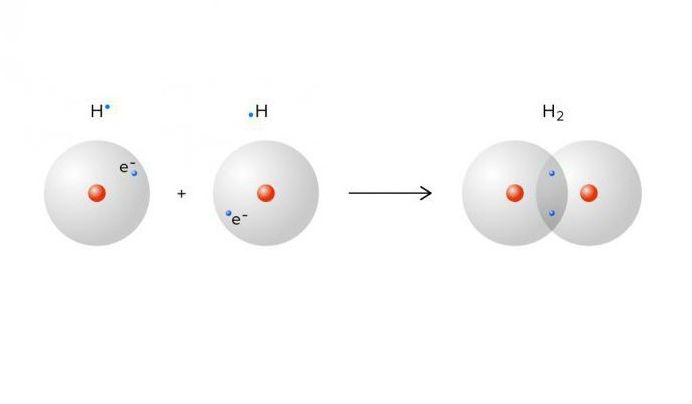
В предыдущей главе вы узнали, что валентные электроны атома можно просто изобразить с помощью электронной точечной диаграммы. Атом водорода показан как \(\ce{H} \cdot\) из-за его одного валентного электрона. Структуры молекул, которые удерживаются вместе ковалентными связями, могут быть изображены на диаграмме структурами электронных точек Льюиса . Молекула водорода показана на рисунке ниже.
Рисунок \(\PageIndex{2}\): Слева показан один атом водорода с одним электроном.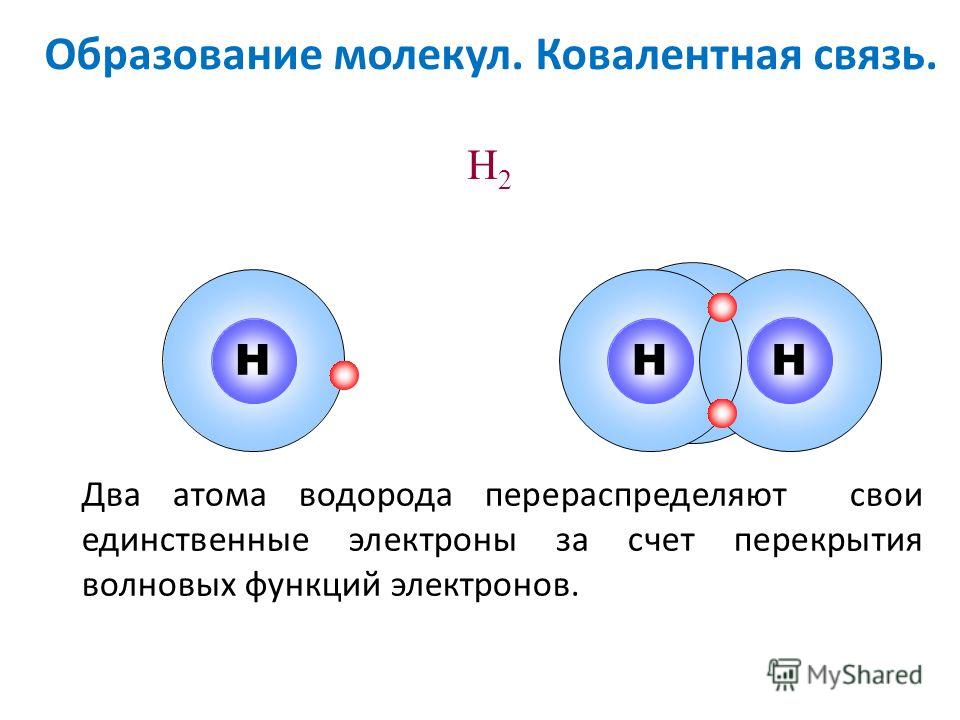 Справа молекула \(\ce{H_2}\), показывающая перекрытие электронного облака. (Источник: Джоди Со; Источник: CK-12 Foundation; Лицензия: CC BY-NC 3.0 (откроется в новом окне))
Справа молекула \(\ce{H_2}\), показывающая перекрытие электронного облака. (Источник: Джоди Со; Источник: CK-12 Foundation; Лицензия: CC BY-NC 3.0 (откроется в новом окне))Общая пара электронов показана двумя точками между двумя символами \(\ce{H}\) \(\left( \ce{H:H} \right)\). Это называется одинарной ковалентной связью , когда два атома соединяются за счет общей пары электронов. Одинарная ковалентная связь также может быть обозначена тире между двумя символами \(\left(\ce{HH} \right)\). Структурная формула — это формула, которая показывает расположение атомов в молекуле и представляет ковалентные связи между атомами штрихами.
Правило октетов и ковалентные связи
Когда образуются ионы, они подчиняются правилу октетов , либо теряя, либо приобретая электроны, чтобы достичь электронной конфигурации ближайшего благородного газа. Аналогичным образом атомы неметаллов делят электроны при образовании ковалентной связи таким образом, что каждый из атомов, участвующих в связи, может достичь электронной конфигурации благородного газа.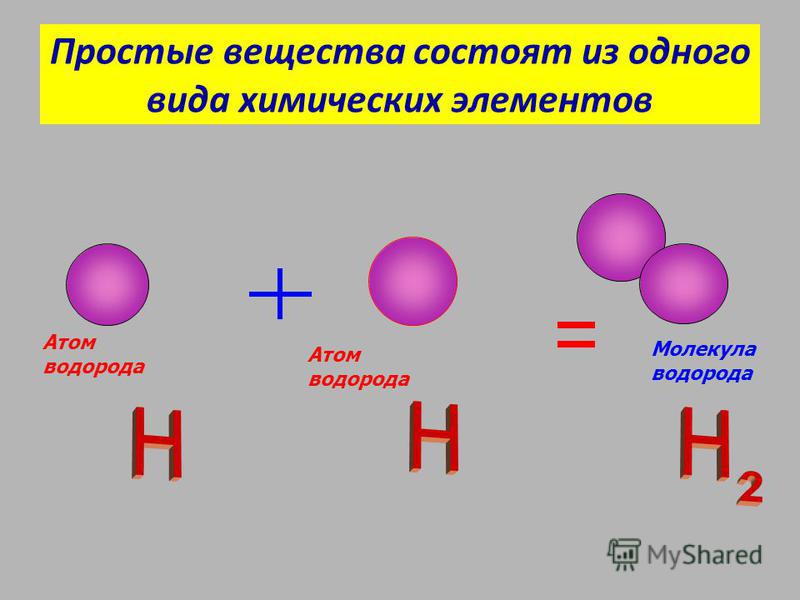 Общие электроны «подсчитываются» для каждого из атомов, участвующих в совместном использовании. Для водорода \(\left( \ce{H_2} \right)\) общая пара электронов означает, что каждый из атомов может достичь электронной конфигурации гелия, благородного газа с двумя электронами. Для атомов, отличных от водорода, совместное использование электронов обычно дает каждому из атомов восемь валентных электронов.
Общие электроны «подсчитываются» для каждого из атомов, участвующих в совместном использовании. Для водорода \(\left( \ce{H_2} \right)\) общая пара электронов означает, что каждый из атомов может достичь электронной конфигурации гелия, благородного газа с двумя электронами. Для атомов, отличных от водорода, совместное использование электронов обычно дает каждому из атомов восемь валентных электронов.
Резюме
- Электронно-точечные структуры Льюиса показывают наличие связи в ковалентных молекулах.
- Ковалентные связи между атомами могут быть обозначены точками \(\left( \ce{:} \right)\) или тире \(\left( \ce{-} \right)\).
Обзор
- Что такое одинарная ковалентная связь?
- Как ковалентно связанные атомы могут подчиняться правилу октета?
- Молекула водорода подчиняется правилу октетов?
Эта страница под названием 9.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
«Применение квантовой механики к строению молекулы водорода и молекулы-иона водорода и к связанным с ними проблемам». Июнь 1928 г. — Опубликованы статьи и официальные документы
«Применение квантовой механики к строению молекулы водорода». и ион молекулы водорода и связанные с ними проблемы». 19 июня28. — Опубликованные статьи и официальные документы — Лайнус Полинг и природа химической связи: документальная историяВсе документы и носители Страница 1 «Применение квантовой механики к строению молекулы водорода».
и ион молекулы водорода и связанные с ними проблемы ». Chem. Rev. 5 (июнь 1928 г.): 173-213
Создатель: Линус Полинг Дата: Июнь 1928 г. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||