2. Строение молекул воды
В молекулах воды ядра атомов образуют равнобедренный треугольник с протонами в основании и ядром атома кислорода в вершине. В свободных молекулах воды (в парах) межъядерные расстояния О–Н равны 0,09568 нм. Угол между направлениями связей составляет 104о27’, а расстояние между протонами 0,1515 нм (рис. 1).
Рис. 1. Модель молекулы воды (по Н.Бьерруму)
Под влиянием электростатического поля соседних молекул или ионов указанные параметры могут несколько изменяться. Это происходит при изменении агрегатного состояния воды, растворении в ней других веществ или под влиянием поверхностного слоя кристаллов твердого тела, с которым соприкасается вода.
При
образовании молекулы воды происходит
sp3-гибридизация
орбиталей атома кислорода и возникают
четыре гибридные электронные орбитали.
При этом два гибридных облака, участвующие
в образовании ковалентной связи,
вытягиваются в направлении атома
водорода.
Рис. 2. Схема перекрывания электронных орбиталей атомов кислорода и водорода в молекуле воды
бразом, в молекуле воды образуются четыре полюса зарядов, расположенных в вершинах неправильного тетраэдра (рис. 2).
Вследствие
такого несимметричного строения вода
обладает высоким дипольным моментом
(1,84 Д) или 5,52∙10–3 Кл∙м. Это один из самых больших
электрических дипольных моментов
молекул с небольшим числом атомов. Эти
особенности строения молекулы Н2О имеют очень важные следствия:
Эти
особенности строения молекулы Н2О имеют очень важные следствия:
большой электрический дипольный момент молекулы воды является причиной возникновения диполь-дипольных и ион-дипольных взаимодействий в водных растворах;
молекула воды образует водородные связи с электроотрицательными атомами других молекул, в том числе других молекул воды;
неподеленные электронные пары позволяют молекуле Н2О образовывать комплексные соединения по донорно-акцепторному механизму с катионами металлов.
Два
первых следствия являются причиной
того, что вода имеет высокие температуры
кипения и плавления. Отсюда же широкий
температурный интервал существования
жидкого состояния воды (0…100оС)
и большие числовые значения теплоты
испарения (40,7 кДж/моль) и теплоты плавления
(6,0 кДж/моль). В результате, вода является
растворителем, способным растворять
огромное число неорганических и
биоактивных веществ.
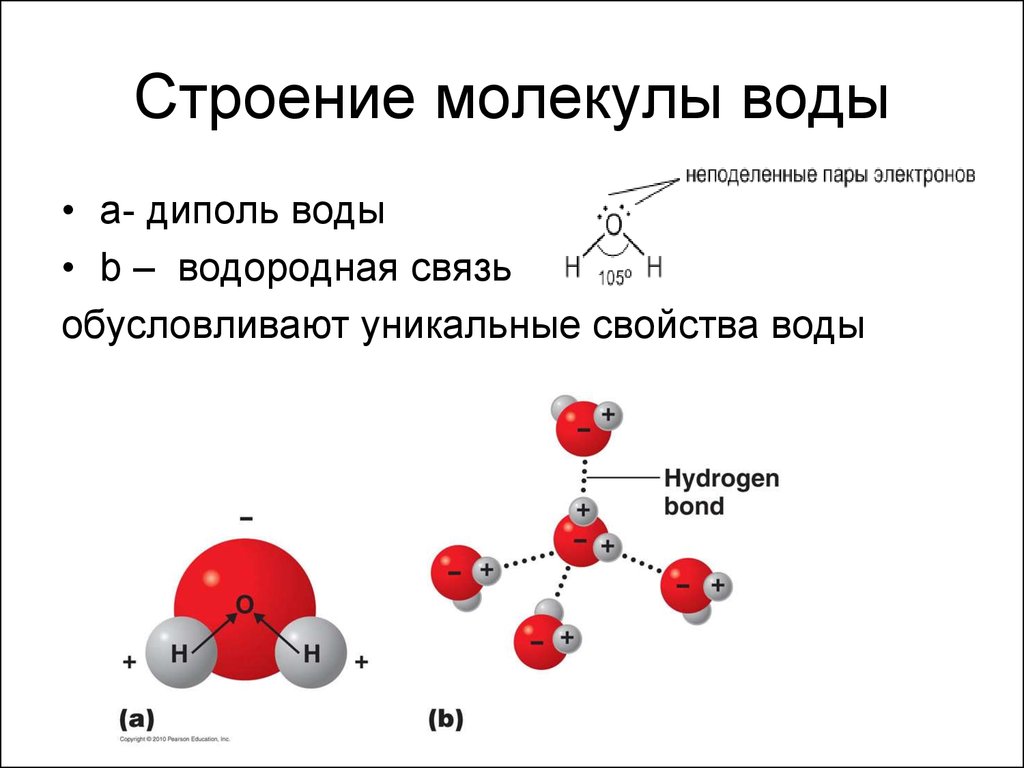
Высокая полярность является также причиной диссоциации в воде электролитов. Значительное влияние на строение и свойства воды и её растворов оказывает способность молекул воды образовывать водородные связи. Каждая молекула воды способна образовать четыре водородные связи с соседними молекулами по схеме (рис.3):
а)
б)
Рис. 3. Структура воды
а) образование водородных связей между молекулами воды;
б) гексагональная структура льда
Количество
связей зависит от температуры. Но
взаимодействие между молекулами воды
оказывается достаточно сильным, что
даже в парах воды присутствуют димеры
и тримеры состава (Н2О)2 и (Н2О)3.
В растворах же могут возникать длинные цепи ассоциатов (Н2О)n. Длина водородной связи
Длина водородной связи
Строение молекул воды и их ассоциаты
разное
«Мир чарующий и фантастический», — такими словами лауреат Нобелевской премии Альберт Сент-Дьердьи характеризует ощущения исследователя, изучающего структуру воды. Результаты тем сильнее впечатляют, что очень уж обычен сам объект изучения.
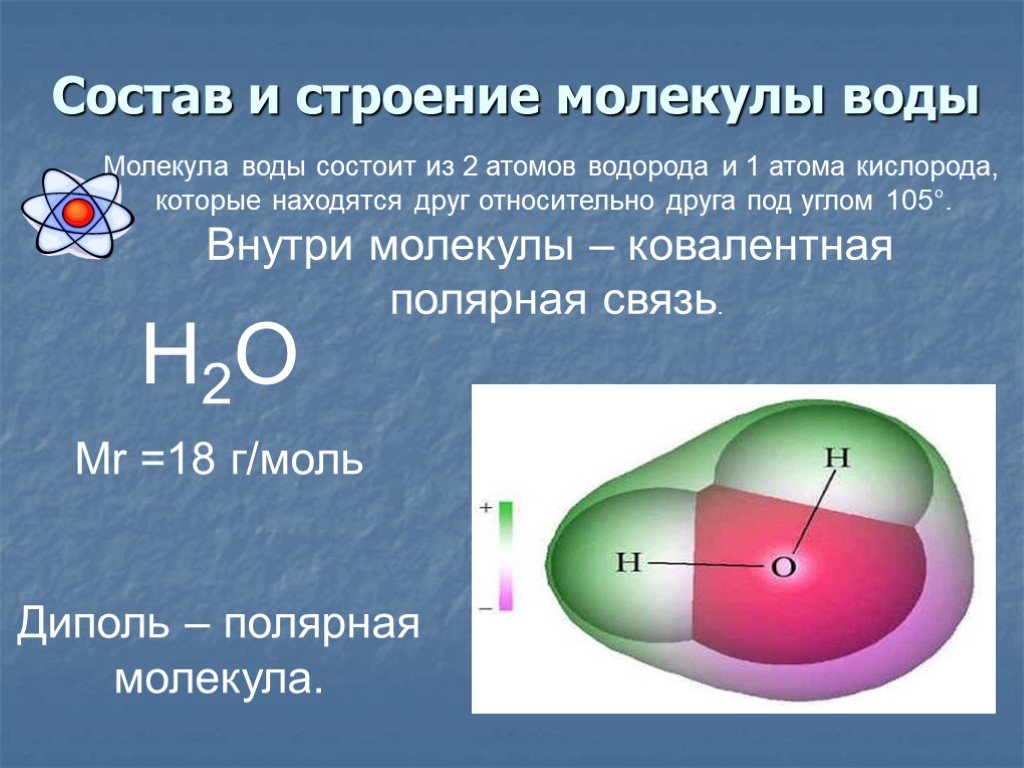
Итак, молекула воды (1h316O) состоит из двух атомов водорода (1H) и одного атома кислорода (16O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его — сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, — по одному ядру водорода.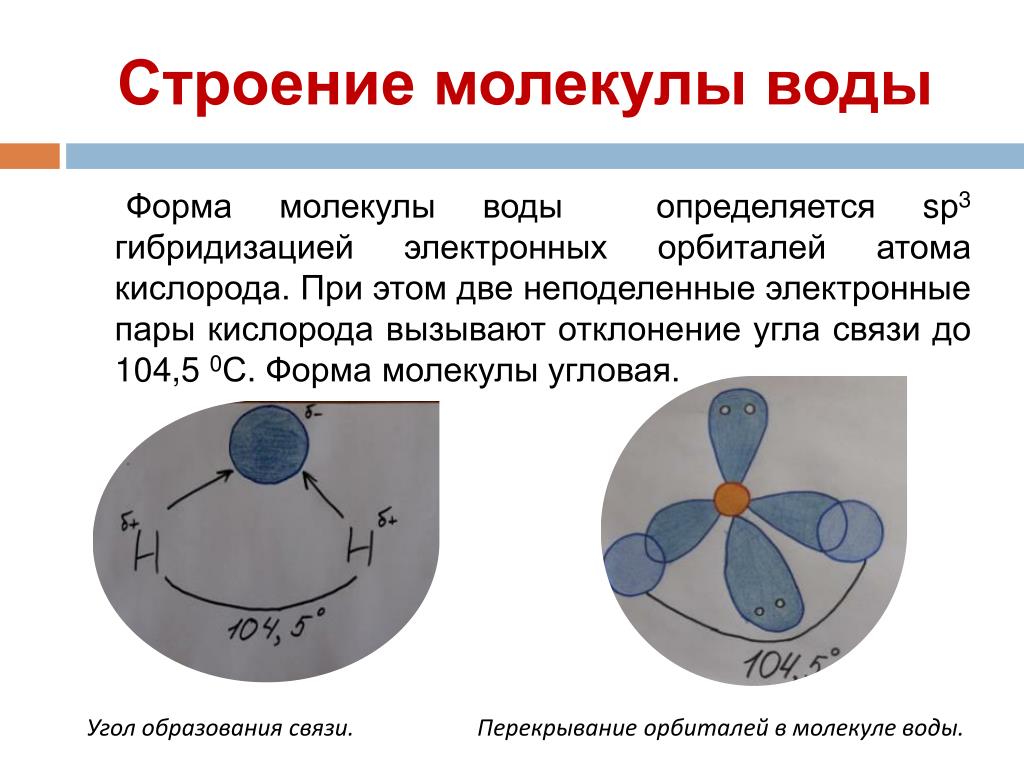 Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно — в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром — ядром O2- (рис. 1.5а). Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра — ядра O2-. Каждый из оставшихся
А — угол между связями O—H;
Б — расположение полюсов заряда;
104° 27′ |
Рис. |
В — внешний вид электронного облака молекулы воды.
Двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра — протоны — оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.5б).
Общий вид электронного облака молекулы воды показан на рис. 1.5в.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким ди — польным моментом — 1,87дебая1.
Во многом благодаря этому, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
В пресных природных водах — речных, озерных — содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном — 18, а в Красном море — около 40 г/л.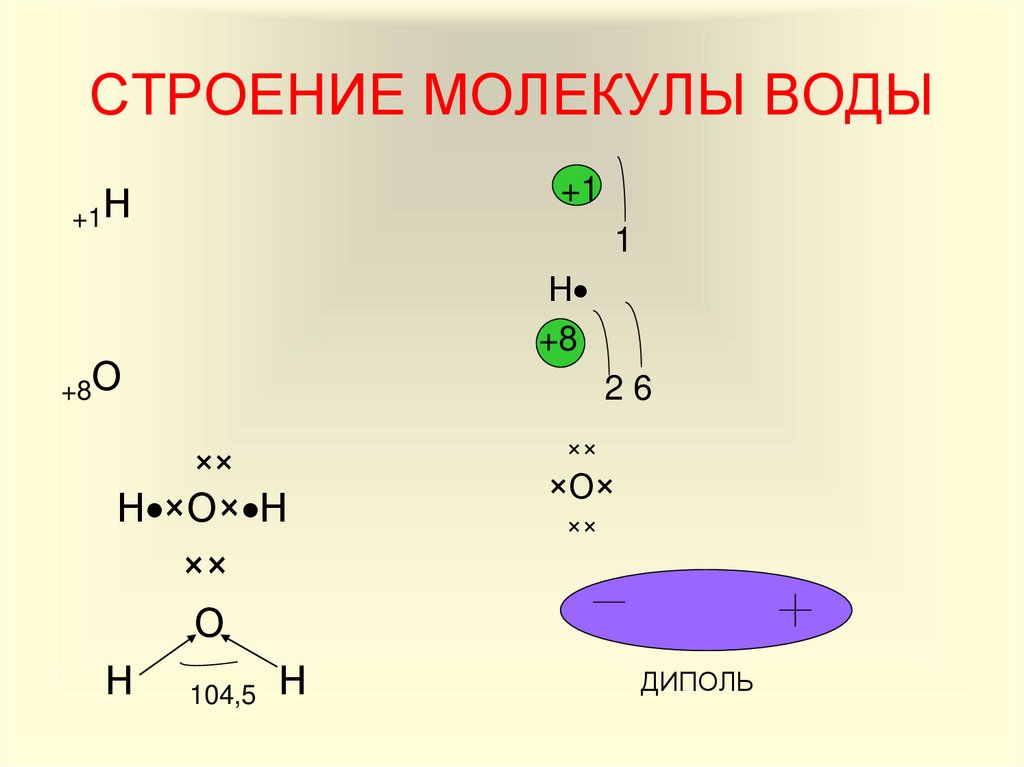 В среднем в 1 л океанской воды растворено 34…35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
В среднем в 1 л океанской воды растворено 34…35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89% морские соли состоят из хлоридов (преимущественно — натрия и кальция), на 10% — из сульфатов (натрия, калия и магния), на 1% — из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) — до 80%. Сульфатов (натрия, кальция и магния) — около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода — до 100 мг/л. Кислород J Водород
Кислород J Водород
— Химическая связь Водородная связь
Рис. 1.6. Схема объединения молекул воды
— ассоциаты. Оказывается, полностью соответствует формуле Н20 лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (h30)x.
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их.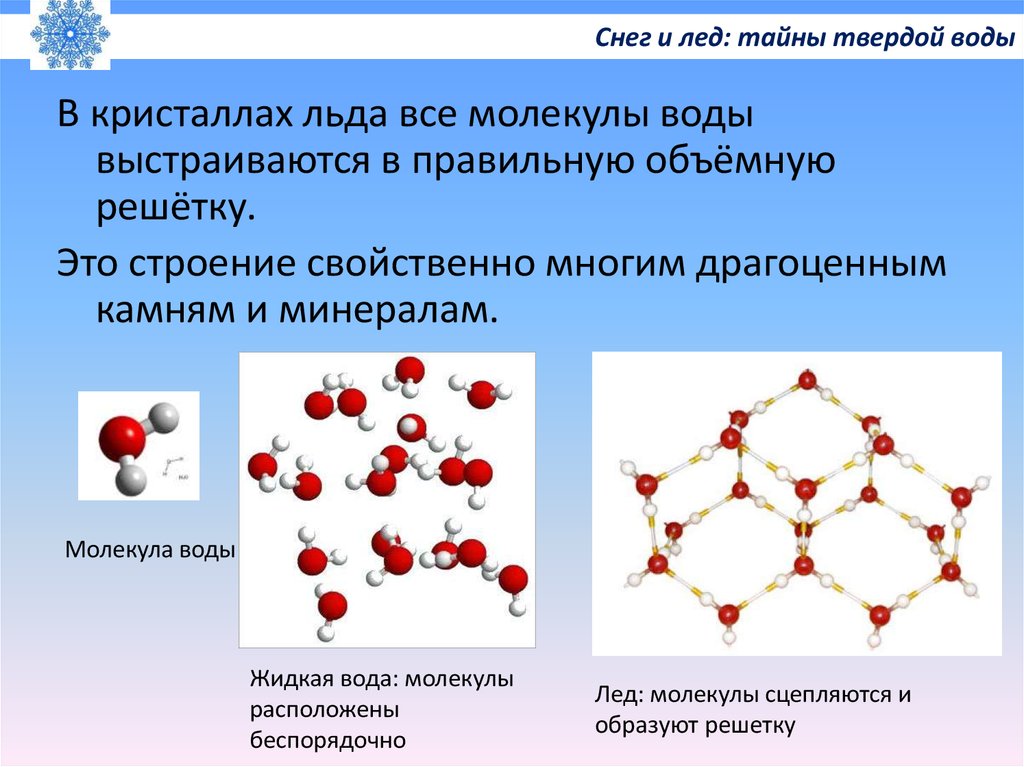 Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
X h3O ~ (h30)x
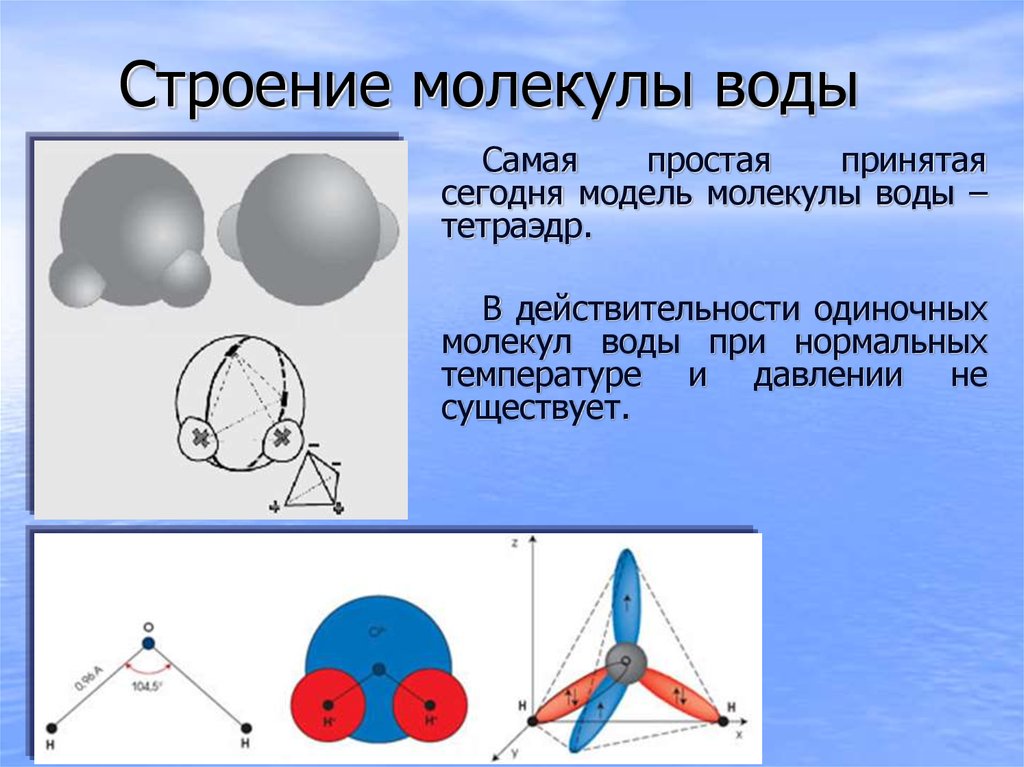
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдричес — кую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоци — атов (рис. 1.6).
Возможны и другие модели водной структуры. Тетраэдрически связанные молекулы воды образуют своеобразные рои довольно стабильного состава. Пространства между роями заполняют мономерные молекулы воды.
Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподоб — ной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры — нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
Современные информационные технологии представляют собой набор инструментов и процессов, которые используются для предоставления информации и услуг. Они используются во всех отраслях промышленности, включая медицину, финансы, образование, производство, торговлю и транспорт. …
Вопросы покупателей услуг практически всегда сводятся к двум – когда и сколько? В этой статье рассмотрим информацию и том что сделать, чтобы слова «когда» звучала меньше. Расчет бюджета Да, сколько …
Структура воды и водородные связи Учебное пособие
Инструменты для творчества скоро будут вдохновлять!
Присоединяйтесь к списку рассылки, чтобы узнать, когда мы запустимся.
Биология
AP Биология
Раздел 1: Химия жизни
Структура воды и водородные связи Учебное пособие
Гаятри Мани
Вода необходима для выживания жизни.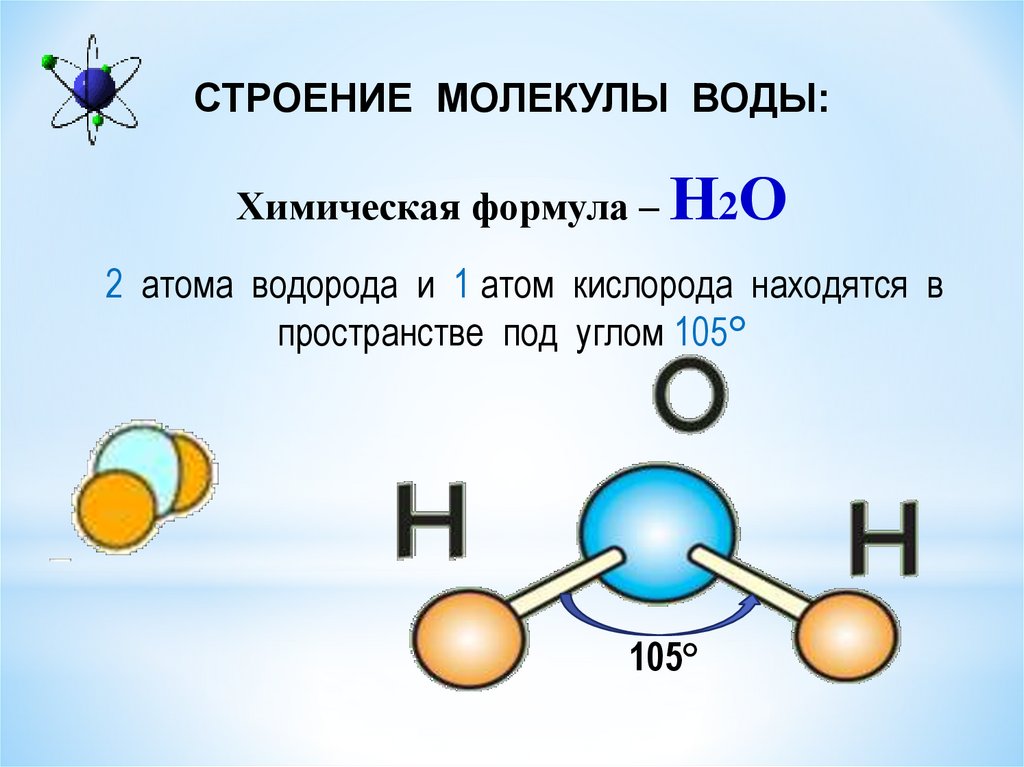 Отличительные качества воды обусловлены полярностью ее молекул, особенно ее способностью образовывать водородные связи друг с другом и с другими молекулами.
Отличительные качества воды обусловлены полярностью ее молекул, особенно ее способностью образовывать водородные связи друг с другом и с другими молекулами.
Содержание
Введение:
Вода необходима для всех форм жизни. Он обладает несколькими замечательными химическими свойствами, которые делают его идеальным для жизнеобеспечения. В этой статье давайте углубимся в понимание водородных связей воды.
Растворяющие свойства воды:
Источник
Воду часто называют «универсальным растворителем» из-за ее способности растворять многие растворенные вещества. Однако некоторые масла не растворяются в воде, и это связано с тем, что вода хорошо растворяет ионы и полярные молекулы, но плохо растворяет неполярные молекулы. Молекулы воды полярны, имеют частичный положительный заряд на водороде, частичный отрицательный заряд на кислороде и скрученную общую структуру.
Когезия и адгезия воды:
- Молекулы воды могут связываться друг с другом, что называется когезией, а другие молекулы называются адгезией.

- Поверхностное натяжение вызывается когезионными силами, отвечающими за склонность поверхности жидкости сопротивляться разрыву при воздействии деформации или напряжения.
- Капли сферической формы образуются водой из-за поверхностного натяжения.
- Адгезия — это притяжение одного типа молекул к другому, и оно может быть относительно сильным для воды, особенно в сочетании с другими молекулами с положительным или отрицательным зарядом.
Удельная теплоемкость, теплота парообразования и плотность воды:
Вода обладает большой удельной теплоемкостью. Это означает, что вода может выдержать большое количество энергии, прежде чем ее температура изменится. Вода также имеет высокую теплоту парообразования, то есть теплоту, необходимую для перехода соединения из жидкого состояния в газообразное. Эффективность испарительного охлаждения (почему пот заставляет человека чувствовать себя прохладнее) и низкая плотность льда (плавающий лед) объясняются водородными связями.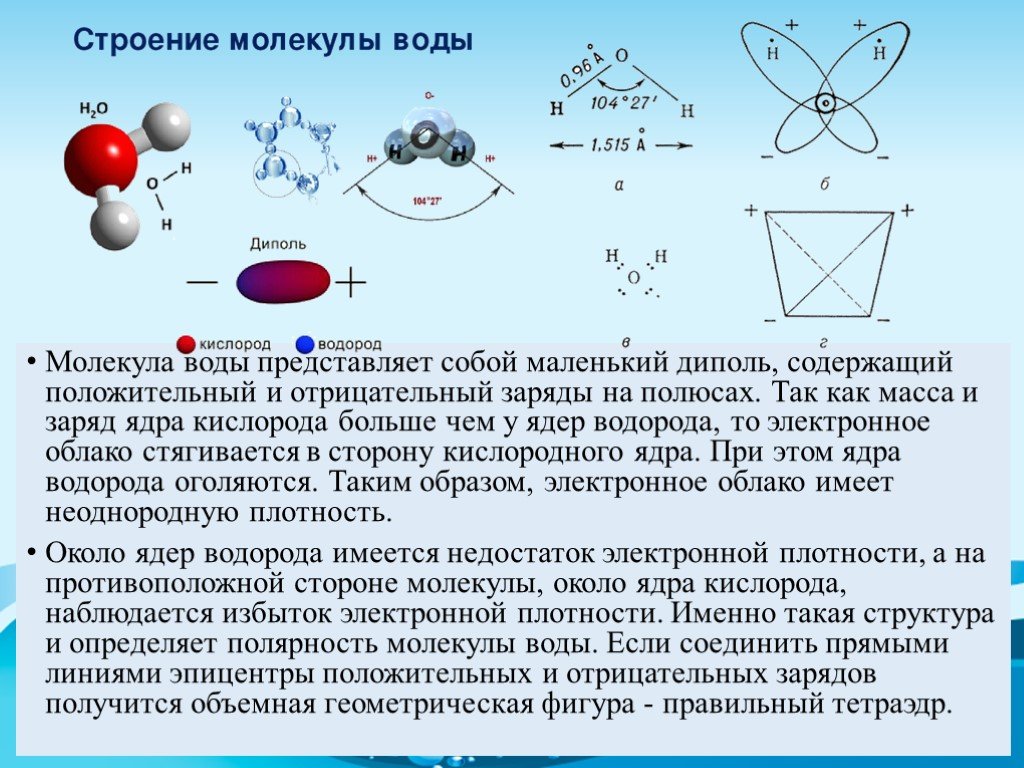
Полярность молекулы воды
Молекулярная структура воды объясняет, что молекула воды состоит из двух атомов водорода, соединенных с атомом кислорода, и ее общая структура изогнута. Помимо образования связей с атомами водорода, атом кислорода несет два неподеленных электрона.
Как общие, так и неподеленные пары электронов отталкивают друг друга. Поскольку кислород более электроотрицательный (электроно-жадный), чем водород, он захватывает электроны и удерживает их подальше от атомов водорода. Это приводит к частичному отрицательному заряду на кислородном конце молекулы воды и частичному положительному заряду на водородном конце. Таким образом, вода классифицируется как полярная молекула.
Водородная связь
Водородная связь представляет собой межмолекулярную силу притяжения, при которой ковалентно связанный атом водорода притягивается к неподеленной паре электронов на атоме в соседней молекуле. Водородные связи довольно прочны по сравнению с другими дипольными взаимодействиями, и типичная водородная связь имеет примерно 5% прочности ковалентной связи.
Водородные связи в молекулах воды приводят к уникальным, но очень важным свойствам. Большинство молекулярных соединений с массой, близкой к воде, являются газами при комнатной температуре. Молекулы воды могут оставаться конденсированными в жидкости из-за сильных водородных связей. На приведенной ниже диаграмме показано, как изогнутая форма и два атома водорода на молекулу позволяют каждой молекуле воды связываться с двумя другими молекулами.
Источник
- Водородные связи воды могут разрываться и восстанавливаться, когда молекулы перемещаются из одного места в другое в жидком состоянии. Молекулы воды начинают замедляться по мере ее охлаждения.
- Когда вода превращается в лед, водородные связи становятся постоянными и создают высокоспециализированную сеть.
- Искаженная форма молекул вызывает пустоты в сети водородных связей льда.
- Лед обладает странным достоинством: в твердом состоянии он менее плотный, чем в жидком. В жидкой воде лед плавает.

Водородная связь в воде
Водородная связь представляет собой динамическое притяжение между окружающими молекулами воды, при котором один атом водорода располагается между двумя атомами кислорода в воде. В жидкой воде водородная связь возникает, когда атомы водорода одной молекулы воды притягиваются к атому кислорода соседней молекулы воды.
Источник
- Благодаря компоненту полярности молекулы воды притягиваются друг к другу.
- Положительный конец одного, атома водорода, соединяется с отрицательным концом атома кислорода. Это водородные связи, слабые связи, которые развиваются между атомом водорода с частичным положительным зарядом и более электроотрицательным атомом, например кислородом.
- Атомы водорода в водородных связях должны быть соединены с электроотрицательными атомами, такими как O, N и F.
Источник
- Молекулы воды притягиваются к другим полярным молекулам, а также к ионам. Гидрофильный относится к заряженному или полярному материалу, который взаимодействует с водой и растворяется в ней: гидро означает «вода», а фильный означает «любящий».

- Масла и жиры, например, являются неполярными соединениями, плохо взаимодействующими с водой. Они гидрофобны (фобия означает «страшный»), потому что они отделяются от него, а не растворяются в нем.
- Шкала pH работает от 0 до 14 и является мерой того, насколько кислой или щелочной является вода — кислая (pH < 7), нейтральная (pH = 7), щелочная/щелочная (pH > 7).
- Кислота – это любое вещество, реагирующее с выделением ионов водорода в водном растворе. Напротив, основание принимает ионы водорода. Чистая вода имеет рН 7 и считается «нейтральной», поскольку не имеет ни кислотных, ни основных свойств.
Заключение:
- Полярность молекулы воды важна при растворении ионных веществ при получении водных растворов.
- Водородная связь — это сила, при которой атом водорода, ковалентно связанный с мельчайшим чрезвычайно электроотрицательным атомом, притягивается к неподеленной паре электронов на атоме в соседней молекуле.
Часто задаваемые вопросы:
1. Как водородные связи влияют на структуру воды?
Как водородные связи влияют на структуру воды?
Водородные связи влияют на твердую структуру воды; по мере замерзания воды связи становятся более жесткими, что придает льду более открытую и менее плотную общую структуру. Существование водородных связей также делает молекулы воды более «липкими», или, говоря научным языком, когезивными и липкими.
2. Что произойдет, если в воде не будет водородных связей?
Без водородных связей молекулы воды двигались бы быстрее и с меньшим подводом тепла, в результате чего температура поднималась бы выше на каждую калорию подведенного тепла. Это также значительно снизит тепловую энергию, необходимую для фазовых переходов от льда к жидкости и от жидкости к пару.
3. Что вызывает образование водородных связей в воде?
В частном случае воды водородные связи развиваются между соседними атомами водорода и кислорода соседних молекул воды.
4. Какова наиболее важная роль водородных связей между молекулами воды?
Молекулы воды могут оставаться конденсированными в жидкости из-за сильных водородных связей.
5. Какие условия необходимы для образования водородной связи?
Водородное соединение требует двух условий:
(i). Первая молекула имеет водородную связь с сильно электроотрицательным атомом (N, O, F).
(ii). Неподеленная пара электронов на мельчайшем крайне электроотрицательном атоме характеризует вторую молекулу (N, O, F).
6. Как разорвать водородные связи в воде?
Эти связи можно разорвать, просто добавив в воду другой материал или вещество.
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о Структуре воды и водородных связях ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности — мы обещаем, что это сделает учебу намного веселее! 😎
Источники:
- Вода.
 https://www.britannica.com/science/water. По состоянию на 16 декабря 2021 г.
https://www.britannica.com/science/water. По состоянию на 16 декабря 2021 г. - Структура воды. https://chem.libretexts.org/Bookshelves/Introductory_Chemistry/Book%3A_Introductory_Chemistry_(CK-12)/15%3A_Water/15.01%3A_Structure_of_Water. По состоянию на 16 декабря 2021 г.
- Структура воды. https://healingearth.ijep.net/water/structure-water. По состоянию на 16 декабря 2021 г.
- Описание курса и экзамена по биологии AP https://apcentral.collegeboard.org/pdf/ap-biology-course-and-exam-description-0.pdf?course=ap-biology По состоянию на 16 декабря 2021 г.
Вода в полуоболочке: структура воды с акцентом на угловую структуру и сольватацию
1. Bragg WH. Кристаллическая структура льда. проц. физ. соц. Лондон. 1921; 34: 98–103. [Google Scholar]
2. Нартен А., Леви Х. Жидкая вода: функции молекулярной корреляции на основе рентгеновской дифракции. Дж. Хим. физ. 1971; 55: 2263–2269. [Google Scholar]
3. Bosio L, Chen S, Teixeira J.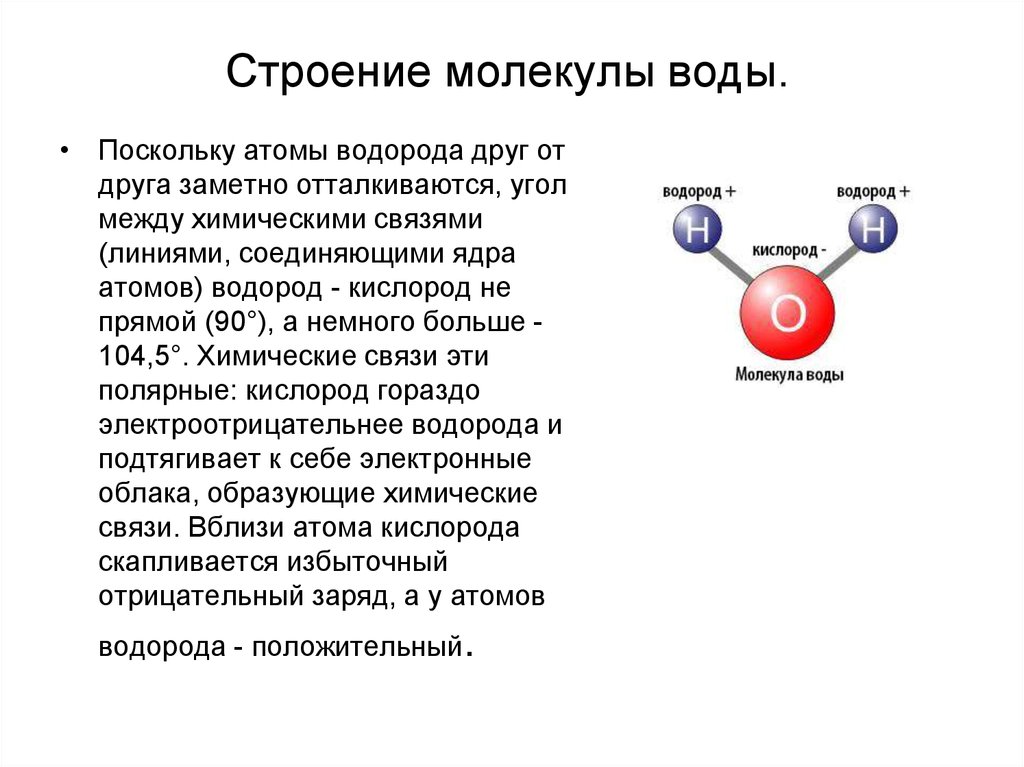 Изохорный температурный перепад рентгеновского структурного фактора и структурные перестройки в низкотемпературной тяжелой воде. физ. Ред. А. 1983;27:1468–1475. [Google Scholar]
Изохорный температурный перепад рентгеновского структурного фактора и структурные перестройки в низкотемпературной тяжелой воде. физ. Ред. А. 1983;27:1468–1475. [Google Scholar]
4. Сопер А.К. Функции радиального распределения воды и льда. хим. физ. 2002; 258:121–137. [Google Scholar]
5. Рахман А., Стиллинджер Ф. Изучение молекулярной динамики жидкой воды. Дж. Хим. физ. 1971; 55: 3336–3359. [Google Scholar]
6. Тернер Дж., Сопер А. Влияние неполярных растворенных веществ на структуру воды: спирты и ионы тетраалкиламмония. Дж. Хим. физ. 1994; 101:6116–6125. [Google Scholar]
7. Тернер Дж., Сопер А., Финни Дж. Ионное и аполярное поведение иона тераметиламмония в воде. Дж. Хим. физ. 1995;102:5438–5443. [Google Scholar]
8. Чау П., Хардвик А. Новый параметр порядка для тетраэдрических конфигураций. Мол. физ. 1998; 93: 511–518. [Google Scholar]
9. Эррингтон Дж., Дебенедетти П. Связь между структурным порядком и аномалиями жидкой воды. Природа.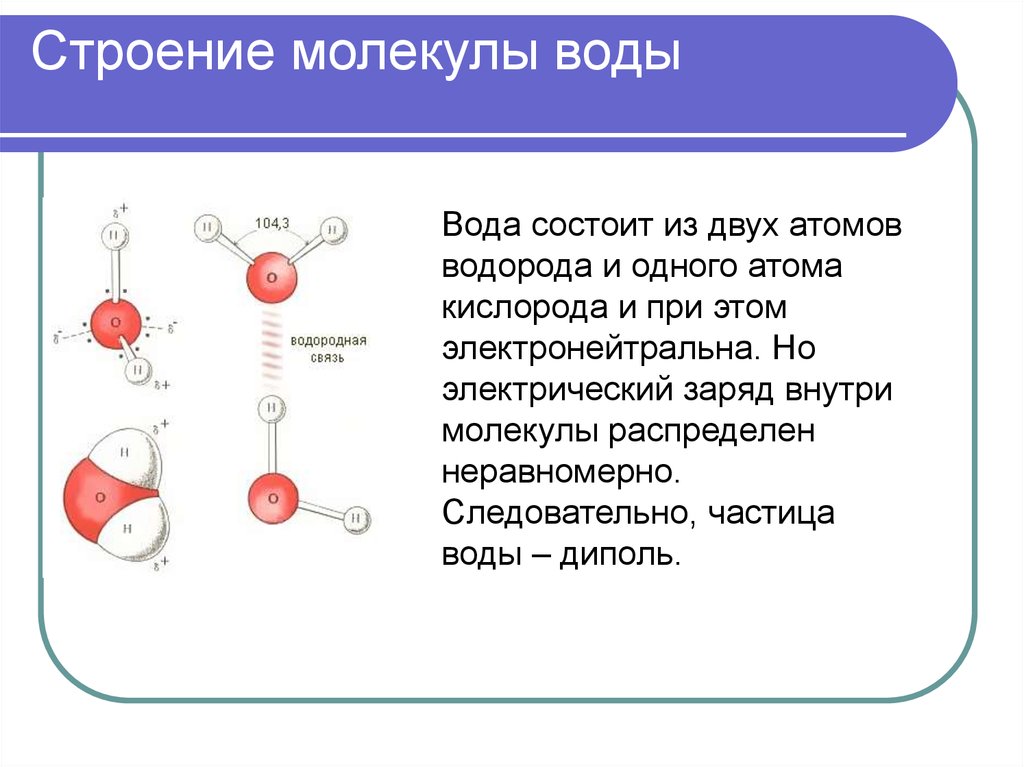 2001; 409: 318–21. [PubMed] [Google Scholar]
2001; 409: 318–21. [PubMed] [Google Scholar]
10. Медведев Н., Наберухин Ю. Форма симплексов Делоне в плотных случайных упаковках твердых и мягких сфер. J. Некристалл. Твердые вещества. 1987; 94: 402–406. [Академия Google]
11. Смолин Н., Даггетт В. Формирование льдоподобной структуры воды на поверхности антифриза. Дж. Физ. хим. Б. 2008; 112:6193–6202. [PubMed] [Google Scholar]
12. Свищев И., Кусалик П. Структура жидкой воды: исследование функций пространственного распределения. Дж. Хим. физ. 1993; 99: 3049–61. [Google Scholar]
13. Свищев И.М., Засецкий А., Кусалик П. Сольватационные структуры в трех измерениях. хим. физ. 2000; 258:181–186. [Google Scholar]
14. Сопер А., Риччи М. Структуры воды высокой и низкой плотности. физ. Преподобный Летт. 2000; 84: 2881–2884. [PubMed] [Академия Google]
15. Сопер А.К. Исследование структуры воды вокруг биологических молекул: концепции, построения и последствия. Физика Б. 2000; 276: 12–16. [Google Scholar]
16. Хенн А.Р., Каузманн В. Уравнение состояния случайной сети, континуальная модель жидкой воды. Дж. Физ. хим. 1989;93:3770–3783. [Google Scholar]
Хенн А.Р., Каузманн В. Уравнение состояния случайной сети, континуальная модель жидкой воды. Дж. Физ. хим. 1989;93:3770–3783. [Google Scholar]
17. Pople J. Proc. Рой. соц. Лонд. 1961; А 205:163. [Google Scholar]
18. Sceats MG, Stavola M, Rice SA. Случайная сетевая модель нулевого порядка жидкой воды. Дж. Хим. физ. 1979;70:3927–38. [Google Scholar]
19. Sceats MG, Rice SA. Случайная сетевая модель расчета свободной энергии жидкой воды. Дж. Хим. физ. 1980; 72: 6183–91. [Google Scholar]
20. Rice SA, Sceats MG. Случайная сетевая модель для воды. Дж. Физ. хим. 1981; 85: 1108–1119. [Google Scholar]
21. Галлахер К., Шарп К.А. Новый взгляд на изменение теплоемкости при гидрофобной сольватации. Варенье. хим. соц. 2003; 125:9863–9870. [PubMed] [Google Scholar]
22. Рашке Т., Левитт М. Неполярные растворенные вещества улучшают структуру воды в гидратных оболочках, уменьшая взаимодействие между ними. проц. Натл. акад. науч. США. 2005; 102: 6777–6782. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Кумар Р., Шмидт Дж., Скиннер Дж. Определение и динамика водородных связей в жидкой воде. Дж. Хим. физ. 2007; 126:204107–11. [PubMed] [Google Scholar]
24. Чо Х., Сингх С., Робинсон Г. Понимание всех аномалий воды с нелокальным потенциалом. Дж. Хим. физ. 1997; 107:7979–7988. [Google Scholar]
25. Мадан Б., Шарп К. Изменения в структуре воды, вызванные гидрофобным раствором, подтверждены моделированием углов водородных связей воды и функций радиального распределения. Биофиз. хим. 1999;78:33–41. [PubMed] [Google Scholar]
26. Мадан Б., Шарп К. Изменения теплоемкости, сопровождающие гидрофобную и ионную сольватацию: исследование методом Монте-Карло и случайной сети. Дж. Физ. хим. 1996; 100:7713–7721. [Google Scholar]
27. Мадан Б., Шарп К. Молекулярное происхождение изменений теплоемкости гидратации гидрофобных растворенных веществ: возмущение структуры воды вокруг алканов. Дж. Физ. хим. Б. 1997; 101:11237–11242. [Google Scholar]
[Google Scholar]
28. Шарп К.А., Мадан Б. Гидрофобный эффект, структура воды и изменения теплоемкости. Дж. Физ. Хим.Б. 1997;101:4343–4348. [Google Scholar]
29. Ванци Ф., Мадан Б., Шарп К. Влияние белковых денатурантов мочевины и гуанидиния на структуру воды: структурное и термодинамическое исследование. JACS. 1998; 120:10748–53. [Google Scholar]
30. Мадан Б., Шарп К.А. Теплоемкость гидратации компонентов нуклеиновых кислот, определенная с помощью модели случайных сетей. Биофизический журнал. 2001; 81: 1881–1887. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Gallagher KR, Sharp KA. Анализ термогистерезисной гидратации белков с использованием модели случайных сетей. Биофиз. хим. 2003;105:195–209. [PubMed] [Google Scholar]
32. Spolar RS, Livingstone JR, Record MT., Jr. Использование данных о переносе жидких углеводородов и амидов для оценки вклада в сворачивание белка. Биохимия. 1992; 31: 3947–55. [PubMed] [Google Scholar]
33. Гомес Дж. , Хильзер В., Се Д., Фрейре Э. Теплоемкость белков. Белки. 1995; 22: 404–412. [PubMed] [Google Scholar]
, Хильзер В., Се Д., Фрейре Э. Теплоемкость белков. Белки. 1995; 22: 404–412. [PubMed] [Google Scholar]
34. Галлахер К.Р., Шарп К.А. Новый взгляд на изменение теплоемкости при гидрофобной сольватации. Варенье. хим. соц. 2003;125:9853–9860. [PubMed] [Google Scholar]
35. Frank HS, Wen WY. Структурные аспекты взаимодействия ионов и растворителей в водных растворах: предполагаемая картина структуры воды. Обсуждать. Фарадей Сок. 1957; 24:133. [Google Scholar]
36. Немети Г., Шерага Х. Структура воды и гидрофобная связь. I Модель термодинамических свойств жидкой воды. Дж. Хим. физ. 1962; 36: 3382–3400. [Google Scholar]
37. Walrafen GE. Раман-спектральные исследования влияния температуры на структуру воды. Дж. Хим. физ. 1967;47:114–26. [Google Scholar]
38. Smith JD, Cappa CD, Wilson KR, Cohen RC, Geissler PL, Saykally RJ. Единое описание температурно-зависимых перегруппировок водородных связей в жидкой воде. проц. Натл. акад. науч. США. 2005; 102:14171–14174.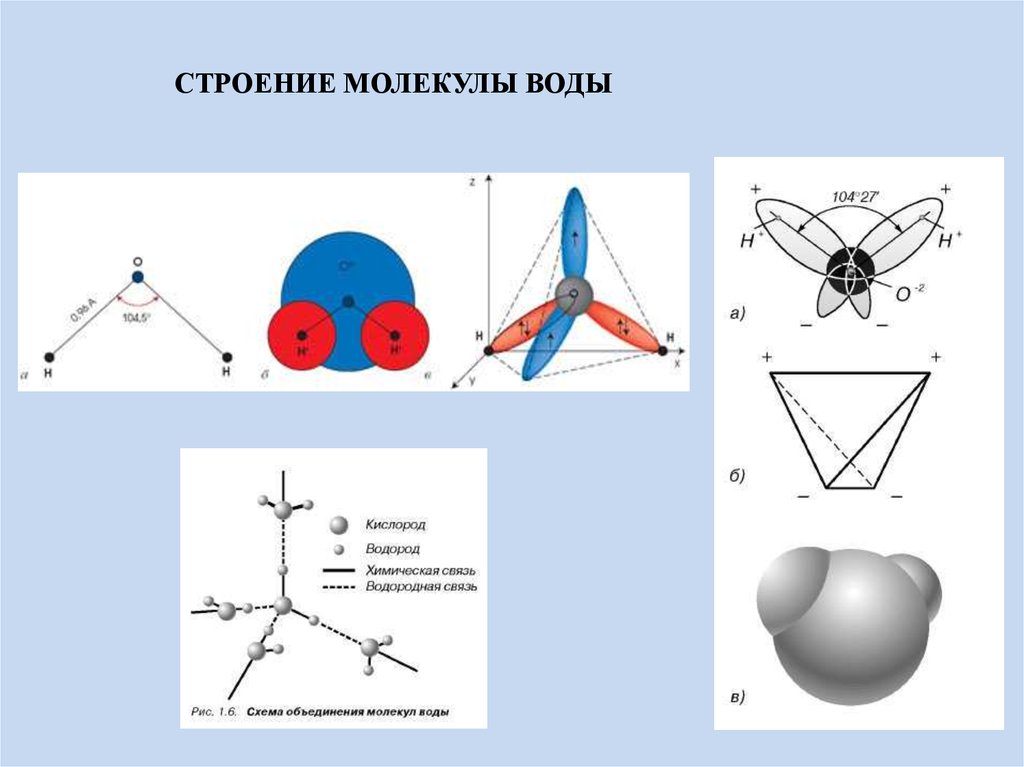 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Wernet P, Nordlund D, Bergmann U, Cavalleri M, Odelius M, Ogasawara H, Naslund L, Hirsch TK, Ojamae L, Glatsel P, Pettersson LG, Nilsson А. Строение первой координационной оболочки в жидкой воде. Наука. 2004;304:995–999. [PubMed] [Google Scholar]
40. Смит Дж., Каппа С., Уилсон К., Мессер Б., Коэн Р., Сайкалли Р. Энергетика перегруппировок сети водородных связей в жидкой воде. Наука. 2004; 306:851–3. [PubMed] [Google Scholar]
41. Джеффри Г.А. Введение в водородную связь. Издательство Оксфордского университета; New York: 1997. [Google Scholar]
42. Вандеркуи Дж.М., Дашнау Дж.Л., Зелент Б. Инфракрасная спектроскопия с отклонением температуры (TEIR) для изучения водородных связей между водой и биомолекулами. Биохим. Биофиз. Акта. 2005;1749: 214–233. [PubMed] [Google Scholar]
43. Sharp KA, Madan B, Manas ES, Vanderkooi JM. Изменения структуры воды, вызванные гидрофобными и полярными растворенными веществами, выявленные с помощью моделирования и инфракрасной спектроскопии. Дж. Хим. физ. 2001; 114:1791–1796. [Google Scholar]
Дж. Хим. физ. 2001; 114:1791–1796. [Google Scholar]
44. Нуччи Н.В., Вандеркуи Дж.М. Влияние солей ряда Гофмейстера на сеть водородных связей воды. Дж. Мол. Жидкости. 2008; 143:160–170. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Коллинз К.Д. Сила гидратации и биологическая структура в зависимости от плотности заряда. Биофиз. Дж. 1997;72:65–76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Дашнау Ю.Л., Нуччи Н.В., Шарп К., Вандеркоой Ю.М. Водородная связь и криозащитные свойства смесей глицерин/вода. Дж. Физ. хим. 2006; 110:13670–13677. [PubMed] [Google Scholar]
47. Pace CN. Определение и анализ кривых денатурации мочевины и гидрохлорида гуанидина. Методы Энзимол. 1986; 131: 266–280. [PubMed] [Google Scholar]
48. Rezus YLA, Bakker HJ. Влияние мочевины на структурную динамику воды. Proc Natl Acad Sci U S A. 2006;103:18417–18420. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Сопер А.К., Кастнер Э.В., Лузар А. Влияние мочевины на структуру воды: ключ к ее свойствам в качестве денатуранта? Биофиз хим.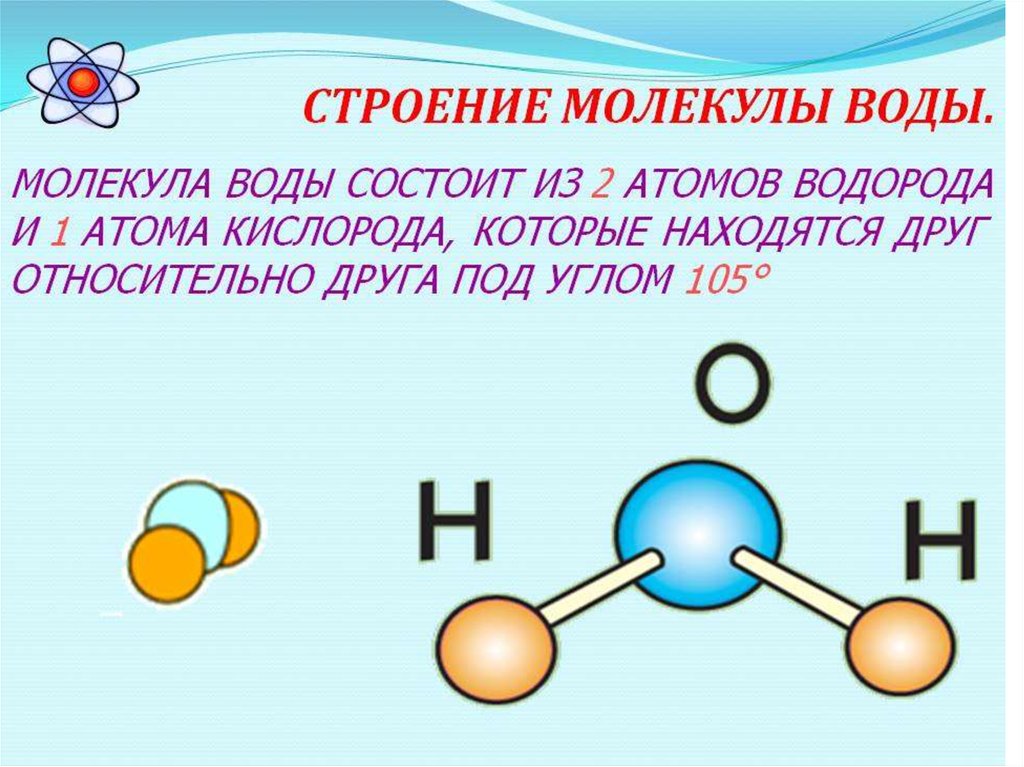 2003; 105: 649–666. [PubMed] [Google Scholar]
2003; 105: 649–666. [PubMed] [Google Scholar]
50. Скотт Дж. Н., Нуччи Н. В., Вандеркуи Дж. М. Изменения в структуре воды, вызванные катионом гуанидиния, и влияние на денатурацию белков. Дж. Физ. хим. А. 2008; 112:10939–10948. [Статья бесплатно PMC] [PubMed] [Google Scholar]
51. Кримм С., Бандекар Дж. Колебательная спектроскопия и конформация пептидов, полипептидов и белков. Доп. Белок хим. 1986;38:181–364. [PubMed] [Google Scholar]
52. Манас Э.С., Гетахун З., Райт В.В., ДеГрадо В.Ф., Вандеркуи Дж.М. Инфракрасные спектры амидных групп в α-спиральных белках: свидетельство водородных связей между спиралями и водой. Варенье. хим. соц. 2000;122:9883–9890. [Google Scholar]
53. Уолш С.Т., Ченг Р.П., Даггетт В., Вандеркуи Дж.М., ДеГрадо В.Ф. Гидратация амидов в спиралях: полная картина молекулярной динамики, ИК и ЯМР. Белковая наука. 2003; 12: 520–531. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Мукерджи П., Касс И., Аркин И.Т., Занни М.Т.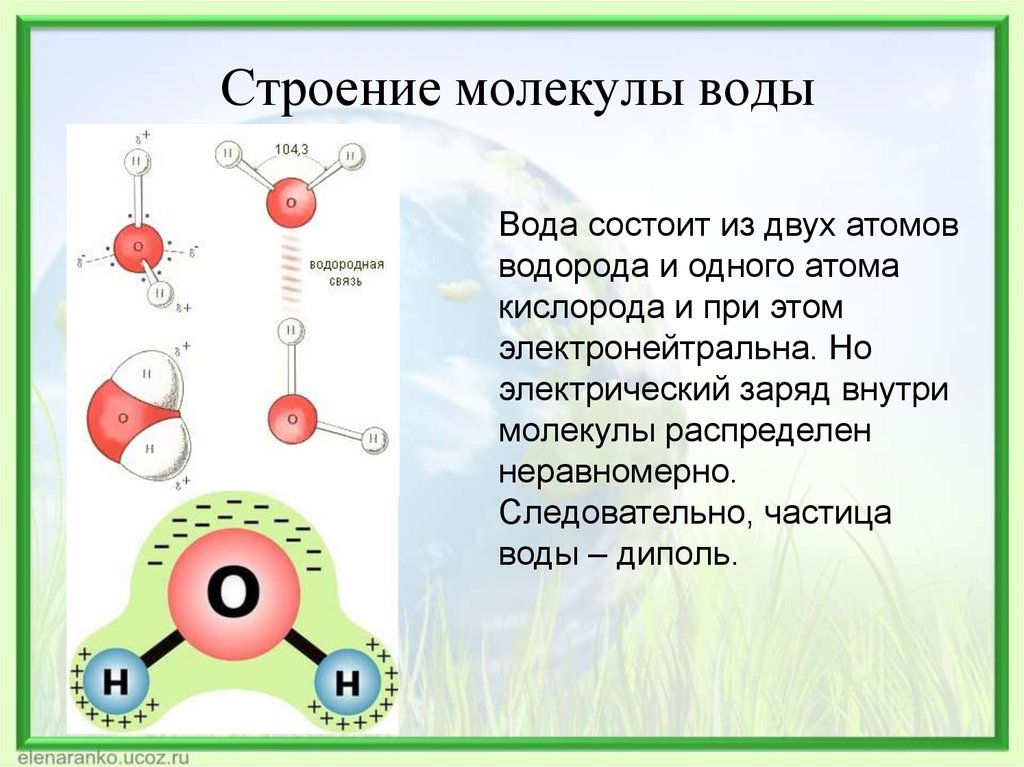 Структурное нарушение трансмембранного домена Ch4 изучено с помощью двумерной ИК-спектроскопии и моделирования молекулярной динамики. Дж. Физ. хим. Б. 2006; 110:24740–24749. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Структурное нарушение трансмембранного домена Ch4 изучено с помощью двумерной ИК-спектроскопии и моделирования молекулярной динамики. Дж. Физ. хим. Б. 2006; 110:24740–24749. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Ян С., Шарп К. Гидрофобная тенденция гидратации полярных групп как основная сила в распознавании антифризного белка I типа. Белки. 2005; 59: 266–74. [PubMed] [Google Scholar]
56. Ян С., Шарп К.А. Механизм действия белка-антифриза III типа: вычислительное исследование. Биофиз. хим. 2004;109: 137–148. [PubMed] [Google Scholar]
57. Pentelute BL, Gates Z, Dashnau JL, Vanderkooi JM, Kent SBH. Зеркальные формы антифризного белка снежной блохи (sfAFP), полученные методом тотального химического синтеза, обладают идентичной антифризной активностью. Варенье. хим. соц. 2008; 130:9702–9707. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Zelent B, Bryan MA, Sharp KA, Vanderkooi JM. Влияние поверхностных групп белков на воду изучали методами гистерезиса замораживания/оттаивания и инфракрасной спектроскопии.


 1.5. Строение молекулы воды
1.5. Строение молекулы воды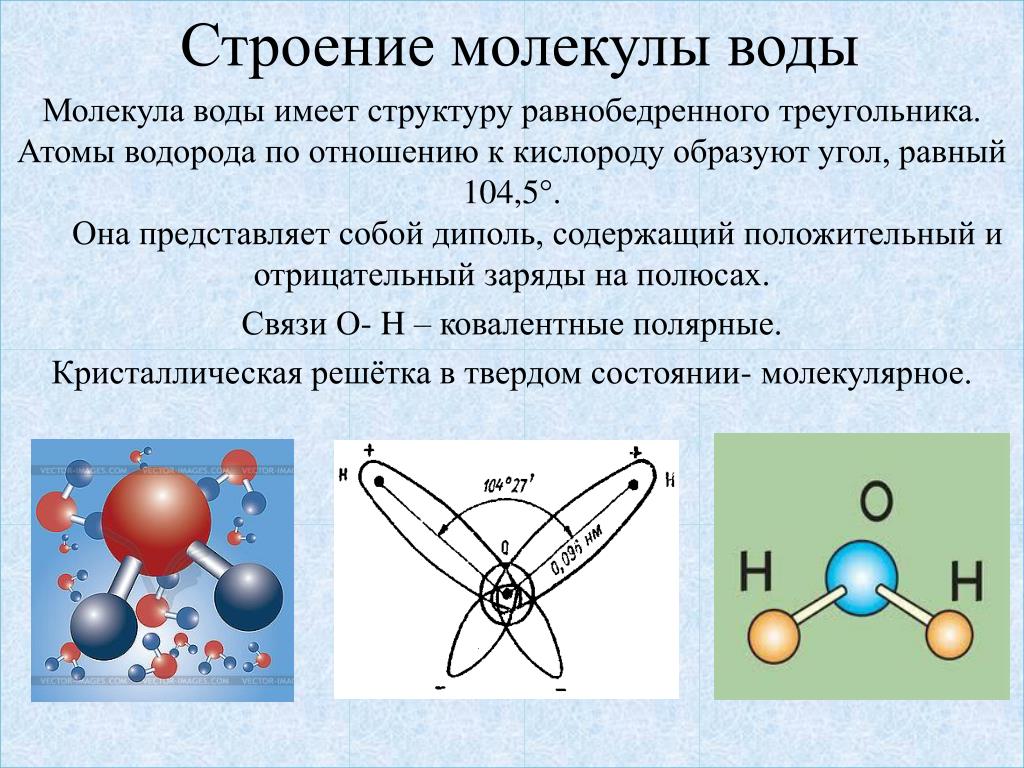

 https://www.britannica.com/science/water. По состоянию на 16 декабря 2021 г.
https://www.britannica.com/science/water. По состоянию на 16 декабря 2021 г.