Готовимся к углубленному изучению химии : 2.3 Молекулы. Химические формулы
2.3. Молекулы. Химические формулы. Молекулярные массы. Элементный состав веществ
Атомы могут соединяться друг с другом. В результате этого соединения обычно образуются более сложные частицы – молекулы. Например:
Эти примеры показывают, что соединяться друг с другом могут атомы одного элемента и атомы разных элементов. Число атомов, которые соединяются друг с другом, может быть различным.
Состав любой молекулы можно выразить химической формулой.
Так, молекула водорода имеет формулу Н2 . Число «2» в этой формуле показывает число атомов водорода в молекуле водорода.
Числа
в химических формулах, которые показывают, сколько атомов данного элемента
входит в состав молекулы, называются индексами.
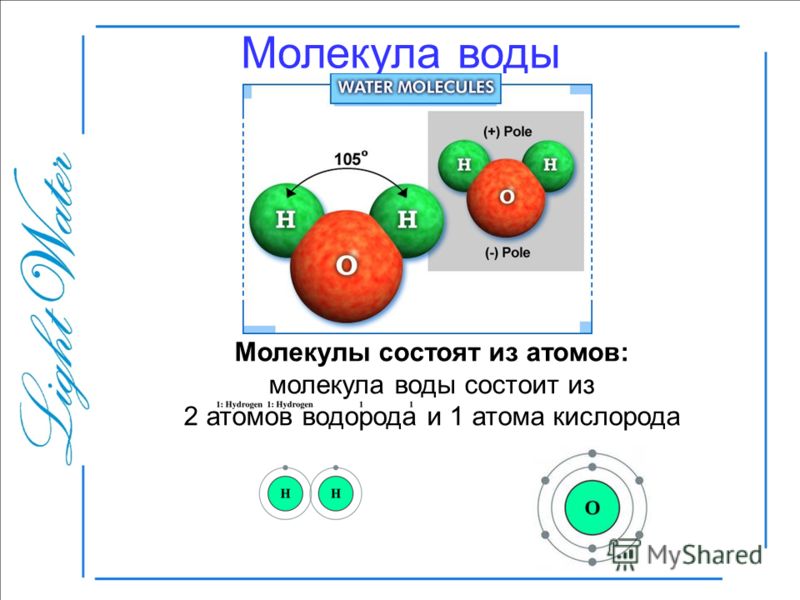
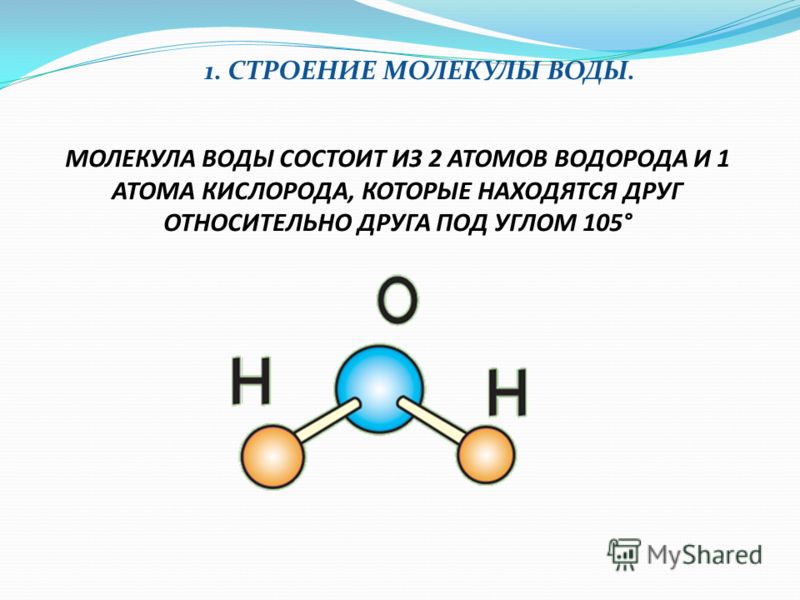
Молекула хлороводорода имеет формулу НСl, так как она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет формулу Н2О. Эта формула показывает, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Таким образом, химические формулы показывают качественный и количественный состав молекулы.
Согласно закону постоянства состава (Ж. Пруст, Франция, 1808 г.):
Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Так
как вещество состоит из одинаковых молекул, то состав молекулы определяет
состав всего вещества. Различия в химических свойствах веществ обусловлены
различиями в составе и строении молекул, из которых состоят эти вещества.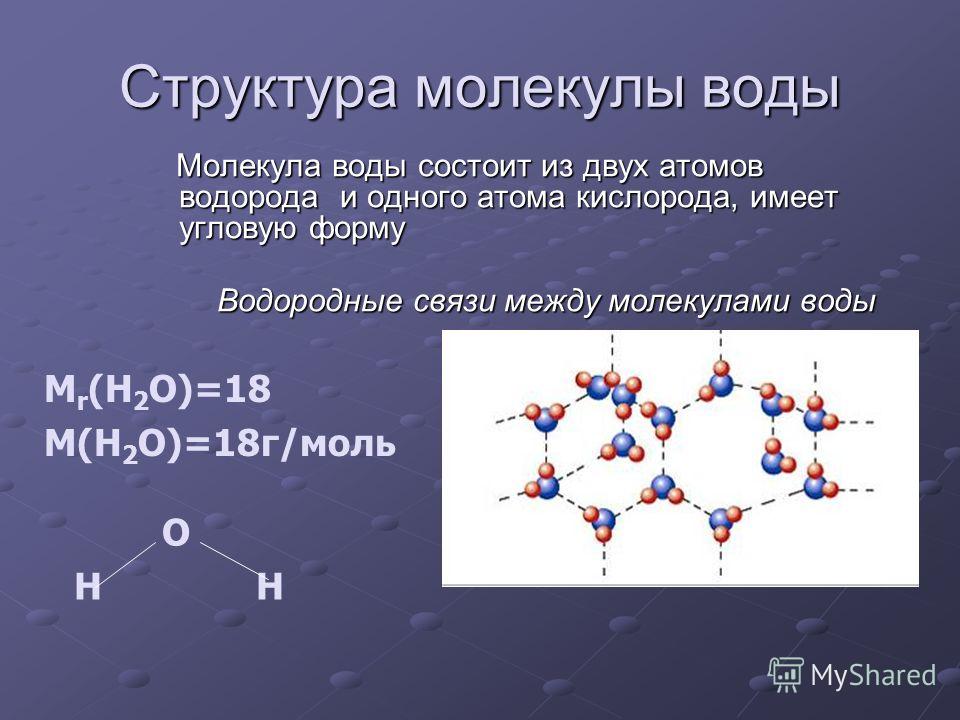 Поэтому можно сделать вывод:
Поэтому можно сделать вывод:
Молекула – это наименьшая частица вещества, которая сохраняет его химические свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается
Например, относительная молекулярная масса воды Н2О равна:
Относительная молекулярная масса сульфата железа (III)равна:
Относительная молекулярная масса вещества Мr – это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода С.
Например,
относительная молекулярная масса воды Мr
(Н2О)= 18.
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля (w) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:
Массовые доли обычно выражаются в процентах:
Рассчитаем, например, массовые доли водорода и кислорода в воде Н2О:
УПРАЖНЕНИЯ
1.
Рассчитайте
массовую долю марганца в оксиде марганца (VII).
Решение: Молярные массы веществ равны: М(Mn) = 55
г/моль, М(О) = 16 г/моль, M(Mn2O7)=2М(Mn)+7М(О)= 222
г/моль. Следовательно, масса Mn
m(Mn2O7) = M(Mn2O7)·n(Mn2O7) = 222·1= 222 г.
Из формулы Mn2O7следует, что количество вещества атомов марганца в два раза больше количества вещества оксида марганца (VII). Значит,
n(Mn) = 2n(Mn2O7) = 2 моль,
m(Mn)= n(Mn)·M(Mn) = 2·55 = 110 г.
Таким образом, массовая доля марганца в оксиде марганца(VII) равна:
ω(X)=m(Mn) : m(Mn2O7)
= 110:222 = 0,495 или 49,5%.
_______________________________________________________________
2.
Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2h3O.
Решение: Молярная масса BaCl2 • 2h3O составляет: М(BaCl2 • 2h3O) = 137+ 2 • 35,5 + 2 • 18 =244 г/моль.
Из формулы BaCl2 • 2h3O следует, что 1 моль дигидрата хлорида бария содержит 2 моль Н2О. Отсюда можно определить массу воды, содержащейся в BaCl2 • 2h3O: m(h3O) = 2 • 18 = 36 г. Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2h3O. ω(h3O) = m(h3O)/ m(BaCl2 • 2h3O) = 36/244 = 0,1475 = 14,75%.
_______________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Какие частицы обычно образуются в результате соединения атомов.
2.
Чем можно выразить состав любой молекулы.
3.
Что показывают химические формулы
4.
Чему равна масса молекулы
5.
Чему равна массовая доля данного элемента в данном веществе.
Опишите качественный м количественный состав молекул следующих веществ: метан СН4, сода Na2CO3, глюкоза C6H12O6 , хлор Cl2 , сульфат алюминия Al2(SO4)3.
7.
Молекула фосгена состоит из одного атома углерода, одного атома кислорода и двух атомов хлора. Молекула мочевины состоит из одного атома углерода, одного атома кислорода и двух атомных групп NH2. Напишите формулы фосгена и мочевины.
8.
Подсчитайте общее число атомов в следующих молекулах:
Рассчитайте относительные молекулярные массы веществ, которые указаны в упражнении 6.
.
Чему равны массовые доли элементов в следующих веществах:
В каком из этих веществ массовая доля азота наибольшая и в каком – наименьшая.
1. Про молекулу нельзя сказать, что она: | |
а) сохраняется в химических реакциях | б) носитель химических свойств вещества |
в) разрушается в химических реакциях | г) имеет тот же качественный состав, что и вещество, состоящее из данных молекул |
2. Нельзя утверждать, что в состав молекулы воды входят: | |
а) два атома Н и один атом О | б) молекула Н2 и один атом О |
в) атомы различных химических элементов | г) атомы Н и О в массовом соотношении 1:8 соответственно |
3. Какими свойствами не характеризуется молекула: | |
а) качественным составом | б) строением |
в) количественным составом | г) электрической проводимостью |
4. Что одинакового для молекул НСl и HBr: | |
а) масса | б) массовая доля водорода |
в) качественный состав | г) число атомов в молекуле |
5. Что показывает химическая формула H2SO4: | |
а) одну молекулу серной кислоты | б) относительную атомную массу серной кислоты |
в) нет верного ответа | г) пространственное строение молекулы серной кислоты |
6. Какие свойства характеризуют и молекулу, и вещество, состоящее из этих молекул: | |
а) качественный состав | б) электрическая проводимость |
в) физические свойства | г) агрегатное состояние |
7. Массовая доля хлора в его оксиде равна 59,66 %. Укажите формулу оксида: | |
а) Cl2O | б) Cl2O3 |
в) Cl2O5 | г) Cl2O7 |
8. Какова формула оксида железа, в котором массовая доля железа в 2,333 раза больше массовой доля кислорода: | |
а) FeO | б) Fe2O3 |
в) Fe3O4 | г) FeO3 |
9. Какова массовая доля водорода в воде Н2О: | |
а) 11 | б) 10 |
в) 15 | г)12 |
10. Рассчитайте массовую долю фосфора в веществе H3PO4: | |
а) 32 | б) 65 |
в) 36 | г) 17 |
Ответы:
1 | а |
2 | б |
3 | г |
4 | г |
5 | а |
6 | а |
7 | б |
8 | б |
9 | а |
10 | а |
Сравнение атома и молекулы
☰
Атом — это мельчайшая, химически неделимая частица вещества.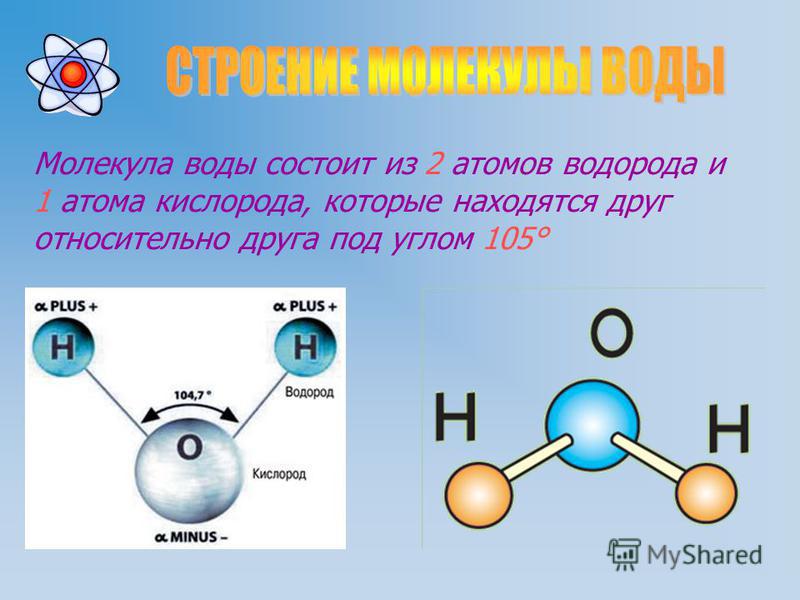 Все вещества состоят из атомов. То, что атомы существуют, предполагал еще Демокрит в IV в. до н. э. Однако доказать, что атомы действительно существуют, ученые смогли только в XIX веке.
Все вещества состоят из атомов. То, что атомы существуют, предполагал еще Демокрит в IV в. до н. э. Однако доказать, что атомы действительно существуют, ученые смогли только в XIX веке.
Существует более 100 видов атомов. Они отличаются друг от друга своим строением. Когда выше было сказано, что атомы — это химически неделимые частицы, то это не значит, что они неделимы вообще.
Атомы состоят из более мелких частиц — протонов, нейтронов и электронов. В зависимости от того, сколько этих более мелких частиц входит в атом, различают виды атомов. Протоны и нейтроны образуют ядро атома, вокруг которого есть электронные облака, где двигаются электроны. Протоны и нейтроны также называют нуклонами.
Самые простые атомы — это водород и гелий. У первого только один электрон, а у второго — два. Это самые распространенные атомы во Вселенной, так как из них состоят звезды. Но они не самые распространенные на Земле. На Земле распространены более сложные атомы, больше различных их видов. Однако наиболее распространены кислород и кремний.
Однако наиболее распространены кислород и кремний.
Молекулы состоят из атомов, которые притягиваются друг к другу. Одинаковые молекулы образуют вещество. Свойства вещества зависят от атомного состава и строения молекул. Имеет значение, какие атомы входят в состав молекулы, как они между собой соединены.
Одну молекулу водорода образуют два атома водорода. Много молекул водорода образуют вещество водород, которое при нормальных условиях — газ. Вода — это вещество, состоящее из молекул, образованных одним атомом кислорода и двумя атомами водорода. При нормальных условиях вещество вода — это жидкость.
Мельчайшей частицей вещества считается именно молекула, так как она определяет его химические свойства, а не атомы. При химических реакциях, когда одни вещества превращаются в другие, изменяются молекулы — одни исчезают, другие появляются. Однако атомы при этом остаются неизменными. Сколько атомов и каких типов было до химической реакции, столько их будет и после.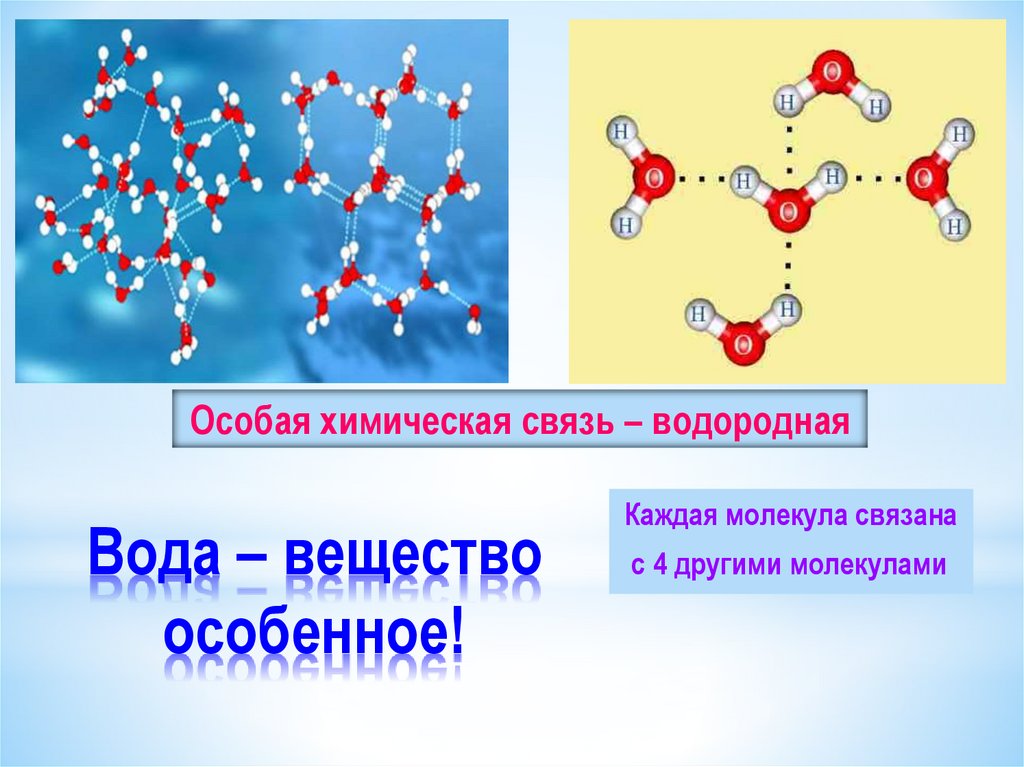 Просто они будут по-другому между собой объединены и, следовательно, образуют уже другие молекулы, то есть другие вещества.
Просто они будут по-другому между собой объединены и, следовательно, образуют уже другие молекулы, то есть другие вещества.
Если различных видов атомов всего чуть более 100, то число различных видов молекул исчисляется миллионами. Существуют очень сложные молекулы, в состав которых входят сотни и более атомов (преимущественно одного или нескольких видов). Такие молекулы входят в состав живых организмов.
Следует понимать, если две молекулы различаются между собой всего лишь одним атомом, то это уже совершенно разные молекулы, образующие разные вещества. Тогда станет понятным, почему разных атомов не так уж и много, а разных молекул огромное количество.
Размеры атомов и молекул ничтожны, это миллионные доли миллиметра и даже меньше. Их можно увидеть только с помощью электронного микроскопа. Понятно, что молекулы больше атомов.
Размеры атомов зависят от их сложности. Чем больше электронов и больше ядро атома, тем больше сам атом. То же самое можно сказать о молекулах.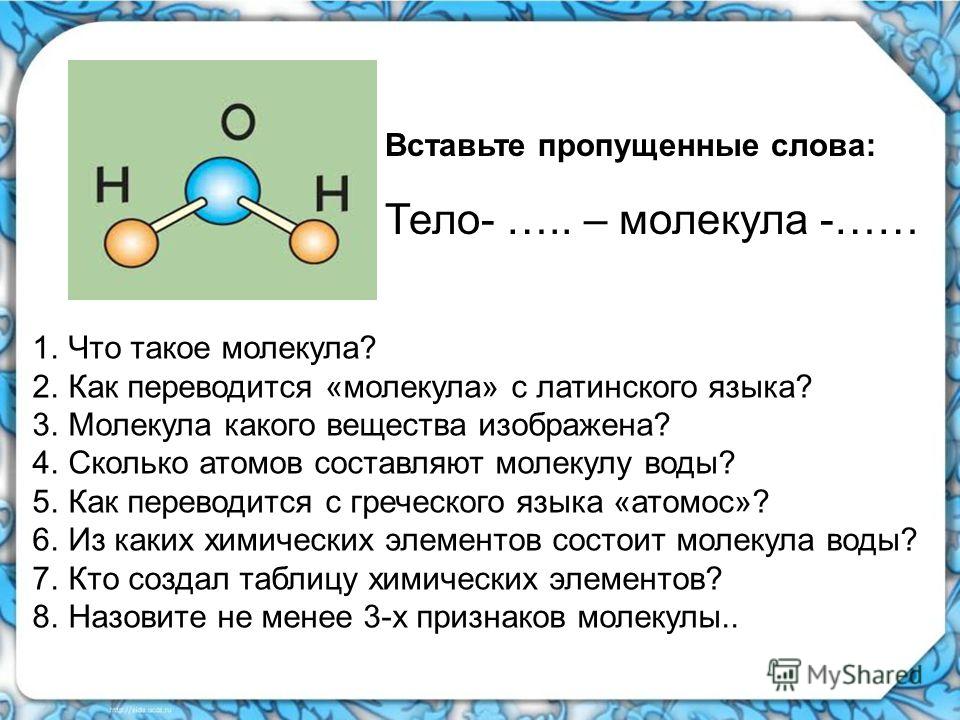 Чем больше атомов входит в их состав и чем крупнее сами атомы, тем больше будет молекула вещества.
Чем больше атомов входит в их состав и чем крупнее сами атомы, тем больше будет молекула вещества.
Количество атомов в капле воды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 50702
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавье Прат-Ресина, Тим Вендорф и Адам Хан
- Цифровая библиотека химического образования (ChemEd DL)
Поскольку атомы и молекулы чрезвычайно малы, в любом макроскопическом образце их очень много. 15,9994 г кислорода, выраженного в молях: количество молекул воды, будет содержать, например, 6,022 × 10 23 атомов кислорода, а 2,016 г водорода, вступившего в реакцию с ним, будут содержать в два раза больше (12,044 × 10 23 ) атомов водорода.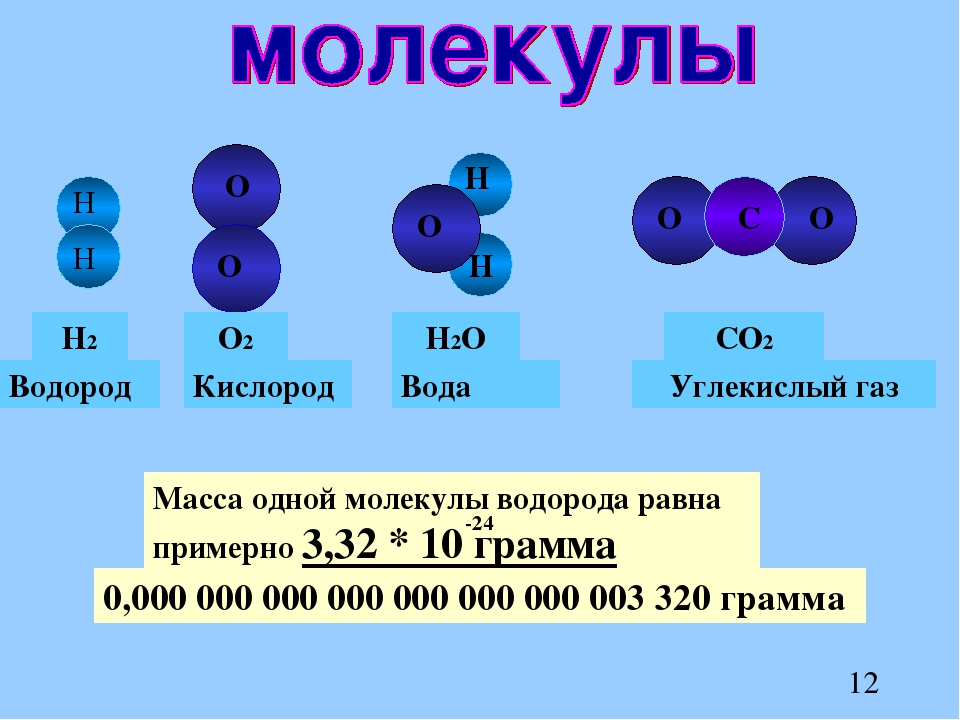 Очень большие числа, связанные с подсчетом микроскопических частиц, неудобно обдумывать или записывать. Поэтому химики выбрали для подсчета атомов и молекул единицу измерения, называемую моль. Один моль (сокращенно моль) составляет 6,022 × 10 23 микроскопических частиц, из которых состоит рассматриваемое вещество. Таким образом, 6,022 × 10 23 атомов O относятся к 1 моль O.
Очень большие числа, связанные с подсчетом микроскопических частиц, неудобно обдумывать или записывать. Поэтому химики выбрали для подсчета атомов и молекул единицу измерения, называемую моль. Один моль (сокращенно моль) составляет 6,022 × 10 23 микроскопических частиц, из которых состоит рассматриваемое вещество. Таким образом, 6,022 × 10 23 атомов O относятся к 1 моль O.
Идея использования большого числа в качестве единицы измерения количества имеющихся у нас объектов не является уникальной для химиков. Яйца, пончики и многое другое продается дюжинами — единицей из двенадцати штук. Предметы меньшего размера, такие как карандаши, можно заказать по 144 штуки, то есть оптом, а бумага упакована в пачки, каждая из которых содержит 500 листов. Химик, ссылающийся на 1 моль O, очень похож на управляющего книжным магазином, который заказывает 2,5 дюжины спортивных рубашек, 20 брутто карандашей или 62 пачки бумаги.
Однако существует разница в степени, потому что химическая единица 6,022 × 10 23 очень велика. Стопка бумаги, содержащая моль листов, простиралась бы более чем в миллион раз на расстояние от земли до солнца, а 6,022 × 10 23 песчинок покрыли бы всю землю в мире на глубину почти 2 фута. У студента может быть 10 27 молекул воды (около 10 4 моль), и ему необходимо накопить около 10 18 (десять миллионов миллионов миллионов, но только 0,00001 моль) молекул воды в секунду за 18 лет, чтобы достичь этого количества. Доказательство будет дано вскоре в разделе «Использование молярной массы воды». Очевидно, что в моле чего-либо содержится очень много частиц.
Стопка бумаги, содержащая моль листов, простиралась бы более чем в миллион раз на расстояние от земли до солнца, а 6,022 × 10 23 песчинок покрыли бы всю землю в мире на глубину почти 2 фута. У студента может быть 10 27 молекул воды (около 10 4 моль), и ему необходимо накопить около 10 18 (десять миллионов миллионов миллионов, но только 0,00001 моль) молекул воды в секунду за 18 лет, чтобы достичь этого количества. Доказательство будет дано вскоре в разделе «Использование молярной массы воды». Очевидно, что в моле чего-либо содержится очень много частиц.
Почему химики выбрали такое необычное число, как 6,022 × 10 23 , в качестве единицы для подсчета количества атомов или молекул? Наверняка какое-нибудь красивое круглое число было бы легче запомнить. Ответ состоит в том, что число граммов в массе 1 моль атомов любого элемента равно атомному весу этого элемента . Например, 1 моль атомов кислорода не только содержит 6,022 × 10 23 атомов, но его массу 15,9994 г удобно получить, прибавив единицу грамм к таблице атомных весов.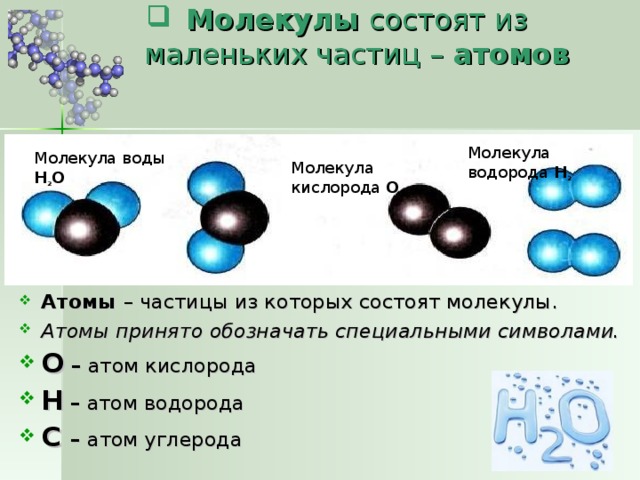 Некоторые другие примеры:
Некоторые другие примеры:
1 моль H содержит 6,022 × 10 23 атомов H; его масса 1,008 г.
1 моль C содержит 6,022 × 10 23 атомов C; его масса 12,01 г.
1 моль О содержит 6,022 × 10 23 атомов О; его масса 15,994 или 16,00 г.
1 моль Br содержит 6,022 × 10 23 атомов Br; его масса 79,90 г.
(Здесь и в последующих расчетах атомные веса округляются до двух знаков после запятой, если только, как в случае H, не останется менее четырех значащих цифр.)
Масса моля из молекул также может быть получена из атомных весов. Подобно тому, как в дюжине яиц будет дюжина белков и дюжина желтков, моль молекул CO будет содержать моль атомов C и моль атомов O.
Таким образом, масса моля СО равна
.\[\text{Масса 1 моль C} + \text{масса 1 моль O} = \text{масса 1 моль CO}\nonumber\]
\[\text{12,01 г} + \text{16,00 г} = \text{28,01 г}\номер\]
Молекулярная масса CO (28,01), выраженная в граммах, представляет собой массу моля CO. Некоторые другие примеры:
Некоторые другие примеры:
Таблица \(\PageIndex{1}\) Молекулярные веса
| Молекула | Молекулярный вес | Масса 1 моль молекул |
| Бр 2 | 2 (79,90) = 159,80 | 159,80 г |
| О 2 | 2(16.00) = 32.00 | 32,00 г |
| Н 2 О | 2(1,008) + 16 = 18,02 | 18,02 г |
| Н 2 О 2 | 2(1,008) + 2(16) = 34,016 | 34,016 г |
| HgBr 2 | 200,59 + 2(79,90) = 360,39 | 360,39 г |
Важно указать, к какому типу частиц относится моль. Моль атомов О, например, содержит вдвое меньше атомов (и вдвое меньше массы), чем моль молекул О 2 . Лучше не говорить о моле кислорода, не уточнив, имеете ли вы в виду 1 моль O или 1 моль O 2 .
От ChemPRIME: 2.7: Крот
Эд Витц (Университет Куцтауна), Джон В. Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавье Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан.
Эта страница под названием «Количество атомов в капле воды» используется в соответствии с лицензией CC BY-NC-SA 4.0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон У. Мур, Джастин Шорб, Ксавье Прат- Резина, Тим Вендорф и Адам Хан.
- Вернуться к началу
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Теги
- Образец
Его химическая формула проста, но вода (h3O) является одним из самых поразительных веществ в известной Вселенной.
 сложное, нюансированное, изменяющее форму соединение.
сложное, нюансированное, изменяющее форму соединение.Это что-то вроде загадки: соединение, состоящее всего из двух химических элементов, один из которых является самым простым в известной вселенной. Пара атомов водорода, крепко держащаяся за один атом кислорода, создает обманчиво минималистское устройство, которое противоречит его огромной универсальности и важности.
Ценность воды как ресурса общеизвестна. Без постоянного снабжения цивилизация, какой мы ее знаем, не существовала бы.
Но как вещество — как молекула — вода, как правило, ускользает от чувства удивления большинства людей. Что очень плохо, на самом деле, потому что это весьма примечательно.
Сформированный и связанный
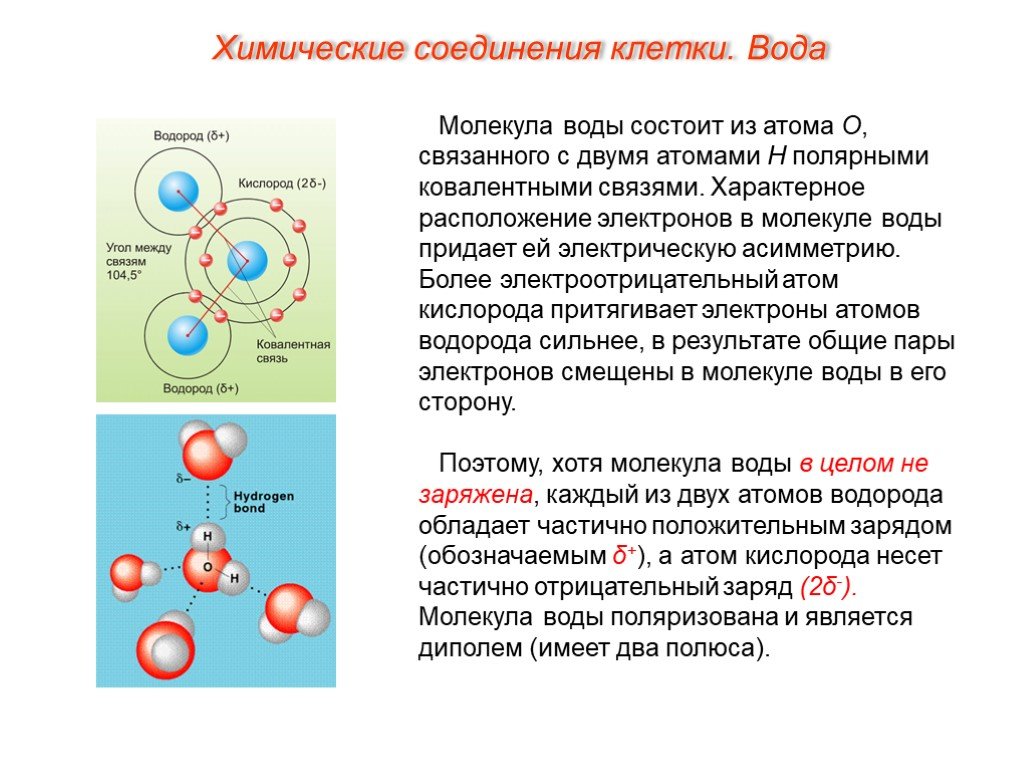
Основная молекулярная формула воды, H₂O, предполагает простую структуру из трех атомов на прямой линии. Но физические свойства трех атомов требуют другого расположения — V-образной формы с кислородом в конце. Эта нелинейная форма превращает воду в замечательную субстанцию с поразительными способностями.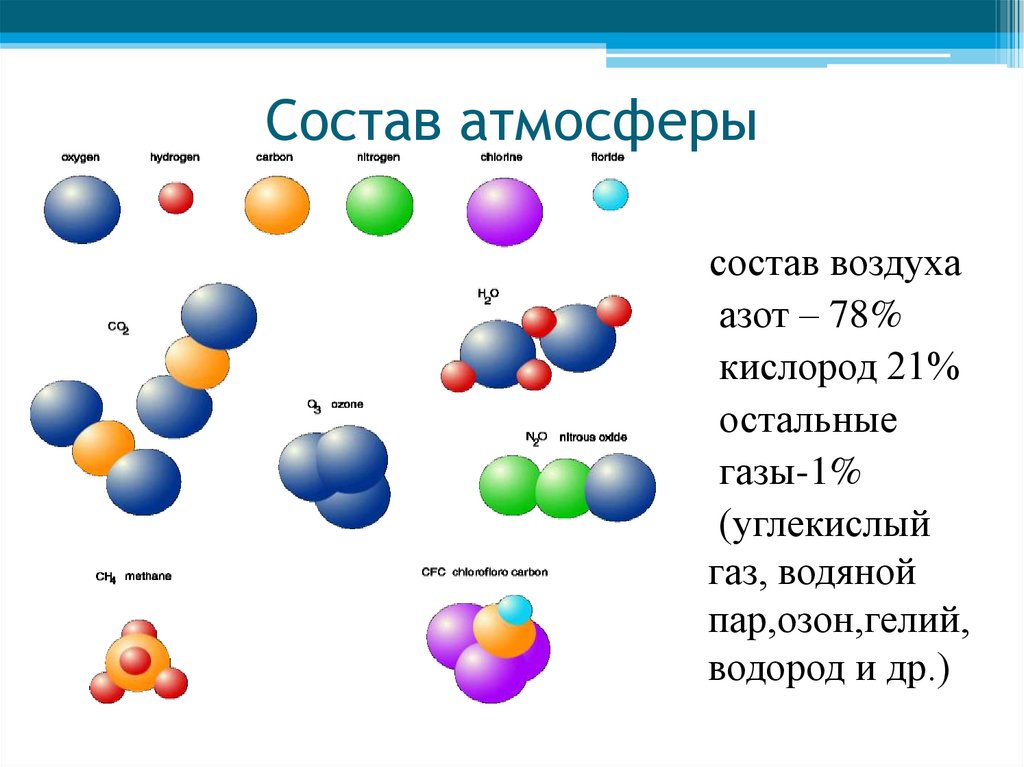
Форма «V» возникает из-за расположения электронов в молекуле, которое вызывает дисбаланс электрического заряда, при этом кислородная точка «V» немного более отрицательна, чем противоположный конец возле атомов водорода. Это небольшое разделение означает, что молекулы воды поляризованы — один полюс положительный, а другой отрицательный.
Полярность электрического заряда лежит в основе удивительных свойств воды. Слегка отрицательный конец одной молекулы воды притягивает слегка положительный конец другой и наоборот, что ученые называют водородной связью.
Водородные связи между молекулами воды исключительно прочны, что дает им склонность цепляться друг за друга, поведение, которое чаще всего проявляется как поверхностное натяжение. Например, вода в наполненном до краев сосуде выглядит выпуклой, если смотреть сбоку из-за поверхностного натяжения. А некоторые существа, такие как водомерки, могут использовать поверхностное натяжение, чтобы скользить по поверхности прудов.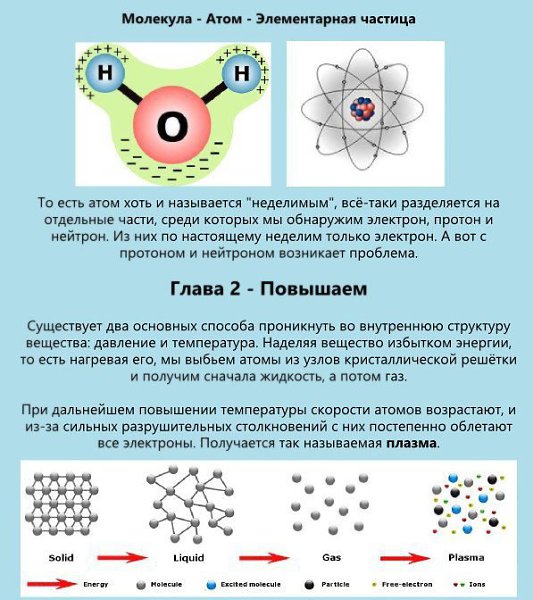
Водородные связи также позволяют воде прилипать к посторонним веществам. Это клейкое свойство позволяет растениям вытягивать воду из земли через корни и до кончиков листьев, игнорируя притяжение.
Полярная природа воды и ее форма делают ее легче в твердом состоянии, чем в жидком. Это потому, что молекулярные V образуют воздушные кристаллические структуры при замерзании, делая лед менее плотным, чем его жидкая форма. Таким образом, лед плавает по рекам и озерам, образуя щит против холодного воздуха сверху и удерживая воду внизу от замерзания, что позволяет рыбам и другим водным видам выживать в более холодных краях.
Водородные связи воды также приводят к другой важной характеристике — более высокой, чем ожидалось, температуре кипения, объясняет Джессика Парр, профессор (преподавание) химии. Парр получила докторскую степень по химии в USC Dornsife в 2007 году и с тех пор преподает общую химию студентам. Ее диссертационное исследование было сосредоточено на понимании того, как водородные связи реагируют на воздействие интенсивного света.
«Если бы вода не была способна образовывать такие прочные водородные связи, она бы кипела при температуре минус 200 градусов по Цельсию, — объясняет Парр.0056 замерзание 0 градусов по Цельсию. Это означает, что он будет существовать на Земле в основном в виде газа, что сделает жизнь в том виде, в каком мы ее знаем, невозможной. Вместо этого наша планета залита водой, всего около 366 миллионов миллиардов галлонов.
Универсальный растворитель
Полярная природа воды также делает ее исключительным растворителем, способным растворять самые разные вещества.
«Мы называем его «универсальным растворителем», потому что он может растворять не все, а очень многое», — говорит Парр. «Многие другие молекулы разборчивы в том, с чем они взаимодействуют и как они работают вместе, но вода будет взаимодействовать практически со всем».
Например, его положительные и отрицательные центры притягивают и легко разводят заряженные атомы, называемые ионами, из которых состоят такие соли, как хлорид натрия, обычно используемый в кулинарии.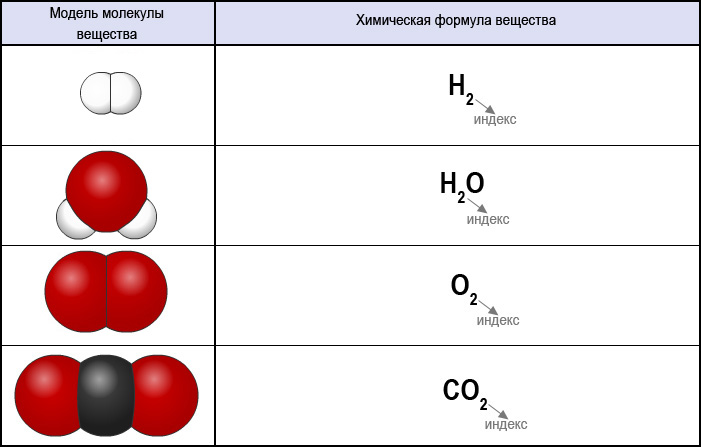 Положительно заряженные атомы натрия и отрицательно заряженные хлориды находят удобный дом среди поляризованных молекул воды.
Положительно заряженные атомы натрия и отрицательно заряженные хлориды находят удобный дом среди поляризованных молекул воды.
Но вода также может растворять вещества, не состоящие из ионов, например сахара. Однако вместо того, чтобы разделять отдельные атомы молекулы сахара, молекулы воды прокладывают себе путь между каждой молекулой сахара, находя слабозаряженные части для водородной связи. Это ослабляет связи между молекулами сахара, отталкивая их друг от друга и в конечном итоге превращая в раствор.
«Пока присутствует один атом, который заставляет другую молекулу взаимодействовать с водой, вода будет это делать», — говорит Парр.
Становится странно
Вода не всегда ведет себя так, как ожидалось. Хотя он чаще всего переходит из твердого состояния (льда) в жидкое, а затем в газообразное (пар или пар) и наоборот, когда его температура поднимается и падает, он может совершить прыжок прямо из льда в пар при правильных условиях.
«Если вы когда-нибудь замечали, что ваши кубики льда со временем становятся меньше, то это потому, что они сублимируются в морозильной камере — лед сразу превращается в газ», — объясняет Парр. Эта сублимация происходит из-за низкой влажности внутри морозильной камеры, что позволяет нескольким молекулам воды выходить из льда в воздух без предварительного таяния.
Эта сублимация происходит из-за низкой влажности внутри морозильной камеры, что позволяет нескольким молекулам воды выходить из льда в воздух без предварительного таяния.
В обратном процессе, называемом отложением, газообразная вода внезапно замерзает, так и не превратившись в жидкость. Так образуется снег. И когда условия подходящие, снег может пропустить стадию таяния и сублимировать обратно в атмосферу, что является особой проблемой для подверженных засухе районов, таких как Калифорния, которые полагаются на таяние снежного покрова в качестве источника воды.
Но вода может быть еще более странной.
«Лед имеет множество различных кристаллических форм, но он также может существовать в форме, напоминающей стекло — аморфное твердое вещество, которое находится где-то между жидкостью и твердым телом и все еще может течь», — говорит Парр. По словам Парра, когда молекулы воды сливаются при очень низких температурах и давлениях — представьте себе космическое пространство — образующийся лед также может вести себя как стекло.