Молекула Кислорода дифторидная структура Льюиса, др., разное, химический элемент, другие png
Молекула Кислорода дифторидная структура Льюиса, др., разное, химический элемент, другие pngтеги
- разное,
- химический элемент,
- другие,
- сфера,
- nailart,
- льюис,
- структура,
- трехмерное пространство,
- красный,
- точка,
- озоновый слой,
- озон,
- кислород Дифторид,
- кислород,
- круг,
- молекула,
- молекулярная вибрация,
- молекулярная модель,
- газ,
- сила Ван-дер-Ваальса,
- png,
- прозрачный,
- бесплатная загрузка
Об этом PNG
- Размер изображения
- 1024x1024px
- Размер файла
- 118.13KB
- MIME тип
- Image/png
изменить размер PNG
ширина(px)
высота(px)
Лицензия
Некоммерческое использование, DMCA Contact Us
 36KB
36KB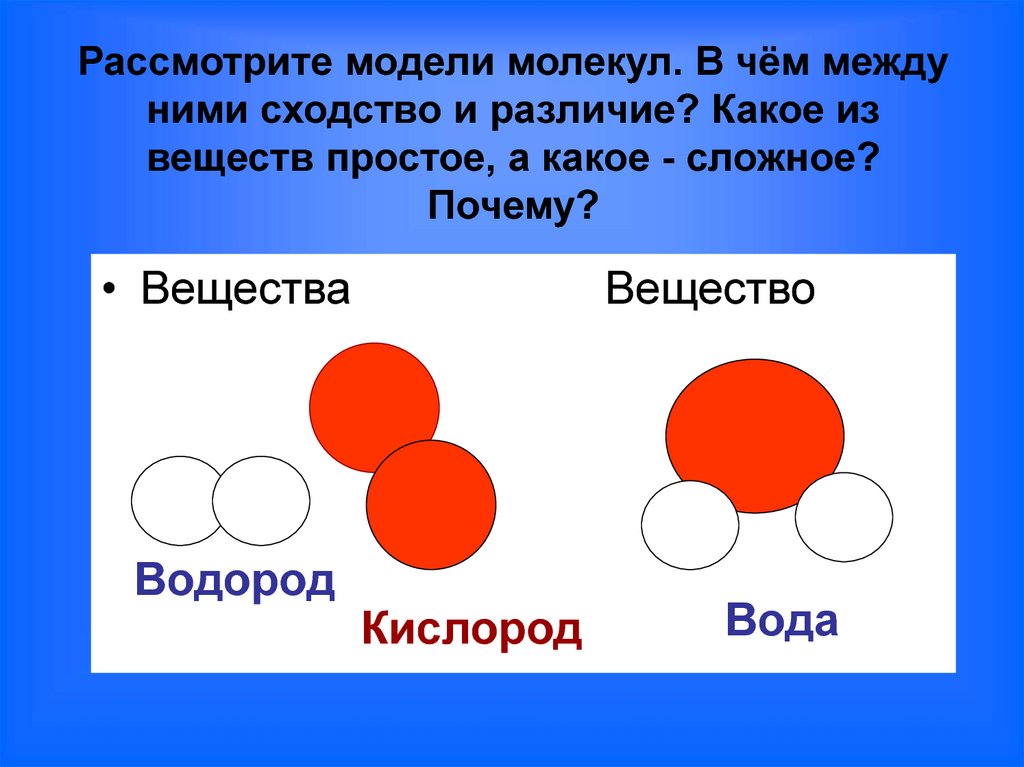
 42KB
42KB
 9KB
9KB 92KB
92KBМолекула кислорода рисунок (45 фото) » Рисунки для срисовки и не только
Формула водорода и кислорода в химии
Скачать
Шаростержневая модель молекулы водорода
Скачать
Строение атома кислорода 2-
Скачать
Строение молекулы кислорода
Скачать
Молекула трехатомная озона
Скачать
Молекула кислорода
Скачать
Модель молекулы кислорода
Скачать
Строение молекулы кислорода
Скачать
Формула строения молекулы кислорода
Шаростержневая модель кислорода
Скачать
2 Молекулы кислорода
Скачать
Схема молекулы кислорода
Скачать
Строение молекулы o2
Скачать
Озон формула
Скачать
Гелий молекула модель
Скачать
2 Молекулы кислорода
Скачать
Модель молекулы кислорода
Схема образования озона
Скачать
Молекула водорода н2
Скачать
Шаростержневая модель водорода
Скачать
Озон структурная формула молекулы
Скачать
Формула кислорода
Скачать
Молекула озона o3
Скачать
2 Молекулы кислорода
Скачать
2 Молекулы кислорода
Скачать
2 Молекулы кислорода
Скачать
Молекула озона формула и строение
Скачать
Кислород o2 молекула
Скачать
Молекула кислорода
Скачать
Молекула o2
Скачать
Шаростержневая модель молекулы азота
Скачать
Модель молекулы кислорода
Скачать
Шаростержневая модель кислорода
Скачать
Молекула озона o3
Скачать
Молекула кислорода
Молекула Льюиса
Скачать
О3 строение молекулы
Скачать
2 Молекулы кислорода
Скачать
Молекула воды
Скачать
Молекула 3
Скачать
Молекула о3 химия
Скачать
Шаростержневая модель азота
Скачать
Атом кислорода
Скачать
Скачать
Чертеж, несколько соединений и подробные пояснения —
Кислород Точечные структуры Льюиса с самим собой и другими элементами могут быть использованы для определения образования химической связи.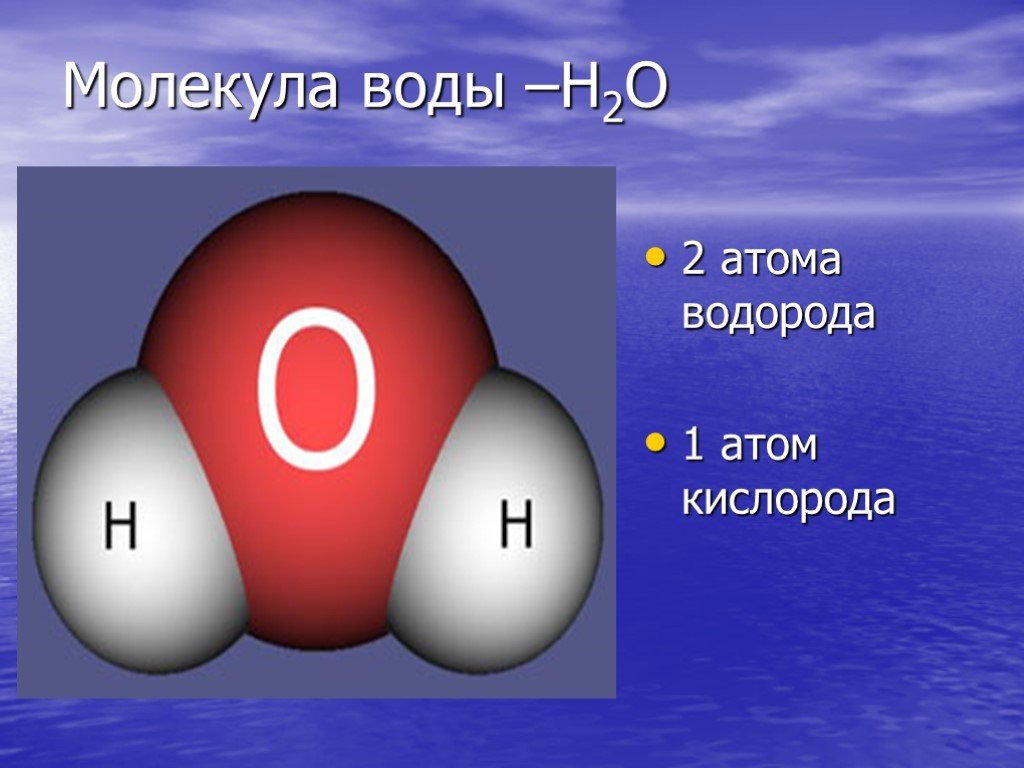 В этой статье схематически обсуждаются различные кислородные точечные структуры Льюиса, а также их подробное объяснение.
В этой статье схематически обсуждаются различные кислородные точечные структуры Льюиса, а также их подробное объяснение.
Атомный номер кислорода 8 и его электронная конфигурация 2,6. Это означает, что атом кислорода имеет шесть электронов в своей самой внешней оболочке, также называемой валентной оболочкой, и для достижения стабильной конфигурации благородного газа 2,8 (октета) неона ему нужны еще два электрона. Таким образом, для достижения этой стабильности один атом кислорода делится своими двумя электронами с двумя электронами другого атома кислорода, образуя двойную связь между двумя атомами кислорода.
Поскольку эта двойная связь образуется за счет совместного использования двухэлектронных пар, ее называют двойной ковалентной связью. Самые внешние электроны, участвующие в обмене, называются общими парами электронов, а самые внешние электроны, не участвующие в обмене, называются неподеленными парами электронов. Следовательно, образуется стабильная молекула кислорода с формулой O 2 .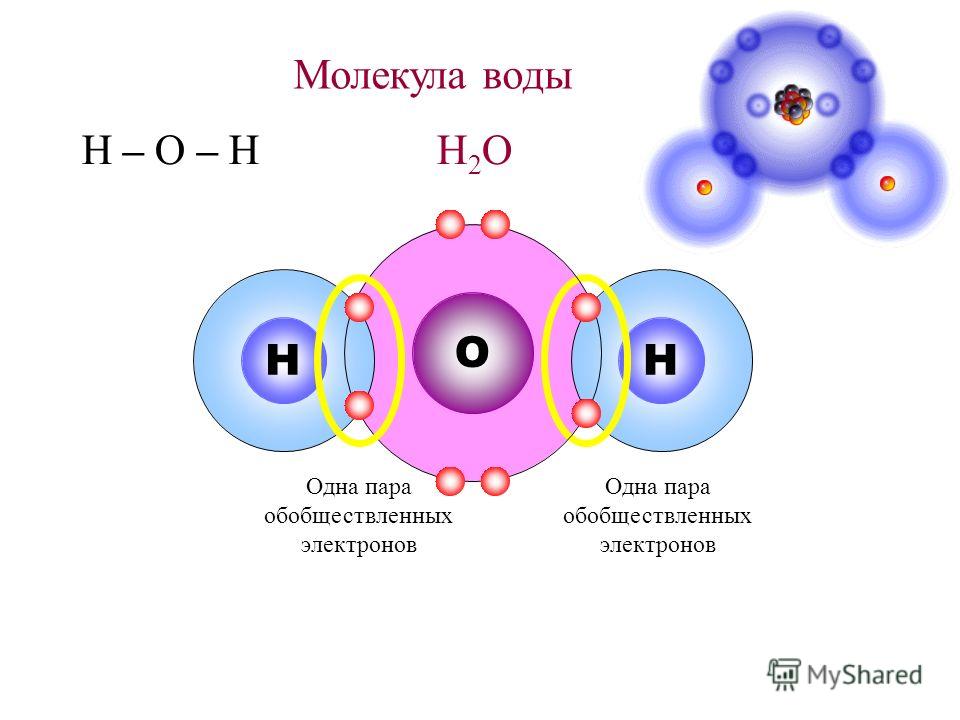
Самый простой способ понять структурное представление и точечную структуру Льюиса, который работает с любым атомом, молекулой и соединением, приведен ниже:
- Подсчитайте общее количество валентных электронов (12 электронов в случае молекулы кислорода, по 6 от каждого атома кислорода).
- Рассчитайте необходимые электроны (в соответствии с правилом октета это 8 в атоме кислорода и 16 в молекуле кислорода). молекулы кислорода)
- Рассчитайте количество несвязывающих электронов (количество несвязывающих электронов = валентные электроны – связывающие электроны, 12-4 = 8 в случае молекулы кислорода)
Подчеркнув эти четыре шага, затем нет. связывающих электронов информирует о наличии двойной связи в вышеупомянутом случае. Количество несвязывающих электронов указывает на наличие неподеленной пары электронов. В приведенном выше случае имеется 8 неподеленных пар электронов, что при делении на 2 дает количество электронов на атом кислорода (4). Следовательно, есть 2 неподеленные пары электронов.
Следовательно, есть 2 неподеленные пары электронов.
Интересным фактом о молекуле O2 является то, что она является парамагнитной из-за наличия неспаренных электронов. Хотя этот факт не может быть объяснен точечной структурой Льюиса кислорода и требует довольно сложной схемы молекулярных орбиталей O2. Теперь давайте обсудим точечную структуру кислорода Льюиса с различными элементами, показанными ниже:0003
Кислород в точечной структуре Льюиса (ион) Ион кислорода представлен как O 2- . Он имеет двойной отрицательный заряд, полученный за счет присоединения 2 электронов. Это легко объяснить точечной структурой Льюиса. Согласно периодической таблице кислород (атомный номер = 8 и электронная конфигурация = 2,6) принадлежит к группе 16 th , поэтому атом кислорода имеет 6 электронов в своей валентной оболочке. Таким образом, чтобы достичь стабильности в соответствии с правилом октета, он должен получить два электрона и превратиться в анион вместо своей элементарной формы. Это также подчеркивает, что атомы кислорода могут не только делиться, но и приобретать электроны для достижения стабильности.
Это также подчеркивает, что атомы кислорода могут не только делиться, но и приобретать электроны для достижения стабильности.
Структуру Льюиса атома кислорода показать относительно легче, поскольку она не включает в себя какое-либо совместное использование или перенос электронов. На схеме атома кислорода показан валентный электрон элемента. Поскольку атом кислорода (атомный номер = 8 и электронная конфигурация = 2,6) принадлежит к группе 16 в периодической таблице, он будет окружен 6 валентными электронами. Но значение имеет спаривание валентных электронов вокруг атома кислорода. Обычно у него есть каждая пара электронов с двух сторон, а остальные две стороны имеют неспаренные электроны.
Кислород Точечная структура Льюиса с водородом
Точечная структура Льюиса водорода и кислорода приводит к образованию воды (h3O). Атом водорода (атомный номер = 1 и электронная конфигурация = 1) имеет один электрон на валентной оболочке.![]() Таким образом, требуется всего один электрон, чтобы достичь стабильной конфигурации, ближайшей к благородному газу гелию. Точно так же атому кислорода (атомный номер = 8 и электронная конфигурация = 2,6) не хватает 2 электронов, чтобы достичь целевого октета, ближайшего к конфигурации благородного газа Неон. Таким образом, в этом случае каждый электрон 2 атомов водорода взаимно делится с 2 валентными электронами одного атома кислорода, образуя молекулу воды.
Таким образом, требуется всего один электрон, чтобы достичь стабильной конфигурации, ближайшей к благородному газу гелию. Точно так же атому кислорода (атомный номер = 8 и электронная конфигурация = 2,6) не хватает 2 электронов, чтобы достичь целевого октета, ближайшего к конфигурации благородного газа Неон. Таким образом, в этом случае каждый электрон 2 атомов водорода взаимно делится с 2 валентными электронами одного атома кислорода, образуя молекулу воды.
Точечная структура Льюиса для лития и кислорода показывает образование оксида лития (Li2O). Это можно лучше объяснить визуально. Каждый атом лития (атомный номер = 3 и электронная конфигурация = 2,1) теряет один валентный электрон, который одновременно приобретается атомом кислорода. Это приводит к тому, что литий-ион имеет +1 заряд, каждый из которых ближе всего к конфигурации инертного газа гелий. Заряды на литий как 2 [Li + ] и на кислороде как [O 2- ] связаны с потерей и приобретением электрона соответственно.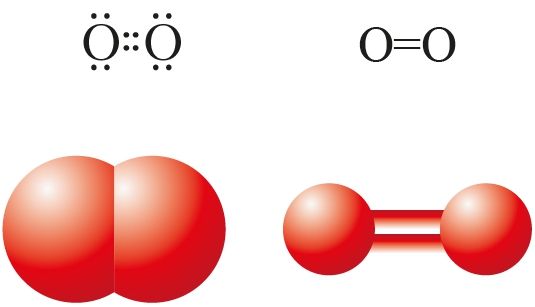
Точечная структура Льюиса бериллия и кислорода относительно проста. Бериллий (атомный номер = 4 и электронная конфигурация = 2,2) принадлежит к 2 -й -й группе периодической таблицы и имеет 2 валентных электрона. Кислород принадлежит к 16 й группе периодической таблицы и имеет 6 валентных электронов. Таким образом, чтобы достичь стабильности в соответствии с правилом октета, бериллий теряет свои 2 электрона, которые приобретает кислород. Точно так же бериллий превращается в Be 9.0034 2+ , а кислород превращается в анион O 2-, образуя оксид бериллия (BeO).
Кислород Точечная структура Льюиса с углеродом С углеродом и кислородом можно сформировать две точечные структуры Льюиса в соответствии с разделением между электронами для достижения стабильности. Этими структурами являются двуокись углерода (CO 2 ) и окись углерода (CO).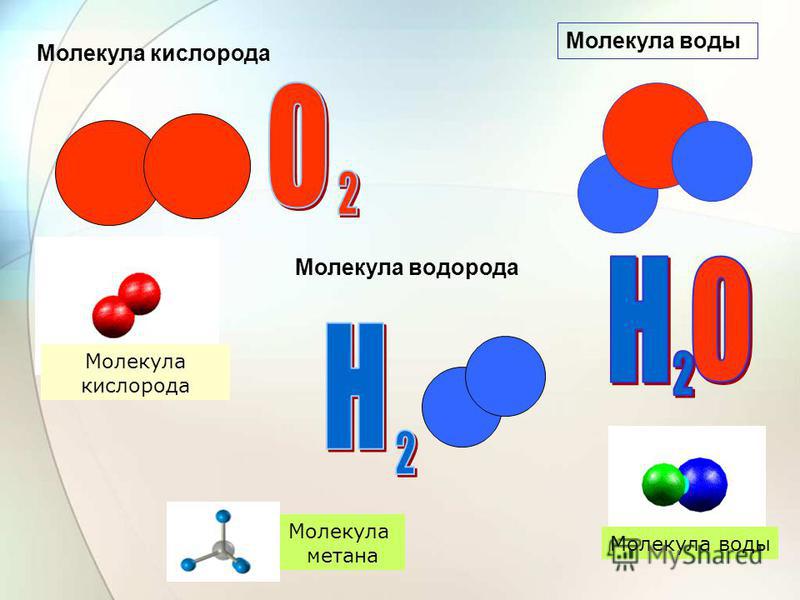
Акцентируя внимание на двуокиси углерода, чтобы завершить свой октет, один атом углерода (атомный номер = 6 и электронная конфигурация = 2,4) должен соединиться с 2 атомами кислорода. Углерод имеет 4 валентных электрона и требует еще 4 электрона, а кислород имеет 6 валентных электронов и требует еще 2 электрона для достижения стабильности. Таким образом, существует совместное использование электронов между двумя атомами кислорода и атомом углерода, которое представлено двойной ковалентной связью.
В случае угарного газа для достижения стабильности требуется завершение октета между одним атомом углерода и атомом кислорода. Здесь происходит разделение 2 пар электронов между атомами углерода и кислорода. Для полной стабильности октета кислород отдает пару электронов углероду, образуя координационную связь между углеродом и кислородом. Это приводит к образованию тройной ковалентной связи.
Кислородная точечная структура Льюиса с фтором (OF 2 ) Точечное представление Льюиса OF 2 не очень сложно, поскольку оно включает одинарную связь.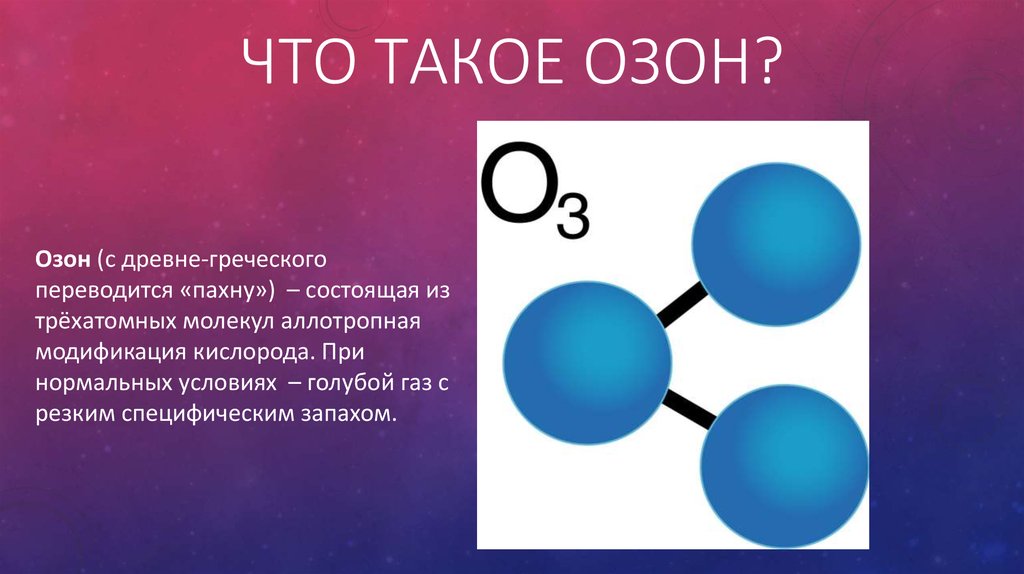 Атом кислорода находится в группе 16 с 6 валентными электронами, а атом фтора (атомный номер = 9 и электронная конфигурация = 2,7) находится в группе 17 с 7 валентными электронами. Кислород, будучи наименее электроотрицательным, будет находиться в центре двух атомов фтора. Таким образом, 2 электрона атома кислорода будут разделены с одним электроном каждого атома фтора с каждой стороны, тем самым завершая октет для каждого элемента.
Атом кислорода находится в группе 16 с 6 валентными электронами, а атом фтора (атомный номер = 9 и электронная конфигурация = 2,7) находится в группе 17 с 7 валентными электронами. Кислород, будучи наименее электроотрицательным, будет находиться в центре двух атомов фтора. Таким образом, 2 электрона атома кислорода будут разделены с одним электроном каждого атома фтора с каждой стороны, тем самым завершая октет для каждого элемента.
Натрий (атомный номер = 11 и электронная конфигурация = 2,8,11) принадлежит к группе 1 st в периодической таблице и должен потерять 1 электрон, чтобы образовать Na + и получить стабильную конфигурацию благородных газов. С другой стороны, кислород принадлежит к группе 16 и должен получить 2 электрона, чтобы завершить стабильность октета. Таким образом, каждый атом натрия теряет электрон, который приобретается кислородом, что приводит к образованию Na 2 O. Здесь 2[Na + ] и [O 2- ] удерживаются сильными электростатическими силами.
Здесь 2[Na + ] и [O 2- ] удерживаются сильными электростатическими силами.
Магний (Атомный номер = 12 и электронная конфигурация = 2,8,2) принадлежит к 2 й группе в периодической таблице и должен потерять 2 электрона для достижения стабильности. С другой стороны, кислород получает эти 2 электрона, чтобы завершить свой октет. Таким образом, Mg 2+ и O 2- , будучи одинаково и противоположно заряженными, притягиваются друг к другу и образуют MgO, который удерживается вместе сильными электростатическими силами.
Кислород Точечная структура Льюиса с алюминием Структура, образованная алюминием (атомный номер = 13 и электронная конфигурация = 2,8,3) и кислородом, представляет собой оксид алюминия (Al 2 O 3 ). Al 2 O 3 является ионным соединением, что означает наличие переноса электронов между алюминием и кислородом. Таким образом, алюминий принадлежит к 13-й группе в периодической таблице и имеет 3 валентных электрона, а кислород принадлежит к 16-й группе и имеет 6 электронов. Алюминий, будучи менее электроотрицательным, отдаст свои 3 электрона, а кислород, будучи более электроотрицательным, получит их. Следовательно, 2 атома алюминия превратятся в 2[Al 9Катион 0034 3+ } и 3 атома кислорода превратятся в анионы 3[O 2- ].
Таким образом, алюминий принадлежит к 13-й группе в периодической таблице и имеет 3 валентных электрона, а кислород принадлежит к 16-й группе и имеет 6 электронов. Алюминий, будучи менее электроотрицательным, отдаст свои 3 электрона, а кислород, будучи более электроотрицательным, получит их. Следовательно, 2 атома алюминия превратятся в 2[Al 9Катион 0034 3+ } и 3 атома кислорода превратятся в анионы 3[O 2- ].
Приводит к образованию SiO 2 . Кремний (атомный номер = 14 и электронная конфигурация = 2,8,4) имеет 4 валентных электрона, а кислород имеет 6 валентных электронов. Таким образом, чтобы завершить свой октет, 2 атома кислорода поделятся своими электронами с одним атомом кремния. Образуется двойная ковалентная связь.
Кислород точечная структура Льюиса с хлором (OCl 2 ) Хлор (атомный номер = 17 и электронная конфигурация = 2,8,7) принадлежит к группе 17 периодической таблицы и нуждается в 1 электроне для завершения своей стабильной благородной газовая конфигурация. Кислород, с другой стороны, принадлежит к группе 16, и ему не хватает 2 электронов для достижения конфигурации благородного газа. Таким образом, кислород станет центральным атомом и будет делить каждый электрон от двух атомов хлора. Это приводит к образованию OCl2, в котором образуется одинарная ковалентная связь между участвующими атомами
Кислород, с другой стороны, принадлежит к группе 16, и ему не хватает 2 электронов для достижения конфигурации благородного газа. Таким образом, кислород станет центральным атомом и будет делить каждый электрон от двух атомов хлора. Это приводит к образованию OCl2, в котором образуется одинарная ковалентная связь между участвующими атомами
Точечная структура Льюиса калия (атомный номер 19 и электронная конфигурация = 2,8,8,1) находится на той же линии, что и у натрия и кислорода. Калий относится к 1-й группе периодической таблицы и для достижения стабильности должен потерять 1 электрон. С другой стороны, кислород должен получить 2 электрона, чтобы завершить свою стабильность. Таким образом, каждый атом калия отдает 1 электрон кислороду, что приводит к образованию ионного соединения K2O, и ионы удерживаются вместе сильными электростатическими силами.
Кислород в точечной структуре Льюиса с кальцием Кальций (атомный номер = 20 и электронная конфигурация = 2,8,8,2) теряет 2 электрона для достижения стабильности, а кислород, как упоминалось несколько раз, должен получить 2 электрона для достижения стабильности .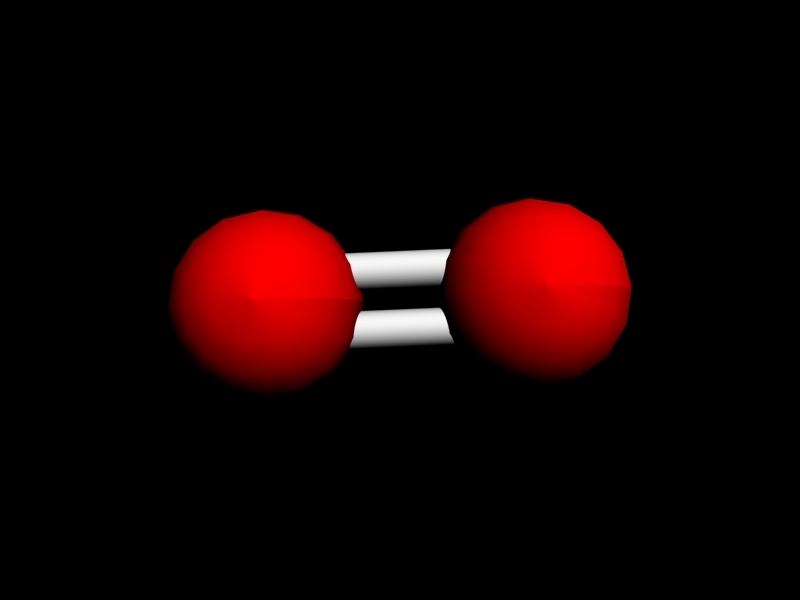 Теперь из-за этого переноса электронов кальций и кислород приобретут противоположный заряд и образуют ионное соединение CaO
Теперь из-за этого переноса электронов кальций и кислород приобретут противоположный заряд и образуют ионное соединение CaO
Кислород Структура Льюиса совершенно симметрична и неполярна. Кроме того, неполярные молекулы обычно представляют собой газы по своей природе, поэтому между молекулой дикислорода и газообразным кислородом нет большой разницы
Роль крайних электронов в точечной структуре кислорода Самые внешние электроны называются валентными электронами. Они ответственны за образование химических связей и реакции, потому что они слабо связаны с ядром. Из-за меньшей силы связывания ядер они могут легко участвовать в обмене и переносе электронов. С другой стороны, по мере того, как мы движемся от валентных электронов к внутренним электронам, ядерная связь увеличивается, что затрудняет их участие в любом образовании связи и реакции.
Структуры Льюиса отражают движение и присутствие электронов в соединении в соответствии с его коэффициентом стабильности. Он легко показывает количество атомов, валентных электронов и связей. Однако молекулярная форма соединений находится под влиянием различных сил между атомами и зависит от валентных углов и длин связей
Структура Льюиса h3O.0001
Вода, один из основных компонентов Земли, имеет молекулярную формулу H 2 O. Молекула воды состоит из двух атомов водорода и одного атома кислорода, которые соединены ковалентной связью. Кроме того, две или более молекулы H 2 O соединяются водородными связями, образуя соединение.
Структура Льюиса, также известная как структура электронных точек, представляет собой схематическое представление определения общего числа валентных электронов, присутствующих в атоме, которые готовы образовать связи для образования молекулы и, в конечном итоге, соединения.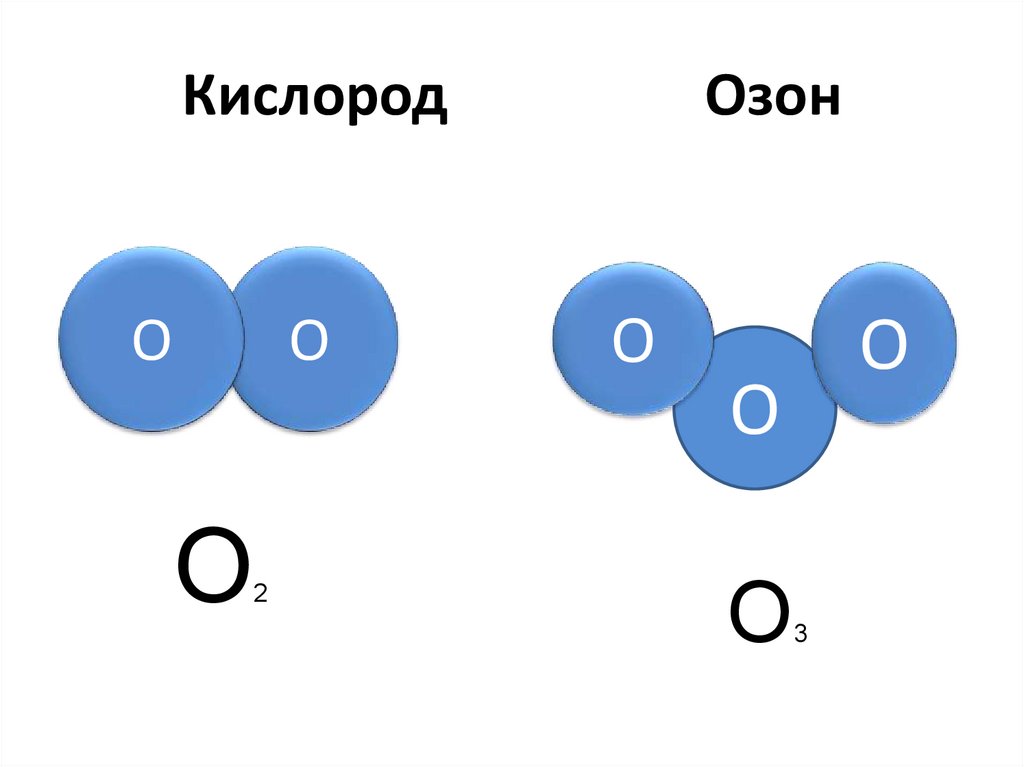
Содержание
- Как нарисовать структуру Льюиса для H 2 O
- Молекулярная геометрия H 2 O
- Гибридизация H 2 O
- Полярность H 2 O
- Часто задаваемые вопросы – Часто задаваемые вопросы
Как нарисовать структуру Льюиса для H
2 OСледующие шаги должны быть выполнены при построении структуры Льюиса для H 2 O-
1. Определить общее число электронов на валентных оболочках атомов водорода и кислорода.
В периодической таблице-
Водород является элементом группы IA с одним электроном в самой внешней оболочке (валентной оболочке).
Кислород — элемент группы VIA с шестью электронами на последней оболочке.
Таким образом, общее количество валентных электронов, необходимых для построения структуры Льюиса H 2 O= 1(2)+6 = 8 валентных электронов.
2. Определить общее количество электронных пар в виде неподеленных пар и связей.
Определить общее количество электронных пар в виде неподеленных пар и связей.
Общее количество электронных пар рассчитывается путем деления общего числа валентных электронов на два. В случае H 2 O общее число электронных пар в их валентных оболочках равно четырем.
3. Выбор центрального атома.
Способность иметь более высокую валентность важна для того, чтобы быть центральным атомом. Следовательно, кислород будет центральным атомом.
4. Пометить атом неподеленными парами.
- Всего имеется четыре пары электронов с двумя связями H-O, уже присутствующими в структуре эскиза.
- Осталось пометить только две пары электронов на атомах, чего нельзя сделать на внешних атомах – водороде, так как он не может удерживать более двух электронов в своей последней оболочке.
- В результате на центральном атоме – кислороде отмечаются две электронные пары.
5. Если на атомах есть заряды, отметьте их.
Если на атомах есть заряды, отметьте их.
Атомы кислорода и водорода не имеют заряда.
6. Чтобы получить наилучшую структуру Льюиса, минимизируйте заряды на атомах путем преобразования неподеленных пар в связи.
Поскольку на атомах нет зарядов, нет необходимости уменьшать заряды в процессе рисования наилучшей структуры Льюиса. У нас уже есть лучшая структура Льюиса для H 2 O.
7. Проверить стабильность каждого атома
Можно проверить по формуле-
Формальный заряд = валентные электроны – несвязанные электроны – ½ связанные электроны
| Элементы | Кислород | Водород |
|---|---|---|
| Применяемая формула | валентных электронов = 6 неподеленных пары электронов = 4 Общая пара электронов (2 одинарных связи) = 4 | валентных электронов = 1 неподеленная пара электронов = 0 Общая пара электронов (1 одинарная связь) = 2 |
| Официальная оплата | (6 – 4 – 4/2) = 0 | (1 – 0 – 2/2) = 0 |
Поскольку общий формальный заряд равен нулю, приведенная выше структура Льюиса H 2 O является наиболее подходящим, надежным и стабильным по своей природе.
Молекулярная геометрия H
2 OАтом кислорода образует две одинарные сигма-связи с атомами водорода в молекуле H 2 O. Хотя эти два атома водорода расположены симметрично в плоскости, две неподеленные пары электронов на атоме кислорода толкают эти атомы.
Поскольку силы отталкивания неподеленных пар больше, чем силы отталкивания связанных пар, расположение атомов искажается. В результате молекулярная геометрия молекулы воды имеет угловатую или V-образную форму.
Валентный угол в молекуле воды (104,5°)
Гибридизация H
2 OСтруктура Льюиса показывает две одинарные сигма-связи между атомами кислорода и водорода. Кроме того, эти связи оставляют атом кислорода с двумя неподеленными парами электронов.
Гибридизация молекулы H 2 O имеет вид sp 3 , поскольку она имеет одну s-орбиталь и три p-орбитали, которые объединяются в четыре гибридные орбитали.
Полярность H
2 O Вода H 2 O – полярное вещество.

