Реакция — разложение — вода
Cтраница 1
Реакция разложения воды является наиболее характерной для щелочных металлов. [1]
| Сопоставление потенциалов разных электродов в растворах редокс-системы Се4 3. [2] |
Реакция разложения воды: 2Се Н2О — — 2Се3 1 / 2О2 2Н, которая должна протекать активно, учитывая значения формальных потенциалов системы. [3]
При изучении реакции электрохимического разложения воды в присутствии окислительно-восстановительных ферментов — гидрогеназ — было установлено, что их эффективность значительно возрастает, если фермент включен в полимерные матрицы, обладающие электронной проводимостью. [4]
Химически активные материалы являются катализаторами реакции разложения воды. [5]
Рассмотрение химического равновесия при наличии нескольких реакций разложения воды
 Как известно, число корней уравнения равно его степени.
[6]
Как известно, число корней уравнения равно его степени.
[6]Имея в виду, что теоретический предел энергозатрат реакции разложения воды составляет 3 эВ / моль, КПД описанного процесса составит 90 — 97 / о в зависимости от параметров системы. Учитывая расход тепла на процесс испарения воды и на потери тепла в системе, авторы исследования считают, что на получение 1 м3 Н2 таким методом энергетические затраты составят 3 5 кВт — ч, против 6 кВт — ч при обычном электролизе. Кроме того, авторы отмечают более простое технологическое оформление процесса. [7]
Данные по теплотам хемосорбции были получены путем измерения равновесий
Примером такой задачи является поиск химических рабочих тел для осуществления реакций разложения воды на водород и кислород в замкнутом цикле при наличии ограничений на температуру. [9]
[9]
Потеря некоторого количества электричества обусловливается побочными реакциями, из которых главное значение имеет реакция разложения воды во время заряда аккумулятора. Известное значение здесь имеет также отделение активной массы от электродов. [10]
| Зависимость. — рН для платиновых ( X, золотых ( и стеклянных ( Д, ЭО-01, ( О, ЭО-021 электродов. [11] |
Из этого следует, что хотя система СlOj 1 обладает ярко выраженными окислительными свойствами, но от кислых до нейтральных растворов реакцию разложения воды можно не учитывать. [12]
Расход энергии в балансе электролизера состоит из теплового эффекта реакции разложения хлорида натрия и воды на хлор, водород и гидроокись натрия и реакции разложения воды на водород и кислород, а также физического тепла, уносимого из электролизера катодными щелоками, хлором и водородом, энтальпии паров воды, уносимых из электролизера газообразными продуктами электролиза, и потерь тепла через стенки аппарата в окружающую среду.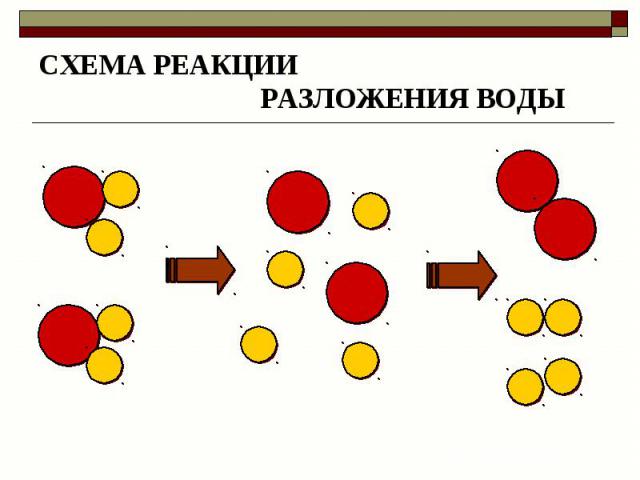
Расход энергии в балансе электролизера будет включать тепловой эффект реакции разложения хлорида натрия и воды на хлор, водород и гидроокись натрия, а также реакции разложения воды на водород и кислород, физическое тепло, уносимое из электролизера с катодными щелоками, хлором и водородом, энтальпию паров воды, уносимых из электролизера с газообразными продуктами электролиза, и потери тепла стенками аппарата в окружающую среду. [14]
| Изменение потенциала во времени после включения тока для замедленной электрохимической стадии при л 25 мВ. / — С 50 мкФ / см2. / КГ2 А / см2, т, 0 24 В, 1 / 1, 100. 2 — С 50 мкФ / см1. / 10 2А / см2, Т 0 36 В, J / t, 1000. [15] |
Страницы: 1 2 3
Типы химических реакций на примере свойств воды
Урок 32. Химия 8 класс
Предлагается видеофрагмент, который сделает данную тему легче и привлечет внимание учащихся, здесь рассматриваются все пройденные типы реакций на примере свойств воды.
Конспект урока «Типы химических реакций на примере свойств воды»
Для воды характерна реакция разложения – электролиз воды. Он протекает под действием электрического тока в специальном устройстве – электролизёре. В результате образуется два газа – кислород и водород.
2Н2О 2Н2↑+ О2↑
Растения также разлагают воду в процессе фотосинтеза.
Если веточку водного растения элодеи поместить в специальный прибор и выставить на яркий свет, то уже через 10-15 мин начнет выделяться кислород, в результате разложения воды на свету, т.е. происходит
 Совокупность
всех этих реакций и называют процессом фотосинтеза. В результате
фотосинтеза из углекислого газа и воды образуется глюкоза и кислород.
Совокупность
всех этих реакций и называют процессом фотосинтеза. В результате
фотосинтеза из углекислого газа и воды образуется глюкоза и кислород.6СО2 + 6Н2О = С6Н12О6 + 6О2
Для воды также характерны и реакции соединения. Если в фарфоровую чашечку поместить несколько кусочков негашеной извести, а затем прилить к ним немного воды, то когда вода впитается, над чашечкой появиться пар. Т.о. мы «погасили» негашеную известь водой. В результате этой реакции образуется новое вещество – гашеная известь.
СаО + Н2О = Са(ОН)2
негашеная гашеная
известь известь
Все оксиды металлов I A группы главной подгруппы и металлы IIA группы: Ca
 Поэтому металлы I
A группы
главной подгруппы называют щелочными металлами, а металлы II
A группы, как Ba,
Ca, Sr
–
щелочноземельными.
Поэтому металлы I
A группы
главной подгруппы называют щелочными металлами, а металлы II
A группы, как Ba,
Ca, Sr
–
щелочноземельными.При взаимодействии с водой оксидов неметаллов будут образовываться соответствующие кислоты, где неметалл будет иметь туже степень окисления, как и в оксиде. Например, в реакции оксида фосфора (V) образуется фосфорная кислота, в которой степень окисления фосфора тоже +5.
P
Поэтому, основания и кислородсодержащие кислоты в химии называют гидроксидами.
Вода реагирует с оксидами металлов и
неметаллов только в том случае, если образуется растворимый гидроксид.
Например, с оксидом калия вода образует растворимое основание –
гидроксид калия, а вот с оксидом меди (II)
вода не реагирует, т.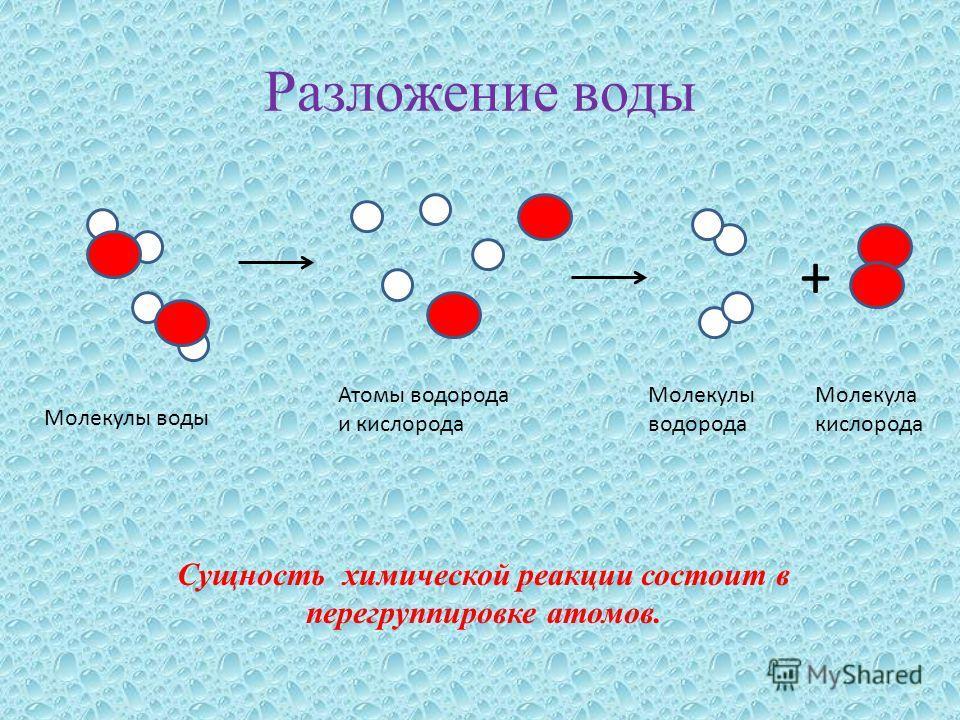 к. гидроксид меди (II)
нерастворимое в воде основание. Аналогично и с оксидами неметаллов: вода
реагирует
к. гидроксид меди (II)
нерастворимое в воде основание. Аналогично и с оксидами неметаллов: вода
реагирует
K2O + H2O = 2KOH
CuO + H2O ≠
SO3 + H2O = H2SO4
SiO2 + H2O ≠
Реакции замещения идут тогда, когда с водой реагируют щелочные или щелочноземельные металлы. При взаимодействии натрия с водой образуется щёлочь и водород.
2Na + 2H2O = 2NaOH + H
Эту реакцию можно наблюдать в следующем
опыте: нальем в чашку Петри воды, добавим туда несколько
капель фенолфталеина. Затем поместим маленький кусочек натрия.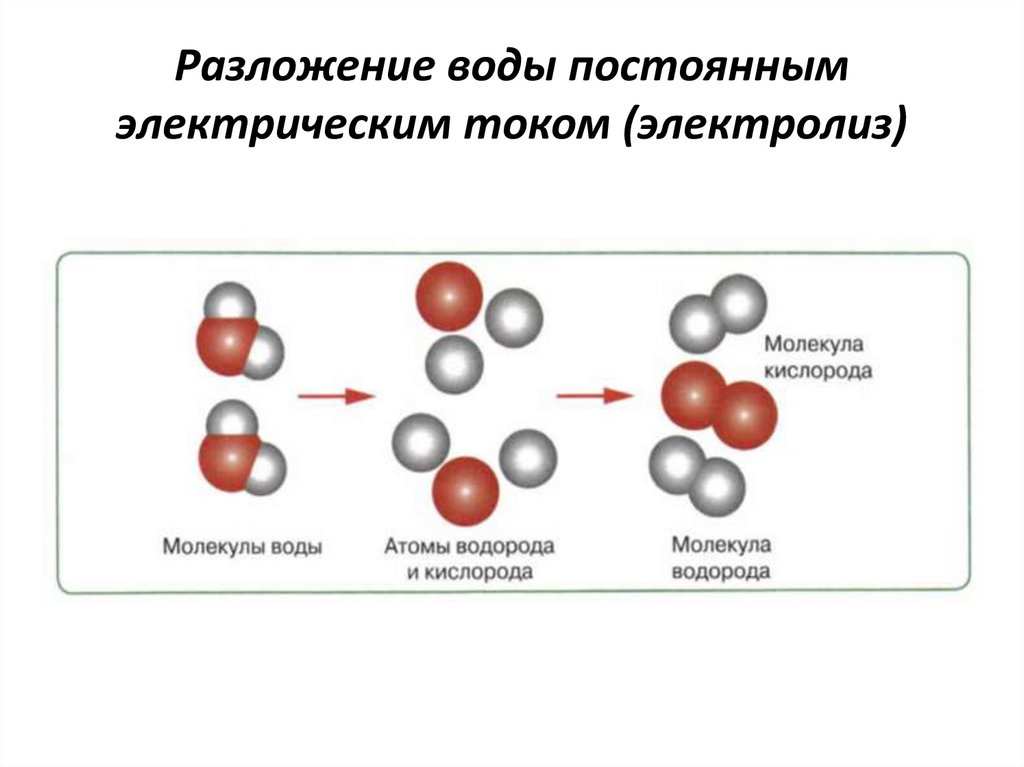 Кусочек натрия
округляется, т.к. начинает плавиться из-за образования большого количества
теплоты, «бегает» по поверхности воды, т.к. образующийся водород его
выталкивает, раствор при этом окрашивается в малиновый цвет, из-за образования
щёлочи.
Кусочек натрия
округляется, т.к. начинает плавиться из-за образования большого количества
теплоты, «бегает» по поверхности воды, т.к. образующийся водород его
выталкивает, раствор при этом окрашивается в малиновый цвет, из-за образования
щёлочи.
Реакции обмена с участием воды – это реакции гидролиза. Если в таблице растворимости в клетке стоит прочерк
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
При гидролизе карбида кальция
образуется газ – ацетилен и щелочь – гидроксид кальция. В этом легко убедиться,
если воду добавить кусочек карбида кальция, то можно заметить выделение газа
ацетилена, если в образовавшийся раствор капнуть несколько капель
фенолфталеина, то он окрасится в малиновый цвет.
Гидролиз протекает и в живых организмах и составляет основу их жизнедеятельности, как гидролиз жиров и белков.
Поэтому вода не только самое важное вещество на планете, но и соединение, обладающее разнообразными химическими свойствами.
Предыдущий урок 31 Реакции обмена
Следующий урок 33 Растворение как физико-химический процесс. Растворимость. Типы растворов
Получите полный комплект видеоуроков, тестов и презентаций Химия 8 класс
Чтобы добавить комментарий зарегистрируйтесь или войдите на сайт
Реакция разложения | Типы и классификация реакций разложения
Процесс, при котором химические вещества взаимодействуют друг с другом с образованием нового химического вещества с помощью различных составов, называется химическими реакциями, а также когда реагенты превращаются в продукты. Способы изменения состава элемента или соединения определяются химическими свойствами элемента или соединения.
Способы изменения состава элемента или соединения определяются химическими свойствами элемента или соединения.
Обычно химическая реакция представляется химическим уравнением, которое отражает переход от реагентов к продуктам. В химическом уравнении левая часть будет представлять реагенты, а правая часть будет представлять продукты реакции. Чтобы показать относительные количества реагентов и продуктов, участвующих в реакции, химическая реакция будет записана со стехиометрическими коэффициентами.
В химической реакции примечание в скобках о состоянии соединения будет дано для каждого соединения, т. е. для твердого вещества как (s), для жидкости как (l) и для газа как (g) и для водного раствора, в котором соединения растворяются в воде, будет использоваться символ (aq).
Форма химической реакции будет такой:
A (водн.) + B(g) → C(s) + D (водн.)
Здесь A и B реагируют вместе, образуя продукты C и D.
Чтобы получить точное химическое уравнение, должны присутствовать следующие вещи:
Все реагенты и продукты должны быть записаны с использованием их химических формул.
 Например H₂.
Например H₂.Количество атомов каждого элемента должно быть одинаковым в обеих частях уравнения. Чтобы сбалансировать количество атомов, их коэффициенты будут использоваться перед химическими формулами. Пример: 2Mg + O2 → 2MgO.
Осаждение или реакция двойного замещения
Осаждение – это реакция, происходящая при взаимодействии водных растворов катионов, являющихся положительно заряженными ионами, и анионов, являющихся отрицательно заряженными ионами. Осадок представляет собой нерастворимое твердое вещество, а оставшаяся жидкость представляет собой супернатант.
Кислотно-основная реакция или реакция нейтрализации
Реакция, происходящая при смешивании кислоты и основания, называется реакцией нейтрализации. Ионы H+ производятся кислотным веществом, а ионы OH- образуются щелочным веществом.
Соль и вода, являющиеся ионогенными соединениями, образуются в результате кислотно-щелочной реакции. Реакция между соляной кислотой и гидроксидом натрия является примером типичной кислотно-основной реакции.
Реакция между соляной кислотой и гидроксидом натрия является примером типичной кислотно-основной реакции.
Ниже приводится уравнение вышеупомянутой реакции:
HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H₂O(л)
В упомянутой выше реакции HCl и NaOH являются кислотой и щелочью, а солью является NaCl.
Окислительно-восстановительные или окислительно-восстановительные реакции
Когда степень окисления атомов, участвующих в реакции, изменяется, происходит окислительно-восстановительная реакция. Процесс, при котором степень окисления атома увеличивается, называется процессом окисления. Процесс, при котором степень окисления атома уменьшается, называется реакцией восстановления.
Реакция между газообразным водородом и газообразным фтором является примером окислительно-восстановительной реакции.
h3(г) + F2(г) → 2HF(г)
В вышеупомянутой реакции водород окисляется от степени окисления 0 до +1, поэтому он является восстановителем. При восстановлении от 0 до -1 фтор является окислителем.
При восстановлении от 0 до -1 фтор является окислителем.
Реакция горения
Тип окислительно-восстановительной реакции, во время которой топливо взаимодействует с окислителем с выделением энергии в виде тепла, называется реакцией горения. Такие реакции, при которых выделяется энергия, называются экзотермическими реакциями, а реакции, при которых происходит поглощение тепла, называются эндотермическими реакциями.
Ниже приведен пример реакции горения глюкозы.
C6h22O6 + 6O2 → 6CO2 + 6h3O
Реакции синтеза
Когда одно или несколько соединений объединяются вместе с образованием комплексного соединения, говорят, что происходит реакция синтеза.
Серебро в сочетании с газообразным кислородом с образованием оксида серебра является примером реакции синтеза.
2Ag + O2 → 2AgO
Реакция разложения
Реакция, противоположная реакции синтеза, называется реакцией разложения.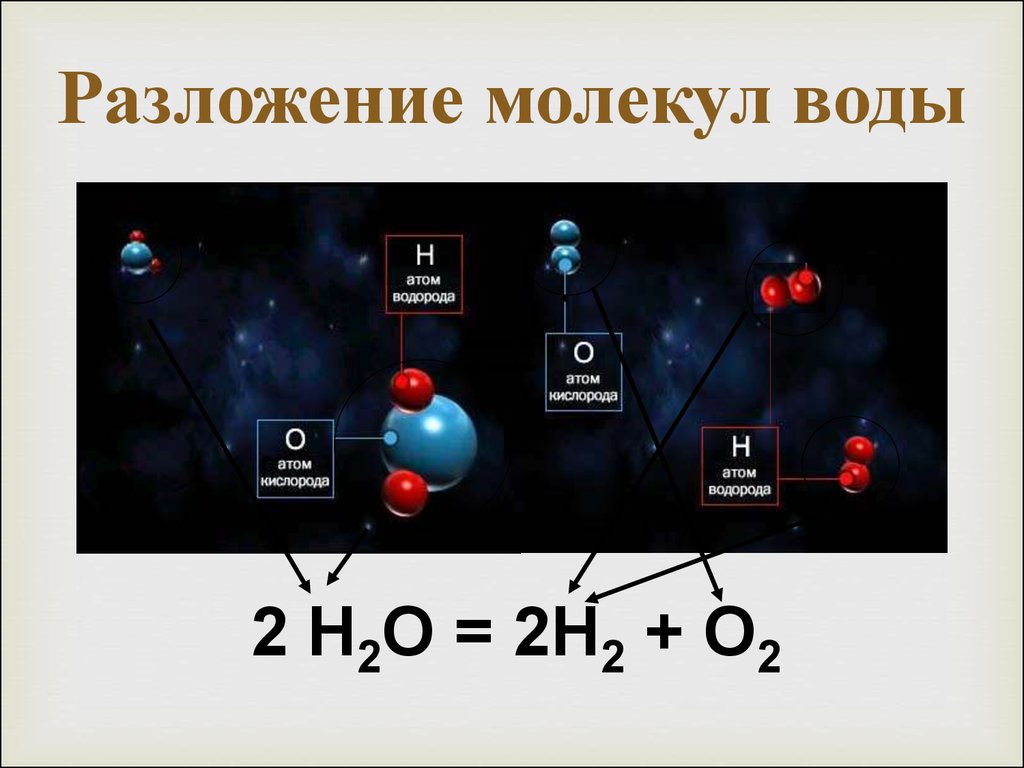 В процессе реакции разложения многие сложные соединения распадаются на множество более простых соединений.
В процессе реакции разложения многие сложные соединения распадаются на множество более простых соединений.
Разделение вещества или материала на два или более веществ или материалов, которые могут отличаться друг от друга и от исходного или уникального вещества, называется реакцией разложения.
От нашей повседневной жизни до химической лаборатории реакция разложения происходит повсюду. Процесс пищеварения — это тип реакции разложения, при которой пища расщепляется с образованием воды, углекислого газа и тепла, поэтому это важный тип реакции.
Распространенным примером реакции разложения является переваривание пищи в нашем организме. Здесь пища, такая как белки, жиры, углеводы и т. д., будет разлагаться на ряд более простых и меньших единиц. Чтобы наше тело продолжало работать, происходит дальнейшая реакция, высвобождающая большое количество энергии.
Разложение перекиси водорода на кислород и газообразный водород является типичным примером реакции разложения.
H₂O₂ → H₂ + O₂
Классификация реакции разложения
Реакция термического соединения или термолиз – это разложение под действием тепла. Реакция электролитического разложения или электролиз – это разложение с помощью электричества. Реакция фоторазложения или фотолиз – это разложение под действием света.
Реакции разложения можно разделить на три типа. Они следующие:
1. Реакция термического разложения
Химическая реакция, при которой одно вещество распадается на два или более простых вещества при нагревании, называется реакцией термического разложения. Поскольку для разрыва связей в веществе требуется тепло, эта реакция обычно эндотермическая.
Реакция разложения карбоната кальция
Известняк или кальций при нагревании разлагается на негашеную известь или оксид кальция и диоксид углерода. Основным компонентом цемента является негашеная известь.
Реакция разложения хлората калия
Хлорат калия разлагается на хлорид калия и кислород при сильном нагревании, и эта реакция используется для получения кислорода.
В присутствии двуокиси марганца, если разложение будет происходить при более низкой температуре. В качестве катализатора в этой реакции используется диоксид марганца.
Реакция разложения нитрата свинца
Если небольшое количество порошкообразного бесцветного нитрата свинца помещают в сухую пробирку и нагревают над горелкой, то можно наблюдать выделение бурых паров диоксида азота и желтого остатка оксида свинца. останется в трубе. Если горящую свечу положить на горлышко пробирки, она загорится и снова начнет гореть. Газообразный кислород также выделяется во время этой реакции, как показано здесь.
Реакция разложения гидратированной щавелевой кислоты
При разложении гидратированной щавелевой кислоты на щавелевую кислоту и воду получают при нагревании.
2. Реакция электролитического разложения:
Когда электрический ток пропускают через водный раствор соединения, это может привести к реакции электролитического разложения. Электролиз воды является хорошим примером реакции электролитического разложения.
Электролиз воды: Разложение воды на кислород и водород при прохождении через нее электрического тока называется электролизом воды.
Реакция разложения хлорида натрия
Когда электричество проходит через расплавленный хлорид натрия, он разлагается на натрий и хлор.
3. Фотореакция разложения или фотолиз
Реакция разложения хлорида серебра
цвет. Согласно анализу, разложение хлорида серебра на серебро и хлор вызвано солнечным светом.
Таким же образом разлагается бромид серебра.
Реакция разложения перекиси водорода
Разложение перекиси водорода на воду и кислород происходит в присутствии света.
Под действием света, тепла или электричества для большинства реакций разложения требуется энергия. Разрыв связей, присутствующих в реагирующем веществе, которое разлагается с образованием продукта, вызывается поглощением энергии.
Примеры реакций разложения:
При нагревании карбонаты разлагаются на оксиды металлов и углекислый газ.
CaCO₃ (т) → CaO (т) + CO₂ (г)
Na₂CO3 (т) → Na₂O (т) + CO₂ (г)
Разложение оксикислот приводит к образованию двуокиси углерода и воды.
H₂CO3 → H₂O (ж) + CO₂ (г)
Реакция двойного разложения
Реакция между двумя соединениями, в которой части каждого соединения заменяются местами с образованием двух новых соединений, называется реакцией двойного разложения. Реакция между двумя соединениями, при которой положительный ион одного соединения заменяется положительным ионом другого соединения, называется реакцией двойного замещения.
Использование реакции разложения
Для извлечения металлов реакции разложения используются следующими способами:
С помощью электролитического разложения металлы извлекаются из их расплавленных солей.
Пример: из встречающейся в природе руды цинка карбонат цинка сначала разлагается с образованием оксида цинка, а затем восстанавливается с получением металлического цинка.
Реакция разложения — это тип реакции, при которой связи разрываются и образуются новые. Реакции разложения можно классифицировать как экзотермические или эндотермические, в зависимости от того, выделяют ли они или поглощают тепло во время реакции. реакции разложения также классифицируются по количеству необходимых стадий. разложение может быть одностадийным или многостадийным процессом, в зависимости от того, требуется ли для его завершения одна или несколько отдельных реакций.
Разложение экзотермическое | разлагается на два более простых продукта, которые имеют более низкое содержание энергии в молекуле из-за выделения тепла во время этого типа реакции разложения Пример реакции: Металлический натрий реагирует с водным раствором гидроксида натрия с выделением газообразного водорода и эндотермическим разложением гидроксида натрия | разлагается на два более простых продукта, которые имеют более высокое содержание энергии в молекуле из-за поглощения тепла во время этого типа реакции разложения Пример реакции: Кристаллы нитрата аммония реагируют с водой с образованием водного раствора аммиака, газообразного кислорода и гидроксида аммония.
Одноэтапное разложение | разложение одного соединения путем разрыва его связей через одну индивидуальную стадию реакции. Это происходит, когда существует только одно химическое уравнение или результирующее ионное уравнение для каждого чистого элемента, участвующего в фазовом переходе.
Важность разложения
Реакции разложения используются для производства топлива и других химических веществ
Разложение метана на двуокись углерода и воду используется для производства угольного газа
Разложение этанола на этиленгликоль и воду используется для производства полиэфирных волокон
Разложение мочевины на аммиак и диоксид углерода используется при производстве удобрений производство пластмасс, лекарств и красителей.

Разложение используется для разложения опасных отходов
Реакции разложения используются для определения количества продукта в образце. реакции разложения используются для измерения уровня углекислого газа, образующегося при различных типах дыхания.
Разложение используется для проведения реакции разложения других химических соединений карбоната кальция (CaCO) соляной кислотой (HCl).
Разложение пищи играет важную роль в пищеварительной системе человека. расщепление белков, липидов и углеводов на аминокислоты, жирные кислоты и моносахариды обеспечивает организм питательными веществами, необходимыми ему для функционирования.
Вот несколько советов по изучению реакции разложения
Изучите концепцию.
 Важно изучить концепцию реакции разложения, потому что разложение является обычной реакцией в организме. Что поможет вам легче понять.
Важно изучить концепцию реакции разложения, потому что разложение является обычной реакцией в организме. Что поможет вам легче понять.Изучение механизма реакции разложения. Механизм реакции разложения — хороший способ изучить реакцию разложения. реакции разложения также имеют множество применений, поэтому механизм реакции разложения поможет вам лучше понять разложение.
Знайте задачи на декомпозицию — попробуйте попрактиковаться в задачах на декомпозицию, потому что это также поможет вам лучше понять декомпозицию.
Читайте статьи о разложении — вы можете прочитать статьи, рассказывающие о том, как реакции разложения используются в разных областях и как они работают. Это будет лучший способ изучения реакций разложения.
Изучите примеры реакций разложения — также важно, чтобы вы изучили некоторые примеры реакций разложения, которые вы можете найти в Интернете, и изучите их.

Узнайте о факторах, влияющих на скорость разложения — существуют различные факторы, влияющие на скорость разложения, такие как катализаторы, уровень pH и т. д. Чтобы узнать, как эти вещи разлагаются, вы сможете лучше изучить реакции разложения.
Избегайте зубрежки — изучение в последнюю минуту не поможет вам лучше понять реакцию разложения, на самом деле, вам будет труднее понять разложение. Поэтому старайтесь изучать реакцию разложения постепенно, и это поможет вам лучше понять реакцию разложения.
Появление на пробных тестах — участие в пробных тестах поможет вам лучше понять реакции разложения, а также поможет вам получить хорошие оценки по теме реакции разложения.
Руководство по изучению реакции разложения | Inspirit
Реакция разложения — это химическая реакция, при которой из одного реагента получаются два или более продуктов. Читайте дальше, чтобы узнать о его различных типах.
Читайте дальше, чтобы узнать о его различных типах.
ВВЕДЕНИЕ
Мы изучали химические реакции, в которых участвуют один или несколько реагентов, в результате которых образуются продукты. Одно из основных правил состоит в том, что левая сторона — это реагенты, а правая — продукты. Однако химические реакции можно разделить на различные типы, из которых реакции разложения являются основным типом.
Источник
ЧТО ТАКОЕ РЕАКЦИЯ РАЗЛОЖЕНИЯ?
Если в результате химической реакции два или более продуктов получаются только с одним реагентом, то такая химическая реакция называется реакцией разложения. Общая форма любой реакции разложения будет следующей:
AB → A + B.
Источник
Уравнения разложения также можно назвать реакциями анализа или даже химическими разложениями. Противоположностью реакции разложения будет синтез, при котором более одного реагента объединяются с образованием сложного продукта. Реакции разложения можно легко распознать, ища отдельные реагенты с более чем одним продуктом.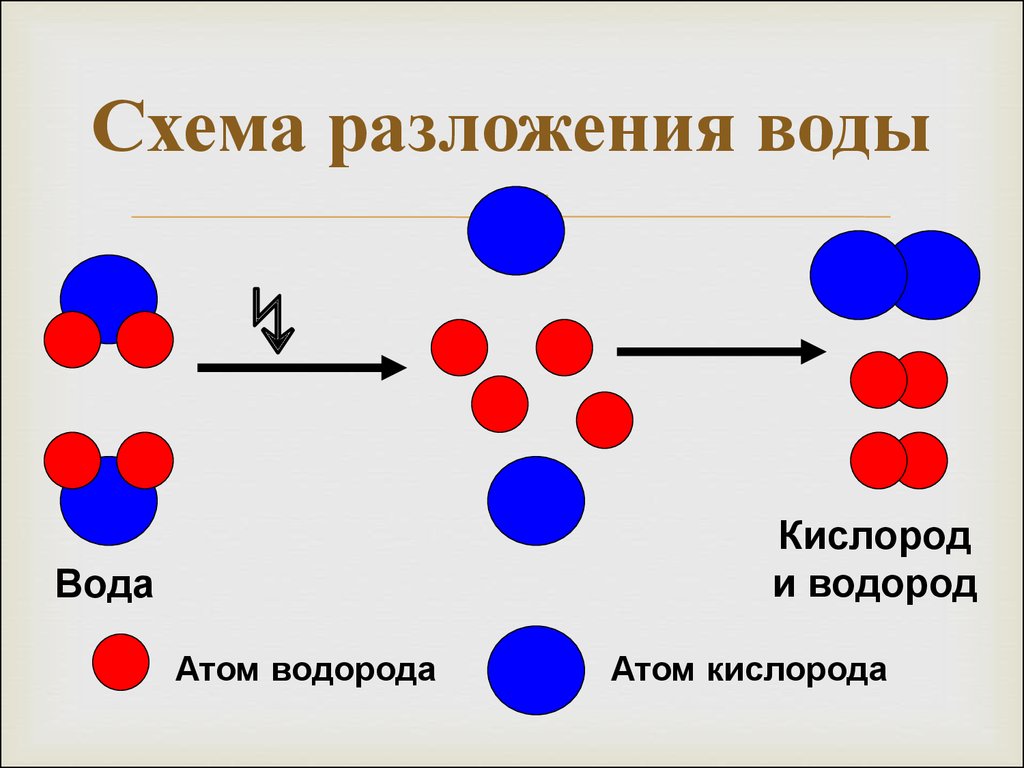
ПРИМЕРЫ РЕАКЦИЙ РАЗЛОЖЕНИЯ
Если вы обратите внимание, реакции разложения происходят каждый день в вашей жизни. Одним из них был бы электролиз воды с образованием газообразного водорода и кислорода.
2 H₂O → 2 H₂ + O₂
Другим примером может служить разложение перекиси водорода с образованием воды и кислорода.
2 H₂O₂ → 2 H₂O + O₂
Другим примером реакции разложения может быть нагревание зеленого карбоната меди; он разлагается с образованием оксида меди, а также двуокиси углерода.
CuCO₃ → CuO + CO₂(г)
Соединение изменит цвет со светло-зеленого на черный.
ТИПЫ РЕАКЦИЙ РАЗЛОЖЕНИЯ
Существуют три основных типа реакций разложения:
Термическое разложение: Реакция термического разложения активируется теплом. Этот тип реакции разложения является эндотермическим. Ярким примером реакции термического разложения может быть разложение карбоната кальция с образованием диоксида углерода и оксида кальция.

CaCO₃ → CaO + CO₂
Электролитическое разложение: Чтобы реагенты разлагались более чем на один продукт, электрическая энергия снабжает эту реакцию энергией активации. Электролиз воды, как упоминалось выше, является ярким примером.
Фотолитическое разложение: Реагент поглощает энергию фотонов, чтобы разорвать химические связи и затем сформировать продукты. Примером такой реакции разложения может быть разложение озона с образованием кислорода.
O₃ hv → O₂ + O
Если катализатор способствует какой-либо реакции разложения, то ее можно назвать реакцией каталитического разложения.
Применение:
Источник
- Реакция разложения используется для получения негашеной извести для цемента.
- Используется для сварки термитной реакцией.
- Чтобы облегчить кислотное расстройство желудка.
- Для идентификации любого образца на основе реакции разложения и полученных продуктов.

- Другим важным применением этой реакции может быть извлечение чистых металлов из их хлоридов, оксидов, а также руд.
ЗАКЛЮЧЕНИЕ
- Реакция разложения – это химическая реакция, при которой из одного реагента получаются два или более продуктов.
- Простой способ определить реакцию разложения — посмотреть на количество продуктов.
- Реакции разложения бывают трех типов: термическое разложение, фотолитическое разложение, электролитическое разложение.
Часто задаваемые вопросы
1. Как происходит разложение карбоната меди?
Это реакция термического разложения, при которой нагревая зеленый карбонат меди, он разлагается с образованием оксида меди, а также двуокиси углерода.
2. Каково сбалансированное уравнение для карбоната меди?
Сбалансированное уравнение для карбоната меди будет следующим:
CuCO₃ → CuO + CO₂(г)
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о Реакция разложения ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности — мы обещаем, это делает учебу намного веселее! 😎
ИСТОЧНИКИ
- Реакция разложения: https://www.



 Например H₂.
Например H₂.
 Важно изучить концепцию реакции разложения, потому что разложение является обычной реакцией в организме. Что поможет вам легче понять.
Важно изучить концепцию реакции разложения, потому что разложение является обычной реакцией в организме. Что поможет вам легче понять.


