Расщепление воды с эффективностью 100%: полдела сделано / Хабр
alizar
Научно-популярное Энергия и элементы питания Нанотехнологии Химия
Если найти дешёвый и простой способ электролиза/фотолиза воды, то мы получим невероятно богатый и чистый источник энергии — водородное топливо. Сгорая в кислороде, водород не образует никаких побочных выделений, кроме воды. Теоретически, электролиз — очень простой процесс: достаточно пропустить электрический ток через воду, и она разделяется на водород и кислород. Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Теперь учёные решили часть головоломки. Исследователи из Технион-Израильского технологического института разработали метод проведения второго из двух шагов окислительно-восстановительной реакции — восстановления — в видимом (солнечном) свете с энергетической эффективностью 100%, значительно превзойдя предыдущий рекорд 58,5%.
Осталось усовершенствовать полуреакцию окисления.
Столь высокой эффективности удалось добиться благодаря тому, что в процессе используется только энергия света. Катализаторами (фотокатализаторами) выступают наностержни длиной 50 нм. Они абсорбируют фотоны от источника освещения — и выдают электроны.
В полуреакции окисления производятся четыре отдельных атома водорода и молекула О2 (которая не нужна). В полуреакции восстановления четыре атома водорода спариваются в две молекулы H2, производя полезную форму водорода — газ H2,
Эффективность 100% означает, что все фотоны, поступившие в систему, участвуют в генерации электронов.
На такой эффективности каждый наностержень генерирует около 100 молекул H2 в секунду.
Сейчас учёные работают над оптимизацией техпроцесса, который пока что требует щелочной среды с невероятно высоким pH. Такой уровень никак не приемлем для реальных условий эксплуатации.
К тому же, наностержни подвержены коррозии, что тоже не слишком хорошо.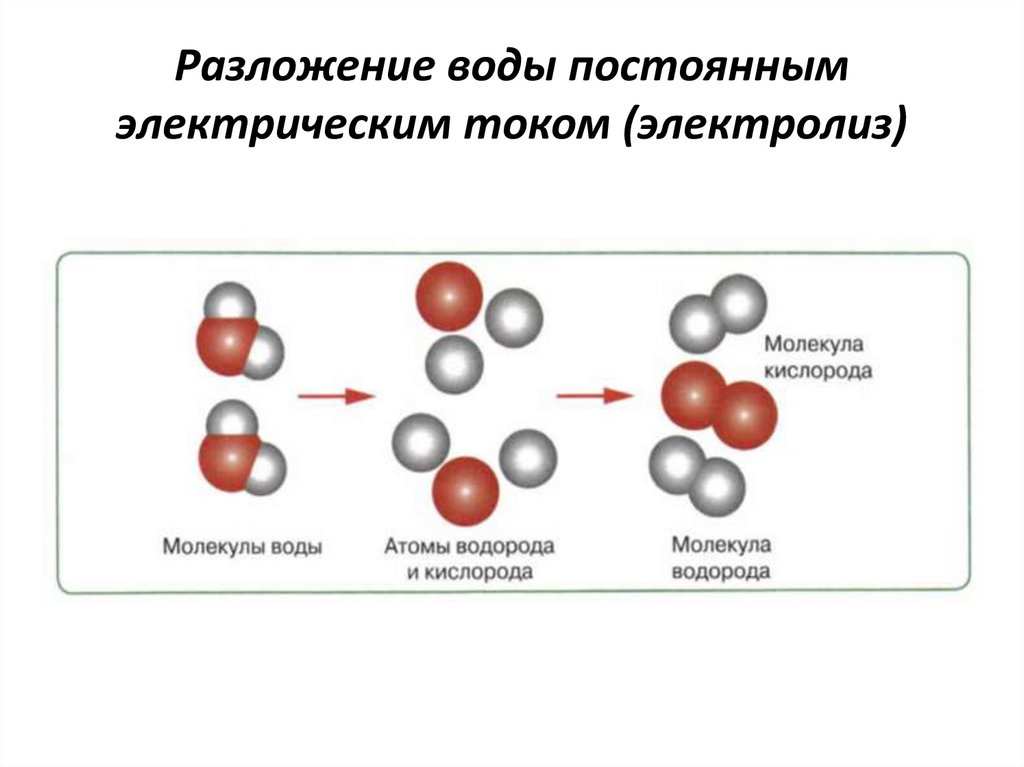
Тем не менее, сегодня человечество стало на шажок ближе к получению неиссякаемого источника чистой энергии в виде водородного топлива.
Научная работа опубликована в журнале
Теги:
- вода
- электролиз
- восстановление
- водородное топливо
- солнечная энергия
- фотолиз
Хабы:
- Научно-популярное
- Энергия и элементы питания
- Нанотехнологии
- Химия
Всего голосов 26: ↑23 и ↓3 +20
Просмотры69K
Комментарии 75
Анатолий Ализар @alizar
автор, фрилансер
Telegram
Комментарии Комментарии 75
Электролитическое разложение воды — Вода и воздух — самое дешевое сырье — Практическая химия
26 июля 2007
Для разложения воды электрическим током чаще всего используют аппарат Гофмана. Кто не располагает таким аппаратом, может сам легко построить подобное приспособление. Возьмем кусок очень широкой стеклянной трубки (например, химический стакан или широкогорлую склянку без дна. Как удалить дно, описано в главе 8, а острые края надо оплавить на пламени бунзеновской горелки). Отверстие трубки или горло склянки закроем очень плотно подогнанной резиновой пробкой. В пробке на не слишком близком расстоянии друг от друга просверлим два отверстия, в которые в качестве электродов вставим два угольных стержня. Такие стержни можно купить или взять из батарейки для электрического карманного фонаря. Перед применением очистим угольные стержни длительным кипячением в воде. К нижним концам угольных стержней присоединим токоподводы из изолированной медной проволоки. Лучше всего достать у электрика подходящие клеммы и к ним припаять зачищенные концы проводов. В крайнем случае обмотаем стержень проволокой. Изоляционный лак с проволоки необходимо тщательно счистить, а число витков должно быть достаточно большим.
Кто не располагает таким аппаратом, может сам легко построить подобное приспособление. Возьмем кусок очень широкой стеклянной трубки (например, химический стакан или широкогорлую склянку без дна. Как удалить дно, описано в главе 8, а острые края надо оплавить на пламени бунзеновской горелки). Отверстие трубки или горло склянки закроем очень плотно подогнанной резиновой пробкой. В пробке на не слишком близком расстоянии друг от друга просверлим два отверстия, в которые в качестве электродов вставим два угольных стержня. Такие стержни можно купить или взять из батарейки для электрического карманного фонаря. Перед применением очистим угольные стержни длительным кипячением в воде. К нижним концам угольных стержней присоединим токоподводы из изолированной медной проволоки. Лучше всего достать у электрика подходящие клеммы и к ним припаять зачищенные концы проводов. В крайнем случае обмотаем стержень проволокой. Изоляционный лак с проволоки необходимо тщательно счистить, а число витков должно быть достаточно большим.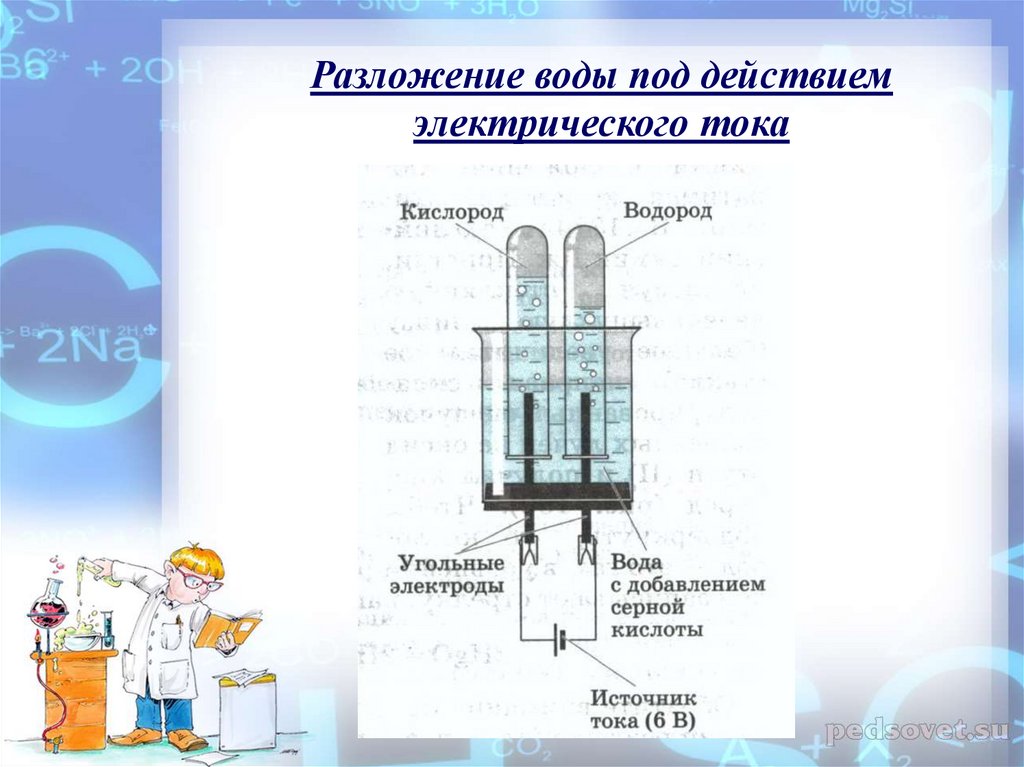
Наполним изготовленный электролизный сосуд примерно на две трети водой, в которую добавим немного разбавленной серной кислоты. Чистая вода проводит электрический ток очень плохо. Уже незначительное количество кислоты сильно повышает проводимость. Лучше всего, чтобы концентрация серной кислоты составляла 2—4 %. Осторожно — даже разбавленная серная кислота разъедает кожу. Запомните навсегда: при разведении кислоты ее следует очень медленно вливать в воду; ни в коем случае нельзя поступать наоборот — вливать воду в кислоту.
Ячейка готова. Теперь замкнем электрическую цепь. На обоих электродах выделяется газ: на положительном полюсе (аноде) слабее, на отрицательном (катоде) — сильнее. Соберем газы для их изучения. Для этого поместим перевернутые наполненные водой пробирки над электродами — только, чтобы они не стояли на резиновой пробке, а то электрическая цепь прервется.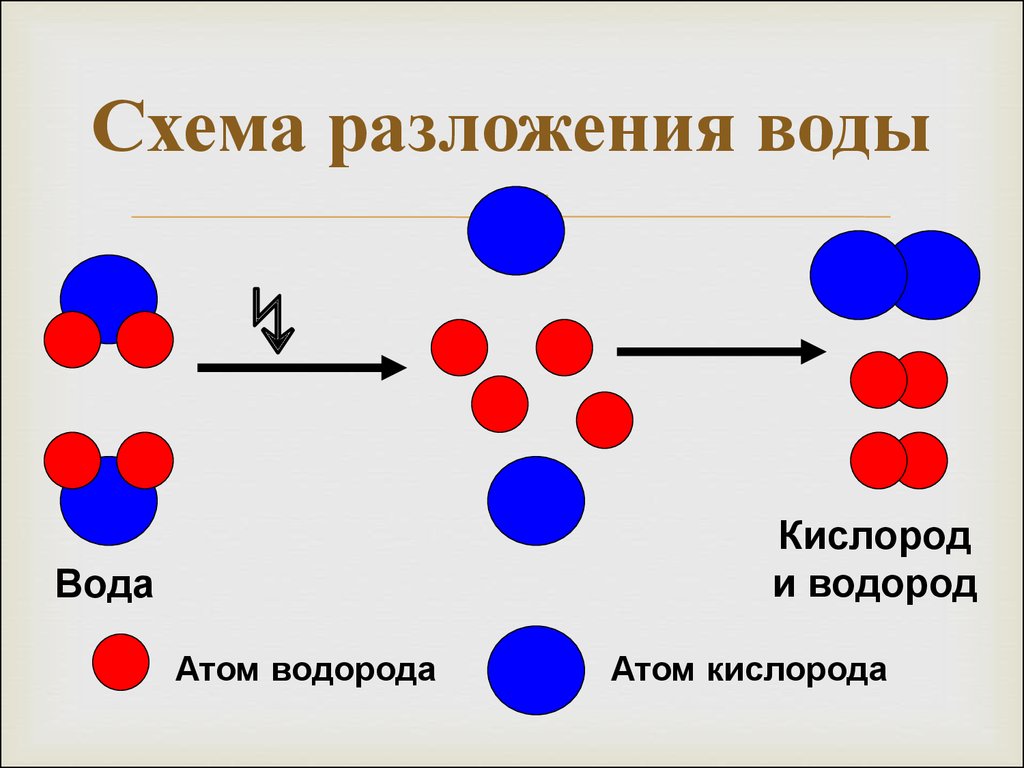
В обеих пробирках соберется газ. В идеальном случае нужно ожидать, что на аноде образуется ровно вдвое меньше газа, чем на катоде. Ведь на аноде выделяется кислород, а на катоде — водород. Так как формула воды Н
Несмотря на правильность этой теории, мы будем несколько разочарованы, когда сравним полученные объемы газов. Кислорода будет мало, так как часть его соединится с углеродом электрода. Для точных исследований необходимо применять электроды из благородного металла (лучше всего платины).
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
Электролиз воды Научный эксперимент
Этим летом моя дочь проводит время с бабушкой и дедушкой и наслаждается каждым мгновением этих драгоценных моментов. Кроме того, когда дедушка инженер-химик, как ее день может обойтись без научных развлечений?
Кроме того, когда дедушка инженер-химик, как ее день может обойтись без научных развлечений?
Всегда интересно изучать науку с помощью практических экспериментов. Поэтому наша команда дедушки и внучки занимается научными экспериментами. Первый в серии — «Электролиз воды», который сразу же был решен за обеденным столом, когда речь зашла о воде (читайте химический состав воды).
Если вы еще не знаете, вода электролиз это разложение воды на кислород и газообразный водород под действием электрического тока.
СВЯЗАННЫЕ >> СОЛНЕЧНОЕ ЗАТМЕНИЕ CRAFT
Хотя моя 4-летняя дочь слишком молода для этого эксперимента, ей очень понравился процесс, и она была очарована водяными пузырьками, генерируемыми электрическим током, разделяющим два газа. Я думаю, что любые мыльные пузыри — это развлечение для детей, вы согласны?
Теперь она понимает, что вода состоит из молекул водорода и кислорода. В эксперименте мы разделяем компоненты воды, которые она видит как пузырьки газа.
Если ваши дети любят проекты STEAM или STEM, как мой, загляните в блог, чтобы узнать больше о научных развлечениях в ближайшие недели. Вы также можете получать регулярные обновления нашего нового поста, подписавшись на нашу рассылку (ссылка в конце поста) или подписавшись на нас в Instagram или Facebook.
Этот пост содержит партнерские ссылки на упомянутые продукты. Ознакомьтесь с нашей политикой раскрытия информации для получения дополнительной информации.
Электролиз воды
Материалы
Стекло
Соль
КАРДСТОК КАКТЕКА
Батарея 9 В
СВОЙСТВЕННЫЙ КРАНЦИИ (2)
Переточковая точилка
Инструкции
Шаг 1: Зала и половина заполнения.
Шаг 2: Добавьте в воду немного соли и хорошо перемешайте.
Шаг 3: Заточите оба конца карандашей. Старайтесь, чтобы длина обоих карандашей была одинаковой.
Шаг 4: Вырежьте прямоугольный лист картонной бумаги так, чтобы он плотно закрывал стекло.
Шаг 5. Аккуратно протолкните оба карандаша через картон на расстоянии примерно 0,5 дюйма друг от друга. вода
Шаг 7: Держите батарею поверх карандашей так, чтобы узлы батареи касались стержня карандаша. Подождите несколько секунд, чтобы начать веселье!
ПРОЦЕСС ЭЛЕКТРОЛИЗА
В этом эксперименте электрический ток проходит от батареи через карандаши к воде и соли. Вода разлагается на кислород и газообразный водород, поскольку она состоит из этих основных элементов и образует пузырьки вокруг кончика карандаша. В зависимости от электрической полярности молекулы водорода появляются вокруг конца карандаша, соединенного с положительным узлом батареи (+), и кислорода на карандаше, соединенного с отрицательным узлом батареи (-).
2h3O —- Электрический ток —> 2h3 + O2
Кроме того, поскольку в воде на каждую молекулу кислорода приходится две молекулы водорода, можно сказать, что кончик карандаша, на котором больше пузырьков, притягивает водород, а другой получает кислород.
Кроме того, мы добавили в воду соль (хлорид натрия или NaCL), потому что она действует как электролит, помогая прохождению электрического тока. Соль в воде тоже разлагается.
2NaCl —> 2Na + Cl2
Хлор образует пузырьки с резким запахом.
Присоединяйтесь!
Подпишитесь на раздел «Радость делиться» на PINTEREST | ФЕЙСБУК | INSTAGRAM
| Примечание. После подписки вы получите электронное письмо от «Радость обмена» со ссылкой для получения ваших печатных шаблонов. |
ВАМ ТАКЖЕ МОЖЕТ ПОНРАВИТЬСЯ:
Новое сообщение Старый пост Главная
Производство водорода — Управление энергетической информации США (EIA)
Чтобы получить водород, его необходимо отделить от других элементов в молекулах, в которых он встречается. Существует множество различных источников водорода и способов его производства для использования в качестве топлива. Двумя наиболее распространенными методами производства водорода являются паровая конверсия метана и электролиз (расщепление воды электричеством. Исследователи изучают другие методы производства водорода или пути .
Существует множество различных источников водорода и способов его производства для использования в качестве топлива. Двумя наиболее распространенными методами производства водорода являются паровая конверсия метана и электролиз (расщепление воды электричеством. Исследователи изучают другие методы производства водорода или пути .
Процессы производства водорода
Источник: Министерство энергетики США , Управление энергоэффективности и возобновляемых источников энергии, Пути производства водорода (общественное достояние)
Нажмите, чтобы увеличить
Конверсия метана с водяным паром является широко используемым методом промышленного производства водорода
Конверсия метана с водяным паром в настоящее время составляет почти весь коммерчески производимый водород в Соединенных Штатах. Коммерческие производители водорода и нефтеперерабатывающие заводы используют паровую конверсию метана для отделения атомов водорода от атомов углерода в метане (CH 4 ).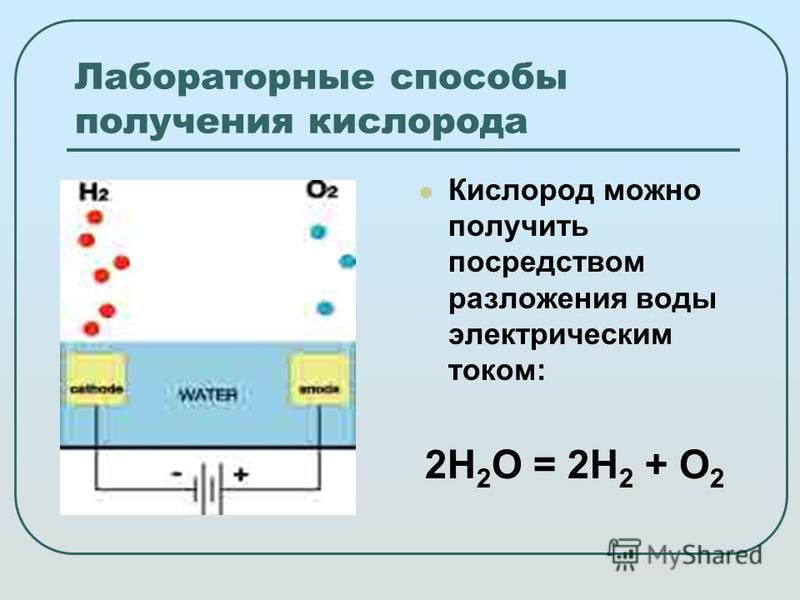 При паровой конверсии метана высокотемпературный пар (от 1300°F до 1800°F) под давлением 3–25 бар (1 бар = 14,5 фунтов на квадратный дюйм) реагирует с метаном в присутствии катализатора с образованием водорода, монооксида углерода. , и относительно небольшое количество углекислого газа (CO 2 ).
При паровой конверсии метана высокотемпературный пар (от 1300°F до 1800°F) под давлением 3–25 бар (1 бар = 14,5 фунтов на квадратный дюйм) реагирует с метаном в присутствии катализатора с образованием водорода, монооксида углерода. , и относительно небольшое количество углекислого газа (CO 2 ).
Природный газ является основным источником метана для производства водорода на промышленных предприятиях и нефтеперерабатывающих заводах. Свалочный газ/биогаз, который можно назвать биометаном или возобновляемым природным газом , является источником водорода для нескольких электростанций на топливных элементах в Соединенных Штатах. Биотопливо и нефтяное топливо также являются потенциальными источниками водорода.
Электролиз использует электричество для производства водорода
Электролиз — это процесс, при котором водород из воды выделяется с помощью электрического тока. Электролиз обычно используется для демонстрации химических реакций и производства водорода на уроках естествознания в средней школе. В крупном коммерческом масштабе этот процесс можно назвать мощность-газ , где мощность это электричество, а водород газ . Электролиз сам по себе не производит никаких побочных продуктов или выбросов, кроме водорода и кислорода. Электричество для электролиза может поступать из возобновляемых источников, ядерной энергии или ископаемого топлива. Если электроэнергия для электролиза производится из ископаемого топлива (угля, природного газа и нефти) или сжигания биомассы, то соответствующие воздействия на окружающую среду и выбросы CO 2 косвенно связаны с этим водородом.
В крупном коммерческом масштабе этот процесс можно назвать мощность-газ , где мощность это электричество, а водород газ . Электролиз сам по себе не производит никаких побочных продуктов или выбросов, кроме водорода и кислорода. Электричество для электролиза может поступать из возобновляемых источников, ядерной энергии или ископаемого топлива. Если электроэнергия для электролиза производится из ископаемого топлива (угля, природного газа и нефти) или сжигания биомассы, то соответствующие воздействия на окружающую среду и выбросы CO 2 косвенно связаны с этим водородом.
Другие методы получения водорода
- Использование микробов, использующих свет для производства водорода
- Преобразование биомассы в газ или жидкость и выделение водорода
- Использование технологий солнечной энергии для отделения водорода от молекул воды
Категории водорода
Производители водорода, продавцы, государственные учреждения и другие организации могут классифицировать или определять водород в соответствии с источниками энергии для его производства, и они используют цветовой код для классификации водорода.

