Получение водорода в домашних условиях
Библиографическое описание:Шапилова, В. В. Получение водорода в домашних условиях / В. В. Шапилова, Г. И. Талапчук. — Текст : непосредственный // Юный ученый. — 2018. — № 1.1 (15.1). — С. 97-98. — URL: https://moluch.ru/young/archive/15/1180/ (дата обращения: 06.06.2023).
На Земле водород в чистом виде почти не встречается, и в повседневной жизни мы с ним не сталкиваемся. Но в соединениях — это второй по количеству атомов элемент в земной коре после кислорода. Все живые существа на Земле, включая нас с вами, примерно на 2/3 состоят из водорода.
Ключевые слова: водород, получение водорода.
Так что же такое водород? Каковы его свойства? Как его получают и применяют в земных условиях? Можно ли получить водород в домашних условиях, и как это делать лучше всего? На эти и другие вопросы мы постараемся ответить в ходе нашей научной работы.
Водород — это самый простой элемент в природе, состоящий из одного протона и вращающегося вокруг него электрона. Впервые получение водорода упоминается у английского учёного Роберта Бойля, который в 1671 году проводил реакцию между железными стружками и разбавленными кислотами. Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова. Официальное латинское название водорода «Hydrogenium».
В промышленности водород получают в основном из ископаемого топлива. В первую очередь это природный газ, метан, с которым большинство из нас может встретится на кухне, если вас есть газовая плита. Водород получают из лёгких фракций нефти. Третий по популярности источник водорода — это уголь.
Наиболее доступным для повторения в домашних условиях является разложение воды электрическим током (электролиз).
Для проведения нашего эксперимента мы взяли старую зарядку на 5 В 750мА и угольные электроды, извлечённые из обычных солевых батареек. Для измерения протекающего тока использовался мультиметр.
Для измерения протекающего тока использовался мультиметр.
Наблюдение выделения водорода в результате взаимодействия металлов с разбавленными кислотами было самых первым в истории химии. И его относительно просто повторить в домашних условиях. Для этого нам понадобится металл, желательно поактивнее и кислота. В нашем эксперименте мы выбрали электролит для свинцовых аккумуляторов, который можно найти в ближайшем автомобильном магазине и цинк из использованных солевых батареек. Для сбора водорода, как и в случае электролиза, использовали перевёрнутую бутылку с опущенным в воду горлышком. Электролит дополнительно развели водой в пропорции 50 мл раствора серной кислоты на 150 мл. воды. Цинка из батарейки получилось примерно 1 г. За 12 часов весь металл растворился и мы получили 0.7 литра водорода.
И его относительно просто повторить в домашних условиях. Для этого нам понадобится металл, желательно поактивнее и кислота. В нашем эксперименте мы выбрали электролит для свинцовых аккумуляторов, который можно найти в ближайшем автомобильном магазине и цинк из использованных солевых батареек. Для сбора водорода, как и в случае электролиза, использовали перевёрнутую бутылку с опущенным в воду горлышком. Электролит дополнительно развели водой в пропорции 50 мл раствора серной кислоты на 150 мл. воды. Цинка из батарейки получилось примерно 1 г. За 12 часов весь металл растворился и мы получили 0.7 литра водорода.
Другой популярный метод — взаимодействие металлов с щелочами. Для эксперимента мы выбрали два варианта, которые были под рукой — кусочки провода и фольгу для запекания. Щёлочь (гидроксид натрия) можно найти в бытовых магазинах как средство для прочистки канализационных труб (КРОТ, например). Установку для получения использовали почти такую же, что и в опыте с кислотой и цинком.
Таким образом, в экспериментах по получению водорода наиболее быстрым и доступным способом оказался вариант взаимодействия алюминиевой фольги со щёлочью. Но если необходимо получать водород регулярно и в больших количествах, то на первое место должен выйти электролиз, так как он не требует никаких расходных материалов кроме воды. Правда для этого понадобится более серьёзная установка, чем зарядка от телефона и пара бутылок.
Правда для этого понадобится более серьёзная установка, чем зарядка от телефона и пара бутылок.
В ходе научной работы мы познакомились с самым распространённым, но таким редким в быту веществом, как водород. Научились получать его различными способами и выбрали наиболее удобный для осуществления в домашних условиях — воздействие средства для прочистки труб, содержащего щёлочь, на алюминиевую фольгу.
Так же мы на собственном опыте убедились, что водород — горючий и взрывоопасный газ, но им вполне можно наполнять воздушные шарики, чтобы они летали. Правда при этом стоит держать их подальше от открытого огня.
Основные термины (генерируются автоматически): водород, получение водорода, опыт, алюминиевая фольга, научная работа, литр водорода, площадь поверхности.
Из
опыта подготовки исследовательского проекта школьников по…Известные технологии получения водорода из связанного состояния энергозатратные, дорогие и сложны в эксплуатации [4, с. 8]. Существует необходимость в поиске методов получения водорода из связанного состояния, лишенных перечисленных недостатков.
8]. Существует необходимость в поиске методов получения водорода из связанного состояния, лишенных перечисленных недостатков.
Получение
Исследование методов
получения водорода в соответствии…Говоря о водороде как о экологически чистом топливе будущего, считается, что его производство не наносит вреда окружающей среде.
Настоящая работа направлена на исследование способов получения водорода в соответствии с принципами «зелёной химии».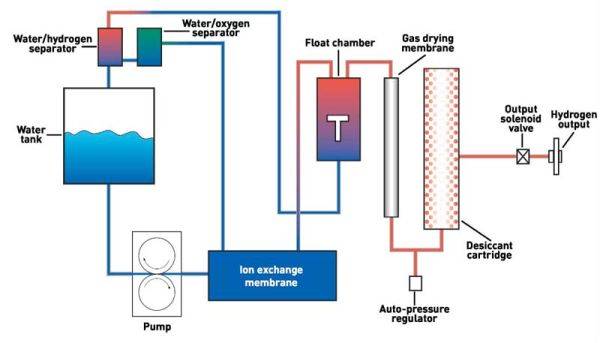
Создание технологий
водородной энергетики | Статья в журнале…Введение. Понятие — «водородная энергетика» сформировалось в середине 70-х г. XX столетия. Водородную энергетику можно определить, как научно техническое направление, охватывающее проблемы получения, хранения, транспортировки и использования водорода.
Краткий обзор опытно-конструкторских
работ по использованию…При подаче водорода соответственно уменьшалось количество бензина в смеси. Как видно, добавка водорода при неизменной энергии
2. Трелин Ю. А. Исследование особенностей работы ДВС с искровым зажиганием при добавках водорода в бензовоздушную смесь: дисс…
К вопросу применения
водорода на двигателях внутреннего. ..
..Первое практическое использование водорода в качестве добавки к топливу для авиационных ДВС относится к 1927г. В Советском Союзе
Особенности топливных систем двигателей, работающих на…
Получение водорода разложением воды в многоступенчатых термохимических циклах на транспортных энергоустановках практически невозможно из-за высоких и различных на разных ступенях температур (до 450-9000С) и использования большого количества цветных металлов.
Технология очистки отходящих газов высокоамперных…
Технология улавливания фтористого водорода в системе сухой газоочистки основана на способности глинозема поглощать фтористый водород. В реакторе-адсорбере в режиме аэровзвеси, происходит процесс соединения фтористого водорода с оксидом алюминия [2]
Анализ условий самовоспламенения сжатого
водорода. Обзор
ОбзорПроведен обзор работ за последние 15 лет по проблеме водородной безопасности. Приведены условия, при которых происходит самовоспламенение струи водорода, истекающей под высоким давлением в воздух. Показано, что воспламенение водорода возможно даже при…
Кислород можно извлекать из воды при помощи магнитов
17 августа 2022, 17:25 3372
Ученые Университета Уорика продемонстрировали новый метод извлечения кислорода из воды с помощью магнитов. Это невероятно важное открытие, которое значительно облегчит космическую экспансию человечества.
Проблема электролиза в невесомости
На Международной космической станции кислород вырабатывается с помощью электролизера — устройства, которое электричеством расщепляет воду на водород и кислород. Этот процесс довольно прост — в воду опускается два электрода и на них подается ток. На положительном электроде (аноде) образуются пузырьки водорода, а на отрицательном (катоде) пузырьки водорода. Расщеплять воду на кислород и водород можно даже в домашних условиях. Но в невесомости все гораздо сложнее.
Этот процесс довольно прост — в воду опускается два электрода и на них подается ток. На положительном электроде (аноде) образуются пузырьки водорода, а на отрицательном (катоде) пузырьки водорода. Расщеплять воду на кислород и водород можно даже в домашних условиях. Но в невесомости все гораздо сложнее.
Когда вы наливаете газированную воду в стакан, то видите пузырьки, газа поднимающиеся наверх. Это происходит потому, что легкий газ выталкивается весом воды. Но в невесомости нет понятий «низ» и «верх», равно как нет и веса. Соответственно, пузырьки газа не выталкиваются, а плавают подвешенными в жидкости.
В космосе водород и кислород, выделенные в процессе электролиза, остаются на электродах, так что извлекать их приходится с помощью громоздких и сложных центрифуг, создающих в аппарате электролиза искусственную силу тяжести. Ученые пришли к выводу, что использовать такую технологию в дальних миссиях, например, при полете на Марс, будет сложно и дорого. Тут-то на помощь и приходят магниты.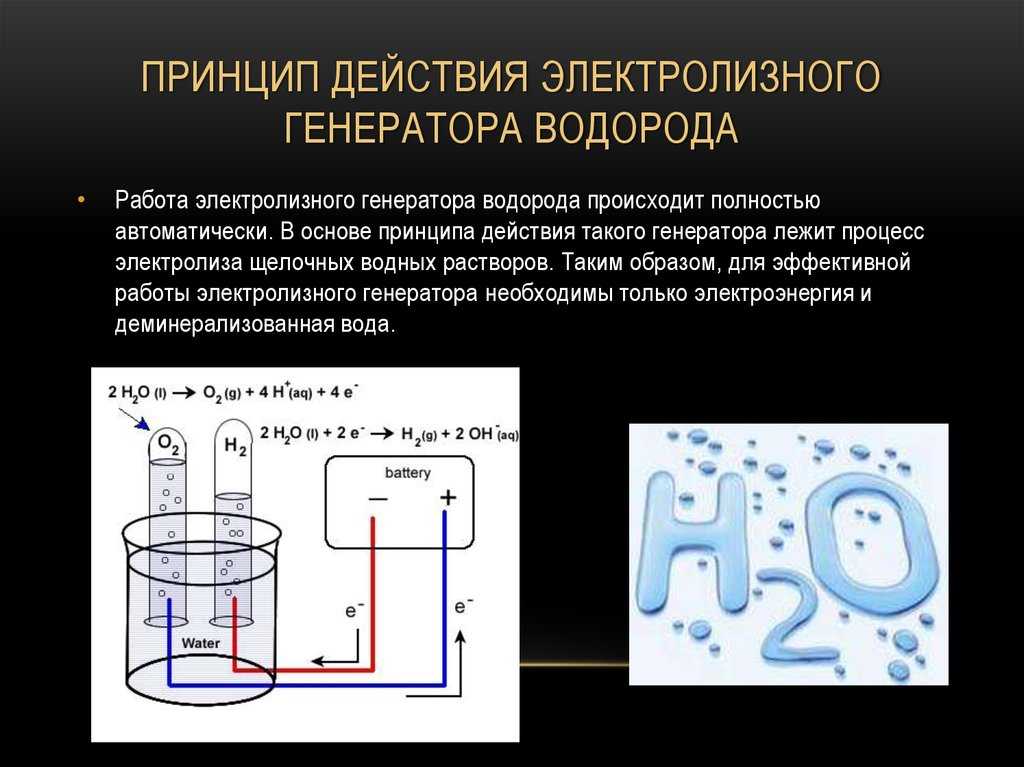
Электролиз с магнитами
Ученые разработали новую методику отделения газовых пузырьков от поверхности электрода в различных жидкостях с помощью неодимовых магнитов.
Технология была проверена в реальных условиях микрогравитации. Создать такие условия помогла Бременская башня Drop Tower в Германии. Это 146-метровый научный стенд, который позволяет отправлять в свободное падение ударопрочные капсулы. При падении объекты в капсуле испытывают невесомость в течение 9,2 секунды. Это не очень долгий срок, но такие эксперименты позволяют проверить, как будут проявляться те или иные явления на орбите или в дальнем космосе.
Эксперименты показали, что магнитный метод работает. Мощное магнитное поле заставляет пузырьки газа отлипать от электродов и «выталкиваться» из жидкости даже при отсутствии силы тяжести. А значит, сложные и ненадежные центрифуги больше не понадобятся.
Почему это важно?
По словам ученых, открытие позволит создать новые, более совершенные системы жизнеобеспечения для космических кораблей следующего поколения. Это крайне важная технология, которая значительно упростит отправку людей на Луну и Марс.
Это крайне важная технология, которая значительно упростит отправку людей на Луну и Марс.
«Эффект имеет огромные последствия для дальнейшего развития систем разделения фаз, которые используются в долгосрочных космических полетах. Эффективное производство кислорода и водорода в системах водяного электролиза может быть достигнуто даже при отсутствии выталкивающих сил», — говорит автор исследования доктор Катарина Бринкерт из Университета Уорика.
Исследование опубликовано в журнале npj Microgravity.
ученых разработали самый эффективный катализатор для расщепления воды: ScienceAlert
VALex/Shutterstock.comУченые только что нашли новый способ расщепления воды на водород и кислород, который является дешевым и эффективным, и это может означать, что в будущем мы сможем производить в изобилии чистое водородное топливо.
Водород является фантастическим источником экологически чистой энергии, но задача состоит в том, чтобы сделать его достаточно эффективным и доступным по цене. Сообщается, что недавно разработанный катализатор решает обе проблемы, обеспечивая большую эффективность при меньшей стоимости, чем существующие решения, и может работать в течение 20 часов подряд.
Сообщается, что недавно разработанный катализатор решает обе проблемы, обеспечивая большую эффективность при меньшей стоимости, чем существующие решения, и может работать в течение 20 часов подряд.
По словам ученых Хьюстонского университета, разработавших катализатор, он отвечает всем требованиям с точки зрения долговечности и сохранения энергии, а также стоимости и эффективности.
«Водород — самый чистый первичный источник энергии на Земле», — говорит один из членов команды, Пол К. В. Чу. «Вода могла бы быть самым распространенным источником водорода, если бы можно было отделить водород от его прочной связи с кислородом в воде с помощью катализатора».
Чтобы разделить воду на водород и кислород, необходимы две реакции — по одной для каждого элемента. Основная проблема заключалась в том, чтобы получить эффективный катализатор для кислородной части уравнения, что, по словам этих исследователей, они теперь взломали.
Катализатор состоит из метафосфата железа и платформы из проводящей пены никеля, сочетание материалов, которое, по словам команды, является более эффективным и менее дорогим, чем существующие решения.
Он также показал впечатляющую долговечность в тестах, проработав более 20 часов и 10 000 циклов без сбоев.
Использование нового метода означает, что водород можно производить без образования углеродных отходов. Это то, чего не могут избежать существующие методы производства, такие как паровая конверсия метана и газификация угля.
До сих пор кислородные реакции часто полагались на электрокатализаторы, в которых используется иридий, платина или рутений — «благородные» металлы, которые трудно и дорого добывать. Эксперты говорят, что кислородные реакции стали узким местом всего процесса.
Никель, напротив, более распространен, и поэтому его легче и дешевле достать. Этот металл лежит в основе еще одного метода разделения воды, открытого в прошлом году, поэтому теперь у ученых есть несколько способов улучшить производство водорода.
Само расщепление обычно происходит за счет электрического тока или солнечной энергии, но поскольку вода улавливает лишь небольшую часть светового спектра, более продуктивно сначала преобразовать солнечный свет в энергию, а затем использовать электричество для выделения водорода.
Если ученые смогут разгадать формулу, водород в конечном итоге сможет питать все, от домов до автомобилей. И это гораздо лучший вариант для окружающей среды, чем ископаемое топливо, выделяющее CO2 — водородное топливо производит воду в качестве побочного продукта сгорания, что является экологически безопасным и не загрязняющим окружающую среду.
Хорошая новость: если метод электролиза воды не сработает, исследователи также изучают способы получения водорода из биомассы.
Чем меньше тепла и энергии мы тратим на подготовку водорода, тем лучше он для нашей планеты, а когда он будет готов, он станет намного чище и экологичнее, чем ископаемое топливо.
«Мы считаем, что наше открытие является гигантским шагом к практическому и экономичному производству водорода путем расщепления воды, что внесет значительный вклад в усилия по сокращению потребления ископаемого топлива», — говорят исследователи из Хьюстона.
Их выводы были опубликованы в PNAS .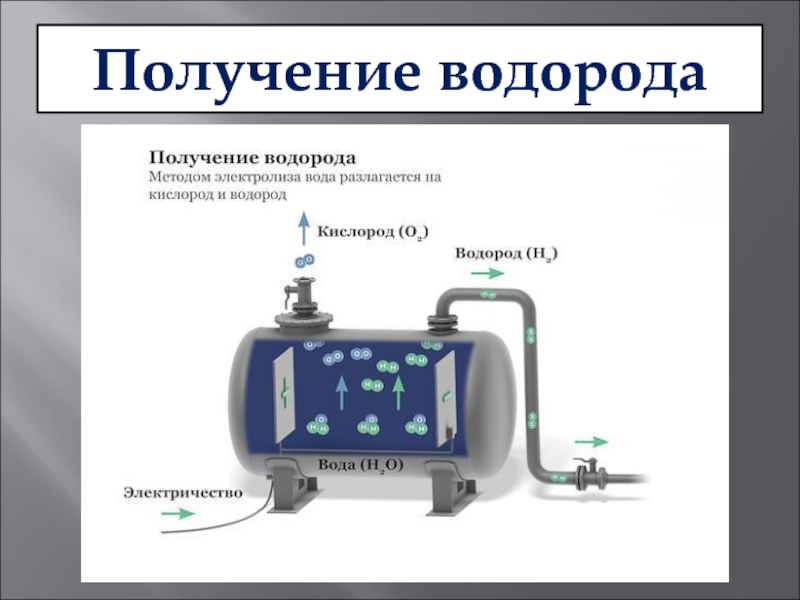
Новый метод разделения воды для получения чистого водорода
Ингрид Фаделли, Tech Xplore
Фотография исследователей, на которой изображены (слева направо): доктор Хен Дотан, Авигейл Ландман, профессор Авнер Ротшильд, профессор Гидеон Грейдер. Фото: Чен Галили, официальный представитель Техниона.Электролитическое производство водорода предполагает получение водорода из воды с использованием электроэнергии, которая в идеале должна поступать из возобновляемых источников энергии, таких как солнечный свет и ветер. Хотя этот метод производства водорода может быть очень многообещающим решением для повышения устойчивости, исследователям придется преодолеть несколько ключевых проблем, чтобы он получил широкое распространение.
В недавнем исследовании, представленном в Nature Energy , группа исследователей из Израильского технологического института Технион решила некоторые из этих проблем, представив новый метод расщепления воды, который может улучшить существующие методы производства электролитического водорода. Их исследование черпает вдохновение из одного из их предыдущих исследований фотоэлектрохимического (PEC) расщепления воды, в котором они пытались объединить солнечную энергию и (фото)электролиз воды для получения водорода из солнечного света и воды.
Их исследование черпает вдохновение из одного из их предыдущих исследований фотоэлектрохимического (PEC) расщепления воды, в котором они пытались объединить солнечную энергию и (фото)электролиз воды для получения водорода из солнечного света и воды.
Одной из самых больших проблем, изложенных в этой предыдущей работе, был сбор газообразного водорода из миллионов ячеек PEC, распределенных в солнечном поле. В своем исследовании исследователи из Техниона попытались разработать метод, который мог бы эффективно решить эту проблему.
«Взяв фотогальванические (PV) солнечные электростанции в качестве базового сценария, солнечная ферма состоит из миллионов отдельных фотоэлементов, где ток (и напряжение) собирается от каждого из них в металлическую сетку», Авнер Ротшильд, один из исследователей, проводивших исследование, сказал TechXplore. «Это легко с электричеством, но не так с газообразным водородом».
В идеальной солнечной электростанции будущего фотоэлектрические элементы должны быть заменены на элементы PEC, которые могут производить водород в компоненте, известном как катодное отделение, и кислород в отдельной камере, называемой анодным отделением. Эти два отсека должны быть разделены хотя бы мембраной, чтобы водород и кислород не смешивались, так как это может привести к взрыву. Кроме того, газообразный водород должен собираться из каждой отдельной ячейки.
Эти два отсека должны быть разделены хотя бы мембраной, чтобы водород и кислород не смешивались, так как это может привести к взрыву. Кроме того, газообразный водород должен собираться из каждой отдельной ячейки.
Создание этой установки до сих пор оказалось технически сложным и дорогим, так как требует очень дорогого трубопроводного коллектора. В конечном итоге это сделало нереалистичной реализацию решений по крупномасштабному производству водорода путем расщепления воды ПЭК.
«Мы искали выход из этой сложной ситуации и пришли к идее разделения кислородного и водородного отсеков в ячейке PEC на две отдельные ячейки, чтобы кислород вырабатывался в солнечном поле и выбрасывался в атмосферу. , тогда как водород вырабатывается в центральном реакторе в углу поля», — сказал Ротшильд. «Разделение на две ячейки стало возможным благодаря вставке другого набора из двух электродов, называемых вспомогательными электродами, которые заряжаются и разряжаются одновременно с помощью OH 9. 0057 — ионов, участвующих в реакции расщепления воды, тем самым опосредуя ионный обмен между двумя клетками (что необходимо для замыкания электрической цепи)».
0057 — ионов, участвующих в реакции расщепления воды, тем самым опосредуя ионный обмен между двумя клетками (что необходимо для замыкания электрической цепи)».
В своей предыдущей статье, опубликованной в Nature Materials , Ротшильд и его коллеги представили революционный новый подход к архитектуре электролиза воды (электролизеры) и фотоэлектролиза (PEC). Этот многообещающий подход, однако, создал еще одну проблему регенерации вспомогательных электродов, когда они насыщаются в конце производственного цикла. Исследователи предположили, что электроды можно менять местами в конце каждого цикла, но это было бы довольно обременительно, поэтому они продолжили поиск альтернативных решений.
«Затем мы обнаружили, что когда вы нагреваете вспомогательный электрод в водородной ячейке, после того как он был заряжен (чтобы стать NiOOH), он самопроизвольно выпускает пузырьки газообразного кислорода и восстанавливается до своего исходного состояния (Ni(OH) 2 ), — сказал Ротшильд. «Это открытие привело к разработке процесса разделения воды E-TAC, который представлен в настоящей работе».
«Это открытие привело к разработке процесса разделения воды E-TAC, который представлен в настоящей работе».
E-TAC, новый метод разделения воды, предложенный Ротшильдом и его коллегами, имеет высокую энергоэффективность 98,7 процента, следовательно, он значительно превосходит обычные электролизеры, которые обычно имеют энергоэффективность от 70 до 80 процентов для современных устройств. Еще одним преимуществом E-TAC является то, что он производит водород и кислород последовательно, в то время как в большинстве других электролизеров они производятся одновременно. В конечном итоге это устраняет необходимость в мембране, разделяющей газообразные водород и кислород, что значительно упрощает конструкцию и сборку элементов, а также их эксплуатацию и техническое обслуживание.
«Потенциально это может привести к значительной экономии капитальных и эксплуатационных затрат, что приведет к разработке экономичной технологии разделения воды, которая может конкурировать с SMR (паровой конверсией метана), предлагая дешевый водород без выбросов CO 2 , при условии, что электричество поступает из возобновляемых источников, таких как гидроэнергетика, солнечная энергия или энергия ветра», — сказал Ротшильд.
При обычном электролизе воды водород и кислород всегда образуются одновременно в катодном и анодном отделениях соответственно. Отсеки расположены как можно ближе друг к другу, чтобы свести к минимуму электрические омические потери, и разделены мембраной во избежание создания взрывоопасной среды H 2 /O 2 смесь.
«Катод восстанавливает воду, генерируя водород (H 2 молекул) и ионы гидроксида (OH —) посредством реакции, известной как HER (реакция выделения водорода)», — сказал Ротшильд. «Ионы ОН — мигрируют к аноду через электролит и через мембрану, где они окисляются посредством ОВР (реакции выделения кислорода). Вместе эти две реакции (ГВР и ОВР) завершают реакцию расщепления воды: 2Н 2 О 2Н 2 + О 2 ».
При обычном электролизе воды две электрохимические реакции, описанные Ротшильдом, связаны как во времени, так и в пространстве, поскольку они происходят одновременно, в одной и той же ячейке и в непосредственной близости. Более того, эти характеристики одинаковы независимо от того, применяется ли процесс к щелочным электролизерам или электролизерам с ПОМ.
Более того, эти характеристики одинаковы независимо от того, применяется ли процесс к щелочным электролизерам или электролизерам с ПОМ.
В отличие от этого традиционного подхода к электролизу воды, процесс разделения воды, разработанный исследователями, разделяет реакции HER и OER, которые вместо этого происходят в разное время и потенциально в разных частях устройства. Таким образом, вместо того, чтобы быть непрерывным, E-TAC можно описать как «периодический процесс» с двумя циклами, первый из которых генерирует водород электрохимически, а второй — кислород посредством спонтанной химической реакции.
«Мы помещаем катод (тот же самый катод, который используется в щелочном электролизе) и анод (который отличается от анода в обычном электролизе) в электролитическую ячейку и пропускаем ток между ними», — сказал Ротшильд. «Катод вырабатывает водород посредством реакции HER, точно так же, как это происходит в случае обычного электролиза воды, но анод делает совершенно другое. Анод, по сути, заряжается, поглощая OH — ионов, которые образуются на катоде и постепенно превращаются из Ni(OH) 2 (гидроксид никеля) в NiOOH (оксигидроксид никеля).
«Катод вырабатывает водород посредством реакции HER, точно так же, как это происходит в случае обычного электролиза воды, но анод делает совершенно другое. Анод, по сути, заряжается, поглощая OH — ионов, которые образуются на катоде и постепенно превращаются из Ni(OH) 2 (гидроксид никеля) в NiOOH (оксигидроксид никеля).
Интересно, что реакция, происходящая на аноде, аналогична той, которая происходит на катоде щелочных батарей (например, Ni-MH батарей) во время их зарядки. Это говорит о том, что он может хорошо работать в течение многих циклов, как и щелочные батареи.
Однако иногда зарядка анода в процессе E-TAC должна быть прервана, потому что, если он будет перезаряжен, он может начать генерировать кислород. Поэтому, когда заряд превышает определенный уровень, исследователям необходимо ограничить напряжение, подаваемое на ячейки, чтобы избежать возможных взрывов, возникающих в результате совместного производства кислорода и водорода.
«Чтобы продолжить процесс E-TAC, нам необходимо регенерировать заряженный анод (NiOOH) обратно в исходное состояние (Ni(OH) 2 )», — объяснил Ротшильд. «Мы делаем это, повышая его температуру, тем самым увеличивая скорость спонтанной химической реакции между заряженным анодом и водой, которая высвобождает кислород и регенерирует анод обратно в исходное состояние».
«Мы делаем это, повышая его температуру, тем самым увеличивая скорость спонтанной химической реакции между заряженным анодом и водой, которая высвобождает кислород и регенерирует анод обратно в исходное состояние».
Техника, разработанная Ротшильдом и его коллегами, предполагает использование тепла для управления химической реакцией, в результате которой образуется кислород, поскольку скорость реакции замедляется при низких температурах и увеличивается при высоких температурах. Генерация водорода происходит при низкой температуре или температуре окружающей среды, а генерация кислорода при высоких температурах около 95 градусов Цельсия. Вот почему исследователи решили назвать его процессом E-TAC, что означает электрохимически-термически активированный химический процесс.
«В лабораторных испытаниях для проверки концепции, представленных в нашей статье, мы вручную перемещали анод из холодной камеры (т. е. стеклянного стакана, наполненного щелочным водным раствором при температуре окружающей среды) в горячую камеру (т. химический стакан, но нагретый до 95 градусов Цельсия), так что разделение между генерацией водорода и кислорода было не только вовремя, но и на месте», — пояснил Ротшильд. «Однако в реальной промышленной системе мы предвидим другой сценарий, при котором два электрода (анод и катод) и неподвижны (не движутся), тогда как ячейка, в которой они находятся, последовательно заполняется холодными или горячими растворами электролита. »
химический стакан, но нагретый до 95 градусов Цельсия), так что разделение между генерацией водорода и кислорода было не только вовремя, но и на месте», — пояснил Ротшильд. «Однако в реальной промышленной системе мы предвидим другой сценарий, при котором два электрода (анод и катод) и неподвижны (не движутся), тогда как ячейка, в которой они находятся, последовательно заполняется холодными или горячими растворами электролита. »
Разделение производства водорода и кислорода, которое устраняет необходимость в мембране, разделяющей две разные камеры внутри электролитических ячеек, приводит к значительной экономии по сравнению с традиционными подходами к электролизу. На самом деле герметизация мембраны, как правило, является дорогостоящей, а также усложняет общий производственный процесс. Мембрана в обычных системах требует воды высокой чистоты и постоянного обслуживания, в которых нет необходимости в E-TAC.
Кроме того, метод, разработанный Ротшильдом и его коллегами, полностью исключает риск летучих столкновений между кислородом и водородом, а также последующих взрывов.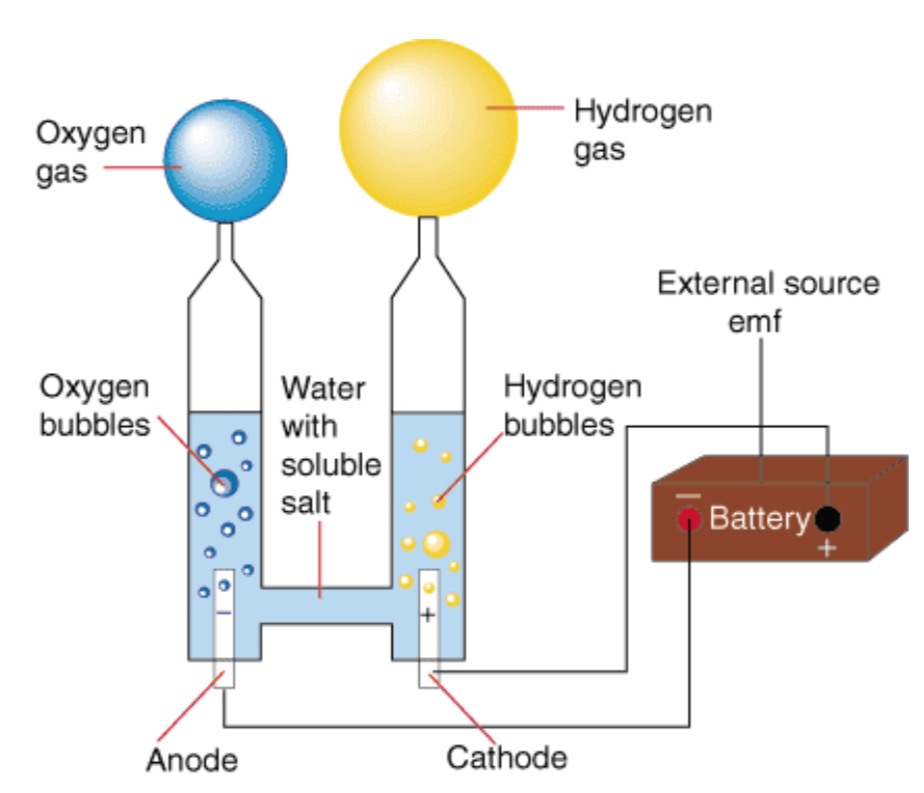 С другой стороны, в традиционных системах этот риск все еще присутствует, поскольку мембрана может порваться или ее уплотнение может сломаться.
С другой стороны, в традиционных системах этот риск все еще присутствует, поскольку мембрана может порваться или ее уплотнение может сломаться.
«В настоящее время использование мембран также ограничивает давление при производстве водорода», — сказал Ротшильд. «E-TAC делает мембрану ненужной, что облегчает производство водорода при гораздо более высоком давлении и устраняет некоторые из высоких затрат на позднее сжатие водорода. Более того, в новом предложенном нами процессе кислород производится в результате самопроизвольной химической реакции между анод и вода, без использования электрического тока.Эта реакция устраняет потребность в электричестве при производстве кислорода и повышает энергетическую эффективность с ~70 до 80 процентов при использовании обычных методов до беспрецедентного 98,7 процента».
Техника, разработанная Ротшильдом и его коллегами, может снизить эксплуатационные расходы устойчивого производства водорода и затраты на оборудование. Исследователи подсчитали, что затраты на производство оборудования на основе E-TAC будут примерно в два раза ниже, чем на существующие технологии.
«Изобретенный нами процесс представляет собой концептуальный прорыв в разделении воды, и, учитывая преимущества, которые он предлагает, он может изменить правила игры и привести к новой технологии производства водорода из воды без CO 2 выбросов, которые могли бы конкурировать с SMR в производстве чистого водорода и обеспечить переход от ископаемого топлива к чистому водородному топливу», — сказал Ротшильд.
После того, как они закончили писать свою статью, исследователи из Техниона запатентовали свое изобретение и основали стартап под названием H 2 Pro с миссией разработки и распространения новой технологии разделения воды, основанной на методе E-TAC. Они надеются вскоре коммерциализировать эту технологию, увеличив электроды и ячейки, используемые в их исследовании, сконструировав и испытав генераторы водорода на основе процесса разделения воды E-TAC, оптимизировав схему их работы и изучив производство водорода под высоким давлением.
«Мы также планируем провести дальнейшие академические исследования для изучения новых электродных материалов и применения передовых аналитических методов для понимания корреляции между составом электрода и микроструктурой и его функциональными свойствами, чтобы разработать следующее поколение Ni(OH) 2 Электроды на основе для нашего процесса разделения воды E-TAC», — сказал Ротшильд.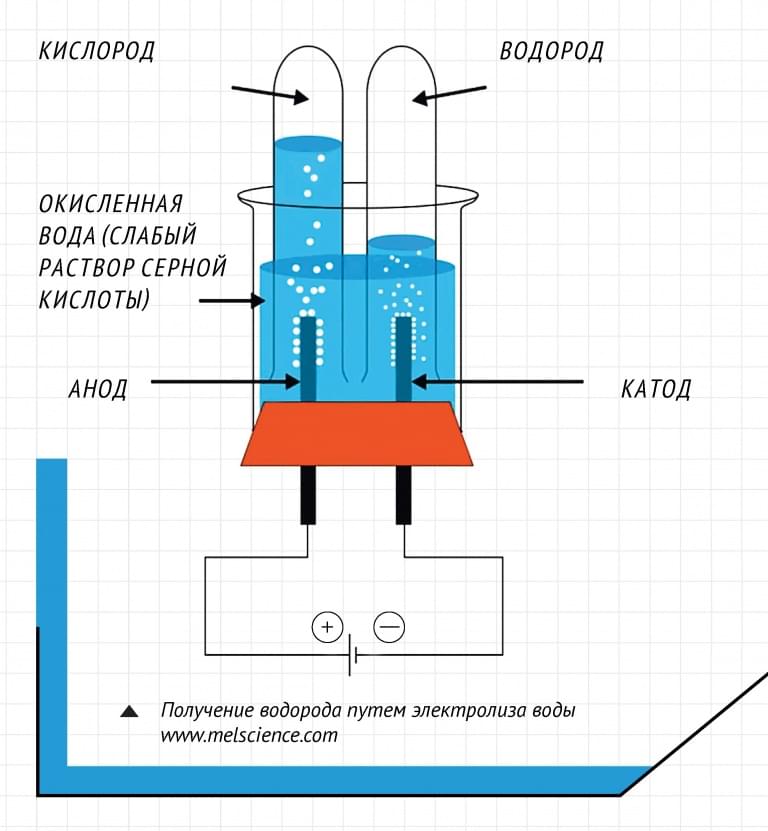 «Наша цель — повысить их производительность (чтобы мы могли запускать более длительные процессы) за счет быстрой зарядки и регенерации, чтобы обеспечить высокую скорость производства водорода».
«Наша цель — повысить их производительность (чтобы мы могли запускать более длительные процессы) за счет быстрой зарядки и регенерации, чтобы обеспечить высокую скорость производства водорода».
Дополнительная информация: Разделение выделения водорода и кислорода с помощью двухэтапного электрохимико-химического цикла для эффективного общего разделения воды. Энергия природы , DOI: 10.1038/s41560-019-0462-7
Авигейл Ландман и др. Фотоэлектрохимическое разделение воды в отдельных кислородных и водородных ячейках, Nature Materials (2017). DOI: 10.1038/nmat4876
Информация журнала: Природные материалы , Энергия природы
© 2019 Наука Х Сеть
Цитата :
Новая технология разделения воды для получения чистого водорода (2019 г.

