Молекулярная физика
Молекулярная физикаМолекулярная физика
- В голодной воде молекулы простые, а в горячей воде другие, а во льде замершие молекулы, а воды нет.
- Молекулы разбрелись по колбе.
- Возьмем замазку и замажем что-нибудь.
- Между молекулами прошла вода и они слиплись.
- Дефузия это явление которое смешивается само собой.
- Запах переходит сам по молекулам.
- Давление воздуха давит на давление воды.
- Молекулы воды имеют более притяжительные свойства.
- Атмосферное давление сжимается и разрушает здания.
- Вода нагревается до нужной ей температуры.
- Тепло идет на плавление спиртовки.
- Нафтальгин.
- Нагревание и охлаждение тел при нагревании и охлаждении.
- При ударе воздух спокойно выходит из мяча.
- Человек содержит в своих легких нормальное давление воздуха, и банка присасывается к телу.
- Если влажность равна 100%, то в природе нужно ждать дождя.

- При увеличении температуры молекулы начинают биться друг о друга и вылетать через сосуд.
- Пар чая соединяется с дующей массой.
- Если горячие молекулы соединить с холодными, то вода все-таки станет теплой.
- Вода — это жидкое существо.
- На самом деле молекулы очень крупные. А если посмотреть на них так, то они очень малого размера. Их глазом не увидишь
- Газ не видно, а жидкость видно, и даже очень хорошо.
- Вода закипает, потому что молекулы находятся в бешеном состоянии.
- Если взять жменьку песка и такую же жменьку молекул…
- Почему в Белоруссии зимы более теплые, чем в Сибири? — Так как у Белоруссии больше удельная теплоемкость.
- Быстро перемещая руку, насос нагрелся.
- Горячие молекулы передаются холодным.
- Если бы ручки паяльника были металлическими, то человек бы много не паял. Но так как в нем ручка деревянная, то человеку нечего бояться.
- Соленые молекулы передвигались и проникали в картошку.

- Мокрые молекулы притягивают друг друга.
- Если у вас спросят, в какой воде диффузия происходит быстрее, в холодной, или теплой, то вы сразу ответите: «В теплой». Почему? Потому, что при теплой температуре диффузия происходит быстрее, чем при холодной (Это письменный ответ!)
- Лед — это замерзшее твердое тело. Оно образовалось в связи с тем, что вода при минусной температуре замерзает или превращается в лед, а вода — это жидкость.
- Удаленная теплоемкость.
- Калолитр.
- Коопеляры.
- При нагревании характер движения молекул увеличивается.
- Так как проволка нагревается, то плотность проволки увеличивается. Она не может достигать абсолютного нуля, а так как после абсолютной массы мы не знаем Co, то она не может нагреваться.
- Весной когда льдина движется молекулы движутся как с водой.
- Ящик с повешенной температурой.
- Если кинул палку, она не раздробилась, потому что она крепкая.

- Жидкости и газы сохраняют свои формы.
- Из менее молекулярного вещества образуется более молекулярное.
- Одна молекула передвигается на место другой и в результате чернило распространяется. И со временем вода будет синенькой.
- Молекулы заморозков и ветра отталкиваются.
- В теплую погоду молекулы движутся хаотичнее.
- Опыты показали, что для газов всякая температура имеет одно и то же значение.
- Банка присасывается к телу потому, что давление банки меньше давления тела.
- Влажность не может превышать 100%, потому что при выше этой влажности воздуха будет обсалютная вода.
- Так как частицы золота в несколько раз тяжелее воды, то их смешивать нельзя, объясняя силы тяжести.
- Результаты неточны, так как из пробирки вышло немного опыта.
- [Ниже следует неизмененный текст, содержавшийся на рваненьком листочке с протоколом лабораторной работы]:
На картине А.А. Пластова. Накортины ми видим как мальчик с сосвоим отцом.
Все кото честно душою мы зовем за собою. В счастья народав светла завтра в наших руках друзья.
Молодыми серцами. Против огня мир.
Тель работы. Измерить грузики и отметить их на листики.
Прибор: динаметор которы измеряит груз.
Глава 4.1. Свойства воды | BookOnLime
Описание свойств воды начинают, обычно, с характеристики аномалий, присущих воде – самому распространенному и, вместе с тем, самому загадочному и необычному веществу на земле. Причем практически каждое из этих аномальных свойств имеет важное значение для обеспечения жизнедеятельности на земле. Необычные свойства воды особенно ярко выделяются на фоне свойств ее гомологов: h3S, h3Se, h3Te. Молекула воды является самым первым и легким представителем этого гомологического ряда, однако гидриды серы, селена и теллура при комнатной температуре, в отличие от воды, находятся в газообразном состоянии (рис.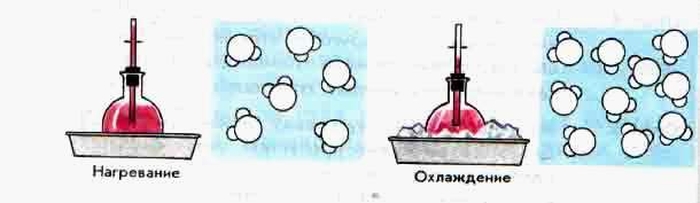
И вода, если бы она была обычным членом гомологического ряда, должна в соответствии со своей молекулярной массой закипать при температуре –70 оС и превращаться в лед при температуре –90 оС, а значит, не могла бы быть основой жизни на земле.
Рис. 23. Точки плавления и кипения гидридов VI группы Периодической системы элементов
Другая особенность воды – это аномальное изменение плотности в зависимости от температуры (рис. 24). В обычных жидкостях плотность всегда уменьшается с ростом температуры. Для воды характер изменения плотности в зависимости от температуры другой – после таяния льда плотность увеличивается, проходит через максимум при температуре 4 оС, а затем уменьшается с ростом температуры.
Рис. 24. Зависимость плотности воды от температуры
Жидкая вода имеет максимум плотности не в точке плавления, а при температуре 4 оС и ее плотность уменьшается, как при повышении температуры, так и при ее понижении до температуры возможного переохлаждения, равной – 40 оС (при 1 атмосфере). При этом плотность воды больше плотности льда на 10%, благодаря чему лед плавает на поверхности воды. При температуре 4 оС вода уменьшается в объеме до минимальных значений, а при дальнейшем понижении температуры от 4 оС до 0 оС расширяется (рис. 25).
При этом плотность воды больше плотности льда на 10%, благодаря чему лед плавает на поверхности воды. При температуре 4 оС вода уменьшается в объеме до минимальных значений, а при дальнейшем понижении температуры от 4 оС до 0 оС расширяется (рис. 25).
Рис. 25. Зависимость молярного объема воды и льда от температуры
Минимум объема воды при температуре 4 оС обусловлен, по мнению Зацепиной Г.Н., особенностью межмолекулярного взаимодействия системы Н2О, в которой число межмолекулярных переходов протонов равно числу внутримолекулярных переходов. Вода, превращаясь в лед, благодаря увеличению объема приобретает огромную силу, способность разрушать крепчайшие породы и, вместе с тем это спасает нашу планету от оледенения. Так как максимум плотности при 4 оС предотвращает конвективное перемешивание жидкости и опускание на дно поверхностных слоев воды, остывших до температуры ниже 4 оС, что замедляет дальнейшее охлаждение и промерзание водоемов.
Морская вода, в отличие от пресной ведет себя иначе.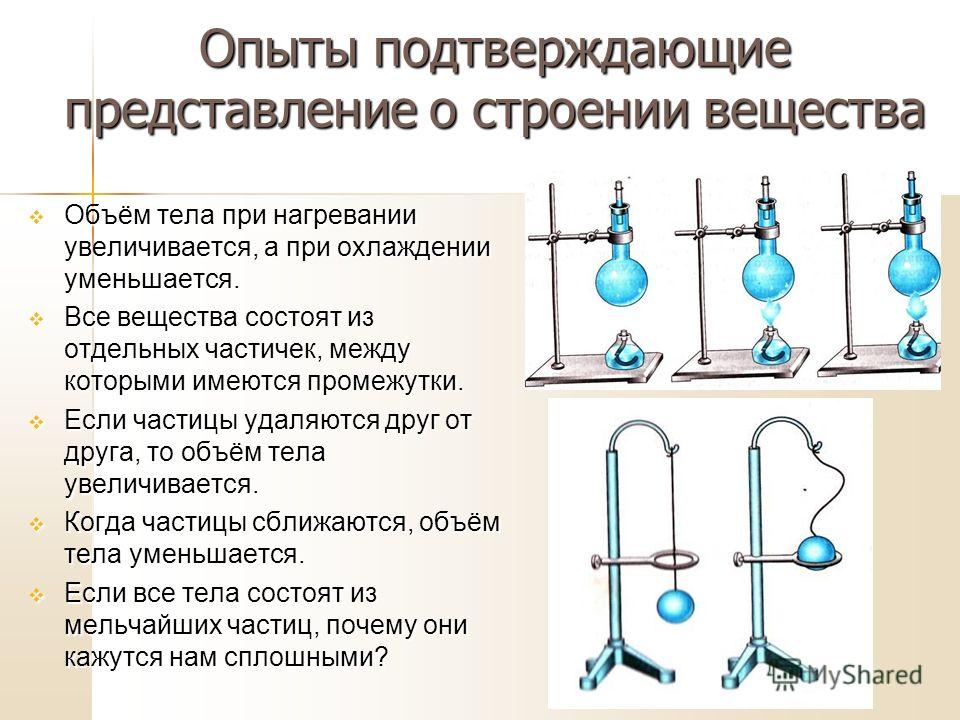 Наличие различных солей меняет ее физико-химические свойства. Она замерзает при – 1,9 оС (переохлажденная вода) и имеет максимальную плотность при – 3,5 оС, то есть она превращается в лед, не достигая наибольшей плотности. Переохлажденная вода, то есть остающаяся в жидком состоянии ниже точки замерзания 0 оС, ведет себя странно, с одной стороны плотность воды сильно уменьшается по мере переохлаждения, но, с другой стороны она приближается к плотности льда при понижении температуры.
Наличие различных солей меняет ее физико-химические свойства. Она замерзает при – 1,9 оС (переохлажденная вода) и имеет максимальную плотность при – 3,5 оС, то есть она превращается в лед, не достигая наибольшей плотности. Переохлажденная вода, то есть остающаяся в жидком состоянии ниже точки замерзания 0 оС, ведет себя странно, с одной стороны плотность воды сильно уменьшается по мере переохлаждения, но, с другой стороны она приближается к плотности льда при понижении температуры.
Другая аномалия воды – необычное поведение ее сжимаемости, то есть уменьшение объема при увеличении давления. Для обычных жидкостей сжимаемость растет с температурой – при высоких температурах жидкости более рыхлы, имеют меньшую плотность, их легче сжать. Вода так ведет себя при высоких температурах выше 50 оС. При низких температурах, от 0 оС до 45 оС сжимаемость воды меняется противоположным образом, в результате при температуре 45 оС появляется минимум. Изотермическая сжимаемость воды при температуре 0 оС в четыре раза больше, чем изотермическая сжимаемость льда (рис.
Рис. 26. Зависимость сжимаемости воды от температуры
Максимальное изменение сжимаемость испытывает при плавлении. Сжимаемость воды и льда мала по сравнению со сжимаемостью других веществ (табл.4.1.1).
Таблица 4.1.1. Сжимаемость ряда веществ в интервале температур от 5 оС до 30 оС
Температура, оС | βs ·1012, дин/см2 | ||
Вода | Метанол | Бензин | |
5 | 51,6 | – | |
10 | 48,7 | 114,9 | 88,5 |
15 | – | 118,8 | 92,2 |
25 | 46,6 | 122,7 | 95,6 |
30 | 45,8 | 131,0 | 103,1 |
Указание особенности изменения сжимаемости воды и льда объясняют характером водородных связей в них. На этих примерах видно, что необычные свойства воды характеризуются появлением максимумов или минимумов на кривых зависимостей от температуры. Такие зависимости означают, что имеют место два противоположных процесса, которые и определяют эти свойства. Один процесс – это обычное тепловое движение, которое усиливается с ростом температуры и делает воду, как и любую другую жидкость, более разупорядоченной. Другой процесс необычный, присущий только воде, за счет него вода становится более упорядоченной при низких температурах. Разные свойства воды по-разному чувствительны к этим двум процессам, и поэтому положение экстремума наблюдается для каждого свойства при своей температуре.
На этих примерах видно, что необычные свойства воды характеризуются появлением максимумов или минимумов на кривых зависимостей от температуры. Такие зависимости означают, что имеют место два противоположных процесса, которые и определяют эти свойства. Один процесс – это обычное тепловое движение, которое усиливается с ростом температуры и делает воду, как и любую другую жидкость, более разупорядоченной. Другой процесс необычный, присущий только воде, за счет него вода становится более упорядоченной при низких температурах. Разные свойства воды по-разному чувствительны к этим двум процессам, и поэтому положение экстремума наблюдается для каждого свойства при своей температуре.
Самая сильная аномалия воды – это температурная зависимость ее теплоемкости. Величина теплоемкости показывает, сколько нужно затратить тепла, чтобы поднять температуру вещества на один градус. При нагревании вещества теплоемкость, как правило, возрастает для всех веществ, кроме воды. Изменение теплоемкости воды с повышением температуры аномально – от 0 оС до 37 оС она падает и от 37 оС до 100 оС начинает повышаться.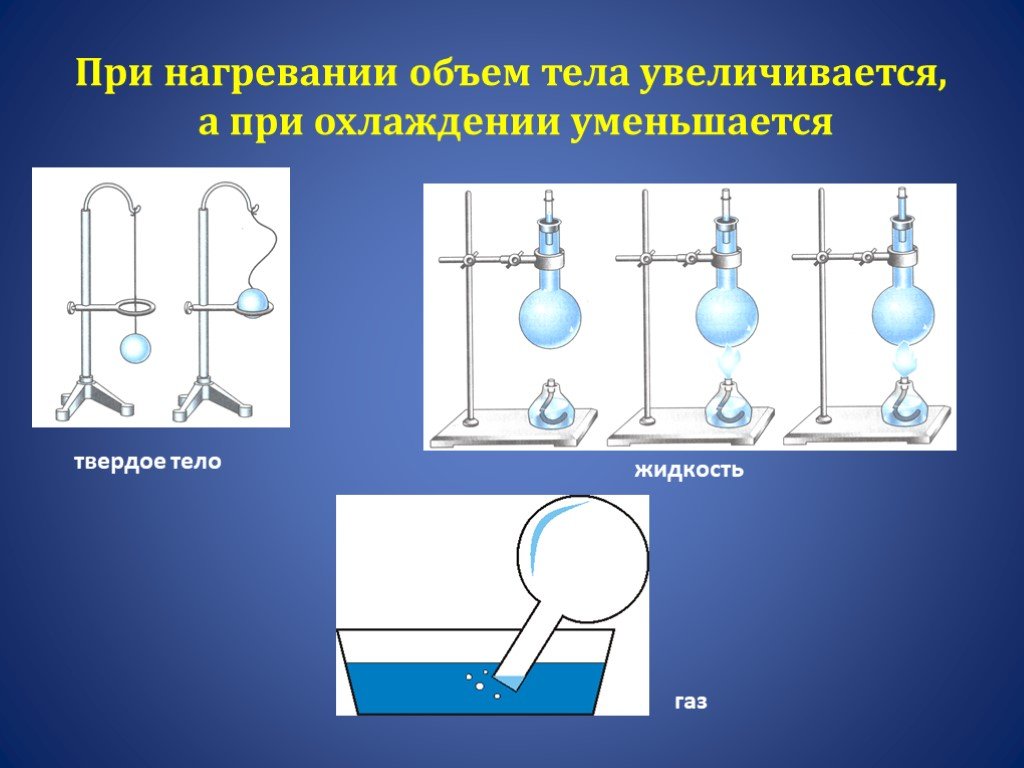 Теплоемкость водяного пара приближается к теплоемкости льда. Минимальное значение теплоемкость воды имеет около 37 оС. Это нормальная температура тела человека (36,6–37 оС), именно при этой температуре происходят сложные биохимические процессы в организме человека, значит энергетически это наиболее выгодные условия. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла изменяется незначительно (табл. 4.1.2).
Теплоемкость водяного пара приближается к теплоемкости льда. Минимальное значение теплоемкость воды имеет около 37 оС. Это нормальная температура тела человека (36,6–37 оС), именно при этой температуре происходят сложные биохимические процессы в организме человека, значит энергетически это наиболее выгодные условия. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла изменяется незначительно (табл. 4.1.2).
Таблица 4.1.2. Теплоемкость веществ в трех агрегатных состояниях
Агрегатное состояние | Теплоемкость вещества (СоР, кал/моль) | ||||||
Н2О | Nh4 | Ch5 | HCl | h3 | Hg | Na | |
газообразное | 8,75 | 9,9 | – | 6,7 | 6,9 | – | 5,0 |
жидкое | 18,0 | 12,0 | 11,0 | 12,0 | 11,0 | 6,8 | 7,6 |
твердое | 9,0 | 9,0 | 14,0 | 15,0 | 13,0 | 6,7 | 8,0 |
Вода же при плавлении льда меняет теплоемкость в два раза, такого огромного скачка при плавлении не наблюдается ни у одного вещества. Теплоемкость льда имеет очень низкое значение, она близка к теплоемкости одноатомных кристаллов и равна теплоемкости твердого аммиака. В процессе плавления металлов теплоемкость практически не изменяется, для веществ из многоатомных молекул в процессе плавления она, как правило, уменьшается, что, вероятно, связано с тем, что молекулы могут свободно вращаться в жидкости, и не могут в твердом теле. Для таких соединений как Н2О и Nh4 теплоемкость в жидком состоянии много больше, чем в твердом состоянии. Это означает, что в воде открываются какие-то новые, энергоемкие процессы, на которые тратится подводимое тепло, что и обуславливает появление избыточной теплоемкости, причем это характерно для всего диапазона температур, при которых вода находится в жидком состоянии. Эта аномалия исчезает только в паре, то есть это свойство именно жидкой воды. Для переохлажденной воды теплоемкость еще больше возрастает при сильном переохлаждении, то есть переохлажденная вода еще более аномальна, чем обычная.
Теплоемкость льда имеет очень низкое значение, она близка к теплоемкости одноатомных кристаллов и равна теплоемкости твердого аммиака. В процессе плавления металлов теплоемкость практически не изменяется, для веществ из многоатомных молекул в процессе плавления она, как правило, уменьшается, что, вероятно, связано с тем, что молекулы могут свободно вращаться в жидкости, и не могут в твердом теле. Для таких соединений как Н2О и Nh4 теплоемкость в жидком состоянии много больше, чем в твердом состоянии. Это означает, что в воде открываются какие-то новые, энергоемкие процессы, на которые тратится подводимое тепло, что и обуславливает появление избыточной теплоемкости, причем это характерно для всего диапазона температур, при которых вода находится в жидком состоянии. Эта аномалия исчезает только в паре, то есть это свойство именно жидкой воды. Для переохлажденной воды теплоемкость еще больше возрастает при сильном переохлаждении, то есть переохлажденная вода еще более аномальна, чем обычная. Высокая теплоемкость воды и высокая удельная теплота плавления среди простых веществ (лед трудно растопить, а воду заморозить) способствуют смягчению климата на земле, не происходит резкого перепада температур зимой и летом, ночью и днем, поскольку существует гигантский регулятор, своеобразный термостат – воды Мирового океана.
Высокая теплоемкость воды и высокая удельная теплота плавления среди простых веществ (лед трудно растопить, а воду заморозить) способствуют смягчению климата на земле, не происходит резкого перепада температур зимой и летом, ночью и днем, поскольку существует гигантский регулятор, своеобразный термостат – воды Мирового океана.
Другой величиной, которая определяет характер теплового движения в жидкостях, является теплопроводность. Зависимость изменения теплопроводности воды от температуры приведена на рисунке 26. Для сравнения приведено изменение теплопроводности четыреххлористого углерода, который ведет себя, как обычная жидкость, то есть с ростом температуры уменьшается теплопроводность и растет теплоемкость. Как видно из рисунка 27, теплопроводность при плавлении льда уменьшается приблизительно в четыре раза. Переохлажденная вода имеет тот же характер изменения теплопроводности, что и обычная.
Рис. 27. Зависимость теплопроводности воды и четыреххлористого углерода от температуры
Все нормальные жидкости с ростом давления изменяют знак зависимости теплопроводности от температуры. Теплопроводность воды не изменяет характера температурной зависимости под давлением. Относительная величина увеличения теплопроводности воды при давлении 1200 кг/см2 составляет около 50%, в то время как для нормальных жидкостей это увеличение при том же давлении составляет приблизительно 270%. Теплопроводность воды слабо зависит от давления, что связано с малой сжимаемостью воды по сравнению с другими жидкостями.
Теплопроводность воды не изменяет характера температурной зависимости под давлением. Относительная величина увеличения теплопроводности воды при давлении 1200 кг/см2 составляет около 50%, в то время как для нормальных жидкостей это увеличение при том же давлении составляет приблизительно 270%. Теплопроводность воды слабо зависит от давления, что связано с малой сжимаемостью воды по сравнению с другими жидкостями.
И, наконец, еще одно удивительное свойство воды, связанное с особенностями ее поверхностного натяжения. Вода в свободном состоянии принимает шарообразную форму (капли дождя, росы). На границе двух сред (вода-воздух) силы межмолекулярного притяжения действуют с одной стороны, стягивая поверхность жидкости. На структуру поверхностного слоя воды влияет два фактора – полярность молекул воды и сетка водородных связей. Поверхностное натяжение воды 72 мн/м (миллиньютон/метр). Это поверхностное натяжение настолько велико, что смоченные водой две пластинки из стекла удается разъединить только с помощью огромных усилий. Из всех известных жидкостей силы поверхностного натяжения воды по своей величине уступают только ртути (около 500 мн/м).
Из всех известных жидкостей силы поверхностного натяжения воды по своей величине уступают только ртути (около 500 мн/м).
Рис. 28. Зависимость сдвиговой вязкости от температуры для воды и четыреххлористого углерода
Еще одно аномальное свойство воды – ее вязкость. Обычные жидкости с повышением давления увеличивают вязкость, а с ростом температуры уменьшают. Характер изменения вязкости у воды другой. На рисунке 28 представлена зависимость вязкости от температуры для воды и четыреххлористого углерода. Как видно из рисунка вязкость четыреххлористого углерода до температуры около 23 оС меньше, чем у воды, а для больших температур она больше, чем у воды.
Зависимость вязкости от давления для разных температур приведена на рисунке 29, из которой следует, что для низких температур с ростом давления вплоть до 2000 атм вязкость воды уменьшается, а затем начинает расти и при температуре 100 оС кривая близка по характеру зависимости для обычных жидкостей.
Рис. 29. Зависимость сдвиговой вязкости от давления для ряда температур
Зависимость сдвиговой вязкости от давления для ряда температур
Увеличение вязкости для них с ростом давления связано с уменьшением длины свободного пробега молекул, так как при большем давлении они плотнее упакованы. Как видно из приведенных характеристик, вода действительно является необычной, аномальной жидкостью и природа этих аномалий кроется в особенностях ее структуры.
Heat- Energy on the Move
Нагрев вещества заставляет его атомы и молекулы двигаться быстрее. Это происходит независимо от того, является ли вещество твердым, жидким или газообразным. Нелегко увидеть, как это происходит в твердом теле, но давайте попробуем это для жидкости и газа. Посмотрим, сможете ли вы сказать, что тепло заставляет молекулы двигаться!
Вот что нужно сделать:
- Положите немного льда в большую чашку и добавьте воды, чтобы получилась ледяная вода. После того, как вода остынет, налейте ледяную воду (без льда) в чашку так, чтобы она была заполнена примерно на ¾.

- Попросите своего взрослого партнера налить горячую воду в другую чашку, пока она не наполнится на ¾.
- Одновременно вы и ваш взрослый партнер должны капнуть по одной капле желтого и по одной капле синего пищевого красителя на поверхность горячей и холодной воды.
Что вы заметили в движении пищевого красителя в двух чашках?
Чего ожидатьПищевой краситель в горячей воде будет перемещаться и перемешиваться больше и станет более зеленым, чем пищевой краситель в холодной воде.
Что там происходит?
Тепло — это форма энергии. Тепловая энергия воды заставляет молекулы воды в горячей воде двигаться быстрее, чем молекулы воды в холодной воде. Более быстро движущиеся молекулы в горячей воде чаще и с большей силой сталкиваются с молекулами пищевого красителя и перемещают их быстрее, чем более медленно движущиеся молекулы воды в холодной воде.
Что еще можно попробовать? Вы могли видеть, заставляет ли нагревание молекулы газа двигаться быстрее. Давай попробуем!
Давай попробуем!
Что вам понадобится:
- Горячая водопроводная вода
- Холодная водопроводная вода
- 3 пластиковых стаканчика (достаточно широких, чтобы в них поместилась пластиковая бутылка)
- Пластиковая бутылка на 8 унций (из бутилированной воды)
- Жидкое моющее средство для посуды
Будьте в безопасности
Прежде чем продолжить, обязательно ознакомьтесь с инструкциями по технике безопасности на стр. 1.
Вот что нужно сделать:
- Добавьте горячую воду в одну чашку и холодную воду в другую, пока они не будут заполнены примерно наполовину.
- В отдельной пустой чашке приготовьте раствор моющего средства, смешав ½ чайной ложки жидкого моющего средства для посуды с 1 столовой ложкой воды.
- Опустите открытое горлышко бутылки в чашку с моющим средством. Осторожно наклоните и поднимите бутылку, чтобы пленка моющего средства закрыла горлышко бутылки.

- Медленно опустите донышко бутылки в горячую воду. Что происходит?
- Теперь погрузите дно бутылки в холодную воду. Что происходит?
Когда бутылка находится в горячей воде, на ее верхней части образуется пузырь. Когда бутылку помещают в холодную воду, пузырь сжимается.
Что там происходит?
Когда бутылку помещают в горячую воду, тепловая энергия воды заставляет молекулы газа внутри бутылки двигаться быстрее и распространяться дальше друг от друга. По мере того, как они расходятся дальше друг от друга, они давят на пленку моющего средства и образуют пузырь.
Когда бутылку затем помещают в холодную воду, молекулы газа замедляются и пузырек сжимается.
2.13: Вода — теплота парообразования
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 12670
- Безграничный
- Безграничный
Цели обучения
- Объяснить, как теплота парообразования связана с температурой кипения воды
Вода в жидкой форме имеет необычно высокую температуру кипения, значение близкое к 100°C. В результате наличия сети водородных связей между молекулами воды требуется большое количество энергии для преобразования одного грамма жидкой воды в водяной пар, потребность в энергии, называемая теплотой парообразования. Вода имеет теплоту парообразования 40,65 кДж/моль. Для осуществления этого изменения в воде требуется значительное количество тепловой энергии (586 калорий). Этот процесс происходит на поверхности воды. Когда жидкая вода нагревается, водородные связи затрудняют отделение молекул воды друг от друга, что необходимо для ее перехода в газообразную фазу (пар). В результате вода действует как поглотитель тепла или резервуар тепла, и для ее кипения требуется гораздо больше тепла, чем для такой жидкости, как этанол (зерновой спирт), водородная связь которого с другими молекулами этанола слабее, чем водородная связь воды. В конце концов, когда вода достигает точки кипения 100 ° по Цельсию (212 ° по Фаренгейту), тепло может разорвать водородные связи между молекулами воды, а кинетическая энергия (движение) между молекулами воды позволяет им покинуть жидкость.
В результате наличия сети водородных связей между молекулами воды требуется большое количество энергии для преобразования одного грамма жидкой воды в водяной пар, потребность в энергии, называемая теплотой парообразования. Вода имеет теплоту парообразования 40,65 кДж/моль. Для осуществления этого изменения в воде требуется значительное количество тепловой энергии (586 калорий). Этот процесс происходит на поверхности воды. Когда жидкая вода нагревается, водородные связи затрудняют отделение молекул воды друг от друга, что необходимо для ее перехода в газообразную фазу (пар). В результате вода действует как поглотитель тепла или резервуар тепла, и для ее кипения требуется гораздо больше тепла, чем для такой жидкости, как этанол (зерновой спирт), водородная связь которого с другими молекулами этанола слабее, чем водородная связь воды. В конце концов, когда вода достигает точки кипения 100 ° по Цельсию (212 ° по Фаренгейту), тепло может разорвать водородные связи между молекулами воды, а кинетическая энергия (движение) между молекулами воды позволяет им покинуть жидкость.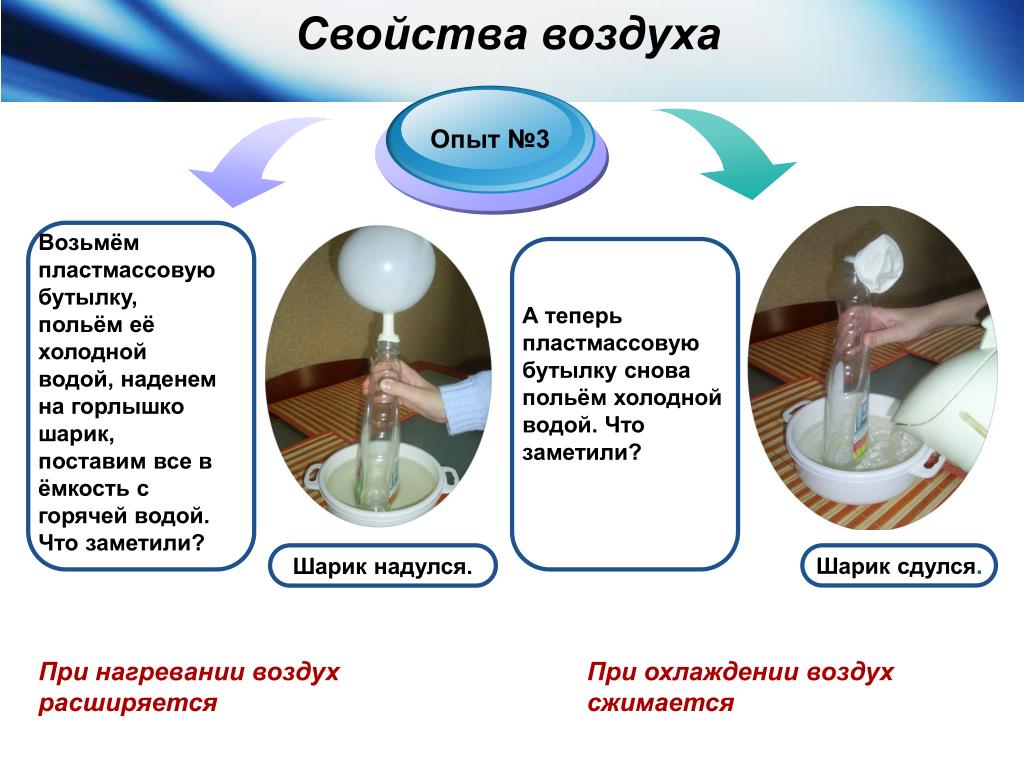 как газ. Даже когда температура ниже точки кипения, отдельные молекулы воды получают достаточно энергии друг от друга, так что некоторые молекулы поверхностной воды могут ускользнуть и испариться; этот процесс известен как испарение.
как газ. Даже когда температура ниже точки кипения, отдельные молекулы воды получают достаточно энергии друг от друга, так что некоторые молекулы поверхностной воды могут ускользнуть и испариться; этот процесс известен как испарение.
Тот факт, что для испарения воды необходимо разорвать водородные связи, означает, что в процессе используется значительное количество энергии. Когда вода испаряется, процесс потребляет энергию, охлаждая окружающую среду, в которой происходит испарение. У многих живых организмов, в том числе и у человека, испарение пота, состоящего на 90 % из воды, позволяет организму охлаждаться для поддержания гомеостаза температуры тела.
Когда вода испаряется, процесс потребляет энергию, охлаждая окружающую среду, в которой происходит испарение. У многих живых организмов, в том числе и у человека, испарение пота, состоящего на 90 % из воды, позволяет организму охлаждаться для поддержания гомеостаза температуры тела.
Ключевые моменты
- Диссоциация молекул жидкой воды, превращающая вещество в газ, требует много энергии.
- Температура кипения воды – это температура, при которой имеется достаточно энергии для разрыва водородных связей между молекулами воды.
- Вода превращается из жидкой формы в газообразную (пар), когда достигается теплота парообразования.
- Испарение пота (в основном воды) отводит тепло с поверхности кожи, охлаждая тело.
Ключевые термины
- теплота парообразования : Энергия, необходимая для превращения данного количества вещества из жидкости в газ при заданном давлении (часто атмосферном).
Эта страница под названием 2.







