Почему молекула воды полярная — Все о воде

В составе молекулы воды – один атом кислорода и два атома водорода, которые имеют ковалентную связь, именно это является причиной, по которой молекула Н2О – полярная.
Полярность молекулы определена конкретно её геометрией, – молекула воды представлена треугольником, в котором водород несет частичный положительный заряд, а кислород – частичный отрицательный заряд. При подобной асимметричности электронная плотность частично смещается вдоль оси к «отрицательному» атому.
Молекулы Н2О обладают очень высокой полярностью, и это обуславливает целый ряд различных качеств воды:
- Способность растворять другие полярные молекулы (соли, спирты, твердые вещества, газы и т.д.), образовывая растворы с различными физическими свойствами.
- Электролиты распадаются на ионы (процесс диссоциации), что становится причиной изменения плотности воды.
- Возможность обратимого гидролиза многих солей, растворенных в воде.
- Поверхностное натяжение воды и др.
Огромное практическое значение имеет влияние воды на твердые вещества. Наличие двух положительных атомов объясняет возможность воды образовывать новые соединения с другими полярными молекулами. Эта водородная связь снижает прочность твердых материалов, разрушая их структуру. Благодаря полярности, молекулы воды также способствуют протеканию многих восстановительных и окислительных реакций между веществами.
Понравилась статья? Поделитесь:
Полярные вещества — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 июля 2014; проверки требуют 6 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 июля 2014; проверки требуют 6 правок.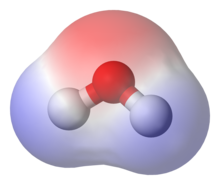
Поля́рные вещества́ в химии — соединения, молекулы которых обладают электрическим дипольным моментом. Для полярных веществ, в сравнении с неполярными, характерны высокая диэлектрическая проницаемость (более 10 в жидкой фазе), повышенные температура кипения и температура плавления.
Дипольный момент обычно возникает вследствие разной электроотрицательности составляющих молекулу атомов, из-за чего связи в молекуле приобретают полярность. Однако для приобретения дипольного момента требуется не только полярность связей, но и соответственное их расположение в пространстве. Молекулы, имеющие форму, подобную молекулам метана CH4 (∠HCH = 109,5°, правильный тетраэдрический), триоксида серы SO3 (∠OSO = 120°, правильный треугольный) либо диоксида углерода CO2 (∠OCO = 180°, линейный), а также фторида серы(VI) (все углы ∠FSF = 90°, правильный октаэдрический), являются неполярными.
Полярные растворители наиболее охотно растворяют полярные вещества, а также обладают способностью сольватировать. Примерами полярного растворителя являются вода, спирты и другие вещества.
Молекула воды, полярность — Справочник химика 21
Физические свойства. Чистая вода представляет собой бесцветную прозрачную жидкость без запаха и вкуса. Она существует в трех агрегатных состояниях твердое — лед, жидкое и газообразное — водяной пар. При О °С твердая и жидкая фазы находятся в состоянии динамического равновесия, поэтому температура плавления льда равна О °С. При 1(Ю °С в равновесии находятся жидкая и газообразная фазы. Температура кипения воды равна 100 °С. При — -4°С она имеет наибольшую плотность, равную 1 г/см . Выше или ниже этой температуры плотность воды меньше 1 г/см . Эта особенность отличает воду от всех других веществ, плотность которых с понижением температуры увеличивается. При переходе воды из жидкого в твердое состояние происходит увеличение объема и уменьшение плотности из 92 объемов жидкой воды образуется 100 объемов льда. Молекула воды полярна и построена по типу треугольника, в вершине которого находится электроотрицательный атом кислорода, а в углах оснований — водород. Валентный угол равен 104,5° (рис. 25).Молекулы воды полярны. Что это значит [c.117]
Молекулы Н О и СО2 каждая содержит по две полярных связи (Н—О—Н и соответственно 0=С=0). Почему молекула СО2 неполярна, а молекула воды полярна
Дипольный момент молекул есть векторная сумма диполь-ных моментов связей. Если геометрия молекулы такова, что дипольные моменты связей компенсируют друг друга, то дипольный момент равен нулю и молекула неполярна даже при наличии в ней поляризованных связей (молекула 05). Молекула воды полярна (уголковая форма). [c.106]
ИОН-ДИПОЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ. Молекула воды полярна. Кислородный конец обогащен электронами по сравнению с водородным концом , так как электроотрицательность кислорода больше, чем водорода. Химик отметил бы это неравное распределение электронной плотности, написав символ б + у более положительного конца молекулы и символ б —
Известно, что хорошим растворителем многих веществ является вода. Это объясняется тем, что молекулы воды полярны. Такая полярная частица — диполь, электростатически взаимодействуя с полярными частицами твердого тела, способствует отрыву последних от поверхности кристалла. [c.143]
Молекула воды — полярная молекула (рис. 6.24 следует обратить I внимание на то, что дипольный момент принято представлять в виде век- i тора, направленного от положительного заряда к отрицательному). [c.166]
Этот процесс можно представить следующим образом. Молекула воды полярна, а кристаллы соли, как известно, состоят из ионов. Молекулы воды будут притягиваться к ионам соли. Если сила этого взаимодействия достаточна, чтобы отделить ион от кристалла, то ион переходит в раствор. Так переходит в раствор ион за ионом.
Таков же механизм связывания и иммобилизации молекул воды полярными группировками ряда высокомолекулярных веществ, в частности белков. [c.43]
В молекуле воды имеются две связи О—Н. Кислород сравнительно более электро-нофильный элемент, чем водород. В результате этого связь О—Н полярна, причем вектор полярности направлен от Н к О (рис. 5-8, а). Область молекулы HgO, где расположен кислород, приобретает частичный отрицательный заряд (26″), а у атомов водорода частичный заряд положителен (б+). Векторы полярности в молекуле воды расположены, как уже указывалось, под углом 104, 5°. Результирующий вектор молекулы HgO находим по правилу сложения векторов — строим параллелограмм (рнс. 5-8, б). Как видно из рисунка, молекула воды полярна, это диполь. Дипольный момент равен 1,84 Д.
Какие из перечисленных факторов определяют более высокую по сравнению с кислородом и водородом температуру кипения воды молекула воды угловая, валентный угол равен 104,5° молекула воды полярна в молекуле воды две химические связи между молекулами воды образуются водородные связи молекула воды трехатомна
Диссоциация воды становится понятной, если учесть, что связь между одним из атомов водорода и атомом кислорода в молекуле воды полярна. Диссоциация протекает по следующей схеме [c.96]
Распад веществ на ионы происходит с поглощением теплоты. Очевидно, в соответствии с принципом Ле Шателье, с повышением температуры раствора степень диссоциации увеличивается. Диссоциация электролитов на ионы происходит не только при их растворении в воде, но и в некоторых других растворителях, например в муравьиной кислоте, винном спирте и ацетоне, молекулы которых, как и молекулы воды, полярны. В веществах неполярных и малополярных, например в хлороформе, сероуглероде и эфире, ионизация электролитов не происходит. Об ионизирующем действии того или иного растворителя судят по его диэлектрической постоянной.
Адсорбционная связь — истинная гидратация. В гидрофильных коллоидных системах она осуществляется путем связывания полярных молекул воды полярными группами высокополимеров. Процесс гидратации экзотермичен. Так, [c.353]
С практической точки зрения единственной целью изучения дисперсионных взаимодействий является вычисление энергий взаимодействия, вызываемых силами, действующими между растворенными веществами в воде. По мнению автора, в настоящее время невозможно производить надежные расчеты такого рода. Только недавно были проведены подробные расчеты в гораздо более простом случае взаимодействия насыщенных и ненасыщенных молекул известной геометрии и взаимной ориентации в отсутствие воды, и даже эти расчеты для проверки их состоятельности нуждаются в использовании результатов экспериментальных измерений и не могут претендовать на то, чтобы надежно предсказать ожидаемую силу взаимодействия между данными молекулами. В водном растворе проблема становится еще более трудной, так как здесь необходимо оценивать небольшую разность между энергиями взаимодействия вода — растворенное вещество, с одной стороны, и вода — вода, растворенное вещество — растворенное вещество — с другой. Дело осложняется еще и тем, что молекулы воды полярны и не имеют сферической формы. Вполне вероятно, что различные но своей геометрии и полярности растворенные вещества по-разному взаимодействуют с молекулами воды. Существующее положение можно проиллюстрировать сопоставлением следующих точек зрения 1) дисперсионные силы не должны вносить значительный вклад в энергию взаимодействия углеводородов в воде, так как поляризуемость на единицу объема очень близка для воды и гексана [54] 2) как отмечалось выше, дисперсионные силы должны вносить существенный вклад в энергию взаимоде
Полярные и неполярные молекулы — Знаешь как
Что такое полярные и неполярные молекулы
 Рис. 32. Схемы полярной и не полярной молекул: а — полярная молекула; б—неполярная молекула
Рис. 32. Схемы полярной и не полярной молекул: а — полярная молекула; б—неполярная молекулаВо всякой молекуле имеются как положительно заряженные частицы — ядра атомов, так и отрицательно заряженные — электроны. Для каждого рода частиц (или, вернее, зарядов) можно найти такую точку, которая будет являться как бы их «электрическим центром тяжести». Эти точки называются полюсами молекулы. Если в молекуле электрические центры тяжести положительных и отрицательных зарядов совпадут, то молекула будет неполярной. Таковы, например, молекулы Н2, N2, образованные одинаковыми атомами, у которых общие пары электронов в равной мере принадлежат обоим атомам, а также многие симметрично построенные молекулы с атомной связью, например метан СН4, четыреххлористый углерод ССl4.
Но если молекула построена несимметрично, например состоит из двух разнородных атомов, то, как мы уже говорили, общая пара электронов может быть в большей или меньшей степени смещена в сторону одного из атомов. Очевидно, что в этом случае, вследствие неравномерного распределения положительных и отрицательных зарядов внутри молекулы, их электрические центры тяжести не совпадут и получится полярная молекула (рис. 32).
Полярные молекулы это
Полярные молекулы являются диполями. Этим термином обозначают вообще всякую электронейтральную систему, т. е. систему, состоящую из положительных и отрицательных зарядов, распределенных таким образом, что их электрические центры тяжести не совпадают.
Расстояние между электрическими центрами тяжести тех и других зарядов (между полюсами диполя) называется длиной диполя. Длина диполя характеризует степень полярности молекулы. Понятно, что для различных полярных молекул длина диполя различна; чем она больше, тем резче выражена полярность молекулы.
 Рис. 33. Схемы строения молекул СO2 и CS2
Рис. 33. Схемы строения молекул СO2 и CS2На практике степень полярности тех или иных молекул устанавливают путем измерения так называемого дипольного момента молекулы т, который определяется как произведение длины диполя l на заряд его полюса е:
т = l• е
Величины дипольных моментов связаны с некоторыми свой-ствами веществ и могут быть определены экспериментальным путем. Порядок величины т всегда 10-18, так как заряд элек-
трона равен 4,80 • 10-10 электростатических единиц, а длина диполя — величина того же порядка, что и диаметр молекулы, т. е. 10-8см. Ниже приведены дипольные моменты молекул некоторых неорганических веществ.
Дипольные моменты некоторых веществ
т • 1018
Водород . . . ..…….. 0
Вода……. 1,85
Азот . . . ……….. 0
Хлористый водород……. 1,04
Двуокись углерода……. 0
Бромистый водород . …… 0,79
Сероуглерод………… 0
Йодистый водород…….. 0,38
Сероводород……….. 1,1
Окись углерода ……. 0,11
Сернистый газ. . . …… 1,6
Синильная кислота……..2,1
Определение величин дипольных моментов позволяет сделать много интересных выводов относительно строения различных молекул. Рассмотрим некоторые из этих выводов.
 Рис. 34. Схема строения молекулы воды
Рис. 34. Схема строения молекулы водыКак и следовало ожидать, дипольные моменты молекул водорода и азота равны нулю; молекулы этих веществ совершенно симметричны и, следовательно, электрические заряды в них распределены равномерно. Отсутствие полярности у двуокиси углерода и у сероуглерода показывает, что их молекулы также построены симметрично. Строение молекул этих веществ схематически изображено на рис. 33.
Несколько неожиданным является наличие довольно большого дипольного момента у воды. Так как формула воды аналогична формулам двуокиси углерода
и сероуглерода, то следовало ожидать, что её молекулы будут построены так же симметрично, как и молекулы CS2и СО2.
Однако ввиду экспериментально установленной полярности молекул воды (полярности молекул) это предположение приходится отбросить. В настоящее время молекуле воды приписывают несимметричное строение (рис. 34): два атома водорода соединены с атомом кислорода так, что их связи образуют угол около 105°. Аналогичное расположение атомных ядер имеется и в других молекулах такого же типа (H2S, SO2), обладающих дипольными моментами.
Полярностью молекул воды объясняются многие ее физические свойства.
46 47 48
Вы читаете, статья на тему Полярные и неполярные молекулы
Водный режим растений Свойства молекулы воды Полярность
 Водный режим растений
Водный режим растений
 Свойства молекулы воды Полярность молекул воды. n Под полярностью подразумевают неравномерное распределение зарядов в молекуле воды. n Такую молекулу называют диполем. n Более электроотрицательный атом кислорода притягивает электроны водородных атомов, в результате между молекулами возникает электростатическое взаимодействие. Эти взаимодействия более слабые, чем обычные ионные связи называются водородными связями.
Свойства молекулы воды Полярность молекул воды. n Под полярностью подразумевают неравномерное распределение зарядов в молекуле воды. n Такую молекулу называют диполем. n Более электроотрицательный атом кислорода притягивает электроны водородных атомов, в результате между молекулами возникает электростатическое взаимодействие. Эти взаимодействия более слабые, чем обычные ионные связи называются водородными связями.
 Вода как растворитель n n n Вода хороший растворитель для полярных веществ. Неполярные вещества, например липиды, не смешиваются с водой и потому могут разделять растворы на отдельные компартменты, подобно биологическим мембранам. Неполярные части молекул отталкиваются водой и притягиваются друг к другу. Пример того – масла, образующие пленки, или крупные капли из мелких. То есть неполярные молекулы гидрофобны.
Вода как растворитель n n n Вода хороший растворитель для полярных веществ. Неполярные вещества, например липиды, не смешиваются с водой и потому могут разделять растворы на отдельные компартменты, подобно биологическим мембранам. Неполярные части молекул отталкиваются водой и притягиваются друг к другу. Пример того – масла, образующие пленки, или крупные капли из мелких. То есть неполярные молекулы гидрофобны.
 Другие свойства воды n n Большая теплоемкость. Удельной теплоемкостью воды называют количество теплоты в джоулях, которое необходимо, чтобы поднять температуру 1 кг воды на 1°C. Большая теплоемкость сводит к минимуму температурные изменения в водной среде, благодаря этому биохимические реакции идут в относительно узком температурном диапазоне и опасность нарушения от резкого скачка температуры им грозит не так сильно. n n Большая теплота испарения. Скрытая теплота испарения – это мера тепловой энергии, которую нужно сообщить жидкости для ее превращения в пар, т. е. для преодоления сил молекулярного сцепления. Испарение воды требует значительного количества энергии, что объяснимо наличием водородных связей между молекулами. Именно из-за этого температура кипения воды – вещества, обладающего настолько маленькими молекулами – необычно высока.
Другие свойства воды n n Большая теплоемкость. Удельной теплоемкостью воды называют количество теплоты в джоулях, которое необходимо, чтобы поднять температуру 1 кг воды на 1°C. Большая теплоемкость сводит к минимуму температурные изменения в водной среде, благодаря этому биохимические реакции идут в относительно узком температурном диапазоне и опасность нарушения от резкого скачка температуры им грозит не так сильно. n n Большая теплота испарения. Скрытая теплота испарения – это мера тепловой энергии, которую нужно сообщить жидкости для ее превращения в пар, т. е. для преодоления сил молекулярного сцепления. Испарение воды требует значительного количества энергии, что объяснимо наличием водородных связей между молекулами. Именно из-за этого температура кипения воды – вещества, обладающего настолько маленькими молекулами – необычно высока.
 Другие свойства воды n n Большая теплота плавления. Скрытая теплота плавления – мера тепловой энергии, необходимая для расплавления твердого вещества (в случае воды – льда). Воде для плавления требуется довольно большое количество энергии. Справедливо и обратное – при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости. n n Большое поверхностное натяжение и когезия. Когезия – сцепления молекул физического тела друг с другом при действии сил притяжения. На поверхности жидкости существует поверхностное натяжение – результат действия между молекулами сил когезии, направленных внутрь. Значительная когезия играет важную роль в движении воды по сосудам ксилемы.
Другие свойства воды n n Большая теплота плавления. Скрытая теплота плавления – мера тепловой энергии, необходимая для расплавления твердого вещества (в случае воды – льда). Воде для плавления требуется довольно большое количество энергии. Справедливо и обратное – при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости. n n Большое поверхностное натяжение и когезия. Когезия – сцепления молекул физического тела друг с другом при действии сил притяжения. На поверхности жидкости существует поверхностное натяжение – результат действия между молекулами сил когезии, направленных внутрь. Значительная когезия играет важную роль в движении воды по сосудам ксилемы.
 Физиологические функции воды n n n n n Обеспечивает поддержание структуры (высокое содержание воды в протоплазме). Служит растворителем и средой для диффузии. Вода участвует в реакциях гидролиза. Участвует в фотосинтезе: 6 CO 2+6 H 2 O→C 6 H 12 O 6+6 O 2 Обуславливает осмос и тургесцентность клеток. Обеспечивает транспирацию и транспорт веществ. Обеспечивает прорастание семян – набухание, разрыв семенной оболочки, дальнейшее развитие. Служит средой в которой происходит оплодотворение. Обеспечивает распространение семян и гамет.
Физиологические функции воды n n n n n Обеспечивает поддержание структуры (высокое содержание воды в протоплазме). Служит растворителем и средой для диффузии. Вода участвует в реакциях гидролиза. Участвует в фотосинтезе: 6 CO 2+6 H 2 O→C 6 H 12 O 6+6 O 2 Обуславливает осмос и тургесцентность клеток. Обеспечивает транспирацию и транспорт веществ. Обеспечивает прорастание семян – набухание, разрыв семенной оболочки, дальнейшее развитие. Служит средой в которой происходит оплодотворение. Обеспечивает распространение семян и гамет.
 Формы воды в клетках и тканях. Вода клетки Связанная вода Вода капиллярно связанная (в пределах организма) Вода связанная физически Свободная вода обладает высокой подвижностью. Вода связанная химически
Формы воды в клетках и тканях. Вода клетки Связанная вода Вода капиллярно связанная (в пределах организма) Вода связанная физически Свободная вода обладает высокой подвижностью. Вода связанная химически
 Удержание воды в клетке и тканях n n n Вода удерживается в клетках за счет осмоса и набухания биоколлоидов. Даже если содержание воды снизится до критического – большое количество воды останется в клетке в составе коллоидов. Доля связанной воды зависит от вида, части растения, общего содержания воды в тканях. n n Клеточные стенки обладают высокой гигроскопичностью, в основном из-за гидрофильности пектиновых веществ и целлюлозных фибрилл. Разделяют две фракции воды подвижную и малоподвижную. Вода, удерживаемая водородными связями на фибриллах целлюлозы и содержащаяся в микрокапиллярах, считается малоподвижной. Вода, содержащаяся в крупных капиллярах между фибриллами, достаточно легко перемещается.
Удержание воды в клетке и тканях n n n Вода удерживается в клетках за счет осмоса и набухания биоколлоидов. Даже если содержание воды снизится до критического – большое количество воды останется в клетке в составе коллоидов. Доля связанной воды зависит от вида, части растения, общего содержания воды в тканях. n n Клеточные стенки обладают высокой гигроскопичностью, в основном из-за гидрофильности пектиновых веществ и целлюлозных фибрилл. Разделяют две фракции воды подвижную и малоподвижную. Вода, удерживаемая водородными связями на фибриллах целлюлозы и содержащаяся в микрокапиллярах, считается малоподвижной. Вода, содержащаяся в крупных капиллярах между фибриллами, достаточно легко перемещается.
 Строение корня. n n n Выделяют: корневой чехлик зоны: деления, роста растяжением, всасывания , проведения.
Строение корня. n n n Выделяют: корневой чехлик зоны: деления, роста растяжением, всасывания , проведения.
 Корневой чехлик n n Клетки наружных слоев его секретируют полисахаридную слизь и слущиваются при передвижении корня в почве. Клетки центральной части чехлика – статоциты содержат много крахмальных зерен, участвующих в восприятии корнем силы тяжести.
Корневой чехлик n n Клетки наружных слоев его секретируют полисахаридную слизь и слущиваются при передвижении корня в почве. Клетки центральной части чехлика – статоциты содержат много крахмальных зерен, участвующих в восприятии корнем силы тяжести.
 Функции корневого чехлика n n n Предохранение растущей зоны, в первую очередь апикальной меристемы от повреждений при контакте с почвой. Облегчение движения кончика корня в почве. Восприятие геотропического раздражителя, обеспечивающее правильную пространственную ориентацию.
Функции корневого чехлика n n n Предохранение растущей зоны, в первую очередь апикальной меристемы от повреждений при контакте с почвой. Облегчение движения кончика корня в почве. Восприятие геотропического раздражителя, обеспечивающее правильную пространственную ориентацию.
 Апикальная меристема корня n n n Меристема корня откладывает новые клетки не только внутрь, но и наружу, то есть в направлении корневого чехлика, возобновляя его. Апикальные клетки меристемы корня отличаются от остальных более редкими делениями, более медленным синтезом ДНК, РНК и белка. Эти клетки получили название покоящегося центра. При повреждении апикальной меристемы из-за неблагоприятных факторов, она восстанавливается за счет деления клеток покоящегося центра.
Апикальная меристема корня n n n Меристема корня откладывает новые клетки не только внутрь, но и наружу, то есть в направлении корневого чехлика, возобновляя его. Апикальные клетки меристемы корня отличаются от остальных более редкими делениями, более медленным синтезом ДНК, РНК и белка. Эти клетки получили название покоящегося центра. При повреждении апикальной меристемы из-за неблагоприятных факторов, она восстанавливается за счет деления клеток покоящегося центра.
 Дифференциация корня n n n Ризодерма — покровная ткань, которой снаружи покрыты молодые корневые окончания. Она содержит корневые волоски и участвует в процессах всасывания. Кора — образована паренхимой, обычно дифференцируется на уровне зоны растяжения. Она рыхлая и имеет систему межклетников, по которой вдоль оси корня циркулируют газы, необходимые для дыхания и поддержания обмена веществ. Через кору активно проходит радиальный транспорт воды и растворенных солей от ризодермы к осевому цилиндру. В тканях коры осуществляется активный синтез метаболитов и откладываются запасные питательные вещества. Осевой цилиндр — представляет собой сложный комплекс из проводящей, образовательной и основной тканей.
Дифференциация корня n n n Ризодерма — покровная ткань, которой снаружи покрыты молодые корневые окончания. Она содержит корневые волоски и участвует в процессах всасывания. Кора — образована паренхимой, обычно дифференцируется на уровне зоны растяжения. Она рыхлая и имеет систему межклетников, по которой вдоль оси корня циркулируют газы, необходимые для дыхания и поддержания обмена веществ. Через кору активно проходит радиальный транспорт воды и растворенных солей от ризодермы к осевому цилиндру. В тканях коры осуществляется активный синтез метаболитов и откладываются запасные питательные вещества. Осевой цилиндр — представляет собой сложный комплекс из проводящей, образовательной и основной тканей.
 Поглощение воды корнем, радиальный транспорт воды n n n Через клетки коры возможны два пути транспорта воды минеральных веществ: через цитоплазму по плазмодесмам (симпластный транспорт) и по клеточным стенкам (апопластный транспорт). Сопротивление клеточных стенок для воды значительно ниже, чем у цитоплазмы, следовательно, транспорт воды по апопласту более быстрый. На уровне эндодермы апопластный путь становится невозможным из-за непроницаемых для воды поясков Каспари.
Поглощение воды корнем, радиальный транспорт воды n n n Через клетки коры возможны два пути транспорта воды минеральных веществ: через цитоплазму по плазмодесмам (симпластный транспорт) и по клеточным стенкам (апопластный транспорт). Сопротивление клеточных стенок для воды значительно ниже, чем у цитоплазмы, следовательно, транспорт воды по апопласту более быстрый. На уровне эндодермы апопластный путь становится невозможным из-за непроницаемых для воды поясков Каспари.
 Механизмы возникновения корневого давления. n n В результате активной работы ионных насосов в корне и осмотическому (пассивному) поступлению воды в сосуды ксилемы в сосудах развивается гидростатическое давление получившее название корневого давления. Оно обеспечивает поднятие ксилемного раствора по сосудам ксилемы из корня в надземные части. Механизм передвижения воды по растению в следствие развивающегося корневого давления называется нижним концевым двигателем.
Механизмы возникновения корневого давления. n n В результате активной работы ионных насосов в корне и осмотическому (пассивному) поступлению воды в сосуды ксилемы в сосудах развивается гидростатическое давление получившее название корневого давления. Оно обеспечивает поднятие ксилемного раствора по сосудам ксилемы из корня в надземные части. Механизм передвижения воды по растению в следствие развивающегося корневого давления называется нижним концевым двигателем.
 Формы воды в почве • Степень увлажнения почвы, при которой растения начинают завядать, от недостатка влаги, называется влажностью завядания. • Количество воды, которую почва прочно удерживает, а растения не могут использовать, составляет мертвый запас воды. • Воду, которая содержится в почве сверх влажности завядания (некоторые считают сверх мертвого запаса), называют продуктивной (или доступной) влагой. • В некоторых климатических условиях, вода может содержаться в почве в достаточном количестве, но растение физиологически не может ее получить. Такая почва называется физиологически сухой. n n n Гравитационная вода занимает в почве крупные поры (некапиллярные), передвигается сверху вниз под собственной тяжестью. Это самая доступная для растений вода. Капиллярная вода занимает капилляры почвы. По ним она продвигается от более влажного слоя к более сухому. По мере испарения воды с поверхности почвы такой восходящий ток ее может иссушить почвы. Капиллярная вода вполне доступна растениям. Гигроскопическая вода находится в почве в виде молекул в поглощенном состоянии, удерживается поверхностью почвенных частиц, почти недоступна растениям, передвигается между частицами почвы в форме пара.
Формы воды в почве • Степень увлажнения почвы, при которой растения начинают завядать, от недостатка влаги, называется влажностью завядания. • Количество воды, которую почва прочно удерживает, а растения не могут использовать, составляет мертвый запас воды. • Воду, которая содержится в почве сверх влажности завядания (некоторые считают сверх мертвого запаса), называют продуктивной (или доступной) влагой. • В некоторых климатических условиях, вода может содержаться в почве в достаточном количестве, но растение физиологически не может ее получить. Такая почва называется физиологически сухой. n n n Гравитационная вода занимает в почве крупные поры (некапиллярные), передвигается сверху вниз под собственной тяжестью. Это самая доступная для растений вода. Капиллярная вода занимает капилляры почвы. По ним она продвигается от более влажного слоя к более сухому. По мере испарения воды с поверхности почвы такой восходящий ток ее может иссушить почвы. Капиллярная вода вполне доступна растениям. Гигроскопическая вода находится в почве в виде молекул в поглощенном состоянии, удерживается поверхностью почвенных частиц, почти недоступна растениям, передвигается между частицами почвы в форме пара.
 Транспирация n n Транспирацией называется физиологическое испарение воды растениями. Основным органом транспирации является лист. Устьица – поры, через которые диффундирует вода, испаряющаяся с поверхности клеток. Устьица находятся в эпидермисе листьев и стеблей. Через устьица испаряется до 90% воды это устьичная транспирация. Кутикула – воскоподобный слой, покрывающий эпидермис листьев и стеблей. Через него проходит вода, испаряющаяся с наружных стенок клеток эпидермиса. Через кутикулу испаряется около 10% воды, в зависимости от толщины кутикулы это кутикулярная транспирация. Чечевички: обычно их роль невелика, но у листопадных деревьев после опадения листьев через них испаряется основная масса воды.
Транспирация n n Транспирацией называется физиологическое испарение воды растениями. Основным органом транспирации является лист. Устьица – поры, через которые диффундирует вода, испаряющаяся с поверхности клеток. Устьица находятся в эпидермисе листьев и стеблей. Через устьица испаряется до 90% воды это устьичная транспирация. Кутикула – воскоподобный слой, покрывающий эпидермис листьев и стеблей. Через него проходит вода, испаряющаяся с наружных стенок клеток эпидермиса. Через кутикулу испаряется около 10% воды, в зависимости от толщины кутикулы это кутикулярная транспирация. Чечевички: обычно их роль невелика, но у листопадных деревьев после опадения листьев через них испаряется основная масса воды.
 n Верхний концевой двигатель создается и поддерживается высокой сосущей силой транспирирующих клеток листовой паренхимы.
n Верхний концевой двигатель создается и поддерживается высокой сосущей силой транспирирующих клеток листовой паренхимы.
 Движение воды по листу n n n Вода может идти тремя путями: По апопласту она движется наиболее быстро, транспорт через симпласт наиболее медленный. Движение воды через вакуоли представляет собой смешение двух предыдущих путей.
Движение воды по листу n n n Вода может идти тремя путями: По апопласту она движется наиболее быстро, транспорт через симпласт наиболее медленный. Движение воды через вакуоли представляет собой смешение двух предыдущих путей.
 Процесс транспирации можно разделить на три стадии: n Испарение воды с клеточных стенок в межклетники. n Диффузия паров воды через устьица наружу. n Диффузия паров воды от поверхности листа. n
Процесс транспирации можно разделить на три стадии: n Испарение воды с клеточных стенок в межклетники. n Диффузия паров воды через устьица наружу. n Диффузия паров воды от поверхности листа. n
 Транспирация через сверхмалые отверстия n воды идет быстрее Этим объясняется, что испарение. Все листья окружены неподвижным слоем при большом числе малых отверстий, чем при воздуха, толщина одном большом отверстии той же общей площади. областикоторого определяется одинаковой размером листа и концентрации особенностями его паров воды Чем выше градиент водного потенциала, тем ближе расположены области одинаковой концентрации паров и тем быстрее происходит диффузия. Поэтому имеет место краевой эффект – диффузия идет интенсивнее с краев отверстия. строения. Пары воды сначала диффундируют через этот слой, а потом уносятся воздушными потоками.
Транспирация через сверхмалые отверстия n воды идет быстрее Этим объясняется, что испарение. Все листья окружены неподвижным слоем при большом числе малых отверстий, чем при воздуха, толщина одном большом отверстии той же общей площади. областикоторого определяется одинаковой размером листа и концентрации особенностями его паров воды Чем выше градиент водного потенциала, тем ближе расположены области одинаковой концентрации паров и тем быстрее происходит диффузия. Поэтому имеет место краевой эффект – диффузия идет интенсивнее с краев отверстия. строения. Пары воды сначала диффундируют через этот слой, а потом уносятся воздушными потоками.
 Устройство и работа устьичного механизма n n Морфологической особенностью замыкающих клеток является различие в толщине клеточной стенки. Основной силой вызывающей изменение степени открытости устьичной щели, является изменение тургора замыкающих клеток или, реже, клеток – спутников. Первый механизм характерен для большинства растений и называется гидроактивным механизмом, второй же свойственен злакам и называется гидропассивным.
Устройство и работа устьичного механизма n n Морфологической особенностью замыкающих клеток является различие в толщине клеточной стенки. Основной силой вызывающей изменение степени открытости устьичной щели, является изменение тургора замыкающих клеток или, реже, клеток – спутников. Первый механизм характерен для большинства растений и называется гидроактивным механизмом, второй же свойственен злакам и называется гидропассивным.
 Механизм работы устьиц n n n Традиционная гипотеза для любого механизма сахарокрахмальная. Днем в результате фотосинтеза в замыкающих клетках накапливаются сахара, в результате повышается осмотическое давление и сосущая сила клеток, что вызывает приток воды в клетку. Кроме этого обнаружено, что днем в замыкающих клетках накапливаются ионы калия (К+) которые, обладая гидрофильностью, так же вызывают приток воды в клетку. n Ночью в устьичных клетках происходит образование крахмала, и понижение концентрации сахаров, ионы же калия оттекают в клетки – спутники, что тоже понижает осмотическое давление замыкающих клеток.
Механизм работы устьиц n n n Традиционная гипотеза для любого механизма сахарокрахмальная. Днем в результате фотосинтеза в замыкающих клетках накапливаются сахара, в результате повышается осмотическое давление и сосущая сила клеток, что вызывает приток воды в клетку. Кроме этого обнаружено, что днем в замыкающих клетках накапливаются ионы калия (К+) которые, обладая гидрофильностью, так же вызывают приток воды в клетку. n Ночью в устьичных клетках происходит образование крахмала, и понижение концентрации сахаров, ионы же калия оттекают в клетки – спутники, что тоже понижает осмотическое давление замыкающих клеток.
 Внешние факторы, влияющие на транспирацию n n n Свет. На свету устьица открываются и закрываются в темноте, поэтому потери воды ночью невелики и связаны в основном с кутикулярной транспирацией. Открывание устьиц на свету обусловлено увеличением интенсивности фотосинтеза замыкающих клеток. Температура. На свету самое сильное влияние на открытость устьиц оказывает температура. Чем она выше, тем выше скорость испарения воды из клеток мезофилла и тем больше насыщен водяными парами воздух в межклетниках. Но в то же время уменьшается влажность окружающего лист воздуха. Влажность воздуха. Пониженная влажность воздуха способствует транспирации, так как градиент влажности между межклетниками и окружающей средой увеличен. Повышение влажности наоборот подавляет транспирацию. Ветер. Вокруг листа образуется область воздуха, насыщенная парами воды, мешающая транспирации, которая сдувается при малейшем ветре. Таким образом, ветреная погода способствует транспирации, а безветрие снижает ее интенсивность. Доступность воды в почве. При отсутствии в почве легкодоступной влаги, поглощение ее корнями снижается, что приводит к понижению обводненности всего растения, что сказывается, в том числе и на количестве воды в замыкающих клетках устьиц и их тургоре.
Внешние факторы, влияющие на транспирацию n n n Свет. На свету устьица открываются и закрываются в темноте, поэтому потери воды ночью невелики и связаны в основном с кутикулярной транспирацией. Открывание устьиц на свету обусловлено увеличением интенсивности фотосинтеза замыкающих клеток. Температура. На свету самое сильное влияние на открытость устьиц оказывает температура. Чем она выше, тем выше скорость испарения воды из клеток мезофилла и тем больше насыщен водяными парами воздух в межклетниках. Но в то же время уменьшается влажность окружающего лист воздуха. Влажность воздуха. Пониженная влажность воздуха способствует транспирации, так как градиент влажности между межклетниками и окружающей средой увеличен. Повышение влажности наоборот подавляет транспирацию. Ветер. Вокруг листа образуется область воздуха, насыщенная парами воды, мешающая транспирации, которая сдувается при малейшем ветре. Таким образом, ветреная погода способствует транспирации, а безветрие снижает ее интенсивность. Доступность воды в почве. При отсутствии в почве легкодоступной влаги, поглощение ее корнями снижается, что приводит к понижению обводненности всего растения, что сказывается, в том числе и на количестве воды в замыкающих клетках устьиц и их тургоре.
 Внутренние факторы, влияющие на транспирацию n Площадь поверхности листьев. Транспирация возрастает с увеличением поверхности листьев. Потери воды могут быть уменьшены с уменьшением площади листовой поверхности. Такие приспособления видим у кактусов – редуцированные листья превращенные в колючки; у хвойных, где листья превращены в иглы. Листопадные растения сбрасывают листья на зимний период, который отличается малым количеством доступной влаги.
Внутренние факторы, влияющие на транспирацию n Площадь поверхности листьев. Транспирация возрастает с увеличением поверхности листьев. Потери воды могут быть уменьшены с уменьшением площади листовой поверхности. Такие приспособления видим у кактусов – редуцированные листья превращенные в колючки; у хвойных, где листья превращены в иглы. Листопадные растения сбрасывают листья на зимний период, который отличается малым количеством доступной влаги.
 Внутренние факторы, влияющие на транспирацию n Кутикула. Транспирация через кутикулу идет тем быстрее, чем тоньше кутикула. Молодые листья в этом отношении теряют больше воды потому как их кутикула развита слабо. У старых – потеря воду через кутикулу составляет не более 1 -2% из-за толстой кутикулы. Многие суккуленты имеют очень толстую, зачастую блестящую кутикулу, которая является их защитным механизмом от потери влаги.
Внутренние факторы, влияющие на транспирацию n Кутикула. Транспирация через кутикулу идет тем быстрее, чем тоньше кутикула. Молодые листья в этом отношении теряют больше воды потому как их кутикула развита слабо. У старых – потеря воду через кутикулу составляет не более 1 -2% из-за толстой кутикулы. Многие суккуленты имеют очень толстую, зачастую блестящую кутикулу, которая является их защитным механизмом от потери влаги.
 Внутренние факторы, влияющие на транспирацию n Устьица. Интенсивность транспирации определяется количеством устьиц на единицу площади листа. Чем оно больше, тем выше транспирация. Устьица могут располагаться как на одной стороне листа, так и на обеих. n n n Листья у которых устьица располагаются с верхней стороны называются эпистоматическими. Листья, у которых устьица снизу – гипостоматические. Листья у которых устьица с обеих сторон – амфистоматические.
Внутренние факторы, влияющие на транспирацию n Устьица. Интенсивность транспирации определяется количеством устьиц на единицу площади листа. Чем оно больше, тем выше транспирация. Устьица могут располагаться как на одной стороне листа, так и на обеих. n n n Листья у которых устьица располагаются с верхней стороны называются эпистоматическими. Листья, у которых устьица снизу – гипостоматические. Листья у которых устьица с обеих сторон – амфистоматические.
 Группы растений по водному режиму. Гидрофиты n n n Обитают в водной среде Механические и проводящие ткани развиты слабо Развита аэренхима – воздухоносная ткань Транспирация почти не регулируется, кутикула на листьях слабая. Соотношение устьичной и кутикулярной транспирации – 1: 9
Группы растений по водному режиму. Гидрофиты n n n Обитают в водной среде Механические и проводящие ткани развиты слабо Развита аэренхима – воздухоносная ткань Транспирация почти не регулируется, кутикула на листьях слабая. Соотношение устьичной и кутикулярной транспирации – 1: 9
 Группы растений по водному режиму. Гигрофиты. n n Растут в местах избыточного увлажнения Проводящие пучки слабо развиты, ткани листьев рыхлые Кутикула тонкая Соотношение устьичной и кутикулярной транспирации примерно 1: 4
Группы растений по водному режиму. Гигрофиты. n n Растут в местах избыточного увлажнения Проводящие пучки слабо развиты, ткани листьев рыхлые Кутикула тонкая Соотношение устьичной и кутикулярной транспирации примерно 1: 4
 Группы растений по водному режиму. Мезофиты. Подгруппа: гигромезофиты. n n n Растут в местах избыточного увлажнения или периодического затопления. Ткани развиты в полном объеме. Кутикула развита средне. Соотношение устьичной и кутикулярной транспирации от 1: 3 до 1: 2
Группы растений по водному режиму. Мезофиты. Подгруппа: гигромезофиты. n n n Растут в местах избыточного увлажнения или периодического затопления. Ткани развиты в полном объеме. Кутикула развита средне. Соотношение устьичной и кутикулярной транспирации от 1: 3 до 1: 2
 Группы растений по водному режиму. Мезофиты. Подгруппа: эумезофиты. n n n Растут в местах умеренного увлажнения Ткани развиты нормально. Кутикула хорошо развита. Соотношение устьичной и кутикулярной транспирации от 1: 1 до 2: 1 в зависимости от местообитания.
Группы растений по водному режиму. Мезофиты. Подгруппа: эумезофиты. n n n Растут в местах умеренного увлажнения Ткани развиты нормально. Кутикула хорошо развита. Соотношение устьичной и кутикулярной транспирации от 1: 1 до 2: 1 в зависимости от местообитания.
 Группы растений по водному режиму. Мезофиты. Подгруппа: ксеромезофиты. n n Растут в более засушливых местообитаниях. Сильно развиты проводящая и механическая ткани. Часто развивается опушение листьев. Кутикула мощная. Соотношение устьичной и кутикулярной транспирации около 4: 1
Группы растений по водному режиму. Мезофиты. Подгруппа: ксеромезофиты. n n Растут в более засушливых местообитаниях. Сильно развиты проводящая и механическая ткани. Часто развивается опушение листьев. Кутикула мощная. Соотношение устьичной и кутикулярной транспирации около 4: 1
 Группы растений по водному режиму. Ксерофиты. Настоящие ксерофиты. n n n Обитают в засушливых условиях. Имеют мощно развитую корневую систему и проводящие ткани. Листья и побеги часто метаморфизированы в филлодии, филлокладии или иглы. Растения зачастую опушены, обладают толстой блестящей кутикулой. Устьица расположены на нижней стороне листьев, листья сворачиваются в трубочку. Соотношение устьичной и кутикулярной транспирации 9: 1
Группы растений по водному режиму. Ксерофиты. Настоящие ксерофиты. n n n Обитают в засушливых условиях. Имеют мощно развитую корневую систему и проводящие ткани. Листья и побеги часто метаморфизированы в филлодии, филлокладии или иглы. Растения зачастую опушены, обладают толстой блестящей кутикулой. Устьица расположены на нижней стороне листьев, листья сворачиваются в трубочку. Соотношение устьичной и кутикулярной транспирации 9: 1
 Группы растений по водному режиму. Ксерофиты. Суккуленты n n Растения приспособлены к накоплению воды внутри своих тканей. Корневая система не глубокая, но широко раскинута в поверхностном слое почвы. Листья метаморфизированы в иглы, или мелкие с мощной кутикулой, но могут отсутствовать. У некоторых видов запасание воды происходит так же в листьях.
Группы растений по водному режиму. Ксерофиты. Суккуленты n n Растения приспособлены к накоплению воды внутри своих тканей. Корневая система не глубокая, но широко раскинута в поверхностном слое почвы. Листья метаморфизированы в иглы, или мелкие с мощной кутикулой, но могут отсутствовать. У некоторых видов запасание воды происходит так же в листьях.
Вода полярность — Справочник химика 21
При хлорировании непредельных соединений, как правило, хлор барботируют через раствор непредельного соединения в соответствующем растворителе, при бромировании и иодировании к раствору непредельного соединения по каплям прибавляют раствор галогена в том же растворителе. В качестве растворителя при галогенировании используют галогеналканы, уксусную кислоту, простые и сложные эфиры и другие органические жидкости, не взаимодействующие с галогеном в условиях реакции присоединения, а также воду. Полярные растворители способствуют гетеролитиче-скому протеканию реакции. Чтобы избежать свободнорадикального течения, реакции проводят в темноте и в присутствии ингибиторов радикальных реакций. [c.121]Все многообразие зависимостей поверхностного натяжения от концентрации может быть представлено кривыми трех типов (рис. 43). Для поверхностноактивных веществ (ПАВ) характерны кривые типа 1. ПАВ менее полярны по сравнению с растворителем, обладают меньшим, чем растворитель, поверхностным натяжением. Интенсивность взаимодействия молекул растворителя с молекулами ПАВ меньше, чем молекул растворителя между собой. По отношению к воде, полярному растворителю, поверхностно-активными веществами являются органические соединения, состоящие из углеводородного радикала (гидрофобная или олеофильная часть) и полярной группы (гидрофильная часть) карбоновые кислоты, их соли, спирты, амины. Такое дифильное строение молекулы является характерным признаком ПАВ. Углеводородные цепи, не имеющие постоянного дипольного момента, гидрофобны, взаимодействуют с молекулами воды слабее, чем между собой, и выталкиваются на поверхность. Поэтому органические вещества, не обладающие полярной группой (например, парафины, нафтены), в воде практически нерастворимы. Полярные группы типа —ОН, —СООН, —NH и др. обладают высоким сродством к воде, хорошо гидратируются, и наличие такой группы в молекуле обусловливает растворимость ПАВ. Таким образом, растворимость ПАВ в воде зависит от длины углеводородного радикала (растворимость уменьшается с увеличением длины в гомологическом ряду). Например, карбоновые кислоты i — С4 неограниченно растворяются в воде растворимость кислот С5 — С12 заметно падает с ростом числа С-атомов, а при длине углеводородной цепи более i2 они практически нерастворимы. Увеличение длины углеводородного радикала молекулы ПАВ на одну СНа-группу приводит к увеличению поверхностной активности в 3,2—3,5 раза (это правило называется правилом Дюкло — Траубе). [c.205]
Физические свойства. Чистая вода представляет собой бесцветную прозрачную жидкость без запаха и вкуса. Она существует в трех агрегатных состояниях твердое — лед, жидкое и газообразное — водяной пар. При О °С твердая и жидкая фазы находятся в состоянии динамического равновесия, поэтому температура плавления льда равна О °С. При 1(Ю °С в равновесии находятся жидкая и газообразная фазы. Температура кипения воды равна 100 °С. При — -4°С она имеет наибольшую плотность, равную 1 г/см . Выше или ниже этой температуры плотность воды меньше 1 г/см . Эта особенность отличает воду от всех других веществ, плотность которых с понижением температуры увеличивается. При переходе воды из жидкого в твердое состояние происходит увеличение объема и уменьшение плотности из 92 объемов жидкой воды образуется 100 объемов льда. Молекула воды полярна и построена по типу треугольника, в вершине которого находится электроотрицательный атом кислорода, а в углах оснований — водород. Валентный угол равен 104,5° (рис. 25). [c.162]
В то же время гетеролитическое расщепление галогенов как неполярных молекулярных веществ в воде (полярном растворителе) или в растворах, содержащих ОН -ионы, также приводит к образованию кислородных кислот галогенов или их анионов. Сначала происходит сольватация растворенных галогенов. В результате взаимодействия с диполями воды неполярная молекулах галогенов подвергается индуцированной поляризации. а затем протекает быстро идущее окислительно-вос-становительное диспропорционирование. При этом рассматриваемый формально катион галогена оказывает поляризующее [c.505]
Молекулы Н О и СО2 каждая содержит по две полярных связи (Н—О—Н и соответственно 0=С=0). Почему молекула СО2 неполярна, а молекула воды полярна [c.56]
Важная, роль в процессе разрушения нефтяной эмульсии принадлежит дгэмульгаторам, в качестве которых используются поверхностно-ак-тивные вещества (ПАВ). ПАВ обладают способностью изменять фазовые взаимодействия на различных поверхностях раздела. Такая активность обусловлена химическим строением ПАВ, одаа часть молекулы которого имеет сродство к углеводородам (гидрофобная), а другая — к воде (гидрофильная). На поверхности раздела нефть — вода полярная часть молекулы ПАВ, обладающая гидрофильными свойствами, погружена в воду, а неполярная гидрофобная — в нефть. В зависимости от величины и расположения этих частей изменяются и свойства ПАВ как деэмульгаторов, [c.128]
Дипольный момент молекул есть векторная сумма диполь-ных моментов связей. Если геометрия молекулы такова, что дипольные моменты связей компенсируют друг друга, то дипольный момент равен нулю и молекула неполярна даже при наличии в ней поляризованных связей (молекула 05). Молекула воды полярна (уголковая форма). [c.106]
Электролитическая- диссоциация воды. Полярные молекулы воды могут диссоциировать, проявляя при этом свою амфотер-ность [c.203]
Известно, что хорошим растворителем многих веществ является вода. Это объясняется тем, что молекулы воды полярны. Такая полярная частица — диполь, электростатически взаимодействуя с полярными частицами твердого тела, способствует отрыву последних от поверхности кристалла. [c.143]
Таким образом, оказалось возможным по данным о чистых компонентах и бинарных смесях получить достаточно точную информацию о свойствах разнообразных многокомпонентных систем, в том числе содержащих воду, полярные органические растворители (кетоны, спирты, нитрилы и т. д.), а также парафиновые, нафтеновые и ароматические углеводороды. [c.10]
Сорбционная область в данном случае представляет собой фрагмент поверхностного слоя белка, напоминающий мицеллу ПАВ (где гидрофобные цепи экранированы от воды полярными группами, см. 6 гл. III). [c.145]
Теоретическое пояснение. Для дисперсных тонкоизмельченных систем очень сложно измерить величину краевого угла смачивания, поэ
Полярность — вода — Большая Энциклопедия Нефти и Газа, статья, страница 1
Полярность — вода
Cтраница 1
Полярность воды, как дальше будет показано, играет огромную роль н химических и электрохимических процессах. [1]
Полярность воды обусловливает возникновение водородных связей между атомами водорода одной молекулы воды и атомами кислорода соседних молекул ( рис. VII. [2]
Полярность этих растворителей ниже полярности воды, но выше полярности ОВ, плохо растворяющихся в воде. Хорошо смешиваясь с обоими компонентами, эти растворители способствуют смешению неполярного вещества с сильнополярным растворителем и являются как бы посредниками при растворении. [3]
Изменение плотно-родных связей является достаточная полярность сти воды с температурой, валентных связей водорода в исходных молекулах. [5]
По данным М. П. Гавриша, И. С. Галинкора и С. П. Малинина снижение полярности воды с ростом температуры способствует растворимости неполярных органических соединений. По мнению А. М. Блох, поверхностные силы минеральных частиц, как и температура, но еще более интенсивно снижают полярность связанной воды, тем самым существенно повышают растворимость УВ. Таким образом, поровые воды способны растворять огромные объемы жидких и газообразных УВ и тем самым обеспечивать их вынос из материнских пород. [6]
Поскольку неорганические полимеры — соединения, в которых ковалентная составляющая существенная, то полярности воды недостаточно и она как растворитель мало эффективна. Поэтому используют главным образом кислые или щелочные растворители, приводящие к разрыву связей М — О за счет протони-зации. [7]
Детектирование паров воды имеет свои трудности, связанные, в основном, с полярностью воды. Промышленный анализатор, предназначенный для определения НаО в концентрациях 0 — ДО-4 % в смеси с углеводородами [14], включал в себя хроматографическую колонку с по-лиэтиленликолем на флуоропаке 80, а в качестве детектора — электролитическую ячейку с PjOs. Предельная чувствительность к парам воды 5-ионизационного детектора составляет 5 — 10 — п моль / с [23], причем она возрастает при использовании в качестве газа-носителя неона и уменьшается в случае аргона. [8]
Причем положительный градиент концентрации наблюдается в случае растворов полярных и органических веществ, полярность которых меньше полярности воды, а отрицательный — в тех водных системах, где полярность растворенного вещества ( например, фенола) выше, чем воды. [9]
Жидкая вода состоит из короткоживущих скоплений ( кластеров) молекул, связанных друг с другом водородными связями. Полярность воды и сильно выраженная способность ее молекул образовывать водородные связи делает воду прекрасным растворителем для многих ионных соединений и других веществ, имеющих полярные молекулы. Вода диспергирует также амфипатические вещества, например мыла, с образованием агрегатов молекул, называемых мицеллами, в которых гидрофобные группы спрятаны внутри и не контактируют с водой, тогда как заряженные группы расположены на внешней поверхности. [10]
Неизбежным следствием этого является полярность молекул воды. Полярность воды делает понятным, почему ее молекулы ориентируются в электрическом поле, располагаясь положительными концами к отрицательному источнику поля, а отрицательными — к положительному источнику. Этим путем напряжение электрического поля понижается. Диэлектрическая постоянная является мерой этого понижающего действия и мерой полярности растворителя. [11]
Общий принцип, согласно которому структуры слоистого типа гораздо более обычны среди вновь образовавшихся минералов, специально рассматривался Андреаттой36; характерна тетраэдрическая координация ( RO4 ] для Si4 и А13 в алюмосиликатах. Сильная полярность воды и ее гидроксильных групп, очевидно, особенно благоприятствует образованию гексагональных и псевдогексагональных структур, в которых октаэдриче-ские группы [ ROm ( OH) n ] связываются ребрами октаэдров, в то время как образованные таким образом слои соединяются только вандерваальсовскими силами. Сперва образуются пластинчатые мицеллы, постепенно вырастающие до крипто -, микро — или даже макроскопических кристаллов. Ту же точку зрения, с которой Андре-атта рассматривал изменение полевых шпатов и фельд-шпатоидов во вновь образующиеся минералы слоистой структуры, можно также использовать и при изучении процесса превращения пироксенов либо амфиболов в соответствующие продукты. В последнем случае характерно образование минералов группы гетит — лепидокро-кит или в морской воде в условиях гальмиролиза глауконита, или, наконец, шамозита, тюрингита ( см. А. [12]
В последнее время в литературе начали появляться высказывания о пережатии пузырьков газа вследствие образования на границе раздела с нефтью плотных пленок ПАВ, препятствующих не только расширению газового пузырька при снижении давления, но и диффузии газа в пузырек. В эмульсиях этому способствует полярность воды, облегчающая адсорбцию ПАВ, Молекулы ПАВ ориентируются своими гидрофильными концами в сторону воды, образуя жидкие или твердые пленки. Наличием плотных пленок обусловливается стойкость водонефтяных эмульсий. Ко-гезионные силы молекул пленки ПАВ на границе жидкость — жидкость значительно слабее, чем на границе жидкость — газ. [13]
Установлено, что при 374 С взаимная растворимость УВ и воды становится неограниченной: образуется однородный водогазонефтяной раствор — флюиды находятся в надкритическом или близком к нему состоянии. Существенное повышение растворимости УВ с ростом давления и при снижении полярности воды делает реальным допущение, что состояние взаимной растворимости в системе поровая вода УВ наступает при более низкой температуре и, следовательно, на относительно небольших глубинах. Все это позволяет очень высоко оценивать роль водной эмиграции жидких и газообразных УВ в широком интервале глубин. [14]
Известно, что сверление и шлифовка металлов сильно облегчаются смачиванием водным раствором мыла и сапонина, а для стекла ту же роль играют растворы канифоли, камфоры и других поверхностно активных веществ в керосине. Эти факты находятся в полном согласии с вышеизложенным ( § 282 / полярность воды значительно выше полярности керосина, а полярность металлов значительно выше полярности воды. [15]
Страницы: 1 2

