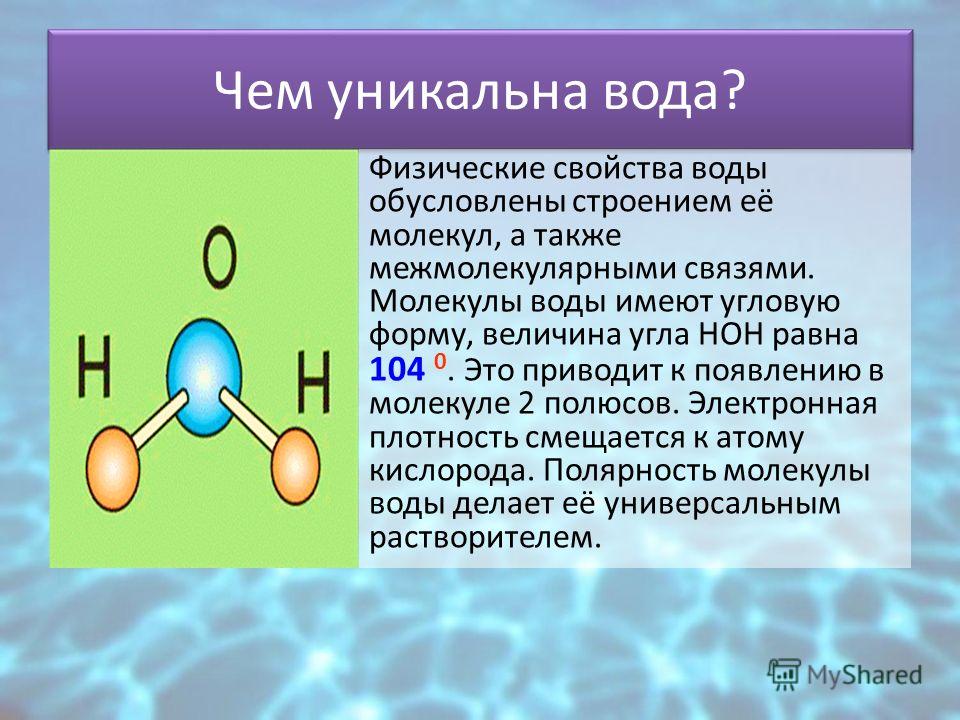
Почему молекулы воды полярны?
Статьи › Чем отличается › Чем отличаются молекулы воды от молекулы пара?
Молекула воды полярная, что является причиной особого взаимодействия между разными её молекулами. Атомы водорода в молекуле воды, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул. Такая химическая связь называется водородной.
- Почему молекулы воды являются полярными?
- Почему воду называют Полярной?
- Какая полярность у воды?
- Почему молекулы воды притягиваются друг к другу?
- Почему молекула Полярна?
- Что такое полярные молекулы?
- Чем является молекула воды?
- Какая молекула воды?
- Как построена молекула воды?
- Почему вода уникальна?
- Что влияет на полярность?
- Что находится между молекулами воды?
- Почему вода является растворителем для полярных веществ?
- Почему вода не смешивается с жиром?
- Какие особенности строения и свойств молекул воды?
- Какие особенности строения молекул воды придают ей?
- Чем отличаются молекулы холодной воды от молекул?
- Что больше молекулы воды или кислорода?
- Почему молекула воды полярная какие частицы называют деталями?
- Почему вода практически не сжимается?
- Какие молекулы у воды?
- Каков состав молекулы воды?
Почему молекулы воды являются полярными?
В молекуле воды имеются две полярные ковалентные связи Н–О. Они образованы за счёт перекрывания двух одноэлектронных р — облаков атома кислорода и одноэлектронных S — облаков двух атомов водорода.
Они образованы за счёт перекрывания двух одноэлектронных р — облаков атома кислорода и одноэлектронных S — облаков двух атомов водорода.
Почему воду называют Полярной?
Молекула воды полярна, т. е. один ее конец имеет частичный положительный заряд, а другой — отрицательный. Это объясняется тем, что две пары электронов в ней — общие у двух атомов водорода и атома кислорода, а две другие пары неподеленных электронов собраны с противоположной стороны кислорода.
Какая полярность у воды?
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким дипольным моментом — 1,87 Дебая (Дебай — внесистемная единица электрического дипольного момента молекул).
Почему молекулы воды притягиваются друг к другу?
Водородная связь между молекулами воды
Благодаря своей полярной природе молекулы воды хорошо притягиваются друг к другу.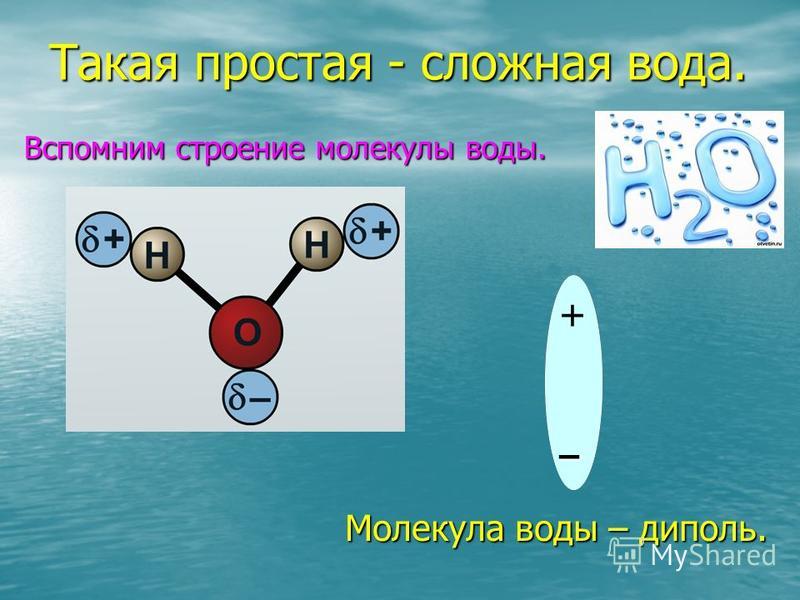 Положительно заряженный конец одной молекулы — атом водорода — притягивается к отрицательно заряженному концу другой молекулы — к атому кислорода.
Положительно заряженный конец одной молекулы — атом водорода — притягивается к отрицательно заряженному концу другой молекулы — к атому кислорода.
Почему молекула Полярна?
Очевидно, что в этом случае, вследствие неравномерного распределения положительных и отрицательных зарядов внутри молекулы, их электрические центры тяжести не совпадут и получится полярная молекула (рис. 32). Полярные молекулы являются диполями.
Что такое полярные молекулы?
Поля́рные вещества́ в химии — соединения, молекулы которых обладают электрическим дипольным моментом. Для полярных веществ, в сравнении с неполярными, характерны высокая диэлектрическая проницаемость (более 10 в жидкой фазе), повышенные температура кипения и температура плавления.
Чем является молекула воды?
Вода́ (оксид водорода, гидроксид водорода, химическая формула — h3O) — бинарное неорганическое соединение, молекула которого состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
Какая молекула воды?
Общепринято, что вода состоит из молекул Н2О, объединённых в группы так называемыми водородными связями. Их наличие обусловлено притяжением между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода.
Как построена молекула воды?
Молекула воды (h3O) состоит из двух атомов водорода (h2) и одного атома кислорода (O16). Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине. Расстояние O-H — 0,9568 Å; H-H — 1,54 Å.
Почему вода уникальна?
Говоря об уникальных свойствах воды, в первую очередь необходимо упомянуть тот факт, что она является единственным веществом, которое может существовать в трех агрегатных состояниях: жидком, твердом и газообразном. Жидкое — это нормальное состояние воды, которое наблюдается при отсутствии влияния внешних факторов.
Что влияет на полярность?
Полярность связи, т. е. значение возникающих на атомах зарядов, определяется электроотрицательностью химических элементов. Чем больше разница в электроотрицательности, тем более полярная связь.
Чем больше разница в электроотрицательности, тем более полярная связь.
Что находится между молекулами воды?
Если представлять себе молекулы как группы слипшихся шариков-атомов, то между ними будет лишь пустое пространство. Правда, в воде молекулы располагаются достаточно тесно, так что места между ними почти не остается. Однако твердый шарик — очень грубая модель атома.
Почему вода является растворителем для полярных веществ?
Из-за своей полярности и способности образовывать водородные связи, вода является отличным растворителем, а это означает, что она может растворять множество различных видов молекул.
Как связаны молекулы воды?
Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных H-связей до 5—6). Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Они ответственны за многие другие уникальные свойства воды.
Почему вода не смешивается с жиром?
Вода не смачивает жир из-за явления несмачиваемости, т.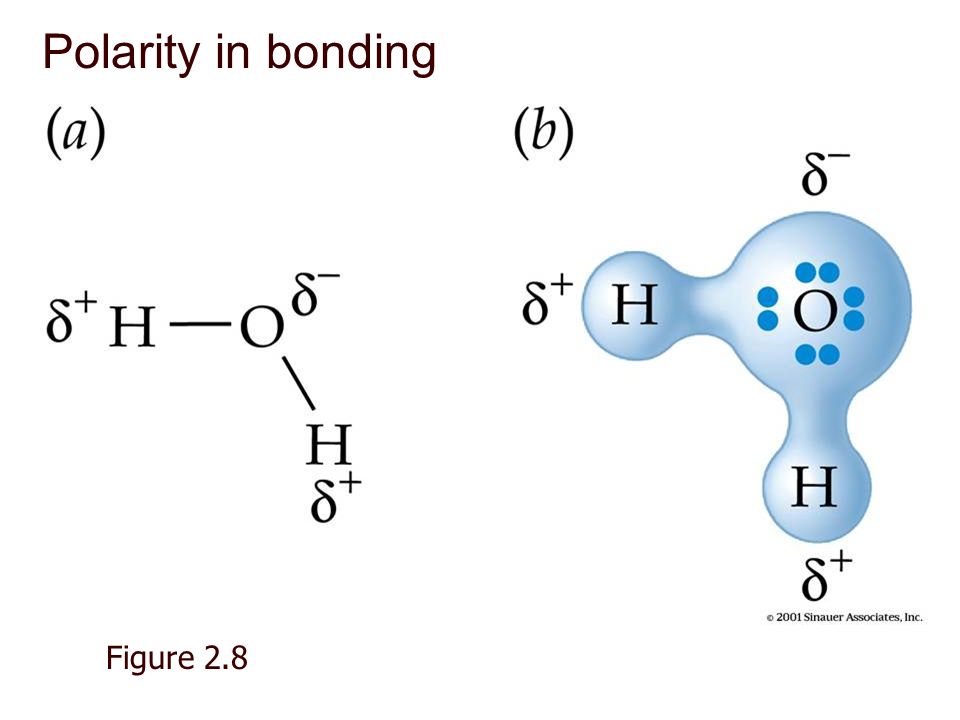 е. молекулы воды сильнее притягиваются друг к другу, чем к молекулам жира.
е. молекулы воды сильнее притягиваются друг к другу, чем к молекулам жира.
Какие особенности строения и свойств молекул воды?
1) способность образовывать водородные связи 2) наличие в молекулах макроэргических связей 3) полярность молекулы 4) высокая теплоёмкость 5) способность образовывать ионные связи 6) способность выделять энергию при расщепленииУстановите последовательность процессов, происходящих при фагоцитозе.
Какие особенности строения молекул воды придают ей?
Структура молекулы воды образована двумя атомами водорода и одним атомом кислорода, которые образуют диполь, то есть вода имеет две полярности «+»и«-». Это способствует ее проницаемости через стенки мембраны, способностью растворять химические вещества.
Чем отличаются молекулы холодной воды от молекул?
Ответы1. Молекула горячей воды не чем не отличается от молекулы холодной воды. Молекула горячей воды быстрее движется, чем молекула холодной воды. Согласно уравнению молекулярно-кинетической теории, средняя кинетическая энергия молекул Ек зависит от температуры следующим образом Ек= 3 *k *T/2.
Что больше молекулы воды или кислорода?
Dh3O (O2) = Mr (O2): Mr (h3O) = 32: 18 = 1,78. Ответ: молекула воды в 9 раз тяжелее молекулы водорода, и в 1,78 раза легче молекулы кислорода.
Почему молекула воды полярная какие частицы называют деталями?
В молекуле воды между атомами Оксигена и Гидрогена существует ковалентная полярная связь, благодаря чему на атоме Оксигена появляется частичный отрицательный электрический заряд, а на атомах Гидрогена — положительный (рис.
Почему вода практически не сжимается?
Вода практически не сжимается (в жидком состоянии), и поэтому служит гидростатическим скелетом клетки. За счет осмоса вода создает избыточное давление внутри вакуолей растительных клеток, это тургорное давление обеспечивает упругость клеточной стенки и поддержание формы органов (например, листьев).
Какие молекулы у воды?
Общепринято, что вода состоит из молекул Н2О, объединённых в группы так называемыми водородными связями. Их наличие обусловлено притяжением между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода.
Каков состав молекулы воды?
Вода́ (оксид водорода, гидроксид водорода, химическая формула — h3O) — бинарное неорганическое соединение, молекула которого состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
ОглавлениеПредисловие редактора переводаГЛАВА 1. Молекулы и жизнь 1.1. Молекулярные модели 1.2. Пространство, время и энергия 1.3. Структура данной книги Часть I. Конформация и динамика ГЛАВА 2. Основные представления о структуре и функции белков 2.1. Белки построены из аминокислот 2.2. Особые аминокислоты дополняют основной набор, насчитывающий двадцать аминокислот 2.3. Аминокислоты, соединяясь пептидной связью, образуют полипептидные цепи 2.4. Белки состоят из одной или нескольких полипептндных цепей 2.5. Для очистки белков можно использовать множество различных методов 2.7. Экспериментальные методы определения последовательности аминокислот 2.8. Конформация полипептидных цепей 2.9. Периодичные структуры: альфа-спираль, бета-складчатый слой, спираль коллагена 2.10. Полипептидная цепь может поворачиваться на 180° благодаря образованию бетта-изгибов 2. 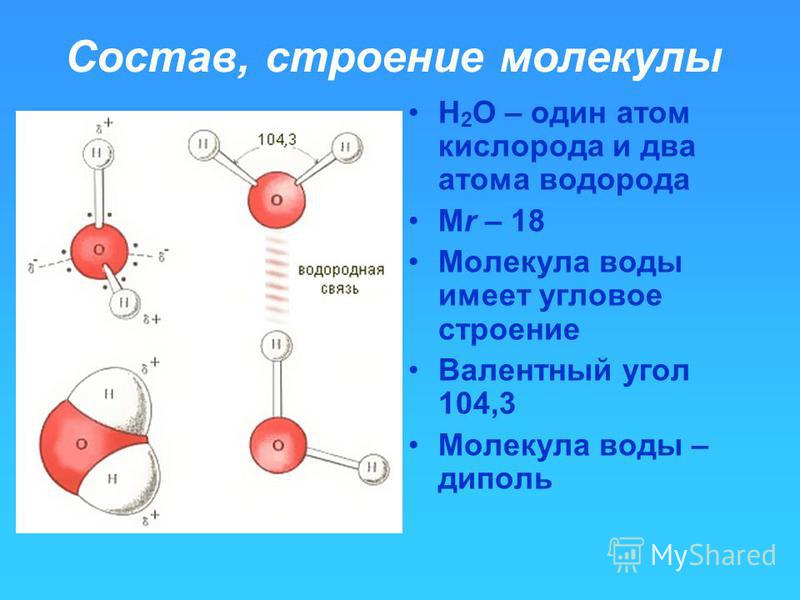 11. Структурные уровни в архитектуре белков 11. Структурные уровни в архитектуре белков2.12. Последовательность аминокислот определяет трехмерную структуру 2.13. Формирование свернутой молекулы белков происходит путем ассоциации альфа-спиралей и складчатых бетта-слоев ПРИЛОЖЕНИЕ. Понятия кислотности и основности ГЛАВА 3. Переносчики киспорода – миоглобин и гемоглобин 3.1. Кислород присоединяется к простетической группе гема 3.2. Рентгеноструктурный анализ кристаллов выявляет пространственное расположение атомов 3.3. Этапы рентгеноструктурного анализа миоглобина 3.4. Структура миоглобина характеризуется компактностью и высокой степенью альфа-спирализованности 3.5. Участок связывания кислорода в миоглобине 3.6. Жесткое окружение гема обеспечивает обратимость оксигенирования 3.7. Присутствие дистального гистидина снижает связывание оксида углерода 3.8. В растворенном виде и в кристаллическом состоянии миоглобин имеет практически одинаковую структуру 3.  10. Развернутая молекула миоглобина спонтанно принимает функционально активную конфигурацию 10. Развернутая молекула миоглобина спонтанно принимает функционально активную конфигурацию3.11. Гемоглобин состоит из четырех полипептидных цепей 3.12. Рентгеноструктурный анализ гемоглобина 3.13. Четвертичная структура гемоглобина 3.14. а- и b-Цепи гемоглобина очень сходны с миоглобином 3.15. Критически необходимые остатки в последовательности аминокислот 3.16. Возникновение гемоглобина – новый этап в эволюции ГЛАВА 4. Гемоглобин: аллостерический белок 4.1. Функциональные различия между миоглобином и гемоглобином 4.3. Кооперативное связывание кислорода гемоглобином увеличивает транспорт кислорода 4.4. H+ и CO2 способствуют высвобождению O2 (эффект Бора) 4.5. Бисфосфоглицерат снижает сродство к кислороду 4.6. Клиническое значение биофосфо-глицерата 4.7. Гемоглобин плода характеризуется высоким сродством к кислороду 4.8. Для проявления аллостерического эффекта необходимо взаимодействие субъединиц 4.  9. Четвертичная структура гемоглобина значительно изменяется при оксигенировании 9. Четвертичная структура гемоглобина значительно изменяется при оксигенировании4.10. Солевые связи между отдельными цепями придают жесткость структуре дезоксигемоглобина 4.12. Движение атома железа передается на другие субъединицы через проксимальный гистидин 4.13. Механизм кооперативного связывания кислорода 4.14. Бисфосфоглицерат снижает сродство к кислороду путем образования перекрестных связей с дезоксигемоглобнном 4.15. CO2 присоединяется к концевым аминогруппам гемоглобина, снижая его сродство к кислороду 4.16. Механизм эффекта Бора 4.17. Коммуникация внутри белковой молекулы ГЛАВА 5. Молекулярные болезни: серповидноклеточная анемия 5.1. Серповидиоклеточная анемия – хроническая гемолитическая болезнь, передающаяся по наследству 5.3. Гемоглобин S отличается от гемоглобина A по электрофоретической подвижности 5. 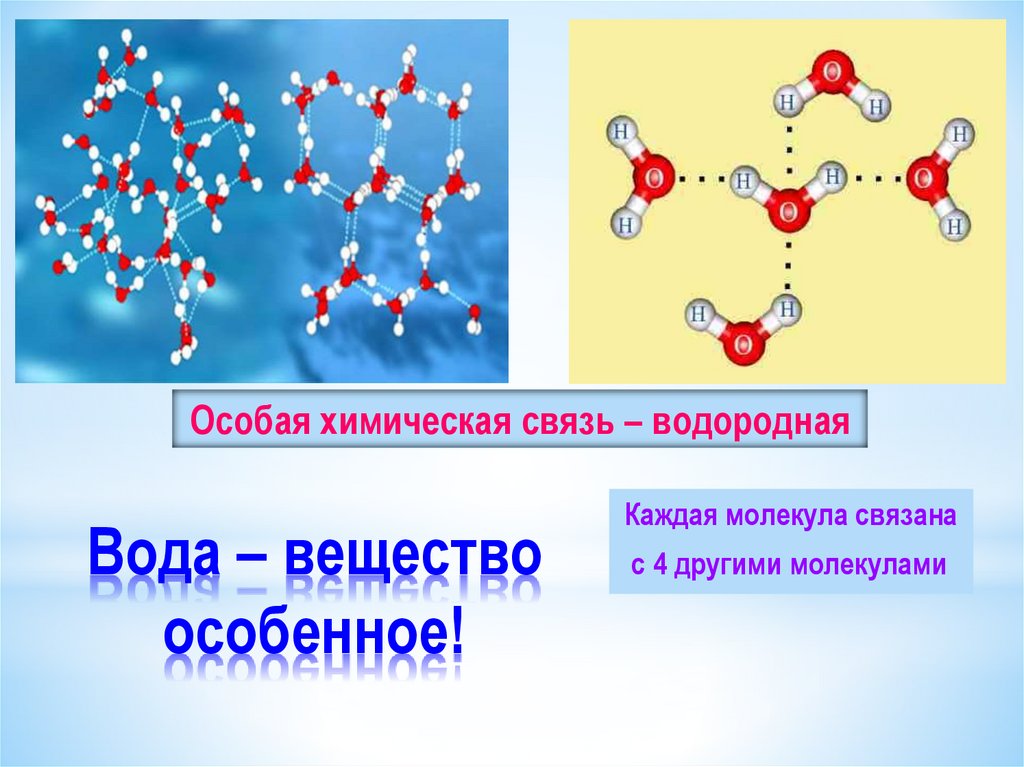 4. Получение пептидных карт: выявление аминокислотной замены в гемоглобине серповидных клеток 4. Получение пептидных карт: выявление аминокислотной замены в гемоглобине серповидных клеток5.5. В бетта-цепи произошла замена одной-единственной аминокислоты 5.6. На поверхности гемоглобина серповидных клеток имеются «липкие» участки 5.7. Дезоксигемоглобин S образует длинные спирализованные волокна 5.9. Высокая частота гена серповидноклеточностн обусловлена его защитным эффектом в отношении малярии 5.10. Стратегия поиска лекарственных средств для лечения серповидноклеточной анемии 5.11. Молекулярная патология гемоглобина 5.12. Гемоглобин М: продукт мутации в активном центре 5.13. Полярные группы в щели, занимаемой гемом, ослабляют его связывание с полипептидной цепью 5.14. В результате некоторых мутаций гемоглобины утрачивают стабильность из-за деформаций третичной структуры 5.15. Мутации в области контактов нарушают аллостерические взаимодействия 5.  ГЛАВА 6. Введение в энзимологию 6.2. Ферменты обладают высокой специфичностью 6.3. Активность некоторых ферментов регулируется 6.4. Ферменты осуществляют трансформацию различных видов энергии 6.5. Ферменты не сдвигают равновесия реакции 6.6. Ферменты снижают энергию активации катализируемых ими реакций 6.7. Первый этап ферментативного катализа – образование фермент-субстратного комплекса 6.8. Некоторые свойства активных центров 6.9. Кинетика многих ферментов описывается моделью Михаэлиса – Ментен 6.10. … можно определить, используя различные концентрации субстрата 6.11. Значение величин … 6.13. Ферменты могут ингибироваться специфическими молекулами 6.15. Лечение отравления этиленгликолем на основе конкурентного ингибирования 6.16. Аллостерические ферменты не подчиняются кинетике Михаэлиса – Ментен 6.  17. Согласованный механизм аллостерических взаимодействий 17. Согласованный механизм аллостерических взаимодействий6.18. Последовательный механизм аллосгерического взаимодействия 6.19. Водородные связи, а также электростатические и вандерваальсовы взаимодействия в фермент-субстратных комплексах 6.20. Заряженные субстраты могут связываться с противоположно заряженными группами фермента 6.22. Белки обладают выраженной способностью к образованию водородных связей 6.23. Вандерваальсовы взаимодействия играют важную роль в случаях стернческой комплементарности 6.24. Биологически важные свойства воды: полярность воды и ее способность к когезин 6.25. Присутствие воды ослабляет полярные взаимодействия 6.26. Гидрофобные взаимодействия; в водной среде неполярные группы стремятся ассоциировать ГЛАВА 7. Механизм действия ферментов: лизоцим и карбоксипептидаза 7.1. Лизоцим расщепляет клеточные стенки бактерий 7.2. Трехмерная структура лизоцима 7. 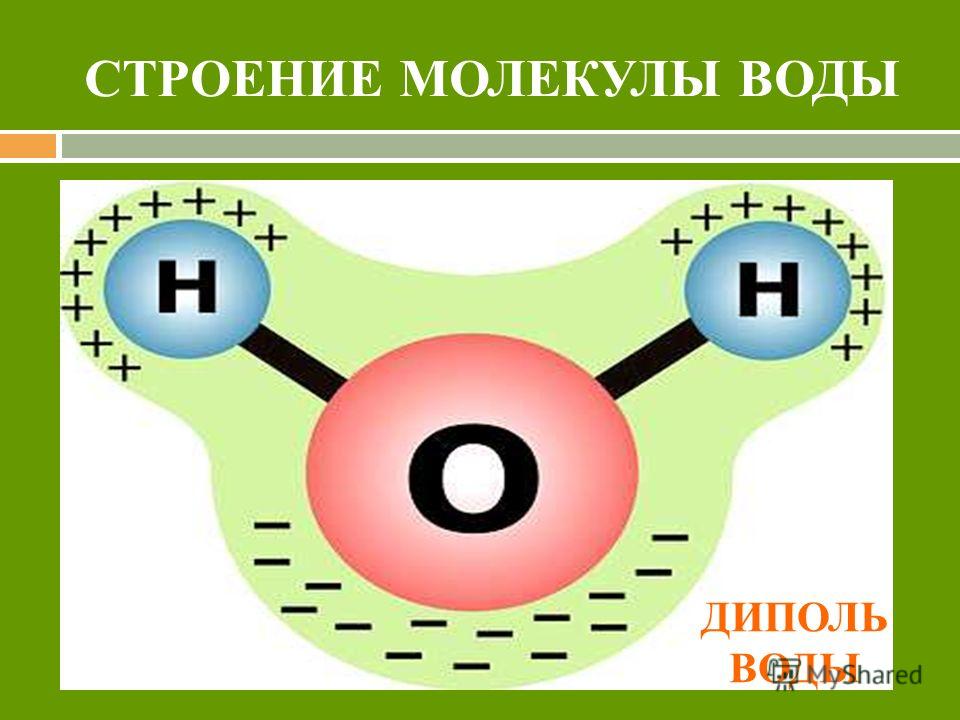 3. Поиски активного центра лизоцима 3. Поиски активного центра лизоцима7.4. Способ связывания конкурентного ингибитора 7.5. От структуры фермента — к механизму ферментативного действия 7.6. Промежуточное образование иона карбония – критический этап катализа 7.7. Экспериментальное доказательство предложенного механизма ферментативного катализа 7.8. Карбоксипептидаза А: протеолитический фермент, содержащий цинк 7.9. Связывание субстрата индуцирует большие структурные изменения активного центра карбоксипептидазы А 7.10. Скорость катализа карбоксипептидазой А возрастает благодаря смещению электронов ГЛАВА 8. Активация проферментов: пищеварительные ферменты и факторы свертывания крови 8.1. Активация химотрипсиногена происходит путем специфического расщепления одной пептидной связи 8.2. Трехмерная структура химотрипсина 8.3. Химотрипсии специфичен в отношении ароматических и больших неполярных боковых цепей 8.4. При катализе химотрипсином часть субстрата ковалентно связывается с ферментом 8. 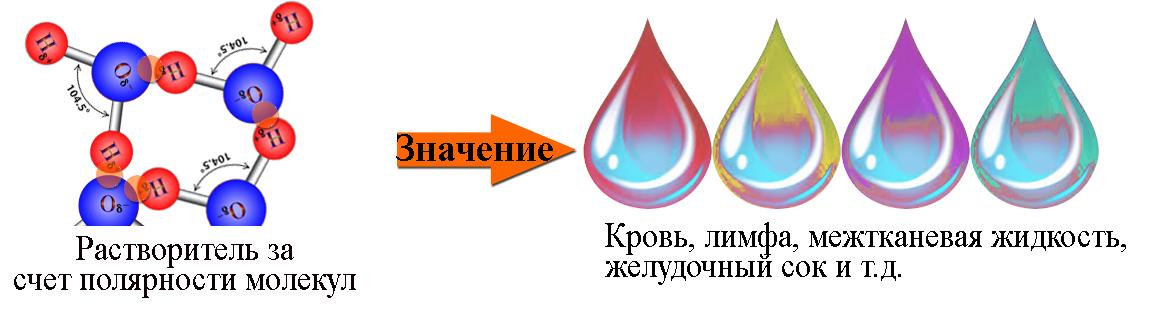 5. Ацильная группа соединяется с необычайно реакционноспособным остатком серина на ферменте 5. Ацильная группа соединяется с необычайно реакционноспособным остатком серина на ферменте8.6. Участие гистидина-57 в катализе выявляется с помощью аффинной метки 8.7. Система переноса заряда обеспечивает челночную передачу протона при катализе 8.8. В химотрипснне имеется глубокий карман для связывания ароматической боковой цепи 8.9. В процессе катализа образуется переходное тетраэдрическое промежуточное соединение 8.10. Механизм активации профермента 8.11. Трипсин и эластаза: вариации на тему 8.12. Ингибитор панкреатического трипсина прочно связывается в активном центре трипсина 8.13. Дивергентная и конвергентная эволюция сериновых протеиназ 8.14. Координированная активация панкреатических проферментов 8.16. Основные типы протеолитических ферментов – это сериновые протеиназы и карбоксипротеиназы 8.17. Свертывание крови как каскад реакций активации проферментов 8.18. Образование кровяного сгустка требует взаимодействия двух типов ферментативных превращений 8.  19. Фибриноген превращается в фибриновый сгусток под действием тромбина 19. Фибриноген превращается в фибриновый сгусток под действием тромбина8.20. Мономеры фибрина спонтанно образуют фибриллы 8.21. Сгусток фибрина стабилизирован ковалентными поперечными связями 8.22. Тромбин гомологичен трипсину 8.23. Для синтеза протромбина необходим витамин К 8.24. На фосфолипидной поверхности тромбоцитов протромбин активируется фактором … 8.25. Гемофилия и другие формы нарушения свертывания крови позволили выявить ряд начальных этапов образования кровяного сгустка 8.26. Внутренний механизм свертывания крови 8.27. Внешний механизм свертывания крови 8.28. Контроль свертывания крови: проблема, требующая внимания ГЛАВА 9. Белки соединительной ткани: коллаген, эластин и протеогликаны 9.1. Тропоколлагеи как основная структурная единица коллагена 9.2. Коллаген обладает необычным составом и необычной последовательностью аминокислот 9.3. Некоторые остатки пролина и лизина в коллагене гидроксилируются 9.4. К остаткам гидроксилизина присоединены сахара 9. 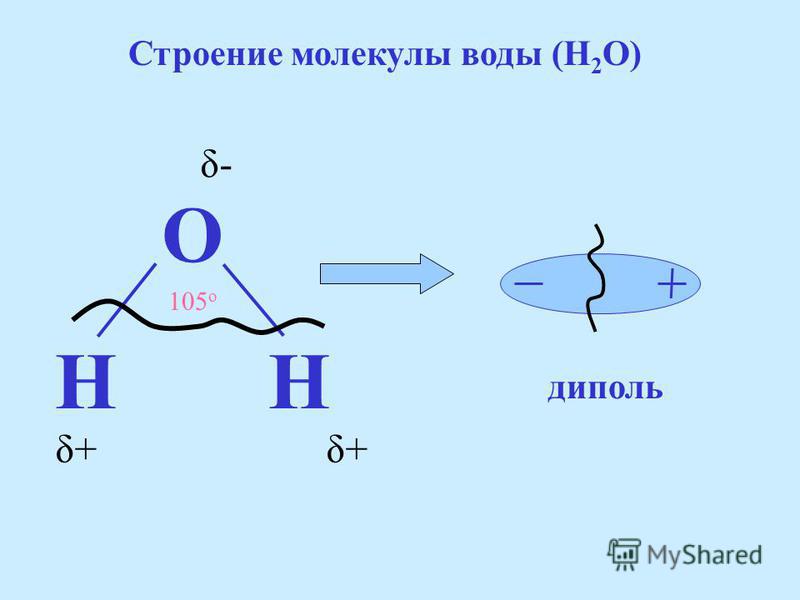 5. Структура тропоколлагена – это тройной спирально скрученный тяж 5. Структура тропоколлагена – это тройной спирально скрученный тяж9.6. Малые размеры глицина делают его незаменимым компонентом структуры 9.7. Стабильность спирали коллагена зависит от кооперативных взаимодействий 9.8. Нарушение гидроксилирования – один из биохимических дефектов при цинге 9.9. Проколлаген предшественник коллагена при его биосинтезе 9.10. Дополнительные пептиды цепей-предшественников отщепляются ферментативно 9.11. Коллагеновое волокно состоит из ступенчато расположенных молекул гропоколлагена 9.12. Образование коллагенового волокна регулируется проколлаген-пептидазами 9.13. Поперечные связи повышают прочность коллагенового волокна 9.14. Коллагеназы-ферменты, специфически расщепляющие коллаген 9.15. Эластин – каучукоподобный белок эластических волокон 9.16. Протеогликаны образуют основное вещество соединительной ткани ГЛАВА 10. Введение в проблему биологических мембран 10.1. Общие свойства биологических мембран 10.  2. Фосфолипиды – основной класс мембранных липидов 2. Фосфолипиды – основной класс мембранных липидов10.3. В большинстве мембран имеются также гликолипиды и холестерол 10.4. Фосфолипиды и глнколипиды легко образуют бислон 10.5. Липидные бислои – нековалентные кооперативные структуры 10.6. Липидные бислои непроницаемы для ионов и многих полярных молекул 10.7. Большинство мембранных процессов опосредовано белками 10.8. Реконструкция функционирующих мембранных систем из очищенных компонентов 10.9. Отдельные белки мембран глубоко погружены в липидный бислой 10.10. В мембране эритроцитов содержатся различные периферические и интегральные белки 10.11. Мембрану эритроцита пронизывают канал для анионов и сложный белок гликофорин 10.12. Углеводные единицы расположены на наружной стороне плазматической мембраны 10.13. Липиды и многие мембранные белки быстро диффундируют в плоскости мембраны 10.14. Мембранные белки не перемещаются поперек бислоев 10.15. Жидкостно-мозаичная модель биологических мембран 10.  16. Мембранам свойственна асимметрия 16. Мембранам свойственна асимметрия10.17. Текучесть мембран зависит от состава жирных кислот и содержания холестерола 10.18. Трехмерная модель мембран по данным электронной микроскопии |
Полярность воды – Почему вода полярна?
Учебники
- Сообщение от Эндрю Дао
12 июль
Основные понятия
Вода — одно из самых распространенных веществ на Земле, занимающее 71% ее поверхности. В этом уроке вы узнаете о полярности воды и о том, как она определяет некоторые из наиболее важных свойств воды.
Темы, освещенные в других статьях
- Что такое полярная ковалентная связь?
- Полярные и неполярные связи и молекулы
- Что такое электроотрицательность?
- Теория ВСЕПР
- Что такое растворенное вещество? Растворитель против растворенного вещества с примерами
Что означает для молекулы быть полярной?
По определению полярная молекула имеет частично положительный конец и частично отрицательный конец.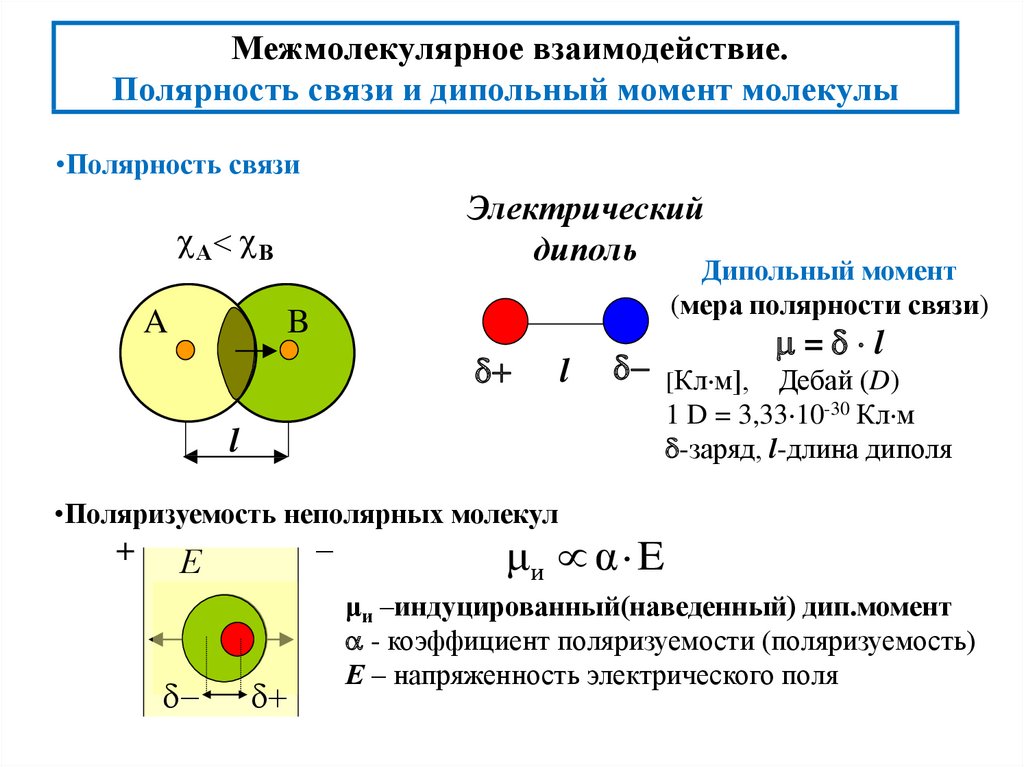 Молекула достигает этого за счет неравномерного распределения электронов между ее атомами. То есть электроны собираются ближе к одному атому, чем к другому, что делает один атом немного более отрицательным, чем другой. Более того, эти атомы также должны быть расположены таким образом, чтобы их частичные заряды не компенсировали друг друга.
Молекула достигает этого за счет неравномерного распределения электронов между ее атомами. То есть электроны собираются ближе к одному атому, чем к другому, что делает один атом немного более отрицательным, чем другой. Более того, эти атомы также должны быть расположены таким образом, чтобы их частичные заряды не компенсировали друг друга.
Является ли вода полярной?
Как указано выше, чтобы быть полярной, молекула должна иметь полярные ковалентные связи и быть асимметричной.
Имеет ли вода полярные ковалентные связи?
Электроотрицательность кислорода 3,5, а электроотрицательность водорода 2,1, что делает разницу в электроотрицательности между ними 1,4. Атомы в полярных ковалентных связях обычно имеют разницу в электроотрицательности от 0,4 до 1,7. Таким образом, связи O–H в молекулах воды, где конец O частично отрицательный, а конец H частично положительный, представляют собой полярные ковалентные связи.
Является ли вода асимметричной?
Атом кислорода в молекуле воды связан с 2 атомами водорода и 2 неподеленными парами, что дает ему стерическое число 4. Согласно теории VSEPR, стерическое число 4 означает, что электронная геометрия воды является тетраэдрической. Более того, поскольку это стерическое число включает 2 неподеленные пары, молекулярная геометрия воды искривлена. Изогнутая структура придает молекуле воды асимметрию.
Трехмерная модель молекулы воды с неподеленными парами и валентным углом.В заключение,
вода является полярной , потому что она имеет полярные ковалентные связи и является асимметричной. Вода полярная!Что получается из-за полярности воды?
Вода как универсальный растворитель
Вспомним золотое правило растворимости: подобное растворяется в подобном. Поэтому вода как полярный растворитель легко растворяет полярные растворенные вещества. Он растворяется следующим образом: частично положительные атомы водорода воды прикрепляются к отрицательно заряженным атомам растворенного вещества, в то время как частично отрицательный кислород воды притягивает положительно заряженные атомы растворенного вещества. При этом вода диссоциирует ковалентные или ионные связи растворенного вещества, отделяя атомы растворенного вещества друг от друга.
Поэтому вода как полярный растворитель легко растворяет полярные растворенные вещества. Он растворяется следующим образом: частично положительные атомы водорода воды прикрепляются к отрицательно заряженным атомам растворенного вещества, в то время как частично отрицательный кислород воды притягивает положительно заряженные атомы растворенного вещества. При этом вода диссоциирует ковалентные или ионные связи растворенного вещества, отделяя атомы растворенного вещества друг от друга.
Однако вода не может растворять неполярные растворенные вещества, такие как масло или воск (вспомните золотое правило ), что делает ее название «универсальным растворителем» немного обманчивым.
Водородная связь
Полярность воды позволяет ей образовывать водородные связи, более сильную версию обычной диполь-дипольной межмолекулярной силы (и НЕ тип ковалентной или ионной связи, как следует из названия).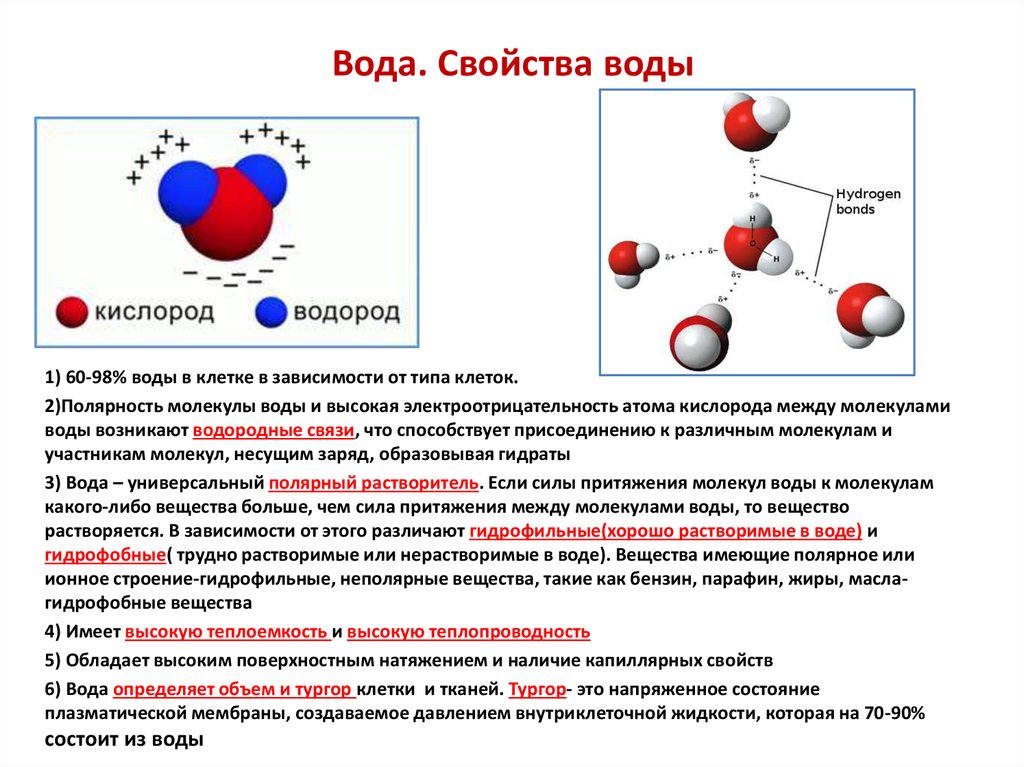 Водородная связь возникает между частично положительным атомом H (обычно связанным с атомом N, O или F) одной молекулы и частично отрицательным атомом (обычно N, O или F) другой молекулы. В случае воды водородная связь возникает между атомом Н одной молекулы воды и атомом О другой молекулы воды.
Водородная связь возникает между частично положительным атомом H (обычно связанным с атомом N, O или F) одной молекулы и частично отрицательным атомом (обычно N, O или F) другой молекулы. В случае воды водородная связь возникает между атомом Н одной молекулы воды и атомом О другой молекулы воды.
Водородная связь обеспечивает когезию воды, адгезию и высокую температуру кипения.
Водородная связь между молекулами водыКогезия
Когезия относится к притяжению между молекулами одного типа. Другими словами, молекулы с сильными силами сцепления любят прилипать друг к другу. Благодаря своей способности образовывать прочные водородные связи вода является одной из таких молекул.
Капли воды являются результатом сильных сил сцепления воды Молекулы воды любят прилипать друг к другу, и такая липкость (то есть силы сцепления) вызывает поверхностное натяжение воды. Поверхностное натяжение — это способность поверхности жидкости сопротивляться внешней силе, ведя себя как эластичная пленка. В случае воды ее поверхностное натяжение позволяет мелким насекомым перемещаться по ней без необходимости плавать или плавать, как водомерка, изображенная ниже.
В случае воды ее поверхностное натяжение позволяет мелким насекомым перемещаться по ней без необходимости плавать или плавать, как водомерка, изображенная ниже.
Адгезия
Адгезия относится к притяжению между молекулами разных типов. Полярность воды позволяет ей прилипать к другим полярным молекулам. Таким образом, чем полярнее молекула, тем лучше к ней будет прилипать вода.
Адгезионные и когезионные силы воды позволяют воде выполнять капиллярное действие. При капиллярном действии вода течет через узкое пространство без помощи или даже против силы тяжести. Это важно, потому что многие процессы в повседневной жизни основаны на капиллярном действии. Капиллярное действие помогает воде достигать корней некоторых растений. Капиллярное действие позволяет бумажным полотенцам и губкам впитывать воду. Кроме того, некоторые научные методы, такие как тонкослойная хроматография, используют капиллярное действие.
Бумажная хроматография в действииДополнительная литература
- Удобный элемент Водород
- Кислород: самый универсальный элемент
- K sp – Константа произведения растворимости
- Что такое хроматография?
- Что такое раствор в химии?
2.
 11: Вода – полярность воды
11: Вода – полярность воды- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 12667
- Безграничный
- Безграничный
Цели обучения
- Описать действия, происходящие из-за полярности воды
Одним из важных свойств воды является то, что она состоит из полярных молекул. Два атома водорода и один атом кислорода в молекулах воды (H 2 О) образуют полярные ковалентные связи. В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный или любит электроны, чем водород. Таким образом, более вероятно, что общий электрон будет найден вблизи ядра кислорода, чем ядра водорода. Поскольку вода является нелинейной или изогнутой молекулой, разница в электроотрицательности между атомами кислорода и водорода создает частичный отрицательный заряд вблизи кислорода и частичные положительные заряды вблизи обоих атомов водорода.
Таким образом, более вероятно, что общий электрон будет найден вблизи ядра кислорода, чем ядра водорода. Поскольку вода является нелинейной или изогнутой молекулой, разница в электроотрицательности между атомами кислорода и водорода создает частичный отрицательный заряд вблизи кислорода и частичные положительные заряды вблизи обоих атомов водорода.
В результате полярности воды каждая молекула воды притягивает другие молекулы воды из-за противоположных зарядов между ними, образуя водородные связи. Вода также притягивает или притягивается к другим полярным молекулам и ионам, включая многие биомолекулы, такие как сахара, нуклеиновые кислоты и некоторые аминокислоты. Полярное вещество, которое легко взаимодействует с водой или растворяется в ней, называется гидрофильным (гидро- = «вода»; -фильный = «любящий»). Напротив, неполярные молекулы, такие как масла и жиры, плохо взаимодействуют с водой, как показано на рис. . Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
Напротив, неполярные молекулы, такие как масла и жиры, плохо взаимодействуют с водой, как показано на рис. . Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
Интерактивный элемент
Водородные связи : Этот интерактивный элемент показывает взаимодействие водородных связей между молекулами воды.
Ключевые моменты
- Разница в электроотрицательности между атомами кислорода и водорода создает на атомах частичные отрицательный и положительный заряд соответственно.
- Молекулы воды притягиваются или притягиваются к другим полярным молекулам.
- Молекулы, которые не растворяются в воде, известны как гидрофобные (боящиеся воды) молекулы.
Ключевые термины
- гидрофильный : имеющий сродство к воде; способный впитывать или смачиваться водой
- гидрофобный : не имеет сродства к воде; не впитывает воду или не смачивается водой
- полярность : Межмолекулярные силы между слегка положительно заряженным концом одной молекулы и отрицательным концом другой или той же молекулы.