От анода до катода
RU C1, US B1, US B2, Адрес для переписки: , г. Саратов, ул. Вавилова, 13, кв.
Поиск данных по Вашему запросу:
Схемы, справочники, даташиты:
Прайс-листы, цены:
Обсуждения, статьи, мануалы:
Дождитесь окончания поиска во всех базах.
По завершению появится ссылка для доступа к найденным материалам.
Содержание:
- От анода до катода
- Между катодом и анодом двухэлектродной лампы приложена разность потенциалов
- Ячейка Хулла — расчет плотностей тока
- Справочник химика 21
- Б)Движение электронов в магнетроне
- Предложения со словом «катод»
- 5.
Контрольные вопросы
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: Замена магниевого анода в водонагревательном баке ТЕРМЕКС (почему перегорают тэны)
От анода до катода
Анод др. Катод от греч. В технике: Электрод полупроводникового прибора диода, тиристора , подключенный к отрицательному полюсу источника тока, когда прибор открыт то есть имеет маленькое сопротивление , называют катодом, подключённый к положительному полюсу — анодом.
В электрохимии: Катод — электрод, на котором происходят реакции восстановления, анод — электрод, на котором происходят окислительно-восстановительные реакции окисление. Термины и определения. Примечание — Анод — отрицательный электрод во время разряда и положительный во время заряда. Примечание — Катод — положительный электрод во время разряда и отрицательный во время заряда.
Войдите или зарегистрируйтесь , чтобы отправлять комментарии. Последнее сообщение. Есть такая нестыковка. В двух словах: Анод др. Главный метролог. Похожие материалы Литий-ионные суперконденсаторы Самый простой способ проверить заряд батареек Аккумуляторные батарей: новые российские технологии Требования к помещениям для работы с аккумуляторами Полезные советы с аккумуляторами и элементами питания.
Между катодом и анодом двухэлектродной лампы приложена разность потенциалов
Форум мехмата МГУ по высшей математике. Ячейка Хулла — расчет плотностей тока Автор темы klavakrivaya. Просмотр формул возможен только при работающем JavaScript. Пожалуйста включите поддержку JavaScript в настройках вашего браузера. Для просмотра формул ваш браузер должен поддерживать MathML. Форумы Список тем Новая тема.
Определяем полярность диода: катод и анод — это минус или плюс Существуют полупроводниковые элементы, которые блокируют ток до.
Ячейка Хулла — расчет плотностей тока
Про анод и катод источника питания необходимо знать тем, кто занимается практической электроникой. Что и как называют? Почему именно так? Будет углублённое рассмотрение темы с точки зрения не только радиолюбительства, но и химии. Наиболее популярное объяснение звучит следующим образом: анод — это положительный электрод, а катод — отрицательный. Увы, это не всегда верно и неполно. Чтобы уметь определить анод и катод, необходимо иметь теоретическую базу и знать, что да как.
Справочник химика 21
Прежде чем рассматривать принцип работы многорезонаторного магнетрона, рассмотрим взаимодействие электрического и магнитного полей на траектории полета электронов между катодом и анодом. В цепи анода будет протекать ток, определяемый током эмиссии катода. Направление силы можно определить, пользуясь правилом левой руки. При этом электроны будут отклоняться в направлении хода часовой стрелки. Рис 3.
Меня зовут Лампобот, я компьютерная программа, которая помогает делать Карту слов.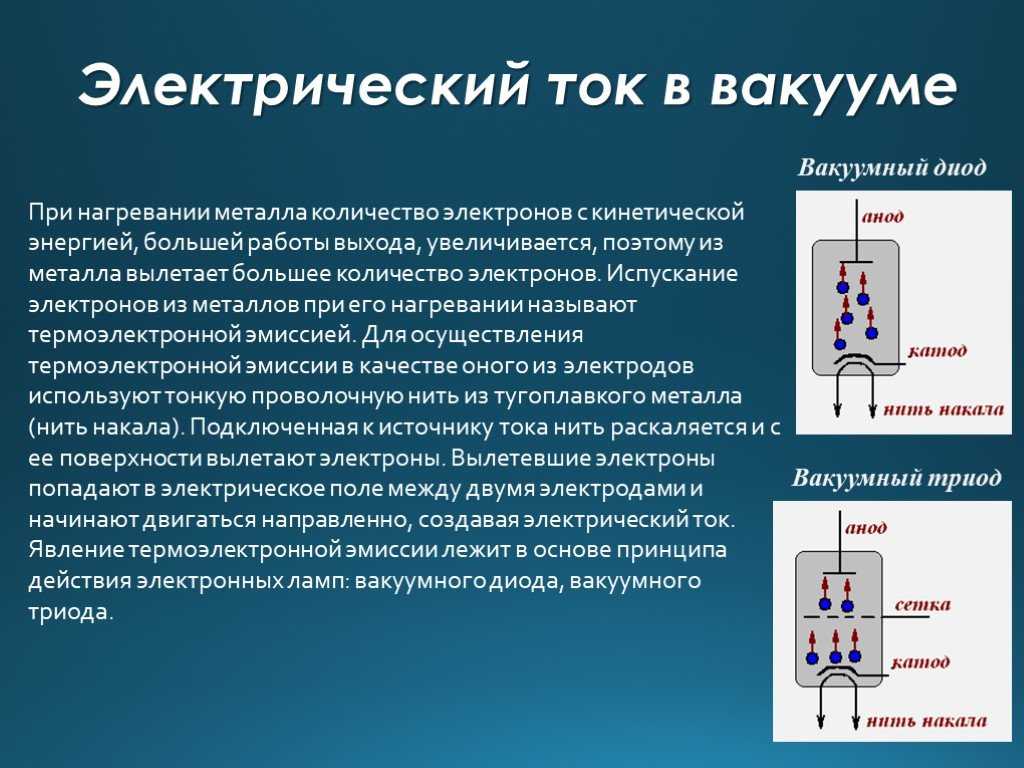
Б)Движение электронов в магнетроне
Меня зовут Лампобот, я компьютерная программа, которая помогает делать Карту слов. Я отлично умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться! Вопрос: умягчить — это что-то нейтральное, положительное или отрицательное? Катод от греч.
Предложения со словом «катод»
Чтобы создавать эффективные электронные схемы с диодами, требуется минимальный объем знаний об их устройстве и принципе работы. Перед началом пайки обязательно необходимо определить, где у этих элементов анод и где катод. Визуального осмотра бывает недостаточно, если электронные элементы приобретены без технической документации или выпаяны из старого оборудования. Для проверки обязательно требуется тестер с различными режимами работы и источник питания с напряжением вольт. Диодами называют электронные элементы, сопротивление которых меняется в зависимости от направления тока. Если ток подается в одну сторону плюс на плюс , он проходит легко диод открыт благодаря низкому сопротивлению.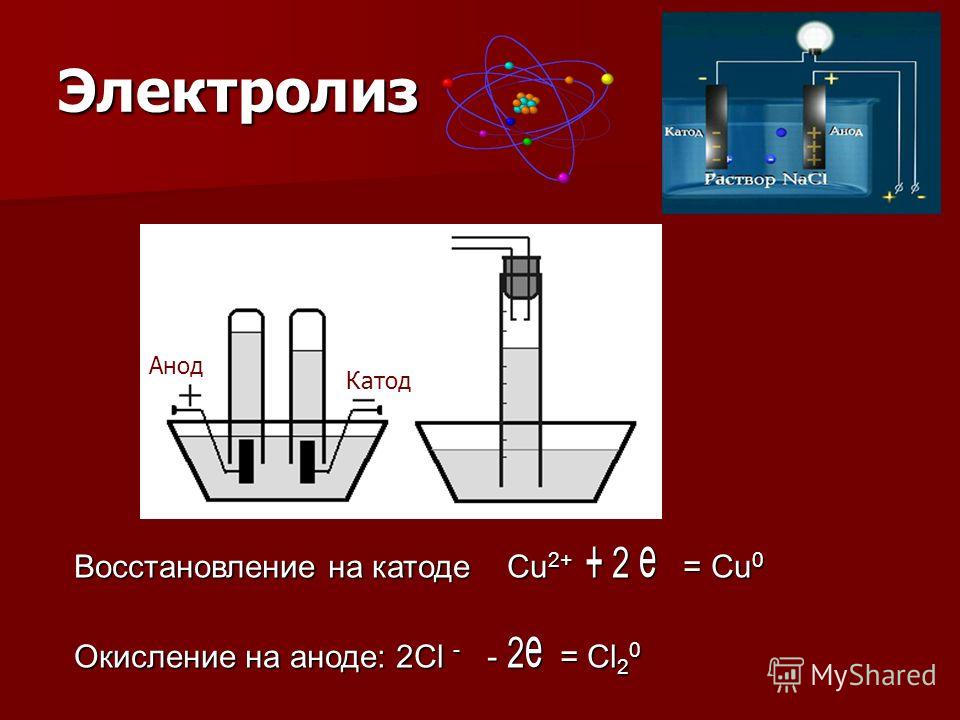 При изменении направления электротока минус на плюс диод закрывается, сопротивление многократно увеличивается, теряется мощность, элемент нагревается. Существуют полупроводниковые элементы, которые блокируют ток до критического значения, потом открываются.
При изменении направления электротока минус на плюс диод закрывается, сопротивление многократно увеличивается, теряется мощность, элемент нагревается. Существуют полупроводниковые элементы, которые блокируют ток до критического значения, потом открываются.
Катод диода нагревается до температур, при которых возникает термоэлектронная эмиссия. При подаче на анод отрицательного относительно катода.
5. Контрольные вопросы
Катод от греч. Например, при электролитическом рафинировании металлов меди , никеля и пр. Получаемый металл также именуется катодом катод медный [1] , катод никелевый, катод цинковый и т. Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины.
Анод др. Катод от греч. В технике: Электрод полупроводникового прибора диода, тиристора , подключенный к отрицательному полюсу источника тока, когда прибор открыт то есть имеет маленькое сопротивление , называют катодом, подключённый к положительному полюсу — анодом. В электрохимии: Катод — электрод, на котором происходят реакции восстановления, анод — электрод, на котором происходят окислительно-восстановительные реакции окисление.
Логин или эл. Войти или Зарегистрироваться.
Получить качественное гальваническое металлопокрытие на различных металлах и сплавах несложно, особенно если представлять, что это за процесс и придерживаться некоторых правил. Осаждение гальванических покрытий получается за счет процесса электролиза. Электролизом называются электрохимические процессы, протекающие при пропускании постоянного тока в некоторых случаях импульсного тока через токопроводящий раствор, содержащий обычно соль металла, который используется в качестве металлопокрытия , и называемого электролитом. Деталь катод подключается к отрицательному полюсу источника тока, а анод к положительному. Отношение площади анода к площади катода для большинства процессов , т.
Главная страница Потенциал энергии Энергосбережение. Инвестиции Инжиниринг Нормативны. Анод разогревается за счет теплоты, которая переносится электронами.
|
Навигация: Главная Случайная страница Обратная связь ТОП Интересно знать Избранные Топ: Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному. Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства… Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие… Интересное: Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления… Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным… Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль… Дисциплины: Автоматизация Антропология Археология Архитектура Аудит Биология Бухгалтерия Военная наука Генетика География Геология Демография Журналистика Зоология Иностранные языки Информатика Искусство История Кинематография Компьютеризация Кораблестроение Кулинария Культура Лексикология Лингвистика Литература Логика Маркетинг Математика Машиностроение Медицина Менеджмент Металлургия Метрология Механика Музыкология Науковедение Образование Охрана Труда Педагогика Политология Правоотношение Предпринимательство Приборостроение Программирование Производство Промышленность Психология Радиосвязь Религия Риторика Социология Спорт Стандартизация Статистика Строительство Теология Технологии Торговля Транспорт Фармакология Физика Физиология Философия Финансы Химия Хозяйство Черчение Экология Экономика Электроника Энергетика Юриспруденция |
Рассмотрим диод с плоскими параллельными электролами, анодное напряжение которого создает между анодом и катодом электрическое поле. Вследствие образования объемного заряда электрическое поле между анодом и катодом является неоднородным. В зависимости от характера этого поля возможны два режима работы диода. Основным режимом для работы диода является режим объемного заряда или точнее режим ограничения анодного тока объемным зарядом. В этом режиме при низких анодных напряжениях вблизи катода имеется плотное облако объемного заряда. В этом случае напряженность поля вблизи катода должна быть равна нулю. Действительно, если считать, что электроны, покидающие катод, имеют практически нулевую скорость, то, если напряженность поля вблизи катода направлена к аноду, ни один из электронов не покинет катода, и ток окажется равным нулю. Остается одна возможность: нулевая напряженность поля на катоде. В этих условиях изменение потенциала внутри лампы и ток определяются объемным зарядом. При увеличении анодного напряжения поле на всем протяжении от катода до анода является ускоряющим, тогда любой электрон, вылетевший из катода, ускоренно движется на анод. Ни один электрон не возвращается в этом случае на катод, и анодный ток будет наибольшим, равным току эмиссии. Объемный заряд исчезает и ток ограничивается лишь скоростью эмиссии электронов с катода. Этот режим называется режимом насыщения. Основной характеристикой диода является вольтамперная характеристика, выражающая зависимость анодного тока от анодного напряжения при постоянной температуре катода. Вольтамперная характеристика одного из диодов показана на рисунке 1. Рис. 1. С увеличением напряжения накала точка А сдвигается влево, так как начальная скорость электронов увеличивается. Средний участок БВ характеристики приближенно считается линейным. Верхний участок ВГ соответствует плавному переходу от режима объемного заряда к режиму насыщения.
3. Вывод приближенной формулы для определения удельного заряда электрона Удельным зарядом электрона называется отношение заряда электрона к его массе e/me. Получим формулу для расчета зависимости анодного тока от напряжения для диода с плоскопараллельными электродами, рассматривая диод как конденсатор, емкость которого:
где eo — абсолютная диэлектрическая проницаемость вакуума, S и d— площадь пластин и расстояние между пластинами конденсатора соответственно. Если катод нагрет до определенной температуры, то эмитированные им электроны устремляются к аноду, создавая ток:
(где q— заряд между катодом и анодом, t— время пролета электрона от катода к аноду), так как за время t все электроны, находящиеся между катодом и анодом, попадут на анод. По определению, заряд, находящийся на обкладках плоского конденсатора пропорционален напряжению на обкладках конденсатора U:
или
Тогда с учетом уравнения (4) уравнение (2) преобразуется:
Умножив числитель и знаменатель (5) на d, получим:
где d / t — средняя скорость движения электронов (Vср). Если считать движение электронов равноускоренным и пренебречь их начальной скоростью, то можно записать:
где V — конечная скорость электрона, достигшего анода. Из закона сохранения энергии найдем скорость V:
где e – модуль заряда электрона, me – масса электрона. Подставляем в уравнение (6) значение конечной скорости из (9) с учетом условия (7), получим зависимость между током и напряжением:
Точное выражение, с учетом изменения напряженности поля от катода к аноду, имеет вид:
Эта формула носит название уравнения Богуславского — Ленгмюра (или закон 3/2).
1234567Следующая ⇒ Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого… Индивидуальные и групповые автопоилки: для животных. Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)… Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим… |
О синхронном полировании медных сплавов и меднении катода в электролитной плазме Текст научной статьи по специальности «Нанотехнологии»
92
О синхронном полировании медных сплавов и меднении катода в электролитной плазме
В. Н. Дураджи, Д. Е. Капуткин
Национальный исследовательский технологический университет «МИСиС», Ленинский пр., 4, г. Москва, 119049, Россия, e-mail: [email protected]
Изучена возможность осуществления синхронного полирования в электролитной плазме металлического анода в электрогидродинамическом режиме и нанесения медного покрытия на поверхность детали, служащей катодом. 270 В; 4) электрогидродинамический — 270 — 330 В; 5) режим контактных электрических разрядов — свыше 330 В.
270 В; 4) электрогидродинамический — 270 — 330 В; 5) режим контактных электрических разрядов — свыше 330 В.
Каждый из этих режимов в той или иной степени можно использовать для обработки и полировки металлических изделий. Низковольтный электролиз приводит к анодному растворению поверхности металлов и сплавов под действием электрического тока. Закономерности обработки подчиняются законам Фарадея. Выход по току в этом режиме в зависимости от вида металла или сплава изменяется от 15-20% (для вольфрама) до 95-98% (для меди). В промышленности существуют различные виды электрохимической обработки. Это электрохимическое полирование, прошивание; точение; объемное копирование; удаление заусенец и др.
В коммутационном режиме наблюдается интенсивное растворение активного электрода под действием импульсных электрических разрядов и интенсивных химических реакций, протекающих в парогазовой оболочке [2]. Этот режим можно использовать для получения иглообразных острий трудно обрабатываемых материалов, таких как вольфрам, молибден, иридий и др. , или химических соединений, например LiB6, который используется в катодах электронно-лучевых трубок.
, или химических соединений, например LiB6, который используется в катодах электронно-лучевых трубок.
При воздействии электролитной плазмы на поверхность активного электрода в режиме нагрева и электрогидродинамическом режиме
специфическая эрозия анода может быть значительной [3]. При этом существуют узкие области напряжений с максимальной скоростью растворения, где условный выход по току увеличивается в 5-10 раз по сравнению с низковольтным электролизным режимом. Если в электрохимии различают нерастворимые (инертные: из платины, графита, иридия) и растворимые (активные) электроды, то при образовании оболочки с электролитной плазмой это разграничение не действует. Особенности воздействия электролитной плазмы на поверхность активного электрода позволяют обрабатывать металлы в таких электролитах, в которых при обычном электролизе они не растворяются и выход по току весьма мал. Эти процессы нашли применение для полировки металлов в электролитной плазме [4].
Однако следует иметь в виду, что электрофизические и электрохимические процессы, протекающие в парогазовой оболочке между металлическим анодом и электролитным катодом, не всегда сопровождаются электрической эрозией и электрохимическим растворением. В некоторых случаях [5], в зависимости от материала анода и состава электролита, эти процессы приводят к образованию покрытий различной толщины на аноде как в режиме нагрева, так и в электрогидродинамическом режиме. В частности, этот эффект нашел широкое применение для микродугового оксидирования (МДО) деталей из алюминия, титана и других металлов [6, 7] в электрогидродинамическом режиме.
В некоторых случаях [5], в зависимости от материала анода и состава электролита, эти процессы приводят к образованию покрытий различной толщины на аноде как в режиме нагрева, так и в электрогидродинамическом режиме. В частности, этот эффект нашел широкое применение для микродугового оксидирования (МДО) деталей из алюминия, титана и других металлов [6, 7] в электрогидродинамическом режиме.
Специфическая эрозия поверхности анода используется не только для полировки, но и для снятия ранее нанесенных покрытий, например Ti с поверхности деталей [8].
Представляет интерес изучение возможности осуществления синхронного полирования в электролитной плазме металлического анода в электрогидродинамическом режиме и нанесения
© Дураджи В.Н., Капуткин Д.Е., Электронная обработка материалов, 2014, 50(6), 92-95.
93
медного покрытия на поверхность детали, служащей катодом.
При реализации способа полировки в электролитной плазме используют в основном водные растворы солей, при необходимости (в зависимости от материала активного электрода) -водные растворы кислот и щелочей. В случае полирования изделий из меди или медных сплавов [9] используют водный раствор аммонийных солей, содержащих фтористый аммоний и аммоний лимоннокислый одно-, двух-, трехзамещен-ный и другие составы при температуре электролита 60-90°С.
В случае полирования изделий из меди или медных сплавов [9] используют водный раствор аммонийных солей, содержащих фтористый аммоний и аммоний лимоннокислый одно-, двух-, трехзамещен-ный и другие составы при температуре электролита 60-90°С.
Медные покрытия [10], как правило, не служат самостоятельным покрытием ни для декоративных целей, ни для защиты стальных деталей от коррозии. Это связано с тем, что медь в атмосферных условиях легко окисляется, покрываясь налетом окислов. Однако, благодаря хорошему сцеплению осажденной меди с различными металлами, медные покрытия применяются в многослойных защитно-декоративных покрытиях в качестве промежуточного подслоя, а также для защиты стальных деталей от цементации.
Электролиты меднения подразделяют на кислые и щелочные. Из кислых электролитов используют сернокислые и борфтористоводородные. Их недостатком является невозможность непосредственного покрытия стальных и цинковых деталей вследствие контактного выделения меди, имеющей плохое сцепление с основным металлом. Поэтому перед меднением в кислых электролитах стальные детали предварительно меднят в цианистых электролитах или осаждают тонкий подслой никеля. Для приготовления сернокислого электролита меднения растворяют медный купорос, фильтруют его в рабочую ванну и при непрерывном помешивании добавляют серную кислоту. При нанесении медных покрытий из сернокислого электролита медные аноды растворяются в основном с образованием двухвалентных ионов, которые, разряжаясь на катоде, осаждаются в виде металлической меди.
Поэтому перед меднением в кислых электролитах стальные детали предварительно меднят в цианистых электролитах или осаждают тонкий подслой никеля. Для приготовления сернокислого электролита меднения растворяют медный купорос, фильтруют его в рабочую ванну и при непрерывном помешивании добавляют серную кислоту. При нанесении медных покрытий из сернокислого электролита медные аноды растворяются в основном с образованием двухвалентных ионов, которые, разряжаясь на катоде, осаждаются в виде металлической меди.
В электролите, омывающем металлическую медь, идет также химический обратный процесс: Си + Cu2+ = 2 Cu+. Накопление в растворе одновалентной меди в больших количествах приводит к сдвигу реакции влево, в результате чего выпадает металлическая губчатая медь.
К щелочным электролитам меднения относятся цианистые, пирофосфатные и др. Цианистые медные электролиты обладают высокой рассеивающей способностью, мелкокристаллической структурой осадков, возможностью непосредственного меднения стальных деталей. Однако они характеризуются пониженным выходом по
Однако они характеризуются пониженным выходом по
току (не более 60-70%). Следует иметь в виду, что процессы на аноде и катоде осложняются, так как на практике электрохимические процессы проводят в условиях, отличных от стандартных.
На катоде процесс заключается в разряде двухвалентных и одновалентных ионов меди, но в связи с тем, что концентрация ионов одновалентной меди приблизительно в 1000 раз меньше концентрации ионов двухвалентной меди, то катодный процесс выглядит так: Cu2+ + 2е» = Cu. Выход по току составляет почти 100% [10].
В режиме нагрева и электрогидродинамическом режиме электрический ток в прианодной области протекает от анода к электролитному катоду через сложную систему. Когда поверхностный слой на аноде отсутствует, существует переход: металл-газ-электролит. Когда же поверхностный слой сплошной и твердый и может быть проводником или полупроводником, переход будет следующим: металл-полупроводник-газ-электролит или металл-газ-электролит. Проводимость в этих случаях изменяется от электронной к смешанной: электронной и ионной и далее к ионной. При этом наряду со стационарными электрическими разрядами, протекающими между поверхностным слоем и электролитом, происходит распыление электролита с образованием электризованных микрокапель. Последние уменьшают величину парогазового слоя, что может привести к возникновению и протеканию импульсных разрядов. Эти разряды могут также возникать и непосредственно между анодом и электролитом на участках, где толщина оболочки становится достаточно малой. Под их действием, а также интенсивных электрохимических реакций на поверхности анода с элементами, входящими в состав электролита, элементы анода переходят в возбужденное и ионизированное состояние. Часть из них вступает в химические реакции с элементами водного раствора, а часть (под действием сил электрического поля) переносится на катод. Можно предположить, что элементы металлов, входящие в состав анода, при этом могут образовывать поверхностный слой на катоде. Состав образовавшегося покрытия на катоде обусловлен только элементами анода и не зависит от элементов, входящих в состав водного раствора.
При этом наряду со стационарными электрическими разрядами, протекающими между поверхностным слоем и электролитом, происходит распыление электролита с образованием электризованных микрокапель. Последние уменьшают величину парогазового слоя, что может привести к возникновению и протеканию импульсных разрядов. Эти разряды могут также возникать и непосредственно между анодом и электролитом на участках, где толщина оболочки становится достаточно малой. Под их действием, а также интенсивных электрохимических реакций на поверхности анода с элементами, входящими в состав электролита, элементы анода переходят в возбужденное и ионизированное состояние. Часть из них вступает в химические реакции с элементами водного раствора, а часть (под действием сил электрического поля) переносится на катод. Можно предположить, что элементы металлов, входящие в состав анода, при этом могут образовывать поверхностный слой на катоде. Состав образовавшегося покрытия на катоде обусловлен только элементами анода и не зависит от элементов, входящих в состав водного раствора.
Ввиду того, что режим нагрева в электролитной плазме используется в основном для термической и химико-термической обработки стальных деталей, синхронное образование поверхностного слоя в этом режиме на катоде не представляет особого интереса. Электрогидродинамический режим широко применяется для поли-
94
Рис. 1. Рентгеноспектральный анализ катода из нержавеющей стали (а) и никелированного железа (б).
Рис. 2. Рентгеноспектральный анализ медненного катода (нержавеющая сталь) при времени обработки, мин: (а) — 2; (б) — 4.
ровки различных металлов и сплавов. Поэтому проведение экспериментов с целью получения поверхностного слоя на катоде элементами, входящими в состав анода и отсутствующими в используемом водном растворе, осуществлялось в этом режиме. Приведем некоторые из результатов исследований, проведенных для изучения процессов, протекающих на электродах электролитической ячейки.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Представляет интерес анод, состоящий из двух-трех элементов и широко используемый в производстве. Таким материалом послужила латунь марки Л63, состоящая из меди и цинка, а для контроля — чистая медь. Активный электрод (анод) изготавливался в виде пластин размерами 60x15x3,5 мм и из прутков диаметром 8 мм, длиной 60 мм. Катод выполнялся из нержавеющей стали (рис. 1а) и никелированного железа (рис. 1б) в виде полуцилиндра размерами
Таким материалом послужила латунь марки Л63, состоящая из меди и цинка, а для контроля — чистая медь. Активный электрод (анод) изготавливался в виде пластин размерами 60x15x3,5 мм и из прутков диаметром 8 мм, длиной 60 мм. Катод выполнялся из нержавеющей стали (рис. 1а) и никелированного железа (рис. 1б) в виде полуцилиндра размерами
150x80x0,3 мм. Химический состав анода и катода до и после обработки определялся рентгеноспектральным анализом.
Чистота поверхности анода определялась с помощью профилометра модели 130 производства «Завода «протон-МИЭТ».
Электролитом являлись водные растворы аммонийных солей (хлористого аммония, фтористого аммония, лимоннокислого аммония ((Nh5)3C6H5O7)) при температуре раствора 60-80°С. Время обработки изменялось от 2 до 10 минут. Напряжение на электродах ванны состав-
ляло 300-320 В, анодная плотность тока -0,6-0,8 А/см2.
Проведенные исследования показали, что в электролите, не содержащем соединений меди, в процессе полировки латуни синхронно осуществляется меднение поверхности катода (рис. 2, 3). После обработки поверхность анода имела зеркальный блеск. Класс чистоты поверхности анода возрос с 9-го до 11-12-го класса. Причем большего класса чистоты можно достичь путем повышения времени обработки.
2, 3). После обработки поверхность анода имела зеркальный блеск. Класс чистоты поверхности анода возрос с 9-го до 11-12-го класса. Причем большего класса чистоты можно достичь путем повышения времени обработки.
Рис. 3. Рентгеноспектральный анализ медненного катода (никелированная сталь). Время обработки — 3 мин.
Поверхность катода равномерно покрывается слоем меди как с внутренней, так и с внешней стороны. На рис. 2 представлены рентгенограммы катода из нержавеющей стали с нанесенным медным слоем в зависимости от времени обработки. Естественно, с увеличением времени обработки толщина медного покрытия возрастает. При длительности процесса 2 мин она составляет 3-4 мкм, а при 4 мин — 5-6 мкм. При этом следу-
95
ет учитывать, что при полировке анода в электролитной плазме в электролите находятся ионы меди и цинка. В первую очередь на поверхности катода разряжаются ионы того металла, величина электродного потенциала которого больше [10]. Таким образом, из раствора, содержащего ионы Zn2+ и Cu2+, выделяется металлическая медь, которая менее активна и имеет большее значение стандартного электродного потенциала: £°(Cu+2/Cu°) = + 0,34 B, E(Zn+2/Zn°) = — 0,76 B.
Для катода, выполненного из железа с никелевым покрытием (рис. 3), толщина медненного слоя составляет 4-5 мкм за время обработки 3 мин. Очевидно также, что толщина медненного покрытия (при постоянстве всех остальных параметров) определяется размерами катода. С уменьшением его площади в два раза толщина слоя возросла в 1,5-1,6 раза. По-видимому, здесь оказывает влияние возросшая катодная плотность тока.
Таким образом, проведенные исследования позволили установить возможность синхронного (одновременного) полирования в электролитной плазме металлического анода в электрогидродинамическом режиме и нанесения медного покрытия на поверхность детали, служащей катодом. Установлено, что медные покрытия на катоде можно получать только за счет ионов, поступающих с анода, без использования электролитов, содержащих соединения меди.
ЛИТЕРАТУРА
1. Дураджи В.Н. Особенности установления электрогидродинамического режима, используемого для полирования металлов в электролитной плазме.
Металлообработка. 2013, (3), 35-40.
2. Лазаренко Б.Р., Фурсов С.П., Факторович А.А., Галанина Е.К., Дураджи В.Н. Коммутация тока на границе металл-электролит. Кишинев: Штиинца, 1971. 74 с.
3. Дураджи В.Н., Брянцев И.В., Товарков А.К. Исследование эрозии анода при воздействии на него электролитной плазмы. ЭОМ. 1978, (5), 13-17.
4. Куликов И.С., Ващенко С.В., Василевский В.И. Особенности электроимпульсного полирования металлов в электролитной плазме. Вести АН Белоруссии. Серия физико-технических наук. 1995, (4), 18-21.
5. Дураджи В.Н., Парсаданян А.С. Нагрев металлов в электролитной плазме. Кишинев: Штиинца, 1988. 216 с.
6. Николаев А.В., Марков Г.А., Пещевицкий Б.И. Новое явление в электролизе. Известия СО АН СССР. Сер. хим. наук. 1977, (5), 32-33.
7. Снежко Л.А., Бескровный Ю.М., Невкрытый В.И., Черненко В.И. Импульсный режим для получения силикатных покрытий в искровом разряде. Защита металлов. 1980, 16(3), 365-367.
8. Горбатков С.А., Парфенов Е. В., Невьянцева Р.Р. Управление технологическим процессом электролитно-плазменного удаления покрытия. Вестник УГАТУ. 2003, 4(1), 145-152.
В., Невьянцева Р.Р. Управление технологическим процессом электролитно-плазменного удаления покрытия. Вестник УГАТУ. 2003, 4(1), 145-152.
9. Куликов И.С., Ващенко С.В., Каменев А.Я.
Электролитно-плазменная обработка материалов. Минск: Беларуская навука, 2010. 232 с.
10. Вайнер Я.В., Дасоян М.А. Технология электрохимических покрытий. Ленинград: Машиностроение, 1972. 464 с.
Поступила 29.03.14 После доработки 17.06.14 Summary
This study examines an opportunity of a synchronous polishing of a metal anode in the electrolyte plasma in the electro-hydrodynamic mode as well as a possibility of deposition of a copper coating on a piece surface used as cathode. It is established that a copper coating on the cathode could be formed without usage of electrolytes containing copper compounds, but only by means of ions coming from the anode.
Keywords: electrolytic plasma, discharge, electrolysis, copper plating, coating, anode, cathode, X-ray analy-
sis.
Аноды для гальваники | Гальванопокрытие
АНОДЫ
Аноды служат, в первую очередь, для подвода тока в электролит и для равномерного распределения его по деталям. Менее важно второе назначение растворимых анодов — возмещать убыль металла в электролите взамен выделенного при покрытии изделий. Третья функция анодов — это выполнение некоторых окислительных процессов, нужных для поддержания постоянства состава электролита. И, наконец, приходится считаться с их побочным действием — загрязнением ванны шламом и посторонними примесями.
Менее важно второе назначение растворимых анодов — возмещать убыль металла в электролите взамен выделенного при покрытии изделий. Третья функция анодов — это выполнение некоторых окислительных процессов, нужных для поддержания постоянства состава электролита. И, наконец, приходится считаться с их побочным действием — загрязнением ванны шламом и посторонними примесями.
Прошедшие через электролит 96,5 кКл (26,8 А«ч) электрического тока растворяют или выделяют на аноде и на катоде по 1 г-экв вещества. Однако почти никогда этот грамм-эквивалент не состоит только из металла покрытия. И на аноде, и на катоде идут еще и другие процессы растворения и выделения разных веществ, сумма эквивалентных количеств которых вместе с металлом покрытия составляет тот грамм-эквивалент, который 96,5 кКл (26,8 А-ч) может растворить или выделить на аноде или на катоде. Та доля количества электричества, которая пошла на растворение металла покрытия на аноде или на его осаждение на катоде, называется анодным или соответственно катодным выходом данного металла по току.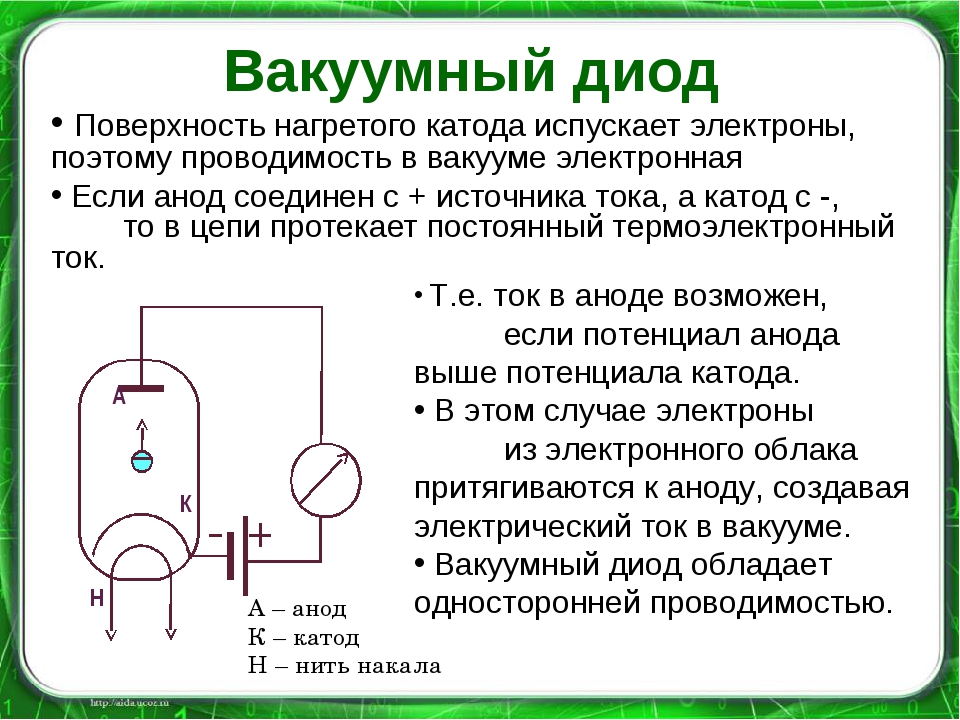 Этот выход по току никогда не может быть больше 100 %. Встречающиеся иногда указания о выходе по току больше 100 % объясняются сознательно допущенной н общепринятой«ошибкой», когда для упрощения не учитывают одновременное выделение металла из ионов разной валентности или его химическое растворение без участия тока г.
Этот выход по току никогда не может быть больше 100 %. Встречающиеся иногда указания о выходе по току больше 100 % объясняются сознательно допущенной н общепринятой«ошибкой», когда для упрощения не учитывают одновременное выделение металла из ионов разной валентности или его химическое растворение без участия тока г.
Роль анодов в гальваническом процессе
Выход по току и постоянство состава электролита.
Анодный и катодный выходы по току зависят от свойств металла покрытия, состава электролита и режима’ процесса. Эти факторы, в частности некоторые компоненты электролита, и плотность тока могут по-разному’ влиять на выходы по току на аноде и катоде. Практически они почти никогда не бывают одинаковы, анодный выход по току часто бывает меньше катодного. В этом случае электролит будет по мере работы обедняться металлом покрытия. Это относительное обеднение металлом следует отличать от общего снижения концентрации электролита вследствие уноса при выгрузке деталей. Такой унос вызывает снижение концентраций компонентов в их первоначальном (рецептурном) соотношении. Для поддержания постоянства относительных концентраций металла покрытия и остальных компонентов следует создать условия, при которых разница между анодным и катодным выходами по току была бы возможно меньшей.
Такой унос вызывает снижение концентраций компонентов в их первоначальном (рецептурном) соотношении. Для поддержания постоянства относительных концентраций металла покрытия и остальных компонентов следует создать условия, при которых разница между анодным и катодным выходами по току была бы возможно меньшей.
Анодные режимы. Анодный выход по току с увеличением анодной плотности тока снижается за счет пассивирования анода, затрудняющего его растворение. Поэтому простейшим и самым распространенным способом улучшения растворимости анодов будет снижение плотности анодного тока путем завески в ванну большей площади анодов, чем площадь деталей. Для ориентировки в табл. 6 приведены для некоторых электролитов предельные значения анодной плотности /а тока, при которой наступает полное пассивирование анода, и рекомендуемое отношение площади анодной поверхности к катодной (Sa : S„).
1 Как правило, в этих случаях специально объясняется, за счет чего расчет дал величину свыше 100 %.
Таблица б. Анодные режимы для электролитов
Влияние анодов на равномерность распределения тока. Расстояние между анодом и деталью должно быть возможно большим, особенно для деталей сложного профиля, чтобы относительные расстояния от анода до ближних и дальних точек детали меньше различались между собой. Нижний конец анода не должен опускаться существенно ниже деталей, иначе нижняя часть детали, получая ток от относительно большей поверхности анода, чем середина детали, может «подгореть», что особенно часто случается в ваннах без перемешивания, на дне которых температура раствора заметно ниже, чем наверху. В технической литературе встречаются даже рекомендации закрывающими и непроводящими экранами верхнюю часть анода от уровня верха детали до зеркала электролита, хотя здесь эффект от избытка площади анода менее опасен! для детали.
Выступающие углы, острия и другие выступы деталей, если их нельзя расположить в плоскости катодной штанги, должны быть направлены в сторону промежутка между соседними анодами. Промежуток между анодами не должен превышать половины расстояния между анодами и деталями.
Промежуток между анодами не должен превышать половины расстояния между анодами и деталями.
Материалы для нерастворимых анодов. В цианистых и щелочных ваннах хорошо работают аноды из малоуглеродистой или из коррозионностойкой стали, предпочтительно хромоникелевой. В кислых ваннах в большинстве случаев применяют аноды из свинца или его сплава с 4—8 % сурьмы, или с 6—10 % олова, или 4,5 % сурьмы и 0,2 % серебра (последние два преимущественно для хромировочных ванн). Значительно реже применяются графит, титан и платинированный титан, обладающие при этом хорошей химической стойкости, и некоторыми отрицательными свойствами: графит механически непрочен; титан иногда может пассивироваться до такого высокого потенциала, что на нем начинает разряжаться хлор из присутствующих в электролите хлоридов.
Активирующие добавки в электролитах и в анодах. Во многих ваннах применяются активаторы растворения анодов, добавляемые в электролит для повышения анодного выхода по току. В медной н других цианистых ваннах такими добавками служат анионы солей винной, угольной или роданистой кислот. В современных кон¬центрированных электролитах количество углекислого натрия часто превышает 100 г/л. В сернокислую и сульфаматную никелевые ванны прибавляют хлористые соли (катион роли не играет). Указываемые в рецептуре электролита количества активирующих добавок можно в процессе практической работы уточнить, добиваясь возможною постоянства кислотности электролита рН или концентрации металла покрытия в растворе (по данным химического анализа).
В медной н других цианистых ваннах такими добавками служат анионы солей винной, угольной или роданистой кислот. В современных кон¬центрированных электролитах количество углекислого натрия часто превышает 100 г/л. В сернокислую и сульфаматную никелевые ванны прибавляют хлористые соли (катион роли не играет). Указываемые в рецептуре электролита количества активирующих добавок можно в процессе практической работы уточнить, добиваясь возможною постоянства кислотности электролита рН или концентрации металла покрытия в растворе (по данным химического анализа).
Добиваться полного постоянства не нужно, да это и затруднительно, ибо оно зависит от еще многих других факторов, лишь бы рН удерживалось в указанных в рецептуре пределах. Для активирования никелевых анодов в большинстве случаев требуется не более 15 г/л NaCl.
В современных ваннах, работающих при больших плотностях тока, начинают все чаще применять аноды с внесенными в них при отливке активирующими добавками. В медных анодах такой добавкой служит фосфор (0,02—0,04 %, иногда даже 0,20 %). Добавка в оловянные аноды алюминия (1 %) позволяет в щелочной оловянной ванне увеличить плотность предельного непассивирующего тока до 9 А/дм2 вместо 4 А/дм* для анодов без добавки. Для никелевых ванн применяют аноды с добавкой кислорода (0,1—0,2 %, что соответствует 0,46—0,91 KiO). В качестве добавки может служить также углерод (0.08—0,30 %) при наличии в аноде кислорода не более 0,01 % или серы (0,002—0,075 %, по другим данным — 0,02— 0,04 %).
Добавка в оловянные аноды алюминия (1 %) позволяет в щелочной оловянной ванне увеличить плотность предельного непассивирующего тока до 9 А/дм2 вместо 4 А/дм* для анодов без добавки. Для никелевых ванн применяют аноды с добавкой кислорода (0,1—0,2 %, что соответствует 0,46—0,91 KiO). В качестве добавки может служить также углерод (0.08—0,30 %) при наличии в аноде кислорода не более 0,01 % или серы (0,002—0,075 %, по другим данным — 0,02— 0,04 %).
Во всех трех типах активированных никелевых анодов концентрация добавок не должна превышать указанные пределы, так как образующиеся окись никеля, графит или сернистый никель скапливаются на границах зерен, ослабляют сцепление между ними, что вызывает их выпадение. При малых концентрациях добавок можно улучшить равномерность их распределения прогревом прокатанных анодов при 950—1250 °С.
В цинковых анодах для кислых ванн применяют противоположно действующую добавку, замедляющую (ингибирующую) бесполезное химическое растворение анодов, — добавку 0,5—1,0% алюминия. Действие алюминия значительно усиливается добавкой 0,03 % ртути. Но изделия, оцинкованные в присутствии ртути, недопустимо применять в соседстве с алюминиевыми (и латунными) деталями, так как попадающая в покрытие ртуть, амальгамируя алюминий детали, лишает его защитной окисной пленки и алюминиевая вещь на глазах превращается в рыхлую окись. В электролитах для никелирования, не содержащих хлориона, никелевый неактивированный анод пассивируется при потенциале не более 0,2 В, тогда анод, содержащий серу, начинает пассивироваться только! при 0,8 В. Анод с 0,02—0,03 % серы в электролите не содержащем хлор-иона, может работать при анодной плотности тока до 15 А/дм2, в электролите типа Уаттса—1 с 50—60 г/л хлористого никеля, при температура 40—60 °С — до 50 А/дм2.
Действие алюминия значительно усиливается добавкой 0,03 % ртути. Но изделия, оцинкованные в присутствии ртути, недопустимо применять в соседстве с алюминиевыми (и латунными) деталями, так как попадающая в покрытие ртуть, амальгамируя алюминий детали, лишает его защитной окисной пленки и алюминиевая вещь на глазах превращается в рыхлую окись. В электролитах для никелирования, не содержащих хлориона, никелевый неактивированный анод пассивируется при потенциале не более 0,2 В, тогда анод, содержащий серу, начинает пассивироваться только! при 0,8 В. Анод с 0,02—0,03 % серы в электролите не содержащем хлор-иона, может работать при анодной плотности тока до 15 А/дм2, в электролите типа Уаттса—1 с 50—60 г/л хлористого никеля, при температура 40—60 °С — до 50 А/дм2.
Анод из электролитического никеля без активирующих добавок дает чисто металлический шлам и в мaлых количествах, составляющих 0,01—0,05 % от массы) израсходованного анода, тогда как анод, активированный серой, дает нерастворимый и нетокопроводный шлам в количестве свыше 0,18 % от массы анода, значительно более мелкий, легче проникающий через чехол, легче вымывающийся через оказавшийся нижа уровня электролита край чехла и хуже отстаивающийся. В литературе приводятся такие результаты ситового анализа шлама, накопившегося в ванне сернокислого никеля, содержащей 45 г/л хлористого никеля: шлам высококачественного неактивированного электролитического никелевого анода содержал частиц крупнее 160 мкм—55%, мельче 40 мкм — 24%; шлам анода, активированного серой, содержал частиц круп¬нее 160 мкм — 3 %, а частиц меньше 40 мкм — 86 %
В литературе приводятся такие результаты ситового анализа шлама, накопившегося в ванне сернокислого никеля, содержащей 45 г/л хлористого никеля: шлам высококачественного неактивированного электролитического никелевого анода содержал частиц крупнее 160 мкм—55%, мельче 40 мкм — 24%; шлам анода, активированного серой, содержал частиц круп¬нее 160 мкм — 3 %, а частиц меньше 40 мкм — 86 %
Неудобства от наличия мелкого шлама окупаются возможностью работы при большой анодной плотности тока.
Эксплуатация анодов
Габаритные размеры и профиль анодов. При работах по уходу за анодами их приходится часто вынимать из ванны, поэтому они не должны быть слишком тяжелыми. Женщинам запрещено поднимать тяжести более 16 кг, но учитывая неудобство снимания анода с задней анодной штанги и необходимость его выдержки на весу для стекания раствора из чехла, не следует делать аноды тяжелее 10—12 кг. Масса анода толщи¬ной 10 мм на каждый 1 дм2 площади его поверхности для различных металлов (г) следующая:
Железо. ……………. 790
……………. 790
Золото…………….. 1930
Кадмий…………….. 865
Кобальт ……………. 890
Медь……………… 894
Никель…………….. 890
Олово……………… 730
Свинец…………….. 1135
Серебро…………….. 1049
Тнтан …………….. 450
Цинк……………… 714
Латунь…………….. 870
Поперечное сечение у распространенных анодов обычно прямоугольное, поскольку их режут из прокатанного листа, но это не самое выгодное сечение, по¬тому что анод срабатывается главным образом с боков и снизу. Часто встречающиеся в производстве цилиндрические аноды (диаметрами 30—50 мм) удобны в эксплуатации и их фактическая поверхность в 1,57 раза больше проекционной. В иностранной литературе рекомендуют, например, для медных пирофосфатных ванн аноды с сечением, напоминающим шестеренку; поверхность такого анода в 2—3 раза больше проекционной.
Подвешивание анодов. Плоский анод подвешивают на двух крюках из медного или латунного прутка или полоски, нижние концы которых, загнутые на полуокружности с внутренним радиусом, равным одинарной или полуторной толщине анода, заведены в отверстия, просверленные около верхнего края анода. Свободный конец загиба не должен выходить из отверстия анода выше горизонтального диаметра загиба — длинный конец мешает надеванию анода. Отверстие в аноде должно быть на 5—8 мм больше диаметра прутка крюка. Расстояние от центра отверстия до верхнего края анода примерно равно полутора диаметрам отверстия, а при завешенном в ванну аноде расстояние от центра отверстия до зеркала раствора должно быть не менее 50 мм (рис. 25).
Свободный конец загиба не должен выходить из отверстия анода выше горизонтального диаметра загиба — длинный конец мешает надеванию анода. Отверстие в аноде должно быть на 5—8 мм больше диаметра прутка крюка. Расстояние от центра отверстия до верхнего края анода примерно равно полутора диаметрам отверстия, а при завешенном в ванну аноде расстояние от центра отверстия до зеркала раствора должно быть не менее 50 мм (рис. 25).
Верхняя часть крюка и его электрический расчет делаются так же, как и у крюка подвески.
Нерастворимые аноды из свинца и его сплавов, особенно для хромировочной ванны, приходится делать сложнее. Их нельзя изготовлять из листа и, тем более.
нельзя вешать на анодную штангу обернув вокруг нее верхний край листа. Такой способ подвешивания не дает надежного контакта со штангой из-за плохого] прилегания и загрязнений (окислов и засохших брызг! раствора), но, что еще важнее, из-за плохой электро-1 проводности свинца (только 8 % от проводимости меди) падение напряжения вдоль даже не длинного! анода катастрофически скажется! на покрытии нижней части деталей. Анод должен быть отлит из свинца или его сплава в виде1 пластины толщиной 10—15 мм или \ цилиндра диаметром 20—50 мм, внутрь которого залит на 2/3—а/4 ‘ длины анода медный или латунный стержень. Верхний конец стержня, выступающий из анода, загнут в стандартный подвесной крюк. Очень важно, чтобы залитая внутрь анода часть стержня крюка была предварительно тщательно покрыта оловом (для надежного контакта). Для надежного крепления в аноде на ней должны быть сделаны заусенцы (3—6 заусенцев, надрубленных зубилом) или конец стержня немного загнут, 1 иначе стержень может вытянуться из анода (рис. 26).
Анод должен быть отлит из свинца или его сплава в виде1 пластины толщиной 10—15 мм или \ цилиндра диаметром 20—50 мм, внутрь которого залит на 2/3—а/4 ‘ длины анода медный или латунный стержень. Верхний конец стержня, выступающий из анода, загнут в стандартный подвесной крюк. Очень важно, чтобы залитая внутрь анода часть стержня крюка была предварительно тщательно покрыта оловом (для надежного контакта). Для надежного крепления в аноде на ней должны быть сделаны заусенцы (3—6 заусенцев, надрубленных зубилом) или конец стержня немного загнут, 1 иначе стержень может вытянуться из анода (рис. 26).
Изложница для отливки плоского анода из свинца или его сплава может быть сделана из листа кровельного железа, края которого отогнуты вверх на толщину будущего анода. В одной из торцовых стенок бортика сделан вырез, куда перед отливкой закладывается стержень анодного крюка. Зазор между краем выреза и стержнем плотно закрывают клочком асбеста и крюк во время заливки и полминуты после заливки, пока металл не затвердеет, придерживают плоскогубцами, чтобы стержень не всплыл (рис. 27).
27).
Изложницу для круглого анода делают из отрезка водопроводной трубы, разрезанной ножовкой по диаметральной плоскости. Полученные два полуцилиндра
складывают в цилиндр, связывают проволокой (некоторая нецилиндричность за счет толщины реза роли не играет). Через нижнее отверстие вставляют стержень
Рис. 26. Закрепление стержня анодного подвесного крюка в литом нерастворимом аноде из свинца или свинцового сплава: о — нижний конец стержня с заусенцами; б — загнутый нижний конец стержня; в — П-образный загиб стержня
крюка, затыкают отверстие вокруг него асбестом и, придерживая крюк плоскогубцами или зажав его в тиски,заливают через верхнее отверстие свинец. В обоих случаях после. выемки плоского или круглого анода из изложницы надо тщательно проверить, не обнажился ли где нибудь стержень. Небольшие аноды из свинца можно отливать просто в трубку, свернутую из плотной бумаги.
Анодные чехлы.
При растворении всех анодов образуется шлам — выкрошившиеся кристаллики металла, окислы, межкристаллические включения и пр.
Этот шлам легко взмучивается в ванне, осаждается на детали, ухудшая внешний вид и качество покрытия. Чтобы шлам не попадал в ванну, на аноды надевают
Рис. 27. Изложница типа подноса для отливки плоских нерастворимых анодов из свинца или свинцового сплава: о — общий вид, б — способ загиба угла чехлы, сшитые из достаточно стойкого в электролите материала в виде открытых сверху мешков с завязками, удерживающими их от сползания с анода. Верхний край чехла должен быть на 50—70 мм выше зеркала электролита, чтобы шлам не могло выплеснуть в ванну. На каждый анод лучше надевать по два чехла один на другой (для гарантии от прорыва).
Из распространенных у нас синтетических тканевых материалов очень удобен для чехлов хлорин (артикул 86006), он достаточно плотен, но при этом поддается сшиванию на бытовой швейной машине. Для не слишком кислых ванн его можно шить обычной I хлопчатобумажной ниткой; для сильно кислых ванн его приходится шить вручную ниткой, выдернутой из хлориновой ткани, или склеивать эпоксидным клеем.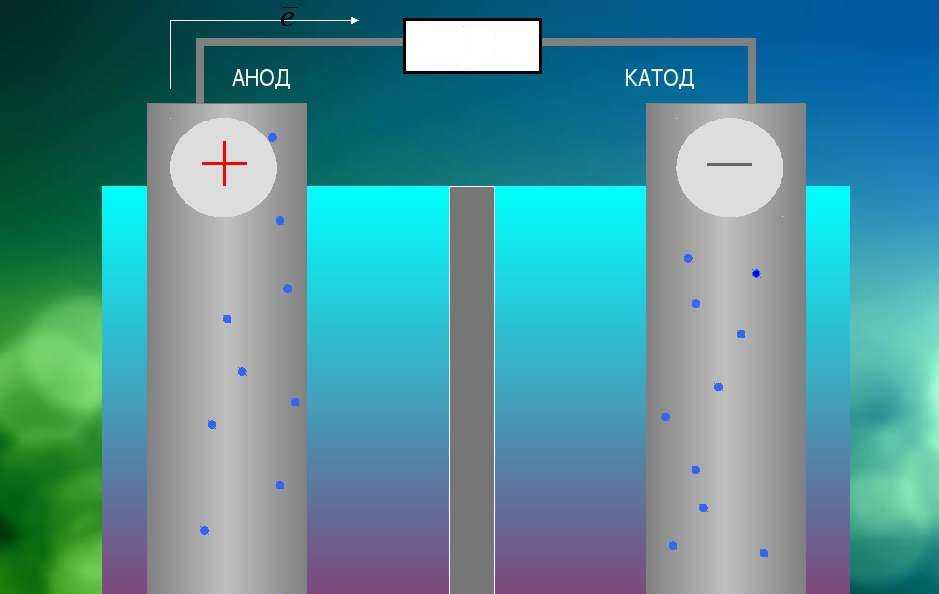 При этом площадь склейки должна быть возможно меньшей — она непроницаема для электролита. Годятся также плотные сорта полипропиленовых и капроновых тканей. Для не очень кислых ванн можно при¬менять хлопчатобумажные ткани (бязь, фланель, бельтип) и льняные, суконные не рекомендуется. Перед употреблением чехлы, особенно хлопчатобумажные, надо стирать в горячей воде для отмывки крахмала и других апретурных материалов. Все чехлы надо не реже раза в неделю снимать с анодов, стирать и перед повторным применением внимательно проверять на целость.
При этом площадь склейки должна быть возможно меньшей — она непроницаема для электролита. Годятся также плотные сорта полипропиленовых и капроновых тканей. Для не очень кислых ванн можно при¬менять хлопчатобумажные ткани (бязь, фланель, бельтип) и льняные, суконные не рекомендуется. Перед употреблением чехлы, особенно хлопчатобумажные, надо стирать в горячей воде для отмывки крахмала и других апретурных материалов. Все чехлы надо не реже раза в неделю снимать с анодов, стирать и перед повторным применением внимательно проверять на целость.
Использование отходов растворимых анодов
Переплавка отходов растворимых анодов для многих заводов затруднительна, да и литые аноды в большинстве случаев работают хуже катаных. Более рационально использование анодных сетчатых корзин, в которые загружают отходы, предварительно нарубленные на кусочки размером от 25×25 до 50×50 мм. Для цианистых и щелочных ванн корзины делают из углеродистой или коррозионно-стойкой стали, для кислых — из пластмассы или из стали покрытой пластмассой.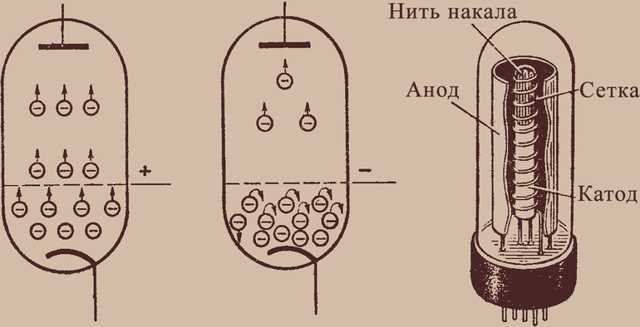 В пластмассовые корзины опускают пластинку из анодного металла для подвода тока к отходам.
В пластмассовые корзины опускают пластинку из анодного металла для подвода тока к отходам.
В последнее время в обиход стали входить значительно более удобные титановые корзины. На титане в присутствии ничтожных следов кислорода или иных окислителей образуется тонкая (0,000005 мм) непроводящая окисная пленка, обладающая свойством существенно снижать свое сопротивление в местах, подвергающихся относительно большому удельному давлению, например под краем лежащего в корзине об¬резка. В других местах эта электрически и химически изолирующая пленка сохраняет свои электрические свойства. Ее пробивное напряжение в растворе сульфатов или серной кислоты доходит до 80 В, в солянокислой среде оно падает до 7—8 В, что тоже достаточно для работы ванны, а в обычных сернокислых электролитах с примесью хлоридов имеет какую-то промежуточную величину. Пленка разрушается только в присутствии иона фтора. Такая корзина в никелевом электролите требует лишь на 0,1 В большее напряжение, чем обычный плоский анод — это в пять раз меньше экономически допустимой разницы.
При пользовании титановыми корзинами нужно, чтобы корзина была всегда наполнена анодными обрезками выше верхнего края деталей. В случае, если какая-либо выступающая точка детали окажется вблизи пустой части корзины, против нее на стенке корзины в точке у возможно повышение напряжения, приводящее к пробою пленки и коррозии титана (рис. 28). При нахождении под током совершенно пустой корзины ее потенциал может подняться до потенциала анодного окисления, что, наоборот, сильно утолщит пленку и корзину придется протравить для восстановления электрического контакта с обрезками металла. Без тока в неработающей ванне корзина может находиться и пустой, и полной. На корзину надевают чехол, как на обычный анод.
Действующая площадь анодной корзины примерно в полтора раза больше площади ее проекционной поверхности. На 1 дм2 площади проекционной поверхности корзины можно подавать ток до 6,5 А.
Конструкция анодной титановой корзины. Сечение корзины, как правило, прямоугольное, толщиной от 50 до 100 мм (в более узких анодные обрезки могут заклиниваться и зависнуть), шириной 100—300 мм. Высота корзины обычно равна высоте анода. Верхний край корзины должен быть выше зеркала электролита на 50—70 мм для возможности ее загружать не вынимая из ванны.
Высота корзины обычно равна высоте анода. Верхний край корзины должен быть выше зеркала электролита на 50—70 мм для возможности ее загружать не вынимая из ванны.
Торцовые стенки делают сплошными, стенки, обращенные к деталям, — из сетки или из горизонтальных прутков с интервалами порядка 20 мм и вертикальных, сдерживающих горизонтальные от выкручивания, с интервалом 70—lOO мм, дно — в виде] сплошного поддона с
бортиками высотой 20—30 мм (рис. 29). На ри¬сунке вертикальные прутки не показаны.
Сварку всех стыков лучше вести аргоно-дуговым способом, но даже при значительном различии в толщине свариваемых деталей, хорошо зачищенных поверхностях и быстрой сварке (менее секунды на точку) титан удается доброкачественно сварить обычной точечной или контактной сваркой — при быстрой сварке кислород и азот воздуха не успевают продиффундировать к месту сварки. Сетку лучше варить заложив ее край между стенкой корзины и накладкой из титановой полоски точечной сваркой с интервалами точек 25— 50 мм.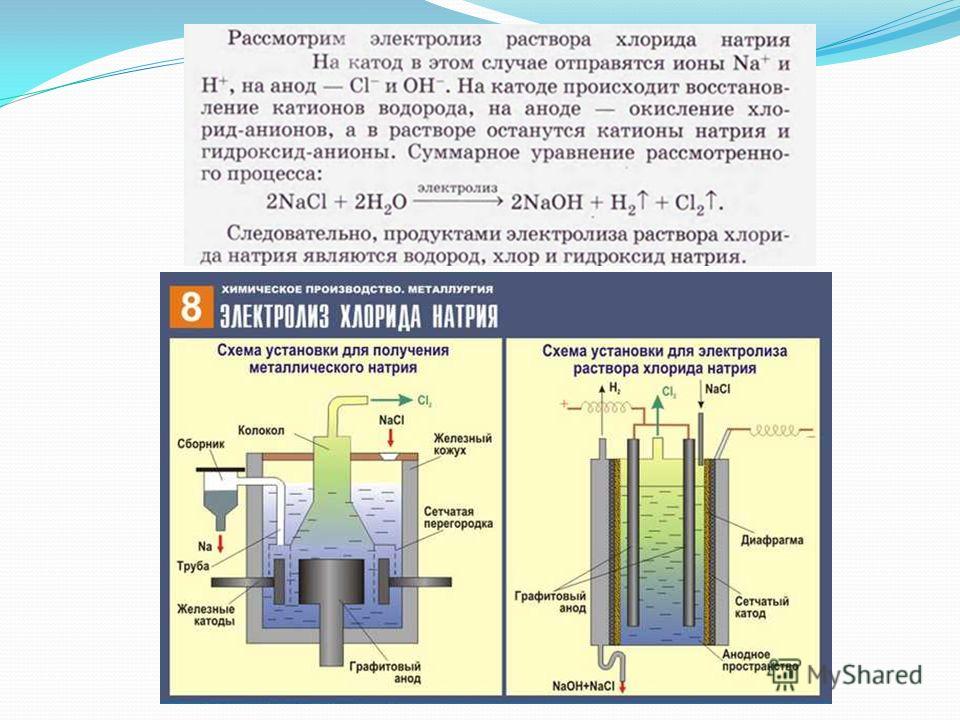 После сварки желательно корзину протравить. Шов, выполненный аргонной сваркой, должен быть светлым, но не серым или белым.
После сварки желательно корзину протравить. Шов, выполненный аргонной сваркой, должен быть светлым, но не серым или белым.
Подвешивание титановой и анодной корзины. Корзину подвешивают на анодную штангу двумя крюками, приваренными к торцовым стенкам.
Крюки выгоднее делать с клепанной медной нли никелевой накладкой для улучшения электрического контакта с арматурной штангой
ребро на лезвие для увеличения давления в кон¬такте стоит только при сравнительно небольших токах, ибо отвод теплоты от лезвия хуже, чем от тупого ребра. Для улучшения контакта при больших токах к контактирующему ребру приклепывают медную или, лучше, никелевую накладку (рис. 31).
Насыпная плотность никелевых шариков около 5,7 кг/дм3, никелевых квадратиков размером 25Х X 25 мм — около 5,0 кг/дм8, а механическая нагрузка, выдерживаемая в пределах упругости титановым крючком сечением 6X6 мм, составляет 100 кг, сечением 12,5X12,5 мм— 250 кг, а при сечении 25×6 мм — 1,8т. Электрический расчет титановой корзины. Электропроводность титана в 28 раз хуже, чем меди, поэтому сечение токонесущих титановых деталей корзины, расположенных выше зеркала электролита, берут из расчета 1 А’мм2, а погруженных в электролит — до 5 А/мм2. При нагрузке 125 А на крюк сечением 25×6 мм и длиной 150 мм с приклепанной медной накладкой при работе над горячей (60—70 °С) никелевой ванной, при перегреве крюка на 25 °С сверх температуры анодной штанги (50—60 С) энергетические потерн на нагрев крюка .составляют 8 Вт; при нагрузке 65 А, размере крюка 12X6X150 мм н прочих вышеприведенных условиях потери равны 4 Вт. Переходное сопротивление заклепки накладки ничтожно, при ее диаметре 6 мм оно менее 3-19″? Ом. При полной нагрузке ванны потерн в крюках составляют менее 1 % от общего расхода электроэнергии.
Электропроводность титана в 28 раз хуже, чем меди, поэтому сечение токонесущих титановых деталей корзины, расположенных выше зеркала электролита, берут из расчета 1 А’мм2, а погруженных в электролит — до 5 А/мм2. При нагрузке 125 А на крюк сечением 25×6 мм и длиной 150 мм с приклепанной медной накладкой при работе над горячей (60—70 °С) никелевой ванной, при перегреве крюка на 25 °С сверх температуры анодной штанги (50—60 С) энергетические потерн на нагрев крюка .составляют 8 Вт; при нагрузке 65 А, размере крюка 12X6X150 мм н прочих вышеприведенных условиях потери равны 4 Вт. Переходное сопротивление заклепки накладки ничтожно, при ее диаметре 6 мм оно менее 3-19″? Ом. При полной нагрузке ванны потерн в крюках составляют менее 1 % от общего расхода электроэнергии.
Термоэмиссионная рентгеновская трубка — определение
- Главная org/ListItem»> База знаний НК
- Азбука контроля
- Термоэмиссионная рентгеновская трубка
Термоэмиссионная рентгеновская трубка является основным элементом рентгенаппарата непрерывного действия, служащая источником рентгеновского излучения. В зависимости от того, для каких целей разработана конструкция, и в каких условиях он работает, создано множество моделей, имеющих единую электрическую схему, но отличающихся по конструктивному исполнению.
В зависимости от того, для каких целей разработана конструкция, и в каких условиях он работает, создано множество моделей, имеющих единую электрическую схему, но отличающихся по конструктивному исполнению.
ТРТ относится к классу электровакуумных приборов и представляет собой диод — двухэлектродную электронную лампу с накальным катодом. Металлические электроды ТРТ, катод и анод, заключены в металлокерамическую или стеклянную колбу, в которой создаётся глубокий вакуум до величины давления 10-6 – 10-7 мм рт. ст. Катод выполняется в форме спирали из вольфрамовой проволоки, а анодом служит массивный медный стержень со скошенным под углом 45 – 70° торцом, обращенным к катоду. На скошенную поверхность анода приваривается вольфрамовая пластинка (мишень), на которой и генерируется рентгеновское излучение. В процессе работы на аноде ТРТ выделяется большое количество тепловой энергии, для отвода которой предусматривается система охлаждения – водяная, масляная или воздушная.
Электропитание анодных цепей ТРТ осуществляется по двух- и однополупериодной схеме.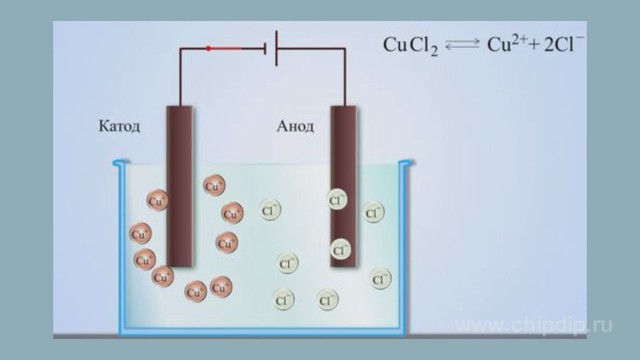 В стационарном или мобильном РА трубка питается от выпрямителя, собранного по мостовой схеме, с последующим умножением напряжения, при этом используются оба полупериода синусоиды тока. В портативных аппаратах применяется однополупериодная схема питания анодной цепи, где кенотроном служит сама́ ТРТ и в работе используется только один «ряд» полупериодов синусоиды (верхний или нижний).
В стационарном или мобильном РА трубка питается от выпрямителя, собранного по мостовой схеме, с последующим умножением напряжения, при этом используются оба полупериода синусоиды тока. В портативных аппаратах применяется однополупериодная схема питания анодной цепи, где кенотроном служит сама́ ТРТ и в работе используется только один «ряд» полупериодов синусоиды (верхний или нижний).
2500°C
— максимальная температура нагрева спирали катода
Принцип работы
Генерация рентгеновских лучей происходит при подаче на электроды трубки накального и анодного напряжения. Ток накала разогревает спираль катода до температуры 2200-2500 °С, в результате чего он благодаря термоэлектронной эмиссии становится источником отрицательно заряженных электронов, которые собираются вокруг катода в электронное облако. При включении анодного напряжения – величиной в десятки и сотни киловольт, — катод окажется под отрицательным потенциалом, и будет отталкивать одноименно заряженные электроны, которые с большой скоростью будут притягиваться к аноду, находящемуся под положительным потенциалом.
Поток электронов, достигнув вольфрамовой мишени, резко на ней тормозится, в результате чего ≈ 1-3% Ек электронов преобразуется в энергию тормозного рентгеновского излучения, а остальная часть идёт на нагревание анода. Рентгеновское излучение представляет собой электромагнитные волны длиной λ = 10-7 – 10-12 м (от 100 до 10-3 нм), которые располагаются между УФ-излучением и γ-излучением.
Схема работы термоэмиссионной рентгеновской трубки.
Особенности
Изменение анодного напряжения на ТРТ вызывает изменение спектра излучения. Так увеличение напряжения увеличивает коротковолновую (жёсткую) составляющую спектра, обладающую бо́льшей проникающей способностью по сравнению с длинноволновой (мягкой) и наоборот.
Изменение напряжения накала приведёт к изменению температуры катода, что вызовет изменение эмиссии электронов и, соответственно, изменение силы тока в ТРТ и плотность потока рентгеновских лучей. Увеличение напряжения увеличит все эти параметры и наоборот.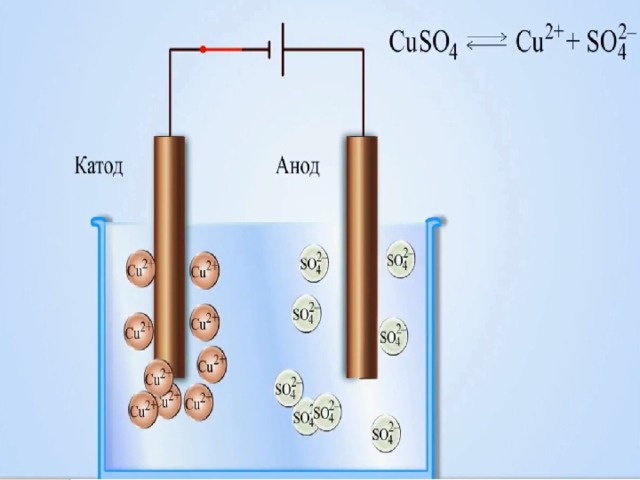 Немаловажным показателем качества ТРТ является размер фокусного пятна мишени – чем оно меньше, тем чётче отпечатки рентгенографий, но меньше мощность излучения.
Немаловажным показателем качества ТРТ является размер фокусного пятна мишени – чем оно меньше, тем чётче отпечатки рентгенографий, но меньше мощность излучения.
При выборе ТРТ следует принимать компромиссное решение, исходя из поставленной задачи и возможностей прибора.
Принцип устройства и работы электро-вакуумных приборов
Анод лампы принимает на себя поток электронов. Происходит электронная бомбардировка анода, от которой он нагревается. Кроме того, анод нагревается от теплового излучения катода. В установившемся режиме количество теплоты, выделяющееся на аноде, равно количеству теплоты, отводимому от анода.
Важно, чтобы анод не нагревался выше предельной температуры. При перегреве из анода могут выделяться газы, и тогда ухудшается вакуум. Возможно даже расплавление анода от чрезмерного перегрева. Кроме того, раскаленный анод испускает тепловые лучи, которые могут вызвать перегрев катода.
У ламп малой мощности и большинства ламп средней мощности анод имеет лучистое охлаждение. Теплота отводится излучением
анода. Для усиления теплового излучения увеличивают площадь поверхности анода (часто снабжают ребрами) и делают ее черной
или матовой. В лампах средней и большой мощности иногда применяется принудительное охлаждение потоком воздуха. Вывод анода
снабжается радиатором, который обдувается вентилятором. У ламп большой мощности применяется также принудительное охлаждение
анода проточной водой.
Теплота отводится излучением
анода. Для усиления теплового излучения увеличивают площадь поверхности анода (часто снабжают ребрами) и делают ее черной
или матовой. В лампах средней и большой мощности иногда применяется принудительное охлаждение потоком воздуха. Вывод анода
снабжается радиатором, который обдувается вентилятором. У ламп большой мощности применяется также принудительное охлаждение
анода проточной водой.
Различные конструкции сеток (цилиндрическая, плоская и др.) показаны на рис. 15.9.
Работа ламп ухудшается, если сетка, нагреваясь от накаленного катода, начинает испускать термоэлектроны. Для устранения этого явления проводники сетки покрывают слоем металла с большой работой выхода, например золота.
Чтобы эффективно управлять электронным потоком, сетку располагают очень близко к катоду.
Вакуум в лампах необходим прежде всего потому, что накаленный катод при наличии воздуха сгорит. Кроме того, молекулы
газов не должны мешать свободному полету электронов.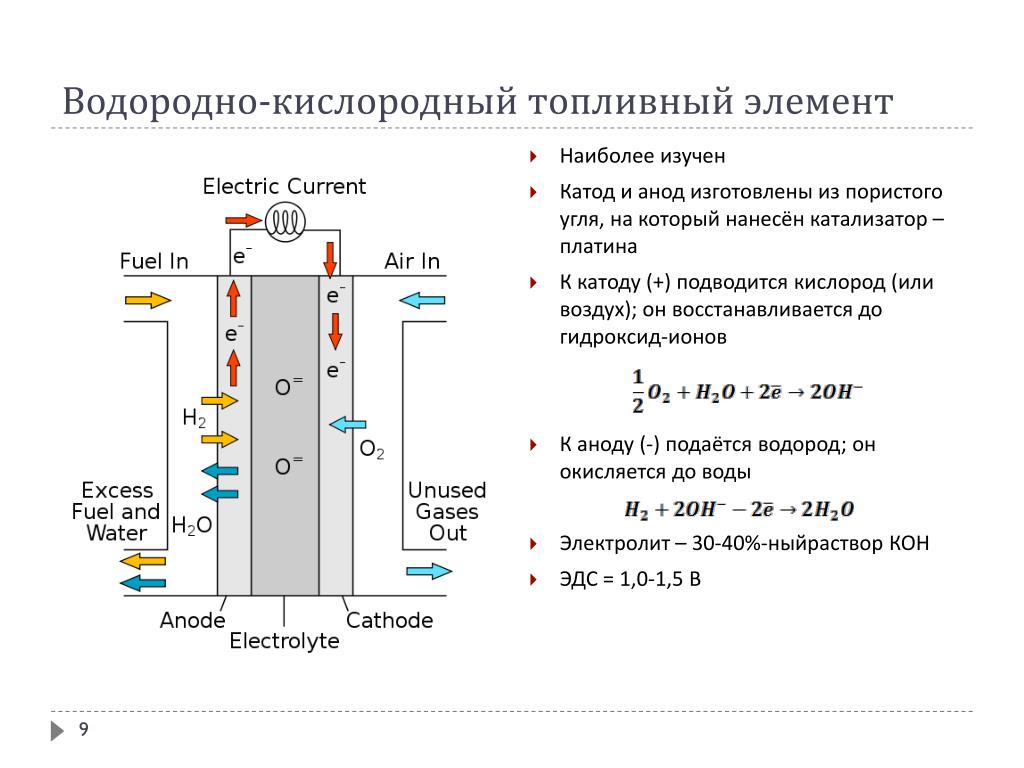 Высокий вакуум в лампах характеризуется давлением менее 100 мкПа. Если
вакуум недостаточный, то летящие электроны ударяют в молекулы газов и превращают их в положительные ионы, которые бомбардируют
и разрушают катод. Ионизация газов увеличивает также инерционность и нестабильность работы лампы и создает дополнительные шумы.
Высокий вакуум в лампах характеризуется давлением менее 100 мкПа. Если
вакуум недостаточный, то летящие электроны ударяют в молекулы газов и превращают их в положительные ионы, которые бомбардируют
и разрушают катод. Ионизация газов увеличивает также инерционность и нестабильность работы лампы и создает дополнительные шумы.
Рис. 15.9. Конструкции сеток в триоде
Предварительную откачку воздуха производят форвакуумными насосами, затем продолжают высоковакуумными насосами. Кроме того, обезгаживают электроды путем нагрева их до красного каления. Лампу помещают в переменное магнитное поле, индуцирующее в электродах вихревые токи, которые разогревают металл.
Для улучшения вакуума в лампу помещают газопоглотитель (геттер), например кусочек магния или бария. При разогреве лампы
указанным выше индукционным способом газопоглотитель испаряется и после охлаждения оседает на стекле баллона, покрывая его
зеркальным слоем (магний) или коричневато-черным (барий).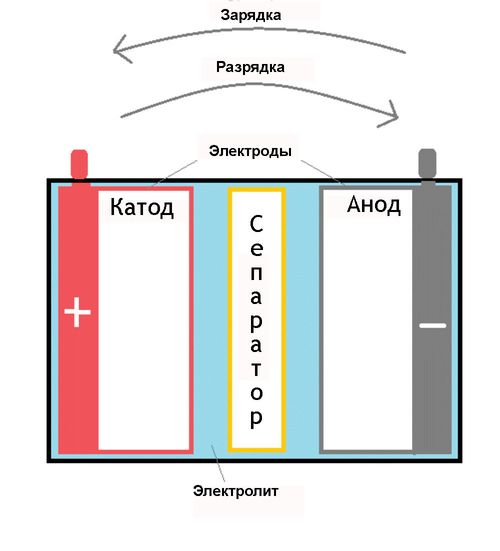 Этот слой поглощает газы, которые могут выделиться из электродов
в процессе работы лампы.
Этот слой поглощает газы, которые могут выделиться из электродов
в процессе работы лампы.
Размеры баллона лампы зависят от ее мощности. Чтобы температура баллона не стала недопустимо высокой, увеличивают площадь его поверхности. Наиболее часто применяют стеклянные баллоны, но у керамических значительно выше термостойкость и механическая прочность.
Металлические (стальные) баллоны имеют большую прочность и обеспечивают хорошее экранирование лампы от внешних электрических и магнитных полей. Но они сильно нагреваются, и это приводит к перегреву электродов.
В последние годы выпуск ламп с металлическими баллонами прекращен.
В лампах старого типа электроды укреплены на стеклянной ножке в виде трубки, сплющенной на одном конце (рис. 15.10, а). В эту ножку впаяны проволочки из металла, имеющего одинаковый со стеклом температурный коэффициент расширения. Концы выводных проволочек приварены к проводникам, идущим к контактным штырькам цоколя.
Держатели электродов крепятся в слюдяных или керамических пластинах-изоляторах, благодаря чему фиксируется расстояние
между электродами (рис.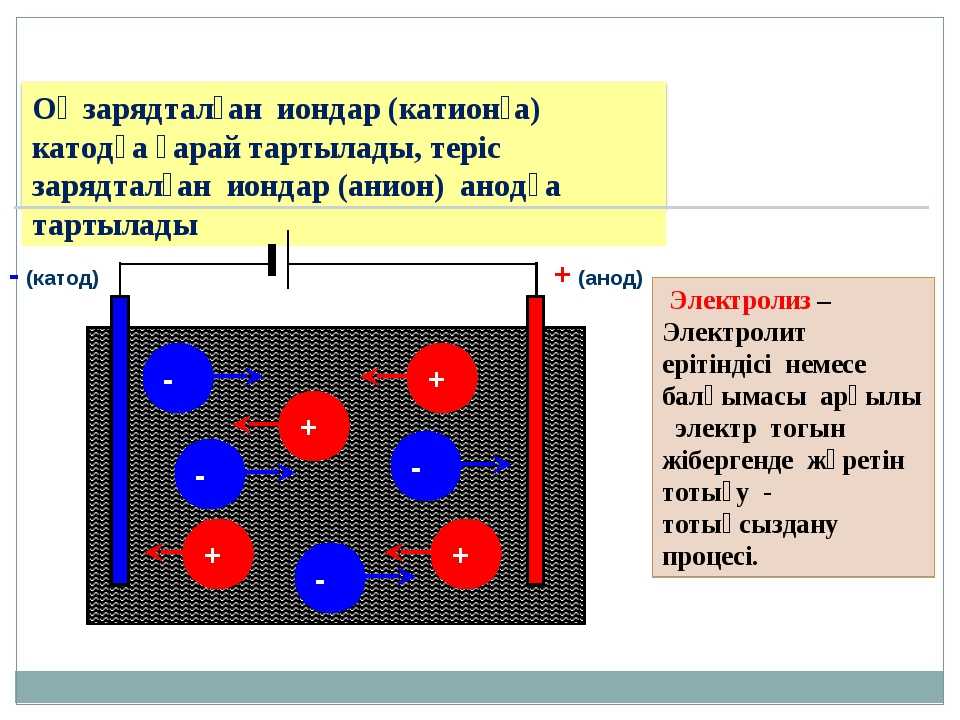 15.10, б).
15.10, б).
У ламп пальчиковой серии и ряда других электроды монтируются на плоской ножке, представляющей собой утолщенное стеклянное основание баллона. В ножку впаяны проводники (рис. 15.10, в), которые снаружи выполняют роль контактных штырьков, а внутри лампы являются держателями электродов. Катод прямого накала обычно натягивается с помощью пружинки (рис. 15.10, г), чтобы он не провисал при удлинении от нагрева.
В лампах имеются еще некоторые вспомогательные детали. К ним относятся держатели для геттера, электростатические экраны, устраняющие емкостные токи между отдельными часгями лампы или защищающие лампу от воздействия внешних электрических полей.
Рис. 15.10. Крепление электродов и их выводов в стеклянных лампах
Особое внимание уделяется точности сборки и прочности крепления электродов. Но все же существует разброс электрических
свойств между отдельными экземплярами ламп данного типа. Он объясняется неоднородностью деталей, их случайными деформациями
при сборке, неточностью сборки, неодинаковостью эмиссии катодов у различных экземпляров ламп и другими причинами.
Система выводов от электродов, служащая для подключения лампы к схеме, называется цоколевкой лампы. Стеклянные лампы с цоколем имеют восемь штырьков, расположенных в вершинах правильного восьмиугольника (рис. 15.11, а). В центре цоколя находится ключ, т. е. более длинный штырек с выступом, обеспечивающий правильную установку лампы. Штырьки принято нумеровать по часовой стрелке от выступа на ключе. Электростатический экран, имеющийся внутри некоторых ламп, соединен с одним из штырьков. У различных ламп электроды соединяются с разными штырьками. Схемы цоколевки приводятся в справочниках.
При анодных напряжениях в сотни вольт все электроды имеют выводы на цоколь. А у ламп на напряжения в тысячи вольт вывод анода часто находится наверху баллона.
Рис. 15.11. Цоколевка ламп
Выводы электродов у пальчиковых ламп сделаны в виде семи, или девяти, или десяти заостренных проводников, впаянных в
плоскую ножку и расположенных соответственно в вершинах правильного многоугольника (рис. 15.11,6). Сверхминиатюрные бесцокольные
лампы имеют выводы от электродов в виде проволочек. У мощных ламп выводы от электродов часто делают в разных местах баллона
и на удалении друг от друга, так как напряжения между этими выводами могут быть значительными.
15.11,6). Сверхминиатюрные бесцокольные
лампы имеют выводы от электродов в виде проволочек. У мощных ламп выводы от электродов часто делают в разных местах баллона
и на удалении друг от друга, так как напряжения между этими выводами могут быть значительными.
| >>>>> | 0 !………………. | 20 !………………. | 40 !………………. | 60 !………………. | 80 !………………. | 100 !………………. | 120 !………………. |
Voltaic Cells — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 285
В окислительно-восстановительных реакциях электроны передаются от одного вида к другому. Если реакция идет самопроизвольно, высвобождается энергия, которую затем можно использовать для совершения полезной работы. Чтобы использовать эту энергию, реакцию необходимо разделить на две отдельные полуреакции: реакции окисления и реакции восстановления. Реакции помещаются в два разных контейнера, и для перемещения электронов с одной стороны на другую используется провод. При этом 9-_{3\;(aq)}\) ионы. Ионы NO 3 — (aq) можно не учитывать, так как они являются ионами-спектаторами и не участвуют в реакции. В этой реакции медный электрод помещают в раствор, содержащий ионы серебра. Ag + (водн.) легко окисляет Cu (тв.) , в результате чего получается Cu 2 + (водн.), , при этом восстанавливаясь до Ag (тв.) .
Если реакция идет самопроизвольно, высвобождается энергия, которую затем можно использовать для совершения полезной работы. Чтобы использовать эту энергию, реакцию необходимо разделить на две отдельные полуреакции: реакции окисления и реакции восстановления. Реакции помещаются в два разных контейнера, и для перемещения электронов с одной стороны на другую используется провод. При этом 9-_{3\;(aq)}\) ионы. Ионы NO 3 — (aq) можно не учитывать, так как они являются ионами-спектаторами и не участвуют в реакции. В этой реакции медный электрод помещают в раствор, содержащий ионы серебра. Ag + (водн.) легко окисляет Cu (тв.) , в результате чего получается Cu 2 + (водн.), , при этом восстанавливаясь до Ag (тв.) .
Эта реакция высвобождает энергию. Однако, когда твердый медный электрод помещается непосредственно в раствор нитрата серебра, энергия теряется в виде тепла и не может быть использована для выполнения работы. Чтобы использовать эту энергию и использовать ее для полезной работы, мы должны разделить реакцию на две отдельные полуреакции; Реакции окисления и восстановления. Провод соединяет две реакции и позволяет электронам течь с одной стороны на другую. При этом мы создали Гальванический/гальванический элемент .
Чтобы использовать эту энергию и использовать ее для полезной работы, мы должны разделить реакцию на две отдельные полуреакции; Реакции окисления и восстановления. Провод соединяет две реакции и позволяет электронам течь с одной стороны на другую. При этом мы создали Гальванический/гальванический элемент .
Рисунок \(\PageIndex{1}\): Гальваническая ячейка
Гальваническая ячейка (также известная как гальваническая ячейка) — это электрохимическая ячейка, которая использует спонтанные окислительно-восстановительные реакции для выработки электроэнергии. Он состоит из двух отдельных полуячеек . Полуячейка состоит из электрода (полоска металла М) в растворе, содержащем ионы М n+ , где М — любой произвольный металл. Две полуэлемента соединены между собой проводом, идущим от одного электрода к другому. Солевой мост также соединяется с полуклетками. Функции этих частей обсуждаются ниже.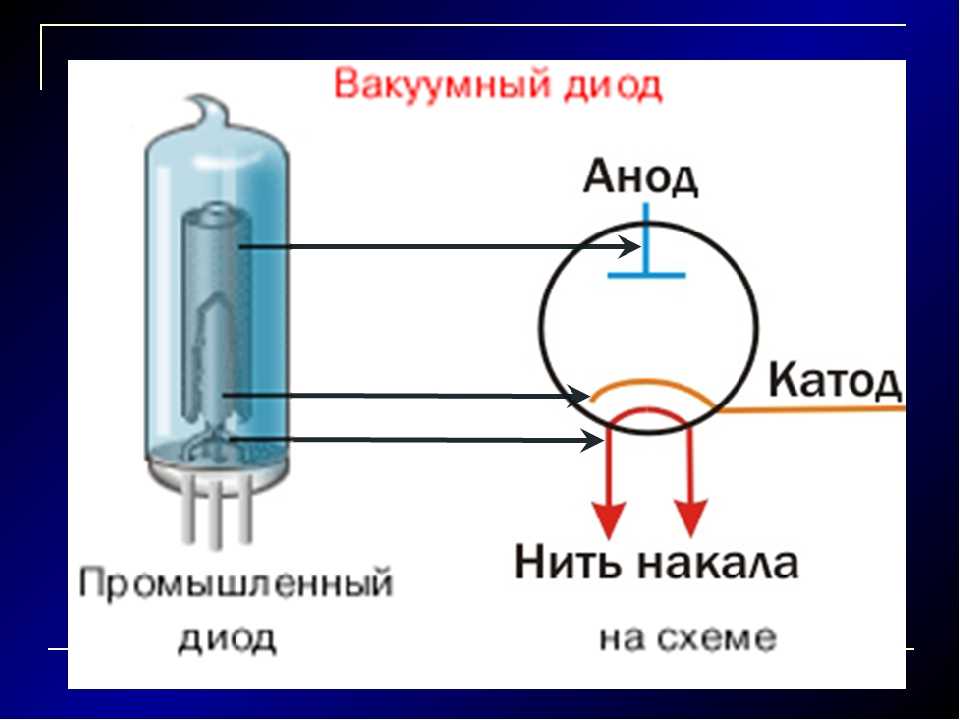
Полуячейки
Половина окислительно-восстановительной реакции происходит в каждой половине ячейки. Поэтому можно сказать, что в каждой полуклетке происходит полуреакция. Когда две половины соединяются проволокой и соляным мостом, создается электрохимическая ячейка.
Электроды
Электрод представляет собой полоску металла, на которой происходит реакция. В гальваническом элементе окисление и восстановление металлов происходит на электродах. В гальваническом элементе два электрода, по одному в каждой полуэлементе. 9Катод 0024 — это место, где происходит восстановление, а окисление происходит на аноде .
С помощью электрохимии эти реакции реагируют на металлических поверхностях или электродах. Между металлом и веществами в растворе устанавливается окислительно-восстановительное равновесие. Когда электроды погружены в раствор, содержащий ионы того же металла, это называется полуэлементом .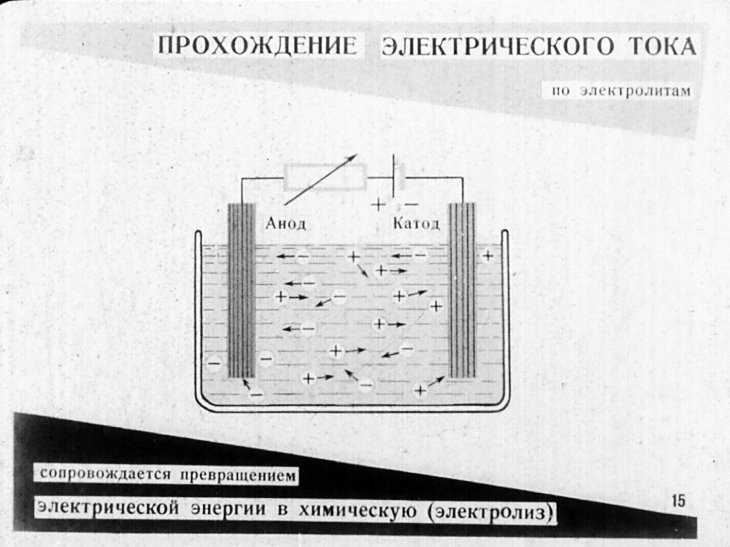 Электролиты представляют собой ионы в растворе, обычно жидком, проводящем электричество за счет ионной проводимости. Между атомами металла на электроде и ионными растворами могут происходить два возможных взаимодействия.
Электролиты представляют собой ионы в растворе, обычно жидком, проводящем электричество за счет ионной проводимости. Между атомами металла на электроде и ионными растворами могут происходить два возможных взаимодействия.
- Ион металла M n + из раствора может столкнуться с электродом, получив от него «n» электронов, и превратиться в атомы металла. Это означает, что ионы восстановлены.
- Атом металла на поверхности может отдать «n» электронов электроду и войти в раствор в виде иона M n + , что означает окисление атомов металла.
Когда электрод окисляется в растворе, он называется анодом и когда электрод восстанавливается в растворе. это называется 9катод 0024.
- Анод : На аноде протекает реакция окисления. Другими словами, именно здесь металл теряет электроны. В приведенной выше реакции анодом является Cu (s), поскольку его степень окисления увеличивается от 0 до +2.
 +_{(aq)}\) получает электрон, что означает его уменьшение. \(Cu_{(s)}\) теряет два электрона, таким образом, он окисляется.
+_{(aq)}\) получает электрон, что означает его уменьшение. \(Cu_{(s)}\) теряет два электрона, таким образом, он окисляется.Соляной мост является жизненно важным компонентом любого гальванического элемента. Это трубка, заполненная раствором электролита, таким как KNO 3(s) или KCl (s) . Цель солевого мостика состоит в том, чтобы сохранять растворы электрически нейтральными и обеспечивать свободный поток ионов из одной клетки в другую. Без солевого мостика вокруг электродов будут накапливаться положительные и отрицательные заряды, что приведет к остановке реакции.
Назначение солевого мостика состоит в том, чтобы сохранять растворы электрически нейтральными и обеспечивать свободный поток ионов из одной клетки в другую.
Поток электронов
Электроны всегда текут от анода к катоду или от полуэлемента окисления к полуэлементу восстановления. С точки зрения ячейки полуреакции E o электроны будут течь от более отрицательной полуреакции к более положительной полуреакции.
 Диаграмма ячейки представляет собой представление электрохимической ячейки. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\) выше.
Диаграмма ячейки представляет собой представление электрохимической ячейки. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\) выше.Рисунок \(\PageIndex{2}\): Диаграмма ячеек. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\).
При рисовании клеточной диаграммы мы придерживаемся следующих соглашений. Анод всегда размещается с левой стороны , а катод размещается с правой стороны . Соляной мост представлен двойными вертикальными линиями (||). Разница в фазе элемента представлена одной вертикальной линией (|), а изменения в степенях окисления представлены запятыми (,). 9o_{ячейка}\) для гальванического элемента, образованного каждой реакцией.
- Брейди, Джеймс Э., Холум, Джон Р. «Химия: изучение материи и ее изменений», John Wiley & Sons Inc., 1993
- Brown, Theodore L., LeMay, H. Eugene Jr. «Химия: центральная наука», третье издание, Prentice-Hall, Inc. Englewood Cliffs, NJ 07632 1985
- Браун, Теодор Л., ЛеМэй, Х. Юджин мл., Берстен, Брюс Э.
 «Химия: центральная наука», пятое издание, Prentice-Hall, Inc. Englewood Cliffs, N.J. 07632 1991
«Химия: центральная наука», пятое издание, Prentice-Hall, Inc. Englewood Cliffs, N.J. 07632 1991 - Гессер, Хайман Д. «Описательные принципы химии», C.V. Компания Мосби 1974
- Harwood, William, Herring, Geoffrey, Madura, Jeffry, and Petrucci, Ralph, General Chemistry: Principles and Modern Applications, Ninth Edition, Upper Saddle River, New Jersey, Pearson Prentice Hall, 2007.
- Петруччи, Ральф Х. Общая химия: принципы и современные приложения, 9-е изд. Нью-Джерси: Pearson Education Inc., 2007. .
- Вассос Бэзил Х. Электроаналитическая химия. Нью-Йорк: Публикация Wiley-Interscience. 1983.
- Зумдал, Стивен С. Химия, 7-е изд. Нью-Йорк: Компания Houghton Mifflin. 2007.
- Шамшер Сингх, Дебора Го
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
- Батареи Вольта
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 270
- Обратите внимание, что место окисления по-прежнему является анодом, а место восстановления — катодом, но заряды на этих двух электродах меняются местами. Анод теперь заряжен положительным зарядом , а катод заряжен отрицательным зарядом .
- Условия, в которых работает электролитическая ячейка, очень важны. Вещество, которое является самым сильным восстановителем (вещество с самым высоким значением стандартного клеточного потенциала в таблице), будет подвергаться окислению. Вещество, являющееся сильнейшим окислителем, будет восстановлено. Если бы в приведенной выше системе использовался водный раствор хлорида натрия, вместо натрия восстанавливался бы водород, так как он является более сильным окислителем, чем натрий.
- Может происходить более одной электродной реакции, что означает, что может иметь место более одной полуреакции, оставляя две или более возможностей для клеточной реакции.
- Реагенты могут находиться в нестандартных условиях, что означает, что напряжение для полуячеек может быть меньше или больше, чем стандартное состояние. Например:
- Концентрация хлорид-иона = 5,5M, а не единица активности 1M. Это означает, что восстановление хлорида = 1,31 В, а не 1,36 В
- Стандартным условием является наличие pH 4 в анодной полуэлементе, но иногда в нестандартных состояниях pH может быть выше или ниже при изменении напряжения.
- Способность инертного электрода к электролизу зависит от реагентов в растворе электролита, в то время как активный электрод может работать сам по себе для проведения полуреакции окисления или восстановления.

- Преобразование любого заданного времени в секунды
- Возьмите заданный ток ( A ) за секунды, [1 c = (A)/(s)]
- Наконец, используйте стехиометрическую конверсию 1 моль электрона = 9-\].
 Какая масса брома может быть осаждена за 3,00 часа током силой 1,18 А?
Какая масса брома может быть осаждена за 3,00 часа током силой 1,18 А?Solution :
3.00 hours x 60 min/hour x 60 sec/1 min x 1.18 C(A) / 1 sec x 1 mol e — /96,485 C
= 0,132 моль e —
Задачи
1) Предсказать продукты электролиза, заполнив график:
— Cl 0043, BR — , I — , H + , OH — , CU 2+ , PB 2+ , AG +, K + , NA + ,
9 23 , NA + ,
93 4 2 , NA + ,
93 3 , NA + ,
3 , NA + ,
3 , NA + ,
3 . 2 Cr 2 O 7 по половинному уравнению ( водный раствор ) + 12H + ( водный раствор ) + 12 e — → 2CR ( S ) + 7 H 2 O ( L )
3) Перекись водорода, H 2 O 2 , может быть изготовлен электролизом COLD -концентрацией.
 кислота. Реакция в аноде составляет
кислота. Реакция в аноде составляет2H 2 SO 4 → H 2 S 2 O 8 + 2H + + 2 E —
3 E —
333333 годы. Н 2 С 2 O 8 , варят при пониженном давлении, он разлагается:
2H 2 O + H 2 S 2 O 8 → 2H 2 SO 4 + H 2 3130 2 SO 4 + H 2 30 2 SO 4 . 2
Рассчитайте массу перекиси водорода, образовавшейся при протекании тока 0,893 в течение 1 часа.
4) Электролиз образца растворенного хлорида можно использовать для определения содержания хлорида в образце. На катоде идет полуреакция восстановления Cl 2 + (водн.) + 2 e — -> 2 Кл — . Какая масса хлорида может быть осаждена за 6,25 ч током силой 1,11 А?
5) В электролитической ячейке электрод, на котором электроны входят в раствор, называется ______ ; химическое изменение, происходящее на этом электроде, называется _______.

- анод, оксидирование
- анод, редуктор
- катод, оксидирование
- катод, редукция
- не может сказать, если мы не знаем, какие виды окисляются и восстанавливаются.
6) Как долго (в часах) должен поддерживаться ток силой 5,0 ампер для гальванического осаждения 60 г кальция из расплавленного CaCl 2 ?
- 27 часов
- 8,3 часа
- 11 часов
- 16 часов
- 5,9 часа
- 7) Сколько времени в часах потребуется для гальванического покрытия 78 г платины из раствора [PtCl 6 ] 2 — , используя средний ток 10 ампер при эффективности электрода 80%?
- 8,4
- 5,4
- 16,8
- 11,2
- 12,4
8) Сколько фарадеев требуется для превращения 1,00 г алюминия(III) в металлический алюминий?
- 1,00
- 1,50
- 3,00
- 0,111
- 0,250
9) Найдите стандартный потенциал гальванического элемента при следующей реакции элемента.

Zn(s) + Cu 2+ (водн.) → Zn 2+ (водн.) + Cu(s)
Ответы
1) . Cl — chlorine H + hydrogen
Cl — chlorine Cu 2+ copper
I — iodine H + Hhydrogen
2) 12 mol e – is требуется для нанесения 2 моль Cr, что дает нам стехиометрическое соотношение S ( e – /Cr). Затем по константе Фарадея можно найти количество заряда.
N CR N E — Q
Q = 1,386 моль CR × × = 8,024 × 5 C
3 3 . нам количество электроэнергии, Q . Зная это, мы легко вычисляем количество электронов, n e –. Тогда из первого полууравнения мы можем найти количество пероксидисерной кислоты, а второе приводит к n h3O2 и, наконец, до m h3O2 .

= 05666 × g H 2 O 2 = 0.5666 g H 2 O 2
4) 0.259 mol e —
5) d
6) d
7) b
8) d
9) Напишите полуреакции для каждого процесса.
Zn(s) → Zn 2+ (водн.) + 2 e —
Cu 2+ (водн.) + 2 e — → Cu(s)
Найдите стандартные потенциалы полуреакции восстановления.
E o восстановление Cu2+ = + 0,339 В
E o восстановление Zn2+ = — 0,762 В
Определите общий потенциал стандартной ячейки.
E o ячейка = + 1,101 В
Ссылки
- Petrucci, et al. Общая химия: принципы и современные приложения.
 9изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007. .
9изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007. . - Кольбе, Герман. Электролиз органических соединений. Эдинбург: Э. и С. Ливингстон, 1947. .
- Стюарт, А.Т. «Электролиз воды». Производство водорода 2001 13 мая
- А также все упомянутые «внешние ссылки».
Авторы и ссылки
- Жасмин Брионес, Калифорнийский университет в Дэвисе, 2012 г.
Electrolytic Cells распространяется по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- нет на странице
- Теги
- электрохимическая ячейка
- гальванический элемент
- Батареи Вольта
BU-104b: Блоки для сборки батарей — Университет батарей
Электрохимическая батарея состоит из катода, анода и электролита, которые действуют как катализатор.
 При зарядке на границе катод/электролит образуется скопление положительных ионов. Это приводит к тому, что электроны движутся к катоду, создавая потенциал напряжения между катодом и анодом. Высвобождение происходит за счет прохождения тока от положительного катода через внешнюю нагрузку и обратно к отрицательному аноду. При зарядке ток течет в другом направлении.
При зарядке на границе катод/электролит образуется скопление положительных ионов. Это приводит к тому, что электроны движутся к катоду, создавая потенциал напряжения между катодом и анодом. Высвобождение происходит за счет прохождения тока от положительного катода через внешнюю нагрузку и обратно к отрицательному аноду. При зарядке ток течет в другом направлении. Батарея имеет два отдельных канала; один представляет собой электрическую цепь, по которой текут электроны, питая нагрузку, а другой представляет собой путь, по которому ионы движутся между электродами через сепаратор, действующий как изолятор для электронов. Ионы — это атомы, которые потеряли или приобрели электроны и стали электрически заряженными. Сепаратор электрически изолирует электроды, но позволяет ионам двигаться.
Анод и катодЭлектрод батареи, который высвобождает электроны во время разряда, называется анод ; электродом, поглощающим электроны, является катод .

Анод аккумулятора всегда отрицательный, а катод положительный. Это, по-видимому, нарушает соглашение, поскольку анод является клеммой, через которую протекает ток. Электронная лампа, диод или заряжаемая батарея следуют этому порядку; однако при отключении питания от батареи при разрядке анод становится отрицательным. Поскольку батарея представляет собой электрическое накопительное устройство, обеспечивающее энергию, анод батареи всегда отрицательный.
Анод литий-ионных аккумуляторов выполнен из углерода (см. BU-204: Как работают литиевые аккумуляторы?), но с литий-металлическими аккумуляторами порядок обратный. Здесь катод — углерод, а анод — металлический литий. (См. BU-212: Аккумуляторы будущего.) За некоторыми исключениями, литий-металлические аккумуляторы не подлежат перезарядке.
Рисунок 1: Символ батареи.
Катод батареи положительный, а анод отрицательный.Таблицы 2a, b, c и d суммируют состав вторичных батарей на основе свинца, никеля и лития, включая первичные щелочные батареи.

Таблица 2а: Состав свинцовой кислоты.Свинцово-кислотный Катод (положительный) Анод (отрицательный) Электролит Материал Диоксид свинца (шоколадно-коричневый) Серый свинец (губчатый при формировании) Серная кислота Полная зарядка Оксид свинца (PbO 2 ), электроны
добавлены к положительной пластинеСвинец (Pb), электроны удалены с пластины Сильная серная кислота Выписан Свинец превращается в сульфат свинца на отрицательном электроде, электроны перемещаются от положительной пластины к отрицательной.
Слабая серная кислота (водоподобная) 
Table 2b: Composition of NiMH and NiCd.NiMH, NiCd
Катод (положительный) Анод (отрицательный) Электролит Material Nickel Oxyhydroxide NiMH: hydrogen-absorbing alloy
NiCd: CadmiumPotassium Hydroxide
Таблица 2c: Состав Li-ion.Литий-ион Катод (положительный)
на алюминиевой фольгеАнод (отрицательный)
на медной фольгеЭлектролит 0515 Оксиды металлов, полученные из кобальта, никеля, марганца, железа, алюминия На основе углерода Соль лития в органическом растворителе Полный заряд Разряженный Ионы лития возвращаются к положительному электроду В основном углерод 
Table 2d: Composition первичной щелочной батареи. Электролит и сепараторAlkaline Cathode (positive) Anode (negative) Electrolyte Material Manganese dioxide Zinc Aqueous alkaline Ионный поток становится возможным благодаря активатору, называемому электролитом. В залитой аккумуляторной системе электролит свободно перемещается между вставленными электродами; в герметичной ячейке электролит обычно добавляют в сепаратор в увлажненном виде. Сепаратор отделяет анод от катода, образуя изолятор для электронов, но пропуская ионы. (См. BU-306: Сепаратор и BU-307: Электролит)
Аккумуляторы в портативном мире
Материал по Battery University основан на незаменимом новом 4-м издании « Аккумуляторы в портативном мире — Справочник по перезаряжаемым батареям для не инженеров », которое можно заказать на Amazon.
 .ком.
.ком.Явления замыкания и разрыва анода/катода в модели дефибрилляции
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попыткуДобавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попыткуВаш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл.
 адрес:
(изменить)
адрес:
(изменить)Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум: 1 штука5 штук10 штук20 штук50 штук100 штук200 штук
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
. 1999 июль; 46 (7): 769-77.
дои: 10.1109/10.771186.

К Б Скоуйбин 1 , Траянова Н.А., Мур П.К.
Принадлежности
принадлежность
- 1 Математический факультет Тулейнского университета, Новый Орлеан, LA 70118, США.
- PMID: 10396895
- DOI: 10.1109/10.771186
KB Skouibine et al. IEEE Trans Biomed Eng. 1999 июля
. 1999 июль; 46 (7): 769-77.
дои: 10.1109/10.771186.
Авторы
К Б Скоуйбин 1 , Траянова Н.
 А., Мур П.К.
А., Мур П.К.принадлежность
- 1 Математический факультет Тулейнского университета, Новый Орлеан, LA 70118, США.
- PMID: 10396895
- DOI: 10.1109/10.771186
Абстрактный
Цель этого исследования моделирования состоит в том, чтобы изучить в листе миокарда вклад явлений разрыва анода и катода в прекращение повторного входа спиральной волны ударом дефибрилляции. Ткань представлена в виде однородного бидомена с неодинаковыми коэффициентами анизотропии. В этой статье представлены два тематических исследования: ткань, которая может электропорировать при высоких уровнях трансмембранного потенциала, и модельная ткань, которая не поддерживает электропорацию.
 В обоих случаях спиральная волна инициируется посредством поперечной стимуляции слоя бидомена. Внеклеточный дефибрилляционный разряд подается через два небольших электрода, расположенных на противоположных границах тканей. Модификации кинетики активной мембраны позволяют проводить дефибрилляционные разряды высокой силы. Численные решения получены с использованием эффективной полунеявной схемы предиктор-корректор, которая позволяет выполнять моделирование в разумные сроки. Результаты моделирования показывают, что возбуждения при разрыве анода и/или катода вносят значительный вклад в активность во время и после удара. Для успешного дефибрилляционного разряда виртуальные электроды и прерывающие возбуждения ограничивают спиральную волну и делают ткань невосприимчивой, поэтому она не может в дальнейшем поддерживать повторный вход. Результаты также показывают, что электропорация изменяет явление разрыва анода/катода, причем основное влияние оказывается на время возбуждения разрыва катода. Таким образом, электропорация приводит к различному характеру распределения трансмембранного потенциала после удара.
В обоих случаях спиральная волна инициируется посредством поперечной стимуляции слоя бидомена. Внеклеточный дефибрилляционный разряд подается через два небольших электрода, расположенных на противоположных границах тканей. Модификации кинетики активной мембраны позволяют проводить дефибрилляционные разряды высокой силы. Численные решения получены с использованием эффективной полунеявной схемы предиктор-корректор, которая позволяет выполнять моделирование в разумные сроки. Результаты моделирования показывают, что возбуждения при разрыве анода и/или катода вносят значительный вклад в активность во время и после удара. Для успешного дефибрилляционного разряда виртуальные электроды и прерывающие возбуждения ограничивают спиральную волну и делают ткань невосприимчивой, поэтому она не может в дальнейшем поддерживать повторный вход. Результаты также показывают, что электропорация изменяет явление разрыва анода/катода, причем основное влияние оказывается на время возбуждения разрыва катода. Таким образом, электропорация приводит к различному характеру распределения трансмембранного потенциала после удара. Эта разница в паттернах может привести или не привести к изменению исхода шока.
Эта разница в паттернах может привести или не привести к изменению исхода шока.Похожие статьи
Моделирование дефибрилляции: эффекты искривления волокон.
Траянова Н, Скуйбине К. Траянова Н. и соавт. J Электрокардиол. 1998;31 Приложение:23-9. doi: 10.1016/s0022-0736(98)
-6. J Электрокардиол. 1998. PMID: 9988001Эффекты виртуального электрода при дефибрилляции.
Траянова Н., Скуйбин К., Мур П. Траянова Н. и соавт. Прог Биофиз Мол Биол. 1998;69(2-3):387-403. doi: 10.1016/s0079-6107(98)00016-9. Прог Биофиз Мол Биол. 1998. PMID: 9785947
Электропорация в модели дефибрилляции сердца.

Ашихара Т., Яо Т., Намба Т., Ито М., Икеда Т., Кавасэ А., Тода С., Сузуки Т., Инагаки М., Сугимати М., Киносита М., Наказава К. Ашихара Т. и др. J Cardiovasc Electrophysiol. 2001 Декабрь; 12 (12): 1393-403. doi: 10.1046/j.1540-8167.2001.01393.x. J Cardiovasc Electrophysiol. 2001. PMID: 11797997
Механизмы электростимуляции возбудимой ткани.
Рот Б.Дж. Рот Б.Дж. Crit Rev Biomed Eng. 1994;22(3-4):253-305. Crit Rev Biomed Eng. 1994. PMID: 8598130 Обзор.
Механизмы дефибрилляции.
Dosdall DJ, Fast VG, Ideker RE. Досдалл Д.Дж. и др. Анну Рев Биомед Инж. 2010 15 августа; 12: 233-58. doi: 10.1146/annurev-bioeng-070909-105305. Анну Рев Биомед Инж. 2010. PMID: 20450352 Бесплатная статья ЧВК.
 Обзор.
Обзор.
Посмотреть все похожие статьи
Цитируется
Конститутивно активный ацетилхолин-зависимый ток калия повышает порог предсердной дефибрилляции, способствуя повторному инициированию после разряда.
Бинген Б.О., Аскар С.Ф., Нешати З., Феола И., Панфилов А.В., де Врис А.А., Пейнаппелс Д.А. Бинген Б.О. и соавт. Научный представитель 2015 г., 21 октября; 5:15187. дои: 10.1038/srep15187. Научный представитель 2015. PMID: 26487066 Бесплатная статья ЧВК.
Эффективный метод конечных элементов для моделирования фиброзных щелей в сердце.
Коста К.М., Кампос Ф.О., Прассл А.Дж., Дос Сантос Р.В., Санчес-Кинтана Д., Ахаммер Х., Хофер Э., Планк Г. Коста С.
 М. и др.
IEEE Trans Biomed Eng. 2014 март;61(3):900-10. doi: 10.1109/TBME.2013.22.
IEEE Trans Biomed Eng. 2014.
PMID: 24557691
Бесплатная статья ЧВК.
М. и др.
IEEE Trans Biomed Eng. 2014 март;61(3):900-10. doi: 10.1109/TBME.2013.22.
IEEE Trans Biomed Eng. 2014.
PMID: 24557691
Бесплатная статья ЧВК.Интуитивно понятный фактор безопасности для сердечного распространения.
Бойл П.М., Вигмонд Э.Дж. Бойл П.М. и соавт. Biophys J. 16 июня 2010 г .; 98 (12): L57-9. doi: 10.1016/j.bpj.2010.03.018. Биофиз Дж. 2010. PMID: 20550885 Бесплатная статья ЧВК.
Решение связанной системы повышает вычислительную эффективность уравнений бидоменов.
Южный JA, Plank G, Vigmond EJ, Whiteley JP. Южный JA и др. IEEE Trans Biomed Eng. 2009 г., октябрь; 56 (10): 2404-12. doi: 10.1109/TBME.2009.2022548. Epub 2009 19 мая. IEEE Trans Biomed Eng. 2009. PMID: 19457741 Бесплатная статья ЧВК.

Создание гистоанатомически репрезентативных моделей индивидуального сердца: инструменты и применение.
Планк Г., Бертон Р.А., Хейлз П., Бишоп М., Мансури Т., Бернабеу М.О., Гарни А., Прассл А.Дж., Болленсдорф К., Мейсон Ф., Махмуд Ф., Родригес Б., Грау В., Шнайдер Д.Е., Гаваган Д., Коль П. Планк Г. и др. Philos Trans A Math Phys Eng Sci. 2009 13 июня; 367 (1896): 2257-92. doi: 10.1098/rsta.2009.0056. Philos Trans A Math Phys Eng Sci. 2009. PMID: 19414455 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
Полнотекстовые ссылки
IEEE Engineering in Medicine and Biology Society
Укажите
Формат: ААД АПА МДА НЛМ
Отправить по номеру
Разница между анодом и катодом
Основное отличие — анод и катод
Термины катод и анод используются для обозначения клемм поляризованного электрического устройства.
 Основное различие между анодом и катодом заключается в том, что, как правило, анод — это клемма, через которую (обычный) ток течет в устройство извне , тогда как катод — это клемма, где (обычный) ток выходит из устройства. . Однако в некоторых случаях использование строго не соблюдается, потому что, когда устройство может подвергаться обратимому процессу, тот же вывод, который назывался «анод», теперь может называться «катодом». Несомненно, это может привести к путанице, и рекомендуется адаптироваться к общему использованию в конкретной области. В этой статье мы рассмотрим несколько сценариев, в которых используются эти термины, и исследуем их использование с точки зрения процессов, происходящих в этих устройствах.
Основное различие между анодом и катодом заключается в том, что, как правило, анод — это клемма, через которую (обычный) ток течет в устройство извне , тогда как катод — это клемма, где (обычный) ток выходит из устройства. . Однако в некоторых случаях использование строго не соблюдается, потому что, когда устройство может подвергаться обратимому процессу, тот же вывод, который назывался «анод», теперь может называться «катодом». Несомненно, это может привести к путанице, и рекомендуется адаптироваться к общему использованию в конкретной области. В этой статье мы рассмотрим несколько сценариев, в которых используются эти термины, и исследуем их использование с точки зрения процессов, происходящих в этих устройствах.Что такое анод
Анод — это клемма, по которой (обычный) ток поступает в устройство извне. Это означает, что электронов вытекают из устройства на анод.
Что такое катод
Катод — это вывод, через который (обычный) ток выходит из устройства.
 Это означает, что электронов втекают в этот терминал извне.
Это означает, что электронов втекают в этот терминал извне.Гальванические/гальванические элементы
Установка гальванического элемента показана ниже:
A Гальванический элемент
В гальваническом элементе один из электродов имеет более высокий восстановительный потенциал, чем другой. Электрод с более высоким восстановительным потенциалом имеет более сильную способность к присоединению электронов, поэтому электроны перетекают в него с другого электрода. В изображенной выше ячейке медь имеет более высокий восстановительный потенциал, чем цинк, поэтому она оттягивает электроны от цинкового электрода. Это сопровождает две реакции. На цинковом электроде цинк диссоциирует на Zn 2+ ионы и электроны. Другими словами, цинк окисляется (теряет электроны).
Электроны, потерянные цинком, текут по проводам на медный электрод. Здесь налетающие электроны объединяются с ионами Cu 2+ и образуют атомы меди.
 Медь восстанавливается (приобретает электроны):
Медь восстанавливается (приобретает электроны):Здесь электроны вытекают «из устройства» с цинкового вывода, поэтому обычный ток течет в устройство здесь. Это делает цинковый вывод анодом. Обычный ток вытекает из устройства через медную клемму, поэтому медь становится катодом. Всякий раз, когда устройство работает с использованием окислительно-восстановительных реакций, клемма, на которой происходит окисление, является анодом, а электрод, на котором происходит восстановление, является катодом. Это согласуется с приведенным выше описанием: цинк (анод) окисляется, а медь (катод) восстанавливается.
Электролитические ячейки
В электролитических ячейках источник питания используется для создания тока в жидкости, содержащей ионы. Например, мы рассмотрим, что происходит, когда два электрода помещают в образец расплавленного хлорида натрия (NaCl или поваренной соли).
Электролиз расплавленного хлорида натрия
Электрод, подключенный к положительной клемме батареи, притягивает анионы.
 Здесь эти ионы отдают свои электроны, образуя газообразный хлор.
Здесь эти ионы отдают свои электроны, образуя газообразный хлор.На электроде, подключенном к отрицательной клемме, положительные ионы натрия приобретают электроны, образуя атомы натрия:
Здесь клеммой, которая пропускает ток в устройство, является электрод, подключенный к положительной клемме батареи. Следовательно, это анод. ионы теряют здесь свои электроны, так что это согласуется с идеей, что окисление происходит на аноде. На другом электроде образуется натрий, где ионы восстанавливаются. Текущие потоки из устройства с этого терминала. Следовательно, этот вывод образует катод.
Приведенные выше два примера должны пояснить, что термины анод и катод относятся не к конкретному потенциалу, а к тому, как протекает ток в установке. Например, «положительный» электрод в гальваническом элементе является его «катодом», но «положительный» электрод в случае электролиза является его «анодом».
Разница между анодом и катодом
Названия «анод» и «катод» могут быть присвоены клемме в зависимости от того, поступает ли ток в эту клемму извне или ток выходит из клеммы наружу.
 Однако, поскольку то, как токи текут в разных ситуациях, может быть совершенно разным, перевод использования этих терминов из одной ситуации в другую может привести к путанице. Поэтому может быть необходимо сначала изучить ситуацию, чтобы правильно использовать терминологию. По возможности следует использовать альтернативные, менее двусмысленные термины (в зависимости от ситуации). Мы обсудили два конкретных примера из электрохимии, но термины «анод» и «катод» используются и во многих других областях. Еще несколько примеров упомянуты в сводном разделе ниже.
Однако, поскольку то, как токи текут в разных ситуациях, может быть совершенно разным, перевод использования этих терминов из одной ситуации в другую может привести к путанице. Поэтому может быть необходимо сначала изучить ситуацию, чтобы правильно использовать терминологию. По возможности следует использовать альтернативные, менее двусмысленные термины (в зависимости от ситуации). Мы обсудили два конкретных примера из электрохимии, но термины «анод» и «катод» используются и во многих других областях. Еще несколько примеров упомянуты в сводном разделе ниже.Направление тока:
Как правило, ток течет в анод снаружи.
Катод дает ток из устройства. Это означает, что вне устройства, электронов текут от анода к катоду.
Окислительно-восстановительная реакция:
В устройствах, основанных на окислительно-восстановительных реакциях, окисление происходит на анодах .
Тогда как восстановление происходит на катодах .

В гальванических элементах и электролитических элементах:
В гальванических элементах и электролитических элементах катод притягивает катионы и окисляет их.
Анод притягивает анионы и восстанавливает их.
При электролизе:
Анод образует положительную клемму при электролизе
В то время как катод образует отрицательную клемму в гальваническом элементе.
В электронных пушках и рентгеновских трубках:
В электронных пушках и рентгеновских трубках часть, испускающая электроны в устройство, образует катод .
Внутри устройства анод собирает электроны.
Когда обычные диоды подключены в прямом направлении, анодом является сторона p- , которая соединена с положительной стороной батареи (она потребляет ток от элемента). Точно так же катод из образует сторону из n-.

Хотя названия выводов следует поменять местами, когда ток течет в обратном смещении в стабилитроне, p-сторона — это , но называется «анод », хотя технически он дает ток на снаружи. Это заметное исключение, и оно подчеркивает, почему следует по возможности избегать терминов «анод» и «катод» (в этом случае стороны лучше называть стороной p- и стороной n-). сторона).
Другой источник путаницы возникает, когда производители батарей маркируют отрицательную клемму перезаряжаемой батареи как «анод ». Когда аккумулятор разряжается, терминология работает. Однако, когда батарея заряжается, технически терминология также должна быть изменена на обратную.
Ссылки:
Denker, J. (2004). Как определить анод и катод . Получено 1 октября 2015 г. с сайта Welcome to Av8n.com 9.0026
Изображение предоставлено:
«Схема гальванического элемента» по стандарту Огайо (перенесено из en.
 wikipedia; передано в Commons пользователем: авиабаза Берпельсон с использованием CommonsHelper) [CC BY-SA 3.0], через Wikimedia Commons
wikipedia; передано в Commons пользователем: авиабаза Берпельсон с использованием CommonsHelper) [CC BY-SA 3.0], через Wikimedia Commonsанод катод — Испанский перевод – Язык
Q. Что такое t h e анод , катод a 2 2 n d электролит?
duracell.in
duracell.in
Р . Qu so n e l nodo, el ctodo y el ele ctrol it o?
duracell.es
duracell.es
Этот процесс происходит между тремя основными
[…] части батареи: Т h e анод , катод , a -й электролит
duracell.in
duracell.in
Este proceso tiene lugar entre las tres partes
[.
 ..] l a pi la: El nodo, e l ctodo y el el ectro li to.
..] l a pi la: El nodo, e l ctodo y el el ectro li to.duracell.es
duracell.es
Полный спектр основных технических
[…] улучшения, такие как min im u m анод/катод d i st 9184 […]
контактная система, сегментированные аноды
[…]
и соответствующие электролиты, InPulse 2 уже находится в крупносерийном производстве и хорошо подготовлен к задачам завтрашнего дня.
atotech.com
atotech.com
Con toda la serie de Importantes
[…]
mejoras tcnicas tales como distancia
[…] mnim a entr e nodo y ctodo , nod os seg мне ntados [.
 ..]
..]в системе контактов крупных компаний
[…]
superficiie y electrolitos apropiados, InPulse2 se utiliza Actualmente en produccin a gran escala y est bien preparado para los retos del maana.
atotech.com
atotech.com
Уникальная система горизонтальной металлизации Uniplate InPulse 2 от Atotech не только сочетает в себе преимущества успешно установленной и проверенной в производстве системы InPulse, но также предлагает все ее
[…]
Ассортимент основных технических
[…] improvements such as min im u m anode / cathode d i st ance, wide area […]
контактная система, сегментированные аноды,
[…]
универсальная транспортная система (UTS-xs) для обработки сверхгибких материалов, новые зажимные системы и многое другое.

atotech.com
atotech.com
Горизонтальная эксклюзивная металлизационная система Uniplate InPulse2 от Atotech, которая не сочетается с системой InPulse InPulse, установленной в общем мире и достаточной пробой в приложениях продукта, китайском языке, полученном в серии
[…]
важные главные истории, сказки
[…] distan ci a mn ima nodo /ctodo, n odos segme nt ados con […]
Единая система контактов с крупными поставщиками,
[…]
универсальный транспорт (UTS-xs) для ультрагибких материалов, nuevos sistemas de pinzado y otras muchas ms.
atotech.com
atotech.com
например 8540 99 0 0 9 1 Анод , Катод o r 2 o 918 [.
 ..]
..]узел, состоящий из этих компонентов (сердечник магнетрона), для
[…]
производство магнетронов подсубпозиции 8540 71 00 (1) 0 с 1.1.2006 по 31.12.2008
eur-lex.europa.eu
eur-lex.europa.eu
е х 8540 99 00 91 nodo, ctodo o dis pos itivo 1 2 d, salida […]
o un conjunto de estos elementos (трубка с сердечником магнетрона), место назначения
[…]
фабрика магнетронов подразделения 8540 71 00 (1) 0 1.1.2006-31.12.2008
eur-lex.europa.eu
eur-lex.europa.eu
Анод Катод
leroy-somer.com
leroy-somer.com
узел Ctodo
leroy-somer.com
leroy-somer.
 com
comАнод Катод
leroy-somer.com
leroy-somer.com
Anodo Ctodo
leroy-somer.com
leroy-somer.com
Также имеет автоматическую систему до
[…] de s ( анод/катод ) w это ч […]
техническое обслуживание и эксплуатация
[…]
time и имеет полностью управляемый трехфазный или монофазный привод переменного/постоянного тока, который минимизирует энергопотребление.
procontrolsl.com
procontrolsl.com
Dispone de un sistema automtico de
[…] limpieza de l os el ect стержень os (nodo/ctodo) qu e min imteno limiza 2 e 2 [.
 ..]
..]Оборудование, неуправляемый
[…]
полный преобразователь переменного тока в постоянный, монофазный или трехфазный, который минимизирует потребление электроэнергии.
procontrolsl.com
procontrolsl.com
3. Электролит — проводник, который
[…] transfers charge between t h e anode a n d cathode i n si de the cell.
duracell.com.au
duracell.com.au
3. Электролито: Непроводящая очередь
[…] transfiere la c ar ga en tre e l nodo y e l ctodo d ent ro de la c elda.
duracell.com.co
duracell.
 com.co
com.co4. Сепаратор — материал, обеспечивающий
[…] барьер между t h e Anode A N D T T 1 T 1 T 1 T 1 T 1 T T
соприкасаются друг с другом, обеспечивая свободный поток заряда.
duracell.com.au
duracell.com.au
4. Разделитель: Нематериальная пропорция
[…] una bar re ra en tre el nodo y el ctodo par a e vitar q ue se […]
жетоны входа, разрешения
[…]
mismo tiempo la libre circulacin de la carga.

duracell.com.co
duracell.com.co
В этой конфигурации используется тот же материал электрода
[…] одновременно г а с анод а н d 1 кат.
болетины.с.в.с
болетины.с.в.с
En esta configuracin, el mismo material de electrodose utiliza
[…] simul t neame nte co mo nodo y ctodo .
болетины.секв.эс
болетины.сек.эс
A n anode a n d cathode g a s diffusion layer, each one having […]
Круговое уплотнение из эластомера с профилированной кромкой.
Симрит.вход
Симрит.
 вход
входКапа де Дифузи n gaseo sa con nodo y ctodo ro dea dos cada u […]
una junta de elastmero perfilada.
simrit.es
simrit.es
Диод в хорошем рабочем состоянии должен пропускать ток до
[…] расход только в t h e анод — по — катод d i re кт.
leroy-somer.com
leroy-somer.com
Un diodo en buen estado debe licenser el paso de la intensidad
[…] nicamente en e l senti do de nodo hac ia ctodo .
leroy-somer.com
leroy-somer.com
For each input, t h e anode ( p os itiv e) & cathode ( № например, активный) оптоизолятора [.
 ..]
..]выведен на разъем.
badgermeter.de
badgermeter.de
Para ca da entr ada , e l nodo ( pos iti v o) y e l ctodo ( ne gati vo ) de l aislador […]
ptico se saca del conector.
badgermeter.de
badgermeter.de
Plastic dropping bottles fot t h e anode a n d cathode s o lu tions.
eur-lex.europa.eu
eur-lex.europa.eu
5.8. Фраско де
[…] plstico p ar a el goteo de las solu c iones andica y catdica .

eur-lex.europa.eu
eur-lex.europa.eu
Both t h e anode a n d t h e cathode c u p were plunged в жидкость […]
раствор хлорида аммония, выступавший в роли электролита.
duracell.in
duracell.in
T ant o e l nodo c omo la c opa de l ctodo e ran su mergi do s en una [.. .]
раствор хлорида аммония, который действует вместе с электролитом.
duracell.es
duracell.es
Отсоединить шток диода от вращающегося выпрямительного моста и механически
[.
 ..]
..]прикрепить к другой части моста
[…] such a way that t h e anode a n d t h e cathode o f t диод находится […]
тот же потенциал.
leroy-somer.com
leroy-somer.com
Десконектар «Кола» де ун Диодо дель Пуэнте
[…]
giratorio y fijarla mecnicamente a otra parte del puente para
[…] que este d iodo ten ga su nodo y suctodo al ми смо поте нк иал.
leroy-somer.com
leroy-somer.com
Другими словами, чем больше напряжение и тем ниже
[…] resistance between t h e anode a n d t h e cathode , t он выше [.
 ..]
..]текущий.
colexon.es
colexon.es
En otras palabras, cuanto mayor sea el voltaje y la parte inferior de la
[…] ia entr e e l nodo y e l ctodo, may or se r lacorient.
colexon.es
colexon.es
Исправный диод должен пропускать ток
[…] to flow from t h e anode t o t h e cathode .
leroy-somer.com
leroy-somer.com
Un diodo en estado de Marcha ha de dejar pasar la intensidad slo
[…] en la di recc in de nodo haci и ctodo .
leroy-somer.com
leroy-somer.
 com
comT h e anode i s o ften a metal, t h e cathode a me оксид таллия и […]
электролит раствор соли, облегчающий поток ионов.
duracell.in
duracell.in
E l nodo s ue le s er un me tal , e l ctodo u n m eta l xi do y el […]
электролитный раствор соляной кислоты, который облегчает работу с ионами.
duracell.es
duracell.es
Anode a n d cathode c o at ed.
thecrawlstyle.
 com
comthecrawlstyle.com
Anodo y ctodo act iv ados .
thecrawlstyle.com
thecrawlstyle.com
Никель-кадмий (NiCd):
[…] These batteries use the Ni ck e l anode a n d the Cad mi u m cathode .
evwind.es
evwind.es
Нкель Кадмио
[…] (никель-кадмиевый ): Util iza n u n nodo d e n quel y un ctodo de c adm io .
evwind.com
evwind.com
Система содержит расширенный
[…] титановая решетка, покрытая оксидом драгоценного металла (t h e анод ) a nd щетка из нержавеющей стали (t h e катод ) .

judo-wasseraufbereitung.de
judo-wasseraufbereitung.de
Электроприборы сена и металла
[…] titani o (el nodo) re cu bierto de xido de metal precioso y una escobilla de acer o fino (эль узел) .
judo-wasseraufbereitung.de
judo-wasseraufbereitung.de
0011] Особым типом детекторов являются многопроволочные пропорциональные камеры, состоящие из
. […]
в основном из набора тонких, параллельных
[…] ac e d анод w I RE S, настенный между T W O Котод P P 1 P 1 P 1 P 2 P .

атмосфера.
givetheplanetachance.com
givetheplanetachance.com
0011] Особый тип детекторов, сон ла Cmaras Multialmbricas Proporcionales, las cuales consten esencialmente de una serie de
[…]
дельгадос, паралелос и
[…] igualment e espac iad os nodos de al ambre , ensamblados en tr e dos paredes catd ic as, en [ …]
в газовой сфере.
givetheplanetachance.com
givetheplanetachance.com
предотвращает ржавчину и образование водорослей,
[…] acting as galv an i c anode a n d so avoi di n g cathode c o rr osione
excosystem.
 com
comexcosystem.com
evita la formacin de oxido y de algas,
[…] funcionado como a nodo galvanico y evitando as i la cor 911
excosystem.com
excosystem.com
Датчик состоит из пластины в у м анод а н д si lv e r катод s e pa
jandc-bo.com
jandc-bo.com
Датчик состоит из анода платины и катода платы, разделенных поровой конъюнкцией керамики, пороза, контениендо ип электролито желатинозо.
jandc-bo.com
jandc-bo.com
Специальные продукты из графита часто классифицируют по способу производства графита: изостатический графит (полученный посредством изостатического формования), используемый в электроэрозионных электродах, штампах для непрерывного литья заготовок, пресс-формах для горячего прессования, полупроводниковых приборах; и
[.
 ..]
..]экструдированный графит (полученный методом экструзии),
[…] используется в электрол yt i c аноды а н д катоды , б 4 4 […]
Лотки, тигли.
eur-lex.europa.eu
eur-lex.europa.eu
Классическое меню по форме, в которой производится графито: графито изосттико (среднее приготовление изосттико), использование электроэрозионных электроэрозионных станков, непрерывное непрерывное производство, приготовление в калиенте, применение в полупроводниках; у
[…]
графито экструзии (производство
[…] extrusin), ut iliza do en nodos y ctodos el ect rol tico […]
bandejas de sinterizacin y crisoles.
eur-lex.
 europa.eu
europa.eueur-lex.europa.eu
Готовая продукция включает товарную продукцию (например, медь
[…] concentrates, co pp e r anodes , c opp e r cathodes , c op за стержень, […]
концентрат молибдена и прочие металлургические продукты).
южный.com
южный.com
Los productos terminados son aquellos que se
[…]
pueden vender (por ejemplo,
[…] concentrados de cob re , nodos d e c obre , ctodos d e co br e, alambrn, […]
концентрат молибдена и других продуктов металлургии).
южный.com
южный.com
Т ч д anode c a n be either a cone attached to the periphery of t h e cathode , t hr ough изолятор, [.

Раствор
1.a) Ba 2+ (aq) → Ba (s) + 2e- с SRP (для противоположной реакции) E o = -2,92 В, где анод происходит окисление)
Cu 2+ (водн.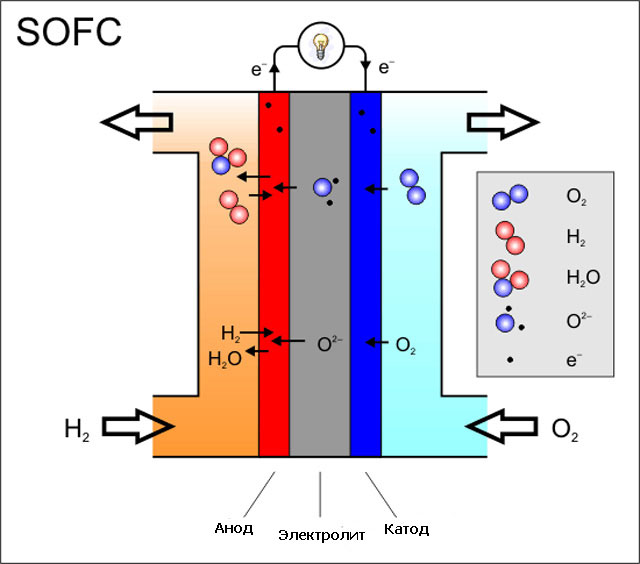 ) + 2e- → Cu (тв) с SRP E o = +0,340 В (Катод; где происходит восстановление)
) + 2e- → Cu (тв) с SRP E o = +0,340 В (Катод; где происходит восстановление)
1b002 Al 3+ (водн.) → Al (s) + 3e — с SRP (для противоположной реакции) E o = -1,66 В (Анод; где происходит окисление)
Sn 2+ (водн.) +2e → Sn (s) с SRP E o = -0,137 В (катод; где происходит восстановление)
2.a) Ba 2+ (водн.) | Ва (с) || Cu (с) | Cu 2+ (водный)
2.b) Al (s) | Al 3+ (водный) || Sn 2+ (водный) | Sn (s)
3.a) E o ячейка = 0,34 — (-2,92) = 3,26 В
3.b) E o — ячейка ) = 1,523 В
Напряжение ячейки/потенциал ячейки
Показания вольтметра дают реакцию напряжения ячейки или разность потенциалов между двумя полуячейками. Напряжение ячейки также известно как 9o_{анод}\]
Напряжение ячейки также известно как 9o_{анод}\]
Значения E o приведены в таблице для всех растворенных веществ при 1 М и всех газов при 1 атм. Эти значения называются стандартными восстановительными потенциалами . Каждая полуреакция имеет различный восстановительный потенциал, разность двух восстановительных потенциалов дает напряжение электрохимической ячейки. Если клетка E o положительна, реакция идет самопроизвольно и это гальваническая ячейка. Если в ячейке E или отрицательный результат, то реакция не является самопроизвольной, и ее называют электролитической ячейкой.
Ссылки
Авторы и ссылки
Voltaic Cells распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
Электролизеры — Химия LibreTexts
Вольтовы элементы приводятся в действие спонтанной химической реакцией, которая производит электрический ток через внешнюю цепь. Эти элементы важны, потому что они являются основой для батарей, питающих современное общество. Но они не единственный вид электрохимической ячейки. Обратная реакция в каждом случае не является самопроизвольной и требует электрической энергии.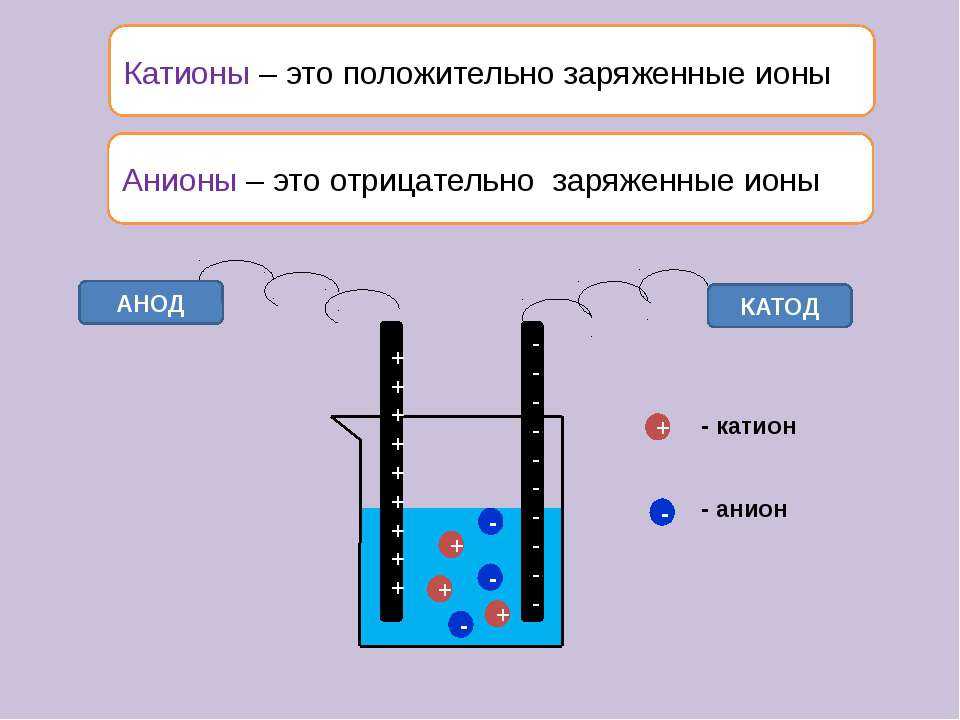
Введение
Общая форма реакции может быть записана как: rightleftharpoons \text{Продукты} + \text{Электроэнергия}}}\]
Можно сконструировать ячейку, которая будет воздействовать на химическую систему, пропуская через нее электрический ток. Эти клетки называются 9Электролизеры 0024. Электролитические элементы, как и гальванические элементы, состоят из двух полуэлементов: один полуэлемент восстановительный, другой полуэлемент окислительный. Однако направление потока электронов в электролитических элементах может быть противоположным направлению спонтанного потока электронов в гальванических элементах, но определение как катода, так и анода остается прежним, когда на катоде происходит восстановление, а на аноде происходит окисление. . Поскольку направления обеих полуреакций были изменены на противоположные, изменился знак, но не величина клеточного потенциала.
Электролитические элементы очень похожи на гальванические (гальванические) элементы в том смысле, что оба требуют солевого мостика, оба имеют катод и анод, и оба имеют постоянный поток электронов от анода к катоду. Однако между двумя клетками есть и поразительные различия. Основные отличия представлены ниже:
Однако между двумя клетками есть и поразительные различия. Основные отличия представлены ниже:
Рисунок \(\PageIndex{1}\): Электрохимические ячейки . Гальванический элемент (слева) преобразует энергию, выделяемую в результате спонтанной окислительно-восстановительной реакции, в электрическую энергию, которую можно использовать для выполнения работы. Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, соединенных внешней электрической цепью; кроме того, для поддержания электрической нейтральности необходимо второе соединение, которое позволяет ионам течь между отсеками (показанное здесь вертикальной пунктирной линией для обозначения пористого барьера). Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток. В электролитической ячейке (справа) внешний источник электрической энергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только одно отделение.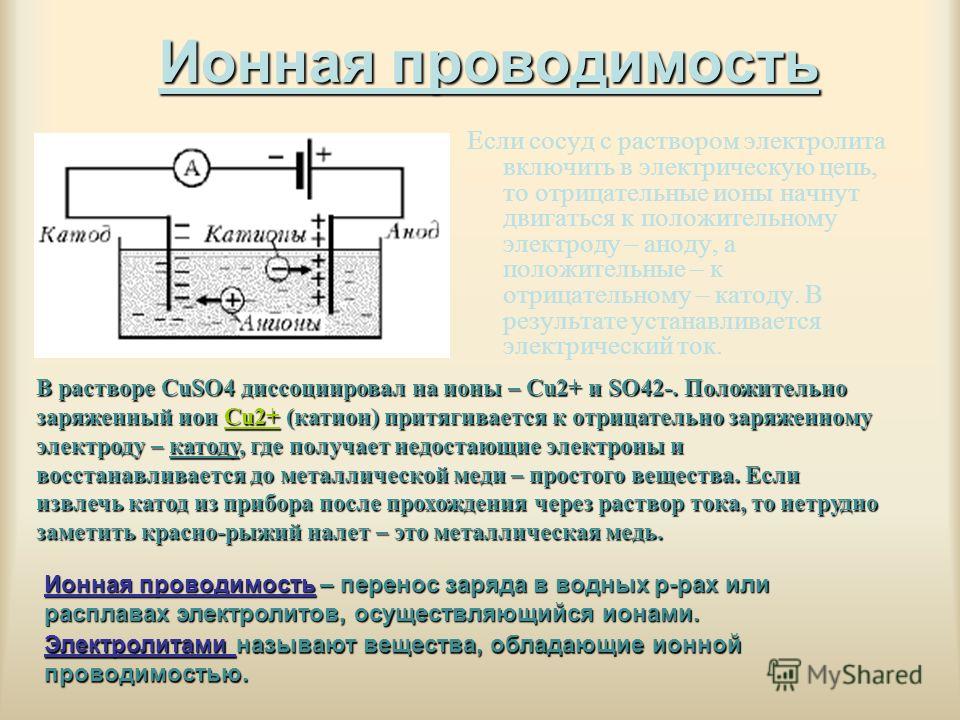 В обоих типах электрохимических элементов анодом является электрод, на котором происходит полуреакция окисления, а катодом является электрод, на котором происходит полуреакция восстановления.
В обоих типах электрохимических элементов анодом является электрод, на котором происходит полуреакция окисления, а катодом является электрод, на котором происходит полуреакция восстановления.
| Электрохимический элемент (гальванический элемент) | Электролитическая ячейка |
|---|---|
| Гальванический элемент преобразует химическую энергию в электрическую. | Электролитическая ячейка преобразует электрическую энергию в химическую. |
Здесь окислительно-восстановительная реакция протекает самопроизвольно и отвечает за производство электроэнергии.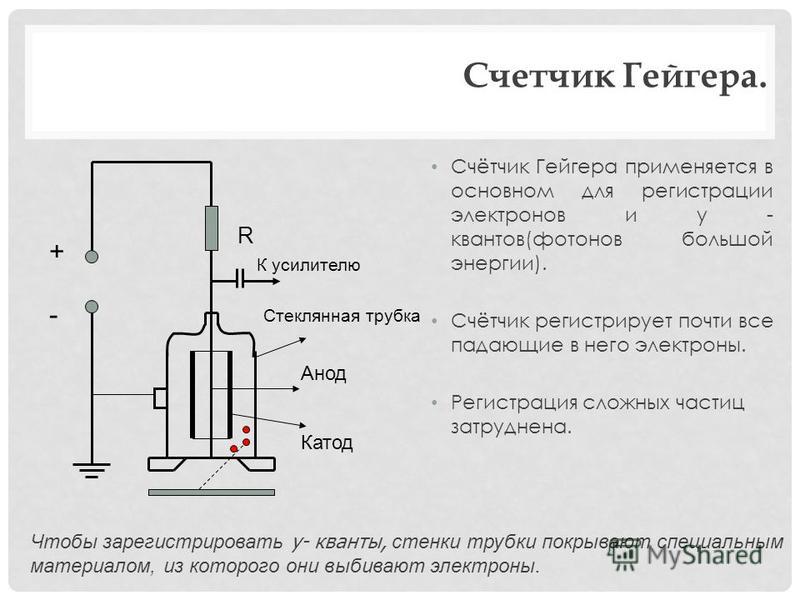 | Окислительно-восстановительная реакция не является самопроизвольной, и для ее инициирования необходимо подать электрическую энергию. |
| Две полукамеры установлены в разных контейнерах, соединенных через соляной мост или пористую перегородку. | Оба электрода помещаются в одну емкость в раствор расплавленного электролита. |
| Здесь анод отрицательный, а катод положительный электрод. Реакция на аноде – окисление, на катоде – восстановление. | Здесь анод положительный, а катод отрицательный. Реакция на аноде – окисление, на катоде – восстановление. |
Электроны поставляются окисляющимися частицами. Они движутся от анода к катоду во внешней цепи.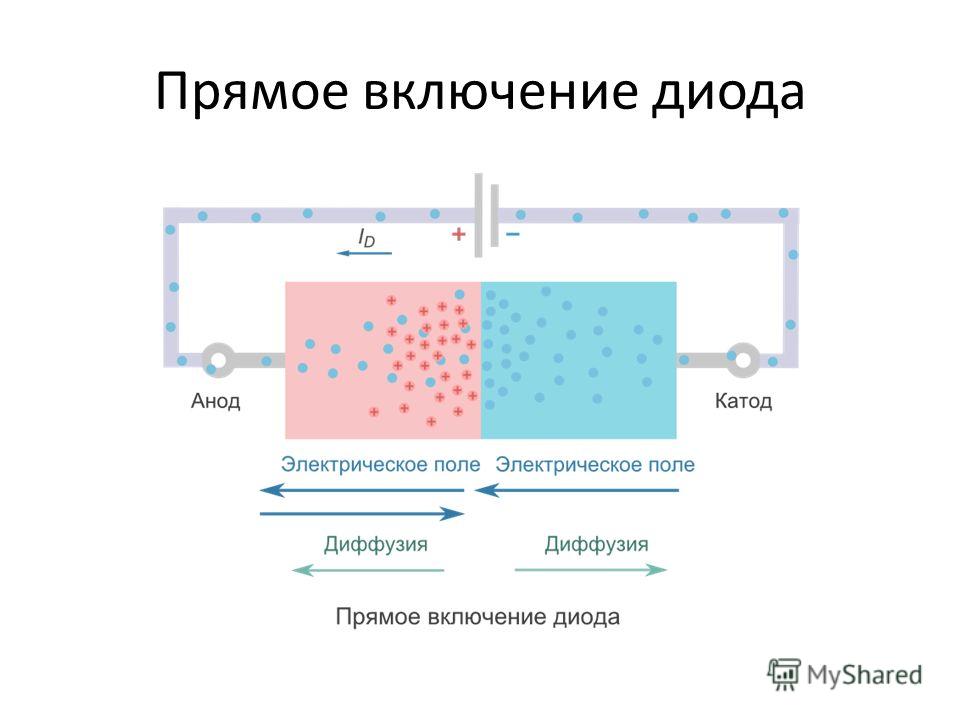 | Внешняя батарея поставляет электроны. Они входят через катод и выходят через анод. |
Электролизеры
Чтобы объяснить, что происходит в электролизере, давайте рассмотрим разложение расплавленного хлорида натрия на металлический натрий и газообразный хлор. Реакция написана ниже.
———> Самопроизвольный (электролитическая ячейка) | ||||
2 NaCl (л) | \(\rightleftharpoons\) | 2 На(т) | + | Класс 2 (г) |
<--------- самопроизвольный (электрохимический элемент) | ||||
Если расплавленный \(NaCl_{(l)}\) поместить в контейнер и вставить инертные электроды \(C_{(s)}\), прикрепленные к положительным и отрицательным клеммам батареи, произойдет электролитическая реакция. 9-\]
9-\]
Прогнозирование реакции электролиза
Существует четыре основных фактора, которые определяют, будет ли происходить электролиз, даже если внешнее напряжение превышает расчетное значение: поверхность. Этот случай чаще случается с газами. Например. H 2 (g) требует перенапряжения 1,5 В, а Pt (s) требует перенапряжения 0 В
Этот случай чаще случается с газами. Например. H 2 (g) требует перенапряжения 1,5 В, а Pt (s) требует перенапряжения 0 В
Если учесть все четыре фактора, мы можем успешно прогнозировать электродные полуреакции и общие реакции при электролизе.
Упражнение \(\PageIndex{1}\)
Предскажите электродные реакции и общую реакцию, когда анод сделан из меди (а) и платины (б).
Количественные аспекты электролиза
Майкл Фарадей в 1833 году обнаружил, что всегда существует простая зависимость между количеством вещества, образующегося или потребляемого на электроде во время электролиза, и количеством электрического заряда Q , прошедшего через ячейку. Например, полууравнение 9– \rightarrow Ag\]
говорит нам, что когда 1 моль Ag + осаждают как 1 моль Ag, 1 моль e – должен поступать с катода. Поскольку известно, что отрицательный заряд одного электрона составляет 1,6022 × 10 –19 Кл, мы можем умножить его на постоянную Авогадро, чтобы получить заряд на моль электронов. Эта величина называется постоянной Фарадея , символ F :
F = 1,6022 × 10 –19 C × 6,0221 × 10 23 9-}\) и \(Q\).
Часто в экспериментах по электролизу измеряется электрический ток, а не количество электрического заряда. Поскольку кулона определяется как количество заряда, которое проходит через фиксированную точку в электрической цепи, когда в течение одной секунды протекает ток в один ампер, заряд в кулонах можно рассчитать, умножив измеренный ток (в амперах) на время (в секундах), в течение которого он течет:
\[Q = It\]
В этом уравнении I представляет ток, а t представляет время. Если вы помните, что
кулон = 1 ампер × 1 секунда 1 Кл = 1 А с
, вы можете настроить единицы времени, чтобы получить правильный результат. Теперь, когда мы можем предсказать электродные полуреакции и общие реакции при электролизе, также важно иметь возможность рассчитать количество потребленных реагентов и произведенных продуктов. Для этих расчетов мы будем использовать постоянную Фарадея:
1 моль электрона = 96,485 Кл
заряд ( Кл ) = ток ( Кл/с ) x время (с)
( Кл/с5 заряда) A )
Простое преобразование для любого типа задач:


 ..
.. Если нет электронной эмиссии катода, то поле будет однородным. При нормальной работе катод испускает большое число электронов, которые в пространстве “анод — катод” создают отрицательный объемный заряд, препятствующий движению электронов к аноду. Наиболее плотный объемный заряд находится вблизи катода.
Если нет электронной эмиссии катода, то поле будет однородным. При нормальной работе катод испускает большое число электронов, которые в пространстве “анод — катод” создают отрицательный объемный заряд, препятствующий движению электронов к аноду. Наиболее плотный объемный заряд находится вблизи катода.
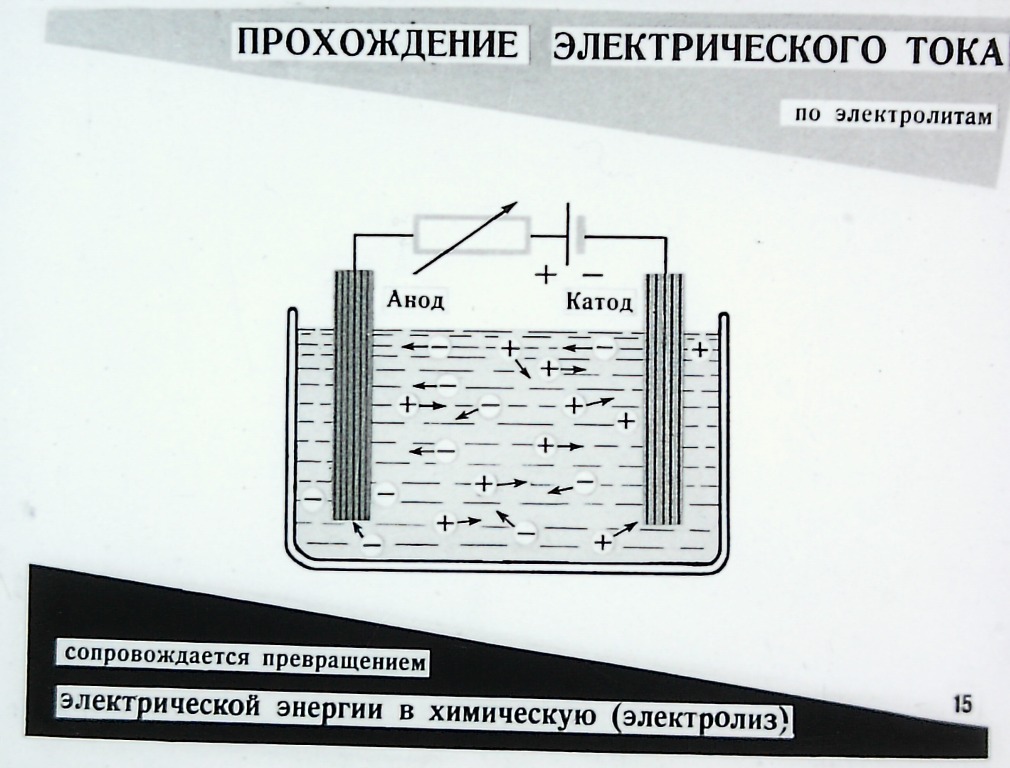


 Схемы и конструкции…
Схемы и конструкции… +_{(aq)}\) получает электрон, что означает его уменьшение. \(Cu_{(s)}\) теряет два электрона, таким образом, он окисляется.
+_{(aq)}\) получает электрон, что означает его уменьшение. \(Cu_{(s)}\) теряет два электрона, таким образом, он окисляется. Диаграмма ячейки представляет собой представление электрохимической ячейки. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\) выше.
Диаграмма ячейки представляет собой представление электрохимической ячейки. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\) выше. «Химия: центральная наука», пятое издание, Prentice-Hall, Inc. Englewood Cliffs, N.J. 07632 1991
«Химия: центральная наука», пятое издание, Prentice-Hall, Inc. Englewood Cliffs, N.J. 07632 1991

 Какая масса брома может быть осаждена за 3,00 часа током силой 1,18 А?
Какая масса брома может быть осаждена за 3,00 часа током силой 1,18 А? кислота. Реакция в аноде составляет
кислота. Реакция в аноде составляет

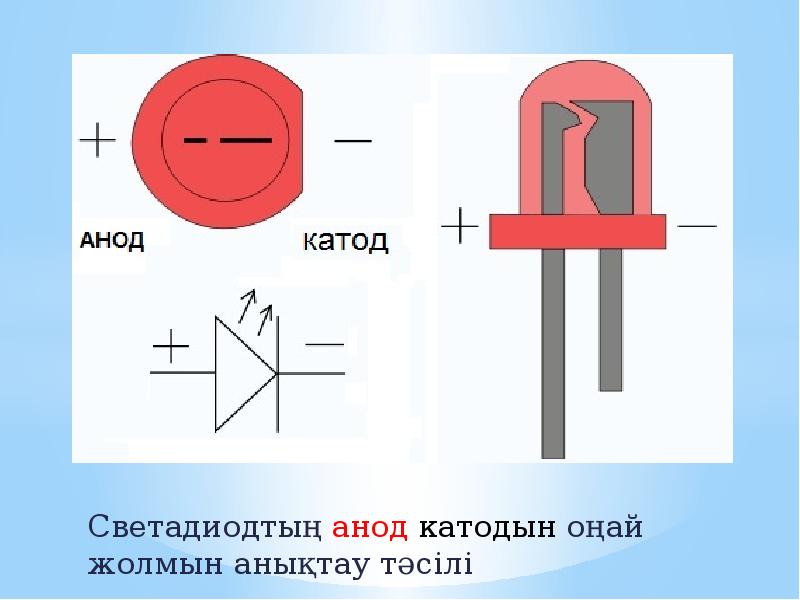
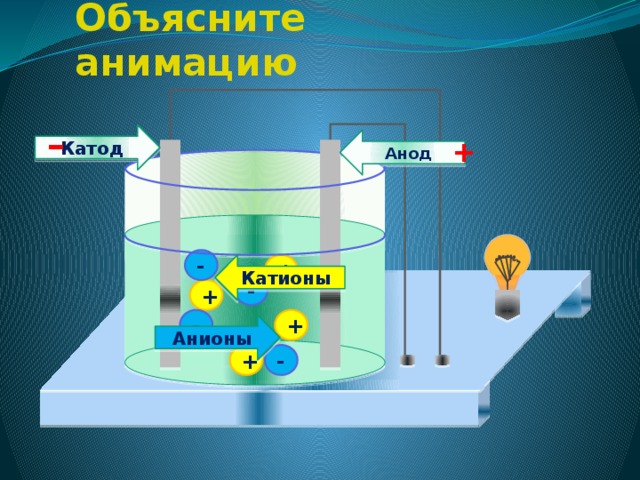 9изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007.
9изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007. При зарядке на границе катод/электролит образуется скопление положительных ионов. Это приводит к тому, что электроны движутся к катоду, создавая потенциал напряжения между катодом и анодом. Высвобождение происходит за счет прохождения тока от положительного катода через внешнюю нагрузку и обратно к отрицательному аноду. При зарядке ток течет в другом направлении.
При зарядке на границе катод/электролит образуется скопление положительных ионов. Это приводит к тому, что электроны движутся к катоду, создавая потенциал напряжения между катодом и анодом. Высвобождение происходит за счет прохождения тока от положительного катода через внешнюю нагрузку и обратно к отрицательному аноду. При зарядке ток течет в другом направлении. 
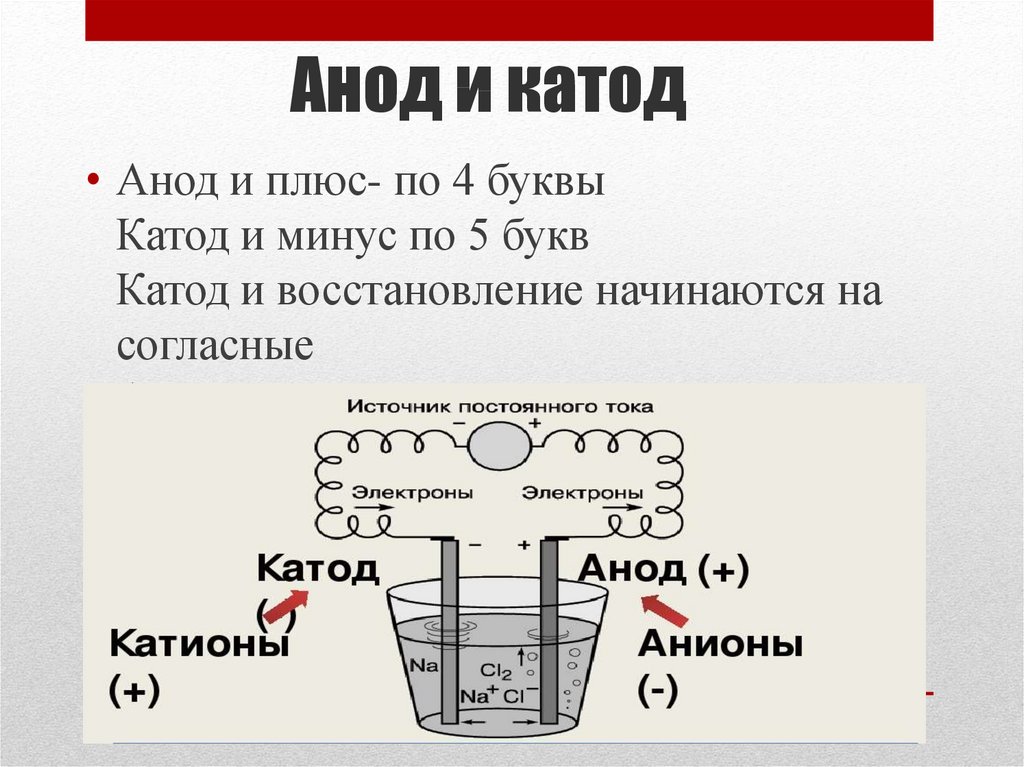

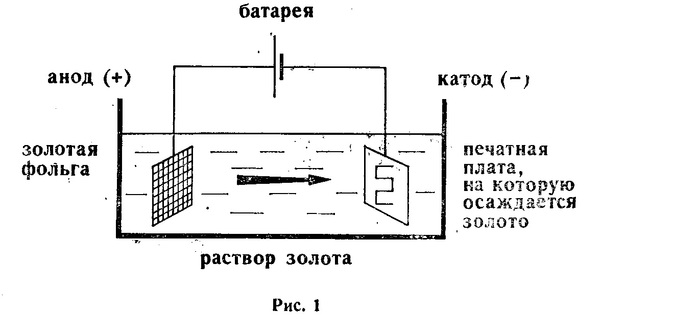
 .ком.
.ком.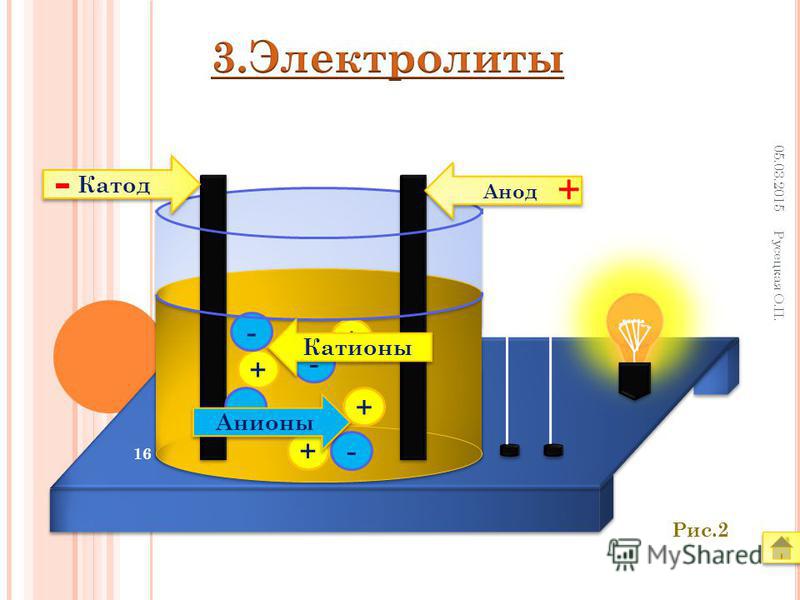 адрес:
(изменить)
адрес:
(изменить)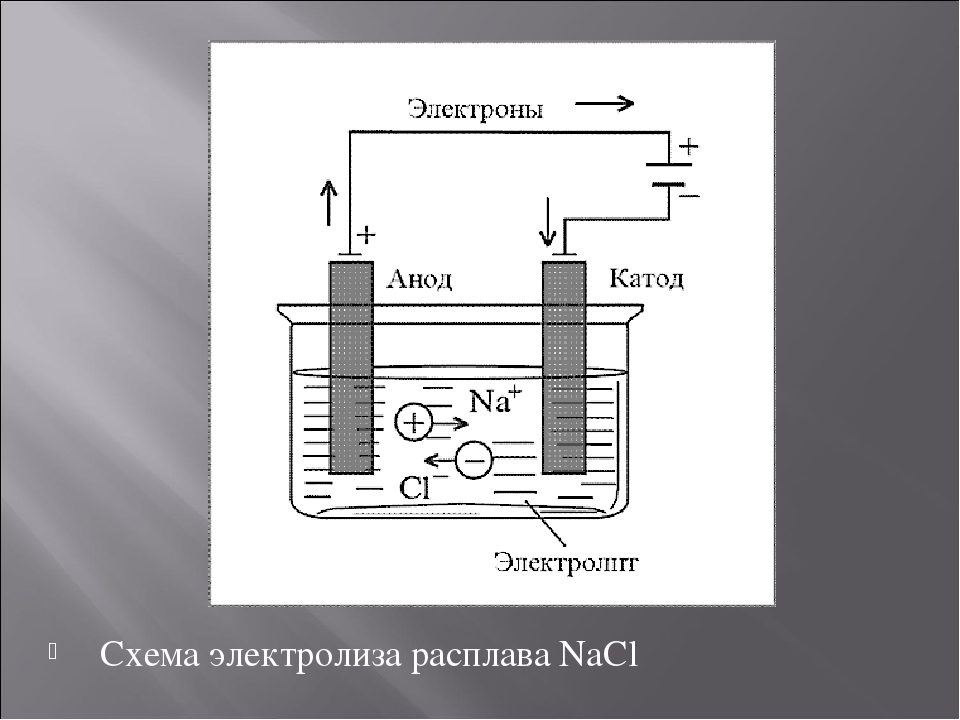
 А., Мур П.К.
А., Мур П.К.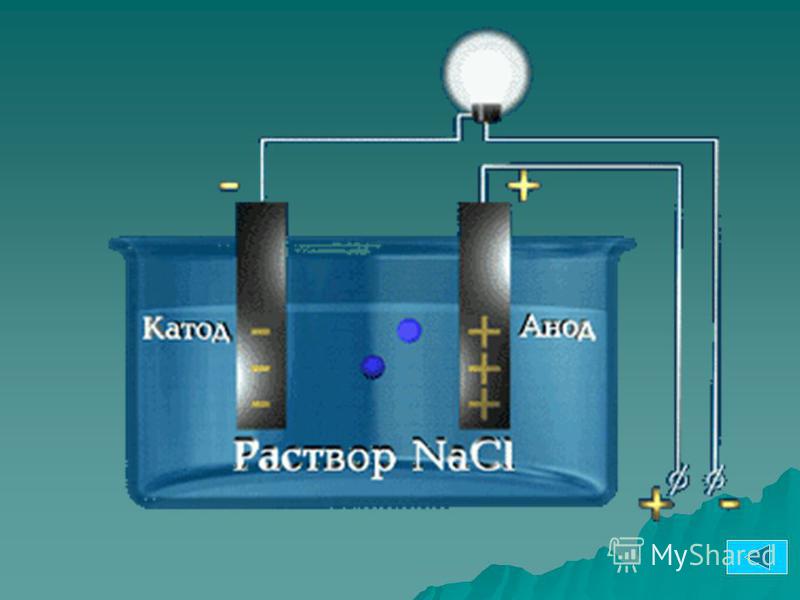 В обоих случаях спиральная волна инициируется посредством поперечной стимуляции слоя бидомена. Внеклеточный дефибрилляционный разряд подается через два небольших электрода, расположенных на противоположных границах тканей. Модификации кинетики активной мембраны позволяют проводить дефибрилляционные разряды высокой силы. Численные решения получены с использованием эффективной полунеявной схемы предиктор-корректор, которая позволяет выполнять моделирование в разумные сроки. Результаты моделирования показывают, что возбуждения при разрыве анода и/или катода вносят значительный вклад в активность во время и после удара. Для успешного дефибрилляционного разряда виртуальные электроды и прерывающие возбуждения ограничивают спиральную волну и делают ткань невосприимчивой, поэтому она не может в дальнейшем поддерживать повторный вход. Результаты также показывают, что электропорация изменяет явление разрыва анода/катода, причем основное влияние оказывается на время возбуждения разрыва катода. Таким образом, электропорация приводит к различному характеру распределения трансмембранного потенциала после удара.
В обоих случаях спиральная волна инициируется посредством поперечной стимуляции слоя бидомена. Внеклеточный дефибрилляционный разряд подается через два небольших электрода, расположенных на противоположных границах тканей. Модификации кинетики активной мембраны позволяют проводить дефибрилляционные разряды высокой силы. Численные решения получены с использованием эффективной полунеявной схемы предиктор-корректор, которая позволяет выполнять моделирование в разумные сроки. Результаты моделирования показывают, что возбуждения при разрыве анода и/или катода вносят значительный вклад в активность во время и после удара. Для успешного дефибрилляционного разряда виртуальные электроды и прерывающие возбуждения ограничивают спиральную волну и делают ткань невосприимчивой, поэтому она не может в дальнейшем поддерживать повторный вход. Результаты также показывают, что электропорация изменяет явление разрыва анода/катода, причем основное влияние оказывается на время возбуждения разрыва катода. Таким образом, электропорация приводит к различному характеру распределения трансмембранного потенциала после удара.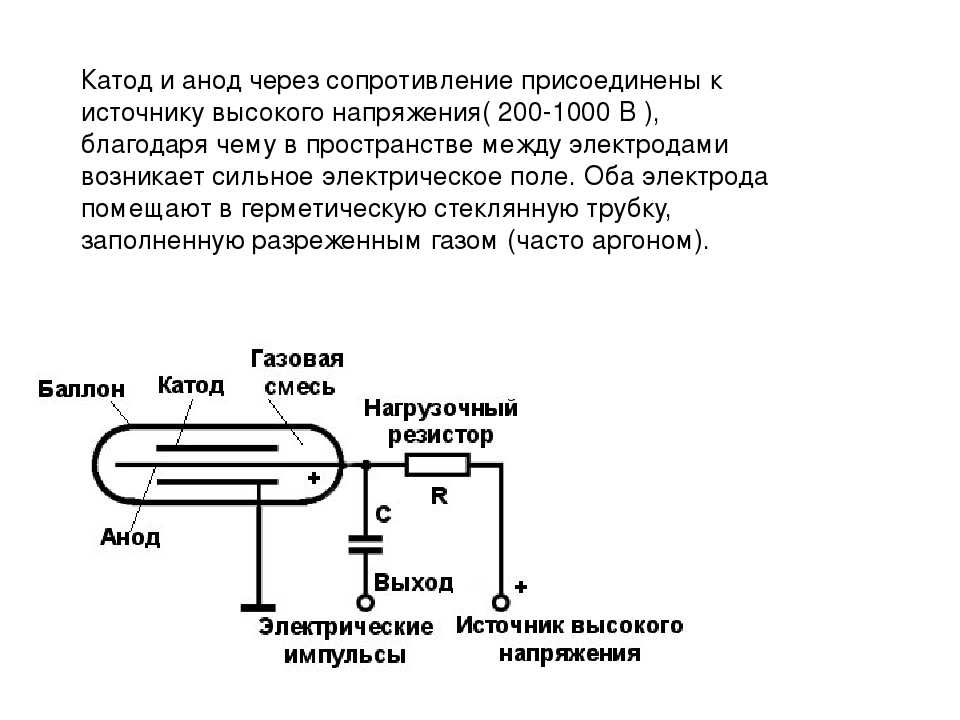 Эта разница в паттернах может привести или не привести к изменению исхода шока.
Эта разница в паттернах может привести или не привести к изменению исхода шока.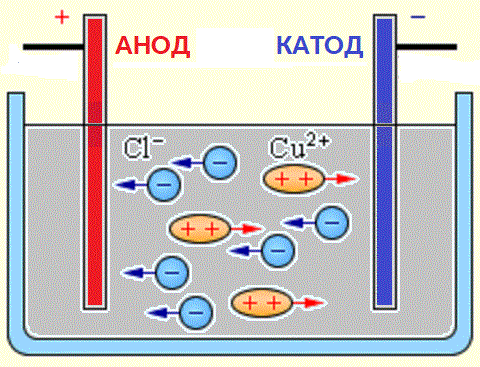
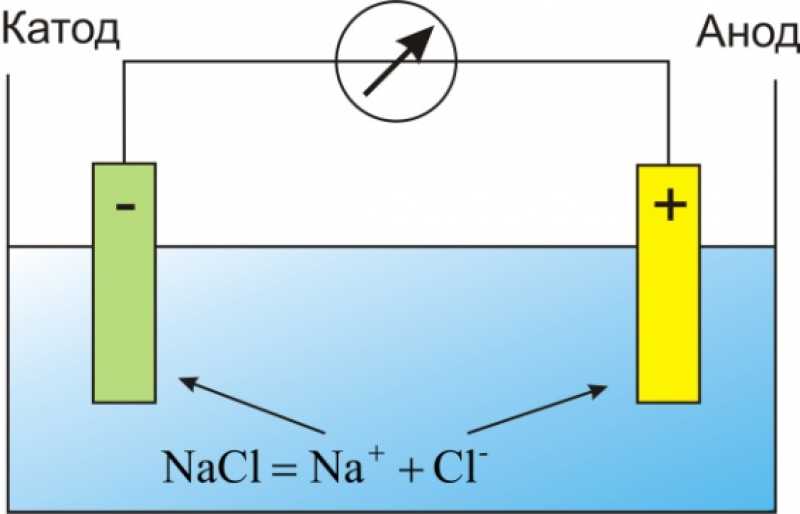 Обзор.
Обзор. М. и др.
IEEE Trans Biomed Eng. 2014 март;61(3):900-10. doi: 10.1109/TBME.2013.22.
IEEE Trans Biomed Eng. 2014.
PMID: 24557691
Бесплатная статья ЧВК.
М. и др.
IEEE Trans Biomed Eng. 2014 март;61(3):900-10. doi: 10.1109/TBME.2013.22.
IEEE Trans Biomed Eng. 2014.
PMID: 24557691
Бесплатная статья ЧВК.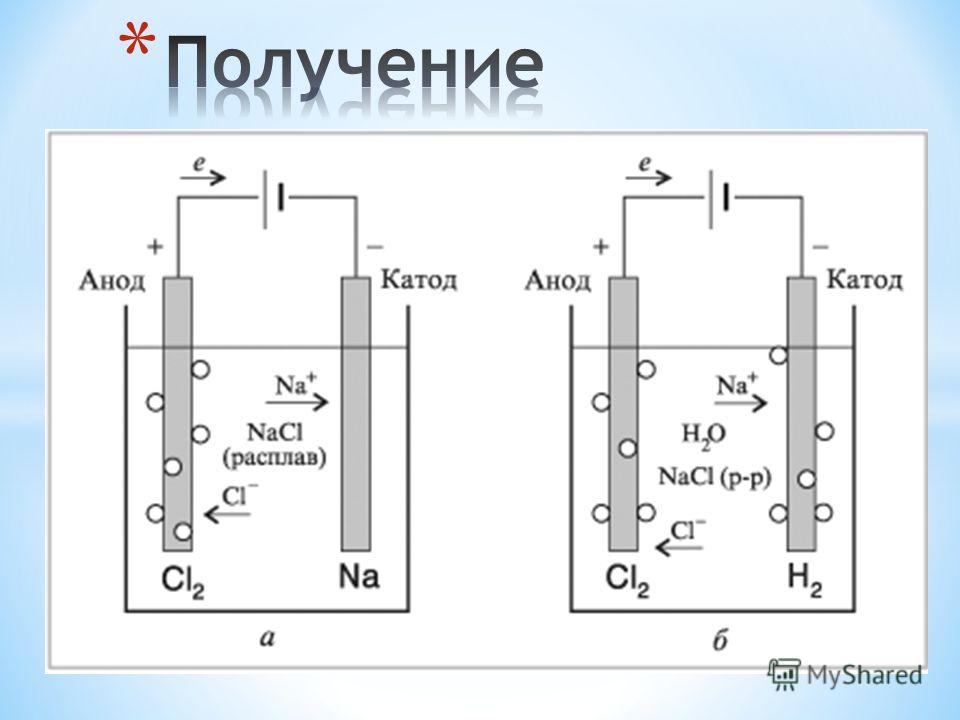
 Основное различие между анодом и катодом заключается в том, что, как правило, анод — это клемма, через которую (обычный) ток течет в устройство извне , тогда как катод — это клемма, где (обычный) ток выходит из устройства. . Однако в некоторых случаях использование строго не соблюдается, потому что, когда устройство может подвергаться обратимому процессу, тот же вывод, который назывался «анод», теперь может называться «катодом». Несомненно, это может привести к путанице, и рекомендуется адаптироваться к общему использованию в конкретной области. В этой статье мы рассмотрим несколько сценариев, в которых используются эти термины, и исследуем их использование с точки зрения процессов, происходящих в этих устройствах.
Основное различие между анодом и катодом заключается в том, что, как правило, анод — это клемма, через которую (обычный) ток течет в устройство извне , тогда как катод — это клемма, где (обычный) ток выходит из устройства. . Однако в некоторых случаях использование строго не соблюдается, потому что, когда устройство может подвергаться обратимому процессу, тот же вывод, который назывался «анод», теперь может называться «катодом». Несомненно, это может привести к путанице, и рекомендуется адаптироваться к общему использованию в конкретной области. В этой статье мы рассмотрим несколько сценариев, в которых используются эти термины, и исследуем их использование с точки зрения процессов, происходящих в этих устройствах. Это означает, что электронов втекают в этот терминал извне.
Это означает, что электронов втекают в этот терминал извне. Медь восстанавливается (приобретает электроны):
Медь восстанавливается (приобретает электроны): Здесь эти ионы отдают свои электроны, образуя газообразный хлор.
Здесь эти ионы отдают свои электроны, образуя газообразный хлор. Однако, поскольку то, как токи текут в разных ситуациях, может быть совершенно разным, перевод использования этих терминов из одной ситуации в другую может привести к путанице. Поэтому может быть необходимо сначала изучить ситуацию, чтобы правильно использовать терминологию. По возможности следует использовать альтернативные, менее двусмысленные термины (в зависимости от ситуации). Мы обсудили два конкретных примера из электрохимии, но термины «анод» и «катод» используются и во многих других областях. Еще несколько примеров упомянуты в сводном разделе ниже.
Однако, поскольку то, как токи текут в разных ситуациях, может быть совершенно разным, перевод использования этих терминов из одной ситуации в другую может привести к путанице. Поэтому может быть необходимо сначала изучить ситуацию, чтобы правильно использовать терминологию. По возможности следует использовать альтернативные, менее двусмысленные термины (в зависимости от ситуации). Мы обсудили два конкретных примера из электрохимии, но термины «анод» и «катод» используются и во многих других областях. Еще несколько примеров упомянуты в сводном разделе ниже.
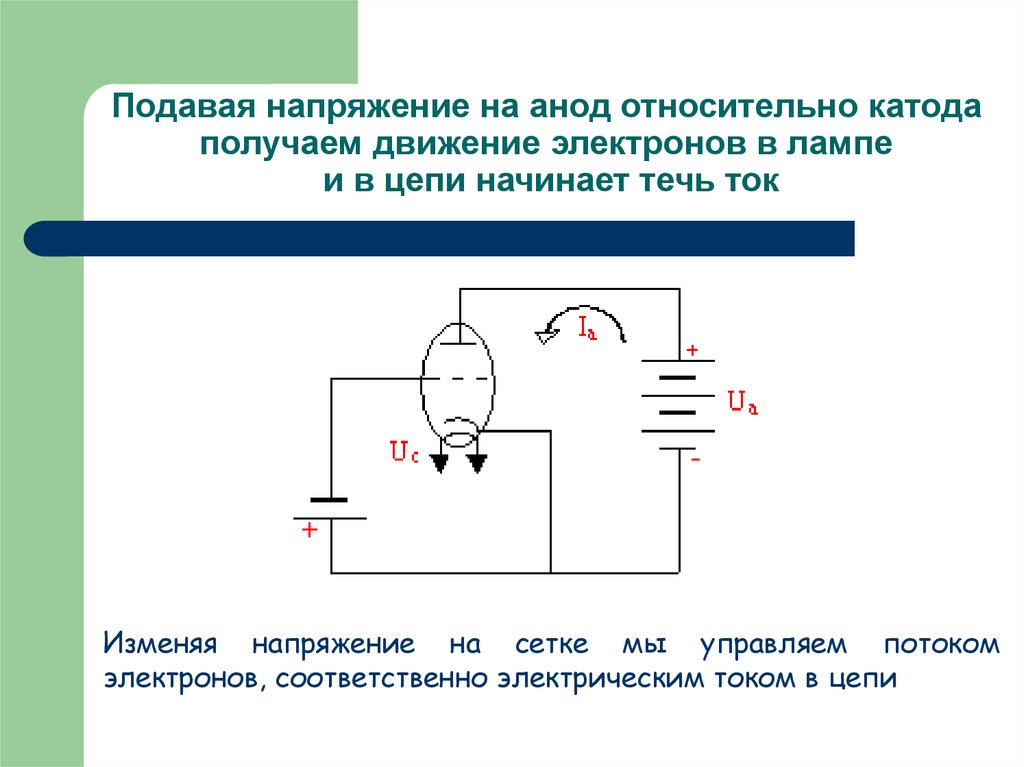
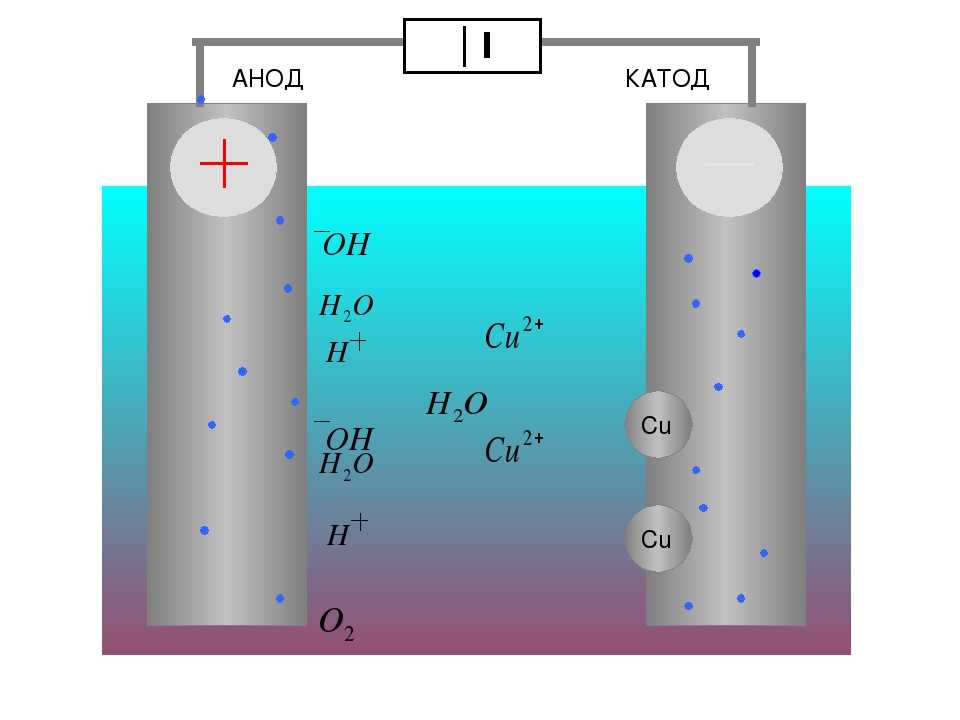 wikipedia; передано в Commons пользователем: авиабаза Берпельсон с использованием CommonsHelper) [CC BY-SA 3.0], через Wikimedia Commons
wikipedia; передано в Commons пользователем: авиабаза Берпельсон с использованием CommonsHelper) [CC BY-SA 3.0], через Wikimedia Commons ..] l a pi la: El nodo, e l ctodo y el el ectro li to.
..] l a pi la: El nodo, e l ctodo y el el ectro li to.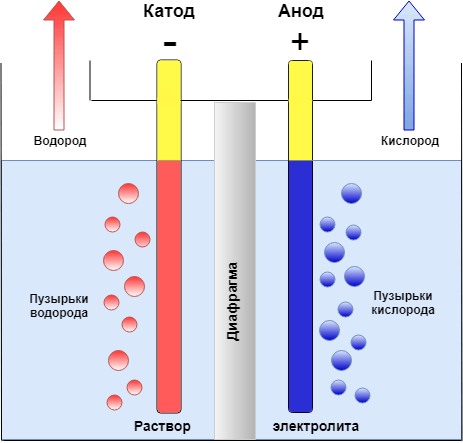 ..]
..]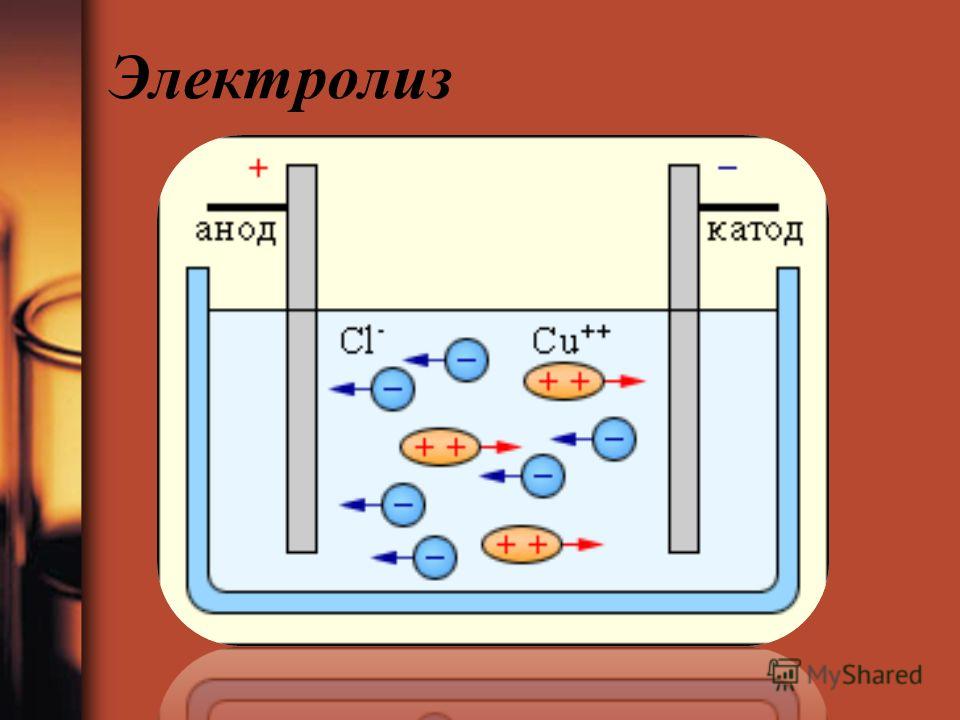
 ..]
..]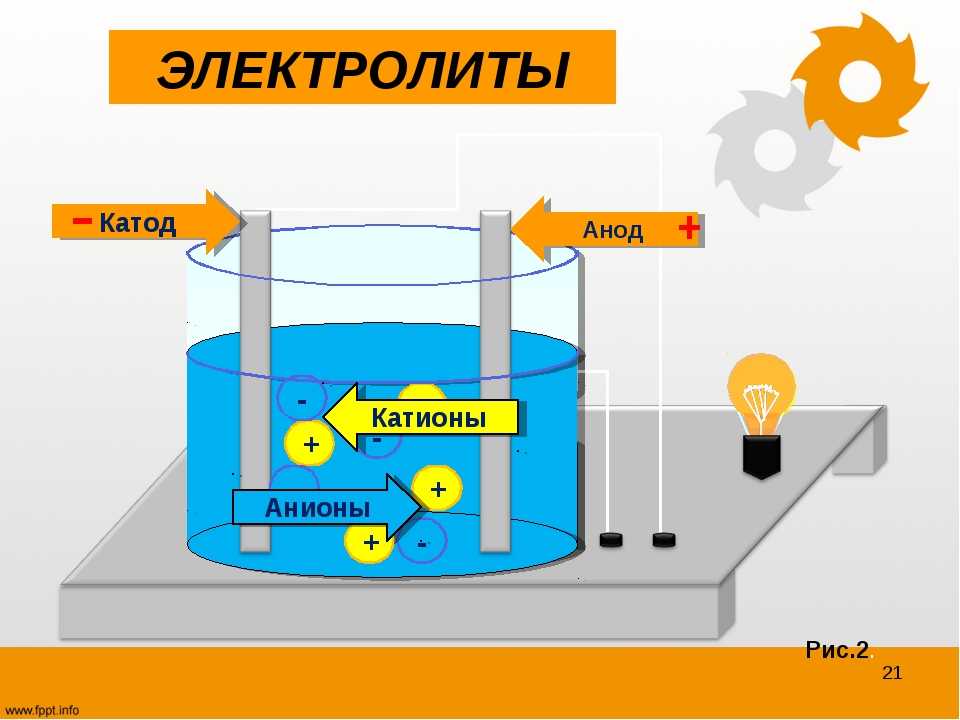 com
com ..]
..]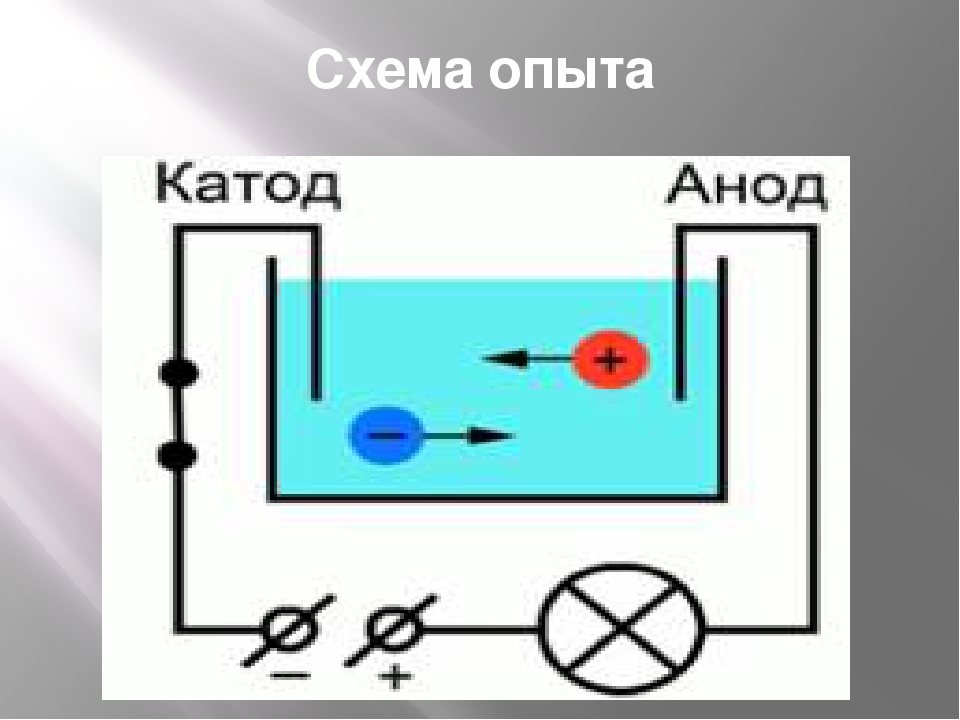 com.co
com.co
 вход
вход ..]
..]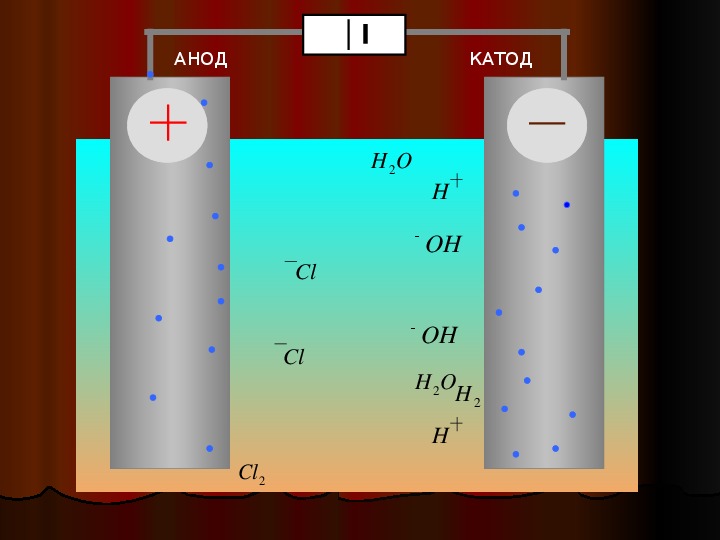
 ..]
..] ..]
..]