В вакуумном диоде ток идёт только в одном направлении – от анода к катоду. При этом электроны, образующие ток, движутся от катода к аноду. Диод обладает односторонней электрической проводимостью.
При неизменном токе накала, то есть при постоянной температуре катода, сила анодного тока Ia зависит от анодного напряжения Ua . При постепенном повышении анодного напряжения сила анодного тока растёт до определённого значения, после чего она остаётся неизменной, несмотря на дальнейшее увеличение анодного напряжения. Основной характеристикой диода является его анодная характеристика или вольт-амперная характеристика диода, которая показывает зависимость анодного тока диода от анодного напряжения при неизменном напряжении накала.
Анодная характеристика вакуумного диода показана на рис. 5. Она имеет три участка.
Первый, нелинейный участок.
 На начальном участке анодной характеристики
ток медленно возрастает при увеличении
напряжения на аноде, что объясняется
противодействием электрическому полю
анода объёмного отрицательного заряда
электронного
облака.
На начальном участке анодной характеристики
ток медленно возрастает при увеличении
напряжения на аноде, что объясняется
противодействием электрическому полю
анода объёмного отрицательного заряда
электронного
облака.
Рис. 5 – Анодная характеристика вакуумного диода. Ia – сила анодного тока, Ua – анодное напряжение, то есть напряжение между анодом и катодом, Uн – напряжение накала катода.
При анодном напряжении, равном нулю, вылетевшие из катода электроны образуют вокруг него отрицательный пространственный заряд, называемый электронным облаком, который отталкивает вылетающие из нагретого катода электроны. Большая их часть возвращается на катод и лишь незначительному числу электронов удается долететь до анода. Поэтому даже при анодном напряжении
 Поэтому вольт-амперная
характеристика диода начинается чуть
левее начала координат, что обычно не
показывают на рисунках (графиках).
Поэтому вольт-амперная
характеристика диода начинается чуть
левее начала координат, что обычно не
показывают на рисунках (графиках).С увеличением положительного анодного напряжения увеличивается число электронов, переносимых на анод, и электронное облако около катода постепенно уменьшается. Сила анодного тока растёт с увеличением напряжения экспоненциально, что обусловлено разбросом начальных скоростей вылетевших их катода электронов.
2. Второй участок анодной характеристики описывается законом Ленгмюра – Богуславского или «законом трёх вторых», согласно которому зависимость силы анодного тока от напряжения определяется выражением
Здесь k — постоянная, зависящая от материала, температуры, площади катода и от расстояния между катодом и анодом.
Третий участок — участок насыщения. При дальнейшем увеличении напряжения на аноде рост тока замедляется, а затем полностью прекращается, так как все электроны, вылетающие из катода, достигают анода.

Этот участок характеристики описывается законом Ричардсона – Дешмана, определяемый формулой (1):
Принцип устройства и работы электро-вакуумных приборов
Анод лампы принимает на себя поток электронов. Происходит электронная бомбардировка анода, от которой он нагревается.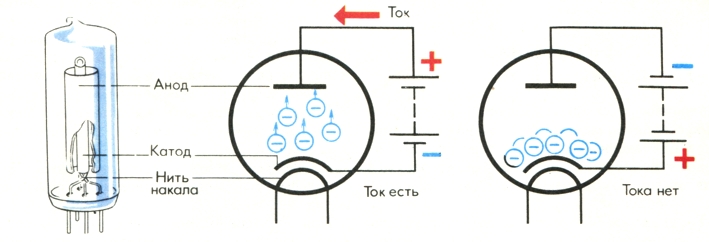 Кроме того,
анод нагревается от теплового излучения катода. В установившемся режиме количество теплоты,
выделяющееся на аноде, равно количеству теплоты, отводимому от анода.
Кроме того,
анод нагревается от теплового излучения катода. В установившемся режиме количество теплоты,
выделяющееся на аноде, равно количеству теплоты, отводимому от анода.
У ламп малой мощности и большинства ламп средней мощности анод имеет лучистое охлаждение. Теплота отводится излучением анода. Для усиления теплового излучения увеличивают площадь поверхности анода (часто снабжают ребрами) и делают ее черной или матовой. В лампах средней и большой мощности иногда применяется принудительное охлаждение потоком воздуха. Вывод анода снабжается радиатором, который обдувается вентилятором. У ламп большой мощности применяется также принудительное охлаждение анода проточной водой.
Различные конструкции сеток (цилиндрическая, плоская и др. ) показаны на рис. 15.9.
) показаны на рис. 15.9.
Работа ламп ухудшается, если сетка, нагреваясь от накаленного катода, начинает испускать термоэлектроны. Для устранения этого явления проводники сетки покрывают слоем металла с большой работой выхода, например золота.
Чтобы эффективно управлять электронным потоком, сетку располагают очень близко к катоду.
Вакуум в лампах необходим прежде всего потому, что накаленный катод при наличии воздуха сгорит. Кроме того, молекулы газов не должны мешать свободному полету электронов. Высокий вакуум в лампах характеризуется давлением менее 100 мкПа. Если вакуум недостаточный, то летящие электроны ударяют в молекулы газов и превращают их в положительные ионы, которые бомбардируют и разрушают катод. Ионизация газов увеличивает также инерционность и нестабильность работы лампы и создает дополнительные шумы.
Рис. 15.9. Конструкции сеток в триоде
Предварительную откачку воздуха производят форвакуумными насосами, затем продолжают высоковакуумными насосами. Кроме
того, обезгаживают электроды путем нагрева их до красного каления. Лампу помещают в переменное магнитное поле, индуцирующее
в электродах вихревые токи, которые разогревают металл.
Кроме
того, обезгаживают электроды путем нагрева их до красного каления. Лампу помещают в переменное магнитное поле, индуцирующее
в электродах вихревые токи, которые разогревают металл.
Для улучшения вакуума в лампу помещают газопоглотитель (геттер), например кусочек магния или бария. При разогреве лампы указанным выше индукционным способом газопоглотитель испаряется и после охлаждения оседает на стекле баллона, покрывая его зеркальным слоем (магний) или коричневато-черным (барий). Этот слой поглощает газы, которые могут выделиться из электродов в процессе работы лампы.
Размеры баллона лампы зависят от ее мощности. Чтобы температура баллона не стала недопустимо высокой, увеличивают площадь его поверхности. Наиболее часто применяют стеклянные баллоны, но у керамических значительно выше термостойкость и механическая прочность.
Металлические (стальные) баллоны имеют большую прочность и обеспечивают хорошее экранирование лампы от внешних электрических и
магнитных полей. Но они сильно нагреваются, и это приводит к перегреву электродов.
Но они сильно нагреваются, и это приводит к перегреву электродов.
В последние годы выпуск ламп с металлическими баллонами прекращен.
В лампах старого типа электроды укреплены на стеклянной ножке в виде трубки, сплющенной на одном конце (рис. 15.10, а). В эту ножку впаяны проволочки из металла, имеющего одинаковый со стеклом температурный коэффициент расширения. Концы выводных проволочек приварены к проводникам, идущим к контактным штырькам цоколя.
Держатели электродов крепятся в слюдяных или керамических пластинах-изоляторах, благодаря чему фиксируется расстояние между электродами (рис. 15.10, б).
У ламп пальчиковой серии и ряда других электроды монтируются на плоской ножке, представляющей собой утолщенное стеклянное
основание баллона. В ножку впаяны проводники (рис. 15.10, в), которые снаружи выполняют роль контактных штырьков, а внутри
лампы являются держателями электродов. Катод прямого накала обычно натягивается с помощью пружинки (рис. 15.10, г), чтобы
он не провисал при удлинении от нагрева.
В лампах имеются еще некоторые вспомогательные детали. К ним относятся держатели для геттера, электростатические экраны, устраняющие емкостные токи между отдельными часгями лампы или защищающие лампу от воздействия внешних электрических полей.
Рис. 15.10. Крепление электродов и их выводов в стеклянных лампах
Особое внимание уделяется точности сборки и прочности крепления электродов. Но все же существует разброс электрических свойств между отдельными экземплярами ламп данного типа. Он объясняется неоднородностью деталей, их случайными деформациями при сборке, неточностью сборки, неодинаковостью эмиссии катодов у различных экземпляров ламп и другими причинами.
Система выводов от электродов, служащая для подключения лампы к схеме, называется цоколевкой лампы. Стеклянные
лампы с цоколем имеют восемь штырьков, расположенных в вершинах правильного восьмиугольника (рис. 15.11, а). В центре цоколя
находится ключ, т. е. более длинный штырек с выступом, обеспечивающий правильную установку лампы.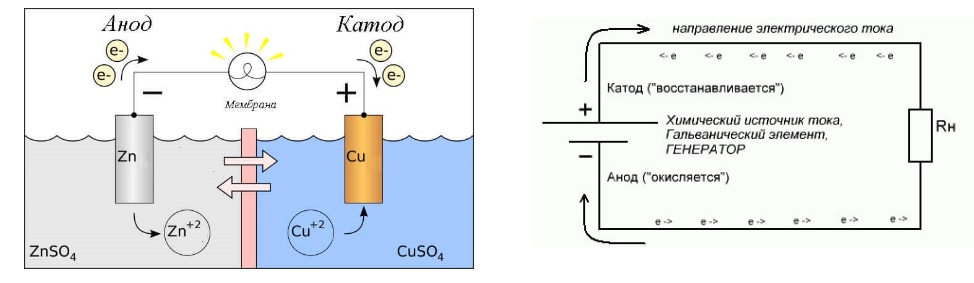 Штырьки принято
нумеровать по часовой стрелке от выступа на ключе. Электростатический экран, имеющийся внутри некоторых ламп, соединен с
одним из штырьков. У различных ламп электроды соединяются с разными штырьками. Схемы цоколевки приводятся в справочниках.
Штырьки принято
нумеровать по часовой стрелке от выступа на ключе. Электростатический экран, имеющийся внутри некоторых ламп, соединен с
одним из штырьков. У различных ламп электроды соединяются с разными штырьками. Схемы цоколевки приводятся в справочниках.
При анодных напряжениях в сотни вольт все электроды имеют выводы на цоколь. А у ламп на напряжения в тысячи вольт вывод анода часто находится наверху баллона.
Рис. 15.11. Цоколевка ламп
Выводы электродов у пальчиковых ламп сделаны в виде семи, или девяти, или десяти заостренных проводников, впаянных в плоскую ножку и расположенных соответственно в вершинах правильного многоугольника (рис. 15.11,6). Сверхминиатюрные бесцокольные лампы имеют выводы от электродов в виде проволочек. У мощных ламп выводы от электродов часто делают в разных местах баллона и на удалении друг от друга, так как напряжения между этими выводами могут быть значительными.
| >>>>> | 0 !.  ……………… ……………… | 20 !………………. | 40 !………………. | 60 !………………. | 80 !………………. | 100 !………………. | 120 !………………. |
Voltaic Cells — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 285
В окислительно-восстановительных реакциях электроны передаются от одного вида к другому. Если реакция идет самопроизвольно, высвобождается энергия, которую затем можно использовать для совершения полезной работы. Чтобы использовать эту энергию, реакцию необходимо разделить на две отдельные полуреакции: реакции окисления и реакции восстановления. Реакции помещаются в два разных контейнера, и для перемещения электронов с одной стороны на другую используется провод. При этом 9-_{3\;(aq)}\) ионы. Ионы NO 3 — (aq) можно не учитывать, так как они являются ионами-спектаторами и не участвуют в реакции. В этой реакции медный электрод помещают в раствор, содержащий ионы серебра. Ag + (водн.) легко окисляет Cu (тв.) , в результате чего получается Cu 2 + (водн.), , при этом восстанавливаясь до Ag (тв.) .
Реакции помещаются в два разных контейнера, и для перемещения электронов с одной стороны на другую используется провод. При этом 9-_{3\;(aq)}\) ионы. Ионы NO 3 — (aq) можно не учитывать, так как они являются ионами-спектаторами и не участвуют в реакции. В этой реакции медный электрод помещают в раствор, содержащий ионы серебра. Ag + (водн.) легко окисляет Cu (тв.) , в результате чего получается Cu 2 + (водн.), , при этом восстанавливаясь до Ag (тв.) .
Эта реакция высвобождает энергию. Однако, когда твердый медный электрод помещается непосредственно в раствор нитрата серебра, энергия теряется в виде тепла и не может быть использована для выполнения работы. Чтобы использовать эту энергию и использовать ее для полезной работы, мы должны разделить реакцию на две отдельные полуреакции; Реакции окисления и восстановления. Провод соединяет две реакции и позволяет электронам течь с одной стороны на другую. При этом мы создали Гальванический/гальванический элемент .
При этом мы создали Гальванический/гальванический элемент .
Figure \(\PageIndex{1}\): Элемент Вольта
Элемент Вольта (также известный как гальванический элемент) представляет собой электрохимический элемент, который использует спонтанные окислительно-восстановительные реакции для выработки электроэнергии. Он состоит из двух отдельных полуячеек . Полуячейка состоит из электрода (полоска металла М) в растворе, содержащем ионы М n+ , где М — любой произвольный металл. Две полуэлемента соединены между собой проводом, идущим от одного электрода к другому. Солевой мост также соединяется с полуклетками. Функции этих частей обсуждаются ниже.
Полуячейки
Половина окислительно-восстановительной реакции происходит в каждой половине ячейки. Поэтому можно сказать, что в каждой полуклетке происходит полуреакция. Когда две половины соединяются проволокой и соляным мостом, создается электрохимическая ячейка.
Электроды
Электрод представляет собой полоску металла, на которой происходит реакция. В гальваническом элементе окисление и восстановление металлов происходит на электродах. В гальваническом элементе два электрода, по одному в каждой полуэлементе. 9Катод 0024 — это место, где происходит восстановление, а окисление происходит на аноде .
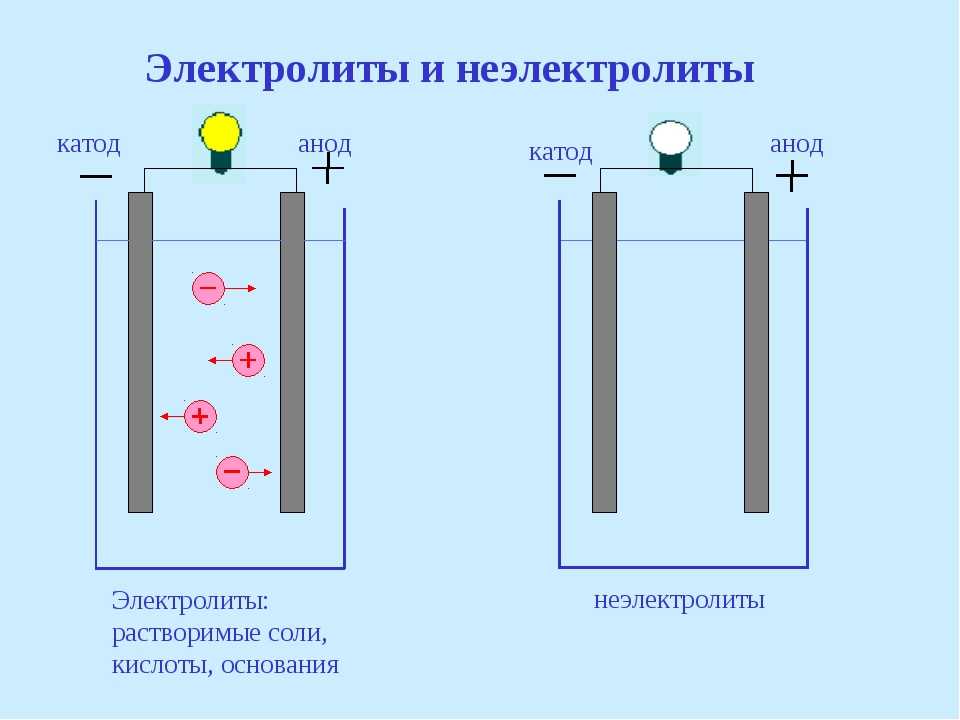
С помощью электрохимии эти реакции реагируют на металлических поверхностях или электродах. Между металлом и веществами в растворе устанавливается окислительно-восстановительное равновесие. Когда электроды погружены в раствор, содержащий ионы того же металла, это называется полуэлементом . Электролиты представляют собой ионы в растворе, обычно жидком, проводящем электричество за счет ионной проводимости. Между атомами металла на электроде и ионными растворами могут происходить два возможных взаимодействия.
- Ион металла M n + из раствора может столкнуться с электродом, получив от него «n» электронов, и превратиться в атомы металла.
 Это означает, что ионы восстановлены.
Это означает, что ионы восстановлены. - Атом металла на поверхности может отдать «n» электронов электроду и войти в раствор в виде иона M n + , что означает окисление атомов металла.
Когда электрод окисляется в растворе, он называется анодом и когда электрод восстанавливается в растворе. это называется 9катод 0024.
- Анод : На аноде протекает реакция окисления. Другими словами, именно здесь металл теряет электроны. В приведенной выше реакции анодом является Cu (s), поскольку его степень окисления увеличивается от 0 до +2.
- Катод : На катоде протекает реакция восстановления. Именно здесь металлический электрод получает электроны. Возвращаясь к приведенному выше уравнению, катодом является Ag (s), поскольку его степень окисления уменьшается с +1 до 0,9.0010
Вспоминая об окислении и восстановлении
Когда дело доходит до окислительно-восстановительных реакций, важно понимать, что значит для металла быть «окисленным» или «восстановленным».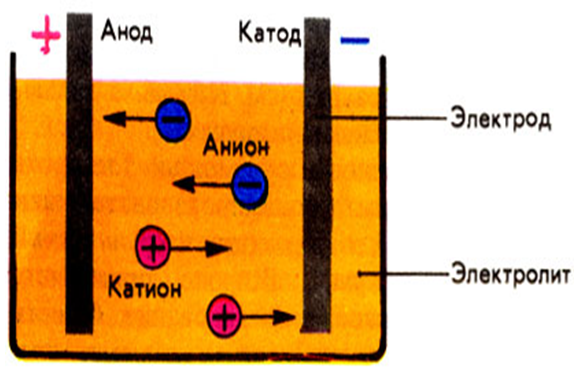 +_{(aq)}\) получает электрон, что означает его уменьшение. \(Cu_{(s)}\) теряет два электрона, таким образом, он окисляется.
+_{(aq)}\) получает электрон, что означает его уменьшение. \(Cu_{(s)}\) теряет два электрона, таким образом, он окисляется.
Соляной мост является жизненно важным компонентом любого гальванического элемента. Это трубка, заполненная раствором электролита, таким как KNO 3(s) или KCl (s) . Цель солевого мостика состоит в том, чтобы сохранять растворы электрически нейтральными и обеспечивать свободный поток ионов из одной клетки в другую. Без солевого мостика вокруг электродов будут накапливаться положительные и отрицательные заряды, что приведет к остановке реакции.
Назначение солевого мостика состоит в том, чтобы сохранять растворы электрически нейтральными и обеспечивать свободный поток ионов из одной клетки в другую.
Поток электронов
Электроны всегда текут от анода к катоду или от полуэлемента окисления к полуэлементу восстановления. С точки зрения ячейки полуреакции E o электроны будут течь от более отрицательной полуреакции к более положительной полуреакции.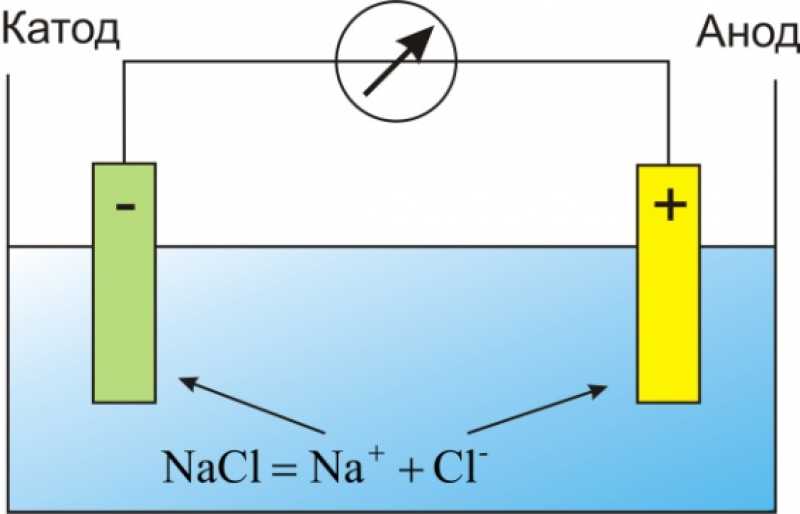 Диаграмма ячейки представляет собой представление электрохимической ячейки. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\) выше.
Диаграмма ячейки представляет собой представление электрохимической ячейки. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\) выше.
Рисунок \(\PageIndex{2}\): Диаграмма ячеек. На рисунке ниже показана диаграмма ячеек для гальванического элемента, показанного на рисунке \(\PageIndex{1}\).
При рисовании клеточной диаграммы мы придерживаемся следующих соглашений. Анод всегда размещается с левой стороны , а катод размещается с правой стороны . Соляной мост представлен двойными вертикальными линиями (||). Разница в фазе элемента представлена одной вертикальной линией (|), а изменения в степенях окисления представлены запятыми (,). 9o_{ячейка}\) для гальванического элемента, образованного каждой реакцией.
Раствор
1.a) Ba 2+ (aq) → Ba (s) + 2e- с SRP (для противоположной реакции) E o = -2,92 В, где анод происходит окисление)
Cu 2+ (водн. ) + 2e- → Cu (тв) с SRP E o = +0,340 В (Катод; где происходит восстановление)
) + 2e- → Cu (тв) с SRP E o = +0,340 В (Катод; где происходит восстановление)
1b002 Al 3+ (водн.) → Al (s) + 3e — с SRP (для противоположной реакции) E o = -1,66 В (Анод; где происходит окисление)
Sn 2+ (водн.) +2e → Sn (s) с SRP E o = -0,137 В (катод; где происходит восстановление)
2.a) Ba 2+ (водн.) | Ва (с) || Cu (с) | Cu 2+ (водный)
2.b) Al (s) | Al 3+ (водный) || Sn 2+ (водный) | Sn (s)
3.a) E o ячейка = 0,34 — (-2,92) = 3,26 В
3.b) E o — ячейка ) = 1,523 В
Напряжение ячейки/потенциал ячейки
Показания вольтметра дают реакцию напряжения ячейки или разность потенциалов между двумя полуячейками. Напряжение ячейки также известно как 9o_{анод}\]
Напряжение ячейки также известно как 9o_{анод}\]
Значения E o приведены в таблице для всех растворенных веществ при 1 М и всех газов при 1 атм. Эти значения называются стандартными восстановительными потенциалами . Каждая полуреакция имеет различный восстановительный потенциал, разность двух восстановительных потенциалов дает напряжение электрохимической ячейки. Если клетка E o положительна, реакция идет самопроизвольно и это гальваническая ячейка. Если в ячейке E или отрицательный результат, то реакция не является самопроизвольной, и ее называют электролитической ячейкой.
Ссылки
- Брейди, Джеймс Э., Холум, Джон Р. «Химия: изучение материи и ее изменений», John Wiley & Sons Inc., 1993
- Brown, Theodore L., LeMay, H. Eugene Jr. «Химия: центральная наука», третье издание, Prentice-Hall, Inc. Englewood Cliffs, NJ 07632 1985
- Браун, Теодор Л., ЛеМэй, Х. Юджин мл., Берстен, Брюс Э.
 «Химия: центральная наука», пятое издание, Prentice-Hall, Inc. Englewood Cliffs, N.J. 07632 1991
«Химия: центральная наука», пятое издание, Prentice-Hall, Inc. Englewood Cliffs, N.J. 07632 1991 - Гессер, Хайман Д. «Описательные принципы химии», C.V. Компания Мосби 1974
- Harwood, William, Herring, Geoffrey, Madura, Jeffry, and Petrucci, Ralph, General Chemistry: Principles and Modern Applications, Ninth Edition, Upper Saddle River, New Jersey, Pearson Prentice Hall, 2007.
- Петруччи, Ральф Х. Общая химия: принципы и современные приложения, 9-е изд. Нью-Джерси: Pearson Education Inc., 2007. .
- Вассос Бэзил Х. Электроаналитическая химия. Нью-Йорк: Публикация Wiley-Interscience. 1983.
- Зумдал, Стивен С. Химия, 7-е изд. Нью-Йорк: Компания Houghton Mifflin. 2007.
Авторы и ссылки
- Шамшер Сингх, Дебора Го
Voltaic Cells распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- гальванические элементы
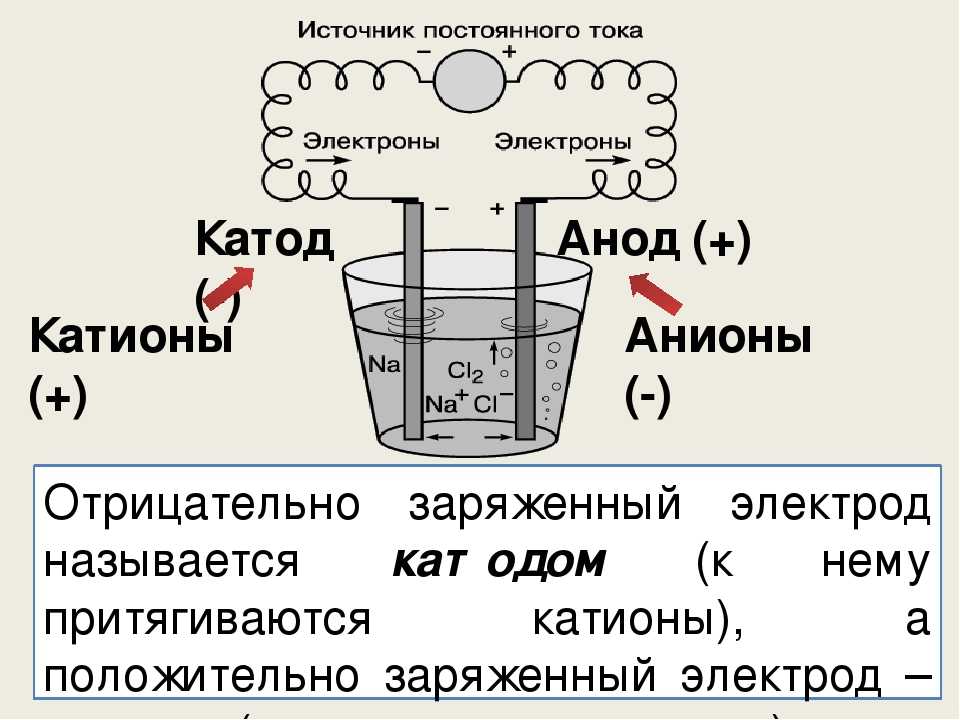
Катод и анод — определение, примеры и основные различия
Прежде чем мы узнаем о катоде и аноде, нам нужно сначала понять, что такое электрод. Согласно общему определению, электрод — это вещество, которое способствует проводимости электричества, при котором электрический ток либо входит, либо выходит из неметаллической среды, как электролитическая ячейка.
Говоря простым языком, электрод представляет собой проводник, который помогает в установлении электрического контакта с неметаллической частью цепи. Электроды состоят из двух основных точек, известных как катод и анод , которые в основном описывают направление тока.
Что такое катод и анод?
Давайте разберемся, что именно означают катод и анод.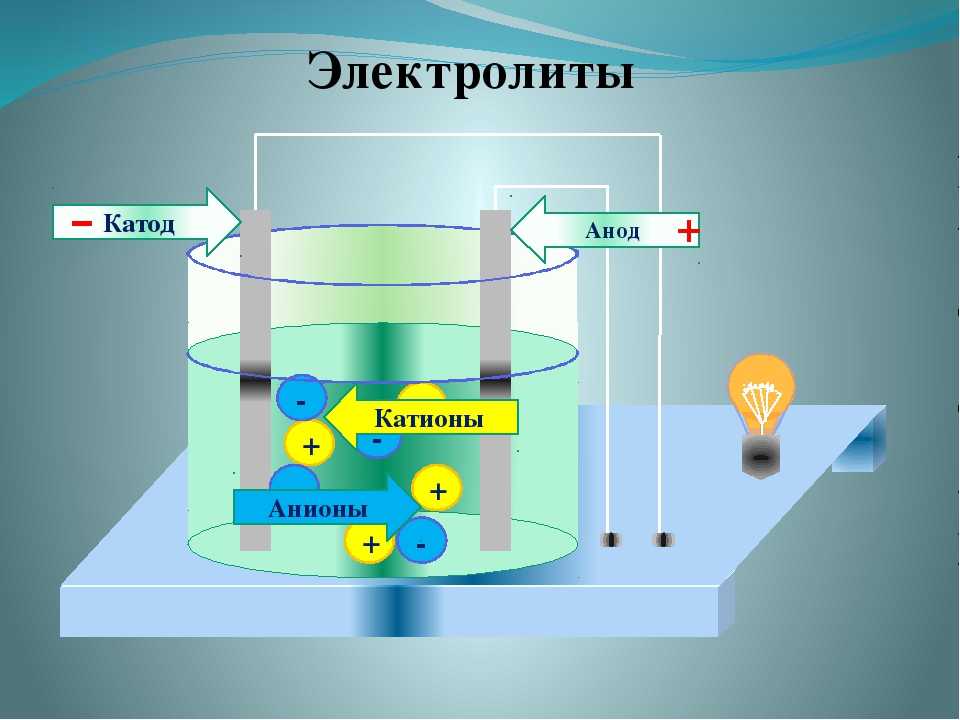 Они оба определяются потоком тока. Следовательно, катод — это электрод, с которого ток выходит из поляризованного электрического устройства. Точно так же анод представляет собой электрод, от которого ток поступает в поляризованное электрическое устройство.
Они оба определяются потоком тока. Следовательно, катод — это электрод, с которого ток выходит из поляризованного электрического устройства. Точно так же анод представляет собой электрод, от которого ток поступает в поляризованное электрическое устройство.
Термины были доработаны в 1834 году Уильямом Уэвеллом , который адаптировал слова из греческого слова (kathodos), «спуск» или «путь вниз». Уильям консультировался с Майклом Фарадеем по поводу создания терминов.
Катод
Когда мы говорим о катоде в химии, говорят, что это электрод, на котором происходит восстановление. Обычно используется в гальваническом элементе. Здесь катод отрицателен, поскольку электрическая энергия, подводимая к ячейке, приводит к разложению химических соединений. Однако он также может быть положительным, как в случае с гальваническим элементом, где химическая реакция приводит к выработке электрической энергии.
Кроме того, считается, что катод представляет собой горячий катод или холодный катод . Катод, который нагревается в присутствии нити накала для испускания электронов за счет термоэлектронной эмиссии, известен как горячий катод, тогда как холодные катоды не нагреваются никакой нитью. Катод обычно помечается как «холодный», если он испускает больше электронов, чем электронов, генерируемых только термоэлектронной эмиссией.
Анод
В самой простой форме анодом в электрохимии является точка 9.0069 где протекает реакция окисления . Как правило, на аноде отрицательные ионы или анионы из-за его электрического потенциала имеют тенденцию вступать в реакцию и испускать электроны. Затем эти электроны движутся вверх и попадают в управляющую цепь.
Если мы возьмем гальванический элемент, анод по своей природе будет отрицательным, и электроны в основном движутся к внешней части цепи.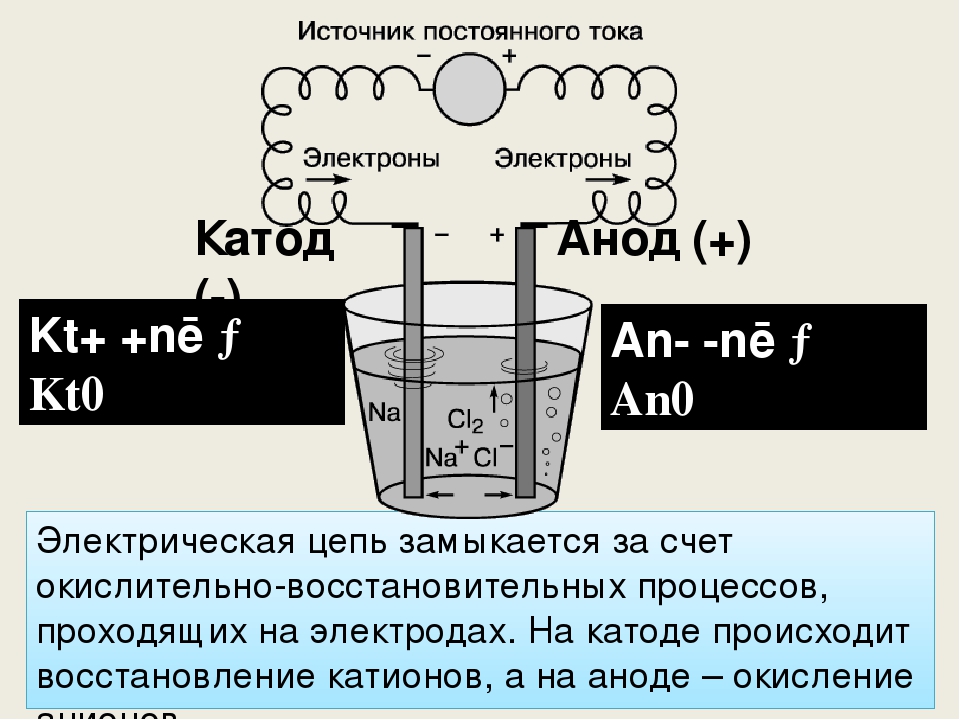 В электролитической ячейке он снова положительный . Кроме того, анодом может быть пластина или проволока, имеющие избыточный положительный заряд.
В электролитической ячейке он снова положительный . Кроме того, анодом может быть пластина или проволока, имеющие избыточный положительный заряд.
Разница между анодом и катодом
Вот некоторые ключевые различия между катодом и анодом.
| Анод | Катод |
| Анод — это электрод, через который проходит электричество. | Катод — это электрод, через который выдается или вытекает электричество. |
| Анод обычно положительный. | Катод — отрицательная сторона. |
| Действует как донор электронов. | Действует как акцептор электронов. |
| В электролизере реакция окисления протекает на аноде. | В электролитической ячейке на катоде протекает реакция восстановления. |
| В гальванических элементах анод может стать катодом. | В гальванических элементах катод может стать анодом.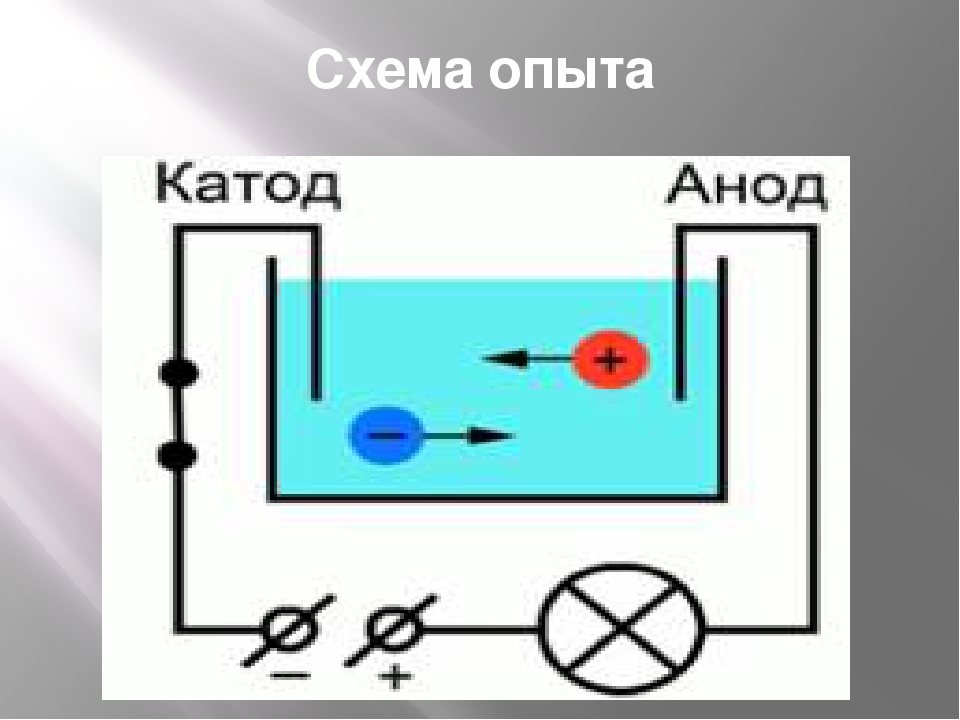 |
Часто задаваемые вопросы
Каков заряд анода и катода?
В гальваническом элементе анод считается отрицательным, а катод считается положительным. Это кажется уместным, потому что анод является источником электронов, а место, где текут электроны, является катодом.
Происходит ли окисление на аноде или катоде?
На аноде происходит реакция на окисление. Другими словами, именно здесь металл теряет электроны.
Какой заряд на аноде и катоде?
Окислительная реакция на аноде. Окисленные частицы потеряли бы электроны, оставив этот электрод с накоплением электронов. Следовательно, анод заряжается отрицательно. В отличие от катода, существует восстановительная реакция, при которой восстановленные частицы получают электроны. Следовательно, электрод, то есть катод, не имеет электронов и поэтому заряжен положительно.
Катионы положительные или отрицательные?
Катион определяется как положительно заряженный ион или атом, потерявший электрон.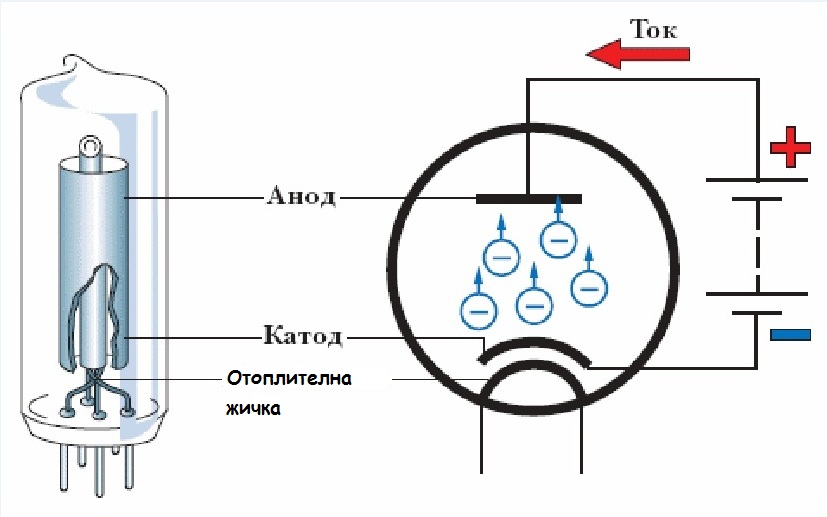


 На начальном участке анодной характеристики
ток медленно возрастает при увеличении
напряжения на аноде, что объясняется
противодействием электрическому полю
анода объёмного отрицательного заряда
электронного
облака.
На начальном участке анодной характеристики
ток медленно возрастает при увеличении
напряжения на аноде, что объясняется
противодействием электрическому полю
анода объёмного отрицательного заряда
электронного
облака.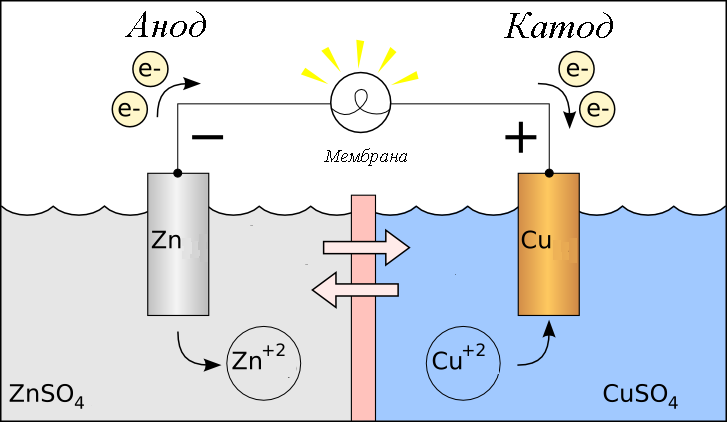
 Это означает, что ионы восстановлены.
Это означает, что ионы восстановлены.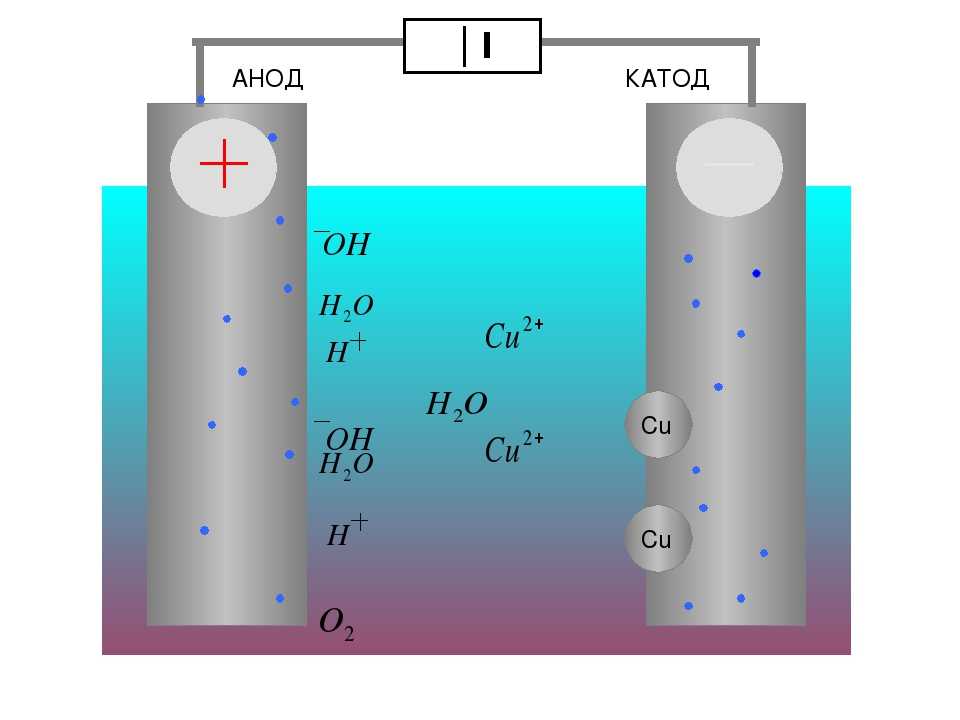 «Химия: центральная наука», пятое издание, Prentice-Hall, Inc. Englewood Cliffs, N.J. 07632 1991
«Химия: центральная наука», пятое издание, Prentice-Hall, Inc. Englewood Cliffs, N.J. 07632 1991