Электрический ток в электролитах – природа носителей заряда
4.7
Средняя оценка: 4.7
Всего получено оценок: 78.
4.7
Средняя оценка: 4.7
Всего получено оценок: 78.
Электролиты – вещества, растворы или расплавы которых способны проводить электричество. Движение электрического тока в электролитах называется электролизом.
Передача электричества
Электрический ток – это упорядоченное движение заряженных частиц. Носителями заряда электрического тока в электролитах являются ионы. Они образуются в результате распада (электролитической диссоциации) молекул вещества под действием молекул воды в растворе или при нагревании и образовании расплава.
Расщепление молекул происходит за счёт разрыва полярных ковалентных или ионных связей. Интенсивность диссоциации зависит от температуры и концентрации раствора. Также на степень диссоциации влияет природа электролита. В связи с этим выделяют:
- слабые электролиты, распадающиеся частично или не распадающиеся вообще;
- сильные электролиты, быстро распадающиеся на ионы.

К слабым электролитам относится большинство органических веществ, слабые кислоты, плохо растворимые соли и нерастворимые основания. Сильные кислоты, щёлочи, соли относятся к сильным электролитам.
Рис. 1. Процесс электролитической диссоциации.Образованные в результате диссоциации ионы делятся на два типа:
- катионы – положительно заряженные частицы;
- анионы – отрицательно заряженные частицы.
Проводником электрического тока в электролитах является электрод. Он может быть анодом или катодом. Анод присоединён к положительному полюсу источника тока, катод – к отрицательному. Анод окисляет вещества, находящиеся в электролите, катод – восстанавливает.
Если в раствор электролита поместить два электрода – катод и анод – и включить электрический ток, то ионы начнут двигаться под действием электрического поля. Катионы устремятся к катоду, анионы – к аноду. Достигнув электродов, ионы нейтрализуются, превращаются в нейтральные атомы и оседают.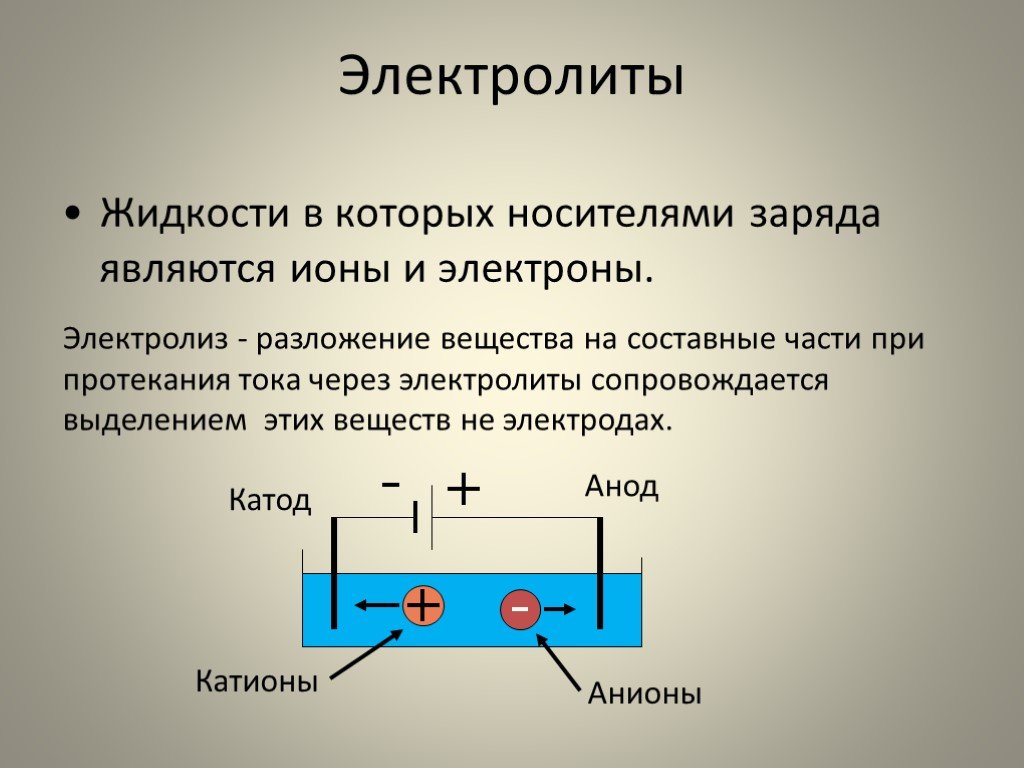
Процесс разложения вещества на составные части, которые оседают на электродах, называется электролизом.
Закон Фарадея
Процесс электролиза экспериментально изучил английский физик и химик Майкл Фарадей в 1833 году. Он сформулировал закон, согласно которому масса выделившегося на электроде вещества прямо пропорциональна прошедшему через электролит заряду. Этот закон закрепился в науке как первый закон Фарадея.
m = kQ = kIt,
где:
- m – масса вещества;
- Q – заряд;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время действия тока.
Согласно второму закону Фарадея масса выделившегося на электроды вещества прямо пропорциональна отношению молярной массы к валентности и равна электрохимическому эквиваленту.
m = k = M/z,
где:
- m – масса выделившегося вещества;
- k – электрохимический эквивалент;
- M – молярная масса;
- z – валентность вещества.

Электролиз используется в щелочных и кислотных аккумуляторах. С помощью электролиза можно защитить изделие металлическим покрытием.
Что мы узнали?
Электрический ток в электролитах передают ионы, образовавшиеся в результате электролитической диссоциации. Положительно заряженные ионы – катионы – движутся к отрицательно заряженному электроду – катоду. Отрицательно заряженные анионы устремятся к положительно заряженному электроду – аноду. Достигнув электрода, ионы нейтрализуются, превращаясь в атомы вещества, и оседают на электродах. Это явление было изучено Майклом Фарадеем и получило название электролиза.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Лидия Маслова
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 78.
А какая ваша оценка?
Электрический ток в электролитах — материалы для подготовки к ЕГЭ по Физике
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: носители свободных электрических зарядов в жидкостях.
Электролитом мы называем раствор (или расплав) вещества, через который может идти электрический ток; при этом исходное вещество проводником тока не является.
Например, кристаллы поваренной соли не проводят ток. Дистиллированная вода — тоже диэлектрик. Однако при растворении соли в воде получается среда, через которую ток отлично проходит! Следовательно, солёная вода будет электролитом (Вот почему запрещено купаться во время грозы — в водоёмах всегда растворено некоторое количество солей. При ударе молнии по воде пойдёт электрический ток).
Электролитами оказываются растворы солей, кислот и оснований. Прохождение тока через эти растворы означает, что в них имеются свободные заряды. Откуда же они там берутся, если ни в воде, ни в исходном веществе свободных зарядов не было?
Электролитическая диссоциация
Механизм, обеспечивающий появление свободных зарядов в электролите, называется электролитической диссоциацией. Мы ограничимся рассмотрением электролитической диссоциации в растворах.
Вообще, диссоциация — это распад молекулы на составные части под влиянием тех или иных факторов.В процессе электролитической диссоциации молекулы растворяемого вещества распадаются на положительные и отрицательные ионы в результате действия электрических сил со стороны молекул воды.
Многие свойства воды объясняются тем, что её молекулы являются полярными, то есть в электрическом отношении ведут себя как диполи (напомним, что диполь — это система двух одинаковых по модулю и противоположных по знаку зарядов, расположенных на небольшом расстоянии друг от друга). Полярность молекул обусловлена их геометрическим устройством (рис. 1 (изображение с сайта howyourbrainworks.net)).
Рис. 1. Молекулы воды
Угол, образованный линиями центров атома кислорода и двух атомов водорода, составляет примерно . Кроме того, электронные оболочки смещены в сторону кислорода. В результате центры положительных и отрицательных зарядов оказываются пространственно разделёнными: «минусы» преобладают в кислородной части молекулы воды, а «плюсы» — в водородной части.
Будучи диполями, молекулы воды создают вокруг себя электрическое поле и действуют электрическими силами как друг на друга, так и на молекулы примесей (притягиваясь друг к другу противоположно заряженными частями, молекулы воды создают весьма прочные связи. Вот почему столь велики удельная теплоёмкость и удельная теплота парообразования воды — на разрыв этих связей требуется значительная энергия).
Почему же соли, кислоты и основания распадаются в воде на ионы? Всё дело в том, что молекулы этих веществ также являются полярными. Давайте вернёмся к нашему примеру с растворением поваренной соли .
У атома натрия на внешнем электронном уровне находится один электрон. Он слабо связан с атомом и всегда готов покинуть место своего обитания. У атома хлора на внешнем электронном уровне семь электронов — одного как раз не хватает до полного комплекта. Атом хлора всегда готов захватить себе недостающий электрон.
Поэтому при образовании молекулы внешний электрон атома натрия уходит к атому хлора, и в результате молекула становится полярной — она состоит из положительного иона и отрицательного иона . Эта молекула схематически изображена на рис. 2 (атом хлора крупнее, чем атом натрия).
Эта молекула схематически изображена на рис. 2 (атом хлора крупнее, чем атом натрия).
Рис. 2. Молекула
Иными словами, с электрической точки зрения молекула также оказывается диполем.
Взаимодействие двух сортов диполей — молекул и — как раз и вызывает процесс растворения.
На рис. 3 мы видим, как протекает этот процесс (изображение с сайта intro.chem.okstate.edu). Более крупные зелёные шарики изображают ионы хлора, более мелкие серые — ионы натрия.
Рис. 3. Электролитическая диссоциация: растворение в воде
Левая часть рисунка показывает ситуацию до начала растворения. Крупица соли в виде небольшого кубического кристаллика (Кристаллическая решётка поваренной соли имеет кубическую структуру. В вершинах куба в шахматном порядке, крест-накрест расположены атомы натрия и хлора) только что оказалась в воде.
Сразу же начинается «электрическая атака» со стороны молекул воды. Отрицательно заряженные (кислородные) части молекул обращаются к положительным ионам натрия, а положительные (водородные) части молекулы воды — к отрицательным ионам хлора. Молекулы начинают «растягиваться» разнонаправленными электрическими силами притяжения к молекулам-диполям воды, и связь между ионами натрия и хлора, скрепляющая молекулу соли, ослабевает.
Молекулы начинают «растягиваться» разнонаправленными электрическими силами притяжения к молекулам-диполям воды, и связь между ионами натрия и хлора, скрепляющая молекулу соли, ослабевает.
В конце концов эта связь становится настолько слабой, что удары соседних частиц, совершающих тепловое движение, разрушают молекулу . Она распадается на положительный ион и отрицательный ион .
В правой части рис. 3 мы видим результат такого распада: вырванные из кристаллической решётки ион хлора и ион натрия отправляются «в свободное плавание», окружённые прицепившимися к ним молекулами воды. Обратите внимание, что молекулы воды прилипли к отрицательному иону хлора своими положительными водородными частями, а к положительному иону натрия, наоборот, повернулись их отрицательные кислородные части.
Таким образом, при растворении соли в воде появляются свободные заряды: положительные ионы и отрицательные ионы (рис. 4). Это и является необходимым условием прохождения тока через раствор.
Рис. 4. Раствор в воде
Описанный выше процесс растворения совершенно аналогично протекает и в случае других примесей.Так, щёлочь распадается в водном растворе на положительные ионы калия и отрицательные ионы гидроксильной группы . Молекула серной кислоты при распаде даёт два положительных иона и отрицательно заряженный ион кислотного остатка В растворе медного купороса появляются положительные ионы меди и отрицательно заряженные ионы
Все ли молекулы растворяемого вещества распадутся на ионы? Это зависит от ряда условий.
Степенью диссоциации называется отношение числа распавшихся молекул к общему начальному числу молекул. При полном растворении вещества степень диссоциации равна .
Наряду с диссоциацией имеет место и обратный процесс: рекомбинация. А именно, две частицы противоположного знака могут встретиться и снова образовать нейтральную молекулу (рекомбинировать). С течением времени в растворе устанавливается состояние динамического равновесия: среднее число диссоциаций в единицу времени равно среднему числу рекомбинаций, в результате чего концентрация раствора остаётся неизменной (вспомните аналогичную ситуацию с насыщенным паром: при динамическом равновесии пара и жидкости среднее число вылетевших из жидкости молекул равно среднему числу молекул, вернувшихся обратно из пара в жидкость, так что концентрация насыщенного пара неизменна).
Процессы диссоциации-рекомбинации записываются в виде следующих уравнений, отражающих состояние динамического равновесия:
Изменение внешних условий может нарушить текущее динамическое равновесие и сместить его в ту или иную сторону. Например, при повышении температуры увеличивается скорость диссоциации, и концентрация положительных и отрицательных ионов в растворе возрастает.
Ионная проводимость
В металлах, как вы помните, имеется лишь один тип свободных зарядов — это свободные электроны. В электролитах ситуация иная: здесь возникают свободные заряды двух типов.
1. Положительные ионы, образовавшиеся из атомов металлов или водорода.
2. Отрицательные ионы — атомные или молекулярные кислотные остатки (например, или ), а также гидроксильная группа .
Второе отличие от металлов заключается в том, что носители свободных зарядов в электролите могут иметь заряд, равный по модулю как элементарному заряду , так и целому числу элементарных зарядов .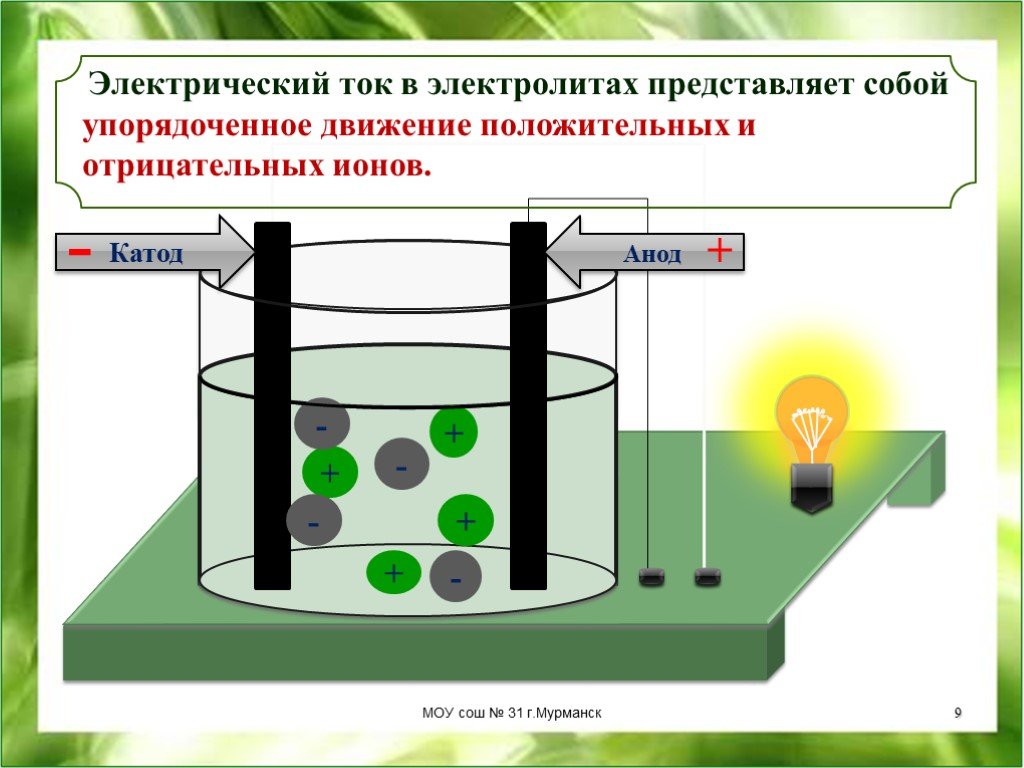 Здесь — валентность атома или группы атомов; например, при растворении медного купороса имеем .
Здесь — валентность атома или группы атомов; например, при растворении медного купороса имеем .
Если внешнего электрического поля нет, то свободные заряды электролита совершают лишь хаотическое тепловое движение наряду с окружающими молекулами. Но при наложении внешнего поля положительные и отрицательные ионы начинают упорядоченное движение.
Поместим в сосуд с электролитом два электрода; один из электродов присоединим к положительной клемме источника тока, а другой — к отрицательной (рис. 5). Когда речь идёт о прохождении тока через электролиты, положительный электрод называют анодом, а отрицательный — катодом (Имеется народная мудрость для запоминания знаков анода и катода: Андрей — парень положительный, Катька — девка отрицательная ;-)).
Рис. 5. Ионная проводимость электролита
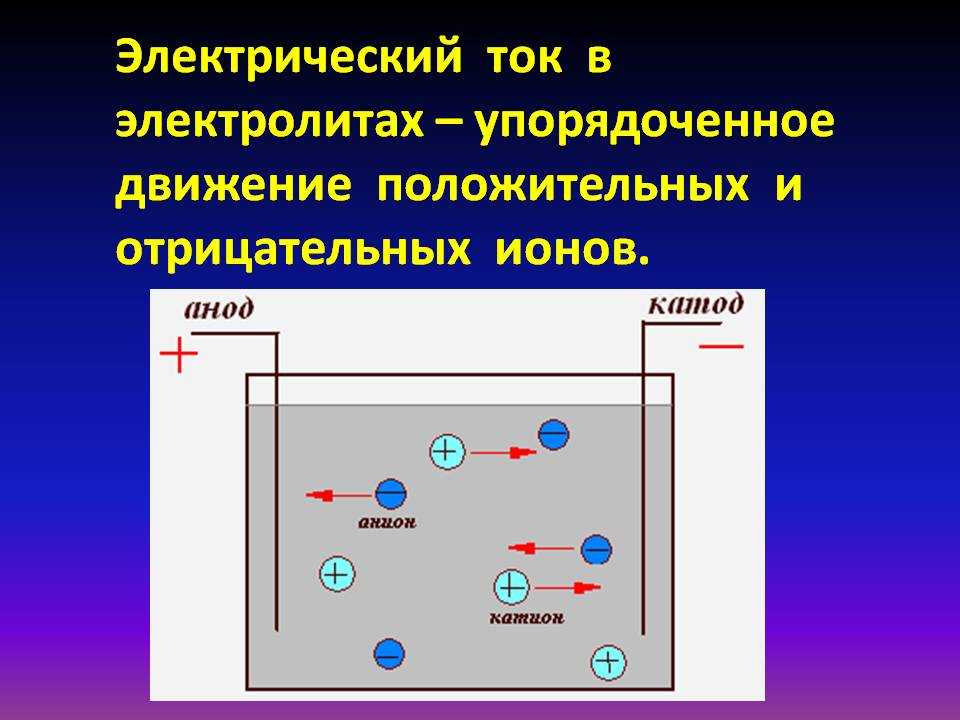
В электрическом поле, возникшем между электродами, положительные ионы электролита устремляются к «минусу» катода, а отрицательные ионы — к «плюсу» анода. Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду. Поэтому проводимость электролитов называется ионной (в отличие от электронной проводимости металллов).
Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду. Поэтому проводимость электролитов называется ионной (в отличие от электронной проводимости металллов).
На положительном аноде имеется недостаток электронов. Отрицательные ионы, достигнув анода, отдают ему свои лишние электроны; эти электроны отправляются по цепи к «плюсу» источника.
Наоборот, на отрицательном катоде — избыток электронов. Положительные ионы, придя на катод, забирают у него электроны, и это количество ушедших электронов немедленно восполняется их доставкой на катод с «минуса» источника.
Таким образом, в той части цепи, которая состоит из источника тока и металлических проводников, возникает циркуляция электронов по маршруту «анод источник катод».
Цепь замыкается электролитом, где электрический ток обеспечивается двусторонним движением ионов.
Электролиз
Положительные и отрицательные ионы, будучи носителями свободных зарядов, в то же время являются частицами вещества. Поэтому важнейшее отличие тока в электролитах от тока в металлах состоит в том, что электрический ток в электролите сопровождается переносом вещества.
Поэтому важнейшее отличие тока в электролитах от тока в металлах состоит в том, что электрический ток в электролите сопровождается переносом вещества.
Явление переноса вещества при прохождении электрического тока через электролит называется электролизом. Законы электролиза были экспериментально изучены Фарадеем.
В процессе электролиза происходит разложение растворённого вещества на составные части и выделение этих частей на электродах. Так, в растворе медного купороса положительные ионы меди идут на катод, в результате чего катод покрывается медью. Кислотный остаток выделяется на аноде.
Естественным образом возникает вопрос о нахождении массы вещества, выделяющегося на электроде за определённое время . Эта масса, очевидно, совпадает с массой данного вещества, перенесённого током за время через электролит.
Пусть — масса одного иона этого вещества, — заряд иона ( — валентность вещества). Предположим, что за время через электролит прошёл заряд . Число ионов, пришедших на электрод, тогда равно . Масса выделившегося на электроде вещества равна суммарной массе пришедших ионов:
Число ионов, пришедших на электрод, тогда равно . Масса выделившегося на электроде вещества равна суммарной массе пришедших ионов:
(1)
Величина является характеристикой вещества и называется его электрохимическим эквивалентом. Значения электрохимических эквивалентов различных веществ приводятся в таблицах.
При протекании через электролит постоянного тока за время проходит заряд . Подставляя это в формулу (1), получим первую формулу Фарадея:
(2)
Первый закон Фарадея. Масса выделяющегося на электроде вещества пропорциональна силе тока, протекающего через электролит, и времени прохождения тока.
Теперь преобразуем выражение для электрохимического эквивалента, введя молярную массу вещества:
Подставляя это выражение в (2), получим вторую формулу Фарадея:
(3)
Второй закон Фарадея. Масса выделяющегося на электроде вещества прямо пропорциональна молярной массе этого вещества и обратно пропорциональна его валентности.
В формуле (3) мы видим произведение двух констант и . Оно также является константой и называется постоянной Фарадея:
Кл/моль.
Формула (3) с постоянной Фарадея запишется так:
Спасибо за то, что пользуйтесь нашими материалами. Информация на странице «Электрический ток в электролитах» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ. Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий. Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена: 09.03.2023
Назовите носители заряда для протекания тока в (i) проводнике и (ii) электролите.
- #CBSE 12 Класс
- # Текущее электричество
- #Школа
- #Физика
Назовите носители заряда для протекания тока в (i) проводнике и (ii) электролите.
Ответы (1)
носители заряда – это частицы, которые могут свободно двигаться и несут электрический заряд
i) В проводниках электроны являются носителями заряда – электроны
ii) В электролите носителями заряда являются ионы. Это могут быть положительные или отрицательные ионы.
Добавил
Safeer PP
Посмотреть полный ответ
Crack
CUET с «Лучшими учителями Индии»- HD видео лекции
- Неограниченные пробные тесты
- Поддержка факультета
Похожие вопросы
- Является ли «процесс OXO» таким же, как «реакция KOCH», используемая для получения карбоновой кислоты?
- я выбрал ctse для медицины, но я получил его для инженерии, могу ли я изменить его
- Какая энергия преобразуется в электрическом элементном устройстве? а) Электрическая энергия в химическую энергию.
 б) Химическая энергия в электрическую энергию. в) Химическая энергия в химическую энергию. г) Электрическая энергия в электрическую энергию.
б) Химическая энергия в электрическую энергию. в) Химическая энергия в химическую энергию. г) Электрическая энергия в электрическую энергию.
Актуальные статьи/новости
CBSE Class 12 Business Studies Анализ экзамена: простой, сбалансированный документ; вопросы от NCERT
CBSE Класс 12 бизнес-исследования, экзамены делового администрирования сегодня; Руководство
Экзамен CBSE 2023: практика информатики в классе 12, анализ экзамена по информатике, реакция учащихся здесь
Последний вопрос
- Определите пару физических величин, которые имеют разные размерности:Вариант: 1 Волновое число и постоянная РидбергаВариант: 2 Напряжение и коэффициент упругостиВариант: 3 Коэрцитивная сила и намагниченность
- Случайная величина X имеет следующее распределение вероятностей:
Создать учетную запись
Номер мобильного телефона (+91)
Я согласен с Политикой конфиденциальности и Условиями использования Careers360
- я уже член
Ваш ответ
Создать учетную запись
Номер мобильного телефона (+91)
Я согласен с Политикой конфиденциальности и Условиями использования Careers360
- я уже член
Носители заряда — Глоссарий терминов по электронике
Глоссарий
Простые определения
Наиболее важные термины в области электроники, демистифицированные в одном месте.
Свежий контент! Мы будем добавлять больше на регулярной основе.
Вопрос, комментарий или предложение?
Наш вариант
В случае с полупроводниками в целях моделирования имеет смысл использовать как электроны, так и отсутствие электронов (дырки) для моделирования протекания тока. Итак, поскольку иногда вы используете электроны, а иногда — дырки, проще просто называть их обоих «носителями заряда» или даже «носителями тока» и двигаться дальше по жизни.
Википедия
В физике носителем заряда является частица или квазичастица, которая может свободно двигаться и несет электрический заряд, особенно частицы, несущие электрический заряд в электрических проводниках. Примерами являются электроны, ионы и дырки. В проводящей среде электрическое поле может воздействовать на эти свободные частицы, вызывая чистое движение частиц через среду; это то, что составляет электрический ток. В проводящих средах частицы служат для переноса заряда:
- Во многих металлах носителями заряда являются электроны.
 Один или два валентных электрона от каждого атома могут свободно перемещаться внутри кристаллической структуры металла. Свободные электроны называются электронами проводимости, а облако свободных электронов называется ферми-газом. Многие металлы имеют электронные и дырочные зоны. В некоторых мажоритарными носителями являются дырки.
Один или два валентных электрона от каждого атома могут свободно перемещаться внутри кристаллической структуры металла. Свободные электроны называются электронами проводимости, а облако свободных электронов называется ферми-газом. Многие металлы имеют электронные и дырочные зоны. В некоторых мажоритарными носителями являются дырки. - В электролитах, таких как соленая вода, носителями заряда являются ионы, представляющие собой атомы или молекулы, которые приобрели или потеряли электроны, поэтому они электрически заряжены. Атомы, которые приобрели электроны, поэтому они заряжены отрицательно, называются анионами, атомы, которые потеряли электроны, поэтому они заряжены положительно, называются катионами. Катионы и анионы диссоциированной жидкости также служат носителями заряда в расплавленных ионных твердых телах (см., например, процесс Холла – Эру для примера электролиза расплавленного ионного твердого вещества). Протонные проводники представляют собой электролитические проводники, использующие положительные ионы водорода в качестве носителей.

- В плазме, электрически заряженном газе, который встречается в электрических дугах через воздух, неоновые вывески, солнце и звезды, электроны и катионы ионизированного газа действуют как носители заряда.
- В вакууме свободные электроны могут действовать как носители заряда. В электронном компоненте, известном как вакуумная трубка (также называемая клапаном ), подвижное электронное облако генерируется нагретым металлическим катодом в процессе, называемом термоэлектронной эмиссией. Когда прикладывается электрическое поле, достаточно сильное, чтобы вовлечь электроны в пучок, это можно назвать катодным лучом, и он является основой дисплея с электронно-лучевой трубкой, широко использовавшегося в телевизорах и компьютерных мониторах до 2000-х годов.
- В полупроводниках, которые являются материалом, используемым для изготовления электронных компонентов, таких как транзисторы и интегральные схемы, ведут себя так, как будто через них проходят «эффективные частицы», известные как электронные дыры с положительным зарядом, вызывая электрические свойства.




 б) Химическая энергия в электрическую энергию. в) Химическая энергия в химическую энергию. г) Электрическая энергия в электрическую энергию.
б) Химическая энергия в электрическую энергию. в) Химическая энергия в химическую энергию. г) Электрическая энергия в электрическую энергию. Один или два валентных электрона от каждого атома могут свободно перемещаться внутри кристаллической структуры металла. Свободные электроны называются электронами проводимости, а облако свободных электронов называется ферми-газом. Многие металлы имеют электронные и дырочные зоны. В некоторых мажоритарными носителями являются дырки.
Один или два валентных электрона от каждого атома могут свободно перемещаться внутри кристаллической структуры металла. Свободные электроны называются электронами проводимости, а облако свободных электронов называется ферми-газом. Многие металлы имеют электронные и дырочные зоны. В некоторых мажоритарными носителями являются дырки.
