3 класс. Окружающий мир. Свойства воды в жидком, твёрдом и газообразном состоянии — Свойства воды в жидком, твёрдом и газообразном состоянии
Комментарии преподавателяВ чистом виде вода не имеет вкуса, запаха и цвета, но она почти никогда не бывает такой, потому что активно растворяет в себе большинство веществ и соединяется с их частицами. Так же вода может проникать в различные тела (ученые нашли воду даже в камнях).
Рис. 1. Вода (Источник)
Если в стакан набрать воды из-под крана, она будет казаться чистой. Но на самом деле, это – раствор многих веществ, среди которых есть газы (кислород, аргон, азот, углекислый газ), различные примеси, содержащиеся в воздухе, растворенные соли из почвы, железо из водопроводных труб, мельчайшие нерастворенные частицы пыли и др.
Рис. 2. Вода в стакане (Источник)
Если нанести пипеткой капельки водопроводной воды на чистое стекло и дать ей испариться, останутся едва заметные пятнышки.
Рис. 3. Капли воды на стекле (Источник)
В воде рек и ручьев, большинства озер содержатся различные примеси, например, растворенные соли. Но их немного, потому что эта вода – пресная.
Рис. 4. Река (Источник)
Вода течет на земле и под землей, наполняет ручьи, озера, реки, моря и океаны, создает подземные дворцы.
Рис. 5. Подземная пещера (Источник)
Прокладывая себе путь сквозь легкорастворимые вещества, вода проникает глубоко под землю, унося их с собой, и через щелочки и трещинки в скальных породах, образуя подземные пещеры, капает с их свода, создавая причудливые скульптуры. Миллиарды капелек воды за сотни лет испаряются, а растворенные в воде вещества (соли, известняки) оседают на сводах пещеры, образуя каменные сосульки, которые называют сталактитами.
Рис. 6. Сталактиты (Источник)
Сходные образования на полу пещеры называются сталагмитами.
Рис. 7. Сталагмиты (Источник)
А когда сталактит и сталагмит срастается, образуя каменную колонну, это называют сталагнатом.
Рис. 8. Сталагнат (Источник)
Наблюдая ледоход на реке, мы видим воду в твердом (лед и снег), жидком (текущая под ним) и газообразном состоянии (мельчайшие частицы воды, поднимающиеся в воздух, которые ещё называют водяным паром).
Рис. 9. Ледоход на реке (Источник)
Вода может одновременно находится во всех трех состояниях: в воздухе всегда есть водяной пар и облака, которые состоят из капелек воды и кристалликов льда.
Рис. 10. Облако (Источник)
Водяной пар невидим, но его можно легко обнаружить, если оставить в теплой комнате охлаждавшийся в холодильнике в течение часа стакан с водой, на стенках которого сразу появятся капельки воды. При соприкосновении с холодными стенками стакана, водяной пар, содержащийся в воздухе, преобразуется в капельки воды и оседает на поверхности стакана.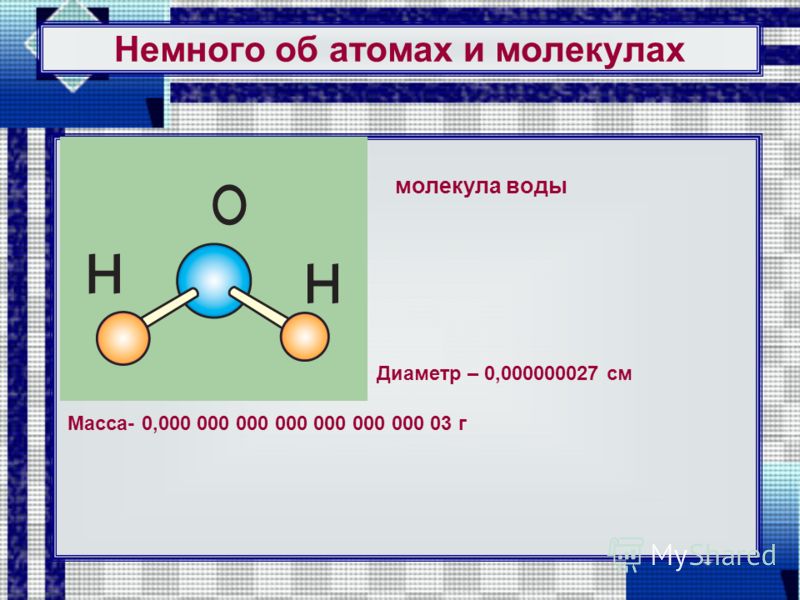
Рис. 11. Конденсат на стенках холодного стакана (Источник)
По этой же причине в холодное время года запотевает внутренняя сторона оконного стекла. Холодный воздух не может содержать столько же водяного пара, сколько и теплый, поэтому какое-то его количество конденсируется – превращается в капельки воды.
Рис. 12. Запотевшее окно (Источник)
Белый след за летящим в небе самолетом – тоже результат конденсации воды.
Рис. 13. След за самолетом (Источник)
Если поднести к губам зеркальце и выдохнуть, на его поверхности останутся мельчайшие капельки воды, это доказывает то, что при дыхании человек вдыхает с воздухом водяной пар.
При нагревании вода «расширяется». Это может доказать простой опыт: в колбу с водой опустили стеклянную трубку и замерили уровень воды в ней; затем колбу опустили в сосуд с теплой водой и после нагревания воды повторно замерили уровень в трубке, который заметно поднялся, поскольку вода при нагревании увеличивается в объеме.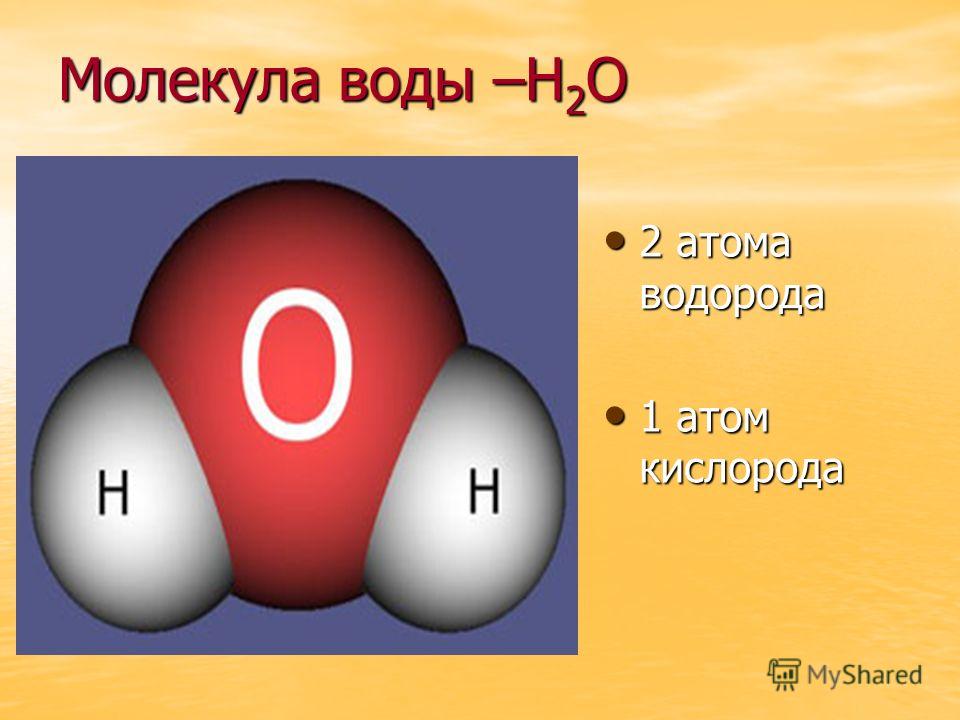
Рис. 14. Колба с трубкой, цифрой 1 и чертой обозначен первоначальный уровень воды
Рис. 15. Колба с трубкой, цифрой 2 и чертой обозначен уровень воды при нагревании
При охлаждении вода «сжимается». Это может доказать сходный опыт: в этом случае колбу с трубкой опустили в сосуд со льдом, после охлаждения уровень воды в трубке понизился относительно первоначальной отметки, потому что вода уменьшилась в объеме.
Рис. 16. Колба с трубкой, цифрой 3 и чертой обозначен уровень воды при охлаждении
Так происходит, потому что частицы воды, молекулы, при нагревании движутся быстрее, сталкиваются между собой, отталкиваются от стенок сосуда, расстояние между молекулами увеличивается, и поэтому жидкость занимает больший объем. При охлаждении воды движение её частиц замедляется, расстояние между молекулами уменьшается, и жидкости требуется меньший объем.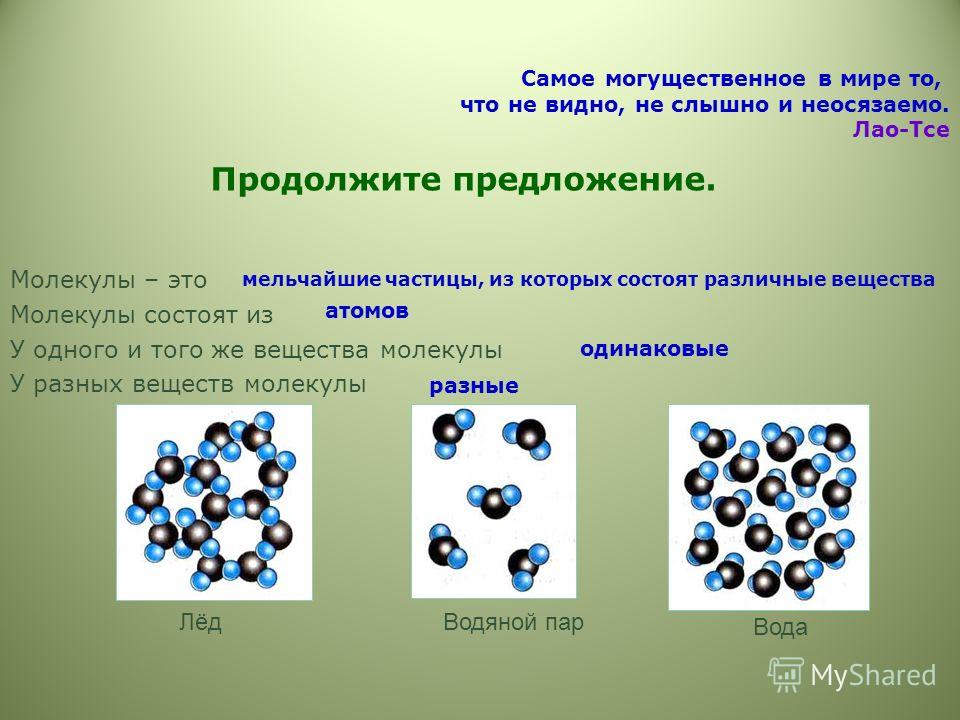
Рис. 17. Молекулы воды обычной температуры
Рис. 18. Молекулы воды при нагревании
Рис. 19. Молекулы воды при охлаждении
Такими свойствами обладает не только вода, но и другие жидкости (спирт, ртуть, бензин, керосин).
Знание этого свойства жидкостей привело к изобретению термометра (градусника), где используется спирт или ртуть.
Рис. 20. Термометр (Источник)
При замерзании вода расширяется. Это можно доказать, если емкость, наполненную до краев водой, неплотно накрыть крышкой и поставить в морозильную камеру, через время мы увидим, что образовавшийся лед приподнимет крышку, выйдя за пределы емкости.
Это свойство учитывается при прокладывании водопроводных труб, которые обязательно утепляются, чтобы при замерзании образовавшийся из воды лед не разорвал трубы.
В природе замерзающая вода может разрушать горы: если осенью в трещинах скал скапливается вода, зимой она замерзает, и под напором льда, который занимает больший объем, чем вода, из которой он образовался, горные породы трескаются и разрушаются.
Вода, замерзающая в трещинах дорог, приводит к разрушению асфальтового покрытия.
Длинные гребни, напоминающие складки, на стволах деревьев – раны от разрывов древесины под напором замерзающего в ней древесного сока. Поэтому в холодные зимы можно услышать треск деревьев в парке или в лесу.
В Антарктиде, покрытой четырехкилометровым слоем льда, находятся основные запасы этого вещества на Земле.
Рис. 1. Антарктида (Источник)
Лед встречает под землей, покрывает поверхности водоемов.
Рис. 2. Лед в подземной пещере (Источник)
Рис. 3. Лед на поверхности реки (Источник)
Айсберги – плавающие в море глыбы льда.
Рис. 4. Айсберг (Источник)
Снежинки состоят из мелких кристалликов льда.
Рис. 5. Снежинка (Источник)
Узоры на стекле в зимнее время – это кристаллы льда, образованные замерзшим водяным паром.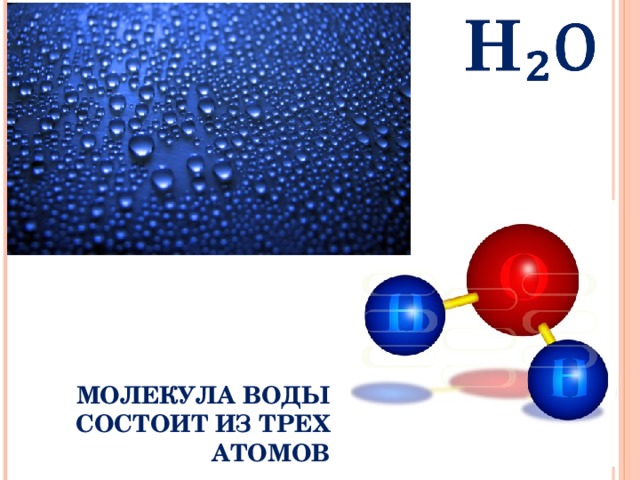
Рис. 6. Иней на стекле (Источник)
В современном мире получение льда – процесс доступный даже ребенку. Достаточно взять какую-нибудь емкость, наполнить водой, поставить на время в морозильную камеру, и получится лед.
Рис. 7. Получение льда из форм (Источник)
Иней в холодильнике – это замерзший водяной пар. Иней и лед – это вода в твердом состоянии.
Лед имеет свойство таять в теплом помещении (выше 0°), превращаясь в воду.
Лед холодный и скользкий на ощупь.
Рис. 8. Лед на руке (Источник)
Люди знали о том, что лед скользкий, и защищали крепости на возвышениях рвами с водой. В холодное время года защитники поливали стены водой, и по скользкой ледяной стене захватчики не могли пробраться внутрь.
Рис. 9. Крепость зимой
При температуре ниже 0° вода на поверхности почвы замерзает, превращаясь в гололед – опасное явление природы (в спешке можно поскользнуться, упасть и получить травму). Чтобы избежать травм, нужно не торопиться, выходить из дому заранее, при ходьбе наступать на всю подошву. Особенно осторожно нужно переходить дорогу – на скользком пути водителю сложнее быстро затормозить.
Чтобы избежать травм, нужно не торопиться, выходить из дому заранее, при ходьбе наступать на всю подошву. Особенно осторожно нужно переходить дорогу – на скользком пути водителю сложнее быстро затормозить.
Рис. 10. Осторожно! Гололед! (Источник)
Лед – хрупкий. Если стукнуть по кубику льда молоточком, он расколется на множество льдинок.
Рис. 11. Колотый лед (Источник)
Лед сохраняет свою форму. Если переложить льдинку из блюдечка в стакан, её форма не измениться, потому что лед – твердое вещество и не меняет свою форму.
Рис. 12. Кубик льда (Источник)
Замерзшую поверхность водоема можно использовать для перемещений на транспорте или пешком, потому что лед, в отличие от воды, способен выдерживать на своей поверхности достаточно большой вес.
Рис. 13. Мотокросс по льду (Источник)
13. Мотокросс по льду (Источник)
Для занятий спортом и развлечений заливают катки – большие ровные пространства льда.
Рис. 14. Каток на Красной площади (Источник)
Во время катания на коньках лед, соприкасающийся с лезвиями, тает, превращаясь в воду. Если бы не было этого тонкого слоя воды, кататься по льду было бы так же трудно, как по полу. Вода, как масло в машине, уменьшает трение между льдом и коньком и облегчает скольжение.
Рис. 15. Скольжение коньков по льду (Источник)
По той же причине происходит движение ледников с гор. Под давлением огромной массы льда его нижние слои начинают таять и ледяная река скользит по горному склону вниз, как коньки по поверхности катка.
Рис. 16. Схождение ледника с горы (Источник)
Лед не тонет в воде. Если бросить кусочек льда в емкость с водой, он не утонет, а будет плавать на поверхности.
Рис. 17. Лед плавает на поверхности воды (Источник)
Обычно твердые вещества тяжелее, чем те же вещества в жидком состоянии. Например, кусочек железа тонет в расплавленном железе, а свинцовый кубик тонет в расплавленном свинце. При замерзании вода занимает больший объем, чем прежде, она расширяется, поэтому лед легче воды. Уже одного этого свойства достаточно, чтобы выделить лед из ряда твердых веществ как исключение.
Если бы лед тонул, на поверхности водоемов в течение холодного времени года образовывались бы новые и новые слои льда на месте затонувших и водоем промерзал бы до самого дна. В результате водные животные и растения оказались бы скованы льдом, им грозила бы неминуемая гибель. К счастью, в природе этого не происходит, потому что лед не тонет в воде.
Рис. 18. Слой льда на поверхности водоема (Источник)
Лед плохо проводит тепло. В водоеме он защищает воду под ним от дальнейшего охлаждения. Вода тоже плохо передает тепло. Это доказывает такой опыт: на дно пробирки с водой опускают кубик льда с тяжелым грузом (поскольку лед не тонет в воде, в него заранее вмораживают грузик), край пробирки нагревают, верхний слой воды кипит, а лед не плавится. Из опыта можно сделать вывод, что не только лед, но и вода плохо проводит тепло. Верхние слои воды нагреваются, в то время как нижние остаются холодными. Это объясняет, почему испарения происходят только с поверхности водоемов.
В водоеме он защищает воду под ним от дальнейшего охлаждения. Вода тоже плохо передает тепло. Это доказывает такой опыт: на дно пробирки с водой опускают кубик льда с тяжелым грузом (поскольку лед не тонет в воде, в него заранее вмораживают грузик), край пробирки нагревают, верхний слой воды кипит, а лед не плавится. Из опыта можно сделать вывод, что не только лед, но и вода плохо проводит тепло. Верхние слои воды нагреваются, в то время как нижние остаются холодными. Это объясняет, почему испарения происходят только с поверхности водоемов.
Рис. 19. Опыт по нагреванию края пробирки с водой и утопленным льдом (Источник)
Если же нагревать воду в емкости снизу, то вскоре весь объем воды закипит (например, если мы поставим на плиту кастрюлю с супом). Так происходит потому, что нижний слой воды нагревается, расширяется и поднимается вверх, на его место опускается еще не прогретая вода, и процесс повторяется до тех пор, пока вся вода не прогреется до 100°.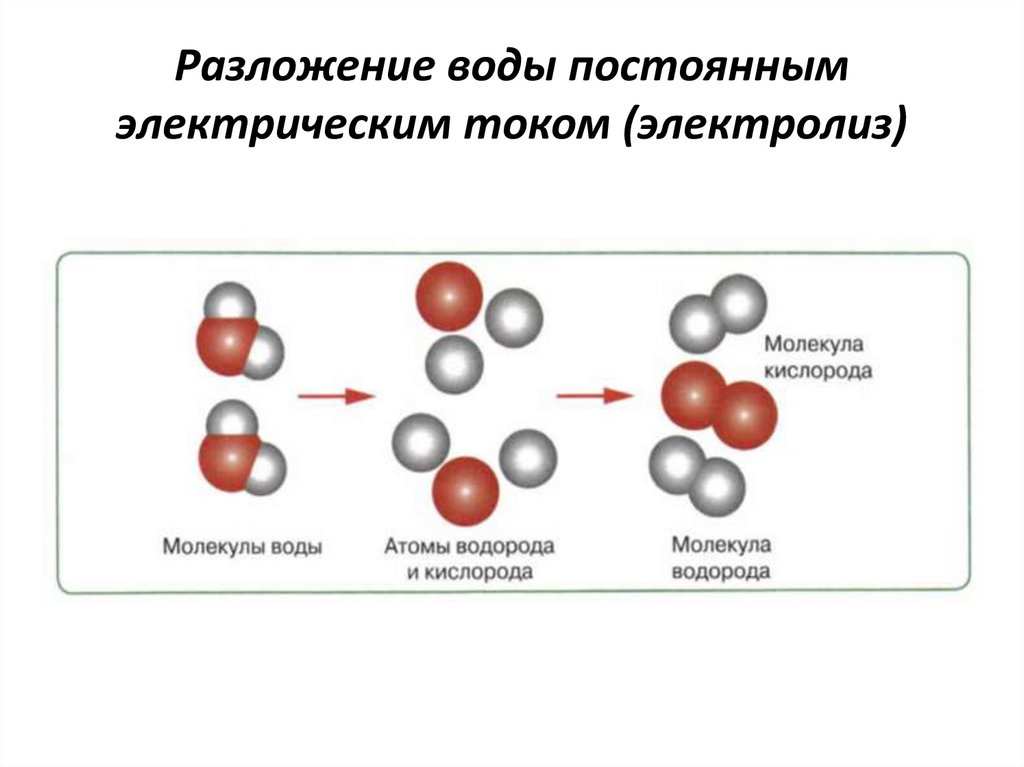 При такой температуре вода закипает и превращается в водяной пар.
При такой температуре вода закипает и превращается в водяной пар.
Рис. 20. Опыт по нагреванию емкости с водой снизу (Источник)
Лед, как и стекло, бесцветен и прозрачен.
Рис. 21. Лед (Источник)
Рис. 22. Стекло (Источник)
Снег – одно из твердых состояний воды. Он белый, рыхлый, непрозрачный, тает в тепле и плавает в воде.
Рис. 23. Снег (Источник)
Вода состоит из молекул, которые находятся в непрерывном движении.
Рис. 1. Молекулы воды обычной температуры
Те из них, что оказываются близко к поверхности, оказываются в воздухе и перемешиваются с его частицами, превращаясь в водяной пар. Частицы воздуха и водяного пара так малы, что их невозможно увидеть невооруженным глазом. Водяной пар – это прозрачный бесцветный газ, невидимый, как и воздух.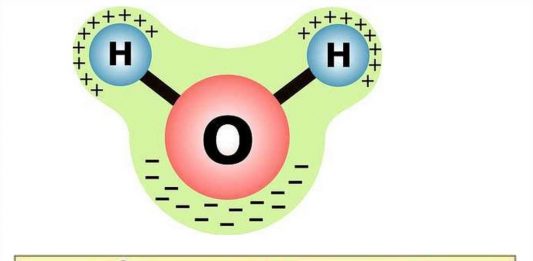
Рис. 2. Образование водяного пара при кипении (Источник)
Испарение – переход воды из жидкого состояния в газообразное.
Рис. 3. Испарение воды с поверхности водоема (Источник)
Лед тоже испаряется, но значительно медленнее, чем вода в жидком состоянии. Например, если зимой вывесить мокрое белье на улицу, сначала оно покроется ледяной коркой, а потом высохнет.
Рис. 4. Сушка мокрого белья зимой (Источник)
В каком бы состоянии вода не была, она постоянно испаряется с поверхности Земли.
Человек использует знания об испарении воды. Просушивают собранное зерно, заготовленные дрова, оштукатуренные стены, вымытую посуду, выстиранное белье.
Рис. 5. Сушка зерна (Источник)
Рис. 6. Сушка дров (Источник)
Рис. 7. Сушка оштукатуренных стен (Источник)
Рис. 8. Сушка посуды (Источник)
8. Сушка посуды (Источник)
Рис. 9. Сушка белья (Источник)
Мокрые волосы сушат электрическим феном.
Рис. 10. Сушка волос феном (Источник)
Интенсивность испарения зависит от температуры воды: чем выше температура, тем выше скорость движения молекул воды, а значит и испарения. Это доказывает простой опыт: если в 2 емкости налить одинаковое количество воды, а затем одну поставить в холодное место, а другую – в теплое, через некоторое время станет ясно, что вода в холодном месте испаряется медленнее, чем в теплом.
Мокрая дорога летом высохнет намного быстрее, чем осенью.
Рис. 11. Мокрая дорога (Источник)
Скошенная трава в солнечный день высохнет быстрее, чем в пасмурный.
Рис. 12. Скошенная трава (Источник)
Знание этого свойства помогает людям. Например, если подмокла старинная книга, её оставляют в специальной морозильной камере, чтобы высыхание шло медленно и страницы книги не повредились.
Испарение происходит в месте соприкосновения поверхности воды с воздухом, соответственно, чем больше площадь соприкосновения, тем быстрее происходит испарение. Доказать это можно с помощью несложного опыта: нужно налить одинаковое количество воды в 3 емкости с разной площадью соприкосновения налитой воды с воздухом (например, бутылка с узким горлышком, стеклянная банка и широкая тарелка). Через некоторое время мы увидим, что вода из тарелки испаряется быстрее всего, потому что площадь соприкосновения воды с воздухом наибольшая. Из банки немного медленнее, потому что площадь соприкосновения меньше. А из бутылки медленнее всего, потому что площадь соприкосновения воды с воздухом наименьшая.
Рис. 13. Опыт по испарению воды из емкостей с различной площадью соприкосновения воды с воздухом (Источник)
Поэтому фрукты, предназначенные для сушки, разрезают на тонкие ломтики – чтобы увеличить поверхность соприкосновения с воздухом и увеличить скорость испарения.
Рис. 14. Сушка яблок (Источник)
Под воздействием ветра испарение идет быстрее, потому что молекулы воды активнее соединяются с молекулами воздуха. В ветреную погоду влажные поверхности высыхают быстрее, если держать руки под сушилкой, они высохнут быстрее.
Рис. 15. Сушка рук под воздействием потока теплого воздуха (Источник)
Наиболее активно испарение идет при нагревании. При 100г вода кипит и превращается в водяной пар. Молекулы водяного пара под воздействием высокой температуры двигаются очень быстро, ему необходим большой объем, поэтому у кипящего чайника «подпрыгивает» крышка.
Рис. 16. Кипящий чайник (Источник)
Знание этого свойства водяного пара позволило людям сконструировать паровые двигатели.
Рис. 17. Машина с паровым двигателем (Источник)
Часто, когда печется яблоко, его кожура лопается – это яблочный сок, превращаясь в пар, разрывает кожуру.
Рис. 18. Печеное яблоко (Источник)
Или можно услышать треск дров в печи – под воздействием высокой температуры вода в дровах превращается в водяной пар и разрывает древесину.
Рис. 19. Дровяная печь (Источник)
Как было сказано, водяной пар – невидим. Так почему же мы видим пар, когда кипит чайник? В холодном воздухе разогретый водяной пар конденсируется – превращается в мельчайшие капельки воды, которые мы видим как белый пар. А невидимый водяной пар находится возле носика чайника на границе белого облачка пара.
Рис. 20. Кипящий чайник (Источник)
Если поместить у носика кипящего чайника холодный металлический предмет, то очень скоро на нем появятся капельки осевшей воды. Этот опыт доказывает наличие водяного пара у носика чайника.
Рис. 21. Опыт по конденсации водяного пара у носика чайника (Источник)
источник конспекта:
http://interneturok. ru/ru/school/okruj-mir/3-klass/undefined/svoystva-vody-v-zhidkom-sostoyanii?seconds=0&chapter_id=826
ru/ru/school/okruj-mir/3-klass/undefined/svoystva-vody-v-zhidkom-sostoyanii?seconds=0&chapter_id=826
http://interneturok.ru/ru/school/okruj-mir/3-klass/undefined/svoystva-vody-v-tverdom-sostoyanii
http://interneturok.ru/ru/school/okruj-mir/3-klass/undefined/svoystva-vody-v-gazoobraznom-sostoyanii
исчтоник презентации — http://prezentacii.com/biologiya/6000-tri-sostoyaniya-vody.html
источник видео:
http://www.youtube.com/watch?v=nGsOh3iCC70
http://www.youtube.com/watch?v=WL_GTjYByG8
http://www.youtube.com/watch?v=BsjlZh2kKbo
Загадка молекулярной структуры воды
Международная группа учёных разбиралась, как происходит
вращение молекулы воды и каковы ее критические
свойства и локальная структура.
Как двигается молекула в поле рентгеновского излучения и какова структура жидкостей — всё это нужно для понимания механизмов взаимодействия излучения с веществом и структурой сложных молекулярных систем.
Так, наблюдая за молекулярным движением, ученые используют динамический вращательный эффект Доплера. Наличие изолированных колебательных состояний в Оже-переходах дает уникальный способ изучения индуцированного молекулярного вращения.
Теоретические предсказания подтверждаются на практике. При помощи современных синхротронов и экспериментальной методики есть возможность изучать сверхбыстрое молекулярное вращение во льду, в газообразном и жидком состоянии воды. Применяя Оже-спектроскопию и рентгеновскую фотоионизацию, специалисты рассматривают поведение молекул воды при высоких энергиях фотонов.
Фарис Хафизович Гельмуханов –
доктор физ-мат. наук, ведущий научный сотрудник, профессор
Института нанотехнологий, спектроскопии и квантовой химии
Сибирского федерального университета (г.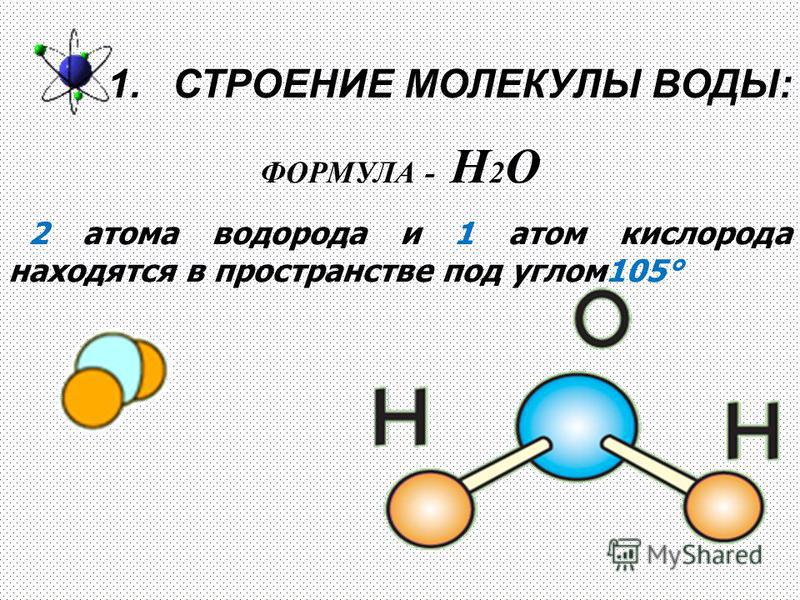 Красноярск),
приглашенный исследователь, профессор отделения теоретической
химии и биологии Королевского технологического института в
Стокгольме (Швеция). Выпускник Новосибирского государственного
университета, бывший сотрудник Института автоматики и
электрометрии (г. Новосибирск) – рассказал об актуальных
исследованиях по изучению атомных связей в молекуле воды, которые
проходили в сотрудничестве с зарубежными специалистами,
использующими новейшее оборудование.
Красноярск),
приглашенный исследователь, профессор отделения теоретической
химии и биологии Королевского технологического института в
Стокгольме (Швеция). Выпускник Новосибирского государственного
университета, бывший сотрудник Института автоматики и
электрометрии (г. Новосибирск) – рассказал об актуальных
исследованиях по изучению атомных связей в молекуле воды, которые
проходили в сотрудничестве с зарубежными специалистами,
использующими новейшее оборудование.
Ряд исследований международной команды ученых представлен
несколькими значимыми публикациями. Например, в статье,
опубликованной в Proceedings of the National Academy of Sciences of the United States of America, vol. 116(11),
4877–4882 (2019) внимание специалистов направлено на
изучение движения молекулы углекислого газа (CO) с использованием
динамического вращательного эффекта Доплера.
Фарис Гельмуханов пояснил, как меняется молекулярная ориентация, в частности, как возникает индуцированная отдача молекулярного вращения и каковы отличительные особенности Оже-спектров молекулы:
Рис.1
«Эффект Допплера имеет место для любых волн – звуковых волн, волн
на воде, фотонов, электронов и так далее. Эффект Допплера мы
наблюдаем и в повседневной жизни: если машина скорой помощи с
включённой сиреной приближается к вам, вы слышите высокую
частоту. Как только автомобиль проедет мимо – вы слышите низкий
звук
Поскольку молекулы двигаются, эффект Допплера можно наблюдать и
по характерному сдвигу частоты или энергии испущенного фотона или
электрона. Важно отметить, что эффект Допплера можно наблюдать
как при поступательном движении молекул, так и при их вращении
(вращательный эффект Допплера). Однако длительное время считалось
невозможным обнаружить вращения в рентгеновских спектрах в силу
сверхбыстрого характера рентгеновского процесса, длительность
которого была слишком короткой по сравнению с периодом медленных
молекулярных вращений.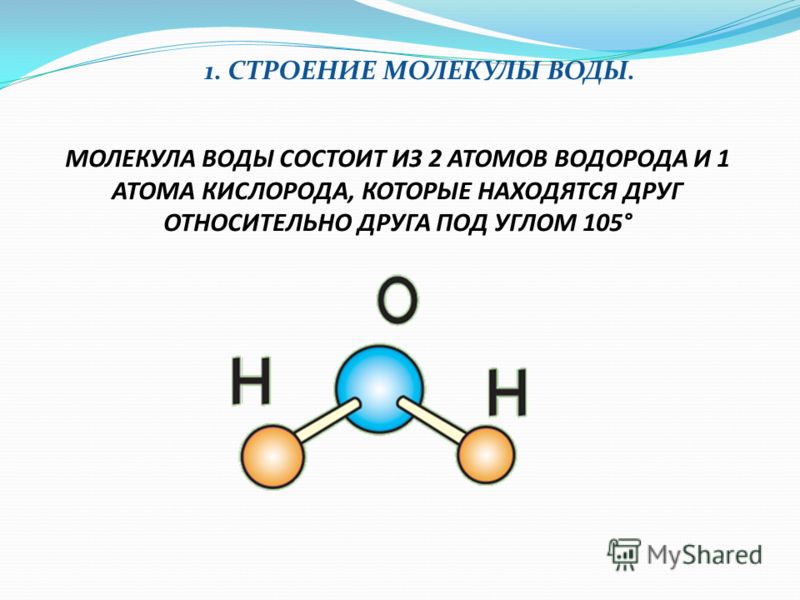
Профессор выделяет два ключевых момента исследованного явления: «Первый момент заключается в переводе молекулы в состояние сверхбыстрого вращения. Для этого исследователи ионизовали молекулу CO фотонами большой энергии (около 10 кэВ). Подобно снаряду, вылетевший из атома углерода быстрый фотоэлектрон, сообщил этому атому момент импульса. В результате этой отдачи, молекуле была сообщена большая скорость вращения с характерной вращательной температурой, близкой к температуре на поверхности солнца (10 000 K)».
Рис. 2. Быстрый фотоэлектрон при вылете из атома углерода (красный шарик) толкает за счет отдачи и приводит к сверхбыстрому вращению молекулы CO. Через 8 fs влетает Оже-электрон. Оже-спектр дает информацию о повороте оси молекулы за время жизни 1s-дырочного состояния (8 fs).
«Следует отметить, что фотоэлектрон с той же самой вероятностью
влетает в противоположную сторону. Тем самым у нас будут молекулы
сверхбыстрого вращения в противоположную сторону. Mы
детектировали это вращение, измеряя энергию испущенного
Оже-электрона (см. Рис. 2).
Тем самым у нас будут молекулы
сверхбыстрого вращения в противоположную сторону. Mы
детектировали это вращение, измеряя энергию испущенного
Оже-электрона (см. Рис. 2).
Вращение молекулы сдвигает энергию Оже-электрона в сторону
увеличения или уменьшения. Это зависит от направления вращения.
Taк как у нас половина молекулы крутится в одну сторону, а другая
половина в противоположную сторону, то Оже-резонанс расщепляется
на два пика
Нo молекула, благодаря этому сверхбыстрому вращению, могла успеть повернуться на заметный угол за короткое время (порядка 8 фемтосекунд) рентгеновского процесса (см. Рис. 2)».
Второй ключевой момент работы, по словам Фариса Гельмуханова,
заключается «в детектировании этого угла поворота. В качестве
такого временного детектора использовался тот самый Оже-электрон,
вылетевший через приблизительно 8 фемтосекунд после ионизации.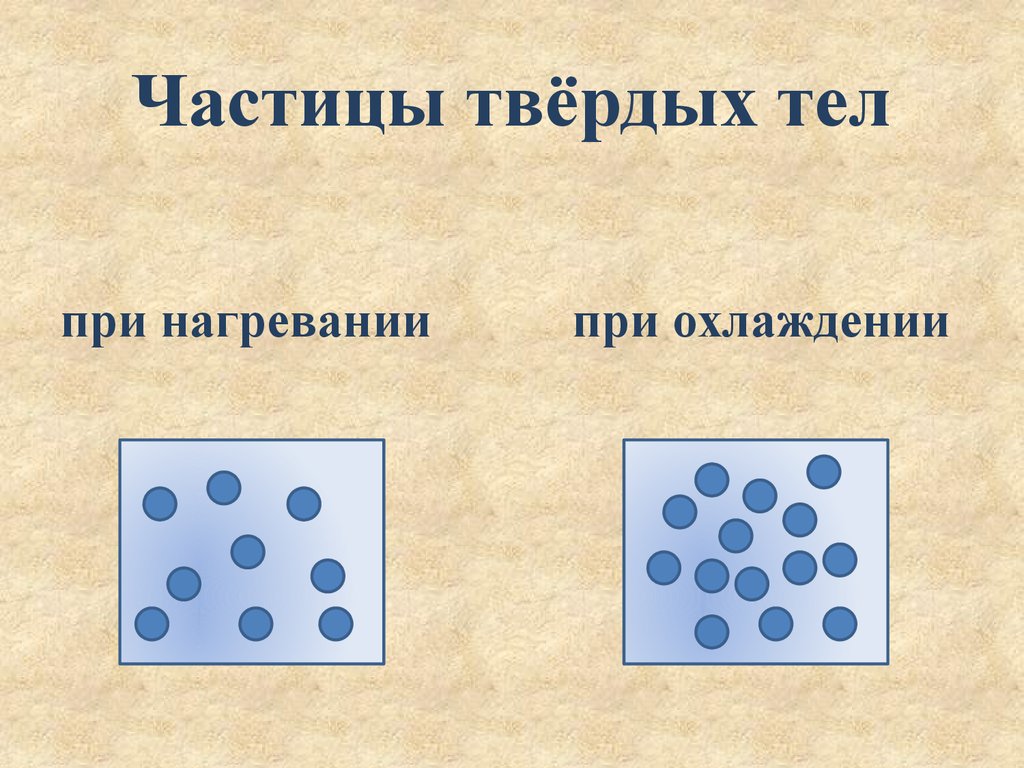
Рис.3. a) вращательный эффект Допплера приводит к расщеплению Оже-резонанса на два пика с одинаковой интенсивностью; b) теория предсказывает, что проворот оси молекулы за время жизни ионизованного состояния молекулы CO приводит к ассиметрии дуплета c) экспериментальный спектр
В этой работе по изучению Динамического эффекта Допплера воды участвовали теоретики и экспериментаторы. Группу теоретиков возглавил профессор Фарис Гельмуханов. Эксперимент был выполнен на синхротроне SOLEIL (Париж, Франция).
Следующий этап исследований был посвящен изучению локальной
структуры жидкой воды.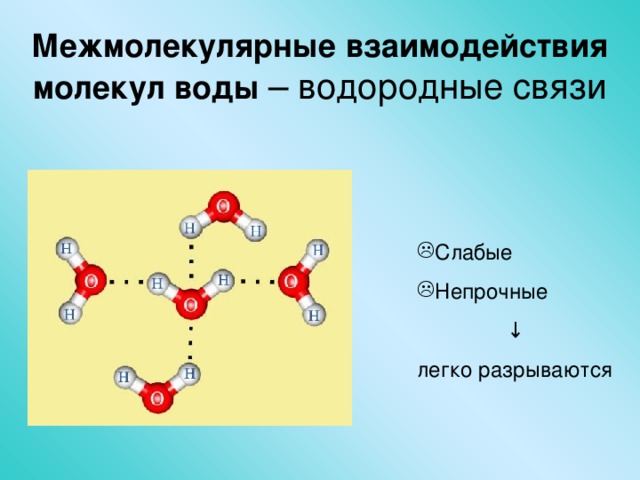 Pезультаты этой работы опубликованы в
престижном журнале Proceedings of the National Academy of
Sciences of the United States of America, vol. 116 (10) 4058-4063
(2019).
Pезультаты этой работы опубликованы в
престижном журнале Proceedings of the National Academy of
Sciences of the United States of America, vol. 116 (10) 4058-4063
(2019).
По словам Фариса Гельмуханова, «общепринято, что вода состоит из молекул Н2О, объединенных в группы так называемыми водородными связями (ВС). Hе связанные в кластеры молекулы воды присутствуют в ней лишь в небольшом количестве. Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединения. Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F».
Суть исследований помог понять профессор Гельмуханов: «Существует
две модели жидкой воды.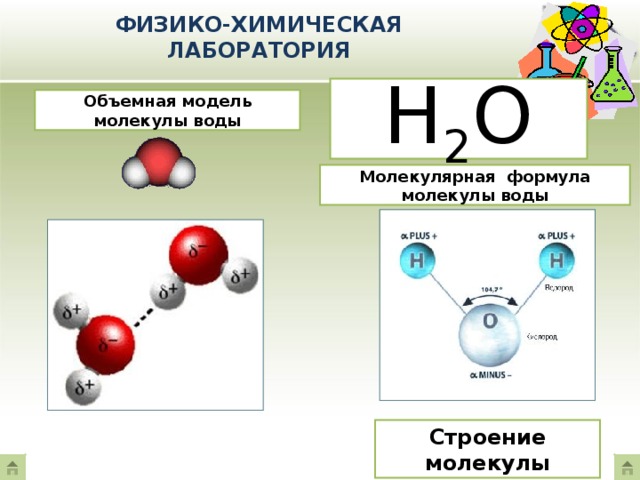 Большинство экспериментальных данных
указывает на то, что вода является однородной, c плотностью
1г\см3. Несмотря на это, многие ученые думают, что
вода есть флуктуирующая смесь кластеров двух типов, в одном их
которых молекулы связаны друг с другом водородной связью как во
льду, а в другом связи нарушены. Благодаря чему эти кластеры
более плотные. Наши недавние теоретические и экспериментальные
исследования показали, что жидкая вода все-таки является
однородной».
Большинство экспериментальных данных
указывает на то, что вода является однородной, c плотностью
1г\см3. Несмотря на это, многие ученые думают, что
вода есть флуктуирующая смесь кластеров двух типов, в одном их
которых молекулы связаны друг с другом водородной связью как во
льду, а в другом связи нарушены. Благодаря чему эти кластеры
более плотные. Наши недавние теоретические и экспериментальные
исследования показали, что жидкая вода все-таки является
однородной».
Как сообщил Фарис Гельмуханов, «было проведено два типа
экспериментов: во-первых, измерение рентгеновских спектров
поглощения (RSP) газообразной воды, жидкой воды и льда в широком
диапазоне энергии. Измерение RSP вдали от порога ионизации 1S
электрона атома кислорода в воде было необходимо, чтобы
откалибровать по интенсивности RSP паров воды, жидкой воды и льда
(в этой области RSP всех трёх фаз воды строго совпадают).
Измерение RSP до порога ионизации позволило нам количественно
сравнить вероятность перехода 1S электрона на первую незанятую
молекулярную орбиталь.
Во втором случае измерялся спектр резонансного неупругого рассеяния рентгеновского излучения (PHPPИ)) газообразной и жидкой водой. Для этого использовался спектрометр SAXES на пучке рентгеновских фотонов “ADRESS” синхротрона “Swiss Light Source” в Швейцарии.
Что представляет собой PHPPИ метод? Как объяснил профессор,
«резонансноe неупругоe рассеяниe рентгеновского излучения (PHPPИ)
может приблизительно рассматриваться как 2-этапный процесс. На
первом этапе молекула поглощает падающий рентгеновский фотон и
переходит из основного в высоковозбужденное промежуточное
состояние с «дыркой» на 1s-уровне соответствующего атома. Это
промежуточное состояние неустойчиво и оно распадается в конечное
состояние, испустив конечный рентгеновский фотон. Очевидно,
энергия испустившего фотона меньше энергии начального фотона на
разницу энергии конечного и начального состояния молекул».
На
первом этапе молекула поглощает падающий рентгеновский фотон и
переходит из основного в высоковозбужденное промежуточное
состояние с «дыркой» на 1s-уровне соответствующего атома. Это
промежуточное состояние неустойчиво и оно распадается в конечное
состояние, испустив конечный рентгеновский фотон. Очевидно,
энергия испустившего фотона меньше энергии начального фотона на
разницу энергии конечного и начального состояния молекул».
Далее, экспериментальный материал был детально проанализирован теоретиками при помощи соответствующих расчетов и опубликован в престижном международном журнале Nature Communications 10: 1013 (2019). Здесь акцент ставится на прочности водородной связи в жидкой воде, а в основе лежат показания, снятые при помощи метода резононсного рассеяния рентгеновского излучения (PHPPИ)).
Фарис Гельмуханов подробно прокомментировал основные
положения этого исследования:«Mногие ученые считают, что вода
есть флуктуирующая смесь кластеров двух типов (лёгкая и тяжёлая
фракции), в одном из которых молекулы связаны друг с другом, как
во льду, а в другом связи нарушены, благодаря чему эти кластеры
более плотные. Но так ли это? Если изучать резонансное неупругое
рассеяние рентгеновского излучения (RNRRI) водой, то можно
увидеть эмиссионный переход, в котором электрон с занятой
молекулярной орбитали 1b1 заполняет дырку, созданную
падающим фотоном в глубоком 1s уровне атома кислорода.
Эксперимент с жидкой водой показывает расщепление этого резонанса
на два пика. В научной литературе часть ученых приписывает этот
дублет двум вышеупомянутым структурным мотивам. Из этого делаются
далеко идущие заключения о локальной структуре и критических
свойствах воды. Чтобы пролить свет на эту фундаментальную
проблему, авторы данной работы выполнили недавно RNRRI
эксперимент с парами воды, т.е. измерили RNRRI спектр
изолированной молекулы воды».
Но так ли это? Если изучать резонансное неупругое
рассеяние рентгеновского излучения (RNRRI) водой, то можно
увидеть эмиссионный переход, в котором электрон с занятой
молекулярной орбитали 1b1 заполняет дырку, созданную
падающим фотоном в глубоком 1s уровне атома кислорода.
Эксперимент с жидкой водой показывает расщепление этого резонанса
на два пика. В научной литературе часть ученых приписывает этот
дублет двум вышеупомянутым структурным мотивам. Из этого делаются
далеко идущие заключения о локальной структуре и критических
свойствах воды. Чтобы пролить свет на эту фундаментальную
проблему, авторы данной работы выполнили недавно RNRRI
эксперимент с парами воды, т.е. измерили RNRRI спектр
изолированной молекулы воды».
Как заверил профессор Гельмуханов, «эксперименты привели к
неожиданному результату и показали, что точно такое же
расщепление присутствует в рентгеновских спектрах рассеяний
молекул воды в газовой фазе, где очевидно водородная связь
отсутствует и вопрос о легкой и тяжелой фракциях не возникает.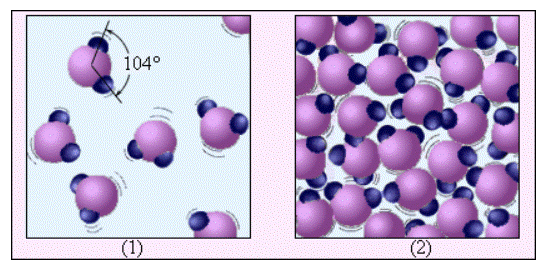 Более того, выполненные теоретические расчёты однозначно
объясняют данное расщепление сверхбыстрой диссоциациeй молекулы
воды в 1s-дырочном состоянии. Таким образом, данное исследование,
однозначно свидетельствуя о динамической природе расщепления
1b1 резонанса, опровергает структурный механизм, тем
самым свидетельствуя, что структура воды однородна».
Более того, выполненные теоретические расчёты однозначно
объясняют данное расщепление сверхбыстрой диссоциациeй молекулы
воды в 1s-дырочном состоянии. Таким образом, данное исследование,
однозначно свидетельствуя о динамической природе расщепления
1b1 резонанса, опровергает структурный механизм, тем
самым свидетельствуя, что структура воды однородна».
Рис. 4. Левая панель показывает распределение молекул воды в жидкой фазе. Средняя врезка показывает процесс неупругого рассеяния молекулой воды, а правый рисунок показывает колебательную d-структуру в PHPPИ спектре.
Вторым не менее важным результатом данной работы, по словам
российского ученого, является «извлечение из эксперимента более
детальной структурной информации, а именно, как влияет водороднaя
связь (ВС) на силу OH связи. Колебательная инфракрасная (ИК)
спектроскопия является общепринятым инструментом для исследования
ВС в жидкостях. Однако в жидкостях ИК-спектроскопия исследует
лишь наиболее интенсивный переход в первое колебательное
состояние, которое “слабо чувствует” межмолекулярное
взаимодействие (см. Рис. 4) в силу малой
амплитуды колебаний. Спектроскопия RNRRI воды качественно
отличается от ИК спектроскопии тем, что при возбуждении
рентгеновским фотоном глубокого 1s электрона кислорода на первую
незанятую молекулярную орбиту, молекула воды быстро диссоциирует.
В процессе этой сверхбыстрой диссоциации возбуждённый электрон
переходит обратно на 1s уровень, испуская рентгеновский фотон.
Частота испущенного фотона отличается от возбуждающего фотона,
так как при этом переходе заселяются более высокие колебательные
уровни (см. Рис. 4). Таким образом, в
отличие от ИК-спектра, RNRRI спектр состоит из протяжённого
набора колебательных пиков. Чем выше колебательное состояние (см. Рис. 4), тем дальше атомы водорода
удаляются от кислорода в процессе OH колебаний и тем сильнее
данное колебание “чувствует” взаимодействие с ближайшей молекулой
воды, а именно водородную связь».
Рис. 4) в силу малой
амплитуды колебаний. Спектроскопия RNRRI воды качественно
отличается от ИК спектроскопии тем, что при возбуждении
рентгеновским фотоном глубокого 1s электрона кислорода на первую
незанятую молекулярную орбиту, молекула воды быстро диссоциирует.
В процессе этой сверхбыстрой диссоциации возбуждённый электрон
переходит обратно на 1s уровень, испуская рентгеновский фотон.
Частота испущенного фотона отличается от возбуждающего фотона,
так как при этом переходе заселяются более высокие колебательные
уровни (см. Рис. 4). Таким образом, в
отличие от ИК-спектра, RNRRI спектр состоит из протяжённого
набора колебательных пиков. Чем выше колебательное состояние (см. Рис. 4), тем дальше атомы водорода
удаляются от кислорода в процессе OH колебаний и тем сильнее
данное колебание “чувствует” взаимодействие с ближайшей молекулой
воды, а именно водородную связь».
Итак, «PHPPИ даёт уникальную возможность исследовать ВС, а
именно, извлечь из экспериментального спектра количественную
информацию o влиянии соседних молекул через ВС на потенциал
взаимодействия OH связи. Важно отметить, что в отличие от
изолированной молекулы воды с одним OH потенциалом, в жидкости
имеется набор (распределение) OH потенциалов в силу
флуктуирующего многообразия ближайшего окружения молекулы воды.
Таким образом, вторым результатом работы является “измерение”
распределения OH потенциалов в сети флуктуирующих водородных
связей», — заключил физик.
Важно отметить, что в отличие от
изолированной молекулы воды с одним OH потенциалом, в жидкости
имеется набор (распределение) OH потенциалов в силу
флуктуирующего многообразия ближайшего окружения молекулы воды.
Таким образом, вторым результатом работы является “измерение”
распределения OH потенциалов в сети флуктуирующих водородных
связей», — заключил физик.
В этой многоаспектной работе по изучению структуры жидкой воды участвовало две группы: теоретики и экспериментаторы. Группу теоретиков возглавлял профессор Фарис Гельмуханов. Сюда вошли специалисты из разных научных учреждений, в частности, из Королевского технологического института (Стокгольм), Стокгольмского университета и российские ученые Сибирского федерального университета (доктор Сергей Полютов и аспирантка Нина Игнатова).
Руководителем экспериментальной группы был профессор Александр
Фёxлиш (Alexander Föhlisch) из Института методов и приборов для
исследования синхротронного излучения (Берлинский центр
материалов и энергии имени Гельмгольца, Берлин, Германия). Она
представлена учеными из Германии и Швейцарии (синхротрон “Swiss
Light Source”).
Она
представлена учеными из Германии и Швейцарии (синхротрон “Swiss
Light Source”).
Важно, что вторая практическая работа, выводы которой обнародованы в Proceedings of the National Academy of Sciences of the United States of America, vol. 116 (10) 4058-4063 (2019) выполнена на двух синхротронах: это Европейская установка синхротронного излучения “European Synchrotron Radiation Facility”, в Гренобле, (Франция) и “Swiss Light Source” в Швейцарии. По замечанию профессора Гельмуханова, “Swiss Light Source «уникальный спектрометр, который обладает в настоящее время лучшим в мире пo спектральному разрешению. Поэтому мы измеряем на нем, чтобы увидеть в PHPPИ спектре колебательную структуру воды в жидкой фазе , связанную с колебаниями OH связи в молекуле воды».
Итогом длительной работы ученых стало обнаружение нового
физического эффекта – Динамического вращательного эффекта
Допплера, а также детальное исследование роли структуры и ядерной
динамики на рентеновские спектры паров воды, жидкой воды и льда. Впервые удалось визуализировать Динамику индуцированного
вращения. Экспериментальные данные, дополненные теоретическими
расчетами позволили получить детальную структурную информацию о
жидкой воде, и было показано, что структура воды однородна.
Впервые удалось визуализировать Динамику индуцированного
вращения. Экспериментальные данные, дополненные теоретическими
расчетами позволили получить детальную структурную информацию о
жидкой воде, и было показано, что структура воды однородна.
Цифровая вода обещает безбрежные перспективы
Наука
|
Поделиться
страницы: предыдущая | 1 | 2 | 3
«К нашему великому удивлению, термолюминесцентное свечение всех трех систем оказалось существенно различным», сказал д-р Рей, отметив, что результат подтверждает различие в структуре водородных связей в различных образцах.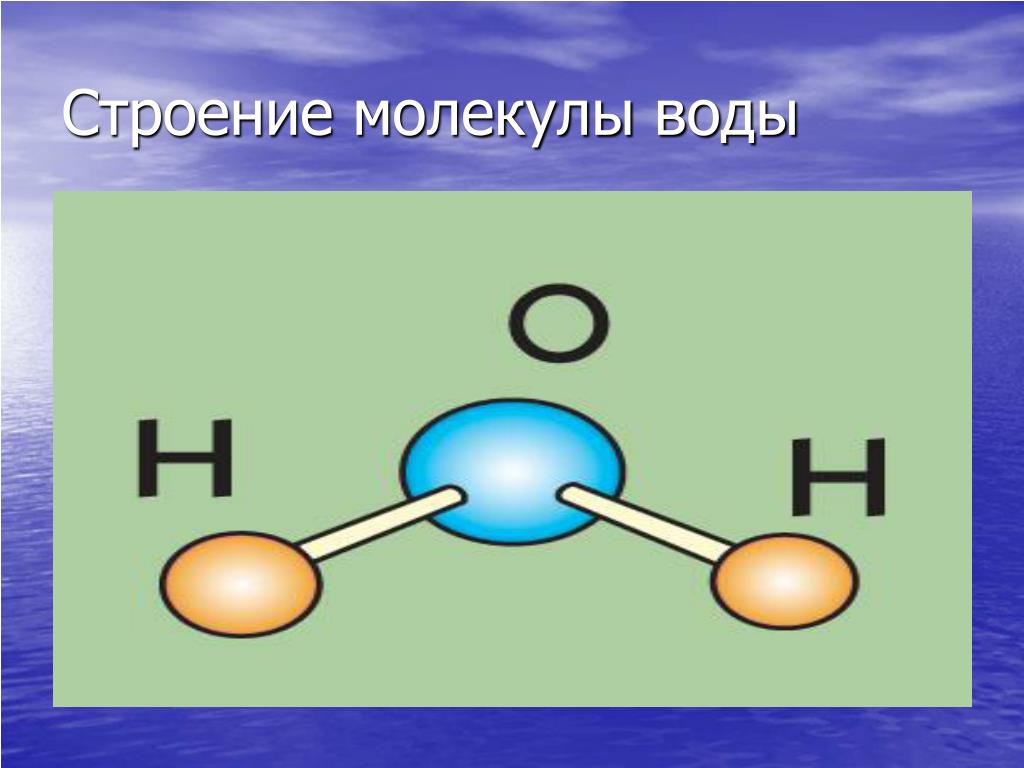
Мнения специалистов, как и положено, разделились. «Логическое обоснование д-ром Реем как памяти воды выглядит наименее правдоподобным, заявил Мартин Чаплин (Martin Chaplin) из лондонского South Bank University. Большинство водородных связей, существующих в жидкой воде, испытывают перестройку при замерзании».
В противоположность этому, эксперт в области термолюминесценции Рафаэль Висосекас (Rafael Visocekas) из парижского университета Дени Дидро, с которым Рей проводил эксперименты, заявил, что полностью убежден их результатами. «Эксперименты продемонстрировали чрезвычайно высокую воспроизводимость, считает он. Такой физике можно верить».
Мнение самого д-ра Бенвениста относительно данного эксперимента было достаточно взвешенным. «Это интересная работа, заявил он, однако эксперименты Рея проводились не в слепой методике, и, хотя он и заявил об их повторяемости, но не привел информации об их постановке. По собственному опыту знаю, насколько это противоречивая область исследований, и просто необходимо быть защищенным от случайных ошибок настолько, насколько это возможно».
По собственному опыту знаю, насколько это противоречивая область исследований, и просто необходимо быть защищенным от случайных ошибок настолько, насколько это возможно».
Ассоциаты: на пути к телепатической RAM
Новое подтверждение наличия у воды необычных свойств пришло из России. В проблемной лаборатории федерального научного клинико-экспериментального центра Минздрава РФ под руководством Станислава Зенина была продемонстрирована возможность контроля электропроводностью так называемых «ассоциатов» (clathrates). Ассоциатами называются долговременные в обычном состоянии стабильные (время жизни до нескольких часов и более) образования из молекул воды, достигающие микронных размеров и различимые в фазово-контрастный микроскоп. В обычном состоянии в дистиллированной воле клатраты электрически нейтральны.
При перемешивании воды под воздействием магнитного поля связи между элементами клатратов разрушаются, и сама вода превращается в «мертвую», лишенную структурных элементов субстанцию. При добавлении в такую воду исчезающе малых количеств другого вещества буквально одной молекулы ассоциаты клатраты начинают «воспринимать» ее электромагнитные свойства. В ходе экспериментов с более чем 500 испытуемыми, обладающими паранормальными способностями, обнаружилось, что некоторые из них способны чрезвычайно сильно влиять, в частности, на электропроводность воды, одной лишь силой мысли.
При добавлении в такую воду исчезающе малых количеств другого вещества буквально одной молекулы ассоциаты клатраты начинают «воспринимать» ее электромагнитные свойства. В ходе экспериментов с более чем 500 испытуемыми, обладающими паранормальными способностями, обнаружилось, что некоторые из них способны чрезвычайно сильно влиять, в частности, на электропроводность воды, одной лишь силой мысли.
Екатерина Столбова, фонд «Сколково»: Грант покроет до 80% расходов компаний на внедрение ИТ-решений
Поддержка ИТ-отрасли
«Мы только сейчас начинаем понимать, что свойства воды определяются не структурой молекулы воды, а существующими в воде макроструктурами ансамблями молекул, сообщил в беседе с корреспондентом CNews заведующий проблемной лабораторией федерального научного клинико-экспериментального центра Минздрава РФ Станислав Зенин. Об их роли может, например, свидетельствовать такой факт в отсутствие водородных связей между молекулами воды ее температура замерзания составляла бы около минус 100 градусов по Цельсию. Ближайший молекулярный аналог воды сероводород, молекула которого в два раза тяжелее молекулы воды, при нормальных условиях существует только в газообразном состоянии. Новый уровень понимания строения воды открывает новые перспективы в ее исследовании и использовании ее уникальных свойств. К сожалению, широко тиражируемая в последние дни информация о проведении экспериментов с использованием лиц с паранормальной психикой в стенах института медико-биологических проблем РАН не соответствует действительности. Тем не менее, действительно, научными подразделениями Минздрава доказано, что мысленное воздействие на воду в жидком состоянии регистрируемо научными методами посредством, например, контроля физических и/или химических свойств жидкости. Это позволяет уже сейчас начать использовать это свойство в прикладных целях. Например, возможно использовать воду для хранения цифровой информации т. е., как компьютерную память, причем с непосредственным „ментальным“ доступом к ней».
Ближайший молекулярный аналог воды сероводород, молекула которого в два раза тяжелее молекулы воды, при нормальных условиях существует только в газообразном состоянии. Новый уровень понимания строения воды открывает новые перспективы в ее исследовании и использовании ее уникальных свойств. К сожалению, широко тиражируемая в последние дни информация о проведении экспериментов с использованием лиц с паранормальной психикой в стенах института медико-биологических проблем РАН не соответствует действительности. Тем не менее, действительно, научными подразделениями Минздрава доказано, что мысленное воздействие на воду в жидком состоянии регистрируемо научными методами посредством, например, контроля физических и/или химических свойств жидкости. Это позволяет уже сейчас начать использовать это свойство в прикладных целях. Например, возможно использовать воду для хранения цифровой информации т. е., как компьютерную память, причем с непосредственным „ментальным“ доступом к ней».
страницы: предыдущая | 1 | 2 | 3
- Подобрать оптимальный виртуальный сервер VPS/VDS на ИТ-маркетплейсе Market.
 CNews
CNews
Молекула воды: строение в различных агрегатных состояниях
Содержание
- Модель строения воды
- Строение молекулы в различных агрегатных состояниях воды
- Твердое состояние воды
- Жидкое состояние воды
- Состояние газа
- Агрегатные состояния воды — переходные процессы
- Вода всегда вокруг нас
- Какие существуют 3 состояния воды в природе?
- Лёд – вода в твёрдом виде
- Химические названия
- Происхождение воды на планете
- Образование воды
- Наука о воде
- Значение на Земле
- Эмпирическое правило Клечковского
- Органолептические свойства воды
- Вкус
- Запах
- Цветность воды
- Мутность
Модель строения воды
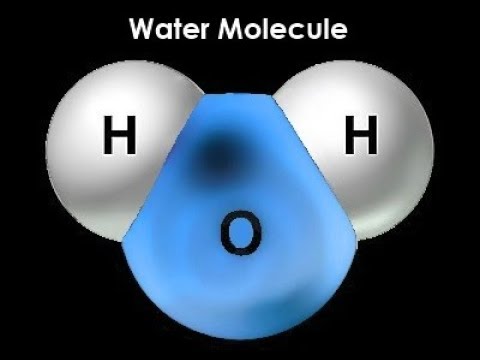
Молекула воды включает два атома водорода (Н) и один атом кислорода (О). Элементы, из которых состоит жидкость, определяют всю функциональность и особенности. Модель молекулы воды имеет форму треугольника. Вершину этой геометрической фигуры представляет крупный элемент кислорода, а внизу находятся небольшие атомы водорода.
Вершину этой геометрической фигуры представляет крупный элемент кислорода, а внизу находятся небольшие атомы водорода.
Молекула воды обладает двумя положительными и двумя отрицательными полюсами зарядов. Отрицательные заряды формируются из-за излишка электронной плотности у атомов кислорода, а положительные – из-за нехватки электронной плотности у водорода.
Неравномерное распределение электрических зарядов создает диполе, где диполярный момент составляет 1,87 дебай. Вода обладает способностью растворять вещества, поскольку ее молекулы пытаются нейтрализовать электрическое поле. Диполя приводят к тому, что на поверхности погруженных в жидкость веществ становятся слабее межатомные и межмолекулярные связи.
Вода отличает большой устойчивостью при растворении прочих соединений. В обычных условиях из 1 млрд молекул только 2 распадаются, а протон переходит в строение иона гидроксония (образуется при растворении кислот).
Вода не меняет свой состав при взаимодействии с другими веществами и не влияет на структуру этих соединений. Такая жидкость считается инертным растворителем, что особо важно для живых организмов. Полезные вещества поступают к различным органам через водные растворы, поэтому важно, чтобы их состав и свойства оставались неизменными. Вода сохраняет в себе память о растворенных в ней веществах и может применяться многократно.
Такая жидкость считается инертным растворителем, что особо важно для живых организмов. Полезные вещества поступают к различным органам через водные растворы, поэтому важно, чтобы их состав и свойства оставались неизменными. Вода сохраняет в себе память о растворенных в ней веществах и может применяться многократно.
Каковы особенности пространственной организации молекулы воды:
- Соединение проводится противоположными зарядами;
- Появляются межмолекулярные водородные связи, которые исправляют электронную неполноценность водорода с помощью дополнительной молекулы;
- Вторая молекула фиксирует водород по отношению к кислороду;
- Благодаря этому образуются четыре водородные связи, которые могут контактировать с 4 соседями;
- Такая модель напоминает бабочку и имеет углы равные 109 градусам.
Атомы водорода соединяются с атомами кислорода и образуют молекулу воды с ковалентной связью. Водородные соединения более сильные, поэтому, когда они разрываются, то молекулы присоединяются к другим веществам, способствуя их растворению.
Прочие химические элементы, в состав которых входит водород, замерзают при -90 градусах, а закипают при 70 градусах. Но вода становится льдом, когда температура достигает нуля, а закипает при 100 градусах. Чтобы объяснить такие отклонения от нормы, требуется разобраться, в чем особенность строения молекулы воды. Дело в том, что вода – это ассоциированная жидкость.
Это свойство подтверждается и большой теплотой парообразования, что делает жидкость хорошим энергоносителем. Вода – отличный регулятор температуры, способен нормализировать резкие перепады этого показателя. Теплоемкость жидкости повышается, когда ее температура 37 градусов. Минимальные показатели соответствуют температуре человеческого тела.
Относительная молекулярная масса воды составляет 18. Рассчитать этот показатель достаточно легко. Следует заранее ознакомиться с атомной массой кислорода и водорода, которая равна 16 и 1 соответственно. В химических задачах нередко встречается массовая доля воды. Этот показатель измеряется в проценте и зависит от формулы, которую требуется рассчитать.
Этот показатель измеряется в проценте и зависит от формулы, которую требуется рассчитать.
Строение молекулы в различных агрегатных состояниях воды
В жидком состоянии молекула воды состоит из моногидроля, дигидроля и тригидроля. Количество этих элементов зависит от агрегатного состояния жидкости. Пар включает одну H₂O – гидроль (моногидроль). Две H₂O обозначают жидкое состояние – дигидроль. Три H₂O включает лед.
Агрегатные состояния воды:
- Жидкое. Между одиночными молекулами, которые связаны водородными связями, располагаются пустоты.
- Пар. Одиночные H₂O никак не соединяются между собой.
- Лед. Твердое состояние отличается прочными водородными связи.
При этом существуют переходные состояния жидкости, например, при испарении или замерзании. Для начала требуется разобраться, отличаются ли молекулы воды от молекул льда. Так замерзшая жидкость имеет кристаллическую структуру. Модель льда может иметь форму тетраэдр, тригональной и моноклинной сингонии, куба.
Обычная и замерзшая вода отличаются плотностью. Кристаллическая структура приводит к меньшей плотности и увеличению объема. Основное различие между жидким и твердым состоянием – это количество, сила и разновидность водородных связей.
Состав не меняется ни в одном агрегатном состоянии. Отличается строение и движение составных частей жидкости, сила связей водорода. Обычно молекулы воды слабо притягиваются друг к другу, размещаются хаотично, поэтому жидкость такая текучая. Лед отличается более сильным притяжением, так как создается плотная кристаллическая решетка.
Многих интересует, одинаковы ли объемы и состав молекул холодной и горячей воды. Важно запомнить, что состав жидкости не меняется ни в одном из агрегатных состояний. Молекулы при нагревании или остывании жидкости отличаются расположением. В холодной и горячей воде разные объемы, так как в первом случае структура упорядоченная, а во втором – хаотичная.
В холодной и горячей воде разные объемы, так как в первом случае структура упорядоченная, а во втором – хаотичная.
Когда лед тает, то его температура не меняется. Только после того, как жидкость меняется свое агрегатное состояние, показатели начинают подниматься. Для таяния требуется определенное количество энергии, которое называется удельной теплотой плавления или лямбда воды. Для льда показатель равен 25000 Дж/кг.
Твердое состояние воды
Вода в твердом состоянии – это лёд и снег. Некоторые не понимают, к какому агрегатному состоянию воды относится иней. Конечно, к твёрдому! Это мелкая ледяная крошка, замерзшие капли росы.
Твердая – это замороженная вода. Когда она замерзает, ее молекулы отодвигаются подальше друг от друга, делая лед менее плотным, чем жидкость, т.е. вода в твердом состоянии занимает больший объем, чем в жидком.
Большинство веществ при снижении температуры сжимается, а вода – расширяется, и в этом ее уникальная особенность.
Замерзает – это значит, что при 0 градусов Цельсия вода кристаллизуется и переходит из жидкого состояния в твердое. Наличие в воде солей снижает температуру замерзания.
Наличие в воде солей снижает температуру замерзания.
На школьных олимпиадах встречается такой интересный вопрос: какой металл, находясь в расплавленном состоянии, может заморозить воду? Ответ – ртуть, которая начинает плавиться при температуре -39 градусов Цельсия. Понятно, что жидкая ртуть при температуре от -38 до 0 способна заморозить воду, отбирая у нее тепло.
Несмотря на то, что самое распространенное на нашей планете — жидкое состояние воды, значительная ее часть (2/3 всех пресноводных запасов) находится в замороженном виде. Площадь ледников – около 11% всей суши Земли.
Если жидкое состояние пресной воды переходит в твердое при 0 градусов Цельсия, то морская вода средней солености замерзает примерно при -1,8 градусах Цельсия.
Жидкое состояние воды
Вода в жидком состоянии встречается на нашей планете не только в реках и океанах. Облака состоят из крошечных капелек воды и кристалликов льда, и дождь – это тоже жидкая вода.
Также вода в жидком состоянии просачивается через почву и образует подземные водные горизонты, из которых черпается основная масса питьевой воды.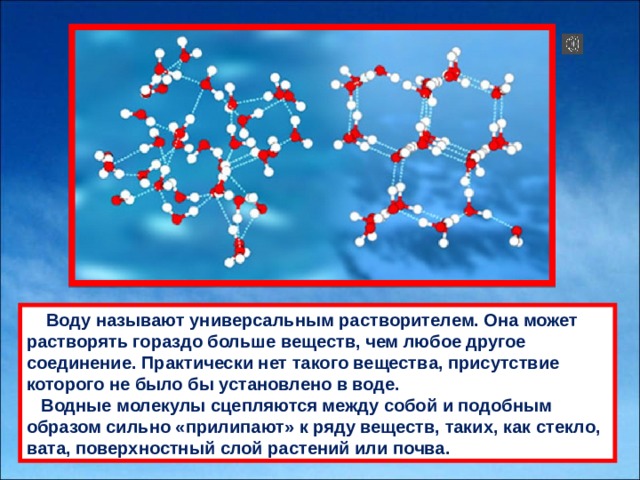
Вода в жидком состоянии отличается высокой прилипчивостью к различным твердым материям. Сама по себе она не является «влажной», но легко делает влажными большинство твердых материалов.
Жидкая вода легко переходит в твердое и газообразное состояние. Главным образом, это зависит от температуры. Но свою роль играет и давление.
Физический переход воды из жидкого состояния в газообразное называется испарением, потому что газообразное состояние воды называется паром.
Как жидкое состояние воды превращается в газообразное? Когда мы кипятим воду, она превращается из жидкости в газ, или водяной пар. Когда его часть остывает, мы видим небольшое облако, которое и называют паром. Хотя, если мы его видим, то это уже жидкое состояние воды, т.е. скопление ее микроскопических капелек.
Пар — это вода в газообразном состоянии, которое образуется, когда вода кипит или испаряется. Настоящий пар невидим; однако слово «пар» часто ошибочно относят к влажному пару, видимому туману, как аэрозолю водяных капель, образующихся при конденсации водяного пара.
И тут всплывает такое понятие, как «точка росы». Это температура воздуха, которая меняется в зависимости от давления и влажности, ниже которой водный пар начинает конденсироваться в водяные капли и образуется роса. Т.е. агрегатное состояние воды из газообразного состояния меняется на жидкое.
Закипает жидкая пресная вода при 100°C (градусах Цельсия) или 212°F (градусах Фарингейта), в условиях нормального атмосферного давления. Чем ниже давление (например, в горах), тем выше температура кипения.
Состояние газа
Итак, вода в газообразном состоянии – это пар. Утверждение, что большая часть воды в гидросфере находится в газообразном состоянии – не верно.
Не все хорошо себе представляют, в каком состоянии вода способна испаряться. Оказывается, вода в твердом состоянии испаряется так же, как и жидкая, только медленнее! Скорость испарения зависит от температуры. Т.е. в газообразное состояние вода может переходить прямо из твердого, минуя жидкое.
Испаренная с поверхности Земли вода в газообразном состоянии образует облака и тучи
Агрегатные состояния воды — переходные процессы
Процессы перехода воды с одного агрегатного состояния в другое определяются следующим образом:
- Кипение и парообразование — переход воды из жидкого состояния в пар;
- Конденсация — процесс перехода пара в жидкое состояние воды;
- Кристаллизация — переход жидкости в лед;
- Плавление – переход льда в жидкость;
- Сублимация – переход льда прямо в парообразное состояние;
- Десублимация – переход пара сразу в лед, примером может служить иней.

Граничные точки перехода воды в состояния лед/вода и вода/пар определили соответственно как 0 и 100 градусов по Цельсию при условии атмосферного давления 760 мм рт. ст. или 101 325 Па. Всем с детства хорошо известна простая примета, температура за окном опустилась ниже нуля, ждите снега 🙂
Вода всегда вокруг нас
Водный баланс – это основа жизни на нашей планете. Большая её часть на Земле – это океаны и моря. В них сосредоточено 97% данного вещества. Остальные 3 % – это реки, озёра, пруды, подземные воды и парообразная вода в атмосфере. Растения и животные для обеспечения своей жизнедеятельности ежедневно потребляют живительную влагу.
Вода – это составляющая часть организма человека. Каждая наша клетка больше чем наполовину состоит из этой жидкости. Кровь, текущая в наших венах, – это на 82% вода. Мышцы и кожа содержат её 76%. Удивительно, но даже кости в своём составе имеют до 30% воды. Её наименьшее содержание в зубной эмали – всего 0,3%.
Общая масса воды на планете Земля – более 2 000 000 000 миллионов тонн.
Какие существуют 3 состояния воды в природе?
На вопрос «Что такое вода?» почти все без раздумий отвечают: «Это жидкость!». Ведь чаще всего мы привыкли видеть жидкое состояние воды в природе. Но на самом деле она может иметь разные формы, кардинально отличающиеся одна от другой.
Вода бывает в трёх состояниях:
- жидкая форма;
- парообразное состояние;
- твёрдая агрегатная форма — лёд.
Лёд – вода в твёрдом виде
Н2О из жидкого переходит в твёрдое агрегатное состояние при снижении температуры ниже 0 градусов по Цельсию. Интересно то, что почти все предметы при охлаждении уменьшаются в объёмах, а вода, наоборот, замерзая, расширяется. Если так она прозрачная и бесцветная, то при замерзании может приобретать белый цвет из-за попадания частичек воздуха внутрь льда.
Необычно, что при одной и той же кристаллической структуре лёд может иметь множество разнообразных форм. Твёрдое состояние воды в природе — это гигантские айсберги, блестящая корка льда на реке, белые хлопья снега, сосульки, висящие на крышах.
Лёд имеет огромное значение для хозяйственной деятельности человека и оказывает большое влияние на поддержание жизнедеятельности многих организмов. Например, при замерзании реки он выполняет защитную функцию, сохраняя водоём от дальнейшего промерзания, этим самым оберегая подводный мир.
Но также лёд может стать причиной разрушительных стихийных бедствий. Например, град, обледенение зданий и летательных аппаратов, промерзание почвы, ледяные обвалы.
В быту мы используем замёрзшую воду как хладагент, бросая небольшие кубики льда в напитки для их охлаждения. Подобным образом могут охлаждаться пищевые продукты и медицинские препараты.
Химические названия
Почему же воду назвали водой? Слово «вода» происходит от древнегерманского «мокрый, текучий». В химии могут встречаться разные названия этого соединения. Самые распространенные – гидроксид водорода и окись водорода. Также в химической литературе ее называют:
- монооксид дигидрофосфата;
- гидроксильная кислота;
- дигидромонооксид
- оксидан
Происхождение воды на планете
Возникновение воды на нашей планете является предметом научных споров. Существует 2 основные гипотезы:
Существует 2 основные гипотезы:
- Космическое происхождение. Часть учёных считают, что вода появилась вследствие падающих метеоритов, астероидов, которые содержали воду.
- Земное происхождение. Другие учёные считают, что вода образовалась на Земле во время формирования, а не занесена с космоса.
Образование воды
Многих интересует, какая вода находится в реках, морях, под землей. Образовавшаяся миллиарды лет назад вода сконцентрировалась в океанах. Из океанов она испаряется и поднимается, где образуются облака. После долгого путешествия она возвращается на землю в виде осадков. Вода собирается и возвращается через реки обратно в море. Часть просачивается в почву и попадает в грунтовые воды. Там формируются новые источники, которые текут в море.
В более холодном климате вода остается на ледниках, которые очень медленно, стекают к более низким высотам, где и тают. В полярных регионах этот механизм скольжения настолько медленный, что в ледниках можно найти воду, попавшую на поверхность Земли десятки тысяч лет назад. Вот откуда берется в природе вода.
Вот откуда берется в природе вода.
Наука о воде
Изучением природных вод, явлений и процессов занимается наука Гидрология.
Первые упоминания о гидрологии появились на заре истории человечества около 6000 лет назад.
Начало гидрологических наблюдений в России относится к XV–XVI вв.: в записях русских летописцев сохранились сведения о свойствах воды, наводнениях, паводках, замерзании.
Значение на Земле
Без воздуха человек может прожить несколько секунд, без еды – несколько месяцев, без воды – максимум несколько суток. Снижение содержания воды в организме всего лишь на 2% может вызвать сильную слабость. При нехватке 8% уже может возникнуть серьезное недомогание, а при 12% – смерть.
Каждая клетка живого организма состоит из жидкости и нуждается в регулярном пополнении. Без воды не проживут ни люди, ни растения, ни животные.
Вода формирует климат, участвует в круговороте воды в природе, для многих живых организмов является средой обитания.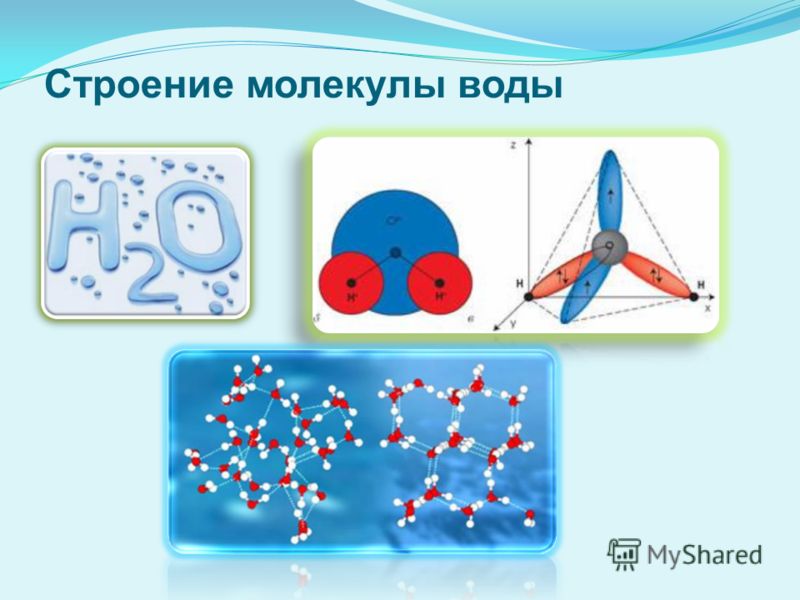
Эмпирическое правило Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами орбиталей 4f, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.
Органолептические свойства воды
Сюда относятся показатели, которые возможно определить органами чувств. К ним относятся вкус, запах, цвет (цветность), мутность (прозрачность или непрозрачность). Часть параметров определяется не только с помощью носа, глаз, языка, но и на аналитическом оборудовании.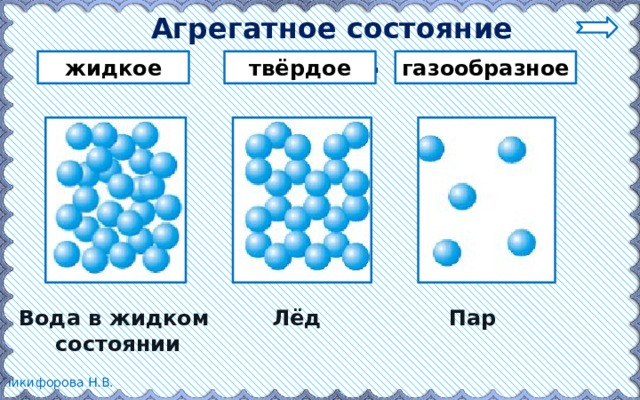 Например, мутность и цветность определяют используя фотометр, а прозрачность — цилиндр и градировочную шкалу.
Например, мутность и цветность определяют используя фотометр, а прозрачность — цилиндр и градировочную шкалу.
Вкус
Характеризует вкусовые ощущения от попадания жидкости на рецепторы языка. Оценивается в баллах. иногда добавляют описание вкуса, помогающее оценить пригодность для питья, содержание специфических химических веществ.
Оценивают вкус только питьевой воды, к которой относится бутилированная и водопроводная. Некоторые лаборатории определяют вкус только бутилированной при условии предоставления запечатанной тары (бутылки). Это обусловлено заботой о безопасности сотрудников. Представьте себя на месте химика-аналитика, который вынужден пробовать жидкость из неизвестного источника. Курьезные случаи: список параметров анализа «сточки» содержал вкус. Разумеется, никто не пробовал канализационные стоки, это опасно.
Запах
Оценивает ощущения от вдыхания пара, образующегося над сосудом, содержащим исследуемую жидкость, через нос.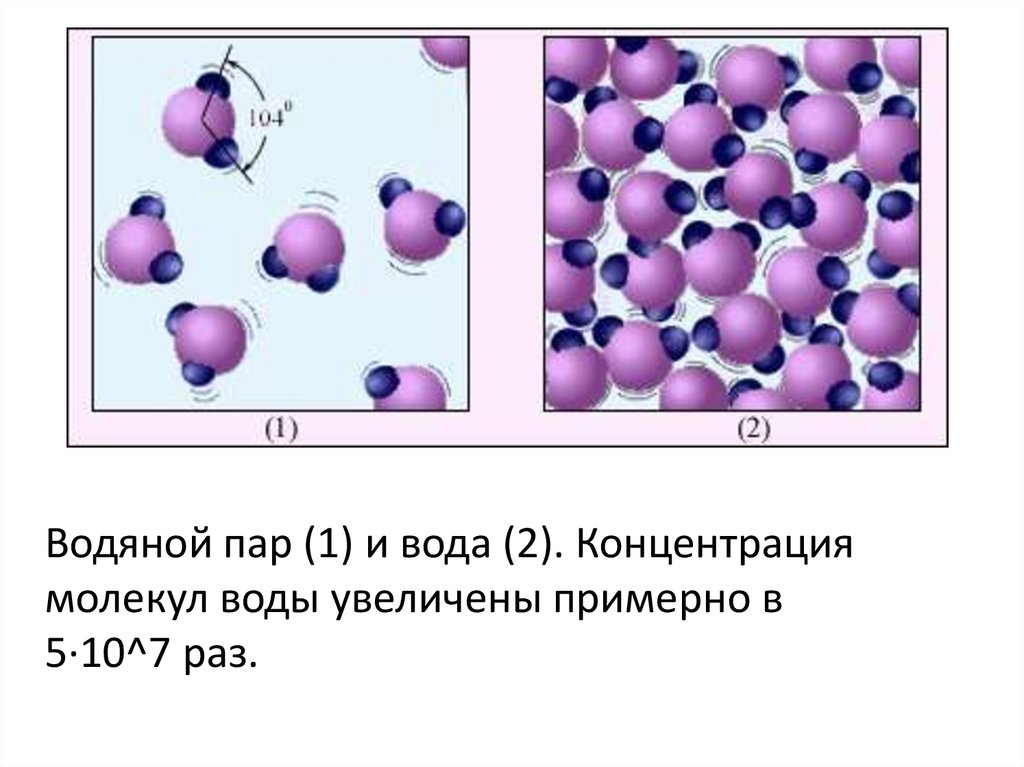 Запах выражают баллами, которые характеризуют интенсивность запаха, а также указывают его характер, например:
Запах выражают баллами, которые характеризуют интенсивность запаха, а также указывают его характер, например:
- цветочный
- специфичный химический
- болотный
- затхлый
- свежести
- гнилостный
Выделяют специфические запахи химических соединений, например, хлора, сероводорода, фенола. По этой причине определение запаха предшествует определению других компонентов, помогает рассчитать коэффициент разбавления, скорректировать подготовку проб. Определять запах могут только сотрудники, прошедшие специальное обучение. Среди требований к помещению числится обеспечение отсутствия мешающих воздействий, включая цвет стен, а также отсутствие посторонних запахов.
Погрешность определению запаха добавляет использование неправильной тары для отбора. К ней относятся бутылки из-под газированных, ароматизированных напитков. Даже если тщательно вымыть такую тару запах все равно сохранится.
Цветность воды
Определяет изменение длины волны светового луча при прохождении через толщу раствора.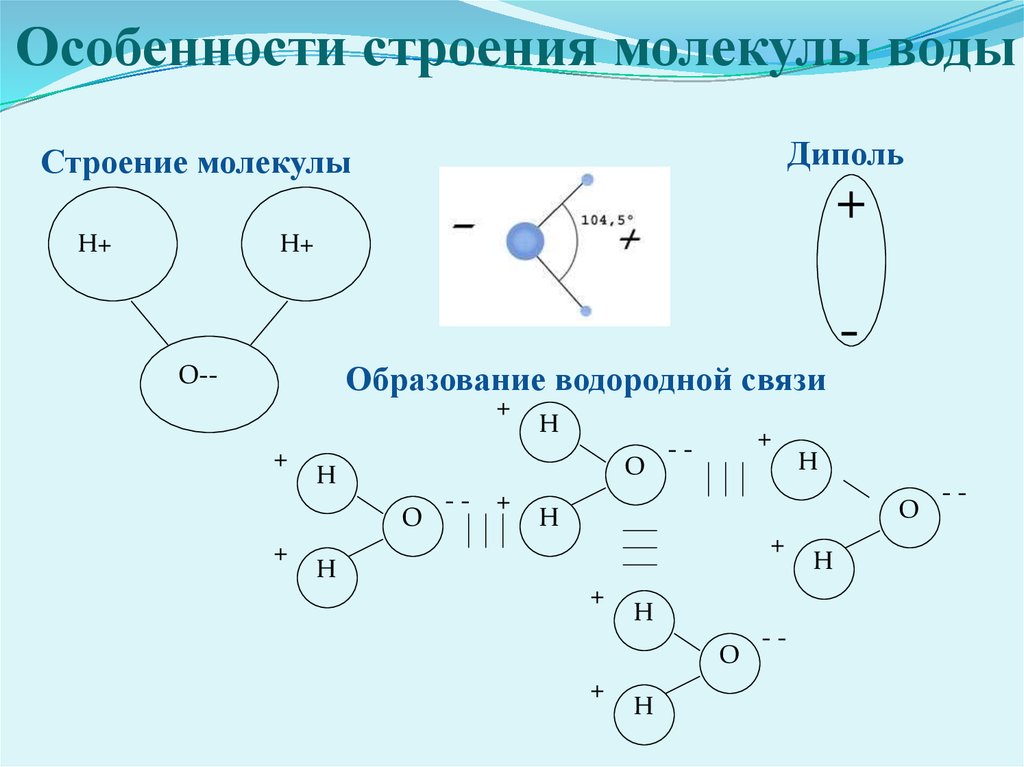 Проще говоря, сосуд прямоугольной формы (длина большей стороны 1 или 5 сантиметров) заполняют исследуемым раствором, пропускают через него свет, изучают изменение этого света. Исследование проводят на оптическом приборе — фотометре или спектрофотометре. При проведении экспресс-анализа используют сравнение с стандартной шкалой. Это быстро, но не точно.
Проще говоря, сосуд прямоугольной формы (длина большей стороны 1 или 5 сантиметров) заполняют исследуемым раствором, пропускают через него свет, изучают изменение этого света. Исследование проводят на оптическом приборе — фотометре или спектрофотометре. При проведении экспресс-анализа используют сравнение с стандартной шкалой. Это быстро, но не точно.
Чистая вода не имеет цвета, по крайне мере, его не видно, если толщина слоя менее метра. Цветность появляется если раствор содержит соединения, изменяющие окраску. К ним относятся органические вещества (гуминовые, органические красители), минеральные компоненты или их комплексы (большинство металлов образуют окрашенные соединения при взаимодействии с гидроксидом или анионами минеральных кислот). По величине цветности судят об общем содержании «цветных» соединений, отдельные группы не выделяют. Как правило, обращают внимание на специфическую окраску, которая помогает при проведении анализа. Например, ржавая говорит о высоком содержании железа, коричневая — признак гуминовых соединений, синие оттенки — выраженное химическое загрязнение.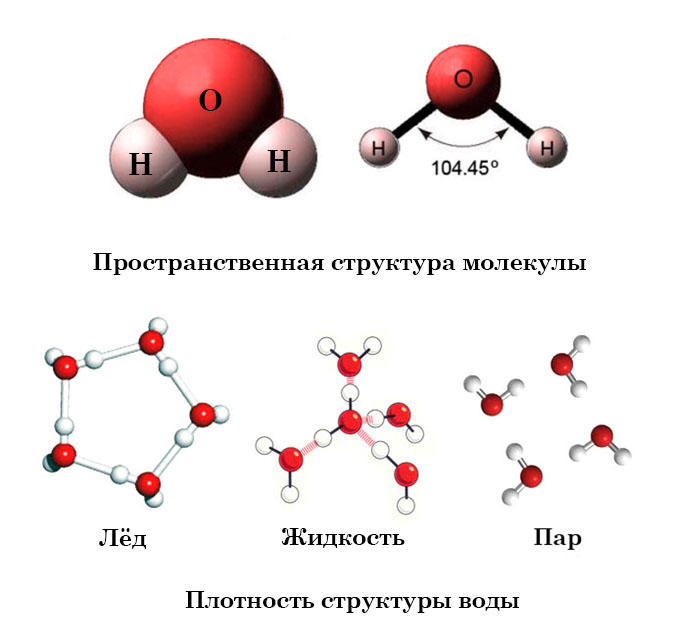
Мутность
Показывает содержание едва заметных взвешенных частиц, которые снижают способность раствора пропускать свет. Это происходит за счет того, что взвесь отражает, рассеивает часть света, проходящего через слой жидкости. Мутность определяют экспресс-методом используя цилиндр с прозрачным дном и бумагу с нанесенным стандартным шрифтом. При таком определении параметр могут называть прозрачностью по шрифту. Мутность не выявляет конкретный компонент, то есть определить характер взвеси определяя только этот параметр невозможно. Он выявляет присутствие посторонних частиц, служит показанием к проведению дополнительных анализов или установке механического фильтра.
Источники
- https://VodaVoMne.ru/svojstva-vody/molekula-vody
- https://VodaVoMne.ru/svojstva-vody/agregatnye-sostoyaniya-vody
- https://vodamama.com/sostoyaniya-vody.html
- https://FB.ru/article/189598/sostoyanie-vodyi-v-prirode-voda-v-tr-h-agregatnyih-formah
- https://VodaVoMne.
 ru/svojstva-vody/voda
ru/svojstva-vody/voda - https://vodasila.ru/o-vode/vsyo-o-vode-rol-na-planete-zemlya
- https://www.sciencedebate2008.com/elektronnyye-formuly-atomov/
- https://www.msulab.ru/knowledge/water/pokazateli-kachestva-vody/
10 уникальных состояний воды — фото
Вода может существовать только в жидком, твердом и газообразном состоянии, не так ли? Нет! Она может существовать в невероятном количестве других состояний, включая те, о которых вы даже не слышали. Вы можете поверить, что вода может превратиться в горячий лед или даже пудру? Да уж, порошкообразная вода – это вещь.
Сейчас вы можете подумать: «Как же это возможно?» Ну, для этого нужно соблюсти очень много условий. В большинстве случаев главными факторами являются время, температура и давление. В других случаях с водой происходят странные вещи, когда ее смешивают с другими субстанциями.
- Квантовая вода
- Горящий лед
- Аморфный лед
- Аэролед
- Сверхзвуковой лед
- Тройная точка воды
- Плазменная вода
- Сверхкритическая вода
- Сухая вода
- Лед VII
10. Лед VII
Лед VII
Лед холодный. Но не лед VII (так называемый «горячий лед»), который, вообще-то, горячий. Ученые называют обычный лед, который есть у нас на Земле «лед Ih», где маленькая «h» означает «шестигранник», так как атомы кислорода выстраиваются в форме шестигранника, когда вода замерзает при нормальном давлении.
Но лед Ih превращается в лед II, когда давление увеличивается. Лед II превращается в лед III при еще большем увеличении давления, и так продолжается все дальше и дальше, пока он не превращается в лед VII, в котором атомы расположены в форме куба.
Лед VII горячий, потому что он формируется под высоким давлением и температурой. На Земле он теоретически может существовать только глубоко под мантией, где давление достаточно высокое, чтобы превратить обычную воду в лед VII. Но, с другой стороны, он не может там сформироваться, потому что высокая температура превратит воду в пар раньше, чем давление превратит ее в лед VII.
Ученые создали лед VII в лабораторных условиях.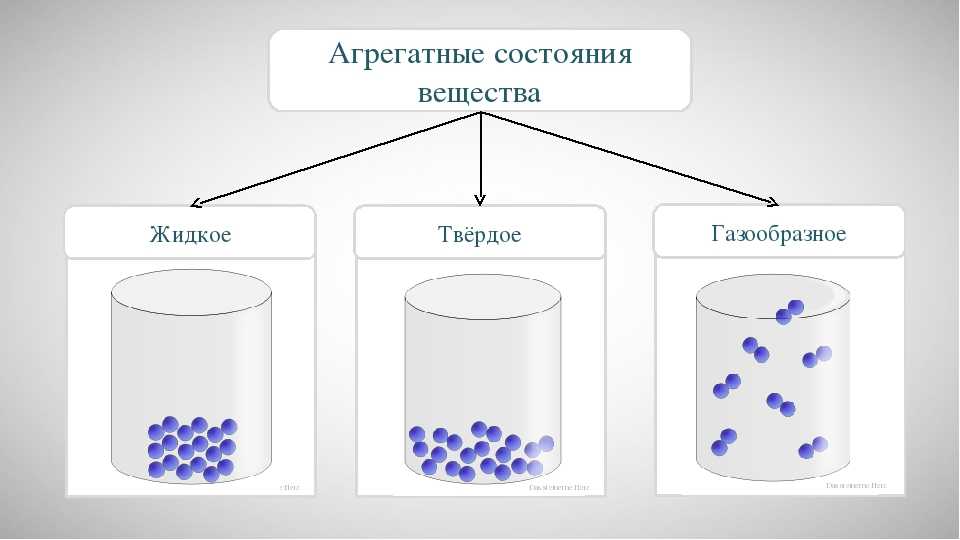 Они так же обнаружили его в составе алмазов, сформированных глубоко в мантии Земли. Лед был создан из капель воды, которые попали в алмазы в то время, когда те только формировались в мантии.
Они так же обнаружили его в составе алмазов, сформированных глубоко в мантии Земли. Лед был создан из капель воды, которые попали в алмазы в то время, когда те только формировались в мантии.
9. Сухая вода
Мы получаем сухую воду при смешивании обычной воды с двуокисью кремния (при помощи машин). Она ведет себя как сухое твердое вещество, хотя и является водой на 95 процентов. Она состоит из сахарообразных крупинок, которые на самом деле являются капельками воды, покрытыми двуокисью кремния. Кремний не дает каплям соединиться и превратиться в жидкость.
Сухая вода была создана в 1968 г., и в то время использовалась в косметологии. Вскоре все про нее забыли, пока в 2006 году ее не открыли заново в Университете Халла, Великобритания.
Ученые считают, что сухую воду можно использовать для поглощения углекислого газа из атмосферы. Это может сработать, учитывая, что сухая вода поглощает в три раза больше углекислого газа, чем просто обычная вода. Ученые также рассматривают возможность использования ее для хранения и транспортировки вредных химических веществ.
Ученые также рассматривают возможность использования ее для хранения и транспортировки вредных химических веществ.
8. Сверхкритическая вода
Вещество достигает сверхкритического состояния, когда его температура и давление становятся настолько высокими, что границы между жидким и газообразным состояниями стираются. В случае с водой это происходит после газообразного состояния. Вода становится твердой, жидкой, газообразной и сверхкритической – именно в таком порядке. Вода в этой точке существует как странный пар, который фактически газом и не является.
Вода достигает сверхкритического состояния при 373 градусах по Цельсию и при давлении в 220 бар. В таком состоянии она не может вернуться в жидкое состояние. Сверхкритическая вода (как и любая сверхкритическая жидкость) в таком состоянии может проходить через твердое вещество – как газ, но все еще может растворять другие вещества – как жидкость.
7. Плазменная вода
Плазменная вода
Глис 1214 б – одна из самых странных планет. Она в шесть раз больше Земли и полна воды – включая плазменную воду, то есть вода там существует в плазменном состоянии.
Материя в плазменном состоянии немного похожа на газ. У нее низкая плотность, а также нет определенной формы или объема – прямо как у газа. Но с другой стороны, в отличие от газа, атомы материи лишены своих электронов. И положительно заряженные ядра перемещаются свободно. Вот почему некоторые ученые считают плазму электрически заряженной версией газа.
Возвращаясь к Глис 1214 б. Планета находятся так близко к своей звезде, что год на ней длится всего лишь 38 часов. Для сравнения Земля находится в 70 раз дальше от Солнца. Дневная температура может достигать 282 градуса по Цельсию, что слишком горячо для любой формы жизни.
Близость Глис 1214 б к своей звезде может быть причиной того, что вода на ней существует в форме плазмы.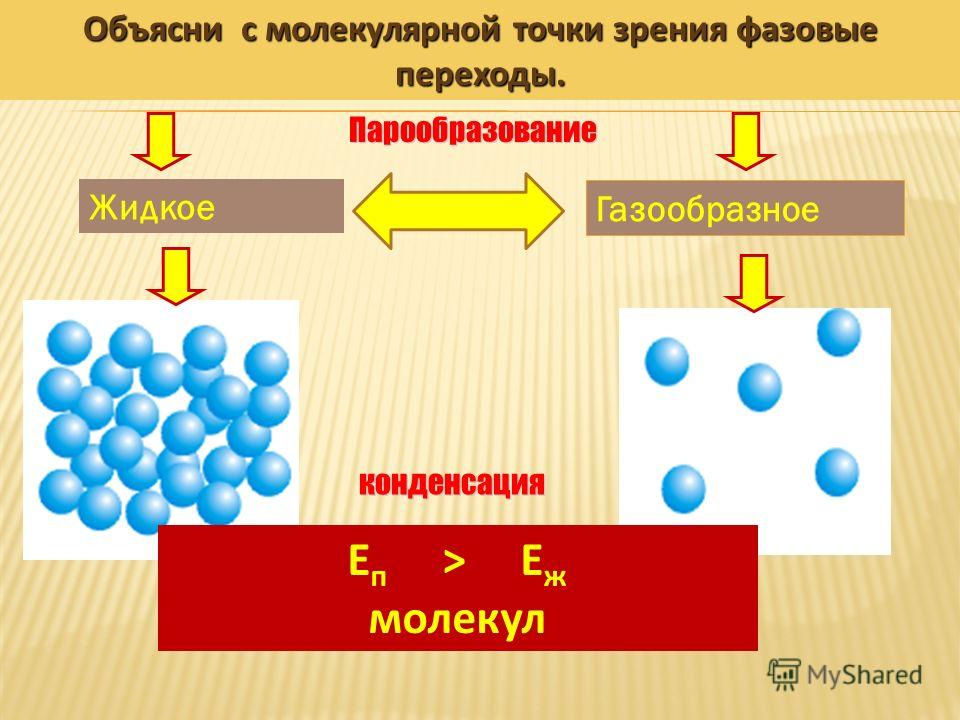 Непомерно высокая температура и высокое давление на самой планете заставляют воду нагреваться и сжиматься настолько, что она превращается в плазму. Плазменная вода считается одной из сверхкритических форм воды, о которых мы упоминали ранее.
Непомерно высокая температура и высокое давление на самой планете заставляют воду нагреваться и сжиматься настолько, что она превращается в плазму. Плазменная вода считается одной из сверхкритических форм воды, о которых мы упоминали ранее.
6. Тройная точка воды
Тройная точка вещества определяется как условия, когда вещество может существовать в твердом, жидком и газообразном состоянии и находится в термодинамическом равновесии. Это может случиться, только если вещество достигает специфической температуры и давления. Для воды эта температура, равная 273,16 по Кельвину (0,01 по Цельсию) и давление, равное 611,66 Паскалей (6,1166 мБар, 0,0060366 атмосфер), соответственно.
Тройную точку воды используют для определения температуры по Кельвину, калибровки термометров и определения тройной точки других жидкостей. Вода в своей тройной точке может быть превращена в твердое вещество, жидкость или газ, просто регулировкой давления и температуры соответственно.
5. Сверхзвуковой лед
Сверхзвуковой лед, или лед XVIII – это еще одна форма льда, сформированная массивным повышением температуры и давления. Он горячий, черный, плотный и ведет себя как металл. Твердый куб изо льда XVIII в четыре раза тяжелее, чем такой же куб из обычного льда. Некоторые ученые верят, что лед XVIII может быть обычной формой воды во вселенной, существуя на «ледяных гигантах», как Уран и Нептун.
Интересно, что ученые подтвердили существование льда XVIII только в 2019 году, хотя о его существовании говорилось еще в 1988 году. В том году группа ученых предположила, что вода может вести себя как металл, если температура и давление достаточно высоки. Лед XVIII образуется, только если температура достигает тысячи градусов, а давление – миллион атмосфер.
Ученые получили лед XVIII в результате эксперимента, в котором они использовали мощные лазеры, чтобы создать ударные волны, которые мгновенно повышали температуру и давление, оказываемое на капли воды. Ученые наблюдали, как молекулы водорода и кислорода моментально разделялись по мере того, как вода превращалась в кристаллы льда.
Ученые наблюдали, как молекулы водорода и кислорода моментально разделялись по мере того, как вода превращалась в кристаллы льда.
Молекулы кислорода формировали замороженные, твердые структуры, называемые кубическими решетками, в то время как молекулы водорода стекали, как жидкость, вокруг затвердевшего кислорода. Некоторые ученые говорят, что этот так называемый лед нельзя считать водой, потому что молекулы водорода и кислорода разделены. Они говорят, что молекулы водорода и кислорода должны быть вместе, чтобы считаться водой.
4. Аэролед
Аэролед – это самая легкая версия льда извне. Он был «обнаружен» в симуляции в 2017 году исследователями из Университета Окаяма в Японии во время эксперимента, проводимого, чтобы понять, как вода превращается в лед. Исследовательская группа создала эту форму льда, когда они попытались выяснить, что происходит, когда вода замерзает при отсутствии давления.
Остальные формы льда, упомянутые здесь, были созданы при экстремально высоком давлении, оказываемом на воду. Эта симуляция была проведена при нулевом давлении.
Эта симуляция была проведена при нулевом давлении.
Ученые создали аэролед путем извлечения двух атомов кислорода в диоксиде кремния (так называемом кварце), оставив только кремний. Затем они заменили атомы кремния атомами кислорода, прежде чем присоединить два атома водорода для образования льда. Это решение может иметь разные последствия того, как вода поведет себя в нанотрубках, нанопорах или других частях космоса.
3. Аморфный лед
Аморфный лед был создан мгновенным охлаждением жидкой воды, так что у молекул не было времени, чтобы образовать кристаллическое вещество. Не имея нормальной упорядоченной кристаллической структуры обычного льда, аморфный лед считается стеклом, то есть жидкостью, которая движется очень медленно. Аморфный лед не распространен на Земле, но считается одной из самых распространенных форм воды во вселенной.
Исследование 2007 года, включающее компьютерные симуляции аморфного льда, подразумевало, что это стекло может представлять собой состояние между кристаллическим и жидким. Смоделированный аморфный лед показал неупорядоченную гиперуниформность, в которой есть порядок на больших пространственных расстояниях, но нет на коротких расстояниях.
Смоделированный аморфный лед показал неупорядоченную гиперуниформность, в которой есть порядок на больших пространственных расстояниях, но нет на коротких расстояниях.
2. Горящий лед
Гидраты метана – это своего рода лед, который действительно может гореть, так что вы можете поджечь его, как лист бумаги. Лед, о котором идет речь, содержит метан. Он естественным образом образуется на определенных глубинах океана, в вечной мерзлоте и даже в нефте- и газопроводах, где может вызвать засоры. Это последнее состояние, которое было обнаружено еще в 1930-х годах.
Горящий лед считается сжатым и замороженным метаном. Замороженный метан вскоре покрывается льдом, создавая горящий лед. Ученые считают этот лед возможным источником топлива, исходя из того, что он содержит много метана. Кубометр горящего льда может высвободить 160 кубометров метана. Он также считается более чистым, чем уголь.
К сожалению, многие страны не могут заменить свой уголь горящим льдом, потому что его трудно добывать из-под воды.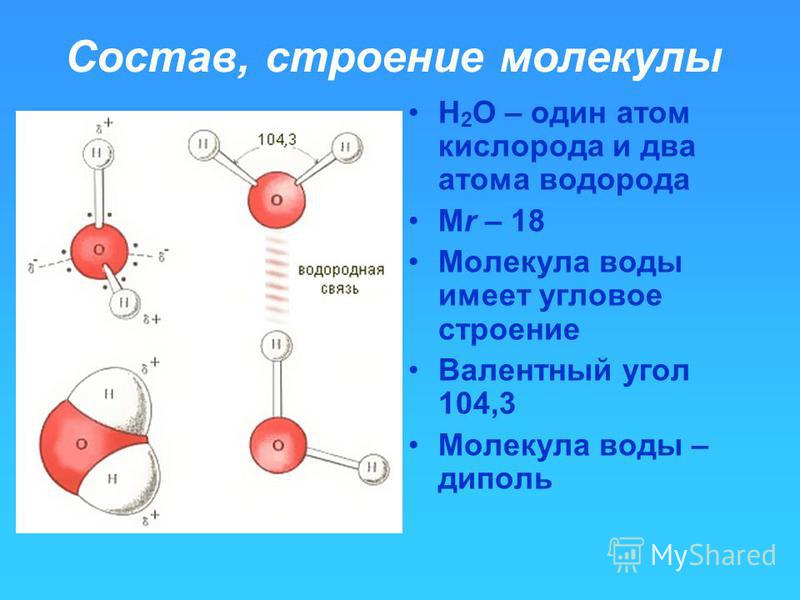 Он также становится нестабильным, когда его выносят на поверхность. Ученые говорят, что горящий лед может также обернуться в другую сторону и усугубить изменение климата. Это может произойти, когда гидрат метана, содержащийся в вечной мерзлоте, расплавится и выпустит метан в атмосферу.
Он также становится нестабильным, когда его выносят на поверхность. Ученые говорят, что горящий лед может также обернуться в другую сторону и усугубить изменение климата. Это может произойти, когда гидрат метана, содержащийся в вечной мерзлоте, расплавится и выпустит метан в атмосферу.
1. Квантовая вода
В 2016 году ученые из Национальной лаборатории Оук-Ридж Министерства энергетики США создали новое квантовое состояние воды. Они сделали свое открытие, «продавливая» молекулы воды между шестиугольными кристаллами берилла.
Массивное сжатие увеличило давление настолько, что атомы молекул воды стали неровными, и с этого момента вода больше не подчиняется ряду физических законов. Молекулы смогли пройти через барьеры на атомном уровне, и их поведение теперь объясняется квантовой механикой и называется «туннелированием».
Это поведение возникает только, когда вещество находится в квантовом состоянии.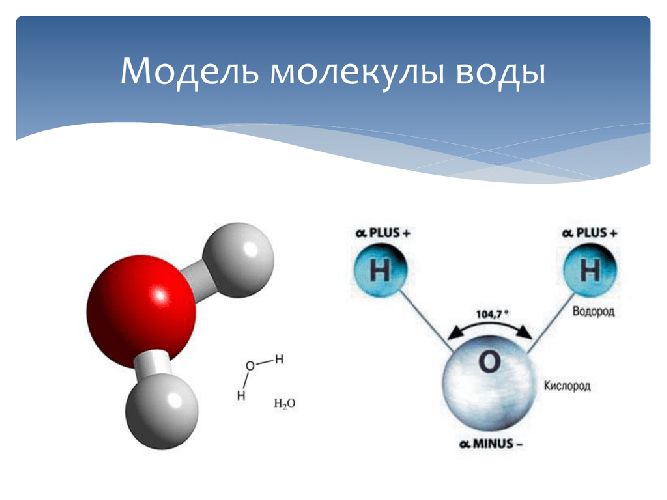 Ученые верят, что вода часто переходит в квантовый режим, проходя через очень узкие полости в скалах, почве или даже через стенки клеток живых существ.
Ученые верят, что вода часто переходит в квантовый режим, проходя через очень узкие полости в скалах, почве или даже через стенки клеток живых существ.
Мы уже много лет продаем и устанавливаем фильтры питьевой воды по всей Украине и искренне верим в свое дело. То, что фильтры способны обеспечивать Вас качественной водой — перепроверено многократно. Если у Вас есть вопросы по финансовой части, предлагаем статью со сравнительным расчетом заказа бутиллированной воды, или фильтра — вы удивитесь!
Самая крутая молекула — MEL Chemistry
[Deposit Photos]В XVIII веке Антуан Лавуазье пропустил через воду электрический ток и обнаружил в ее составе два газа: водород и кислород.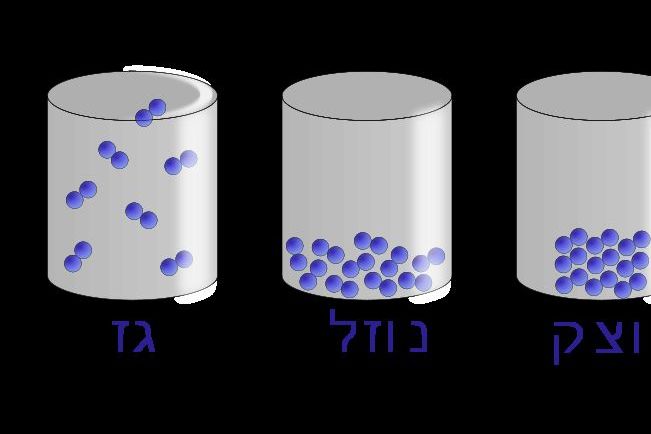
Формула молекулы воды — H₂O — два атома водорода и один атом кислорода. Помимо того, что эти атомы связаны в одну молекулу, их электрические заряды способствуют тому, что молекулы воды могут соединяться друг с другом, образуя водородные связи. Именно маленький размер атома водорода позволяет сильнополярным молекулам, в которых он присутствует, сближаться достаточно тесно для образования этих связей. Они не так сильны, как связи атомов внутри молекулы (ковалентные связи), но именно из-за них молекулы воды притягиваются друг к другу сильнее, чем молекулы многих прочих веществ.
Из-за водородных связей у воды очень высокая удельная теплоемкость. Это означает, что нужно довольно много энергии, чтобы нагреть воду. Судя по расположению кислорода в таблице Менделеева и температурам кипения гидридов (соединений с водородом) аналогичных кислороду элементов (серы, селена, теллура), вода без водородных связей кипела бы при −80 °С, а замерзала при −100 °С.
com/embed/3o7bu528Nh2dxfGrdK» frameborder=»0″ allowfullscreen=»»/>via GIPHY
Кипящая вода
Водородными связями объясняются капиллярные явления. Их можно наблюдать, например, когда краска поднимается между ворсинками кисточки. Молекулы воды притягивают друг друга настолько сильно, что преодолевают силу гравитации. Когда с листьев на деревьях испаряются молекулы воды, они по капиллярам внутри ствола подтягивают воду вверх от самых корней.
via GIPHY
Капля воды
Водородные же связи обеспечивают воде высокое поверхностное натяжение. Благодаря ему вода может собираться в капли, её можно налить в чашку «с горкой», а некоторые насекомые могут ходить по ней, как по суше. Незадолго до рождения в легких человека вырабатывается так называемое поверхностно-активное вещество (ПАВ). Это сложная субстанция из 6 липидов и 4 протеинов. Она помогает новорожденным начать дышать. Сила поверхностного натяжения настолько велика, что недоношенным младенцам с дефицитом ПАВ просто не хватает сил, чтобы раздуть легкие. К счастью, в наши дни поверхностно-активные вещества доступны в виде лекарств.
Сила поверхностного натяжения настолько велика, что недоношенным младенцам с дефицитом ПАВ просто не хватает сил, чтобы раздуть легкие. К счастью, в наши дни поверхностно-активные вещества доступны в виде лекарств.
Универсальный растворитель
Наличие водородных связей делает воду универсальным растворителем. Она растворяет соли, сахара, кислоты, щелочи и даже некоторые газы (например, диоксид углерода, который шипит в газировке). Подобные вещества называются гидрофильными (любящими воду), именно потому что они легко растворяются в воде.
И наоборот, жиры и масла являются гидрофобными. Это означает, что их молекулы не способны образовывать водородные связи. Поэтому вода отталкивает такие молекулы, предпочитая образовывать связи внутри себя. Чтобы отмыть руки от жира, мы используем мыло, в молекулах которого есть и гидрофобные и гидрофильные части. Гидрофобные цепляются к жиру, разбивая его на мелкие капельки. Гидрофильными же частями эта конструкция цепляется за поток воды и отправляется вместе с ним в канализацию.
Двух одинаковых снежинок не бывает
Во-первых, на то, в какую форму заморозятся молекулы воды, влияют малейшие изменения температуры и влажности. А во-вторых, одна среднестатистическая снежинка содержит 10 квинтиллионов (10 и еще 18 нулей) молекул воды. И это дает некоторый простор для творчества.
Вода — одна из немногих субстанций, которые расширяются, когда переходят в твёрдое состояние. Обычно, замерзая, вещества уплотняются и становятся тяжелее жидких форм. Но ведь кубики водяного льда плавают в верхних слоях наших напитков! И, что более ценно для живых организмов, лед в водоемах образуется тоже сверху, не позволяя промерзнуть остальной воде.
Выстраиваясь при замерзании в упорядоченную решетку, молекулы воды занимают больше пространства, чем им требовалось в жидком состоянии.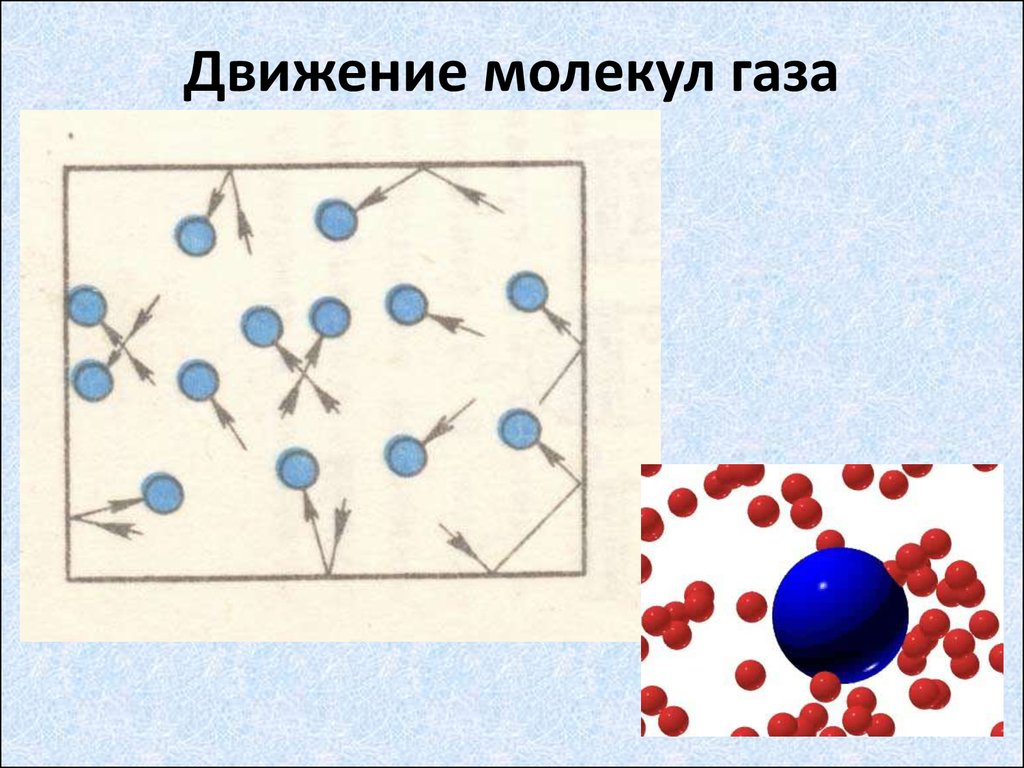 В результате лед на 9% менее плотный, чем жидкая вода.
В результате лед на 9% менее плотный, чем жидкая вода.
Вода невероятно подвижна. Она постоянно перемещается по всей Земле в цикле испарения, конденсации и осадков. Ее подвижность касается и живых организмов, в которых ее водородные и кислородные составляющие непрерывно объединяются и перестраиваются в ходе биохимических процессов.
Мы не только потребляем воду, но и производим ее. Каждый раз, когда в организме расщепляется молекула глюкозы, образуется 6 молекул воды. Эта реакция происходит в теле обычного человека 6 септиллионов (6 с 24 нолями) раз в сутки. Тем не менее, мы не можем таким способом покрыть свои потребности в воде.
via GIPHY
Разрушение ледника
Сколько у нас есть?
Вообще, воды во вселенной довольно много, и это вполне закономерно. Три самых распространённых элемента во вселенной — водород, гелий и кислород. Но поскольку гелий, в силу своей инертности, в химические реакции не вступает, соединение водорода и кислорода (то есть вода) встречается нередко. При этом, из всей воды на Земле получился бы шар диаметром около 1400 км. Это почти в 10 раз меньше диаметра самой Земли. Из этого объема только 3% — пресная вода. То есть на каждый стакан морской воды приходится чуть больше чайной ложки пресной. При этом 85% пресной воды на планете заключены в ледниках и полярных льдах. Рост населения, загрязнение водоемов и ряд других факторов делают всё более реальными опасения, что уже в XXI веке пресная вода может повсеместно стать дефицитом и стоить больше, чем бензин.
Три самых распространённых элемента во вселенной — водород, гелий и кислород. Но поскольку гелий, в силу своей инертности, в химические реакции не вступает, соединение водорода и кислорода (то есть вода) встречается нередко. При этом, из всей воды на Земле получился бы шар диаметром около 1400 км. Это почти в 10 раз меньше диаметра самой Земли. Из этого объема только 3% — пресная вода. То есть на каждый стакан морской воды приходится чуть больше чайной ложки пресной. При этом 85% пресной воды на планете заключены в ледниках и полярных льдах. Рост населения, загрязнение водоемов и ряд других факторов делают всё более реальными опасения, что уже в XXI веке пресная вода может повсеместно стать дефицитом и стоить больше, чем бензин.
К счастью, сегодня у нас еще есть возможность поднять стаканы с водой за самую крутую молекулу.
via GIPHY
Стакан воды
Источник
2.12: Вода – газ, жидкость и твердая вода
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 12668
- Безграничный
- Безграничный
Цели обучения
- Объясните биологическое значение способности льда плавать на воде
Состояния воды: газ, жидкость и твердое тело
Образование водородных связей является важным качеством жидкой воды, которое имеет решающее значение для жизни, какой мы ее знаем.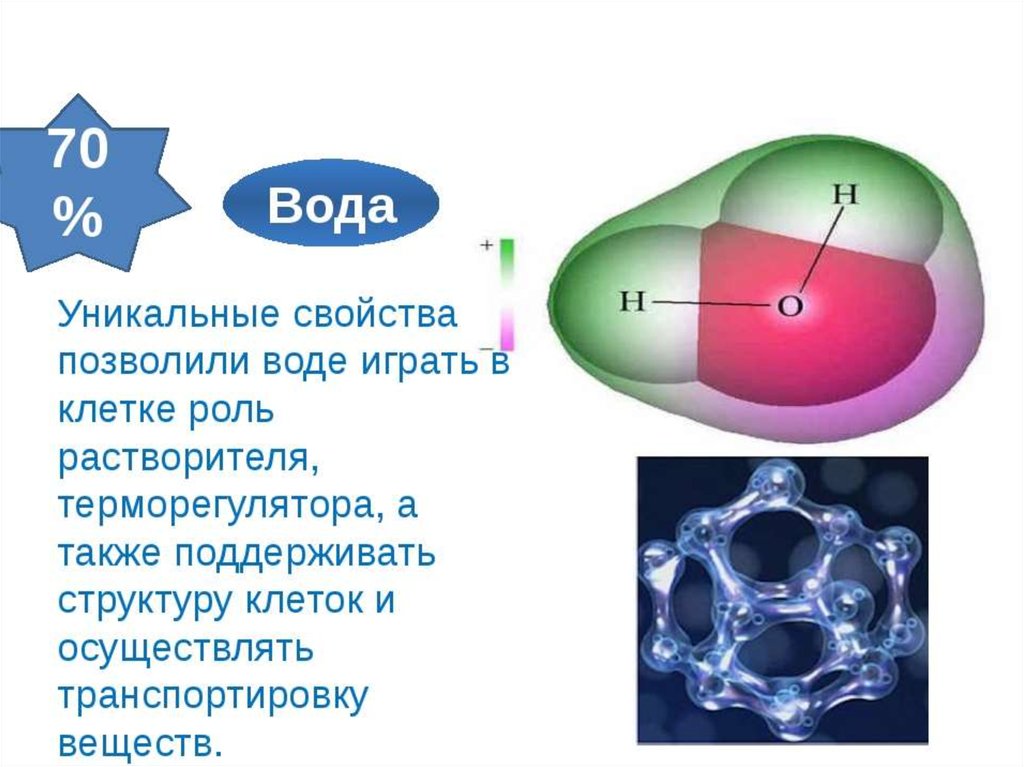 Поскольку молекулы воды образуют водородные связи друг с другом, вода приобретает некоторые уникальные химические характеристики по сравнению с другими жидкостями, а поскольку живые существа имеют высокое содержание воды, понимание этих химических свойств является ключом к пониманию жизни. В жидкой воде водородные связи постоянно образуются и разрываются, когда молекулы воды скользят друг относительно друга. Разрыв этих связей вызывается движением (кинетической энергией) молекул воды за счет тепла, содержащегося в системе. Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии для разрыва водородных связей недостаточно). Это делает лед менее плотным, чем жидкая вода, явление, не наблюдаемое при затвердевании других жидкостей.
Поскольку молекулы воды образуют водородные связи друг с другом, вода приобретает некоторые уникальные химические характеристики по сравнению с другими жидкостями, а поскольку живые существа имеют высокое содержание воды, понимание этих химических свойств является ключом к пониманию жизни. В жидкой воде водородные связи постоянно образуются и разрываются, когда молекулы воды скользят друг относительно друга. Разрыв этих связей вызывается движением (кинетической энергией) молекул воды за счет тепла, содержащегося в системе. Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии для разрыва водородных связей недостаточно). Это делает лед менее плотным, чем жидкая вода, явление, не наблюдаемое при затвердевании других жидкостей.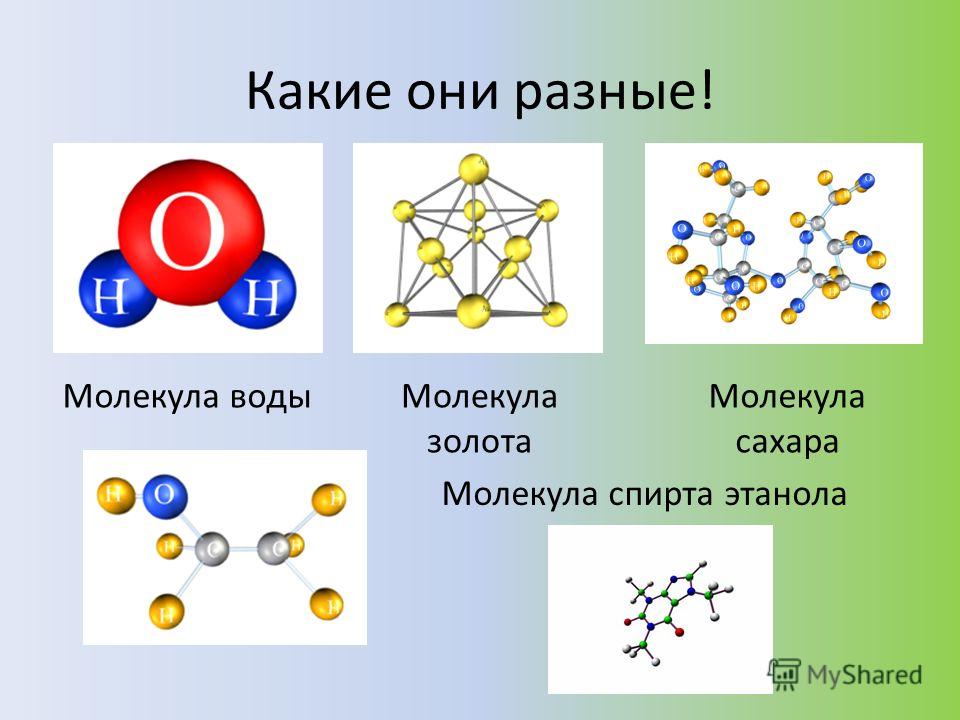
Интерактивный элемент
Фазы вещества : Посмотрите, что происходит с межмолекулярными связями во время фазовых переходов в этом интерактивном.
Меньшая плотность воды в твердом состоянии обусловлена тем, как ориентируются водородные связи при замерзании: молекулы воды раздвигаются дальше друг от друга по сравнению с жидкой водой. Для большинства других жидкостей затвердевание при понижении температуры включает снижение кинетической энергии между молекулами, что позволяет им упаковываться даже более плотно, чем в жидкой форме, и придает твердому телу большую плотность, чем жидкость.
Аномалия низкой плотности льда заставляет его плавать на поверхности жидкой воды, такой как айсберг или кубики льда в стакане воды. В озерах и прудах лед образуется на поверхности воды, создавая изолирующий барьер, который защищает животных и растения в пруду от замерзания. Без этого слоя изолирующего льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.
Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.
Ключевые моменты
- При кипячении воды кинетическая энергия приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара).
- Когда вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями.
- Твердая вода или лед менее плотны, чем жидкая вода.

- Лед менее плотный, чем вода, потому что ориентация водородных связей заставляет молекулы отталкиваться дальше друг от друга, что снижает плотность.
- Для других жидкостей затвердевание при понижении температуры включает снижение кинетической энергии, что позволяет молекулам более плотно упаковываться и делает твердое тело более плотным, чем его жидкая форма.
- Поскольку лед менее плотный, чем вода, он может плавать на поверхности воды.
Ключевые термины
- плотность : Мера количества вещества, содержащегося в данном объеме.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Безграничный
- Количество столбцов печати
- Два
- Печать CSS
- Плотный
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Теги

Кластеры воды и колебания плотности в жидкой воде на основе методов расширенной иерархической кластеризации
Кластеры воды и колебания плотности в жидкой воде на основе методов расширенной иерархической кластеризации
Скачать PDF
Скачать PDF
- Артикул
- Открытый доступ
- Опубликовано:
- Yitian Gao 1 ,
- Hongwei Fang 1 ,
- Ke Ni 1 &
- …
- Yixuan Feng 1
Научные отчеты том 12 , Номер статьи: 8036 (2022) Процитировать эту статью
1200 доступов
1 Альтметрический
Детали показателей
Предметы
- Химическая физика
- Молекулярная динамика
- Термодинамика
Abstract
Микроскопические структуры жидкой воды при температуре окружающей среды остаются предметом горячих споров, связанных со структурными флуктуациями и флуктуациями плотности в сети водородных связей. Здесь мы используем моделирование молекулярной динамики жидкой воды для изучения свойств трехмерных клеточных кластеров воды, которые мы исследуем с использованием расширенных методов иерархической кластеризации на основе графов. Кластеры воды могут покрывать более 95% сети водородных связей, среди которых некоторые кластеры максимально охватывают тысячи молекул, выходящих за пределы 3,0 нм. Кластеры подразумевают фрактальное поведение, образующее перколяционные сети, а морфология малых и больших кластеров демонстрирует разные правила масштабирования. Локальные предпочтительные кластеры и предпочтительные связи между соседними кластерами соответствуют более низкой энергии и конформационной энтропии в зависимости от топологии кластера. Температура может разрушить большие кластеры на мелкие. Далее мы показываем, что внутренняя часть скоплений благоприятствует участкам с высокой плотностью. Молекулы воды в небольших кластерах, внутри которых есть пустоты, рассматриваемые как гидрофобные объекты, предпочитают быть более тетраэдрическими.
Здесь мы используем моделирование молекулярной динамики жидкой воды для изучения свойств трехмерных клеточных кластеров воды, которые мы исследуем с использованием расширенных методов иерархической кластеризации на основе графов. Кластеры воды могут покрывать более 95% сети водородных связей, среди которых некоторые кластеры максимально охватывают тысячи молекул, выходящих за пределы 3,0 нм. Кластеры подразумевают фрактальное поведение, образующее перколяционные сети, а морфология малых и больших кластеров демонстрирует разные правила масштабирования. Локальные предпочтительные кластеры и предпочтительные связи между соседними кластерами соответствуют более низкой энергии и конформационной энтропии в зависимости от топологии кластера. Температура может разрушить большие кластеры на мелкие. Далее мы показываем, что внутренняя часть скоплений благоприятствует участкам с высокой плотностью. Молекулы воды в небольших кластерах, внутри которых есть пустоты, рассматриваемые как гидрофобные объекты, предпочитают быть более тетраэдрическими.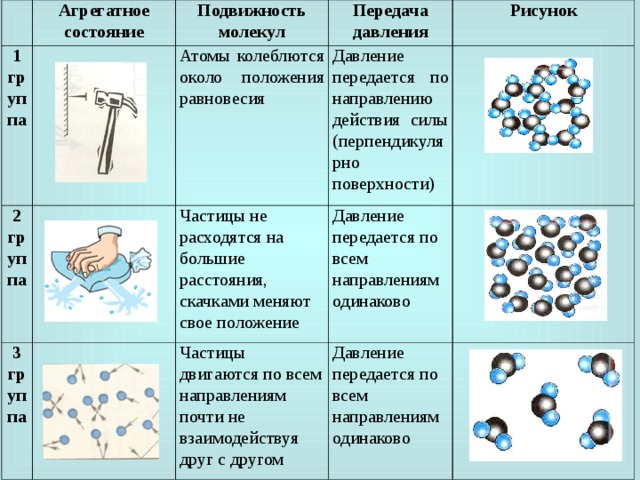 Наши результаты подчеркивают свойства и изменения кластеров воды как фундаментальных строительных блоков сетей водородных связей. Кроме того, кластеры воды могут объяснять колебания структуры и плотности в жидкой воде на разных масштабах длины.
Наши результаты подчеркивают свойства и изменения кластеров воды как фундаментальных строительных блоков сетей водородных связей. Кроме того, кластеры воды могут объяснять колебания структуры и плотности в жидкой воде на разных масштабах длины.
Введение
Вода – самая распространенная жидкость, участвующая в разнообразных физических, химических и биологических процессах на Земле 1,2 . В отличие от простых жидкостей, жидкая вода демонстрирует многочисленные аномальные термодинамические и кинетические свойства, которые имеют большое значение для нашей планеты и живых систем 3,4 . В макроскопическом временном или пространственном масштабе жидкую воду можно рассматривать как однородное вещество. Однако на микроскопическом уровне в сетке водородных связей с локальной тетраэдрической симметрией возникают частые пространственно-временные флуктуации, объясняющие основные причины аномальных свойств воды 5 .
Водные аномалии тесно связаны с локально благоприятными структурами, соответствующими определенным долгоживущим молекулярным структурам с локальными минимумами свободной энергии 6,7 . Основанная на сетях с водородными связями, жидкая вода представляет собой смесь двух различных типов молекулярных структур: тетраэдрические структуры и структуры с искаженными водородными связями, связанные с участками с низкой и высокой плотностью 8,9,10,11,12 , соответственно. Наличие флуктуаций плотности в сетях водородных связей в переохлажденной или жидкой воде широко исследовано по данным экспериментов 13,14,15,16,17,18 и молекулярная динамика 12,19,20,21,22 . Модель воды в двух состояниях, возникающая в результате конкуренции между жидкостью высокой плотности (ЛПВП) пятен искаженных водородных связей и жидкостью низкой плотности (ЛПНП) упорядоченных локально тетраэдрических пятен, может воспроизводить аномальное поведение термодинамических свойств воды 6,7,22 . Неоднородность плотности возникает в масштабе 10–15 Å при температуре окружающей среды 14,15 . Наличие изобестической точки примерно на высоте 3450 см −1 валентной моды O–H доказывает сосуществование двух типов локальных структур в жидкой воде методом рамановской спектроскопии 13 .
Основанная на сетях с водородными связями, жидкая вода представляет собой смесь двух различных типов молекулярных структур: тетраэдрические структуры и структуры с искаженными водородными связями, связанные с участками с низкой и высокой плотностью 8,9,10,11,12 , соответственно. Наличие флуктуаций плотности в сетях водородных связей в переохлажденной или жидкой воде широко исследовано по данным экспериментов 13,14,15,16,17,18 и молекулярная динамика 12,19,20,21,22 . Модель воды в двух состояниях, возникающая в результате конкуренции между жидкостью высокой плотности (ЛПВП) пятен искаженных водородных связей и жидкостью низкой плотности (ЛПНП) упорядоченных локально тетраэдрических пятен, может воспроизводить аномальное поведение термодинамических свойств воды 6,7,22 . Неоднородность плотности возникает в масштабе 10–15 Å при температуре окружающей среды 14,15 . Наличие изобестической точки примерно на высоте 3450 см −1 валентной моды O–H доказывает сосуществование двух типов локальных структур в жидкой воде методом рамановской спектроскопии 13 . Кроме того, малоугловое рассеяние рентгеновских лучей 14 , поглощение рентгеновских лучей 17 и эмиссионная спектроскопия 18 могут свидетельствовать о неоднородных структурах жидкой воды. На основе моделирования молекулярной динамики было предложено множество моделей для описания гетерогенных сетей водородных связей для объяснения физических аномальных свойств жидкой воды, таких как модели мерцания 23 и перколяционные модели 19,24 . Было предложено множество структурных дескрипторов для количественной оценки локальных предпочтительных структур в жидкой воде при различных условиях, таких как индекс локальной структуры (LSI) 25 , расстояние до пяти ближайших соседей ( d 5 ) 26 и сферичность ячейки Вороного 27 .
Кроме того, малоугловое рассеяние рентгеновских лучей 14 , поглощение рентгеновских лучей 17 и эмиссионная спектроскопия 18 могут свидетельствовать о неоднородных структурах жидкой воды. На основе моделирования молекулярной динамики было предложено множество моделей для описания гетерогенных сетей водородных связей для объяснения физических аномальных свойств жидкой воды, таких как модели мерцания 23 и перколяционные модели 19,24 . Было предложено множество структурных дескрипторов для количественной оценки локальных предпочтительных структур в жидкой воде при различных условиях, таких как индекс локальной структуры (LSI) 25 , расстояние до пяти ближайших соседей ( d 5 ) 26 и сферичность ячейки Вороного 27 .
Жидкая вода представляет собой динамическую смесь тетраэдрических и «кольцецепочечных» структур с небольшим уклоном в сторону первых 19,28 , образуя трехмерную сеть водородных связей, постоянно подвергающуюся топологическому преобразованию 3 .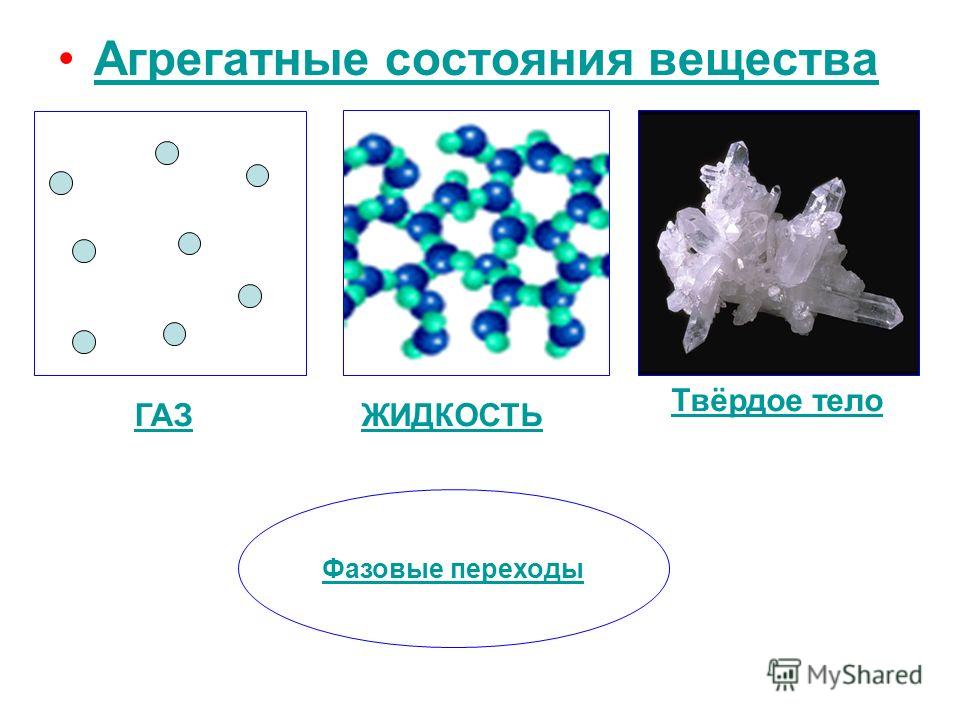 Водные кластеры, совокупность слабосвязанных молекул воды, могут образовываться в сетях с водородными связями локально предпочтительными структурами с локальными минимумами энергии 29,30 . Тем не менее, микроскопические структуры жидкой воды остаются предметом горячих споров, несмотря на множество интенсивных исследований 15 . Теория графов широко используется для определения топологических структур как строительных блоков сетей с водородными связями 31,32,33,34,35,36,37 . Во многих исследованиях были введены определения колец 33 , фрагментов 34 и кластеров 35 . Кольца, циклические пути вдоль водородных связей, имеют широкое распространение, среди которых 6-членные кольца наиболее предпочтительны при температуре окружающей среды 31,32,33,38 . Фрагменты, трехмерные подобные клетке строительные блоки, состоящие из колец, могут объяснить гетерогенность структур водородных связей и перегруппировок 34 .
Водные кластеры, совокупность слабосвязанных молекул воды, могут образовываться в сетях с водородными связями локально предпочтительными структурами с локальными минимумами энергии 29,30 . Тем не менее, микроскопические структуры жидкой воды остаются предметом горячих споров, несмотря на множество интенсивных исследований 15 . Теория графов широко используется для определения топологических структур как строительных блоков сетей с водородными связями 31,32,33,34,35,36,37 . Во многих исследованиях были введены определения колец 33 , фрагментов 34 и кластеров 35 . Кольца, циклические пути вдоль водородных связей, имеют широкое распространение, среди которых 6-членные кольца наиболее предпочтительны при температуре окружающей среды 31,32,33,38 . Фрагменты, трехмерные подобные клетке строительные блоки, состоящие из колец, могут объяснить гетерогенность структур водородных связей и перегруппировок 34 .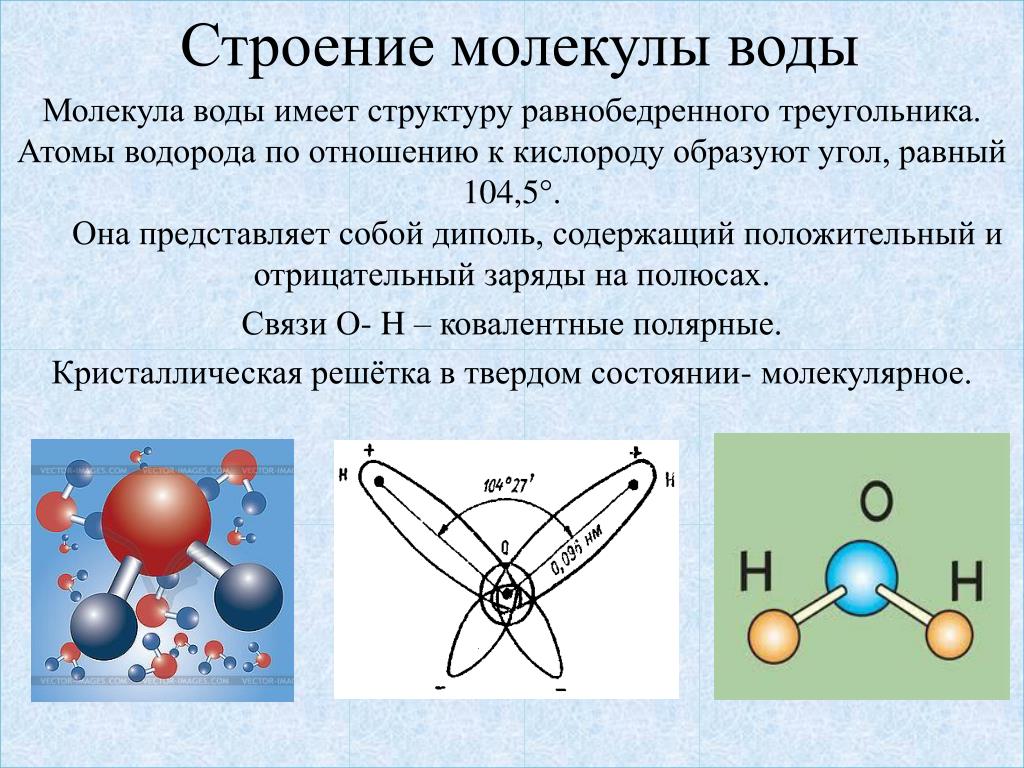 Топологически кластеры воды также включают небольшие циклические кластеры воды, такие как тетрамеры, пентамеры и гексамеры 39,40 . Топология кластеров воды сильно влияет на структуру и химический состав кластеров 41,42 . Составные закономерности того, как мерцающие скопления воды образуют объемную воду, остаются загадкой, несмотря на несколько исследований 43,44,45,46 . Метод иерархической кластеризации 47 предлагается для поиска иерархических кластеров воды в сети водородных связей. Водородные связи, кольца и фрагменты определяются как структуры 1-го, 2-го и 3-го уровня соответственно. Кластеры воды могут быть последовательно получены с помощью алгоритма Лувена, основанного на сети фрагментов.
Топологически кластеры воды также включают небольшие циклические кластеры воды, такие как тетрамеры, пентамеры и гексамеры 39,40 . Топология кластеров воды сильно влияет на структуру и химический состав кластеров 41,42 . Составные закономерности того, как мерцающие скопления воды образуют объемную воду, остаются загадкой, несмотря на несколько исследований 43,44,45,46 . Метод иерархической кластеризации 47 предлагается для поиска иерархических кластеров воды в сети водородных связей. Водородные связи, кольца и фрагменты определяются как структуры 1-го, 2-го и 3-го уровня соответственно. Кластеры воды могут быть последовательно получены с помощью алгоритма Лувена, основанного на сети фрагментов.
Локальные топологические структуры тесно связаны с неоднородностью плотности жидкой воды в микроскопическом масштабе 48 . Для описания структур воды и объяснения многих аномальных свойств 44,45,46,48,49,50,51,52 было предложено множество особых структурных моделей.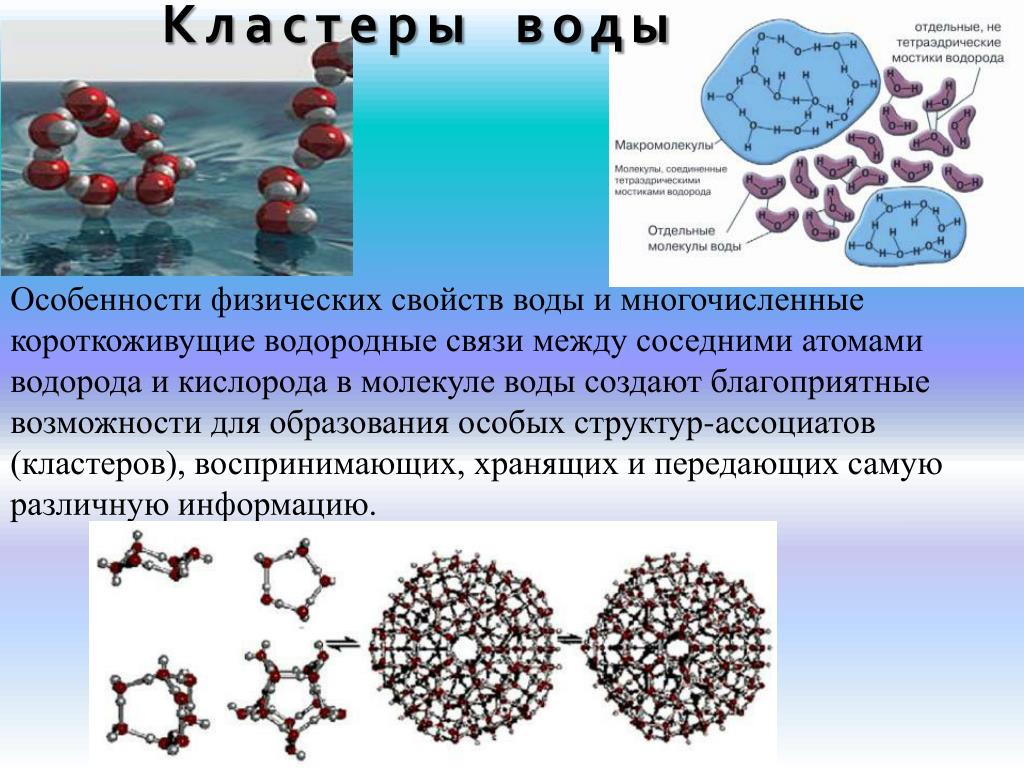 На основе водородных связей Чаплиным 46 были предложены флуктуирующие кластеры воды, содержащие 280 молекул воды с локальной икосаэдрической симметрией. Сети содержат смесь субструктур гексамера и пентамера и преобразуются между формами с более низкой и более высокой плотностью без разрыва водородных связей. Пара жидких структур, молекулярные цепи как жидкие структуры высокой плотности и слитые додекаэдры как тетраэдрические флуктуации определены для воспроизведения физических свойств 49 . Кроме того, смесь двух типов спиральных кластеров также считается строительными блоками 44 . Пустые пространства с сетками водородных связей тесно связаны с природой структурных неоднородностей в жидкой воде 48,49,50,51,52 . Флуктуации плотности формируют разнообразную морфологию пустот, что позволяет идентифицировать участки жидкости с низкой и высокой плотностью 48 .
На основе водородных связей Чаплиным 46 были предложены флуктуирующие кластеры воды, содержащие 280 молекул воды с локальной икосаэдрической симметрией. Сети содержат смесь субструктур гексамера и пентамера и преобразуются между формами с более низкой и более высокой плотностью без разрыва водородных связей. Пара жидких структур, молекулярные цепи как жидкие структуры высокой плотности и слитые додекаэдры как тетраэдрические флуктуации определены для воспроизведения физических свойств 49 . Кроме того, смесь двух типов спиральных кластеров также считается строительными блоками 44 . Пустые пространства с сетками водородных связей тесно связаны с природой структурных неоднородностей в жидкой воде 48,49,50,51,52 . Флуктуации плотности формируют разнообразную морфологию пустот, что позволяет идентифицировать участки жидкости с низкой и высокой плотностью 48 .
В этой статье мы стремимся исследовать эволюцию кластеров воды и структурное происхождение флуктуаций плотности с помощью моделирования с помощью SPC/E. В нашей предыдущей работе мы предложили методы иерархической кластеризации на основе графов 47 для выявления трехмерных клеточных скоплений воды, сочлененных кольцами небольшого размера. Здесь мы дополнительно улучшаем методы иерархической кластеризации, чтобы определить кластеры воды, охватывающие большинство сетей водородных связей. Используя классическое моделирование молекулярной динамики, мы изучаем, как кластеры воды изменяются при температуре окружающей среды. Подробно проанализированы распределения, морфология, энергетические и топологические свойства кластеров воды. Характерные структуры водных кластеров далее рассматриваются как фундаментальные строительные блоки сетей с водородными связями. Путем изучения локальной числовой плотности и структурного дескриптора обнаруживаются колебания плотности вблизи кластеров воды, что доказывает, что кластеры воды могут исследовать колебания плотности в сетях водородных связей, особенно для небольших кластеров.
В нашей предыдущей работе мы предложили методы иерархической кластеризации на основе графов 47 для выявления трехмерных клеточных скоплений воды, сочлененных кольцами небольшого размера. Здесь мы дополнительно улучшаем методы иерархической кластеризации, чтобы определить кластеры воды, охватывающие большинство сетей водородных связей. Используя классическое моделирование молекулярной динамики, мы изучаем, как кластеры воды изменяются при температуре окружающей среды. Подробно проанализированы распределения, морфология, энергетические и топологические свойства кластеров воды. Характерные структуры водных кластеров далее рассматриваются как фундаментальные строительные блоки сетей с водородными связями. Путем изучения локальной числовой плотности и структурного дескриптора обнаруживаются колебания плотности вблизи кластеров воды, что доказывает, что кластеры воды могут исследовать колебания плотности в сетях водородных связей, особенно для небольших кластеров.
Результаты
Моделирование молекулярной динамики и метод иерархической кластеризации
Моделирование молекулярной динамики выполняется с использованием периодических границ с 181 914 молекулами воды в кубическом ящике, взаимодействующими посредством водного потенциала SPC/E 53 .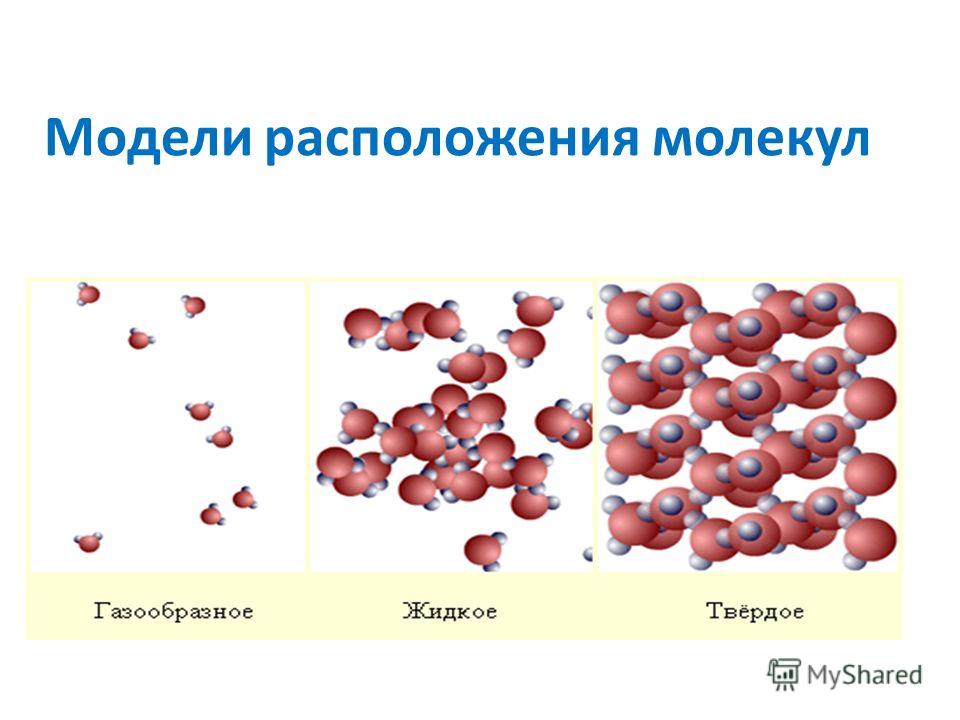 Все симуляции проводились при температурах 278 К, 298 К и 318 К и давлении 1,0 атм с помощью термостата Носа-Гувера и баростата. Шаг по времени составлял 1,0 фс. Системы были уравновешены в течение 2,5 нс в ансамбле NPT перед выводом.
Все симуляции проводились при температурах 278 К, 298 К и 318 К и давлении 1,0 атм с помощью термостата Носа-Гувера и баростата. Шаг по времени составлял 1,0 фс. Системы были уравновешены в течение 2,5 нс в ансамбле NPT перед выводом.
Методы иерархической кластеризации 47 соответственно рассматривают водородные связи, кольца, фрагменты как субструктуры первого, второго и третьего уровня в сети водородных связей. Размер колец ограничен 8, а анализируемые фрагменты содержат 3, 4 и 5 колец. Графовое сообщество представляет собой структуру, в которой узлы имеют более высокую плотность связей внутри групп, чем между ними. С помощью алгоритма Лувена 54,55 лучшие графовые сообщества определяются как водные кластеры, символизирующие регионы, где сосредоточены кольца или определенные структуры.
Альфа-форма 56 может описывать форму кластера воды, исследуя многогранник, обернутый крайними молекулами воды. Объем V и площадь поверхности A скоплений воды определяются как объем и площадь поверхности альфа-формы скоплений.
Статистика кластеров, морфология и энергия
Определение кольцевых кластеров позволяет интуитивно описать области локальных структур, подобных клеткам. В сетях водородных связей более 9В образовании кластеров воды участвует 5% молекул воды и более 60% глобального ящика. Следовательно, кластеры на основе колец можно рассматривать как специфические микроскопические структуры в жидкой воде. Важно изучить свойства кластеров воды, чтобы выяснить, как клеточные структуры влияют на сети водородных связей и даже на физические свойства жидкой воды.
В условиях окружающей среды сети водородных связей могут образовывать перколяционные сети, которые содержат бесконечные кластеры на основе водородных связей, охватывающие периодический кубический блок моделирования по крайней мере в одном направлении 57 . Но в нашем определении кольцевые сети не имеют бесконечных кластеров. Самые большие кластеры содержат только более 1% молекул в коробке. Большинство кластеров довольно малы, среди которых наиболее предпочтительными в сетях являются кластеры из 6 и 9 молекул, как показано на рис. 1а. Небольшие кластеры в основном состоят из одного фрагмента. Подобно распределению кластеров на основе h-связей 57 , распределение больших кластеров на основе колец также подчиняется степенному закону, предполагающему фрактальное поведение. Распределение S > 100 образуют плечо при низкой температуре.
1а. Небольшие кластеры в основном состоят из одного фрагмента. Подобно распределению кластеров на основе h-связей 57 , распределение больших кластеров на основе колец также подчиняется степенному закону, предполагающему фрактальное поведение. Распределение S > 100 образуют плечо при низкой температуре.
Распределение и морфология кластеров при различных температурах. ( a ) Распределение кластеров воды при 278 K, 298 K и 318 K. Черная точка обозначает изобестическую точку S c = 230–270. ( b ) Различные морфологии кластеров воды на временном шаге 0 при 278 К, нарисованные Ovito 58 . S обозначает размер кластера. В и A обозначают объем и площадь поверхности альфа-формы кластеров. ( c ) Объемное распределение кластеров воды при 278 К, 298 К и 318 К. Серые зоны представляют собой объемные распределения кластеров с 6–10 молекулами. ( d ) Распределение площади поверхности кластеров воды при 278 K, 298 K и 318 K. Серые зоны также представляют распределения площади поверхности кластеров с 6–10 молекулами. ( e ) Распределение максимальной длины кластеров при 278 К, 298 К и 318 К. Черная точка обозначает изосбестическую точку при 90 259 L 90 188 90 261 90 259 c 90 188 90 262 = 31–33°.
( d ) Распределение площади поверхности кластеров воды при 278 K, 298 K и 318 K. Серые зоны также представляют распределения площади поверхности кластеров с 6–10 молекулами. ( e ) Распределение максимальной длины кластеров при 278 К, 298 К и 318 К. Черная точка обозначает изосбестическую точку при 90 259 L 90 188 90 261 90 259 c 90 188 90 262 = 31–33°.
Изображение полного размера
Кластерная морфология, тесно связанная с пустотами внутри кластеров, допускает флуктуации плотности в сети водородных связей 48 . Некоторые примеры на рис. 1b показывают различные морфологии кластеров. Небольшие скопления имеют тенденцию образовывать сферическую форму, а большие скопления легко принимают неправильную форму. Как показано на рис. 1c,d, пики 90 259V и A для малых кластеров подразумевают оптимальные формы кластеров, подразумевающие тонкий баланс между энтальпиями водородных связей и структурными искажениями. Но большие скопления имеют более широкое распределение V и A без отчетливых пиков, указывающих на сложную морфологию. Между тем, как показано на рис. 1e, максимальные диаметры кластеров L , самое большое расстояние между двумя молекулами в кластере, могут указывать на то, что структурная неоднородность возникает в масштабе длины более 3,0 нм.
Между тем, как показано на рис. 1e, максимальные диаметры кластеров L , самое большое расстояние между двумя молекулами в кластере, могут указывать на то, что структурная неоднородность возникает в масштабе длины более 3,0 нм.
Кластерная энергия играет важную роль в отношениях между кластерными структурами и флуктуациями энергии в предыдущих исследованиях. Кластеры имеют локальные минимумы энергии, основанные на квантово-химических расчетах и моделировании молекулярной динамики 59,60 . Энергия кластеров воды E S определяется как сумма энергий взаимодействия между молекулами в кластерах. Согласно нашему определению кольцевых кластеров в объемной воде энергия кластера E S почти непосредственно пропорционален размеру кластера S в форме E S = A × S ++++. The equation E S /S = a + b/S indicates that larger clusters may averagely have lower molecular energy E S /S , as shown in Рис. 2а. В то же время энергия кластера в основном определяется числом водородных связей и топологией кластера, связанной с качество водородных связей, как показано на рис. 2b. Формирование низкоэнергетических структур предполагает локальные предпочтительные топологии, объясняя, что флуктуации энергии в сетях водородных связей могут быть в значительной степени связаны со структурным устройством и динамикой.
2а. В то же время энергия кластера в основном определяется числом водородных связей и топологией кластера, связанной с качество водородных связей, как показано на рис. 2b. Формирование низкоэнергетических структур предполагает локальные предпочтительные топологии, объясняя, что флуктуации энергии в сетях водородных связей могут быть в значительной степени связаны со структурным устройством и динамикой.
Диаграммы рассеивания энергии кластера и размера кластера, а также связь между энергией кластера и структурой кластера. ( a ) Графики рассеяния энергии кластера и размера кластера при 298 K. Черная линия представляет собой наклон наклона на E S = A × S + B, , где E S DENOTES CLORSELES. ( b ) Разброс средней энергии кластера с определенным размером кластера и структурой кластера. Цвета представляют размер кластера. Метки точек представляют кольцевые компоненты в кластере.
Изображение полного размера
Температура может сильно изменить свойства кольцевых кластеров. Кластерные распределения имеют изобестическую точку S c = 230–270 деления размера кластера с противоположными температурными характеристиками. При нагревании числа кластеров уменьшаются, когда S > S c , но увеличиваются, когда S < S c 90 среднее число кластеров воды явно увеличивается. Изобестические точки определяются размерами коробок, показанными в части IV дополнительных материалов. Затем это также указывает на то, что агломерация клеточных структур также имеет тенденцию распадаться в кольцевых сетях. Низкая температура может вызвать образование низкоэнергетических структур. В плане E S = A × S + B, при 278 K, 298 K и 318 K, параметр A равен — 12,92 EV, — 12,3 EV и a -EV и —11. , а b равно 65,49 эВ, 60,60 эВ и 54,12 эВ.
Масштабирование распределения и морфологии кластеров
Поведение фракталов — это внутренняя природа микроскопических частиц и сетей для описания самоподобия. Бесконечные кластеры на пороге перколяции сетей водородных связей принадлежат фрактальным объектам, демонстрирующим масштабное поведение распределений. Морфология полостей леннард-джонсовской жидкости 61,62 и пустоты сетей водородных связей в жидкой воде 48,49,50,51,52 также демонстрируют очевидное масштабирование, предполагающее лежащие в их основе фрактальные структуры.
Порог перколяции демонстрирует существование перколяционного перехода с образованием бесконечных кластеров с водородными связями, который тесно связан с фазовым переходом, особенно переходом жидкость-жидкость в переохлажденной воде 52,57 . В условиях окружающей среды кольцевые сети не достигают порога перколяции, образуя бесконечные клеточные кластеры. Лед может образовывать бесконечные кластеры на основе колец, потому что сети мозаичны тетраэдрическими структурами. Это означает, что перколяционный переход сетей на основе колец может вызвать образование бесконечного кластера при более низкой температуре, чем сети водородных связей. Бесконечные кластеры могут представлять собой специфическую цепочечную или листовую структуру охватывающей сети с водородными связями в мезоскопическом масштабе. Формирование гигантских кластерных структур может повлиять на свойства жидкой воды, чувствительные к мезоскопическим структурам 57 . The ring-based clusters also showing scaling behaviors of distributions and large cluster distributions also obeys a approximate power law n S ~ S −τ , where n S denotes номер кластера, а S обозначает молекулярный номер в кластере. Фрактальные размерности τ примерно равны 2,44, аналогично показателям степени τ = 2,20 в случае сетей водородных связей 57 .
Это означает, что перколяционный переход сетей на основе колец может вызвать образование бесконечного кластера при более низкой температуре, чем сети водородных связей. Бесконечные кластеры могут представлять собой специфическую цепочечную или листовую структуру охватывающей сети с водородными связями в мезоскопическом масштабе. Формирование гигантских кластерных структур может повлиять на свойства жидкой воды, чувствительные к мезоскопическим структурам 57 . The ring-based clusters also showing scaling behaviors of distributions and large cluster distributions also obeys a approximate power law n S ~ S −τ , where n S denotes номер кластера, а S обозначает молекулярный номер в кластере. Фрактальные размерности τ примерно равны 2,44, аналогично показателям степени τ = 2,20 в случае сетей водородных связей 57 .
Сложная морфология скоплений воды также показывает основные фрактальные структуры. Both cluster volume V and surface area A scale well with cluster radius r = L /2 illustrated in Fig. 3, giving d V = 2.89 and d S = 2,01. Это указывает на то, что формы кластеров самоподобны. Масштабирование кластеров от поверхности к объему также демонстрирует поведение масштабирования в виде степенного закона ln A ~ a ln V + b 63 . Подобно пустотам в сетях водородных связей, маленькие и большие кластеры демонстрируют разные характеристики масштабирования. Для малых скоплений с V < 100 Å 3 , a = 0,598, b = 0,927; для больших скоплений с V > 100 Å 3 , a = 0,729, b = 0,677. Небольшие скопления являются нефрактальными трехмерными объектами, поскольку параметр и около 2/3. Тогда большие кластеры слабо демонстрируют поверхностные фракталы, потому что параметр a лежит между 2/3–1.
Both cluster volume V and surface area A scale well with cluster radius r = L /2 illustrated in Fig. 3, giving d V = 2.89 and d S = 2,01. Это указывает на то, что формы кластеров самоподобны. Масштабирование кластеров от поверхности к объему также демонстрирует поведение масштабирования в виде степенного закона ln A ~ a ln V + b 63 . Подобно пустотам в сетях водородных связей, маленькие и большие кластеры демонстрируют разные характеристики масштабирования. Для малых скоплений с V < 100 Å 3 , a = 0,598, b = 0,927; для больших скоплений с V > 100 Å 3 , a = 0,729, b = 0,677. Небольшие скопления являются нефрактальными трехмерными объектами, поскольку параметр и около 2/3. Тогда большие кластеры слабо демонстрируют поверхностные фракталы, потому что параметр a лежит между 2/3–1. Коэффициент формы b зависит от формы, т.е. для сфер b = 1,57, для кубических полостей b = 1,79, для тетраэдров b = 1,97.
Коэффициент формы b зависит от формы, т.е. для сфер b = 1,57, для кубических полостей b = 1,79, для тетраэдров b = 1,97.
Логарифмический разброс объема кластера и площади поверхности. Черная линия соответствует наклонам lnS ~ alnV + b.
Увеличить
Динамика и превращения кластеров воды
Термические флуктуации вызывают частую организацию сети водородных связей, а затем рекомбинацию кластеров воды. Соответственно, время жизни кластера очень быстротечно и может в среднем длиться ~ 10 фс по сравнению со временем жизни водородной связи примерно 11,79 пс, 7,99 пс и 5,84 пс при 278 К, 298 К и 318 К. Без каких-либо предположений о времени жизни 64 , среднее время жизни кластеров с S < 10 приблизительно равно 4,0Δ t , где Δ t обозначает временной шаг Δ t = 10,0 фс. Среднее время жизни скоплений с S > 50 составляет всего 0,39Δ t .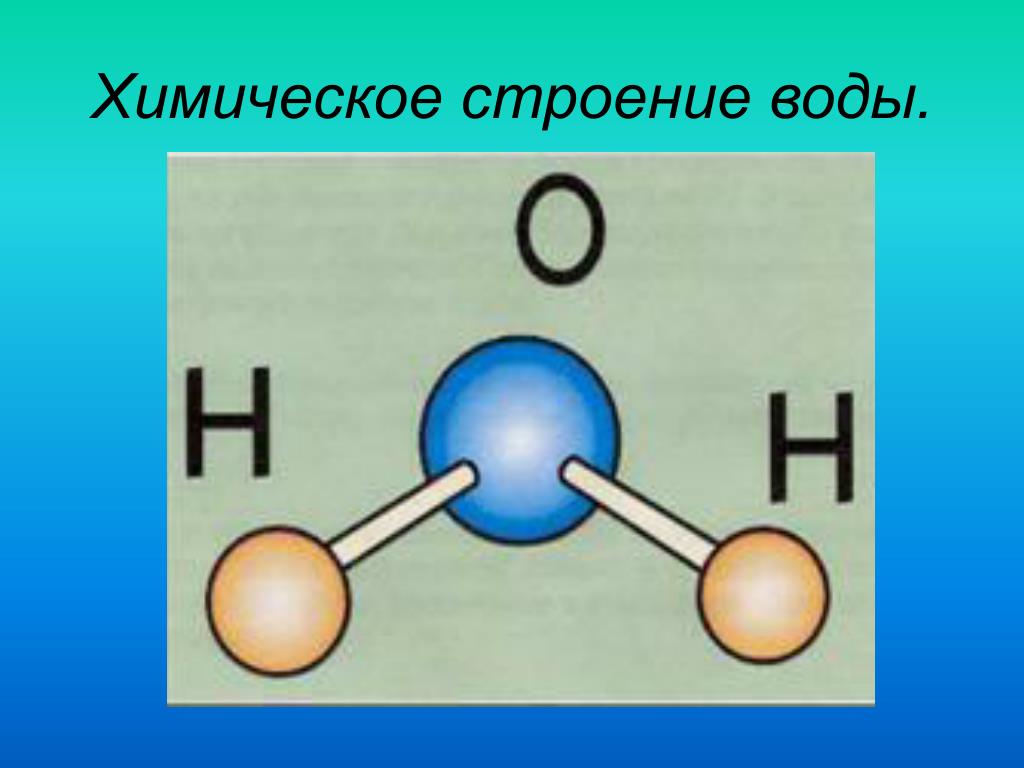 Температура также может сократить время жизни кластеров с S < 10, 4,0Δ t при 278 К, 3,7Δ t при 298 К и 3,4Δ t при 318 К. Кластер
Температура также может сократить время жизни кластеров с S < 10, 4,0Δ t при 278 К, 3,7Δ t при 298 К и 3,4Δ t при 318 К. Кластер
Пример трансформации кластеров и распределение трансформации кластеров при различных температурах. ( a ) Некоторый пример преобразования кластера с участием неизмененных, объединенных и разделенных при 298 K, нарисованный Ovito 58 . ( b ) Скорость трансформации кластеров и распределения продуктов или реагентов разделения и слияния кластеров при 278 K, 298 K и 318 K.
Полноразмерное изображение
- 1.

Changeless: кластер остается неизменным в соседних конфигурациях.
$${1}{\text{C}}_{t}\Rightarrow {1}{\text{C}}_{t+1}$$
(1)
- 2.
Объединение: кластер состоит как минимум из одного кластера или одного кольца в предыдущих конфигурациях.
$${i}_{c}{C}_{t}+{i}_{R}{R}_{t}+{i}_{m}{m}_{t}\Rightarrow {1}{\text{C}}_{t+1}\left(\begin{array}{ccc}{i}_{c}\ge 1& or& \left.{i}_{R}\ge 1\вправо)\конец{массив}\вправо.$$
(2)
- 3.
Разделение: кластер трансформируется как минимум в один кластер или одно кольцо в следующих конфигурациях.
$${1}{\text{C}}_{t}\Rightarrow {i}_{c}{C}_{t+1}+{i}_{R}{R}_{t +1}+{i}_{m}{m}_{t+1}\left(\begin{array}{ccc}{i}_{c}\ge 1& or& \left.
 {i}_{ R}\ge 1\right)\end{массив}\right.$$ 9{{\prime}}}_{m}{m}_{t+1}$$
{i}_{ R}\ge 1\right)\end{массив}\right.$$ 9{{\prime}}}_{m}{m}_{t+1}$$(4)
В интервалах 10 фс более 60% кластеров остаются неизменными, как показано на рис. 4b. Скорости слияния и разделения сравнительно эквивалентны и составляют около 12,0–16,0%. Реагентами слияния кластеров в основном являются 1 кластер и 1–5 молекул. Только 30% слияний содержат изолированные кольца. Продуктами расщепления также являются 1 кластер и несколько молекул. Высокая температура может снизить скорость неизменяемых кластеров и увеличить скорость слияния и разделения с 12,7% при 278 К до 15,4 % при 318 К. Преобразования кластеров происходят очень часто и предпочитают объединять или разделять обломки других кластеров, а не кольцевые структуры, предполагающие случайность динамики кластеров. Кумулятивные эффекты кластеров вызывают изменение локальных структур, а затем и полную перестройку сетей водородных связей.
Структурная неоднородность кластеров воды
В сетях с водородными связями кластеры воды представляют собой области, сконцентрированные в кольцах, где различное строение кольцевых структур подразумевает структурную неоднородность, тесно связанную с расположением сетей водородных связей.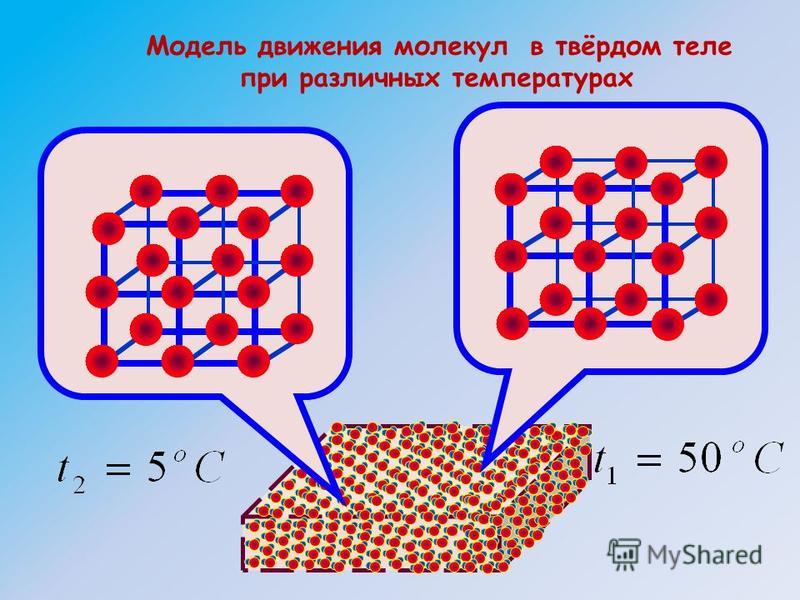
Пространственное распределение скоплений предполагает микроскопические локальные структуры между скоплениями. ФРР (радиальные функции распределения) атомов кислорода в кластерах имеют несколько пиков при 2,7 Å, 4,3 Å и 6,5 Å, подобных пикам для всех атомов кислорода, и постепенно приближаются к нулю, как показано на рис. 5а. Для небольших скоплений пики RDF расположены при 0,5 Å, 3,6 Å и 7,2 Å на рис. 4d, соответственно, представляя соседние скопления воды. Это указывает на то, что структурная неоднородность вокруг областей с концентрацией колец выявляет слабое структурирование до ~ 1 нм.
Рисунок 5 Функции радиального расстояния кислород–кислород и кластер–кластер и топологические свойства кластеров. ( a ) Функции радиального расстояния кислород-кислород в глобальной системе, кислород-кислород в больших скоплениях и маленькое скопление-маленькое скопление. Кластерная РФР рассчитывается по массовой точке кластеров, содержащих не более 10 молекул.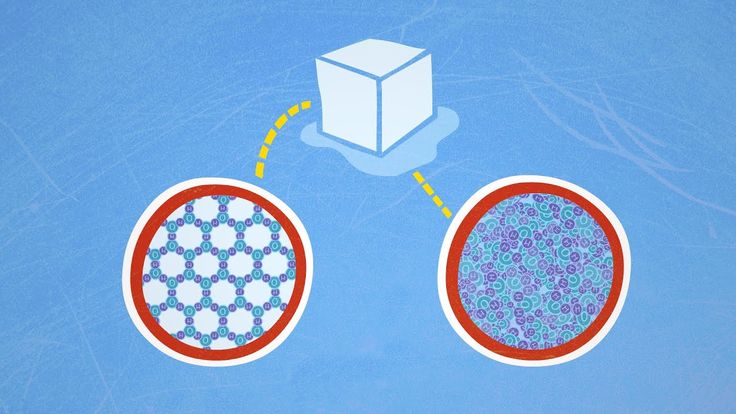 ( b ) 10 наиболее предпочтительных фрагментов в кластерах с фрагментом и более чем одним фрагментом при 278 K. ( c ) Распределение соседних фрагментов в кластерах. Метки 1–10 представляют наиболее локальные предпочтительные фрагменты в сети водородных связей.
( b ) 10 наиболее предпочтительных фрагментов в кластерах с фрагментом и более чем одним фрагментом при 278 K. ( c ) Распределение соседних фрагментов в кластерах. Метки 1–10 представляют наиболее локальные предпочтительные фрагменты в сети водородных связей.
Изображение полного размера
Структуры кластеров имеют несколько предпочтительных топологий. Некоторым фрагментам предпочтение отдается на местном уровне из-за большого количества и длительного времени жизни в части II дополнительного материала. Несколько предпочтительных моделей фрагментов включают (6,7,7), (6,8,8), (4,7,7), (4,6,6), (6,6,7,7), (5 ,6,6,7), (5,6,6,7,8) и так далее. Более 5- и 6-членные кольца в кластерах становятся все более популярными среди локальных структур. Большинство кластеров имеют только один фрагмент, 59.1% из которых содержат 3 кольца. Более 86% кластеров с более чем одним фрагментом имеют 4 и 5 колец. Трехкольцевые фрагменты легко выделяются. Кластеры из 6 молекул принадлежат фрагментам (4,5,5).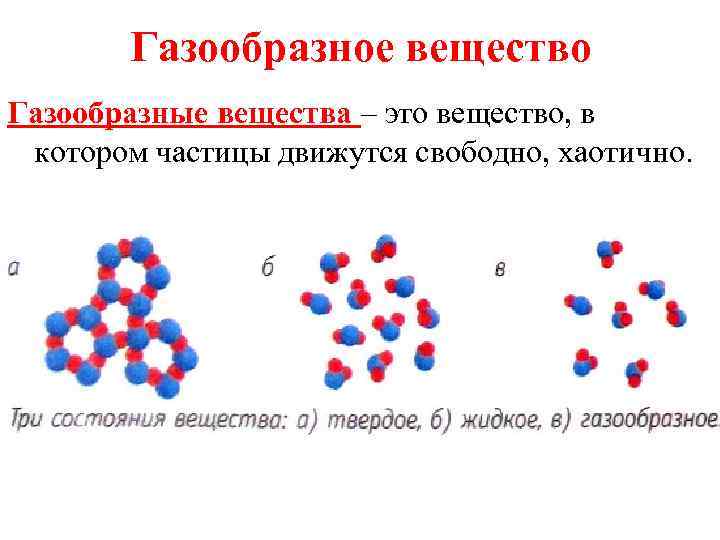 Большинство 9-молекулярных кластеров представляли собой (6,7,7) и (4,8,8) фрагменты. Фрагменты с 4 или 5 кольцами имеют тенденцию объединяться в большие кластеры, включая (5, 6, 6, 7) и (6, 6, 7, 7), как показано на рис. 5b.
Большинство 9-молекулярных кластеров представляли собой (6,7,7) и (4,8,8) фрагменты. Фрагменты с 4 или 5 кольцами имеют тенденцию объединяться в большие кластеры, включая (5, 6, 6, 7) и (6, 6, 7, 7), как показано на рис. 5b.
На рисунке 5c показана вероятность того, что разные кластеры будут соседствовать друг с другом. Это показывает, что фрагменты предпочитают примыкать к фрагментам одного типа, например, 3-кольцевые фрагменты имеют тенденцию объединять 3-кольцевые фрагменты. Топ-5 предпочтительных режимов соединения между кластерами с 2–6 фрагментами на 298 K также указаны в части III дополнительных материалов. Сильная склонность отдельных пар фрагментов к соседству в кластерах объясняет более низкую конформационную энтропию связанных структур в жидкой воде.
Поверхностные кольца среди соседних кластеров оказывают существенное влияние на совместимость между соседними фрагментами. Кольца, соединяющие два фрагмента в кластере, определяются как кольца тела, а остальные определяются как кольца поверхности. 55% 4-членных колец и 45% 6-членных колец соединяют соседние фрагменты. Поверхностные кольца, где происходит большинство водородных связей, преобладают при высокой температуре. При формировании кластеров дефекты трансформируются из их внутренней части в поверхностную. Динамика площади поверхности может вызвать рост или распад кольцевых областей 34 .
55% 4-членных колец и 45% 6-членных колец соединяют соседние фрагменты. Поверхностные кольца, где происходит большинство водородных связей, преобладают при высокой температуре. При формировании кластеров дефекты трансформируются из их внутренней части в поверхностную. Динамика площади поверхности может вызвать рост или распад кольцевых областей 34 .
Кластеры воды и флуктуации плотности в сети водородных связей
Кластеры воды могут представлять собой кольцеобразные структуры, напоминающие клетки. Мы исследуем, как кластеры воды связаны с флуктуациями плотности, а затем доказываем, что кластеры воды можно рассматривать как характерные структуры для описания неоднородных участков сетей водородных связей на разных масштабах длины.
Во-первых, местная плотность ( ρ местная ) вблизи центра кластеров является важным параметром для количественной оценки флуктуаций плотности вокруг кластерных структур. Локальная плотность ( ρ локальная ) вокруг центра кластера определяется как число атомов кислорода внутри зондовой сферы радиусом 4,6 Å 48 .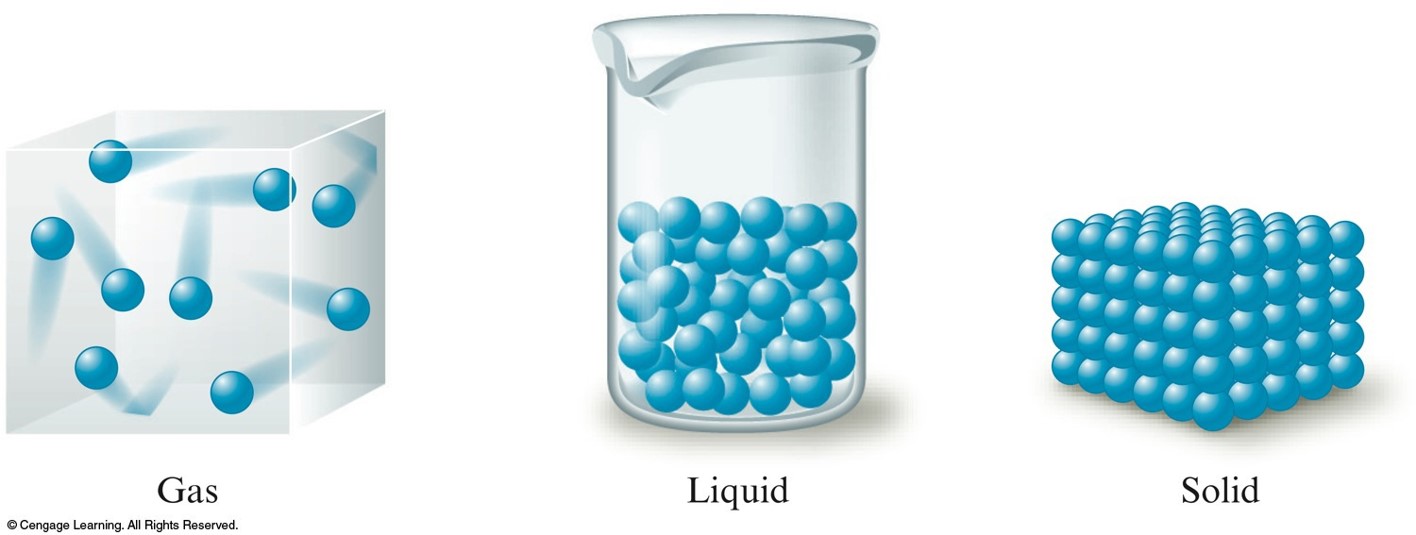 Объемная плотность при 298 К колеблется примерно на уровне 0,0334 молекулы/Å 3 . Малые и большие скопления воды имеют соответственно S ≤ 10 и S ≥ 100. Средний максимальный радиус кластера составляет примерно 3,85 Å и 19,40 Å.
Объемная плотность при 298 К колеблется примерно на уровне 0,0334 молекулы/Å 3 . Малые и большие скопления воды имеют соответственно S ≤ 10 и S ≥ 100. Средний максимальный радиус кластера составляет примерно 3,85 Å и 19,40 Å.
Как показано на рис. 6а, внутри скоплений существуют пятна с высокой плотностью. Для малых скоплений распределение плотностей достигает максимума при 1,8 Å и минимумов вблизи поверхности скоплений. Патчи высокой плотности на ~ 3% больше, чем объемная плотность. Области вне внутренней части больших скоплений все еще больше, чем объемная плотность. На рис. 6b для малых и больших скоплений 64,8% и 64,7% локальные плотности больше, чем объемная плотность в пике плотности по сравнению с 51,3% и 57,4% в минимумах, что объясняет несоответствие плотности в разных регионах. На рисунке 6c показан мгновенный снимок большого кластера при 278 К, иллюстрирующий пространственные неоднородности различных типов кластеров. 9Рисунок 6 который обозначает молекулярный номер.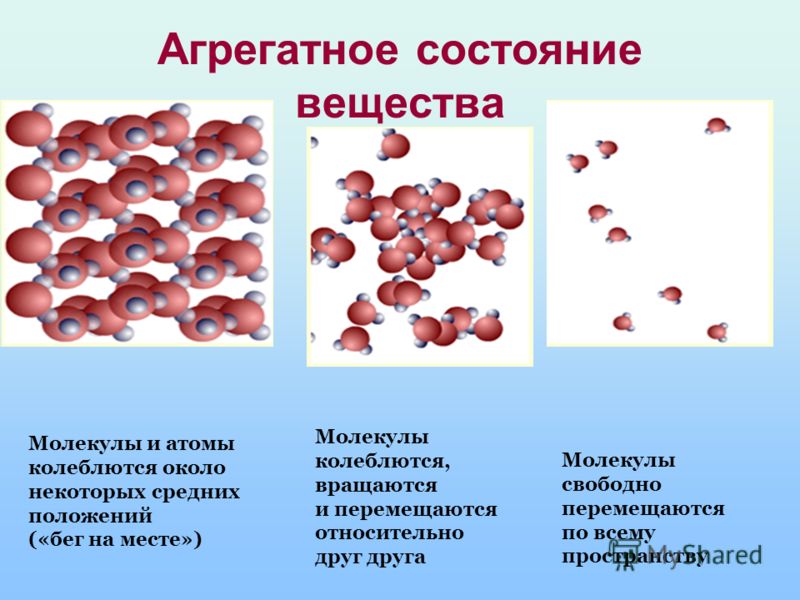 Численную плотность рассчитывают как количество атомов кислорода внутри зондовой сферы, расположенных на определенных атомах кислорода в кластерах радиусом 4,6 Å. ( b ) Распределения плотности чисел, расположенные при максимальной плотности и минимальной плотности. ( c ) Снимки нескольких кластеров, выбранных в локальной области, нарисованной Ovito 58 .
Численную плотность рассчитывают как количество атомов кислорода внутри зондовой сферы, расположенных на определенных атомах кислорода в кластерах радиусом 4,6 Å. ( b ) Распределения плотности чисел, расположенные при максимальной плотности и минимальной плотности. ( c ) Снимки нескольких кластеров, выбранных в локальной области, нарисованной Ovito 58 .
Увеличить
Образования структурирования молекул воды влияют на гидрофобный эффект в жидкой воде 65 . Гидрофобная сольватация может создать пустую полость в сети водородных связей и сформировать более прочные межводородные связи 66 . Чтобы выяснить, как молекулы воды ведут себя внутри кластеров, локальный структурный индекс (LSI) 25 9{2}$$
(5)
\(\Delta (i)={r}_{i+1}-{r}_{i}\) и \(\overline{\Delta}\) является средним по всем молекулам в первой оболочке. Молекулы пронумерованы в порядке удаления от центральной молекулы, \({r}_{1}<{r}_{2}<\cdots<{r}_{i}<3,7\) Å < r и + 1 .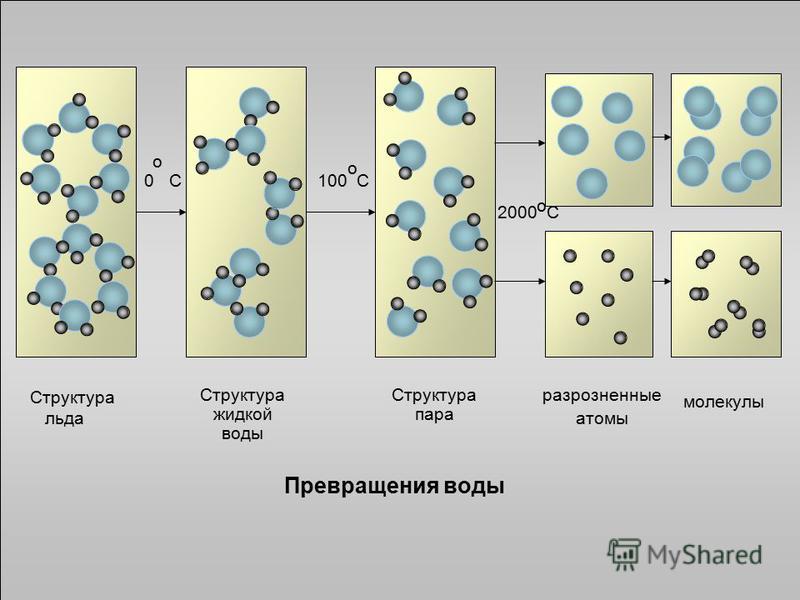 Большие значения LSI соответствуют тетраэдрическим молекулам воды, тогда как малые значения LSI соответствуют неупорядоченным первым оболочкам 21 .
Большие значения LSI соответствуют тетраэдрическим молекулам воды, тогда как малые значения LSI соответствуют неупорядоченным первым оболочкам 21 .
На рис. 7а тетраэдральность молекул воды уменьшается с повышением температуры. Изобестическая точка LSI ≈ 0,03 Å 2 можно разделить на две особенности структур, представляющих бимодальность распределений LSI, имеющих локальные структурные среды с высокой и низкой плотностью 21 . Средняя тетраэдральность молекул воды в малых кластерах несколько больше, чем в больших кластерах. Пустоты внутри небольших кластеров можно рассматривать как гидрофобные объекты, и, следовательно, молекулы воды на поверхности малых кластеров предпочитают быть более тетраэдрическими. Локальные структуры молекул воды в кластерах обнаруживают пространственную неоднородность, а тетраэдральность отрицательно коррелирует с плотностью по радиусу кластеров. Участки с высокой плотностью в кластерах соответствуют более высокой тетраэдричности, что подразумевает более упорядоченное окружение первой оболочки вблизи неполярных гидрофобных растворенных веществ. Это также согласуется с результатами, что дальние структурные флуктуации пятен четырехкоординированных молекул формируются от жидкости к переохлажденной воде 67 .
Это также согласуется с результатами, что дальние структурные флуктуации пятен четырехкоординированных молекул формируются от жидкости к переохлажденной воде 67 .
Распределение LSI для вод вблизи скоплений при различных температурах. ( a ) Распределение LSI молекул воды в кластерах при 278 К, 298 К и 318 К. Сплошной линией обозначены кластеры с S ≤ 10, пунктиром – кластеры с S ≥ 100. ( b ) Средняя LSI вокруг геометрического центра скоплений с S ≤ 10 и S ≥ 100,
Изображение полного размера
Композиционное сходство между кластерами воды и пустотами. Молекулы воды в кластерах могут окружать пустоты, завернутые в замкнутые кольца. Небольшие скопления могут образовывать сферические пустоты; кроме того, большие скопления могут включать в себя некоторые пустые скопления. Обе структуры демонстрируют сходные свойства распределения и морфологии. Подобно молекулам воды вокруг пустот 48 , небольшие скопления обнаруживают аналогичные корреляции с флуктуациями плотности.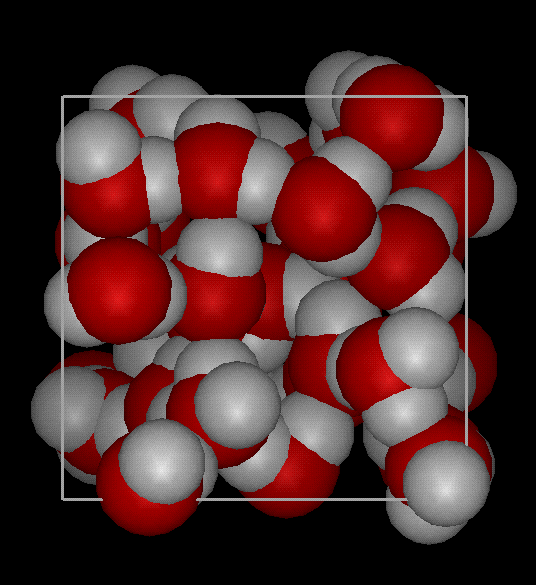 Более глубокая связь между кластерами воды и пустотами требует дальнейшего изучения.
Более глубокая связь между кластерами воды и пустотами требует дальнейшего изучения.
Выводы и обсуждения
Микроскопические структуры в жидкой воде остаются предметом острых дискуссий в недавних исследованиях. Мы ищем водные кластеры в сетях водородных связей жидкой воды, используя молекулярно-динамическое моделирование со 100 тысячами частиц методами иерархической кластеризации.
В настоящей статье мы показываем, что существует корреляция между сетью водородных связей и свойствами кольцевых кластеров внутри нее. Мы демонстрируем, что кластеры воды могут интуитивно идентифицировать плотность и структурные флуктуации в сетях водородных связей, что приводит к микроскопическим интерпретациям аномалий воды. В частности, мы показываем, что области внутри скоплений соответствуют участкам высокой плотности с меньшей тетраэдральностью, особенно для малых скоплений. Небольшие кластеры предпочитают иметь больше тетраэдрических молекул. Это предполагает более упорядоченное окружение первой оболочки вблизи неполярных гидрофобных объектов, что эквивалентно пустотам в малых кластерах.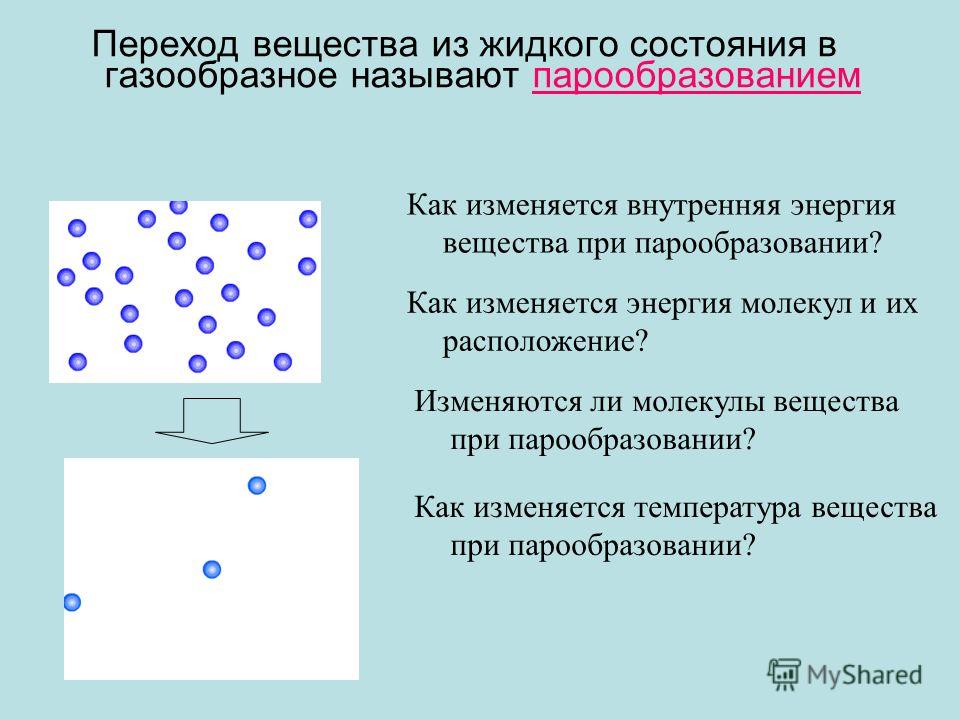 И мы также показываем, что некоторым кластерам благоприятствуют сети водородных связей в зависимости от количества водородных связей и топологии кластера. Совместимость соседних кластеров зависит от конформации и размера соединяющих их поверхностных колец. Структурное предпочтение водных кластеров также объясняет расположение и динамику сетей водородных связей.
И мы также показываем, что некоторым кластерам благоприятствуют сети водородных связей в зависимости от количества водородных связей и топологии кластера. Совместимость соседних кластеров зависит от конформации и размера соединяющих их поверхностных колец. Структурное предпочтение водных кластеров также объясняет расположение и динамику сетей водородных связей.
Кластеры на основе колец в перколяционных сетях водородных связей демонстрируют поведение масштабирования распределения и морфологии кластеров, формирующих основные фрактальные структуры и самоподобие. Мы показываем, что небольшие кластеры являются нефрактальными трехмерными объектами, а большие кластеры слабо отображают поверхностные фракталы. При этом распределение крупных кластеров подчиняется степенному закону с фрактальной размерностью, равной 2,44. Это также означает, что перколяционный переход сетей на основе колец может вызвать образование бесконечного кластера при более низкой температуре, чем сети водородных связей.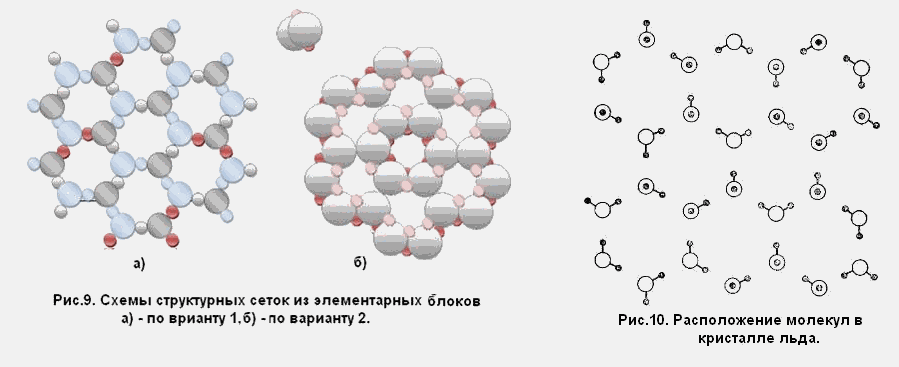 Кроме того, температуры в значительной степени влияют на свойства кластера и динамику в сети водородных связей. Мы показываем, что нагрев может разрушать большие низкоэнергетические кластеры в малые высокоэнергетические из-за возрастающих дефектов топологических структур.
Кроме того, температуры в значительной степени влияют на свойства кластера и динамику в сети водородных связей. Мы показываем, что нагрев может разрушать большие низкоэнергетические кластеры в малые высокоэнергетические из-за возрастающих дефектов топологических структур.
Одной из проблем является отсутствие математической строгости при определении водных структур. Симплициальный комплекс в сложной сети может предоставить инструмент для предложения единого математического определения водных кластеров. Другая проблема заключается в том, что количественная взаимосвязь между динамикой кластеров воды и свойствами воды требует дальнейшего изучения.
Являясь фундаментальной структурной единицей сети водородных связей, кластер воды может обнаруживать колебания структуры и плотности на разных масштабах длины в жидкой воде, а также дает новое понимание процесса образования кристаллов льда, сосуществования жидкости и жидкости в переохлажденной воде и водороде. связывающие структуры вблизи гидрофобного растворенного вещества.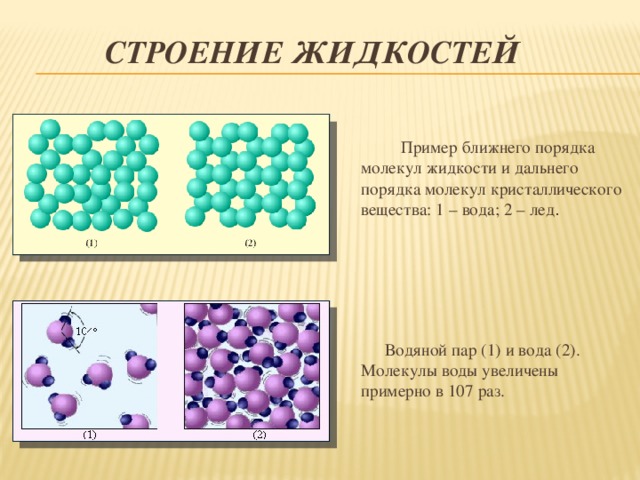 Кроме того, в будущем будет интересно представить непрерывную жидкую воду как совокупность больших кластеров, иерархически образующих мост между изолированными молекулами и объемным веществом.
Кроме того, в будущем будет интересно представить непрерывную жидкую воду как совокупность больших кластеров, иерархически образующих мост между изолированными молекулами и объемным веществом.
Методы
Моделирование молекулярной динамики
100 000 симуляций молекулярной динамики проводятся программным пакетом LAMMPS для изучения свойств кластеров воды. Модель воды моделируется с помощью модели жесткой воды SPC/E 53 , которая широко используется для моделирования макроскопических свойств и микроскопических структур жидкой воды. Длина связи и угол связи воды фиксируются с помощью алгоритма SHAKE. Граница несвязанных взаимодействий составляет 1,0 нм, а дальнодействующие кулоновские взаимодействия рассчитываются с использованием решателя частица-частица-сетка (PPPM). Система содержит 181,914 молекул воды в ящике с периодическими граничными условиями. Начальный размер прямоугольника составляет 28,0 нм в направлении x, 10,0 нм в направлении y и 20,0 нм в направлении z. Уравнения движения интегрируются с использованием алгоритма скорости-Верле 68 с шагом по времени 1,0 фс. Термостат Носа-Гувера и баростат используются для контроля температуры и давления соответственно. Время уравновешивания с использованием ансамбля NPT составляет 2,5 нс. Температуру системы поддерживают постоянной на уровне 278 К, 298 К и 318 К, а давление 1,0 атм. Производственные циклы выдают 500 конфигураций каждые 10,0 фс для структурного анализа.
Уравнения движения интегрируются с использованием алгоритма скорости-Верле 68 с шагом по времени 1,0 фс. Термостат Носа-Гувера и баростат используются для контроля температуры и давления соответственно. Время уравновешивания с использованием ансамбля NPT составляет 2,5 нс. Температуру системы поддерживают постоянной на уровне 278 К, 298 К и 318 К, а давление 1,0 атм. Производственные циклы выдают 500 конфигураций каждые 10,0 фс для структурного анализа.
Плотность, коэффициент диффузии, вязкость и структурные свойства смоделированной воды хорошо согласуются с результатами экспериментов и других молекулярно-динамических моделей, а данные моделирования показаны в таблице 1 и на рис. 1 дополнительного материала.
Расширенные иерархические кластерные методы
Для выявления специфических топологических структур в сетях с водородными связями, водородных связей, колец и фрагментов кластеры строятся как структуры первого, второго, третьего и четвертого уровней водной сети с использованием иерархических кластерные методы 47 , среди которых кластеры представляют собой совокупность трехмерных клеточных структур.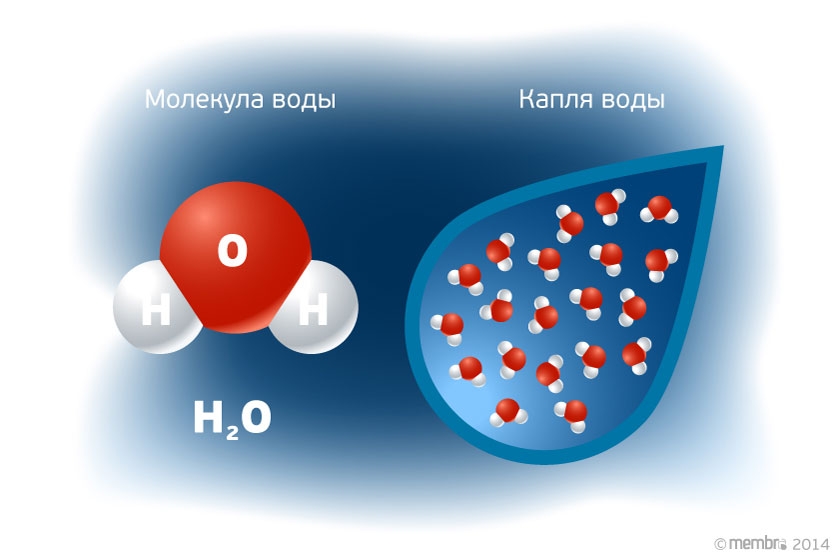 Чтобы гарантировать, что кластеры воды могут в значительной степени покрывать сети водородных связей, мы модифицируем определение иерархических структур кластеров и предлагаем метод расширенной иерархической кластеризации, как показано на рис. 8.
Чтобы гарантировать, что кластеры воды могут в значительной степени покрывать сети водородных связей, мы модифицируем определение иерархических структур кластеров и предлагаем метод расширенной иерархической кластеризации, как показано на рис. 8.
Схема метода расширенной иерархической кластеризации. Водородные связи, кольца и фрагменты считаются структурами 1-го, 2-го и 3-го уровней, которые с химической точки зрения представляют собой шарообразные модели, а красные и белые шары обозначают атомы кислорода и водорода соответственно. Полные и пунктирные палочки обозначают связи O–H и водородные связи соответственно. Кластеры проиллюстрированы с топологической точки зрения. Шары представляют графовое сообщество в виде кластеров воды. Обратите внимание, что структуры на рисунке являются лишь выбором среди рассматриваемых структур алгоритмом кластеризации. Структуры нарисованы GaussView 5.0.8 69 .
Изображение полного размера
Водородные связи, структуры первого уровня, определяются с помощью популярного геометрического стандарта, в котором две молекулы воды считаются связанными водородными связями, когда расстояние между атомами кислорода одной молекулы и атомами водорода другой меньше чем 0,25 нм 70 .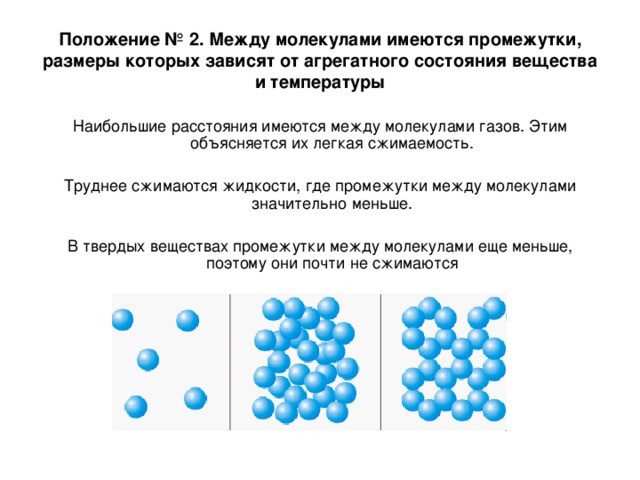 Кольца, структуры второго уровня, представляют собой циклические пути вдоль водородных связей, исследуемые по критерию «кратчайшего пути» (КП) 71 . Максимальный размер кольца ограничен 8. Фрагменты представляют собой трехмерные строительные блоки, похожие на клетки, с использованием топологического определения, предложенного Мацумото 9.0168 34 . Учитываются фрагменты, объединенные 3, 4 и 5 кольцами. Если два фрагмента имеют общие кольца, то они имеют ребро, образующее сеть фрагментов. Кластеры воды идентифицируются как лучшие графовые сообщества с использованием алгоритма Лувена 54,55 .
Кольца, структуры второго уровня, представляют собой циклические пути вдоль водородных связей, исследуемые по критерию «кратчайшего пути» (КП) 71 . Максимальный размер кольца ограничен 8. Фрагменты представляют собой трехмерные строительные блоки, похожие на клетки, с использованием топологического определения, предложенного Мацумото 9.0168 34 . Учитываются фрагменты, объединенные 3, 4 и 5 кольцами. Если два фрагмента имеют общие кольца, то они имеют ребро, образующее сеть фрагментов. Кластеры воды идентифицируются как лучшие графовые сообщества с использованием алгоритма Лувена 54,55 .
Альфа-форма скоплений воды
Альфа-форма представляет собой формализацию интуитивного понятия формы для наборов пространственных точек. Альфа-форма — это конкретная геометрическая модель, которая математически четко определена и уникальна для данного набора точек. Параметр альфа задает уровень уточнения: чем больше значение альфа, тем точнее подгонка, а чем меньше альфа, тем точнее. Объем и площадь поверхности скоплений воды основаны на альфа-формах 56 молекул воды в кластерах. Альфа-формы кластеров учитывают только атомы кислорода. Альфа-радиус выбран равным 3,5 Å. Формирование альфа-формы реализовано в MATLAB 72 .
Объем и площадь поверхности скоплений воды основаны на альфа-формах 56 молекул воды в кластерах. Альфа-формы кластеров учитывают только атомы кислорода. Альфа-радиус выбран равным 3,5 Å. Формирование альфа-формы реализовано в MATLAB 72 .
Доступность данных
Все данные, полученные или проанализированные в ходе этого исследования, включены в эту опубликованную статью и дополнительные информационные файлы к ней.
Литература
Айзенберг Д. и Каузманн В. Структура и свойства воды (издательство Оксфордского университета по запросу, 2005 г.).
Книга Google ученый
Bellissent-Funel, M.C. et al. Вода определяет структуру и динамику белков. Хим. Ред. 116 , 7673–7697 (2016).
КАС пабмед ПабМед Центральный Статья Google ученый
«>Галло, П. и др. Вода: сказка о двух жидкостях. Хим. Ред. 116 , 7463–7500 (2016 г.).
КАС пабмед ПабМед Центральный Статья Google ученый
Маленков Г. Жидкая вода и лед: понимание структуры и физических свойств. J. Phys. Конденс. Материя 21 , 283101 (2009).
ПабМед Статья КАС Google ученый
Руссо, Дж. и Танака, Х. Понимание аномалий воды с местными предпочтительными структурами. Нац. коммун. 5 , 4–6 (2014).
Артикул КАС Google ученый
«>Мисима, О. и Стэнли, Х. Э. Взаимосвязь между жидкой, переохлажденной и стеклообразной водой. Природа 396 , 329–335 (1998).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Гейгер, А. и Стэнли, Х. Э. «Пятна» низкой плотности в сети водородных связей жидкой воды: данные компьютерного моделирования молекулярной динамики. Физ. Преподобный Летт. 49 , 1749–1752 (1982).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Харрингтон С., Чжан Р., Пул П. Х., Шортино Ф. и Стэнли Э. Х. Фазовый переход жидкость-жидкость: данные моделирования.
 Физ. Преподобный Летт. 78 , 2409–2412 (1997).
Физ. Преподобный Летт. 78 , 2409–2412 (1997).ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Пул П. Х., Шортино Ф., Гранде Т., Стэнли Х. Э. и Энджелл К. А. Влияние водородных связей на термодинамическое поведение жидкой воды. Физ. Преподобный Летт. 73 , 1632–1635 (1994).
ОБЪЯВЛЕНИЯ КАС пабмед Статья Google ученый
Ши, Р. и Танака, Х. Микроскопический структурный дескриптор жидкой воды. J. Chem. физ. 148 , 124503 (2018).
ОБЪЯВЛЕНИЕ пабмед Статья КАС Google ученый
Вальрафен, Г. Э. Спектральные исследования комбинационного рассеяния влияния температуры на воду и растворы электролитов. J. Chem. физ. 44 , 1546–1558 (1966).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
«>Нильссон А. и Петтерссон Л. Г. М. Взгляд на структуру жидкой воды. Хим. физ. 389 , 1–34 (2011).
КАС Статья Google ученый
Петтерссон, Л. Г. М., Хенчман, Р. Х. и Нильссон, А. Вода — самая аномальная жидкость. Хим. Ред. 116 , 7459–7462 (2016).
КАС пабмед Статья Google ученый
Вернет Ф. Структура первой координационной оболочки в жидкой воде. Наука 304 , 995–999 (2004).
ОБЪЯВЛЕНИЯ КАС пабмед Статья Google ученый
«>Монтес де Ока, Дж. М., Родригес Фрис, Дж. А., Аккордино, С. Р., Маласпина, Д. К. и Аппиньянези, Г. А. Структура и динамика молекул воды с высокой и низкой плотностью в жидком и переохлажденном режимах. евро. физ. J. E 39 , 1–8 (2016).
КАС Статья Google ученый
Мартелли, Ф. Раскрытие вклада местных структур в аномалии воды: синергетическое действие нескольких факторов. J. Chem. физ. 150 , 094506 (2019).
ОБЪЯВЛЕНИЯ пабмед Статья КАС Google ученый
«>Ши Р., Руссо Дж. и Танака Х. Общее микроскопическое структурное происхождение термодинамических и динамических аномалий воды. J. Chem. физ. 149 , 224502 (2018).
ОБЪЯВЛЕНИЯ пабмед Статья КАС Google ученый
Frank, H.S. & Wen, W.Y. Взаимодействие ионов и растворителей. Структурные аспекты взаимодействия ионов и растворителей в водных растворах: предполагаемая картина структуры воды. Обсудить. Фарадей Сок. 24 , 133–140 (1957).
Артикул Google ученый
Гейгер А., Стиллинджер Ф. Х.
 и Рахман А. Аспекты процесса перколяции сетей водородных связей в воде. J. Chem. физ. 70 , 4185–4193 (1979).
и Рахман А. Аспекты процесса перколяции сетей водородных связей в воде. J. Chem. физ. 70 , 4185–4193 (1979).ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Ширатани, Э. и Сасаи, М. Молекулярный предшественник фазового перехода вода-жидкость. J. Chem. физ. 108 , 3264–3276 (1998).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Катбертсон, М. Дж. и Пул, П. Х. Смесеподобное поведение вблизи фазового перехода жидкость-жидкость в моделировании переохлажденной воды. Физ. Преподобный Летт. 106 , 1–4 (2011).
Артикул КАС Google ученый
Руокко Г., Самполи М. и Валлаури Р. Анализ топологии сети в жидкой воде и сероводороде с помощью компьютерного моделирования. J. Chem. физ. 96 , 6167–6176 (1992).

ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Лю, Дж., Хе, Х. и Чжан, Дж. З. Х. Структура жидкой воды — динамическая смесь тетраэдрических и «кольцо-цепочечных» структур. Физ. хим. хим. физ. 19 , 11931–11936 (2017).
КАС пабмед Статья Google ученый
Махешвари, С., Патель, Н., Сатьямурти, Н., Кулкарни, А.Д. и Гадре, С.Р. Структура и стабильность кластеров воды (H 2 O) n , n = 8–20: An исследование ab initio. J. Phys. хим. А 105 , 10525–10537 (2001 г.).
КАС Статья Google ученый
Игнатов И., Мосин О. Структурные математические модели, описывающие кластеры воды. Нанотехнологии. Рез. Практика. 3 , 141–158 (2014).
Артикул Google ученый
«>Руокко Г., Самполи М., Торчини А. и Валлаури Р. Результаты молекулярной динамики растянутой воды. J. Chem. физ. 99 , 8095–8104 (1993).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Белч А.С. и Райс С.А. Распределение колец молекул с водородными связями в модели жидкой воды. J. Chem. физ. 86 , 5676–5682 (1987).
ОБЪЯВЛЕНИЯ Статья Google ученый
Мацумото М., Баба А. и Омине И. Топологические строительные блоки сети водородных связей в воде. J. Chem. физ. 127 , 134504 (2007 г.
 ).
).ОБЪЯВЛЕНИЯ КАС пабмед Статья Google ученый
Радхакришнан Т.П. и Херндон В.К. Теоретико-графовый анализ кластеров воды. J. Phys. хим. 95 , 10609–10617 (1991).
КАС Статья Google ученый
Маркес Лейте Дос Сантос, В., Брэди Морейра, Ф.Г. и Лонго, Р.Л. Топология сетей водородных связей в жидкой воде при комнатных и сверхкритических условиях: структура маленького мира. Хим. физ. лат. 390 , 157–161 (2004).
ОБЪЯВЛЕНИЯ Статья КАС Google ученый
Чой, Дж., Ли, Х., Чой, Х. Р. и Чо, М. Теория графов и агрегация ионов и молекул в водных растворах. год. Преподобный физ. хим. 69 , 125–149 (2018).
ОБЪЯВЛЕНИЯ КАС пабмед Статья Google ученый
«>Ян, Л., Цзи, Х., Лю, С. и Лу, В. Кластеры воды, образующие кольца: морфология и стабильность. ХимияОткр. 8 , 210–218 (2019).
КАС пабмед ПабМед Центральный Статья Google ученый
Казимирски Дж. К. и Бух В. Поиск низкоэнергетических структур кластеров воды (H 2 O) n , n = 20–22, 48, 123 и 293. J. Phys. хим. А 107 , 9762–9775 (2003 г.).
КАС Статья Google ученый
Седики А., Лебсир Ф., Мартини Л., Даучез М. и Краллафа А. Ab initio исследование топологии и свойств трехмерных кластеров воды (H 2 О) n .
 Пищевая хим. 106 , 1476–1484 (2008).
Пищевая хим. 106 , 1476–1484 (2008).КАС Статья Google ученый
Калиничев А.Г., Чураков С.В. Размер и топология молекулярных кластеров в сверхкритической воде: молекулярно-динамическое моделирование. Хим. физ. лат. 302 , 411–417 (1999).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Монсеррат Б., Бранденбург Дж. Г., Энгель Э. А. и Ченг Б. Жидкая вода содержит строительные блоки различных фаз льда. Нац. коммун. 11 , 1–8 (2020).
Артикул КАС Google ученый
Лозинский, М. Жидкая вода: спиральная перспектива структуры. Хим. физ. 455 , 1–6 (2015).
КАС Статья Google ученый
«>Чаплин М.Ф. Предложение по структурированию воды. Биофиз. хим. 83 , 211–221 (2000).
КАС пабмед Статья Google ученый
Гао Ю., Фанг Х. и Ни К. Метод иерархической кластеризации сетей водородных связей в жидкой воде, подвергающейся сдвиговому потоку. науч. 11 , 1–14 (2021).
Артикул КАС Google ученый
Ансари, Н., Дандекар, Р., Каравати, С., Соссо, Г. К. и Хассанали, А. Участки с высокой и низкой плотностью в смоделированной жидкой воде. J. Chem. физ. 149 , 204507 (2018).

ОБЪЯВЛЕНИЕ КАС пабмед Статья Google ученый
Камисаска Г., Шлезингер Д., Жовтобрюх И., Пицевич Г. и Петтерссон Л. Г. М. Предложение о структуре колебаний высокой и низкой плотности в жидкой воде. J. Chem. физ. 151 , 034508 (2019).
ОБЪЯВЛЕНИЯ пабмед Статья КАС Google ученый
Ши, Дж. П., Шеу, С. Ю. и Моу, С. Ю. Анализ полиэдров Вороного структур жидкой воды. J. Chem. физ. 100 , 2202–2212 (1994).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Ансари, Н., Лайо, А. и Хассанали, А. Спонтанно образующиеся дендритные пустоты в жидкой воде могут содержать небольшие полимеры. J. Phys. хим. лат. 10 , 5585–5591 (2019).
КАС пабмед Статья Google ученый
«>Берендсен Х., Григера Дж. Р. и Страатсма Т. П. Недостающий член в эффективных парных потенциалах. J. Phys. хим. 91 , 6269–6271 (1987).
КАС Статья Google ученый
Барбедо, А. С. и Фалькао Де Фрейтас, А. Поиск структуры сообщества в очень больших сетях. Аарон. Бол. да соц. Порт. Кардиол. 15 , 81–90 (2003).
Google ученый
Блондель, В. Д., Гийом, Дж. Л., Ламбиот, Р. и Лефевр, Э. Быстрое развертывание сообществ в больших сетях. J. Стат. мех. Теория Эксп. 2008 , 1–12 (2008).

МАТЕМАТИКА Статья Google ученый
Аккираю, Н. и др. Альфа-фигуры: определение и программное обеспечение. В Трудах 1-го Международного семинара по программному обеспечению для вычислительной геометрии 63–66 (1995).
Олейникова А., Бровченко И. Перколяционные сети и переходы жидкость-жидкость в переохлажденной воде. J. Phys. Конденс. Материя 18 , S2247 (2006).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Стуковски, А. Визуализация и анализ данных атомистического моделирования с помощью OVITO — Open Visualization Tool. Модель . Симул. Матер. науч. англ. 18 , 2154–2162 (2010).
Google ученый
Ленц А. и Оямяэ Л. Теоретическое исследование кластеров воды: взаимосвязь между топологией водородных связей и энергией взаимодействия на основе квантово-химических расчетов для кластеров, содержащих до 22 молекул.
 Физ. хим. хим. физ. 7 , 1905–1911 (2005).
Физ. хим. хим. физ. 7 , 1905–1911 (2005).КАС пабмед Статья Google ученый
Ленц А. и Оямяэ Л. Теоретическое исследование водного равновесия: распределение кластеров в зависимости от температуры и давления для (H 2 O) n , n = 1–60, и льда. J. Chem. физ. 131 , 134302 (2009 г.).
ОБЪЯВЛЕНИЯ пабмед Статья КАС Google ученый
Hirunsit, P. & Balbuena, P.B. Влияние изоляции на структуру и динамику воды: исследование молекулярного моделирования. J. Phys. хим. C 111 , 1709–1715 (2007).
КАС Статья Google ученый
Стэнли, Х. Э. Применение фрактальных концепций к статистике полимеров и к аномальному переносу в случайно-пористых средах. J.
 Стат. физ. 36 , 843–860 (1984).
Стат. физ. 36 , 843–860 (1984).ОБЪЯВЛЕНИЯ Статья Google ученый
Вишняков А., Дебенедетти П. Г. и Неймарк А. В. Статистическая геометрия полостей в метастабильной замкнутой жидкости. Физ. Преп. E Стат. физ. Плазменные жидкости Relat. междисциплинарный Верхний. 62 , 538–544 (2000).
КАС Google ученый
Волошин В. П., Наберухин Ю. И. Распределение времени жизни водородной связи в воде, моделируемой компьютером. Дж. Структура. хим. 50 , 78–89 (2009).
КАС Статья Google ученый
Wu, X., Lu, W., Streacker, L.M., Ashbaugh, H.S. & Ben-Amotz, D. Зависимая от температуры шкала длины гидрофобного кроссовера и тетраэдрический порядок воды. J. Phys. хим. лат. 9 , 1012–1017 (2018).

КАС пабмед Статья Google ученый
Грдадольник Дж., Мерзель Ф. и Авбель Ф. Происхождение гидрофобности и повышенной прочности водородных связей воды вблизи чисто гидрофобных растворенных веществ. Проц. Натл. акад. науч. США 114 , 322–327 (2017).
КАС пабмед Статья Google ученый
Мур, Э. Б. и Молинеро, В. Растущая длина корреляции в переохлажденной воде. J. Chem. физ. 130 , 244505 (2009 г.).
ОБЪЯВЛЕНИЯ пабмед Статья КАС Google ученый
Мартис, Н. С. и Маунтин, Р. Д. Алгоритм Velocity Verlet для моделей подвесок на основе диссипативной динамики частиц. Физ. Преп. E Стат. физ. Плазменные жидкости Relat. междисциплинарный Верхний. 59 , 3733–3736 (1999).

КАС Google ученый
GaussView, версия 5, Рой Деннингтон, Тодд Кейт и Джон Миллам (Semichem Inc., 2009 г.).).
Кумар Р., Шмидт Дж. Р. и Скиннер Дж. Л. Определения и динамика водородных связей в жидкой воде. J. Chem. физ. 126 , 1–13 (2007).
Google ученый
Францблау Д.С. Вычисление кольцевой статистики для сетевых моделей твердых тел. Физ. Ред. B 44 , 4925–4930 (1991).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Набор инструментов MATLAB и статистики, выпуск 2020b (The Mathworks, Inc., 2020).
Людвиг, Р. Вода: от гроздей до массы. Анжю. хим. Междунар. Эд. 40 , 1808–1827 (2001).
КАС Статья Google ученый
Нильссон А. и Петтерссон Л. Г. М. Структурное происхождение аномальных свойств жидкой воды. Нац. коммун. 6 , 1–11 (2015).
Артикул КАС Google ученый
Хуанг, К. и др. Неоднородная структура воды в условиях окружающей среды. Проц. Нац. акад. науч. США 106 , 15214–15218 (2009 г.).
ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Статья Google ученый
Токусима, Т. и др. Рентгеновская эмиссионная спектроскопия высокого разрешения жидкой воды: наблюдение двух структурных мотивов. Хим. физ. лат. 460 , 387–400 (2008).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Сантра, Б., ДиСтазио, Р. А., Мартелли, Ф. и Кар, Р. Анализ локальной структуры жидкой воды ab initio. Мол. физ. 113 , 2829–2841 (2015).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Бако, И. и др. Топология сети водородных связей в жидкой воде и метаноле: подход теории графов. Физ. хим. хим. физ. 15 , 15163 (2013).
ПабМед Статья КАС Google ученый
Бако, И., Мегиес, Т. и Балинт, С. Смеси вода-метанол: топология сети с водородными связями. Физ. хим. хим. физ. 10 , 5004–5011 (2008 г.).
ПабМед Статья КАС Google ученый
Джовамбаттиста Н., Булдырев С. В., Старр Ф. В. и Стэнли Х. Э. Динамические неоднородности в жидкой воде. Конф. АИП. проц. 708 , 483–490 (2004).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Ансари, Н., Онат, Б., Соссо, Г. К. и Хассанали, А. Взгляд на возникающие сети пустот в смоделированной переохлажденной воде. J. Phys. хим. B 124 , 2180–2190 (2020).
КАС пабмед Статья Google ученый
Скачать ссылки
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (№ U2040214) и проектом 111 (№ B18031).
Информация об авторе
Авторы и организации
Государственная ключевая лаборатория гидротехнических наук, факультет гидротехники, Университет Цинхуа, Пекин, 100084, Китай
Yitian Gao, Hongwei Fang, Ke Ni & Yixuan Feng
Авторы
- Yitian Gao
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Hongwei Fang
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ke Ni
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Yixuan Feng
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
H.F., YG., K.N. и YF разработали исследование.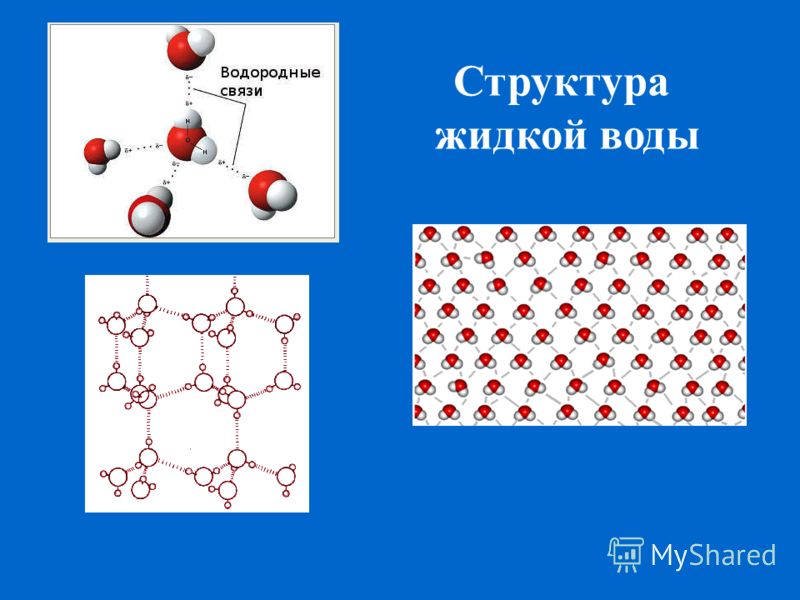 Ю.Г. провел моделирование и проанализировал данные. Х.Ф., Ю.Г., К.Н. и Ю.Ф. обсудили рукопись. Ю.Г. написал рукопись.
Ю.Г. провел моделирование и проанализировал данные. Х.Ф., Ю.Г., К.Н. и Ю.Ф. обсудили рукопись. Ю.Г. написал рукопись.
Автор, ответственный за переписку
Хунвэй Фан.
Декларации этики
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация.
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на первоначальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Скачать PDF
Структура и водородные связи на пределе устойчивости жидкой воды
Реферат
Жидкая вода демонстрирует нетрадиционное поведение в широком диапазоне стабильности — от необычно высокой критической точки жидкого пара до точки плавления и ниже, когда она достигает максимума плотности и демонстрирует отрицательное тепловое расширение, позволяющее льду плавать. Понимание молекулярных основ этих аномалий представляет собой проблему, мотивирующую изучение воды на протяжении более века. Здесь мы исследуем молекулярную структуру жидкой воды в диапазоне ее стабильности, от умеренного переохлаждения до режимов отрицательного давления и высоких температур. Мы используем недавно разработанную электронно-чувствительную модель воды, построенную на основе молекулярных свойств газовой фазы и включающую многочастичные дальнодействующие взаимодействия всех порядков; в результате было показано, что модель имеет высокую переносимость со льда на сверхкритический режим. Мы сообщаем о связи между аномальным тепловым расширением воды и поведением ее второй координационной сферы и аномалией в водородных связях, которая сохраняется во всем диапазоне стабильности жидкой воды — от высокотемпературного предела жидкой воды до ее переохлажденного режима.
Понимание молекулярных основ этих аномалий представляет собой проблему, мотивирующую изучение воды на протяжении более века. Здесь мы исследуем молекулярную структуру жидкой воды в диапазоне ее стабильности, от умеренного переохлаждения до режимов отрицательного давления и высоких температур. Мы используем недавно разработанную электронно-чувствительную модель воды, построенную на основе молекулярных свойств газовой фазы и включающую многочастичные дальнодействующие взаимодействия всех порядков; в результате было показано, что модель имеет высокую переносимость со льда на сверхкритический режим. Мы сообщаем о связи между аномальным тепловым расширением воды и поведением ее второй координационной сферы и аномалией в водородных связях, которая сохраняется во всем диапазоне стабильности жидкой воды — от высокотемпературного предела жидкой воды до ее переохлажденного режима.
Введение
Вода проявляет замечательный набор аномальных свойств даже в привычных условиях, близких к температуре и давлению окружающей среды.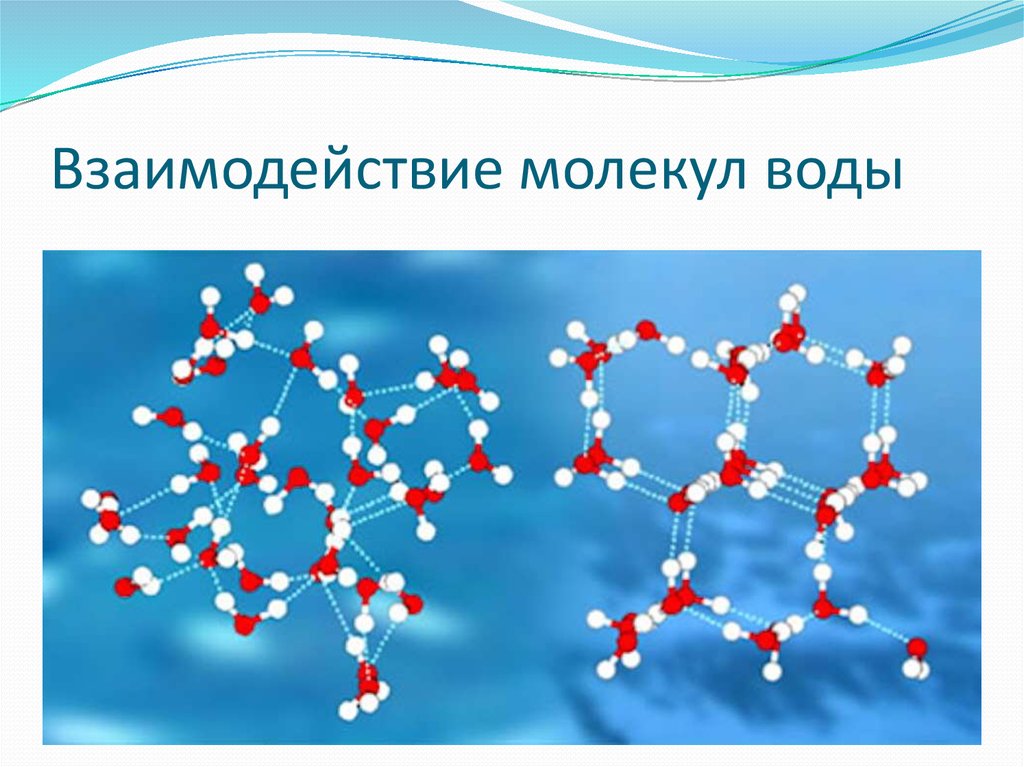 К ним относятся его температура максимальной плотности при атмосферном давлении, его высокая диэлектрическая проницаемость, высокое поверхностное натяжение и кривая плавления с отрицательным наклоном 1 . Вода также имеет необычно высокую критическую температуру, завершающую кривую сосуществования жидкости и газа. Еще больше аномалий возникает вблизи предела устойчивости жидкой воды. При низких температурах и давлении, близком к атмосферному, жидкая вода остается в метастабильном состоянии ниже точки замерзания в переохлажденный состояние 2 . Здесь существование максимума плотности (чуть выше точки замерзания), ниже которого тепловое расширение является отрицательным, потенциальная скрытая критическая точка и максимумы термодинамических откликов обсуждались в литературе 1 , но их трудно изучить и количественно оценить как экспериментально, так и с помощью компьютерного моделирования из-за ограничений длины и масштаба времени.
К ним относятся его температура максимальной плотности при атмосферном давлении, его высокая диэлектрическая проницаемость, высокое поверхностное натяжение и кривая плавления с отрицательным наклоном 1 . Вода также имеет необычно высокую критическую температуру, завершающую кривую сосуществования жидкости и газа. Еще больше аномалий возникает вблизи предела устойчивости жидкой воды. При низких температурах и давлении, близком к атмосферному, жидкая вода остается в метастабильном состоянии ниже точки замерзания в переохлажденный состояние 2 . Здесь существование максимума плотности (чуть выше точки замерзания), ниже которого тепловое расширение является отрицательным, потенциальная скрытая критическая точка и максимумы термодинамических откликов обсуждались в литературе 1 , но их трудно изучить и количественно оценить как экспериментально, так и с помощью компьютерного моделирования из-за ограничений длины и масштаба времени.
Стандартная картина постулирует, что водные аномалии возникают в результате конкуренции 3 между двумя локальными структурами: упорядоченной структурой низкой плотности и неупорядоченной структурой высокой плотности. Доказательства этой картины исходят как из эксперимента, так и из моделирования. Экспериментально воду можно превратить в три типа стекол 4 : аморфное стекло низкой плотности (LDA), аморфное стекло высокой плотности (HDA) и аморфное стекло очень высокой плотности (VHDA) 5 . Таким образом, эти стекла должны представлять собой бассейны свободной энергии в жидкой воде. Действительно, существование «полиаморфизма» воды вдохновило гипотезу о переходе жидкость-жидкость 6 в переохлажденной воде, что все еще активно обсуждается 7,8,9,10,11,12 , поскольку эксперименты трудно проводить в глубоко переохлажденной воде из-за короткого времени замерзания, а моделирование затруднено из-за требуемой длины и временных масштабов. для адекватной выборки.
Доказательства этой картины исходят как из эксперимента, так и из моделирования. Экспериментально воду можно превратить в три типа стекол 4 : аморфное стекло низкой плотности (LDA), аморфное стекло высокой плотности (HDA) и аморфное стекло очень высокой плотности (VHDA) 5 . Таким образом, эти стекла должны представлять собой бассейны свободной энергии в жидкой воде. Действительно, существование «полиаморфизма» воды вдохновило гипотезу о переходе жидкость-жидкость 6 в переохлажденной воде, что все еще активно обсуждается 7,8,9,10,11,12 , поскольку эксперименты трудно проводить в глубоко переохлажденной воде из-за короткого времени замерзания, а моделирование затруднено из-за требуемой длины и временных масштабов. для адекватной выборки.
Моделирование обеспечивает жизнеспособный и всеобъемлющий способ изучения структуры воды с той оговоркой, что выбранная модель может не воспроизводить все основные физические свойства воды. Структура смоделированной жидкой воды была исследована с использованием различных параметров порядка, коллективных переменных, которые кодируют структурные мотивы в наборе уникальных чисел.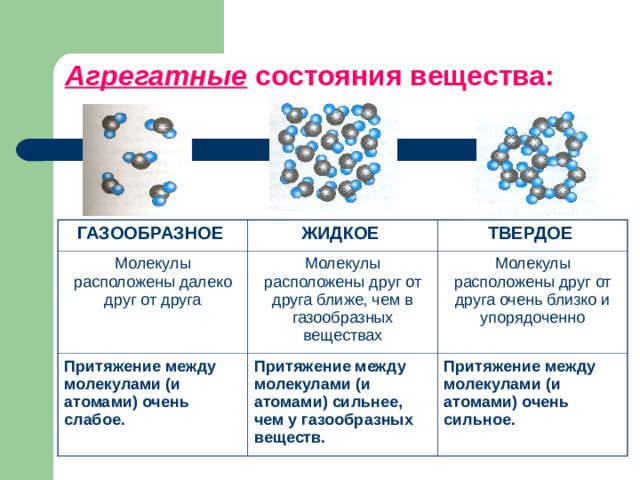 Параметр тетраэдральности (Q) 13 измеряет локальную структуру в первой координационной оболочке. Индекс локальной структуры (LSI) 14 измеряет расстояние между первой и второй оболочками, относящееся к порядку и беспорядку в зазоре между двумя координационными оболочками. Расстояние до пятого соседа ( d 5 ) 15 , соседа, колеблющегося между первой и второй оболочкой, также с успехом использовалось для оценки структурного порядка жидкой воды.
Параметр тетраэдральности (Q) 13 измеряет локальную структуру в первой координационной оболочке. Индекс локальной структуры (LSI) 14 измеряет расстояние между первой и второй оболочками, относящееся к порядку и беспорядку в зазоре между двумя координационными оболочками. Расстояние до пятого соседа ( d 5 ) 15 , соседа, колеблющегося между первой и второй оболочкой, также с успехом использовалось для оценки структурного порядка жидкой воды.
Многочисленные исследования связали параметры порядка, описанные выше, с аномалиями в жидкой воде. Внутренние структуры, полученные путем гашения мгновенных кадров траектории молекулярной динамики, имеют бимодальное распределение LSI 16 с двумя пиками, каждый из которых связан со структурами с низкой и высокой плотностью. Точно так же d 5 можно использовать в качестве дискриминатора 17 между фазами низкой и высокой плотности в термодинамической модели жидкой воды.
Связность сети водородных связей является еще одним показателем структурного порядка в жидкой воде. Классическая картина представлена молекулами, в основном четырехкоординированными, с двумя донорными водородными связями, начинающимися с атома водорода и заканчивающимися на атоме кислорода, и двумя акцепторными водородными связями, начинающимися с кислорода и заканчивающимися на водороде. Недавние исследования поставили под сомнение эту картину: рентгеновская адсорбционная спектроскопия и рамановское рассеяние рентгеновских лучей показали, что только две сильные водородные связи на молекулу воды согласуются с измеренными спектрами 18 . Этот результат в настоящее время интерпретируется как асимметрия силы контакта между акцепторными и донорными связями, наблюдаемая как при расчетах электронной структуры 19,20 , так и при моделировании электронно-крупнозернистой модели воды 21 .
Здесь мы изучаем структуру воды во всей ее области стабильности, от ее переохлажденного и растянутого состояния до режима высокой температуры и высокого давления.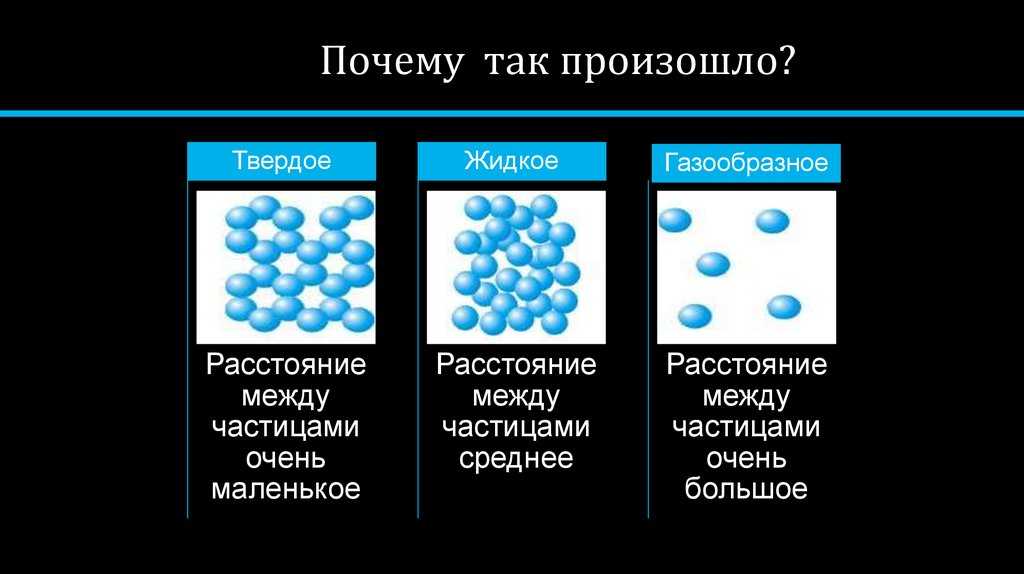 Мы используем вычислительно эффективную квантово-классическую модель QDO (Quantum Drude Oscillator) для воды 22,23,24,25 , в котором крупнозернистая молекулярная электронная подсистема используется для обеспечения полного набора многочастичных электронных ответов дальнего действия. Параметры QDO-вода получены из ответов одиночных молекул и поверхности потенциальной энергии димера. Выборка интеграла по путям дает поверхность Борна – Оппенгеймера для ядер непертурбативным способом и, таким образом, генерирует члены дальнего взаимодействия для всех порядков. Эти термины включают поляризацию многих тел, дисперсионные взаимодействия и перекрестные взаимодействия поляризации и дисперсии за пределами дипольного приближения. Таким образом, электронные отклики не фильтруются искусственным усечением, и априори не навязываются какие-либо отклонения или симметрия окружающей среды, как в случае с моделями с фиксированными функциональными формами, соответствующими свойствам конденсированной фазы.
Мы используем вычислительно эффективную квантово-классическую модель QDO (Quantum Drude Oscillator) для воды 22,23,24,25 , в котором крупнозернистая молекулярная электронная подсистема используется для обеспечения полного набора многочастичных электронных ответов дальнего действия. Параметры QDO-вода получены из ответов одиночных молекул и поверхности потенциальной энергии димера. Выборка интеграла по путям дает поверхность Борна – Оппенгеймера для ядер непертурбативным способом и, таким образом, генерирует члены дальнего взаимодействия для всех порядков. Эти термины включают поляризацию многих тел, дисперсионные взаимодействия и перекрестные взаимодействия поляризации и дисперсии за пределами дипольного приближения. Таким образом, электронные отклики не фильтруются искусственным усечением, и априори не навязываются какие-либо отклонения или симметрия окружающей среды, как в случае с моделями с фиксированными функциональными формами, соответствующими свойствам конденсированной фазы.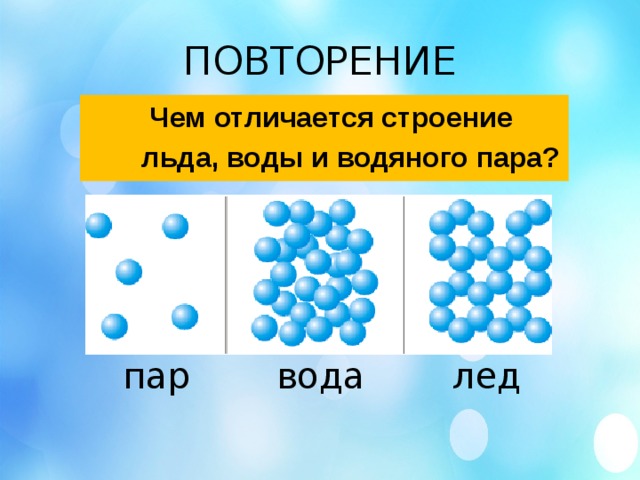 В результате QDO-вода предсказывает реалистичную жидкость в условиях окружающей среды со структурными особенностями и термодинамическими свойствами, превосходно согласующимися с экспериментом 9.0168 22,26 . При этом обе ветви кривой сосуществования жидкость-пар, критическая точка жидкость-пар, температура максимальной плотности, поверхностное натяжение, энтальпия парообразования, структура льда II и сверхкритические изотермы прекрасно согласуются с экспериментом 21, 24 , что является беспрецедентной переносимостью для компьютерной воды.
В результате QDO-вода предсказывает реалистичную жидкость в условиях окружающей среды со структурными особенностями и термодинамическими свойствами, превосходно согласующимися с экспериментом 9.0168 22,26 . При этом обе ветви кривой сосуществования жидкость-пар, критическая точка жидкость-пар, температура максимальной плотности, поверхностное натяжение, энтальпия парообразования, структура льда II и сверхкритические изотермы прекрасно согласуются с экспериментом 21, 24 , что является беспрецедентной переносимостью для компьютерной воды.
Используя QDO-воду, мы связываемся с параметрами порядка, измеряющими структуру воды, и изучаем распределение ближайших соседей. В частности, мы фокусируемся на внешней асимметрии в соединении сети водородных связей воды, чтобы охватить более широкий диапазон условий.
Методы
Детали моделирования
Мы выполнили серию молекулярно-динамических расчетов адиабатического интеграла по путям для квантовых осцилляторов Друде (APIMD-QDO) 23 в каноническом ансамбле ( NVT ) для системы, содержащей 300 молекул воды в кубическая коробка периодически воспроизводится в трех измерениях. Классическая ядерная подсистема модели КДО для воды 24 интегрировалась с шагом по времени 0,15 фс, а при дискретизации интеграла по путям использовалось число Троттера P = 96. Для ядерных и друдоновых степеней свободы использовались отдельные термостаты. Ядерная подсистема доводилась до желаемой температуры с помощью цепи Нозе-Гувера 27 , тогда как друдоны поддерживались на порядок более высокой температуре с помощью отдельного термостата. Полный набор параметров модели, включая эмпирическое отталкивание ближнего действия, можно найти в другом месте 24 . В дополнение к электростатическим взаимодействиям, которые обрабатываются суммированием Эвальда, модель включает только экспоненциально затухающее короткодействующее отталкивание и, следовательно, имеет слабую зависимость от размера системы из-за свойств, зависящих от флуктуаций. Системы уравновешивались в течение 100–300 пс, а статистика собиралась в течение следующих 300–1000 пс. Классическое моделирование с использованием модели TIP4P/2005 28 были выполнены с использованием NAMD 29 с использованием того же размера системы и термодинамических состояний, что и при моделировании воды QDO.
Классическая ядерная подсистема модели КДО для воды 24 интегрировалась с шагом по времени 0,15 фс, а при дискретизации интеграла по путям использовалось число Троттера P = 96. Для ядерных и друдоновых степеней свободы использовались отдельные термостаты. Ядерная подсистема доводилась до желаемой температуры с помощью цепи Нозе-Гувера 27 , тогда как друдоны поддерживались на порядок более высокой температуре с помощью отдельного термостата. Полный набор параметров модели, включая эмпирическое отталкивание ближнего действия, можно найти в другом месте 24 . В дополнение к электростатическим взаимодействиям, которые обрабатываются суммированием Эвальда, модель включает только экспоненциально затухающее короткодействующее отталкивание и, следовательно, имеет слабую зависимость от размера системы из-за свойств, зависящих от флуктуаций. Системы уравновешивались в течение 100–300 пс, а статистика собиралась в течение следующих 300–1000 пс. Классическое моделирование с использованием модели TIP4P/2005 28 были выполнены с использованием NAMD 29 с использованием того же размера системы и термодинамических состояний, что и при моделировании воды QDO.
Проверка модели
Первым шагом является проверка предсказаний QDO-воды в переохлажденных и растянутых областях. Для этого мы выбрали ряд экспериментальных и расчетных тестов: (а) уравнение состояния IAPWS-95 30 , которое было проверено экспериментально в строгих термодинамических условиях и мягком переохлаждении; (б) эксперименты с положительным давлением Мисима 31 ; (c) эксперименты с отрицательным давлением Pallares et al. 32 и (d) моделирование с использованием модели воды общего назначения (TIP4P/2005), проведенной нами и оцифрованной из Singh et al . 17 . Для проведения желаемых сравнений поведение QDO-воды было отобрано на двух изохорах: ρ 1 = 51,8002 моль/л, что соответствует экспериментам Pallares et al. 32 и ρ 2 = 55,3173 моль/л, близко к плотности окружающей среды, а на одной изотерме: T = 230 K. На рис. 1 показано давление как функция температуры в сравнении с экспериментальными и теоретическими эталонными значениями.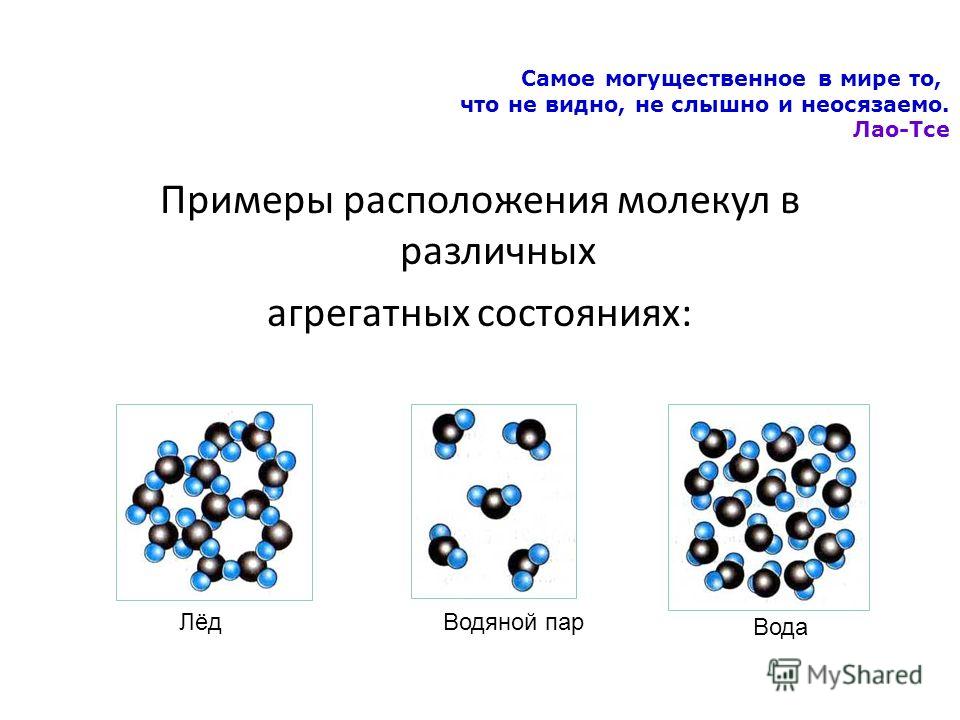
Давление 300 молекул QDO-воды в зависимости от температуры при двух постоянных объемах: ρ 1 = 51,8002 моль/л (красный) и ρ 7 5,3 5,3 моль/л 2 2 902 (синий). Пунктирная линия представляет собой эквивалентные данные, оцифрованные с Pallares 9.0259 и др. . 32 ( ρ 1 , экспериментальные оценки посредством моделирования TIP4P/2005). Пунктирные линии представляют соответствующие изотермы эталонного уравнения состояния воды IAPWS-95 30 . Черная пунктирная линия соответствует интерполированной изохоре, основанной на экспериментальных данных, измеренных Mishima 31 .
Изображение в полный размер
Предсказания экспериментов с QDO-водой совпадают с экспериментами на обеих изохорах, показывая, что применимость QDO-воды распространяется на переохлажденную и растянутую жидкость. Кроме того, взяв минимум давления как функцию температуры на ρ 2 = 55,3173 моль/л изохора, температура максимальной плотности (TMD) предсказывается при экспериментальное значение T = 277,13 K и наша предыдущая оценка 278,6(20) K 24 на основе прямой выборки изобары атмосферного давления. Эти результаты в сочетании с предыдущей работой показывают, что QDO-вода хорошо описывает окружающую воду 26 , сверхкритическую воду 24 граница раздела жидкость-пар 21 , лед II 26 , а теперь еще и переохлажденная и растянутая вода.
Эти результаты в сочетании с предыдущей работой показывают, что QDO-вода хорошо описывает окружающую воду 26 , сверхкритическую воду 24 граница раздела жидкость-пар 21 , лед II 26 , а теперь еще и переохлажденная и растянутая вода.
Сходимость проверялась путем наблюдения за изменением свойств системы во времени. Мы отмечаем, что время релаксации реальной воды короче нескольких наносекунд в выбранной нами области, что меньше, чем время нашего моделирования.
Результаты
В этом разделе мы представляем наш анализ структуры воды. Мы начнем с изучения второй координационной сферы, после чего проведем анализ связности водородных связей, где покажем, что асимметрия в водородных связях сохраняется во всем диапазоне температур и давлений. Мы связываем структуру воды при низкой и высокой плотности со структурой аморфных льдов, а поведение ее дипольного момента связываем с двумя параметрами структурного порядка: индексом локальной структуры и тетраэдральностью.
Вторая координационная оболочка вызывает отрицательное тепловое расширение
Даже при температуре окружающей среды и умеренном переохлаждении структура жидкой воды представляет собой смесь структур низкой и высокой плотности. Предполагается, что конкуренция между этими структурами ответственна за две частные аномалии жидкой воды: ее максимум плотности и возникающее в результате отрицательное тепловое расширение.
Роль второй координационной оболочки в управлении этими аномалиями подчеркивается диапазоном расстояний, занимаемых каждым соседом, как показано на рис. 2а. При охлаждении четыре ближайших соседа, образующие первую оболочку, сжимаются (т. е. ведут себя нормально). Напротив, соседи с четвертого по двенадцатый, являющиеся частью второй оболочки, расширяются при охлаждении (т.е. аномальное поведение). Следовательно, вторая координационная оболочка придает воде отрицательное тепловое расширение. Затем максимум плотности и возврат к положительному тепловому расширению совпадают с прекращением расширения второй координационной сферы при понижении температуры; таким образом достигается баланс свободной энергии между локальным растяжением и возрастающим порядком.
Структура КДО-воды при охлаждении и переохлаждении. ( a ) Распределение вероятности каждого соседа (произвольные единицы) в зависимости от температуры, показывающее диапазон расстояний от центральной молекулы, которую занимает сосед. ( b ) Координационное число как функция плотности при T = 230 K
Изображение в полный размер
Роль второй координационной оболочки в различении структур с низкой и высокой плотностью дополнительно подчеркивается при изучении координационный номер. До значения 4 (т.е. полной тетраэдрической координации) он слабо меняется с плотностью (см. рис. 2б). Это означает, что первая координационная оболочка обладает высокой несжимаемостью, а ее структура остается относительно жесткой при разных плотностях, что является разумным поведением для сильно ассоциированной жидкости.
Популяции водородных связей в стабильном диапазоне жидкой воды
Природа координационных оболочек жидкой воды является прямым следствием ее склонности к водородным связям.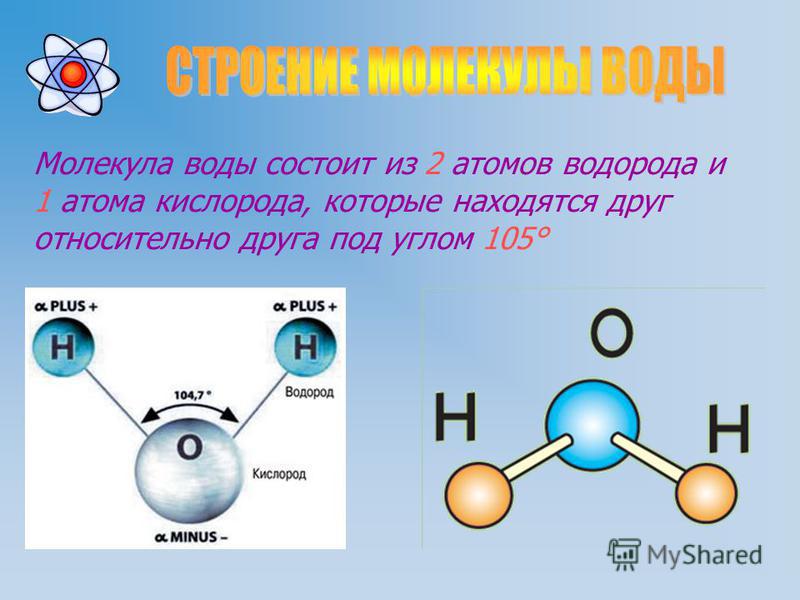 На рис. 3 показано изменение вероятности каждого мотива, связанного водородной связью, в зависимости от температуры на двух изохорах. Каждый мотив помечен количеством акцепторных и донорных водородных связей (например, DA означает «одна донорная и одна акцепторная связь»).
На рис. 3 показано изменение вероятности каждого мотива, связанного водородной связью, в зависимости от температуры на двух изохорах. Каждый мотив помечен количеством акцепторных и донорных водородных связей (например, DA означает «одна донорная и одна акцепторная связь»).
Вероятность данного мотива водородной связи (назначенная с использованием критерия в ссылке 35 ) в зависимости от температуры из моделирования QDO-вода при двух постоянных плотностях ρ 1 = 51,8002 моль/л линии) и ρ 2 = 55,3173 моль/л (штриховые линии).
Изображение с полным размером
Структура с водородными связями ведет себя при переохлаждении так, как ожидается для сильно координирующей жидкости. Тетраэдрически скоординированный мотив увеличивается при охлаждении и переохлаждении, в то время как количество трех мотивов с водородными связями уменьшается. Интересно отметить, что даже при самых низких температурах все еще присутствуют две аномалии.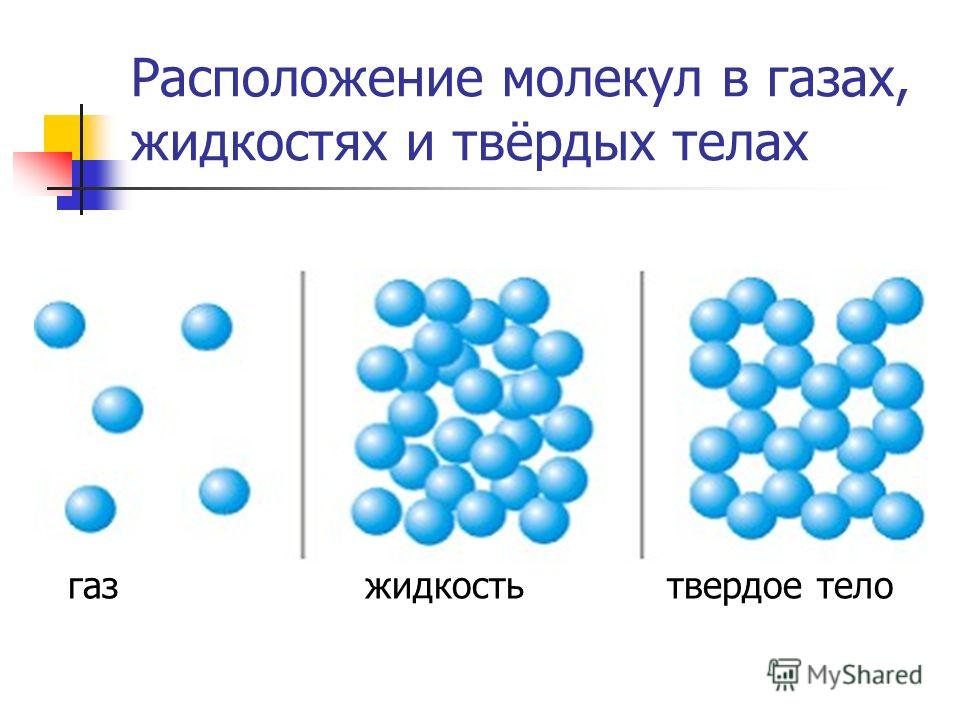 Во-первых, асимметрия между DDA и DAA, ответственная за поверхностную ориентацию молекул воды 21 выживает даже при самом глубоком из доступных переохлаждений. Во-вторых, мотивы с пятью водородными связями все еще присутствуют, их популяция практически не меняется между 250 К и 450 К.
Во-первых, асимметрия между DDA и DAA, ответственная за поверхностную ориентацию молекул воды 21 выживает даже при самом глубоком из доступных переохлаждений. Во-вторых, мотивы с пятью водородными связями все еще присутствуют, их популяция практически не меняется между 250 К и 450 К.
При высоких температурах дело обстоит иначе. Выше T = 450 K (при достаточно высокой плотности) вода все еще остается жидкостью, но только 20% молекул являются DDAA. Доминируют три мотива, связанных водородными связями, с примерно 15% DAA и 20% DAA. При охлаждении первая оболочка становится преимущественно тетраэдрической с преобладающим мотивом ДДАА.
Структурная взаимосвязь между переохлажденной водой и аморфным льдом
Функция радиального распределения кислород-кислород при высокой и низкой плотности при T = 230 K (рис. 4) показывает, что QDO-вода предсказывает две различные локальные структуры в переохлажденной воде. Эти структуры близко соответствуют экспериментальным измерениям аморфных льдов высокой плотности (HDA, 64,76 моль/л) и аморфных льдов низкой плотности (LDA, 51,86 моль/л), измеренных при T = 80 K 33 .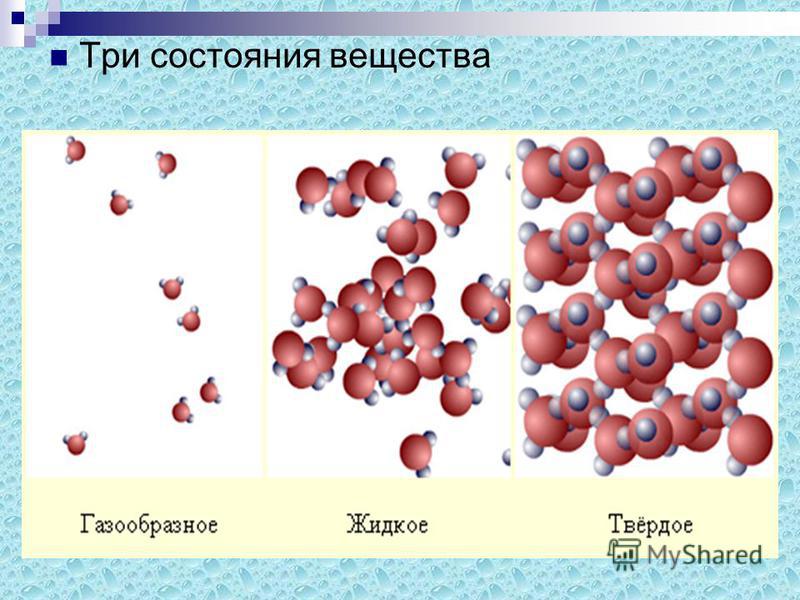
Функции радиального распределения QDO-воды при T = 250 K и ρ = 52 и 62 моль/л по сравнению с аморфной водой высокой и низкой плотности, измеренные Finney et al . 33 .
Изображение в полный размер
При низкой плотности структура похожа на лед, с хорошо разделенными первой и второй координационными оболочками и небольшой заселенностью «промежуточных» участков между ними. При высокой плотности вторая оболочка смещается на меньшие радиусы с уменьшением вершины первой оболочки для достижения более высокой упаковки. Эти мотивы существенно отличаются от структуры КДО-воды при высокой температуре, где сильно ассоциирована только первая оболочка.
Связь между электронными откликами и структурным порядком
Параметры порядка, традиционно используемые для описания аномального поведения воды и смеси двух различных структур по индексу локальной структуры (LSI) 14 и параметру тетраэдральности (Q) 13 (см. Определения методов). Здесь мы изучаем взаимосвязь этих параметров с поведением первой и второй оболочки, показанными выше.
Определения методов). Здесь мы изучаем взаимосвязь этих параметров с поведением первой и второй оболочки, показанными выше.
LSI измеряет расстояние между первой и второй координационными слоями, при этом высокие значения соответствуют большому расстоянию между первым и вторым слоями. Параметр Q является мерой структурного порядка первой оболочки. Он принимает значение нуля для бесструктурной оболочки и достигает единицы для идеального тетраэдрического порядка. Мы также рассматриваем молекулярный дипольный момент, который, как мы показали, является хорошим описанием тонких различий в локальной структуре и образцах водородных связей в полярных жидкостях 9.0168 26 .
На рис. 5 показано изменение LSI, Q и дипольного момента в зависимости от температуры и плотности. Поскольку структура первой оболочки мало меняется с плотностью, мы ожидаем, что Q и дипольный момент будут демонстрировать слабую зависимость от плотности, в то время как LSI будет демонстрировать сильную зависимость от плотности. Это действительно наблюдается, подтверждая различные механизмы сжатия двух оболочек и важность изучения параметров порядка, подходящих для каждого масштаба длины.
Это действительно наблюдается, подтверждая различные механизмы сжатия двух оболочек и важность изучения параметров порядка, подходящих для каждого масштаба длины.
Параметры порядка в зависимости от температуры при постоянной плотности ρ 1 = 51,8002 моль/л (красные кружки) и ρ 2 = 55,3173 смоль/л (синие квадраты).
Изображение полного размера
Дипольный момент не имеет аномалий, а только постоянно увеличивается при охлаждении и переохлаждении, отражая возрастающий порядок в первой координационной сфере. Дипольный момент также отражает несжимаемость первой координационной оболочки, слабо зависящей от плотности.
Обсуждение
Мы исследовали эволюцию структурных и электронных реакций воды во всем диапазоне условий, при которых можно идентифицировать стабильную или метастабильную жидкую форму. Теперь мы пытаемся развить картину жидкой воды в режимах глубокого переохлаждения и растяжения.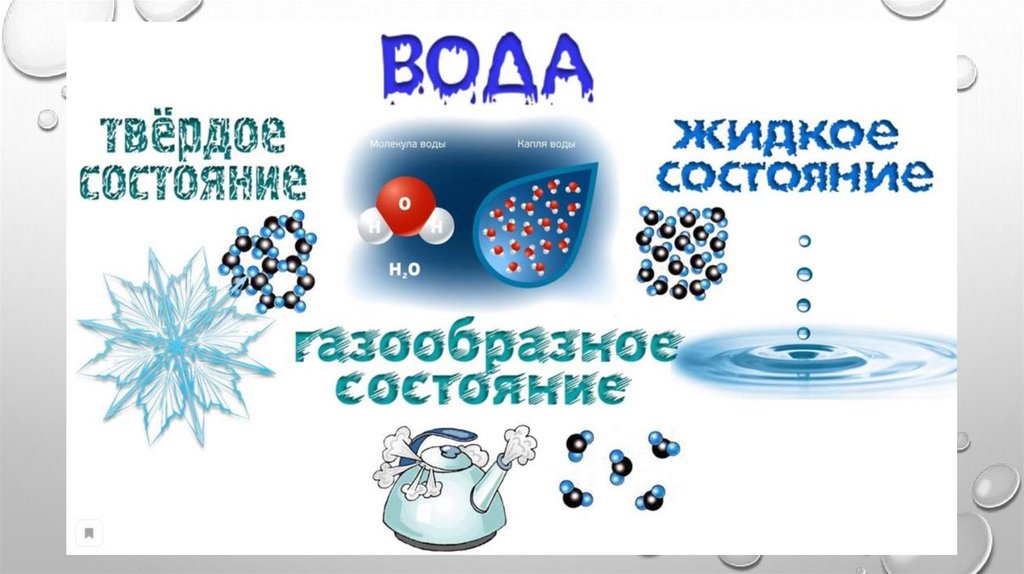
Чтобы лучше понять этот сложный режим, мы провели моделирование с использованием воды QDO. Эта модель позволяет впервые напрямую предсказать поведение переохлажденной и растянутой жидкости на основе модели, основанной исключительно на свойствах изолированных молекул, тем самым устраняя систематическую ошибку параметризации, обычно возникающую при подгонке физически ограниченного закона силы к свойствам конденсированных фаз при моделировании. -выбранные точки состояния. QDO-вода электронно адаптируется к изменяющимся условиям, поскольку вся поляризация многих тел, дисперсия и перекрестные взаимодействия учитываются непертурбативно. В результате было обнаружено, что QDO-вода предсказуема на фазовой диаграмме 21,22,23,24,25,26 .
В нашем исследовании Н-связи в переохлажденном режиме мы обнаружили, что расстояние до i -го соседа является важным параметром порядка. Он показывает, что в то время как первая координационная оболочка сжимается при охлаждении при постоянном объеме (ожидаемое поведение), вторая оболочка расширяется (отрицательное тепловое расширение). Поскольку вода имеет положительное тепловое расширение выше температуры максимальной плотности и отрицательное тепловое расширение ниже, это означает, что поведение второй оболочки доминирует при низких температурах.
Поскольку вода имеет положительное тепловое расширение выше температуры максимальной плотности и отрицательное тепловое расширение ниже, это означает, что поведение второй оболочки доминирует при низких температурах.
Вышеприведенное наблюдение согласуется со все более тетраэдрической жидкостью: когда первая оболочка становится преимущественно четырехкоординированной, ее плотность меньше меняется с температурой, так как это означало бы перестройку связей. При высоких температурах первая оболочка имеет больше степеней свободы, так как тетраэдрические заселенности менее преобладают. Таким образом, при высоких температурах мы имеем коэффициент теплового расширения, в котором преобладает первая оболочка, оставляя положительное тепловое расширение. При низких температурах, когда первая оболочка в основном тетраэдрическая и в ней преобладают сильные водородные связи, доминирует вторая оболочка, что приводит к отрицательному тепловому расширению. Это наблюдение также согласуется с исследованиями трансляционного порядка в первой и второй оболочках, которые показывают, что аномалия в параметре трансляционного порядка в основном вызвана поведением второй оболочки 34 .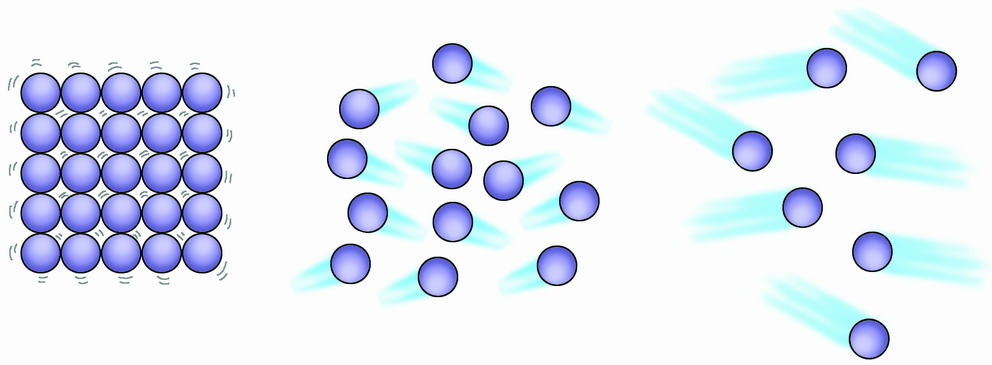
Мы также заметили, что первая оболочка относительно несжимаема при постоянной температуре, а изменения плотности вызваны изменением координационного числа во второй оболочке. Это предполагает два механизма изменения плотности воды. Первая — это сокращение расстояний до ближайших соседей, что видно по поведению первой оболочки. Второй — коллапс углов кислород-кислород-кислород между молекулами первой и второй оболочек. Это сохраняет тетраэдрические клетки жесткими, но упаковывает их ближе друг к другу. Эти два механизма реструктуризации уравновешивают друг друга, позволяя молекулярной физике проявляться своеобразным аномалиям воды.
Асимметрия водородных связей между молекулами DAA и DDA сохраняется во всем исследованном диапазоне температур и давлений. Таким образом, он присутствует в пределе переохлаждения, препятствуя замораживанию в основном тетраэдрических мотивов. Он также присутствует при высоких температурах, когда молекулы с тремя водородными связями образуют доминирующие мотивы. Асимметрия уравновешивается появлением частиц с пятью водородными связями, DDAAA, количество которых является показателем силы асимметрии (чем больше молекул DDAAA, тем больше асимметрия между DDAA и DDA). Численность этих мотивов остается довольно постоянной и слабо зависит как от температуры, так и от плотности. Это показывает, что, хотя асимметрия водородных связей присутствует во всем диапазоне стабильности жидкой воды, точка состояния лишь слабо влияет на нее.
Асимметрия уравновешивается появлением частиц с пятью водородными связями, DDAAA, количество которых является показателем силы асимметрии (чем больше молекул DDAAA, тем больше асимметрия между DDAA и DDA). Численность этих мотивов остается довольно постоянной и слабо зависит как от температуры, так и от плотности. Это показывает, что, хотя асимметрия водородных связей присутствует во всем диапазоне стабильности жидкой воды, точка состояния лишь слабо влияет на нее.
При высоких температурах молекулярный дипольный момент, чувствительный репортер локальной среды 26 , занимает промежуточное положение между его низким значением в изолированной газовой фазе ( мк = 1,85 Дебая) и значением, обнаруженным в окружающей жидкости ( мк = 2,6 Дебая). Дипольный момент увеличивается почти на 15% при охлаждении жидкости от высокотемпературных до низкотемпературных пределов. Во всем этом диапазоне предсказанные изотермы превосходно согласуются с наборами экспериментальных данных, включая те, которые простираются вблизи предела растягивающего напряжения жидкости.
Как свидетельствуют парциальные функции радиального распределения, области низкой и высокой плотности переохлажденной жидкости имеют сходство с локальными средами, наблюдаемыми в стекловидных льдах высокой и низкой плотности с помощью нейтронографических измерений при T = 80 K. Таким образом, КДО-вода указывает на близкое соответствие между сжатыми микросостояниями в переохлажденной жидкости и аморфными твердыми телами.
Таким образом, мы использовали QDO-воду, чтобы выявить два новых структурных понимания структуры водородных связей жидкой воды. Первая и вторая координационные оболочки жидкой воды при охлаждении ведут себя противоположно: первая сжимается, а вторая расширяется. В низкотемпературном пределе преобладают хорошо скоординированные мотивы с четырьмя водородными связями и, таким образом, первая оболочка, которая ведет себя как твердое тело при сжатии и тепловом расширении. Эта физика приводит к возникновению аномалий воды – отрицательного теплового расширения, при котором в ее тепловых свойствах доминирует вторая оболочка. На высокотемпературном пределе картина иная: первая оболочка формируется из низших согласованных мотивов, которые легче реструктурируются при сжатии, нагревании или охлаждении. Асимметрия между мотивами водородных связей DDA и DAA сохраняется при любых условиях, при этом виды DDAAA имеют относительно постоянную вероятность в пределах стабильности воды. Наконец, эти результаты наряду с хорошим совпадением с экспериментальными эталонами расширили применимость QDO-воды во всей области стабильности жидкой воды, от ее переохлажденного режима до ее растянутых и высокотемпературных пределов; это также важно, что позволяет нам надежно раскрыть основную физику водородных связей в необычайном диапазоне температур и давлений.
На высокотемпературном пределе картина иная: первая оболочка формируется из низших согласованных мотивов, которые легче реструктурируются при сжатии, нагревании или охлаждении. Асимметрия между мотивами водородных связей DDA и DAA сохраняется при любых условиях, при этом виды DDAAA имеют относительно постоянную вероятность в пределах стабильности воды. Наконец, эти результаты наряду с хорошим совпадением с экспериментальными эталонами расширили применимость QDO-воды во всей области стабильности жидкой воды, от ее переохлажденного режима до ее растянутых и высокотемпературных пределов; это также важно, что позволяет нам надежно раскрыть основную физику водородных связей в необычайном диапазоне температур и давлений.
Ссылки
Дебенедетти, П. Г. Переохлажденная и стекловидная вода. J. Phys.: Condens. Материя 15 (2003).
Хольтен, В., Бертран, К.Э., Анисимов, М.
 А. и Сенгерс, Дж.В. Термодинамика переохлажденной воды. J. Chem. Физ . 136 , https://doi.org/10.1063/1.36
А. и Сенгерс, Дж.В. Термодинамика переохлажденной воды. J. Chem. Физ . 136 , https://doi.org/10.1063/1.36
Галло, П. и др. . Вода: История двух жидкостей. Хим. Версия . 116 , https://doi.org/10.1021/acs.chemrev.5b00750 (2016).
Фуэнтес-Ландете, В. и др. . Кристаллические и аморфные льды. В Труды Международной школы физики им. Энрико Ферми. Вода: основы как основа для понимания окружающей среды и продвижения технологий . 173–208, https://doi.org/10.3254/978-1-61499-507-4-173 (IOS Press, 2015).
Лёртинг Т., Зальцманн К., Коль И., Майер Э. и Халльбрюкер А. Второе отчетливое структурное «состояние» аморфного льда высокой плотности при 77 К и 1 бар. Физ. хим. хим. физ. 3 , 5355–5357, https://doi.org/10.1039/B108676F (2001).
КАС Статья Google ученый
Пул П. Х., Шортино Ф., Эссманн У. и Стэнли Х. Э. Фазовое поведение метастабильной воды. Природа 360 , https://doi.org/10.1038/360324a0 (1992).
Лиммер, Д. Т. и Чандлер, Д. Соответствующие состояния для мезоструктуры и динамики переохлажденной воды. Фарадей Обсудить . 167 , https://doi.org/10.1039/C3FD00076A (2013 г.).
Лиммер, Д. Т. и Чандлер, Д. Предполагаемый переход жидкость-жидкость — это переход жидкость-твердое состояние в атомистических моделях воды. II. J. Chem. Физ . 138 , https://doi.org/10.1063/1.4807479 (2013).
Лиммер Д. Т. и Чандлер Д. Теория аморфных льдов. Проц. Натл. акад. науч. США 111 , https://doi.org/10.1073/pnas.1407277111 (2014).
Лиммер, Д. Т. и Чандлер, Д. Временные шкалы переохлажденной воды и последствия для обратимого полиаморфизма. Мол. Физ . 113 , https://doi.org/10.1080/00268976.2015.1029552 (2015).
Физ . 113 , https://doi.org/10.1080/00268976.2015.1029552 (2015).
Чендлер Д. Метастабильность и отсутствие критичности. Природа 531 , https://doi.org/10.1038/nature16539 (2016).
Палмер, Дж. К. и др. . Метастабильный переход жидкость–жидкость в молекулярной модели воды. Nature 510 , https://doi.org/10.1038/nature13405 (2014).
Эррингтон Дж. Р. и Дебенедетти П. Г. Связь между структурным порядком и аномалиями жидкой воды. Природа 409 , https://doi.org/10.1038/35053024 (2001).
Ширатани, Э. и Сасаи, М. Рост и разрушение структурных паттернов в сети водородных связей в жидкой воде. J. Chem. Физ . 104 , https://doi.org/10.1063/1.471475 (1996).
Катбертсон, М. Дж. и Пул, П. Х. Смесеподобное поведение вблизи фазового перехода жидкость-жидкость в моделировании переохлажденной воды.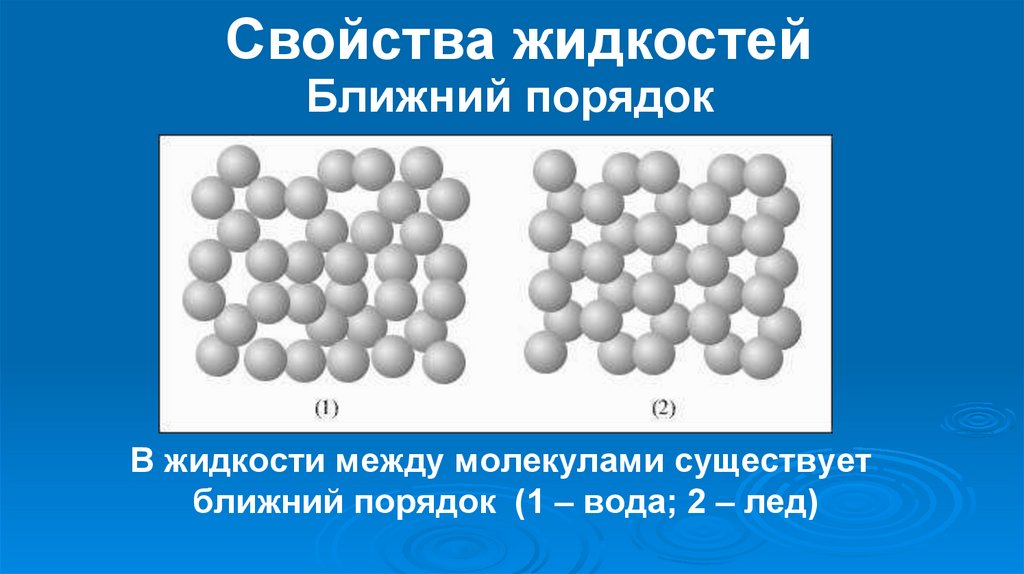 Физ. Преподобный Летт. 106 , 115706, https://doi.org/10.1103/PhysRevLett.106.115706 (2011).
Физ. Преподобный Летт. 106 , 115706, https://doi.org/10.1103/PhysRevLett.106.115706 (2011).
ОБЪЯВЛЕНИЯ Статья пабмед Google ученый
Викфельдт, К. Т., Нильссон, А. и Петтерссон, Л. Г. М. Пространственно неоднородная бимодальная внутренняя структура смоделированной жидкой воды. Физ. хим. хим. физ. 13 , 19918–19924 гг., https://doi.org/10.1039/C1CP22076D (2011 г.).
КАС Статья пабмед Google ученый
Сингх Р.С., Биддл Дж.В., Дебенедетти П.Г. и Анисимов М.А. Термодинамика двух состояний и возможность фазового перехода жидкость-жидкость в переохлажденной воде TIP4P/2005. J. Chem. Физ . 144 , https://doi.org/10.1063/1.4944986 (2016).
Вернет, П. и др. . Строение первой координационной оболочки в жидкой воде. Science 304 , 995–999, https://doi.org/10.1126/science.1096205 (2004).
Science 304 , 995–999, https://doi.org/10.1126/science.1096205 (2004).
ОБЪЯВЛЕНИЯ КАС Статья пабмед Google ученый
Кюне Т. Д., Халиуллин Р. З. Электронная подпись мгновенной асимметрии в первой координационной оболочке жидкой воды. Nature Comm 4 , 1450, https://doi.org/10.1038/ncomms2459 (2013).
Артикул Google ученый
Кюне Т. Д., Халиуллин Р. З. Природа асимметрии в сетях водородных связей гексагонального льда и жидкой воды. Дж. Ам. хим. соц. 136 , 3395–3399, https://doi.org/10.1021/ja411161a (2014).
Артикул пабмед Google ученый
Чипчиган Ф.С., Сохан В.П., Джонс А.П., Крейн Дж. и Мартина Г.Дж. Водородные связи и ориентация молекул на границе жидкость-пар воды.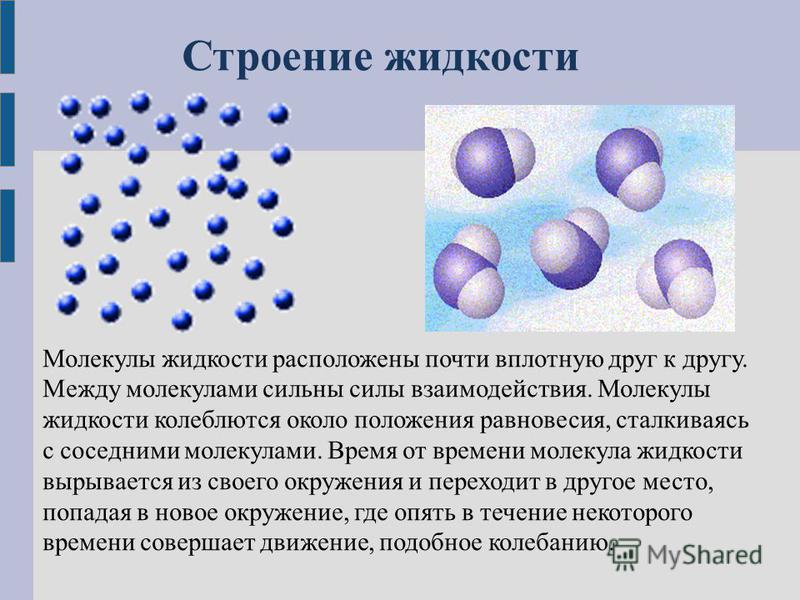 Физ. хим. хим. Физ . 17 , https://doi.org/10.1039/c4cp05506c (2015).
Физ. хим. хим. Физ . 17 , https://doi.org/10.1039/c4cp05506c (2015).
Джонс, А., Чипчиган, Ф., Сохан, В. П., Крейн, Дж. и Мартина, Г. Дж. Крупнозернистая электронная модель воды. Физ. Преподобный Письмо . 110 , https://doi.org/10.1103/physrevlett.110.227801 (2013).
Джонс, А. П. и др. . Электронно крупнозернистая молекулярная динамика с использованием квантовых осцилляторов Друде. Мол. Физ . 111 , https://doi.org/10.1080/00268976.2013.843032 (2013).
Сохан, В.П., Джонс, А.П., Чипчиган, Ф.С., Крейн, Дж. и Мартина, Г.Дж. Характерные свойства воды: их молекулярно-электронное происхождение. Проц. Натл. акад. науч. США 112 , https://doi.org/10.1073/pnas.1418982112 (2015).
Cipcigan, F.S., Sokhan, V.P., Crain, J. & Martina, G.J. Электронное крупнозернистое моделирование повышает прогностическую силу молекулярного моделирования, позволяя решать проблемы в физике воды. Дж. Вычисл. Физ . 326 , https://doi.org/10.1016/j.jcp.2016.08.030 (2016).
Дж. Вычисл. Физ . 326 , https://doi.org/10.1016/j.jcp.2016.08.030 (2016).
Сохан, В.П., Джонс, А., Чипчиган, Ф.С., Крейн, Дж. и Мартина, Г.Дж. Молекулярные остатки перехода жидкость-газ в сверхкритических полярных жидкостях. Физ. Преподобный Письмо . 115 , https://doi.org/10.1103/physrevlett.115.117801 (2015).
Мартина Г.Дж., Кляйн М.Л. и Такерман М. Цепи Нозе-гувера: канонический ансамбль через непрерывную динамику. J. Chem. физ. 97 , 2635–2643, https://doi.org/10.1063/1.463940 (1992).
ОБЪЯВЛЕНИЯ Статья Google ученый
Абаскаль, Дж. Л. Ф. и Вега, К. Модель общего назначения для конденсированных фаз воды: TIP4P/2005. J. Chem. Физ . 123 , https://doi.org/10.1063/1.2121687 (2005 г.).
Phillips, J.C. и др. . Масштабируемая молекулярная динамика с namd. Journal of Computational Chemistry 26 , 1781–1802, https://doi.org/10.1002/jcc.20289 (2005).
Journal of Computational Chemistry 26 , 1781–1802, https://doi.org/10.1002/jcc.20289 (2005).
КАС Статья пабмед ПабМед Центральный Google ученый
Wagner, W. & Pruß, A. Формулировка IAPWS 1995 для термодинамических свойств обычного водного вещества для общего и научного использования. J. Phys. хим. Ссылка Данные 31 (2002 г.).
Мисима, О. Объем переохлажденной воды под давлением и критическая точка жидкость-жидкость. J. Chem. Физ . 133 , https://doi.org/10.1063/1.3487999 (2010).
Палларес, Г. и др. . Аномалии в объемной переохлажденной воде при отрицательном давлении. Проц. Натл. акад. науч. США 111 (2014).
Финни Дж. Л., Халльбрюкер А., Коль И., Сопер А. К. и Боурон Д. Т. Структуры аморфного льда высокой и низкой плотности методом нейтронной дифракции.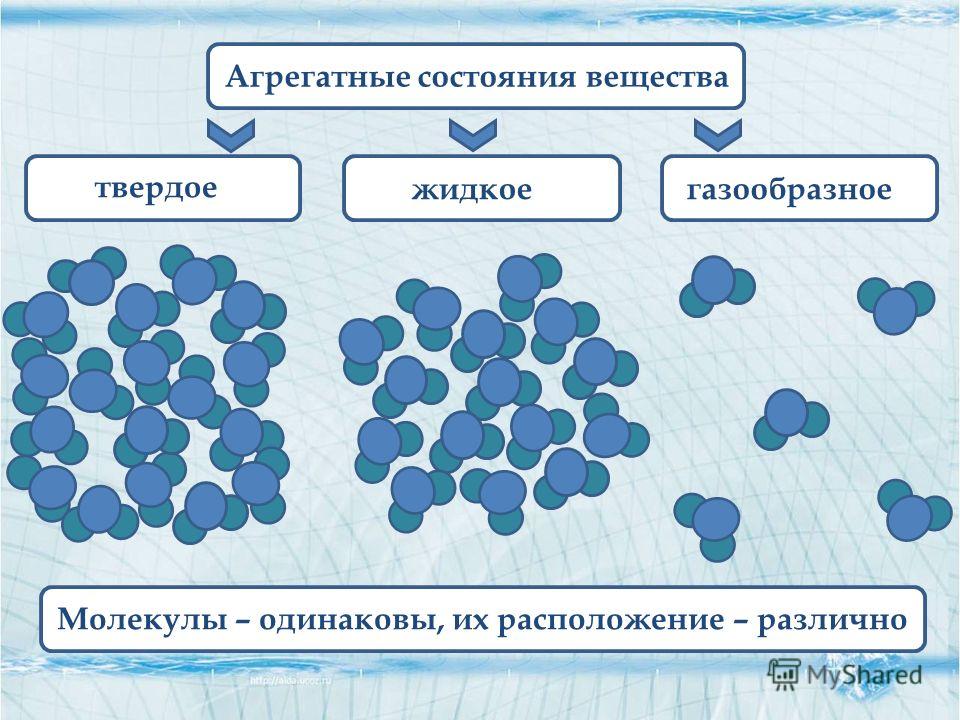 Физ. Преподобный Письмо . 88 , https://doi.org/10.1103/physrevlett.88.225503 (2002).
Физ. Преподобный Письмо . 88 , https://doi.org/10.1103/physrevlett.88.225503 (2002).
Ян З. и др. . Структура первой и второй соседних оболочек моделируемой воды: количественная связь с поступательным и ориентационным порядком. Физ. Ред. E 76 , https://doi.org/10.1103/physreve.76.051201 (2007 г.).
Кумар Р., Шмидт Дж. Р. и Скиннер Дж. Л. Определения и динамика водородных связей в жидкой воде. J. Chem. Физ . 126 , https://doi.org/10.1063/1.2742385 (2007 г.).
Загрузить ссылки
Благодарности
Эта работа была поддержана программой стратегических исследований NPL и программой инновационной отдачи от исследований STFC Hartree Center. FSC выражает признательность Шотландскому учебному центру докторантуры по физике конденсированных сред, Институту последипломного образования NPL и EPSRC за финансирование в рамках студенческой программы Industrial CASE.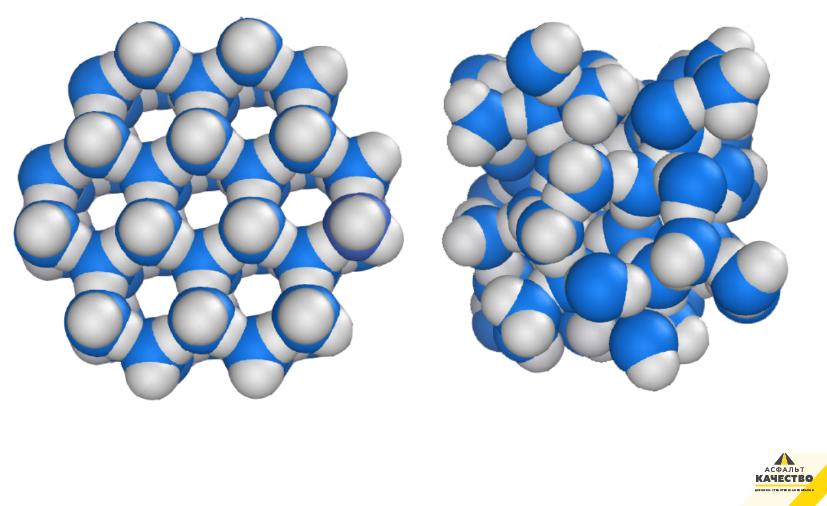 Мы подтверждаем использование вычислительных ресурсов Hartree Centre, EPCC и NPL.
Мы подтверждаем использование вычислительных ресурсов Hartree Centre, EPCC и NPL.
Author information
Authors and Affiliations
IBM Research UK, Hartree Centre, Daresbury, WA4 4AD, United Kingdom
Flaviu Cipcigan & Jason Crain
STFC Daresbury Laboratory, Daresbury, WA4 4AD, United Kingdom
Влад Сохан
IBM T. J. Watson Research Center, Yorktown Heights, New York, 10598, USA
Гленн Мартина
Авторы
- Flaviu Cipcigan
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Влад Сохан
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Glenn Martyna
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Джейсон Крейн
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
FSC, VPS, GJM, JC разработали исследование.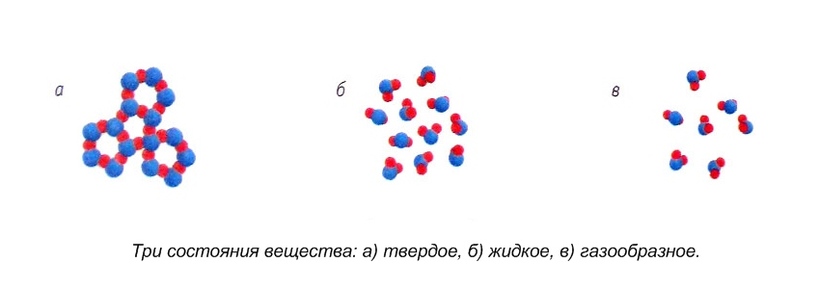 ФСК, В.П.С. провел исследование. FSC, VPS, GJM, JC проанализировали и интерпретировали результаты. Все авторы рассмотрели рукопись.
ФСК, В.П.С. провел исследование. FSC, VPS, GJM, JC проанализировали и интерпретировали результаты. Все авторы рассмотрели рукопись.
Автор, ответственный за переписку
Флавиу Сипиган.
Декларации этики
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Дополнительная информация
Примечание издателя: Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Дополнительная литература
Термическое возмущение свойств ЯМР в малых полярных и неполярных молекулах
- Николас Р. Джагерс
- Юн Ван
- Цзянь Чжи Ху
Научные отчеты (2020)
Поведение эмиссии, индуцированной агрегацией, в системе олеиламин-ацетон и ее применение для улучшения фототока квантовых точек In2S3
- Субраманиам Рамья
- Деварадж Натарадж
- Т.
 Даниэль Тангадурай
Даниэль Тангадурай
Научные отчеты (2020)
Исследование распределения конформеров спирта и образования водородных связей в бинарных смесях (2,2′-дифурилметан + н-пропанол или н-бутанол) с использованием молекулярно-динамического моделирования
- Отсиле Уильям Кгагоди
- Фостер Мбайва
Химия Африка (2019)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества.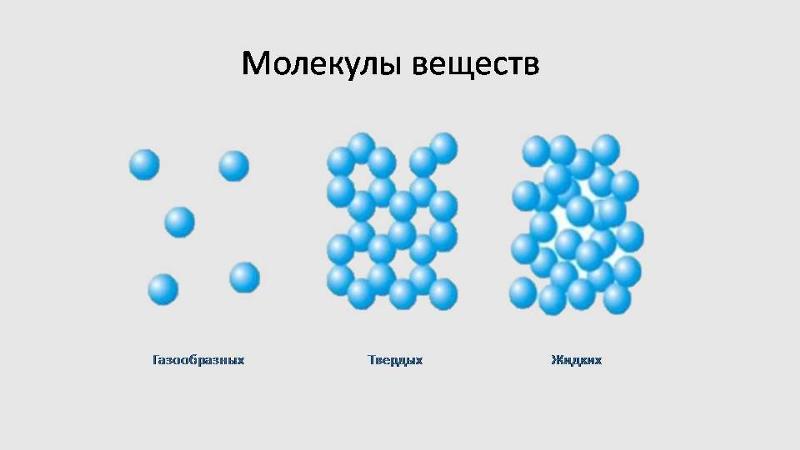 Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
5.1 Свойства воды. Введение в океанографию
Наиболее очевидной особенностью океанов является то, что они содержат воду. Вода настолько вездесуща, что может показаться не очень интересным веществом, но она обладает многими уникальными свойствами, влияющими на глобальные океанографические и климатологические процессы. Многие из этих процессов связаны с образованием между молекулами воды.
Рисунок 5.1.1 Водородные связи (штриховые линии) между молекулами воды. Атомы кислорода показаны красным, атомы водорода — белым (общественное достояние, через Wikimedia Commons).
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Электроны, ответственные за связи между атомами, распределены по всей молекуле неравномерно, так что водородные концы молекул воды имеют небольшой положительный заряд, а кислородный конец имеет небольшой отрицательный заряд, что делает воду . Отрицательная кислородная сторона молекулы образует притяжение к положительному водородному концу соседней молекулы. Эта довольно слабая сила притяжения называется водородной связью (рис. 5.1.1). Если бы не водородные связи, вода испарялась бы при -68 o C, что означает, что жидкая вода (и, следовательно, жизнь) не может существовать на Земле. Эти водородные связи ответственны за некоторые уникальные свойства воды:
Отрицательная кислородная сторона молекулы образует притяжение к положительному водородному концу соседней молекулы. Эта довольно слабая сила притяжения называется водородной связью (рис. 5.1.1). Если бы не водородные связи, вода испарялась бы при -68 o C, что означает, что жидкая вода (и, следовательно, жизнь) не может существовать на Земле. Эти водородные связи ответственны за некоторые уникальные свойства воды:
1. Вода – это единственное вещество, существующее в природе в твердом, жидком и газообразном состояниях при обычных для Земли диапазонах температур и давлений. Это связано с относительно высокими температурами замерзания и испарения воды (см. ниже).
2. Вода имеет высокое , то есть количество тепла, которое необходимо добавить, чтобы повысить ее температуру. это теплота, необходимая для повышения температуры 1 г вещества на 1 o С. Вода имеет самую высокую удельную теплоемкость из всех жидкостей, кроме аммиака (табл. 5.1.1).
5.1.1).
Таблица 5.1.1 Удельная теплоемкость ряда обычных веществ
| Удельная теплоемкость (калории/г/C o ) | |
|---|---|
| Аммиак | 1,13 |
| Вода | 1,00 |
| Ацетон | 0,51 |
| Зерновой спирт | 0,23 |
| Алюминий | 0,22 |
| Медь | 0,09 |
| Серебро | 0,06 |
Таким образом, вода является одной из самых трудных для нагревания или охлаждения жидкостей; он может поглощать большое количество тепла без повышения его температуры. Помните, что температура отражает среднее количество молекул внутри вещества; чем энергичнее движение, тем выше температура. В воде молекулы удерживаются вместе водородными связями, и эти связи необходимо преодолеть, чтобы позволить молекулам свободно двигаться. Когда к воде добавляется тепло, энергия должна сначала пойти на разрыв водородных связей, прежде чем температура начнет повышаться. Следовательно, большая часть добавочного тепла поглощается за счет разрыва Н-связей, а не за счет повышения температуры, что придает воде высокую теплоемкость.
Когда к воде добавляется тепло, энергия должна сначала пойти на разрыв водородных связей, прежде чем температура начнет повышаться. Следовательно, большая часть добавочного тепла поглощается за счет разрыва Н-связей, а не за счет повышения температуры, что придает воде высокую теплоемкость.
Водородные связи также придают воде высокую скрытую теплоту; теплота, необходимая для перехода из твердого состояния в жидкое или из жидкого в газообразное. — это количество тепла, необходимое для перехода из твердого состояния в жидкое; 80 кал/г в случае таяния льда в воду. Лед является твердым телом, потому что водородные связи удерживают молекулы воды в твердой кристаллической решетке (см. ниже). При нагревании льда температура поднимается до 0 o С. В этот момент любое дополнительное тепло идет на таяние льда за счет разрыва водородных связей, а не на повышение температуры. Так что пока есть лед, температура воды не повысится. Вот почему ваш напиток останется холодным, пока в нем есть лед; любое поглощенное тепло идет на таяние льда, а не на подогрев напитка.
Когда весь лед растает, дополнительное тепло повысит температуру воды на 1 o C на каждую добавленную калорию тепла, пока не достигнет 100 o C. В этот момент любое дополнительное тепло идет на преодоление водородные связи и превращение жидкой воды в водяной пар, а не повышение температуры воды. Теплота, необходимая для испарения жидкой воды в водяной пар, равна , что имеет значение 540 кал/г (рис. 5.1.2).
Рисунок 5.1.2 Скрытая теплота, необходимая для фазовых переходов в воде. Скрытая теплота плавления — это теплота, необходимая для таяния льда (80 кал/г), а скрытая теплота парообразования — это теплота, необходимая для превращения жидкой воды в водяной пар (540 кал/г) (PW). Высокий уровень воды помогает регулировать глобальный климат, поскольку океаны медленно поглощают и выделяют тепло, предотвращая резкие колебания температуры (см. раздел 8.1). Это также означает, что водные организмы не так подвержены таким быстрым изменениям температуры, как наземные организмы.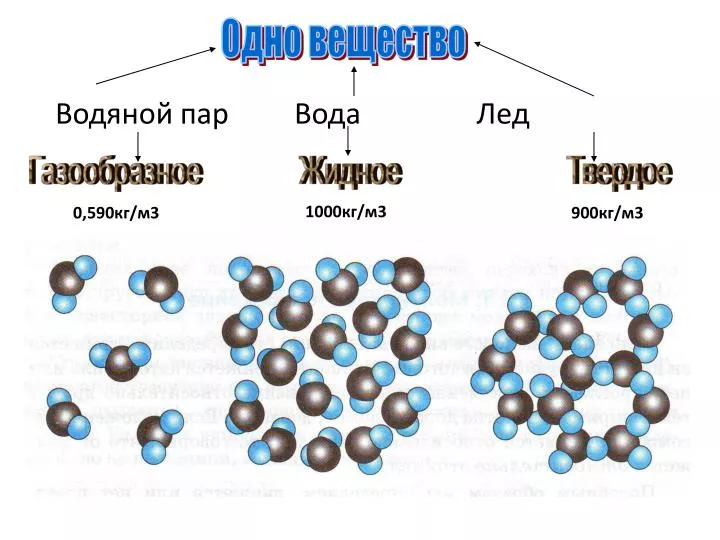 Глубоководный организм может испытывать не более 0,5 o C изменения температуры в течение всей жизни, в то время как у наземных видов за один день могут произойти изменения более чем на 20 o C!
Глубоководный организм может испытывать не более 0,5 o C изменения температуры в течение всей жизни, в то время как у наземных видов за один день могут произойти изменения более чем на 20 o C!
3. Вода растворяет больше веществ, чем любая другая жидкость; это «универсальный растворитель» , поэтому в океане растворено так много веществ. Вода особенно хорошо растворяет ионные соли; молекулы, состоящие из противоположно заряженных частиц, таких как NaCl (Na + и Cl – ). В воде заряженные ионы притягивают молекулы воды. Ионы окружаются слоем молекул воды, ослабляя связь между ионами до 80 раз. При ослаблении связей между ионами вещество растворяется (рис. 5.1.3).
Рисунок 5.1.3 Притяжение между полярными молекулами воды и заряженными ионами (например, в NaCl) больше, чем притяжение между заряженными ионами, вызывая диссоциацию ионов и растворение соли (PW). 4. Твердая фаза менее плотна, чем жидкая фаза .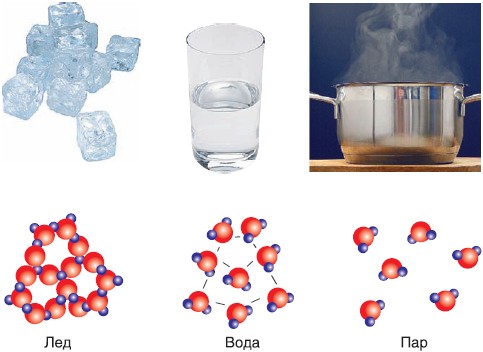 Другими словами, лед плавает. Большинство веществ более плотные в твердом состоянии, чем в жидком, поскольку их молекулы более плотно упакованы в твердом состоянии. Исключение составляет вода: плотность пресной воды составляет 1,0 г/см 9 .0168 3 , а плотность льда 0,92 г/см 3 , и опять же это связано с действием водородных связей.
Другими словами, лед плавает. Большинство веществ более плотные в твердом состоянии, чем в жидком, поскольку их молекулы более плотно упакованы в твердом состоянии. Исключение составляет вода: плотность пресной воды составляет 1,0 г/см 9 .0168 3 , а плотность льда 0,92 г/см 3 , и опять же это связано с действием водородных связей.
По мере того, как вода охлаждается, молекулы замедляются, в конечном итоге замедляясь настолько, что могут образовываться водородные связи и удерживать молекулы воды в кристаллической решетке. Молекулы в решетке расположены дальше друг от друга, чем молекулы в жидкой воде, что делает лед менее плотным, чем жидкая вода (рис. 5.1.4). Это знакомо каждому, кто когда-либо оставлял полную бутылку с водой в морозильной камере только для того, чтобы она лопнула, когда вода замерзнет и расширится.
Рисунок 5.1.4 Структура кристаллической решетки льда, показывающая молекулы воды, удерживаемые вместе водородными связями (автор Adam001d (собственная работа) [CC BY-SA 3.
 0], через Wikimedia Commons).
0], через Wikimedia Commons).Но зависимость между температурой и плотностью воды не является простой линейной. Когда вода охлаждается, ее плотность, как и ожидалось, увеличивается, так как молекулы воды замедляются и сближаются. Однако пресная вода достигает максимальной плотности при температуре 4 90 168 o 90 169 C, и по мере охлаждения выше этой точки ее плотность снижается, так как начинают формироваться водородные связи и увеличивается межмолекулярное расстояние (рис. 5.1.5, вставка). Плотность продолжает снижаться, пока температура не достигнет 0, o C и образуются кристаллы льда, резко снижающие плотность (рис. 5.1.5).
Рисунок 5.1.5 По мере снижения температуры плотность воды увеличивается, пока не достигнет максимальной плотности при 4 o C (врезка). Затем плотность немного снижается до 0 o C, где она резко снижается по мере образования кристаллов льда (Клаус-Дитер Келлер, [CC BY-SA 3.0], через Wikimedia Commons).
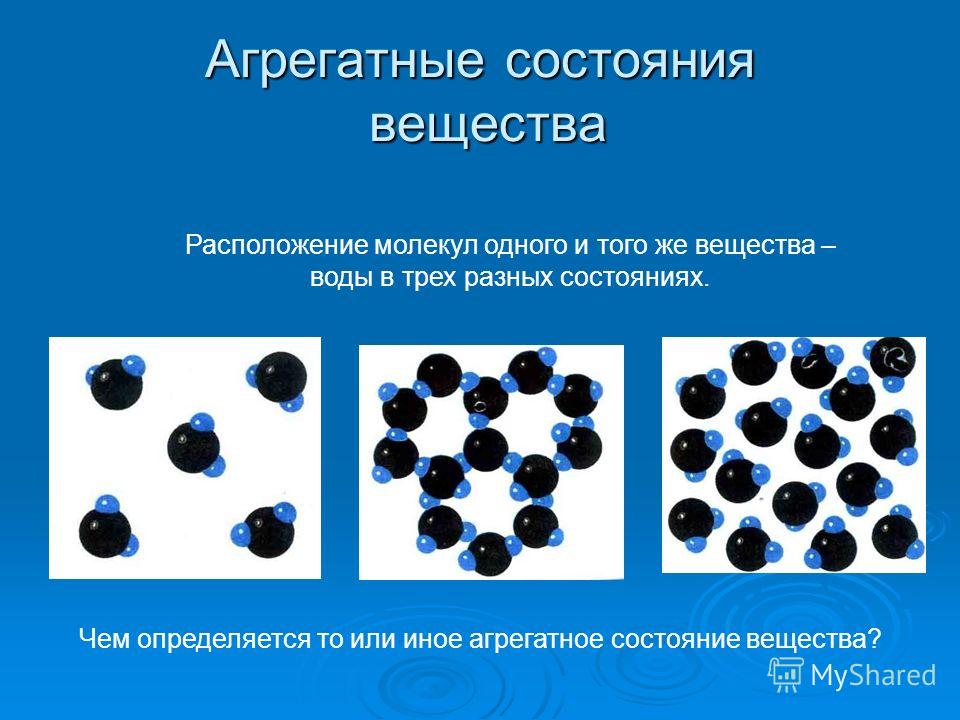
То, что лед менее плотный, чем вода, имеет ряд важных последствий. Лед, плавающий на поверхности океана, помогает регулировать температуру океана и, следовательно, глобальный климат, влияя на количество солнечного света, который отражается, а не поглощается (см. раздел 8.1). В меньших масштабах поверхностный лед может предотвратить замерзание озер и прудов зимой. По мере того как пресная поверхностная вода охлаждается, она становится более плотной и опускается на дно. Затем новая поверхностная вода охлаждается и опускается, и процесс повторяется в так называемом , при этом более плотная вода тонет, а менее плотная вода поднимается на поверхность только для того, чтобы охладиться и опуститься. Таким образом, весь водоем охлаждается несколько равномерно. Этот процесс продолжается до тех пор, пока поверхностная вода не остынет ниже 4 o C. Ниже 4 o C вода по мере охлаждения становится на менее плотной, поэтому она больше не тонет. Вместо этого он остается на поверхности, становясь все холоднее и менее плотным, пока не замерзнет при температуре 0 o C. Как только пресная вода замерзает, лед всплывает и изолирует остальную воду под ним, уменьшая дальнейшее охлаждение. Самая плотная придонная вода по-прежнему находится на уровне 4 o C, поэтому он не замерзает, позволяя дну озера или пруда оставаться незамерзающим (что является хорошей новостью для живущих там животных), независимо от того, насколько холодно на улице.
Как только пресная вода замерзает, лед всплывает и изолирует остальную воду под ним, уменьшая дальнейшее охлаждение. Самая плотная придонная вода по-прежнему находится на уровне 4 o C, поэтому он не замерзает, позволяя дну озера или пруда оставаться незамерзающим (что является хорошей новостью для живущих там животных), независимо от того, насколько холодно на улице.
Растворенные в морской воде соли препятствуют образованию кристаллической решетки и, следовательно, затрудняют образование льда. Таким образом, морская вода имеет точку замерзания около -2 o C (в зависимости от солености) и замерзает до достижения температуры максимальной плотности. Таким образом, морская вода будет продолжать тонуть по мере того, как становится холоднее, пока, наконец, не замерзнет.
5. Вода имеет очень высокое , самое высокое из всех жидкостей, кроме ртути (Таблица 5.1.2). Молекулы воды притягиваются друг к другу водородными связями. Молекулы, не находящиеся на поверхности воды, окружены другими молекулами воды во всех направлениях, поэтому силы притяжения равномерно распределяются во всех направлениях. Но для молекул на поверхности над ними мало соседних молекул, только внизу, поэтому все силы притяжения направлены внутрь, от поверхности (рис. 5.1.6). Эта внутренняя сила заставляет капли воды принимать сферическую форму, а вода собирается на поверхности, поскольку сферическая форма обеспечивает минимально возможную площадь поверхности. Эти силы притяжения также заставляют поверхность воды действовать как эластичная «кожа», которая позволяет таким вещам, как насекомые, сидеть на поверхности воды и не тонуть.
Но для молекул на поверхности над ними мало соседних молекул, только внизу, поэтому все силы притяжения направлены внутрь, от поверхности (рис. 5.1.6). Эта внутренняя сила заставляет капли воды принимать сферическую форму, а вода собирается на поверхности, поскольку сферическая форма обеспечивает минимально возможную площадь поверхности. Эти силы притяжения также заставляют поверхность воды действовать как эластичная «кожа», которая позволяет таким вещам, как насекомые, сидеть на поверхности воды и не тонуть.
Таблица 5.1.2 Поверхностное натяжение различных жидкостей
| Жидкость | Поверхностное натяжение (миллиньютон/метр) | Температура o С |
|---|---|---|
| Меркурий | 487,00 | 15 |
| Вода | 71,97 | 25 |
| Глицерин | 63,00 | 20 |
| Ацетон | 23,70 | 20 |
| Этанол | 22,27 | 20 |
Молекулы воды слипаются более свободно, чем считалось ранее
2 апреля 2004 г.
Давиде Кастельрекки
Физик древности называл его одним из основных элементов природы; третьеклассники знают его химическую формулу; и все известные формы жизни нуждаются в нем для существования. Тем не менее, что такое вода на самом деле — по крайней мере, в жидкой форме — до сих пор в значительной степени остается загадкой. Группа ученых из Стэнфордской лаборатории синхротронного излучения (SSRL) и Стокгольмского университета совершила прорыв в понимании структуры жидкой воды. Они обнаружили, что молекулы воды слипаются гораздо слабее, чем считалось ранее.
Результаты были опубликованы 1 апреля на веб-сайте предварительных публикаций журнала Science. «Результаты переворачивают 20-летние исследования в области физической химии воды», — говорит руководитель группы Андерс Нильссон, физик-химик из Стэнфордского центра линейных ускорителей (SLAC). «Это будет большой шок для всей области».
SSRL является подразделением SLAC, учреждения Министерства энергетики США (DOE), управляемого Стэнфордским университетом.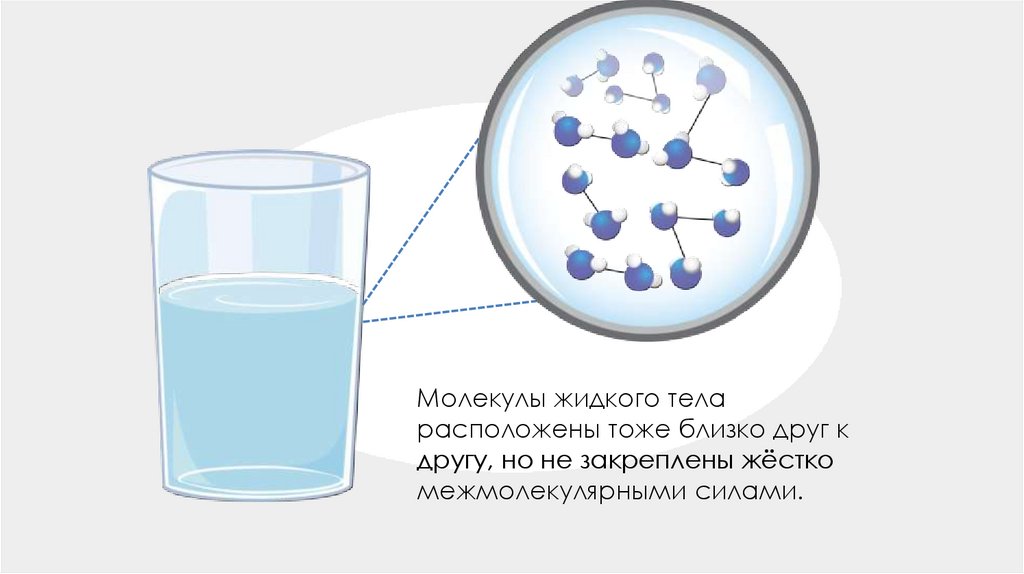 Проект был результатом сотрудничества исследователей из SSRL, Стокгольмского университета, Университета Линчепинга (Швеция) и Утрехтского университета (Голландия).
Проект был результатом сотрудничества исследователей из SSRL, Стокгольмского университета, Университета Линчепинга (Швеция) и Утрехтского университета (Голландия).
Как следует из формулы h3O, каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Во льду молекулы воды организованы в виде кристаллической структуры, где каждая молекула обычно связана с четырьмя другими через то, что химики называют водородными связями. В водородной связи электростатические силы склеивают атом водорода одной молекулы с атомом кислорода другой молекулы. Кислород может образовывать две водородные связи, поэтому молекула может соединиться с четырьмя другими — двумя связями через кислород и по одной через каждый из атомов водорода.
Хотя они в 10 раз слабее, чем ковалентные связи внутри самой молекулы, для разрыва водородных связей между молекулами по-прежнему требуется много энергии — вот почему лед тает так медленно. Даже в жидкой воде молекулы большую часть времени слипаются за счет водородных связей, хотя и не так статично, как во льду.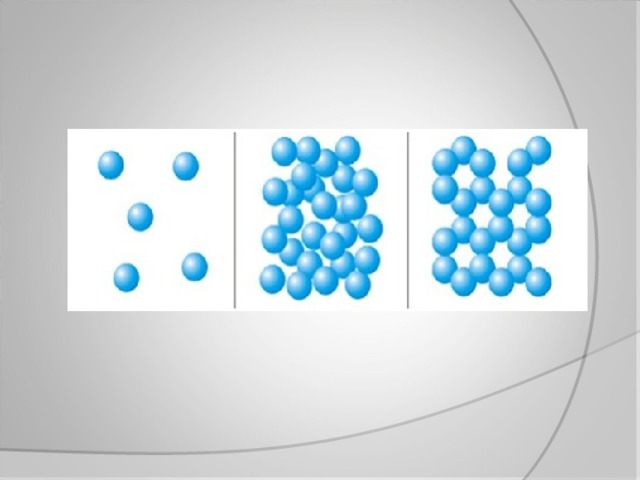 «Водородные связи в жидкой воде образуются и разрываются очень быстро, порядка каждой пикосекунды (одной триллионной доли секунды)», — говорит физик SLAC Уве Бергманн, соавтор исследовательской работы. Эфемерные узоры, образующиеся в результате связывания в жидкости, все еще далеки от понимания, но считается, что они ответственны за особые свойства воды, включая ее относительно высокую температуру кипения, высокую вязкость и, что не менее важно, ее способность поддерживать химические реакции внутри живой клетки.
«Водородные связи в жидкой воде образуются и разрываются очень быстро, порядка каждой пикосекунды (одной триллионной доли секунды)», — говорит физик SLAC Уве Бергманн, соавтор исследовательской работы. Эфемерные узоры, образующиеся в результате связывания в жидкости, все еще далеки от понимания, но считается, что они ответственны за особые свойства воды, включая ее относительно высокую температуру кипения, высокую вязкость и, что не менее важно, ее способность поддерживать химические реакции внутри живой клетки.
В течение последних 20 лет исследователи сходились во мнении, что в любой момент времени молекула воды обычно образует три или четыре водородных связи — в среднем 3,5. «Мы обнаружили, — говорит Бергманн, — что существует не 3,5 водородных связи, а только 2». Исследования показывают, что каждая молекула все еще может образовывать до четырех связей, но две из них будут другого, гораздо более слабого типа.
Авторы отмечают, что более ранняя оценка 3,5 была основана на теоретических предположениях, которые стали общепринятыми, потому что при компьютерном моделировании они давали результаты, согласующиеся с известными свойствами воды, такими как необычно большое количество энергии, необходимое для разогреть это. «Никто не мог возразить против преобладающей модели, поэтому она стала правдой», — говорит Нильссон.
«Никто не мог возразить против преобладающей модели, поэтому она стала правдой», — говорит Нильссон.
Но трудность «увидеть» реальные молекулы в действии означала недостаток реальных данных. «За последние 20 лет не было новой экспериментальной информации о воде, за исключением данных нейтронных исследований», — говорит Нильссон. «Удивительно то, что почти ничего не известно об уникальных свойствах жидкой воды».
Новый результат снова открывает поиски структуры жидкой воды. «Он воскрешает модели, которые считались неподходящими», — говорит Бергманн. Одна из возможностей, по его словам, состоит в том, что молекулы воды могут образовывать цепочки или даже замкнутые кольца. В конце концов, результатом может стать лучшее понимание химии клетки, которую, как известно, трудно имитировать с помощью различных жидкостей. «Ни у кого нет четкого ответа на вопрос, почему вода необходима для жизни», — говорит Нильссон.
Это исследование было первым, в котором метод, называемый рентгеновской абсорбционной спектроскопией, был применен к локальной структуре воды. Метод, разработанный SSRL, среди других лабораторий, бомбардирует материал рентгеновскими лучами, которые точно настроены для возбуждения определенных электронов в структуре молекулы. Тщательное измерение рассеянного излучения выявляет движения возбужденных электронов, которые, в свою очередь, показывают, какие связи формируют молекулы. В экспериментах использовались источники интенсивного рентгеновского излучения в Аргоннской национальной лаборатории и Национальной лаборатории Лоуренса в Беркли, обе из которых являются учреждениями Министерства энергетики США.
Метод, разработанный SSRL, среди других лабораторий, бомбардирует материал рентгеновскими лучами, которые точно настроены для возбуждения определенных электронов в структуре молекулы. Тщательное измерение рассеянного излучения выявляет движения возбужденных электронов, которые, в свою очередь, показывают, какие связи формируют молекулы. В экспериментах использовались источники интенсивного рентгеновского излучения в Аргоннской национальной лаборатории и Национальной лаборатории Лоуренса в Беркли, обе из которых являются учреждениями Министерства энергетики США.
Сейчас команда работает над несколькими проектами, чтобы расширить их результаты. «Мы хотим исследовать воду в целом диапазоне давлений и температур», — говорит Бергманн. SPEAR3, недавно модернизированный современный источник рентгеновского излучения компании SSRL, который официально открылся 29 января, был бы идеальным местом для этого. «Мы предлагаем построить новый объект в SPEAR3, где структура воды будет значительной частью научного исследования», — говорит он.
«Вода покрывает большую часть земной поверхности, присутствует во всех формах жизни и, возможно, является самым важным природным ресурсом для человечества. Несмотря на то, что она знакома и много лет тщательно изучается, вода все еще может преподносить замечательные сюрпризы», — говорит Патриция Демер, директор Управления фундаментальных энергетических наук Министерства энергетики США. «Это сотрудничество… дало новое понимание молекулярных связей в жидкой воде».
Помимо Нильссона и Бергманна, другими учеными SLAC, участвовавшими в пятилетнем сотрудничестве, являются Филипп Вернет (первый автор статьи, в настоящее время работает в лаборатории BESSY в Берлине), Хирохито Огасавара и Ларс Наслунд.
Национальный научный фонд США, Министерство энергетики, Национальные институты здравоохранения и Шведский фонд стратегических исследований, а также Шведский совет по исследованиям в области естественных наук поддержали исследование.
Давиде Кастельвекки (Davide Castelvecchi) — стажер-писатель в Стэнфордском центре линейных ускорителей.
Примечание редактора:
Этот релиз был написан Давиде Кастельвекки, стажером-писателем Стэнфордского центра линейных ускорителей. Изображение структуры жидкой воды в высоком разрешении доступно для загрузки по адресу: http://www-ssrl.slac.stanford.edu/structureofwater.html
.-30-
Молекулам воды нужна помощь, чтобы испариться
• Физика 8, 118
Согласно моделированию, каждый раз, когда молекула жидкой воды переходит в паровую фазу, происходит скоординированный танец нескольких молекул.
iStockphoto.com/yongklet
Как выбраться из горячей воды. Моделирование показывает, что для испарения молекулы воды требуется скоординированное столкновение с парой молекул, которые остаются в жидкой фазе.iStockphoto.com/yongklet
Как выбраться из горячей воды. Моделирование показывает, что для испарения молекулы воды требуется скоординированное столкновение с парой молекул, которые остаются в жидкой фазе.
×
Для испарения молекулы воды — перехода из жидкости в газ — требуется редкая последовательность событий с участием двух других молекул, согласно новому компьютерному моделированию. Исследователи наблюдали за 500 виртуальными жидкими молекулами воды и обнаружили, что одна из них может покинуть жидкую фазу только в том случае, если в определенный момент на нее воздействует связанная пара молекул внутри жидкости. Лучшее понимание испарения может помочь исследователям в моделировании атмосферных процессов, являющихся частью изменения климата.
Тепло, заставляя молекулы двигаться более интенсивно внутри жидкости, может разорвать водородные связи, которые обычно удерживают молекулы воды вместе, высвобождая отдельные молекулы в воздух. Предыдущая работа установила, что выброс молекул требует коллективного процесса — скоординированного взаимодействия трех или более молекул, а не простых столкновений между двумя.
Пока мало что известно об этих коллективных механизмах. В принципе, решающие взаимодействия могут происходить разными способами. Но Юки Нагата и его коллеги из Института исследований полимеров имени Макса Планка в Майнце, Германия, теперь показали, что такие события всегда включают в себя общий элемент — конкретное, своевременное взаимодействие трех тел, которое кажется решающим для доставки достаточного количества энергии в одно целое. молекулу, чтобы позволить ей убежать.
В принципе, решающие взаимодействия могут происходить разными способами. Но Юки Нагата и его коллеги из Института исследований полимеров имени Макса Планка в Майнце, Германия, теперь показали, что такие события всегда включают в себя общий элемент — конкретное, своевременное взаимодействие трех тел, которое кажется решающим для доставки достаточного количества энергии в одно целое. молекулу, чтобы позволить ей убежать.
Команда провела компьютерное моделирование 500 молекул воды, находящихся в крошечном объеме. Они создают жидкую область — зону относительно высокой плотности, где молекулы расположены близко друг к другу и многие из них прочно связаны водородными связями. К жидкости примыкала зона, свободная от молекул. Когда они выбрали температуру, достаточно высокую, чтобы вызвать испарение, исследователи, как и ожидалось, увидели случайные явления испарения. Случайный толчок отправил бы молекулу из жидкой зоны в пустую зону. В своих симуляциях команда зафиксировала 325 таких событий.
Чтобы узнать, как эти молекулы получили достаточно энергии, чтобы преодолеть сильные водородные связи, связывающие их с другими молекулами в жидкости — каждая молекула обычно участвует в трех или четырех таких связях, — Нагата и его коллеги изучили траектории молекул. Они обнаружили, что выброшенная молекула всегда получает свою энергию за счет точного взаимодействия с двумя другими молекулами. Он всегда имел сильное столкновение с быстро движущейся молекулой непосредственно перед тем, как покинуть жидкость. Дальнейшее исследование показало, что эта быстро движущаяся молекула была связана водородной связью с третьей молекулой таким образом, что это имело решающее значение для процесса испарения.
Две молекулы, связанные водородными связями, постоянно колеблются, быстро сближаясь и удаляясь друг от друга с характерной частотой. Исследователи обнаружили, что молекула, которая должна была быть выброшена, всегда сталкивалась со связанной парой примерно через 40 фемтосекунд после того, как пара достигла их максимального сближения. Момент столкновения был также моментом, когда связанные молекулы разлетались с максимальной скоростью и могли передать наибольшую энергию. Пара в целом не должна двигаться быстро; вместо этого кинетическая энергия колебаний может доставить большую часть энергии, необходимой для выброса исходной молекулы из жидкости.
Момент столкновения был также моментом, когда связанные молекулы разлетались с максимальной скоростью и могли передать наибольшую энергию. Пара в целом не должна двигаться быстро; вместо этого кинетическая энергия колебаний может доставить большую часть энергии, необходимой для выброса исходной молекулы из жидкости.
Последствия, как утверждают Нагата и его коллеги, двояки. Во-первых, кажется, что испаряющиеся молекулы всегда выбрасываются из жидкости по общему механизму. Во-вторых, для успешного побега любой молекулы требуется взаимодействие трех молекул, а не только двух. Даже если один член связанной пары молекул никогда не сталкивается с выброшенным, связь, которую он образует с ударяющейся молекулой, имеет все значение. «Испарение всегда связано с скоординированным, своевременным движением нескольких молекул воды», — говорит Нагата.
Эти результаты, по мнению других исследователей, представляют процесс испарения в новом свете. По словам химика-теоретика Адама Уилларда из Массачусетского технологического института, предыдущие исследования моделирования в основном изучали объемную термодинамику испарения воды, рассматривая воду как континуум и пренебрегая эффектами, связанными с отдельными молекулами. «Эта статья действительно погружается в молекулярные детали, — говорит Уиллард, — и сумела получить довольно неожиданный результат». Более того, команде не нужны были превосходные вычислительные инструменты. «Здесь нет особой техники, — говорит он, — просто хорошая физическая интуиция и хорошо выполненный статистический анализ».
«Эта статья действительно погружается в молекулярные детали, — говорит Уиллард, — и сумела получить довольно неожиданный результат». Более того, команде не нужны были превосходные вычислительные инструменты. «Здесь нет особой техники, — говорит он, — просто хорошая физическая интуиция и хорошо выполненный статистический анализ».
Это улучшенное понимание испарения воды может найти применение в технологиях уменьшения нежелательного испарения, предполагают исследователи, например, в хранилищах очищенной воды. Это также может быть полезно для геофизиков, изучающих влияние атмосферных аэрозолей на образование облаков в результате испарения — процесса, важного для изменения климата.
Это исследование опубликовано в Physical Review Letters.
–Марк Бьюкенен
Марк Бьюкенен – независимый научный писатель, работающий в Абергавенни, Великобритания, и Нотр-Дам-де-Курсон, Франция.
Обменные зоны
Физическая химиихимическая физика физика физики
Связанные статьи
Физика с конденсированным веществом
Сплошное наблюдение у сильного Kerr Nonlinearity


 CNews
CNews
 ru/svojstva-vody/voda
ru/svojstva-vody/voda
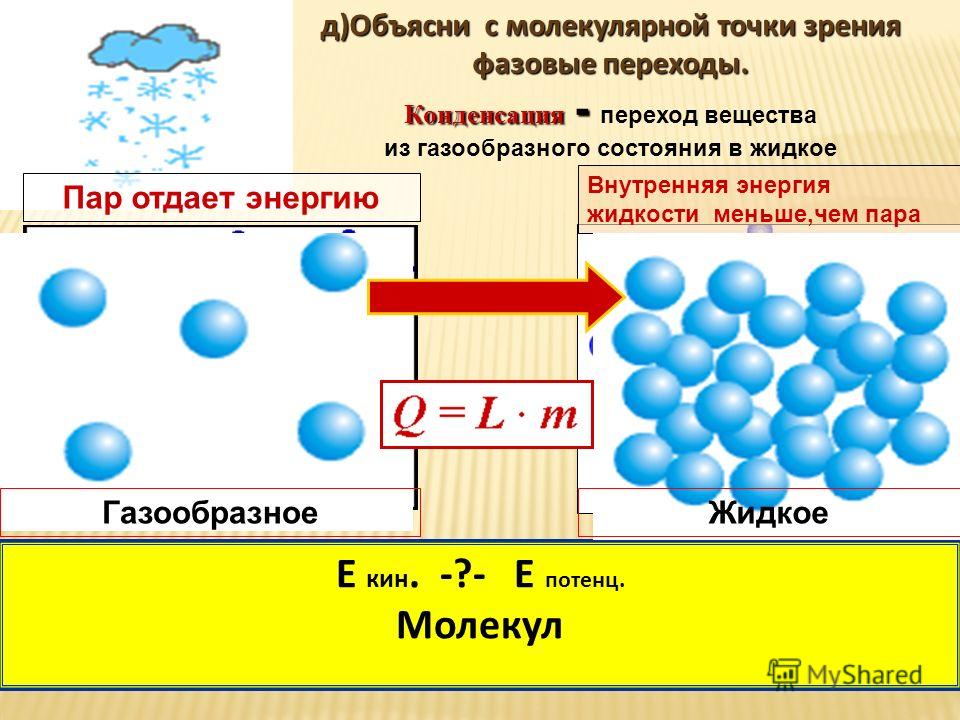
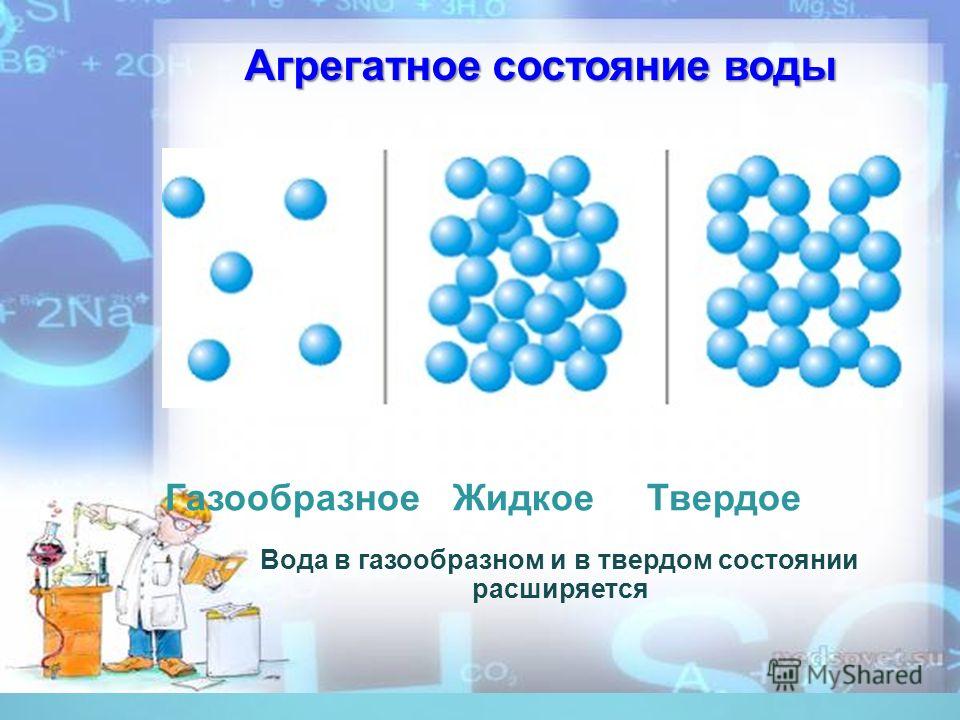
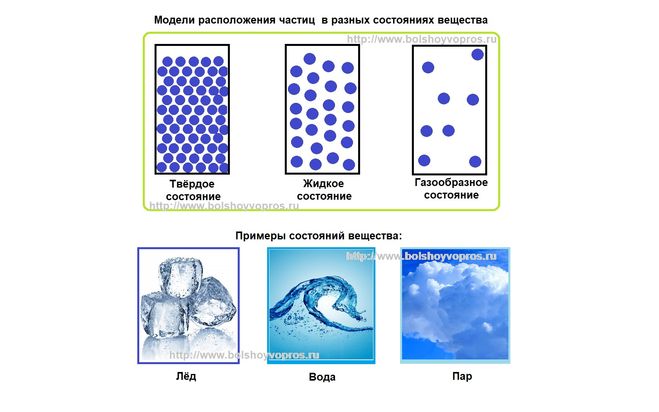 {i}_{ R}\ge 1\right)\end{массив}\right.$$ 9{{\prime}}}_{m}{m}_{t+1}$$
{i}_{ R}\ge 1\right)\end{массив}\right.$$ 9{{\prime}}}_{m}{m}_{t+1}$$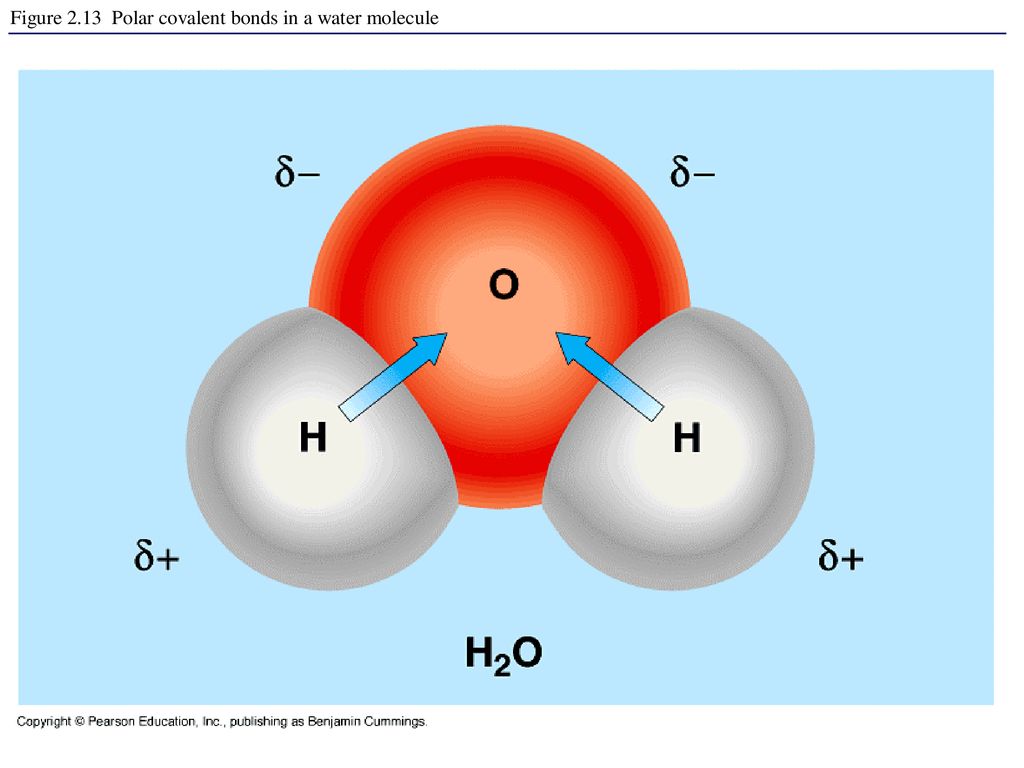 Физ. Преподобный Летт. 78 , 2409–2412 (1997).
Физ. Преподобный Летт. 78 , 2409–2412 (1997). и Рахман А. Аспекты процесса перколяции сетей водородных связей в воде. J. Chem. физ. 70 , 4185–4193 (1979).
и Рахман А. Аспекты процесса перколяции сетей водородных связей в воде. J. Chem. физ. 70 , 4185–4193 (1979).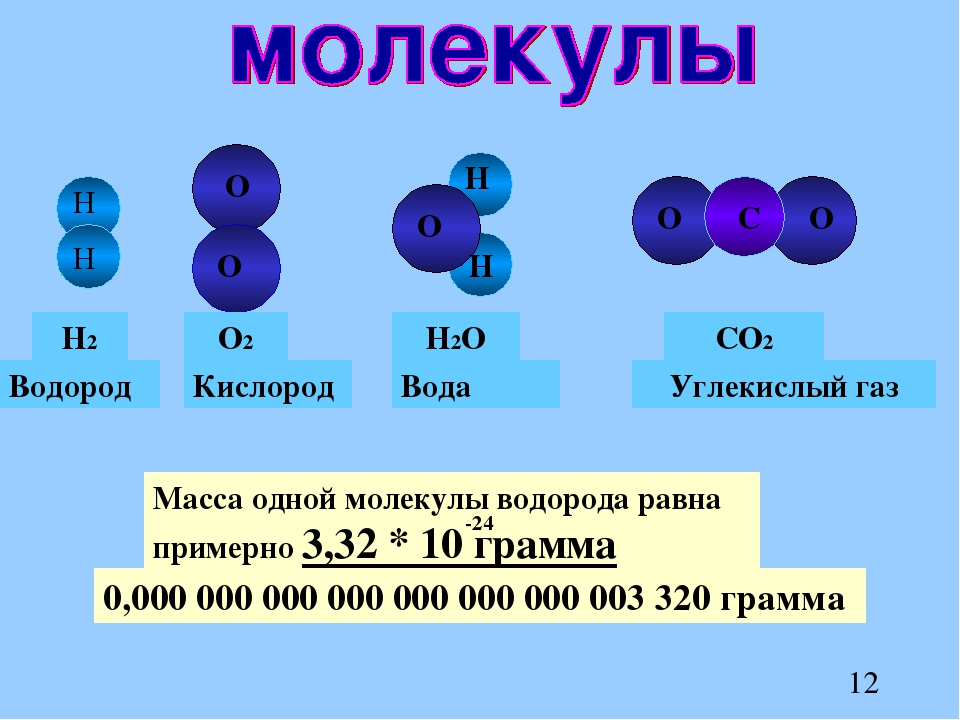
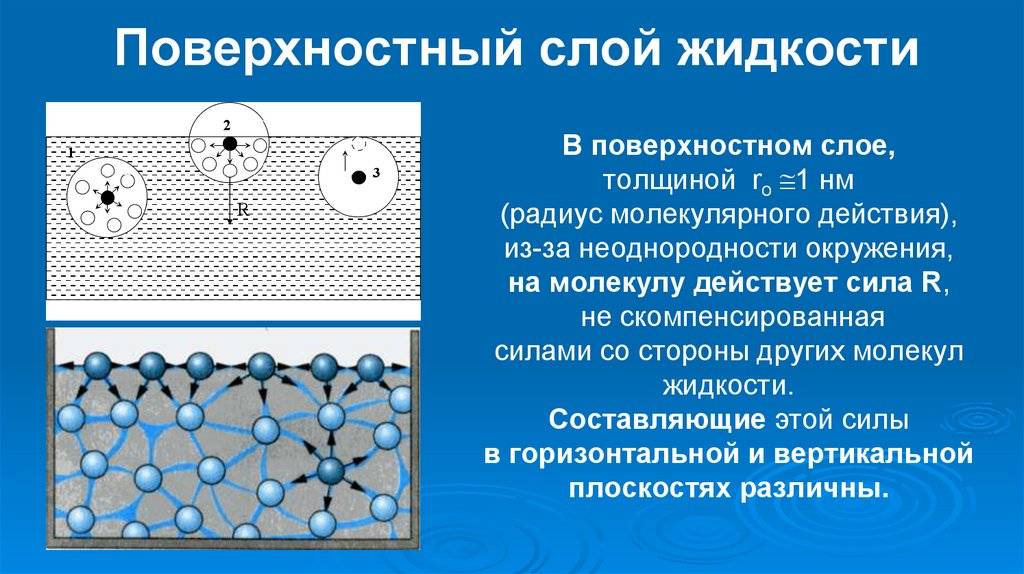 ).
). Пищевая хим. 106 , 1476–1484 (2008).
Пищевая хим. 106 , 1476–1484 (2008).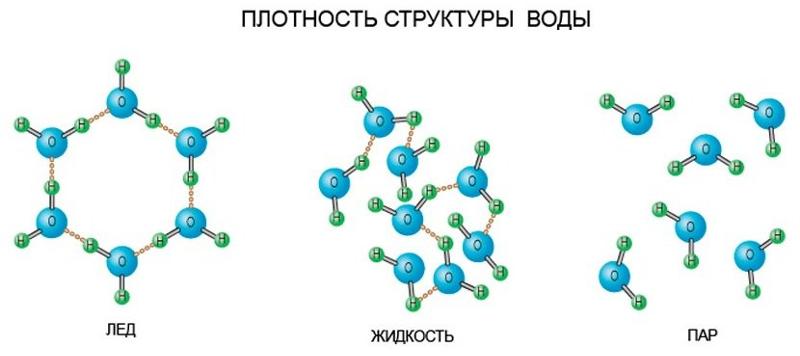
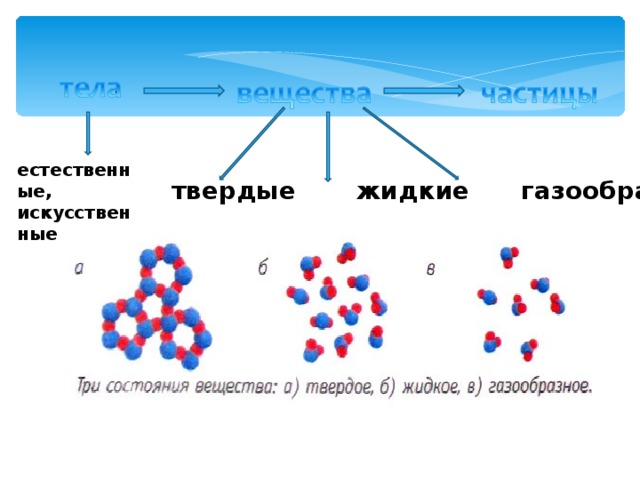 Физ. хим. хим. физ. 7 , 1905–1911 (2005).
Физ. хим. хим. физ. 7 , 1905–1911 (2005).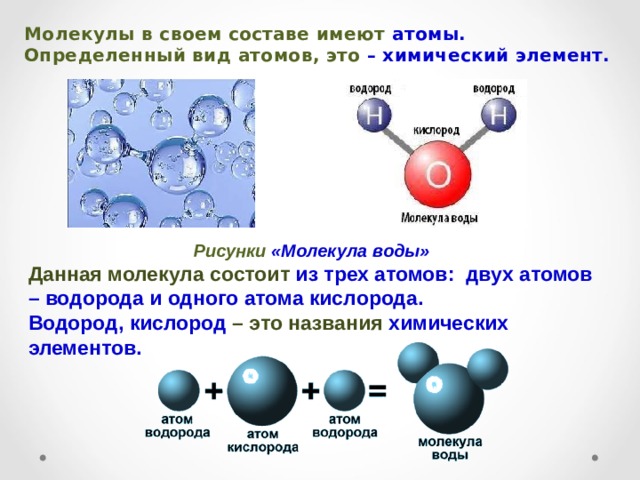 Стат. физ. 36 , 843–860 (1984).
Стат. физ. 36 , 843–860 (1984).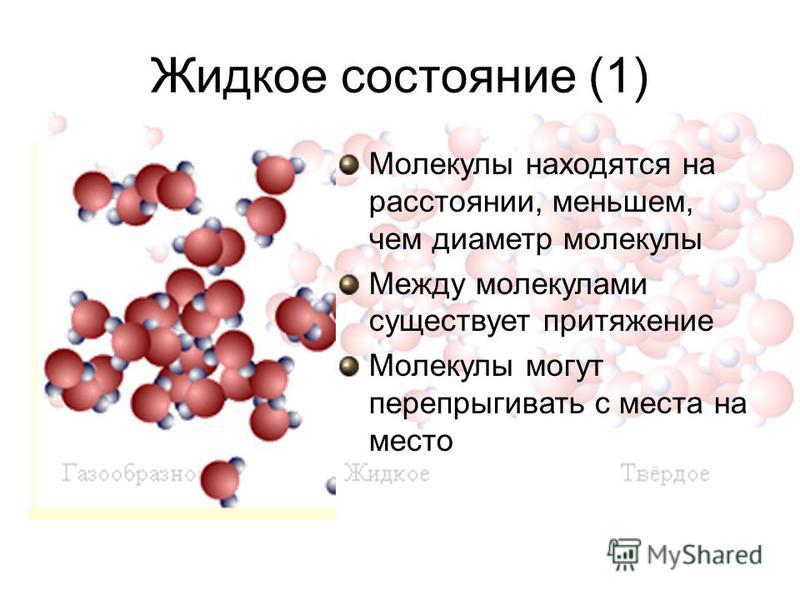

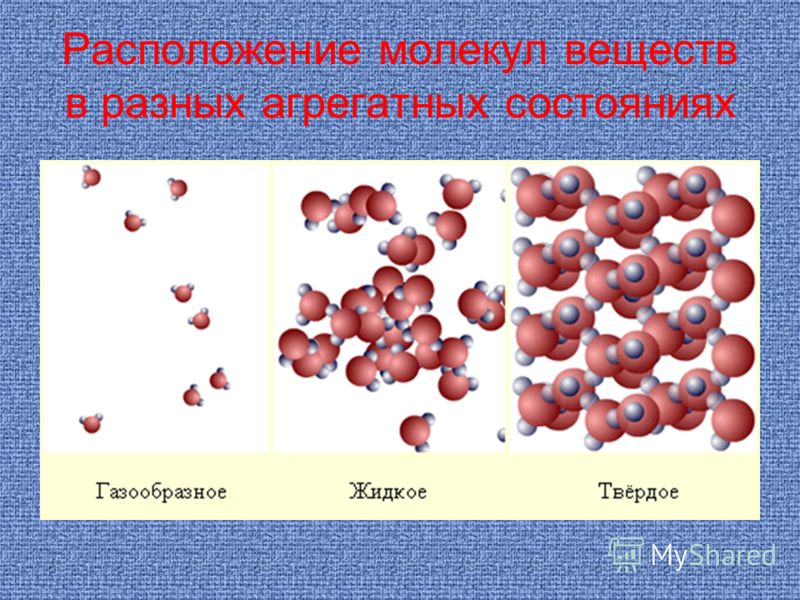 А. и Сенгерс, Дж.В. Термодинамика переохлажденной воды. J. Chem. Физ . 136 , https://doi.org/10.1063/1.36
А. и Сенгерс, Дж.В. Термодинамика переохлажденной воды. J. Chem. Физ . 136 , https://doi.org/10.1063/1.36 Даниэль Тангадурай
Даниэль Тангадурай