Почему вода необходима для жизни? EcoWater Systems
Вода составляет 60-75% веса человеческого тела. Потеря всего 4% воды в организме приводит к обезвоживанию, а потеря 15% может быть смертельной. Поэтому, хотя человек может прожить месяц без еды, но без воды он обычно не может прожить больше 3 дней. Эта критическая зависимость от воды является ключевым регулятором всех форм жизни. Ясно, что вода необходима для выживания, но почему она так важна?
Вода с молекулярной точки зрения
Многие функции воды в поддержании жизни обусловлены ее молекулярной структурой и несколькими особыми свойствами. Вода — это простая молекула, состоящая из двух небольших положительно заряженных атомов водорода и одного большого отрицательно заряженного атома кислорода. Когда атомы водорода связываются с кислородом, образуется асимметричная молекула с положительным зарядом на одной стороне и отрицательным — на другой (рис. 1). Эта разница в зарядах называется полярностью, и она определяет способ взаимодействия воды с другими молекулами.
Рисунок 1: Химический состав воды. Молекулы воды состоят из двух атомов водорода и одного кислорода. Эти атомы различаются по размеру и заряду, что приводит к асимметрии в молекулярной структуре и к прочным связям между водой и другими полярными молекулами, включая саму воду.
Вода — универсальный растворитель?
Как полярная молекула вода лучше всего взаимодействует с другими полярными молекулами, такими как она сама. Это происходит из-за явления, при котором противоположные заряды притягиваются друг к другу: поскольку каждая отдельная молекула воды имеет как отрицательную, так и положительную части, каждая сторона притягивается к молекулам с противоположным зарядом. Притяжение позволяет воде образовывать относительно прочные связи с другими полярными молекулами вокруг нее, включая другие молекулы воды. Затем положительный атом водорода одной из молекул воды объединится с отрицательным атомом кислорода соседней молекулы, собственные атомы водорода которой притягиваются к следующему атому кислороду, и так далее (рис. 1). Важно отметить, что эта связь приводит к тому, что молекулы воды объединяться. Такое свойство воды известно как когезия. Когезия воды помогает растениям «вытягивать» воду из корней. Когезия также способствует высокой температуре кипения воды, что помогает животным регулировать температуру тела.
1). Важно отметить, что эта связь приводит к тому, что молекулы воды объединяться. Такое свойство воды известно как когезия. Когезия воды помогает растениям «вытягивать» воду из корней. Когезия также способствует высокой температуре кипения воды, что помогает животным регулировать температуру тела.
Кроме того, поскольку большинство биологических молекул имеют некоторую асимметрию напряжения, они также полярны, и молекулы воды могут образовывать связи и окружать как их положительные, так и отрицательные части. Окружая полярные молекулы другого вещества, вода попадает в каждый уголок и щель между молекулами, эффективно разрушая и растворяя их. Вот что происходит, когда мы добавляем кристаллы сахара в воду: и вода, и сахар полярны, так что отдельные молекулы воды окружают каждую молекулу сахара, расщепляя сахар и растворяя его. Как и в случае с поляризацией, некоторые молекулы состоят из ионов или противоположно заряженных частиц. Вода также разрушает эти ионные частицы, взаимодействуя как с положительно, так и с отрицательно заряженными частями. Вот что происходит, когда мы добавляем соль в воду, потому что соль состоит из ионов натрия и хлора.
Вот что происходит, когда мы добавляем соль в воду, потому что соль состоит из ионов натрия и хлора.
Благодаря сильной способности воды растворять различные молекулы, она стала известна как «универсальный растворитель», и именно эта способность делает воду такой бесценной силой поддержания жизни. На биологическом уровне вода как растворитель помогает клеткам переносить и использовать кислород и питательные вещества. Растворы на водной основе, такие как кровь, помогают перемещать вещества в нужные места. Таким образом, роль воды как растворителя облегчает транспортировку веществ, таких как кислород, для дыхания, и имеет большое влияние на способность лекарств достигать своих целей в организме
Вода поддерживает клеточную структуру
Вода также играет важную структурную роль в биологии. Вода заполняет клетки, помогая сохранять их форму и структуру (рис. 2). Вода во многих клетках (включая те, что составляют человеческое тело) создает давление, противодействующее внешним силам, как воздух в воздушном шаре.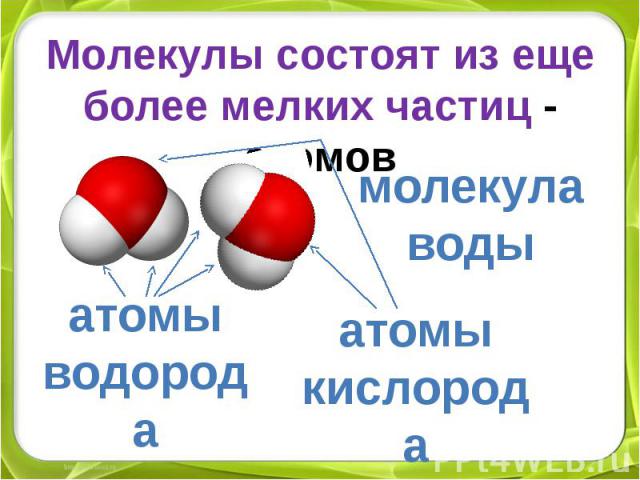 Даже некоторым растениям, способным поддерживать свою клеточную структуру какое-то время без воды, для выживания все равно потом нужна вода. Вода способствует тому, что все внутри клеток сохраняет свою правильную форму на молекулярном уровне. Поскольку форма имеет решающее значение для биохимических процессов, это тоже является одной из самых важных ролей воды.
Даже некоторым растениям, способным поддерживать свою клеточную структуру какое-то время без воды, для выживания все равно потом нужна вода. Вода способствует тому, что все внутри клеток сохраняет свою правильную форму на молекулярном уровне. Поскольку форма имеет решающее значение для биохимических процессов, это тоже является одной из самых важных ролей воды.
Рисунок 2: Вода влияет на форму клетки. Вода создает в клетке давление, которое помогает ей сохранять форму. В гидратированной клетке (слева) вода выталкивается наружу, и ячейка остается круглой. В обезвоженной клетке вытесняется меньше воды, поэтому клетка становится морщинистой.
Помимо влияния на общую форму клеток, вода также влияет на некоторые основные компоненты каждой клетки: ДНК и белки. Белки производятся в виде длинной цепочки строительных блоков, называемых аминокислотами, и для правильного функционирования они должны иметь определенную форму. Вода направляет сборку аминокислотных цепей, поскольку разные типы аминокислот ищут и избегают взаимодействия с водой. Белки обеспечивают структуру, улавливают сигналы и катализируют химические реакции в клетке. В конечном итоге белки управляют сокращением мышц, коммуникацией, перевариванием питательных веществ и многими другими жизненно важными функциями. Без правильной формы белки не смогли бы выполнять эти функции, и клетка (не говоря уже обо всем теле человека) не смогла бы выжить. Точно так же ДНК должна иметь определенную форму, чтобы ее инструкции были правильно расшифрованы. Белки, которые читают или копируют ДНК, могут связываться с ДНК только определенной формы.
Белки обеспечивают структуру, улавливают сигналы и катализируют химические реакции в клетке. В конечном итоге белки управляют сокращением мышц, коммуникацией, перевариванием питательных веществ и многими другими жизненно важными функциями. Без правильной формы белки не смогли бы выполнять эти функции, и клетка (не говоря уже обо всем теле человека) не смогла бы выжить. Точно так же ДНК должна иметь определенную форму, чтобы ее инструкции были правильно расшифрованы. Белки, которые читают или копируют ДНК, могут связываться с ДНК только определенной формы.
Химические реакции воды
Вода принимает непосредственное участие во многих химических реакциях, предназначенных для создания и разрушения важных компонентов клетки. Фотосинтез, процесс, который происходит в растениях, который производит сахар для всех форм жизни, требует воды. Вода также участвует в создании более крупных молекул в клетках. Молекулы, такие как ДНК и белки, состоят из повторяющихся единиц более мелких молекул.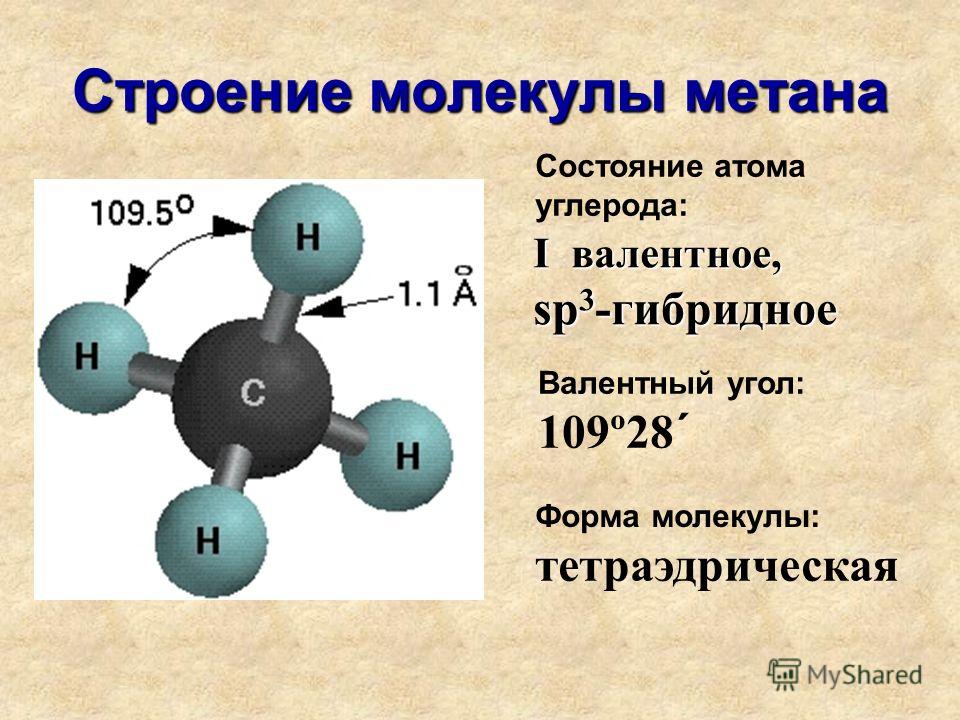 Соединение этих маленьких молекул происходит в результате реакции с образованием воды. И наоборот, вода необходима для того, чтобы обратить вспять реакцию, которая разрушает эти молекулы, позволяя клеткам получать питательные вещества или повторно использовать части больших молекул.
Соединение этих маленьких молекул происходит в результате реакции с образованием воды. И наоборот, вода необходима для того, чтобы обратить вспять реакцию, которая разрушает эти молекулы, позволяя клеткам получать питательные вещества или повторно использовать части больших молекул.
Кроме того вода защищает клетки от вредного воздействия кислот и щелочей. Сильно кислые или щелочные вещества, такие как отбеливатель или соляная кислота, являются едкими даже для самых прочных материалов. Это связано с тем, что кислоты и основания выделяют избыток водорода или забирают избыток водорода из окружающих материалов. Потеря или приобретение положительно заряженного водорода нарушает структуру молекул. Для правильного функционирования протеинам требуется определенная структура, поэтому важно защищать их от кислот и щелочей. Вода делает это, действуя как кислота и основание (рис. 3). Хотя химические связи в молекуле воды очень стабильны, молекула воды может отдать водород и стать ОН-, таким образом действуя как основание, или принять другой водород и превратиться в h4O +, таким образом действуя как кислота.
Рисунок 3: Вода действует как буфер, высвобождая или поглощая атомы водорода.
Вода необходима для любой жизни. Её универсальность и адаптируемость помогает проводить важные химические реакции. Никакая другая молекула не может сравниться с водой, с ее уникальными жизнеобеспечивающими свойствами. Интересно, что исследователи все еще выявляют новые свойства воды, такие как дополнительные преимущества ее асимметричной структуры. Ученым еще предстоит определить физиологические эффекты этих свойств. Удивительно, насколько простая молекула универсально важна для организмов с разными потребностями.
Оригинальная статья: https://sitn.hms.harvard.edu/uncategorized/2019/biological-roles-of-water-why-is-water-necessary-for-life/
Назад ко всем новостям
строение в различных агрегатных состояниях
Автор Исаев Виктор Алексеевич На чтение 7 мин Опубликовано
Вода является источником жизни для всех живых организмов.
Молекула воды имеет уникальное строение. В ней удивительным образом сочетаются прочность и устойчивость кристаллической структуры (льда), и подвижность жидкого вещества.
В статье мы подробно рассмотрим особенности строения молекулы воды в различных агрегатных состояниях: жидком, твердом, газообразном.
Содержание
- Какое строение имеет молекула воды
- Водородная связь
- Строение молекулы в различных агрегатных состояниях
- Лед
- Жидкая вода
- Водяной пар
- Из чего состоит вода
- Элементы
- Подводим итоги
Какое строение имеет молекула воды
Долгое время химики считали воду простым соединением, не вступающим в сложные реакции.
Состав воды как сложного вещества был установлен Лавуазье в 1783 г.
Одна молекула воды состоит из трех атомов: двух атомов водорода и одного атома кислорода, которые соединены между собой ковалентной связью.
Химическая формула: H₂O
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость. Они определяют химические и физические свойства соединений.
Молекула воды, картинка № 1По форме молекула воды напоминает равнобедренный треугольник, в основании которого находятся два атома водорода.Связь между атомом кислорода и атомами водорода полярная, т.к. кислород притягивает электроны сильнее, чем водород.
Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°.
Молекула воды имеет два положительных и два отрицательных полюса и поэтому в большинстве случаев ведёт себя как диполь (т.е. на одной стороне – положительный заряд, на другой – отрицательный)
Значения эффективных зарядов на атомах составляет ±0,17 от заряда электрона.
Водородная связь
В жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты за счёт особой химической связи, которая называется водородной.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость зависит и от способности соединения давать водородные связи с растворителем. В результате содержащие ОН-группы такие вещества, как сахар, глюкоза, спирты, карбоновые кислоты, как правило, хорошо растворимы в воде.
На картинке № 2 показано образование димера воды с одной водородной связью.Димер — это две молекулы Н2О, соединенные водородной связью. Связь между молекулами воды водородная.
Каждая молекула способна образовать четыре водородные связи: две между неподеленными электронными парами её атома кислорода и атомами водорода соседних молекул и ещё две – между атомами водорода и атомами кислорода двух других молекул.
Энергия водородной связи может изменяться от 17 до 33 кДж/моль.
Строение молекулы в различных агрегатных состояниях
Вода может быть в нескольких состояниях:
- Жидком.

- Твердом – это лед, а его кристаллы часто образуют иней или снег.
- Газообразном — водяной пар.
Существуют также и переходные состояния жидкости, которые возникают при замерзании или испарении.
Примечательно, что различные формы воды могут одновременно находиться рядом и даже взаимодействовать, например реки с ледниками, айсберги с морской водой, облака на небе с водяным паром.
Строение молекулы воды, водородная связь способствует расположению молекул воды. Рассмотрим особенности каждого агрегатного состояния по отдельности.
Лед
Представляет собой твердое состояние воды.
Молекулы воды образуют слои, причём каждая молекула связана с тремя молекулами в своём слое и с одной молекулой соседнего слоя. Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Атом кислорода связан с четырьмя атомами водорода: с двумя, расположенными на расстоянии 0,096 — 0,102 нм посредством валентных связей, и с двумя другими, находящимися на расстоянии 0,174 — 0,180 нм посредством водородных связей.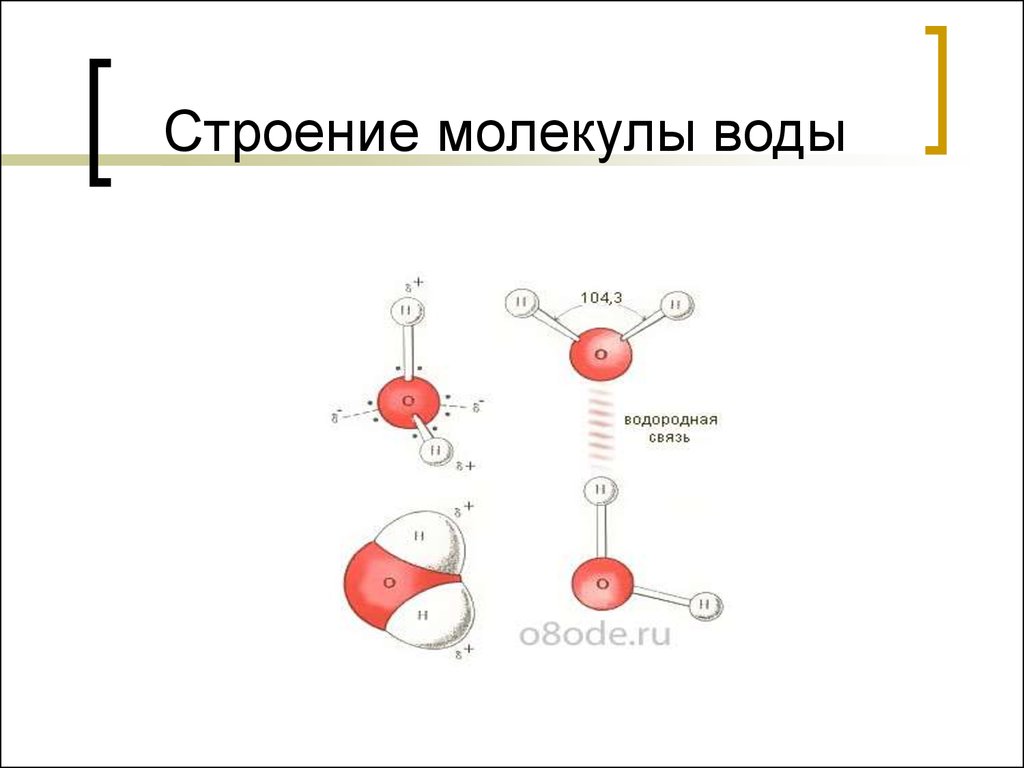
Жидкая вода
В отличие от структуры льда структура жидкой воды исследована ещё недостаточно.
Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
В результате изучения молекулы воды с помощью инфракрасных и рентгеновых лучей было видно, что при температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах.
При температуре близкой к точке кипения они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
При данном состоянии молекула воды не имеет структуры и состоит преимущественно из мономерных молекул воды, которые находятся на расстояние относительно друг друга.
Из чего состоит вода
При обычных условиях вода выглядит как прозрачная жидкость. У нее отсутствуют вкус и запах. При небольшой толщине слоя не наблюдается даже цвета.
Вода является отличным растворителем. В природе в ней постоянно находятся растворенные газы и соли. При соединении атомов кислорода с водородом получается молекула воды. Поскольку более сильными являются водородные соединения, то, когда происходит их разрыв, они прикрепляются к иным веществам, помогая тем растворяться.
В природе в ней постоянно находятся растворенные газы и соли. При соединении атомов кислорода с водородом получается молекула воды. Поскольку более сильными являются водородные соединения, то, когда происходит их разрыв, они прикрепляются к иным веществам, помогая тем растворяться.
Из-за своего малого размера каждую молекулу растворенного вещества окружают очень много молекул воды. Благодаря этому в ней присутствуют отрицательные и положительные ионы.
Чистая вода является еще и хорошим изолятором с концентрацией протонов и гидроксильных ионов в количестве 10-7 моль/л, это позволяет ей проводить электричество. Именно по ее электропроводности можно оценивать чистоту жидкости.
При взаимодействии с другими веществами состав воды не изменяется, что играет особую роль в жизни любого живого организма. Ведь очень важно, чтобы жидкостные растворы, через которые в организм поступают полезные вещества, не изменялись.
Кроме того, вода хорошо поглощает инфракрасное и микроволновое излучение, а также способна хранить в себе память о веществах, которые были в ней растворены.
Элементы
Проходя гидрологический цикл: испарение, конденсацию и выпадение в виде осадков вода может дополняться разными химическими элементами, которые можно разделить на 6 категорий. Рассмотрим информацию в таблице № 1.
Таблица № 1 «Элементы, которые могут входить в состав воды».
| Ионы | Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты находятся в воде в наибольшем, по сравнению с другими, количестве. |
| Растворенные газы | Кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры. |
| Биогенные элементы | Главными из них являются фосфор и азот, которые поступают в жидкость из осадков |
| Микроэлементы | Их насчитывается около 30 видов: бром, селен, медь, цинк и т. д. Показатели их в составе воды очень малы и колеблются от 0,1 до микрограмма на 1 литр. |
| Органические вещества | Спирты, углеводы, альдегиды, фенолы, пептиды и прочее. |
| Токсины | Тяжелые металлы и продукты нефтепереработки. |
В настоящий момент доступны специальные методы очистки, которые эффективно борются с вредными химическими соединениями.
Вода также может содержать в себе магний и катионы кальция. В зависимости от этого ее подразделяют на мягкую и жесткую.
По изотопам водорода в молекуле воды можно говорить о легкой воде, тяжелой и сверхтяжелой воде.
Подводим итоги
Вода необходима для жизни всего живого на Земле. Она участвует в мировом круговороте воды в природе. Благодаря испарению с поверхности водоемов, почвы, растений образуются облака. Затем они выпадают в виде дождя, снега, града, питая собой подземные воды и родники. Родниковые воды по рекам попадает в море.
Таким образом, количество воды на Земле не изменяется, она только меняет свои формы — это и есть круговорот воды в природе.
Уникальное строение молекулы воды помогает ей трансформироваться в три агрегатных состояния.
При замерзании воды ее молекулы собираются в небольшие группы. При испарении находится на расстоянии относительно друг друга. Жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
Список литературы
- Химия и микробиология воды. Учебное пособие В. В. Котов, Г.А. Нетесова
- Конспект лекций ГИДРОГЕОХИМИЯ. Киреева Т.А., МГУ им. М.В. Ломоносова, 2016
Вода как химическое соединение
Природные, сточные и другие виды вод представляют собой сложные системы, основу которых составляет химическое соединение, имеющее простую формулу Н20. На первый взгляд, за этой формулой стоит ничем не примечательное соединение. При более глубоком ознакомлении со строением молекулы и свойствами воды выясняется, что она обладает рядом удивительных свойств.[ …]
Молекула воды состоит из двух атомов водорода и одного атома кислорода.[ …]
Для состава воды характерно следующее массовое содержание элементов (%): водорода 11,19 и кислорода 88,81. Ядра атомов в молекуле воды расположены по углам равнобедренного треугольника, в вершине которого находится ядро атома кислорода. Молекула воды — плоская угловая. В невозбужденных молекулах воды угол НОН, образованный направлениями связей кислород — водород, составляет 104°27/ (для парообразного состояния) и 104°ЗГ (для жидкого) (рис. 1).[ …]
Ядра атомов в молекуле воды расположены по углам равнобедренного треугольника, в вершине которого находится ядро атома кислорода. Молекула воды — плоская угловая. В невозбужденных молекулах воды угол НОН, образованный направлениями связей кислород — водород, составляет 104°27/ (для парообразного состояния) и 104°ЗГ (для жидкого) (рис. 1).[ …]
Межъядерное расстояние О—Н в молекулах воды равно 0,09568 нм (в газовой фазе), 0,09572 нм (в жидкой) и 0,099 нм (в фазе льда). Колебательное, вращательное и электронное возбуждение молекул воды вызывает изменение размеров и формы молекулы Н20. Причем энергетически выгодной является одновременная деформация угла и длины связи О—Н.[ …]
Таким образом, электронное облако молекулы воды имеет вид четырех лепестков, направленных к вершинам неправильного тетраэдра. В двух вершинах одной грани находятся электронные пары, осуществляющие связь О—Н, а в двух вершинах противоположной грани находятся неподеленные электронные пары атома кислорода (рис.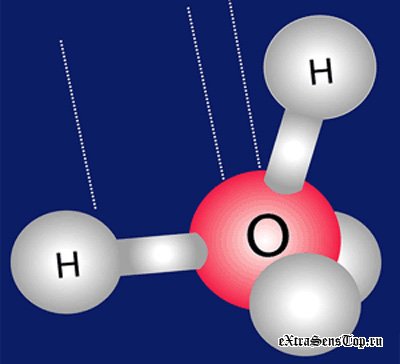
Рассмотрим структуру воды в различных агрегатных состояниях. При 0° С (273,15 К) жидкая вода превращается в лед. Средняя величина электрического момента диполя у молекулы воды в упорядоченной структуре льда составляет 8,58-10-’28.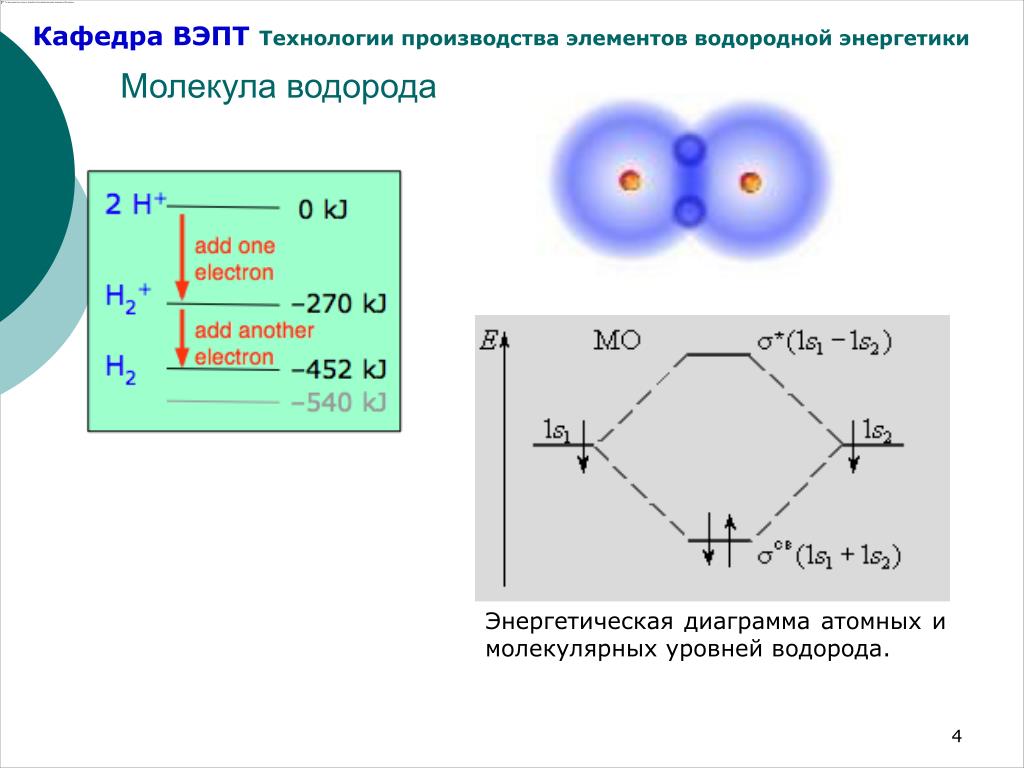 Плотность льда при 0°С 0,9168 г/см3.[ …]
Плотность льда при 0°С 0,9168 г/см3.[ …]
Для воды характерно существование нескольких полиморфных форм льда. В зависимости от температуры и давления, при которых происходит формирование кристаллической фазы, различают 13 видов льда. При обычных условиях устойчивым является лед, имеющий гексагональную структуру. Данными рентгеноструктурного анализа подтверждено, что в кристалле льда, имеющем молекулярную кристаллическую решетку, каждая молекула воды тетраэдрически окружена четырьмя другими молекулами, образующими с ней водородные связи (рис. 3). Подобное соединение молекул воды друг с другом способствует образованию пустот в кристаллической решетке льда. Такой рыхлой структурой объясняется аномально малая плотность воды в твердом состоянии. Свободные полости в структуре льда способствуют образованию клатратных соединений включения клеточного типа. Подобные образования могут давать молекулы таких газов, как С12, Н2Э, метан и др.[ …]
Лед обладает электропроводностью около 10 9 Ом -см“1 при температуре —10° С. Электропроводность льда Бьеррум объясняет существованием ионизационных дефектов в кристалле льда. Ионы могут образоваться при переходе протона от одной молекулы воды к другой по схеме 2Н20 Н30++0Н .[ …]
Электропроводность льда Бьеррум объясняет существованием ионизационных дефектов в кристалле льда. Ионы могут образоваться при переходе протона от одной молекулы воды к другой по схеме 2Н20 Н30++0Н .[ …]
Многие ученые придерживаются теории строения жидкой воды и водных растворов, в основе которой лежит положение о сохранении ажурной решетки льда в жидкой воде и частичном заполнении пустот одиночными молекулами воды. По этой теории ближняя упорядоченность молекул воды, т. е. взаимное расположение соседних молекул воды, аналогично кристаллическому каркасу льда, слегка нарушенному тепловым движением молекул, в пустотах которого находятся одиночные молекулы воды.[ …]
О. Я. Самойловым разработана теория трансляционного движения частиц в воде, согласно которой молекулы воды льдоподобного каркаса, выйдя из состояния равновесия, совершают активированный скачок в пустоты, находятся там некоторое время, а затем вновь приходят в трансляционное движение. Молекулы воды, попавшие в пустоты, энергетически не соответствуют молекулам каркаса. Время перехода молекул воды из одного состояния в другое составляет порядка 10-13 с.[ …]
Время перехода молекул воды из одного состояния в другое составляет порядка 10-13 с.[ …]
Рисунки к данной главе:
| Строение молекулы воды |
| Направленность электронных орбиталей (а) и схема распределения зарядов в молекуле воды (б) |
| Взаимное расположение молекул воды в структуре льда |
Аналогичные главы в дргуих документах:
| См. далее:Вода как химическое соединение |
Вернуться к оглавлению
Молекула воды
Вода (оксид водорода) Н2О – простейшее устойчивое соединение водорода с кислородом. Молекулярная масса воды 18,0160, на водород приходится 11,19% по массе, а на кислород – 88,81%.
Как
ранее говорилось, в природе существует
три изотопа водорода – легкий водород
Н1,
дейтерий D
(Н2)
и тритий (Н3)
и три изотопа кислорода – О16,
О17 и О18. Искусственно получены в ускорителях
сверхтяжелые изотопы водорода Н4 и Н5 и шесть изотопов кислорода: три легких
– О13,
О14,
О15,
два тяжелых – О19,
О20 и один сверхтяжелый – О24.
Теоретически пять изотопов водорода и
девять изотопов кислорода могут
образовать 135 разновидностей молекулы
воды, из которых устойчивыми являются
девять, включающих стабильные изотопы.
В природной воде на долю
О16 приходится 99,75% по массе, на долю
О18 – 0,2%, на
О17 – 0,04% и на Н1Н2О16 – примерно 0,093%; остальные пять
разновидностей присутствуют в ничтожных
количествах [4].
Искусственно получены в ускорителях
сверхтяжелые изотопы водорода Н4 и Н5 и шесть изотопов кислорода: три легких
– О13,
О14,
О15,
два тяжелых – О19,
О20 и один сверхтяжелый – О24.
Теоретически пять изотопов водорода и
девять изотопов кислорода могут
образовать 135 разновидностей молекулы
воды, из которых устойчивыми являются
девять, включающих стабильные изотопы.
В природной воде на долю
О16 приходится 99,75% по массе, на долю
О18 – 0,2%, на
О17 – 0,04% и на Н1Н2О16 – примерно 0,093%; остальные пять
разновидностей присутствуют в ничтожных
количествах [4].
Молекула
воды имеет угловое строение: входящие
в её состав ядра образуют равнобедренный
треугольник, в основании которого
находятся два водорода, а в вершине –
атом кислорода. Межъядерные расстояния
О – Н близки к 0,1 нм, расстояние между
ядрами атомов водорода равно 0,15 нм. Из
шести электронов, составляющих внешний
электронный слой атома кислорода в
молекуле воды, две электронные пары
образуют ковалентные связи О-Н, а
остальные четыре электрона представляют
собой две неподелённые электронные
пары (рисунок 1).
Из
шести электронов, составляющих внешний
электронный слой атома кислорода в
молекуле воды, две электронные пары
образуют ковалентные связи О-Н, а
остальные четыре электрона представляют
собой две неподелённые электронные
пары (рисунок 1).
Рисунок 1 – Модели строения молекулы воды [3]
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов, получится объемная геометрическая фигура – правильный тетраэдр (рисунок 1) [19,20].
С
позиций метода валентных связей
образование химических связей в молекуле
воды можно объяснить за счёт перекрывания
двух одноэлектронных p-облаков
атома кислорода и одноэлектронных
s-облаков
двух атомов водорода.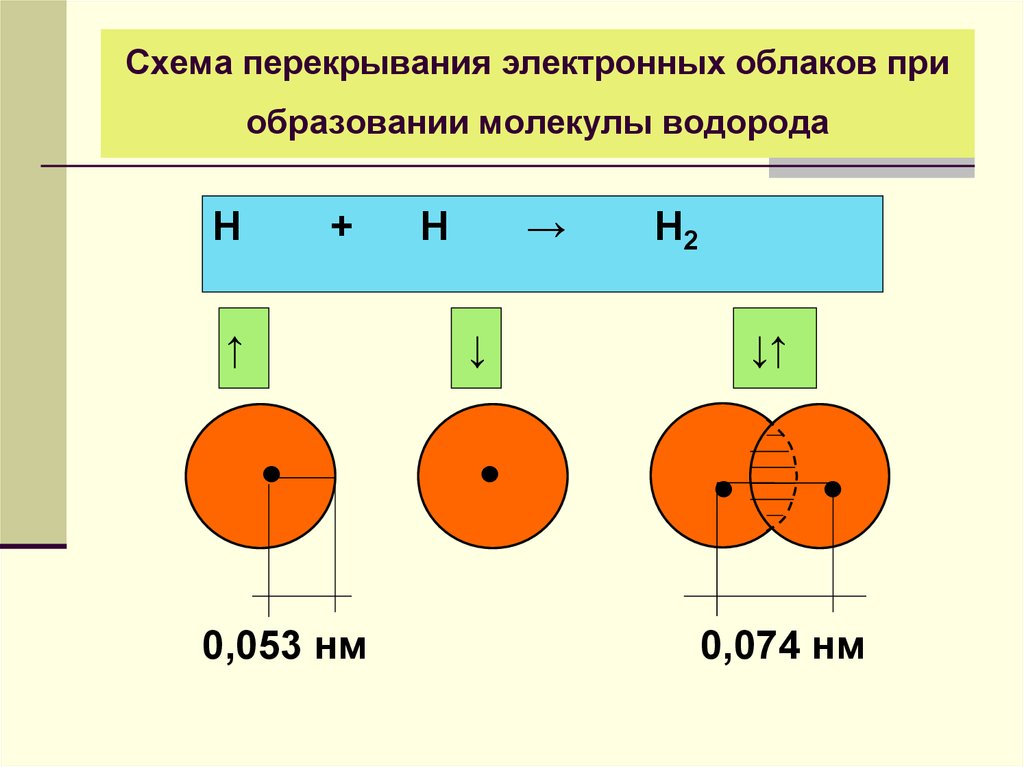 Ввиду того что
участвующие в образовании химических
связей p-облака
кислорода расположены относительно
друг друга под углом в 90,
валентный угол НОН должен был также
соответствовать этому значению. Однако
в действительности он состовляет 104,5.
Отклонение валентного угла от ожидаемого
можно объяснить с двух позиций.
Ввиду того что
участвующие в образовании химических
связей p-облака
кислорода расположены относительно
друг друга под углом в 90,
валентный угол НОН должен был также
соответствовать этому значению. Однако
в действительности он состовляет 104,5.
Отклонение валентного угла от ожидаемого
можно объяснить с двух позиций.
Согласно одной из них увеличение валентного угла с 90 до 104,5можно объяснить отталкиванием атомов водорода, который вследствие большой разности в электроотрицательности с кислородом (разность составляет 1,4 по шкале Полинга) приобретают в молекуле воды частичный положительный заряд (плюс 0,33 на каждом атоме). Эффективный заряд атома кислорода составляет минус 0,66.
С
точки зрения концепции гибридизации
атом кислорода должен находится в
состоянии sp3-гибридизации,
в которой принимают участие две орбитали
с неподелёнными электронными парами и
две орбитали, осуществляющие связи с
водородом. В соответствии с этим валентный
угол между тетраэдрически расположенными
в пространстве орбиталями кислорода
должен составить порядка 109,5. Отклонение валентного угла НОН от
тетраэдрического можно объяснить тем,
что электронные пары связи О – Н занимают
в пространстве меньший объём, чем
неподелённые пары кислорода [3].
Отклонение валентного угла НОН от
тетраэдрического можно объяснить тем,
что электронные пары связи О – Н занимают
в пространстве меньший объём, чем
неподелённые пары кислорода [3].
Особенности строения молекулы воды имеют важные следствия.
Во-первых, из-за неравномерности распределения электронной плотности валентных электронов молекула Н2О представляет собой диполь с отрицательным полюсом на кислороде и положительным со стороны атома водорода. Дипольный момент воды составляет 6,1710-30 Клм. Это достаточно большая величина. Для сравнения, дипольный момент метана равен 0, аммиака – 4,4410-30 Клм.
Во-вторых, большой дипольный момент воды является причиной возникновения диполь-дипольных и ион-дипольных взаимодействий в водных растворах.
В-третьих, молекула воды образует водородные связи.
В-четвёртых,
неподелённые электронные пары кислорода
позволяют Н2О
выступать в качестве лиганда с образованием
комплексных соединений [3].
Вода имеет очень высокие температуры замерзания (0) и кипения (100) (рисунок 2). Это позволяет ей существовать во всех агрегатных состояниях: твердом (лед), жидком (вода) и газообразном (пар) (рисунок 3).
Рисунок 2 – Аномалии точек кипения и замерзания воды
Рисунок 3 – Агрегаты состояния воды: а – лед, б – вода, в – пар [2]
Из одиночных молекул вода состоит в парообразном состоянии. При температуре ниже температуры кипения, когда кинетическая энергия молекул становится ниже их потенциальной энергии взаимодействия, вода, как и любое вещество в этом случае, переходит в жидкое состояние. Но температура этого фазового перехода для воды почти на 200выше, чем это следовало бы ожидать из характера того межмолекулярного взаимодействия, которое должно осуществлять между подобными ей по составу молекулами, например сероводорода.
Высокая
полярность воды является лишь одной из
причин ассоциации молекул воды, которые
могут комбинироваться по две, три и
более вследствие взаимного притяжения
противоположно заряженных концов диполя
[3].
Главной причиной образования ассоциатов (Н2О)х являются водородные связи [3]. В твердом состоянии атом кислорода каждой молекулы воды образует две водородные связи (показаны пунктиром) с соседними молекулами по схеме (рисунок 4) [4]. Благодаря им жидкая вода – это не разупорядоченное движение молекул, а состояние, близкое к аморфному. В нём молекулы воды ассоциированы в агрегаты (Н2О)х – кластеры со степенью ассоциации () до 130 молекул воды при 0, до 90 – при 20, до 60 – при 72(рисунок 5) [3].
Рисунок 4 – Схема образования водородных связей [4]
Рисунок 5 – Некоторые возможные структуры кластеров воды
Время
жизни таких кластеров небольшое (10-11 – 10-10 с). В их образовании участвуют не все
молекулы, иначе бы их плотность в жидком
состоянии должна была бы составить не
1
г/см3,
а 1,84 г/см3.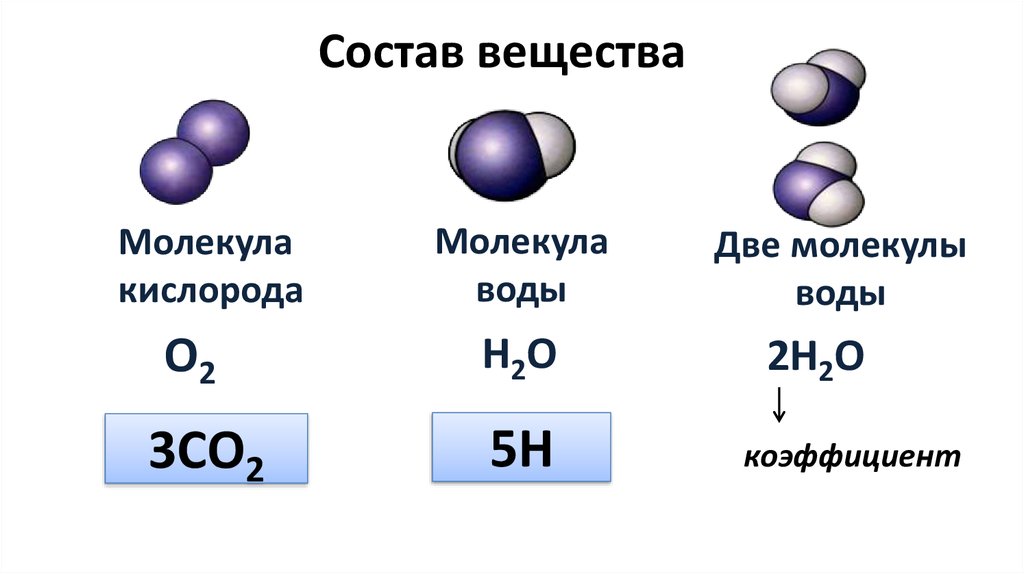 Последняя величина рассчитана из
предположения плотной упаковки молекул
Н2О
с радиусом, равным 1,38
,
который определен из размеров
кристаллической решетки льда [3].
Последняя величина рассчитана из
предположения плотной упаковки молекул
Н2О
с радиусом, равным 1,38
,
который определен из размеров
кристаллической решетки льда [3].
Схема кристаллической решетки льда представлена на рисунке 6. Каждая молекула Н2О (черные шарики) окружена тетраэдрически четырьмя другими молекулами – тремя из того же слоя и одной из соседнего слоя молекул. Структура льда является наименее плотной структурой. Ее особенность заключается в наличии пустот, размеры которых превышают размеры молекул Н2О. При плавлении льда часть водородных связей разрушается, и в пустотах оставшихся агрегатов могут разместиться отдельные молекулы воды, вследствие чего достигается более плотная упаковка молекул. Поэтому при плавлении льда объем воды уменьшается, а плотность возрастает.
Рисунок 6 – Кристаллическая решетка льда [4]
Элементы жизни. Вода — Рамблер/новости
Из чего состоят живые тела и при чем тут углерод? Что такое генетический код, кто такие вирусы, как устроено эволюционное древо и почему произошел кембрийский взрыв? Книга Сергея Ястребова «От атомов к древу: Введение в современную науку о жизни», вышедшая в издательстве «Альпина нон-фикшн» дает актуальные ответы на эти и многие другие вопросы. Публикуем главу из книги.
Публикуем главу из книги.
Фото: ИндикаторИндикатор
Что такое вода?
Видео дня
Вода — одно из самых распространенных веществ на планете Земля. Она покрывает две трети земной поверхности,и ее очень много в живых организмах — гораздо больше, чем любого другого вещества. Подавляющее большинство биохимических реакций, то есть превращений жизненно важных молекул друг в друга, идет в растворах, где вода является растворителем. Воды много и в космосе — например, в кометах, в недрах Урана и Нептуна или в межзвездных туманностях. В целом можно сказать, что вода — это одно из самых распространенных веществ не только на Земле, но и вообще во Вселенной. Иное дело, что далеко не на всех планетах она встречается в жидком виде (Земля — единственная планета Солнечной системы, на поверхности которой есть постоянно существующие водоемы). Так или иначе, неудивительно, что именно вода послужила средой для всем нам знакомой жизни.
Что же такое вода с точки зрения химии? Это весьма простая молекула, состоящая всего лишь из двух атомов водорода (H) и одного атома кислорода (O). Соответственно, химическая формула воды — h3O. Каждый атом водорода соединен с атомом кислорода одной ковалентной связью, в полном соответствии с валентностью кислорода, которая (как мы помним) равна двум. Формулу воды можно записать и так: H–O–H. Это эквивалентно формуле 2 которую обычно приводят в книгах.
Соответственно, химическая формула воды — h3O. Каждый атом водорода соединен с атомом кислорода одной ковалентной связью, в полном соответствии с валентностью кислорода, которая (как мы помним) равна двум. Формулу воды можно записать и так: H–O–H. Это эквивалентно формуле 2 которую обычно приводят в книгах.
Многие свойства воды объясняются тем, что ее молекулы исключительно хорошо «слипаются» друг с другом. Например, на поверхности водоема они образуют пленку, по которой клопы-водомерки, отнюдь не микроскопические существа, бегают как посуху. Другие особенности воды как вещества — прекрасная теплопроводность и высокая температура кипения (на испарение литра воды надо потратить больше энергии, чем на испарение того же объема чуть ли не любой другой жидкости). Чтобы понять, почему вода именно такова, надо присмотреться к ее молекулам повнимательнее.
Водородная связь
Начнем вот с чего. В общей химии часто встречается понятие «электроотрицательность», введенное когда-то Лайнусом Полингом. Электроотрицательность — это сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Самый электроотрицательный элемент — фтор (F), а сразу за ним на шкале электроотрицательности следует кислород (O). Иначе говоря, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора, который в живой природе встречается очень редко. Запомним этот факт, он нам пригодится.
Электроотрицательность — это сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Самый электроотрицательный элемент — фтор (F), а сразу за ним на шкале электроотрицательности следует кислород (O). Иначе говоря, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора, который в живой природе встречается очень редко. Запомним этот факт, он нам пригодится.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующая ее пара электронов никуда не смещается. Грубо говоря, эти электроны располагаются между атомами точно посредине. Такая ковалентная связь называется неполярной. Само собой разумеется, что любая ковалентная связь между одинаковыми атомами будет неполярна (например, связь в молекуле водорода H–H или углерод-углеродная связь C–C).
Если же ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого электроотрицательность выше.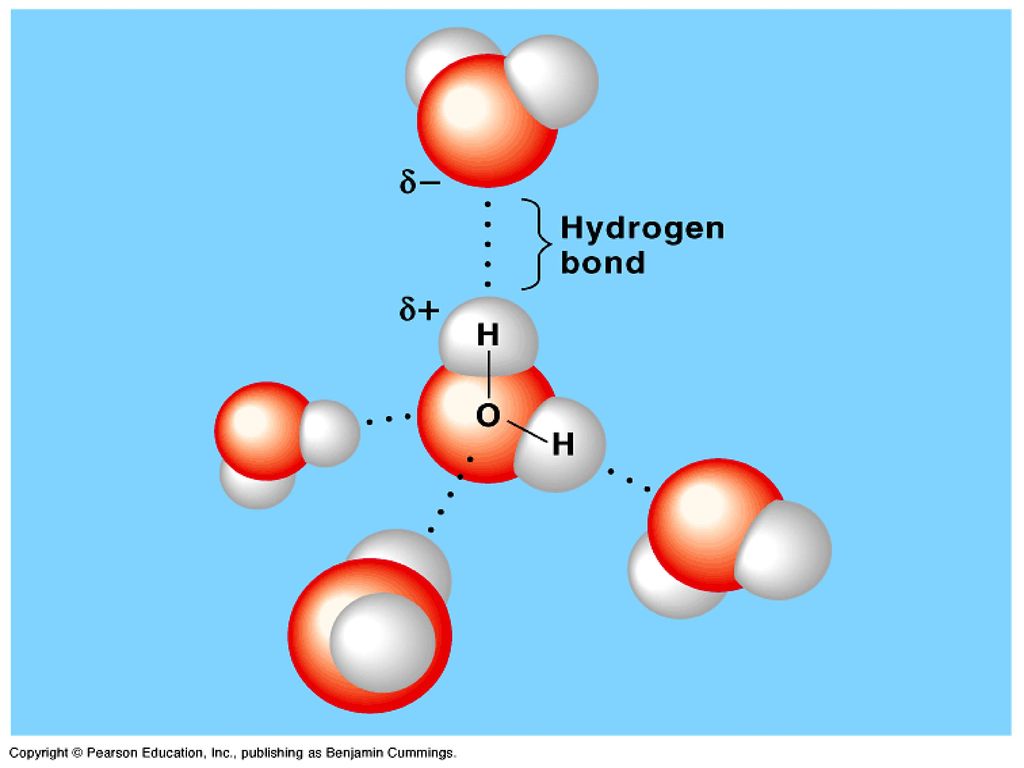 Такая связь называется полярной (см. рис. 1 и 2). При очень большой разнице в электроотрицательности связь может даже превратиться в ионную — это случится, если один атом полностью «отберет» общую пару электронов у другого. В молекулах, из которых состоят живые существа, ионные связи встречаются относительно редко, зато ковалентные полярные — очень часто. Например, это широко распространенные в органических веществах связи C–O и H–O.
Такая связь называется полярной (см. рис. 1 и 2). При очень большой разнице в электроотрицательности связь может даже превратиться в ионную — это случится, если один атом полностью «отберет» общую пару электронов у другого. В молекулах, из которых состоят живые существа, ионные связи встречаются относительно редко, зато ковалентные полярные — очень часто. Например, это широко распространенные в органических веществах связи C–O и H–O.
Связь между водородом и кислородом в молекуле воды — это типичная ковалентная полярная связь. Электроотрицательность кислорода намного выше, поэтому общие лектроны смещены к нему. В результате на атоме кислорода образуется маленький отрицательный заряд, а на атомах одорода — маленькие положительные заряды. На графических формулах эти маленькие заряды, величина которых начительно меньше единицы, принято обозначать буквой «дельта» с добавлением соответствующего знака. Как мы еперь знаем, связи кислорода с водородом или углеродом ообще всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде.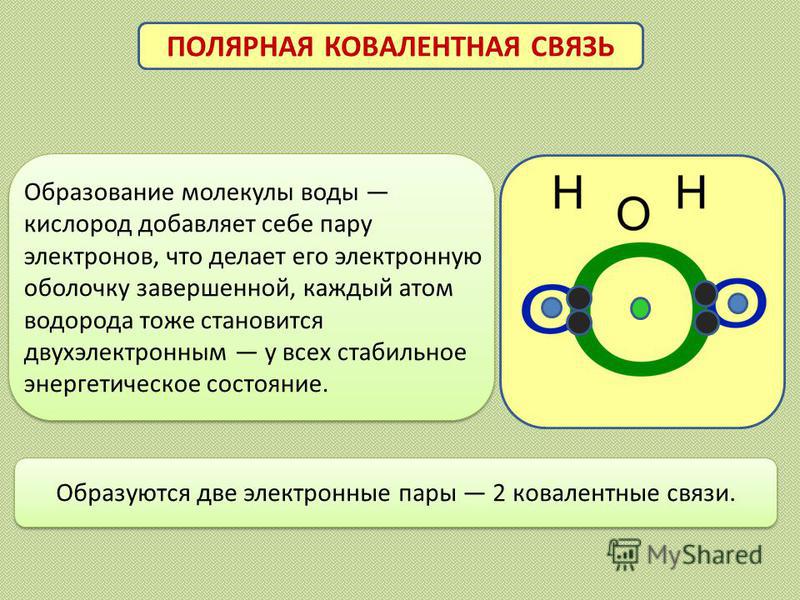
А вот связь между углеродом и водородом (C–H) считается неполярной, хоть атомы и разные. И это тоже очень важно. Между атомами углерода и водорода разница в электроотрицательности настолько мала, что смещение электронов там незаметно. Например, молекулы углеводородов, состоящие только из атомов C и H, в силу этого полностью неполярны, никаких частичных зарядов, которые хоть на что-то влияли бы, в них нет.
Теперь вспомним, что положительные и отрицательные электрические заряды согласно закону Кулона притягиваются друг к другу. Например, частично отрицательный атом кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул воды. В результате между водородом и кислородом возникают нековалентные связи, основанные на электростатическом притяжении, — они называются водородными
Это очень слабые связи, в жидкой воде они легко образуются и так же легко рвутся при движениях молекул. Но, несмотря на то что водородные связи гораздо слабее ковалентных, они дают сильный эффект, если их много.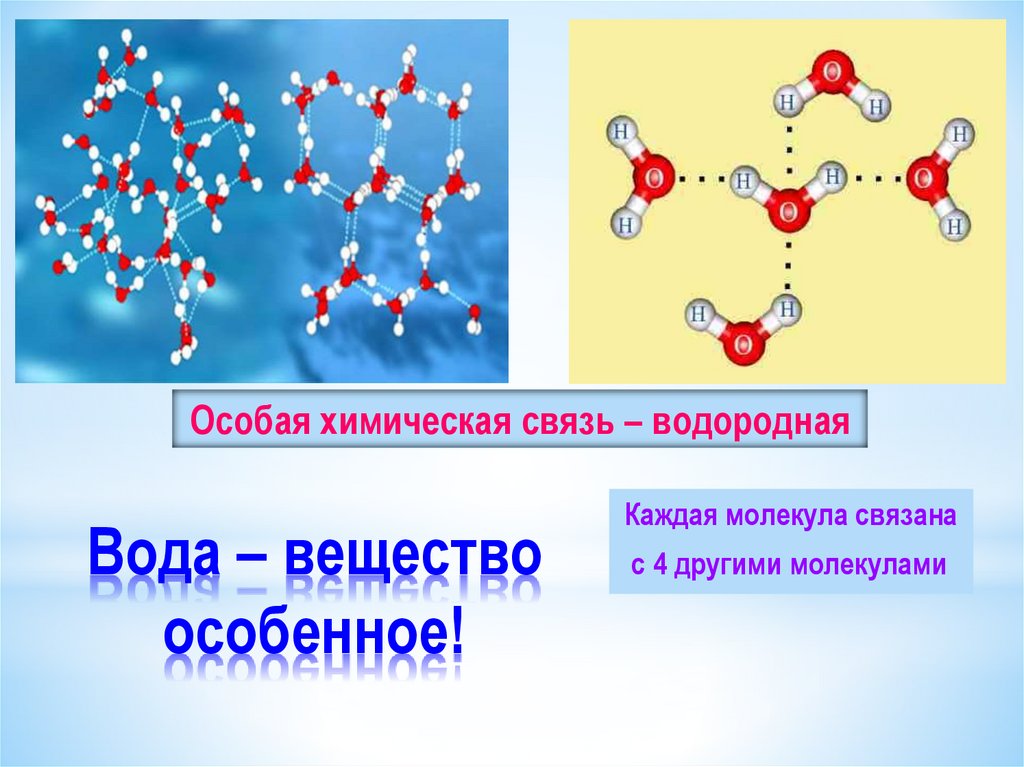
А в воде их очень много. Например, именно из-за колоссального количества водородных связей у воды исключительно высокая теплоемкость — ее трудно нагреть и трудно остудить. Большинство особенностей воды так или иначе связано с тем, что ее молекулы очень хорошо образуют водородные связи.
«Водородная связь чем-то напоминает любовь втроем», — писал в своем известном университетском учебнике американский биохимик Люберт Страйер. Он имел в виду, что в водородной связи атом водорода связан сразу с двумя атомами кислорода: с одним ковалентно (и прочно), а с другим электростатически (и слабо). Чтобы образовать водородную связь, атом водорода обязательно должен уже состоять в ковалентной связи с другим атомом, причем значительно отличающимся от него по электроотрицательности.
Водородные связи важны не только с точки зрения свойств воды. Они много где встречаются. Например, в главе 9 мы увидим, что без водородных связей невозможно представить себе структуру молекулы ДНК, от которой зависит хранение наследственной информации.
Любовь и ненависть воды
Любое вещество, растворенное в воде, так или иначе взаимодействует с ней, и способ этого взаимодействия зависит, прежде всего, от электрических свойств молекул. Например, если растворить в воде поваренную соль (NaCl), она распадется на положительно заряженные ионы натрия (Na+) и отрицательно заряженные ионы хлора (Cl–). При этом к ионам натрия молекулы воды “прилипнут» своими атомами кислорода (несущими маленький отрицательный заряд δ–), а к ионам хлора — атомами водорода (несущими маленький положительный заряд δ+). В результате и те и другие ионы получат оболочку, состоящую из молекул воды (см. рис. 3). Образование таких оболочек называется гидратацией. Ионы натрия и хлора находятся в воде в гидратированном состоянии. Гидратация — процесс, сопутствующий растворению в воде любого вещества (если оно вообще в ней растворимо, конечно).
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой — в первую очередь потому, что образуют с ней водородные связи, «цепляясь» за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы (см. главу 1). Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы (см. главу 1). Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Правда,рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды — тот самый процесс, который мы только что назвали гидратацией.
Менделеев убедительно показал, что растворение — это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор — это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода.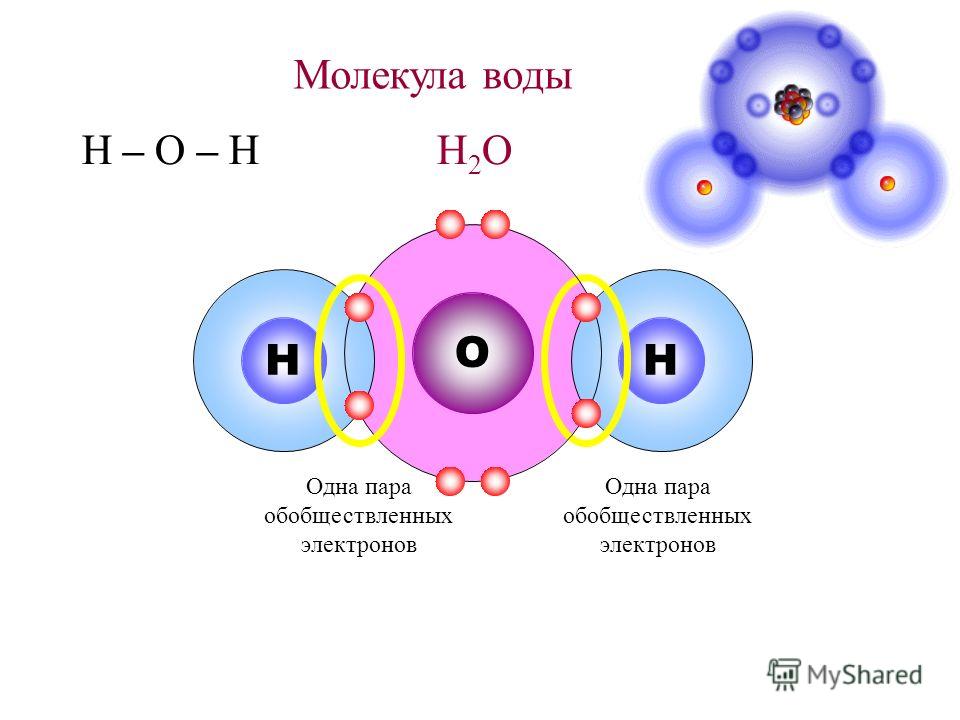 Это понятно: именно вокруг атомов кисло- рода обычно образуются водородные связи. Например, молекула глюкозы (C6h22O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Это понятно: именно вокруг атомов кисло- рода обычно образуются водородные связи. Например, молекула глюкозы (C6h22O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными («боящимися воды»). Типичные гидрофобные соединения — углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела. Вода как бы «выталкивает» эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка.
Гидрофильными бывают и некоторые бескислородные органические вещества — например, амины. В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно (см. главы 3, 5, 6). Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь — водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ — да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям, прежде всего, в виде углекислого газа, который мы выдыхаем. Но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
В этом растворителе могут жить даже земные микробы: например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых «суперземлях» — планетах с массой, в несколько раз превосходящей массу Земли. Суперземли — довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни — аммиак (Nh4). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода — ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, — метиловый спирт,или метанол (Ch4OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем: вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Зем- ля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Зем- ля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Наконец, еще один кандидат на роль подходящего для жизни гидрофильного растворителя — сероводород, соединение водорода и серы с формулой h3S (она же H–S–H). Молекула сероводорода очень похожа на молекулу воды. Правда, водородные связи она образует несколько хуже. В Солнечной системе сероводорода много на Ио — спутнике Юпитера, который отличается невероятной геологической активностью. Поверхность Ио покрыта вулканами, выбрасывающими фонтаны лавы, а состоит эта лава в основном из разнообразных соединений серы, которые текут и застывают, ибо в системе Юпитера очень холодно. Ио — это настоящий «мир льда и пламени”.
В Солнечной системе сероводорода много на Ио — спутнике Юпитера, который отличается невероятной геологической активностью. Поверхность Ио покрыта вулканами, выбрасывающими фонтаны лавы, а состоит эта лава в основном из разнообразных соединений серы, которые текут и застывают, ибо в системе Юпитера очень холодно. Ио — это настоящий «мир льда и пламени”.
Если бы на Ио была жизнь, она вполне могла бы быть основана на сероводороде, точно так же, как земная жизнь — на воде.
А может ли среда для жизни оказаться не гидрофильной, а гидрофобной? Исключить такое в принципе нельзя. Например, на крупнейшем спутнике Сатурна — Титане — есть угле- водородные озера и даже моря, состоящие из метана (Ch5),этана (C2H6) и пропана (C3H8). Это настоящий гидрофобный растворитель, в котором некоторые ученые допускают существование жизни, хотя прямых подтверждений этому пока что нет. Жидкой воды на поверхности Титана не бывает, там слишком холодно.
В целом, однако, сейчас кажется более вероятным, что главный растворитель для внеземной жизни окажется гидрофильным (но не обязательно водой). Во-первых, гидрофильных растворителей в природе просто больше. А во-вторых, все известные биохимические механизмы слишком уж сильно «заточены» под гидрофильную среду. Биохимию на гидрофобной основе вообразить гораздо труднее.
Во-первых, гидрофильных растворителей в природе просто больше. А во-вторых, все известные биохимические механизмы слишком уж сильно «заточены» под гидрофильную среду. Биохимию на гидрофобной основе вообразить гораздо труднее.
Из совсем уж экзотических альтернатив воде можно назвать, к примеру, фтороводород (HF, «аш-фтор»). Водный раствор фтороводорода — очень агрессивное вещество, которое называется плавиковой кислотой (в сериале «Во все тяжкие», главный герой которого — химик, ставший преступником, этой кислотой растворяют трупы). Однако многие органические молекулы, например углеводороды, в ней совершенно стабильны. К тому же фтороводород прекрасно образует водородные связи, а это, как мы уже знаем, очень важное для растворителя свойство. Возможность фтороводородной жизни допускали некоторые ученые, например астроном Карл Саган. А в фантастической повести Ивана Ефремова «Сердце Змеи” описана планета с фтороводородным океаном и дышащими фтором разумными жителями, с которыми земляне вступают в контакт. «Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…»
«Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…»
Великий популяризатор науки Айзек Азимов — кстати говоря, биохимик по научной специальности — не раз задумывался над тем, из каких веществ могли бы образоваться океаны на других планетах. Он назвал такие вещества термином «талассогены», что буквально значит «производящие море». По определению Азимова, талассоген — это вещество, способное сформировать планетарный океан. В замечательной книге «Асимметрия жизни» Азимов подробно разбирает проблему океанов, приходя к выводу, что самые вероятные талассогены — это вода, аммиак и метан. При этом для планет, расположенных примерно на таком расстоянии от звезд, как Земля, вода имеет преимущество, потому что она остается жидкой при более высокой температуре. «Вы можете представить метановые океаны на такой планете, как Нептун, или аммиачные океаны на планете типа Юпитера, однако вода, и только вода может создать океан на внутренней планете вроде Земли».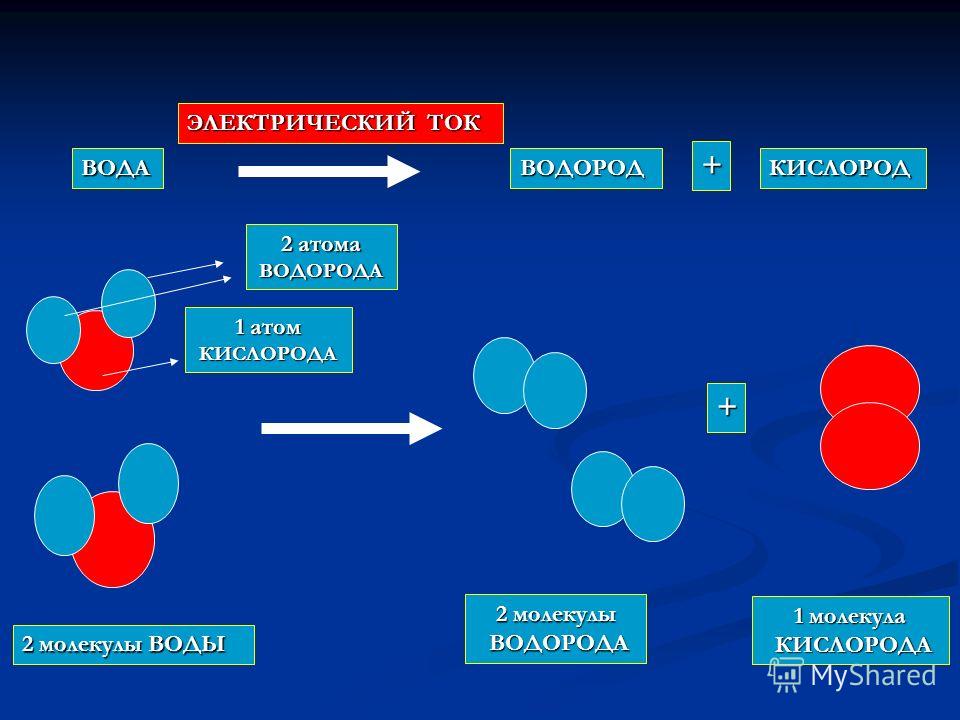 Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
Возвращаясь к земной (а вернее, водной) биохимии, будем иметь в виду, что она — не единственная теоретически возможная. Изучая природу, всегда полезно помнить люби- мую мысль Станислава Лема: «Среди звезд нас ждет Неизвестное».
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс.Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.
Вода и её полезные свойства
Содержание
«Жизнь – это одушевленная вода»
Леонардо да Винчи, XVв.
Вода (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях). Составляет приблизительно около 0,05 % массы Земли.
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды).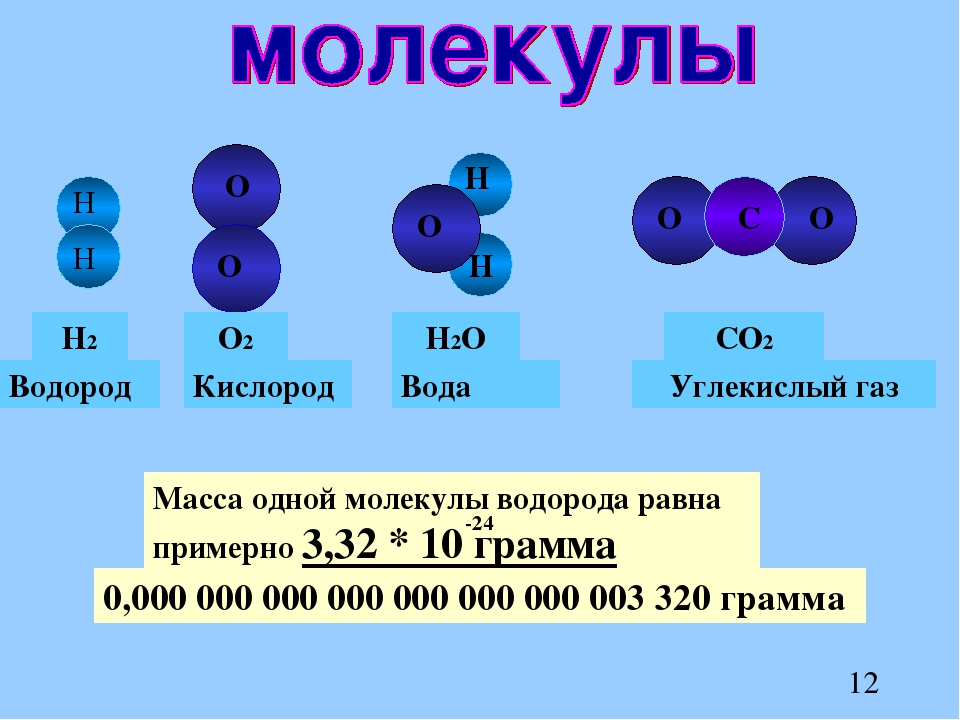
Большая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах. Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Вода является важнейшим веществом для всех живых существ на Земле.
Вода и ее полезные свойства для живых существ:
Сложно переоценить то значение, которое имеет оксид водорода для всего живого. Ведь вода и есть сам источник жизни. Известно, что без нее человек не смог бы прожить и недели.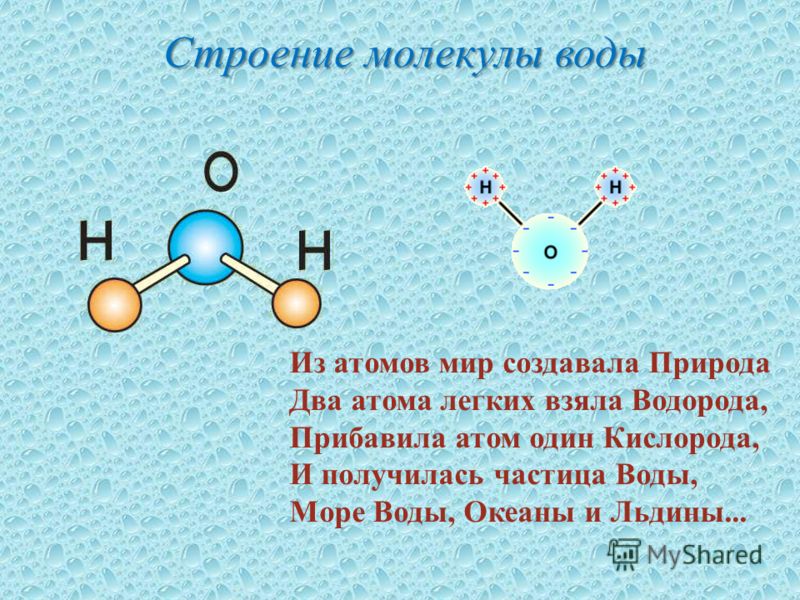 Вода, ее свойства и значение просто колоссальны.
Вода, ее свойства и значение просто колоссальны.
- Это универсальный, то есть способный растворять и органические, и неорганические соединения, растворитель, действующий в живых системах. Именно поэтому вода — источник и среда для протекания всех каталитических биохимических преобразований, с формированием сложных жизненно важных комплексных соединений.
- Способность образовывать водородные связи делает данное вещество универсальным в выдерживании температур без изменения агрегатного состояния. Если бы это было не так, то при малейшем снижении градусов она превращалась бы в лед внутри живых существ, вызывая гибель клеток.
- Для человека вода — источник всех основных бытовых благ и нужд: приготовление пищи, стирка, уборка, принятие ванны, купание и плавание и прочее.
- Промышленные заводы (химические, текстильные, машиностроительные, пищевые, нефтеперерабатывающие и другие) не сумели бы осуществлять свою работу без участия оксида водорода.

- Издревле считалось, что вода — это источник здоровья. Она применялась и применяется сегодня как лечебное вещество.
- Растения используют ее как основной источник питания, за счет чего они продуцируют кислород — газ, благодаря которому существует жизнь на нашей планете.
Питьевая вода — это вода, которая предназначена для ежедневного неограниченного и безопасного потребления человеком и другими живыми существами. Главным отличием от столовых и минеральных вод является пониженное содержание солей (сухого остатка), а также наличие действующих стандартов на общий состав и свойства (СанПиН 2.1.4.1074-01 — для централизованных систем водоснабжения и СанПиН 2.1.4.1116-02 — для вод, расфасованных в ёмкости).
Вода многих источников пресной воды непригодна для питья людьми, так как может служить источником распространения болезней или вызывать долгосрочные проблемы со здоровьем, если она не отвечает определённым стандартам качества воды.
Вода, которая не вредит здоровью человека, и отвечает требованиям действующих стандартов качества, называется питьевой водой. В случае необходимости, чтобы вода соответствовала санитарно-эпидемиологическим нормам, её очищают или, официально говоря, «подготавливают» с помощью установок водоподготовки.
Водопроводная вода (проточная вода, вода из городского водопровода, городского водоснабжения) — вода, поступающая для потребления из крана, доставляется в дома коммунальным предприятием по водоснабжению. Стала доступна в городах развитого мира на протяжении последней четверти XIX века, и в общем в середине XX века. Как правило, это вода из речных водозаборов.
Сточные воды — любые воды и атмосферные осадки, отводимые в водоёмы с территорий промышленных предприятий и населённых мест через систему канализации или самотёком, свойства которых оказались ухудшенными в результате деятельности человека.
Вода – это важный источник энергоресурсов.
Смотрите так же:
- КНС
- Локальные очистные сооружения
- Станция биологической очистки
химических реакций и молекул | Биология для специальности I
Результаты обучения
- Определение компонентов простых химических реакций
Все элементы наиболее стабильны, когда их внешняя оболочка заполнена электронами в соответствии с правилом октета. Это связано с тем, что атомам энергетически выгодно находиться в такой конфигурации, и это делает их стабильными. Однако, поскольку не у всех элементов достаточно электронов, чтобы заполнить их самые внешние оболочки, атомы образуют химически связывает с другими атомами, таким образом получая электроны, необходимые им для достижения стабильной электронной конфигурации. Когда два или более атома химически связываются друг с другом, результирующая химическая структура представляет собой молекулу. Знакомая молекула воды H 2 O состоит из двух атомов водорода и одного атома кислорода; они соединяются вместе, образуя воду, как показано на рисунке 1. Атомы могут образовывать молекулы, отдавая, принимая или делясь электронами для заполнения своих внешних оболочек.
Знакомая молекула воды H 2 O состоит из двух атомов водорода и одного атома кислорода; они соединяются вместе, образуя воду, как показано на рисунке 1. Атомы могут образовывать молекулы, отдавая, принимая или делясь электронами для заполнения своих внешних оболочек.
Рисунок 1. Два или более атома могут связываться друг с другом, образуя молекулу. Когда два атома водорода и кислород делят электроны через ковалентные связи, образуется молекула воды.
Химические реакции происходят, когда два или более атома соединяются вместе, образуя молекулы, или когда связанные атомы распадаются. Вещества, используемые в начале химической реакции, называются реагентов (обычно находятся в левой части химического уравнения), а вещества, встречающиеся в конце реакции, известны как реагентов.0009 продукты (обычно находятся в правой части химического уравнения). Между реагентами и продуктами обычно рисуется стрелка, указывающая направление химической реакции; это направление не всегда является «улицей с односторонним движением». Для образования молекулы воды, показанной выше, химическое уравнение будет таким:
Для образования молекулы воды, показанной выше, химическое уравнение будет таким:
2H + O → H 2 O
Примером простой химической реакции является расщепление молекул перекиси водорода, каждая из которых состоит из два атома водорода связаны с двумя атомами кислорода (H 2 О 2 ). Реагент перекись водорода распадается на воду, содержащую один атом кислорода, связанный с двумя атомами водорода (H 2 O), и кислород, который состоит из двух связанных атомов кислорода (O 2 ). В приведенном ниже уравнении реакция включает две молекулы перекиси водорода и две молекулы воды. Это пример сбалансированного химического уравнения , в котором число атомов каждого элемента одинаково в каждой части уравнения. Согласно закону сохранения материи, число атомов до и после химической реакции должно быть одинаковым, так что при нормальных условиях ни один атом не образуется и не разрушается.
2H 2 O 2 (перекись водорода) → 2H 2 O(вода) + O 2 (кислород)
Несмотря на то, что все реагенты и продукты этой реакции являются молекулами (каждый атом остается связаны по крайней мере с одним другим атомом), в этой реакции только перекись водорода и вода являются представителями подкласса молекул, известных как соединений : они содержат атомы более чем одного типа элемента. С другой стороны, молекулярный кислород, как показано на рисунке 2, состоит из двух атомов кислорода, связанных двойной связью, и классифицируется не как соединение, а как элемент.
С другой стороны, молекулярный кислород, как показано на рисунке 2, состоит из двух атомов кислорода, связанных двойной связью, и классифицируется не как соединение, а как элемент.
Рис. 2. Атомы кислорода в молекуле O 2 соединены двойной связью.
Некоторые химические реакции, такие как показанная выше, могут протекать в одном направлении, пока не будут израсходованы все реагенты. Уравнения, описывающие эти реакции, содержат однонаправленную стрелку и являются необратимыми . Обратимые реакции — это реакции, которые могут идти в любом направлении. В обратимых реакциях реагенты превращаются в продукты, но когда концентрация продукта превышает определенный порог (характерный для данной реакции), часть этих продуктов снова превращается в реагенты; в этот момент обозначения продуктов и реагентов меняются местами. Это движение вперед и назад продолжается до тех пор, пока не установится определенный относительный баланс между реагентами и продуктами — состояние, называемое 9.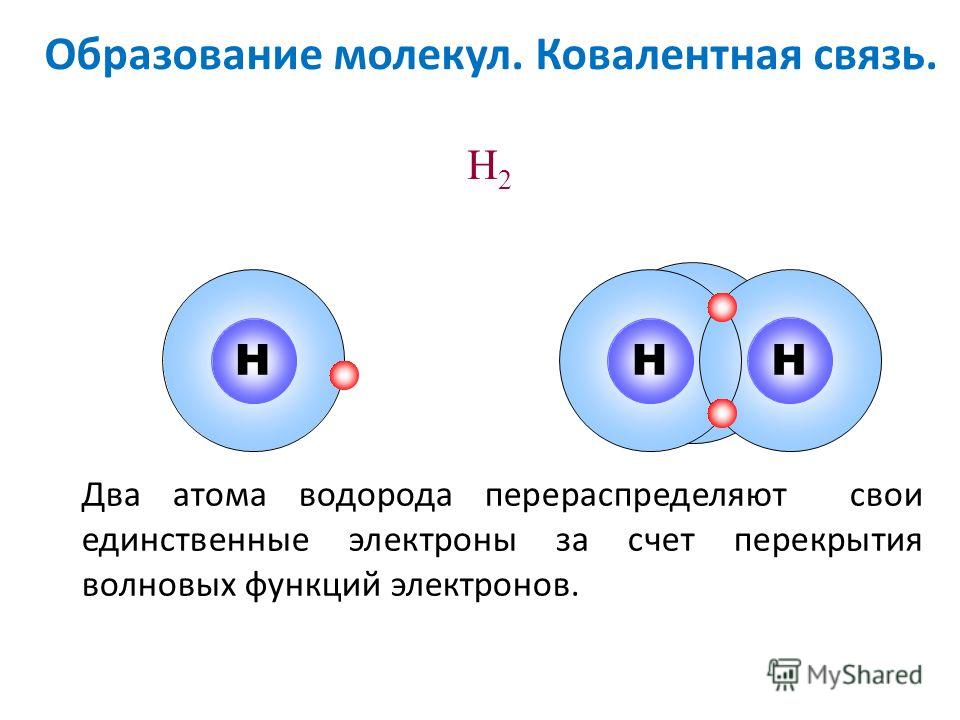 0009 равновесие . Эти ситуации обратимых реакций часто обозначаются химическим уравнением с двунаправленной стрелкой, указывающей как на реагенты, так и на продукты.
0009 равновесие . Эти ситуации обратимых реакций часто обозначаются химическим уравнением с двунаправленной стрелкой, указывающей как на реагенты, так и на продукты.
Например, в крови человека избыточные ионы водорода (H + ) связываются с ионами бикарбоната (HCO 3 – ), образуя равновесное состояние с угольной кислотой (H 2 CO 3 ). Если в эту систему добавить угольную кислоту, часть ее превратится в бикарбонат и ионы водорода.
HCO 3 – + H + ↔ H 2 CO 3
Однако в биологических реакциях равновесие достигается редко, поскольку концентрации обоих реагентов или продуктов постоянно меняются, часто или когда продукт одной реакции является реагентом для другой. Возвращаясь к примеру с избытком ионов водорода в крови, основным направлением реакции будет образование угольной кислоты. Однако угольная кислота также может покидать тело в виде углекислого газа (через выдох) вместо того, чтобы снова превращаться в ион бикарбоната, что приводит к сдвигу реакции вправо по химическому закону, известному как 9. 0009 закон действующих масс . Эти реакции важны для поддержания гомеостаза нашей крови.
0009 закон действующих масс . Эти реакции важны для поддержания гомеостаза нашей крови.
HCO 3 — + H + ↔ H 2 CO 3 ↔ CO 2 + H 2 o
. насколько легко и какой тип химических связей образует конкретный атом. Образование соединений часто визуально описывается химическими уравнениями, которые показывают реагенты, участвующие в химических реакциях с образованием продуктов.
Попробуйте
У вас есть идеи по улучшению этого контента? Мы будем признательны за ваш вклад.
Улучшить эту страницуПодробнее
15.1: Структура воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53837
В своей известной поэме «Сказание о древнем мореплавателе» Сэмюэл Кольридж написал: «Вода, везде вода, ни капли для питья».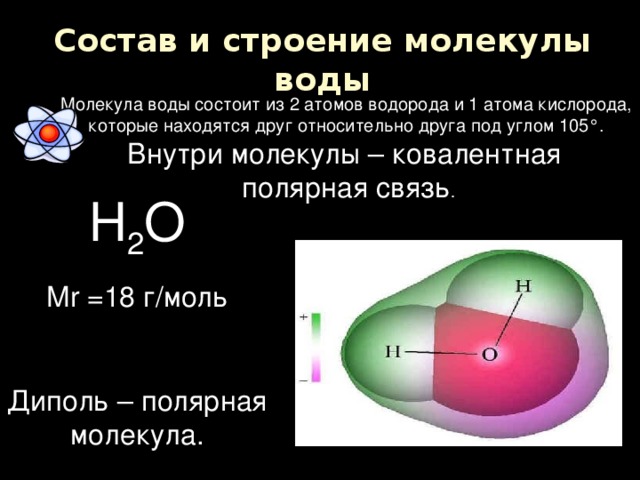 Кольридж говорил о том, что он был в океане, но у него не было воды, потому что он убил альбатроса (очевидно, это принесло несчастье всем на корабле). Около \(75\%\) поверхности Земли покрыто водой. Основной составной частью человеческого тела (более \(60\%\)) является вода. Эта простая молекула играет важную роль во всех видах процессов.
Кольридж говорил о том, что он был в океане, но у него не было воды, потому что он убил альбатроса (очевидно, это принесло несчастье всем на корабле). Около \(75\%\) поверхности Земли покрыто водой. Основной составной частью человеческого тела (более \(60\%\)) является вода. Эта простая молекула играет важную роль во всех видах процессов.
Структура воды
Вода представляет собой простую молекулу, состоящую из одного атома кислорода, связанного с двумя разными атомами водорода. Из-за более высокой электроотрицательности атома кислорода связи являются полярными ковалентными ( полярные связи ). Атом кислорода притягивает общие электроны ковалентных связей в значительно большей степени, чем атомы водорода. В результате атом кислорода приобретает частичный отрицательный заряд \(\left( \delta — \right)\), а каждый атом водорода приобретает частичный положительный заряд \(\left( \delta + \right)\). Молекула принимает изогнутую структуру из-за двух неподеленных пар электронов на атоме кислорода. \text{o}\), что немного меньше идеального \(1093\) гибридная атомная орбиталь.
\text{o}\), что немного меньше идеального \(1093\) гибридная атомная орбиталь.
Изогнутая форма молекулы воды имеет решающее значение, поскольку полярные связи \(\ce{O-H}\) не компенсируют друг друга, а молекула в целом полярна. На рисунке ниже показана чистая полярность молекулы воды. Кислород — отрицательный конец молекулы, а область между атомами водорода — положительный конец молекулы.
Рисунок \(\PageIndex{2}\): Вода является полярной молекулой, так как большая электронная плотность находится вокруг более электроотрицательного атома кислорода. Полярные молекулы притягиваются друг к другу диполь-дипольными силами, так как положительный конец одной молекулы притягивается к отрицательному концу соседней молекулы. В случае воды высокополярные связи \(\ce{O-H}\) приводят к очень малой электронной плотности вокруг атомов водорода. Каждый атом водорода сильно притягивается к неподеленной паре электронов соседнего атома кислорода. Они называются водородными связями и сильнее, чем обычные диполь-дипольные силы.
Каждый атом водорода сильно притягивается к неподеленной паре электронов соседнего атома кислорода. Они называются водородными связями и сильнее, чем обычные диполь-дипольные силы.
Поскольку каждый атом кислорода имеет две неподеленные пары, он может образовывать водородные связи с атомами водорода двух отдельных других молекул. На рисунке ниже показан результат — приблизительно тетраэдрическая геометрия вокруг каждого атома кислорода, состоящая из двух ковалентных связей и двух водородных связей.
Рисунок \(\PageIndex{4}\): В результате наличия двух ковалентных связей и двух водородных связей геометрия вокруг каждого атома кислорода приблизительно тетраэдрическая.Резюме
- Вода представляет собой молекулярное соединение, состоящее из полярных молекул изогнутой формы.
- Атом кислорода приобретает частичный отрицательный заряд, а атом водорода приобретает частичный положительный заряд.

Эта страница под названием 15.1: Структура воды распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Фундамент СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- нет на странице
- Метки
- источник@https://flexbooks.
 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник@https://flexbooks.
Объяснитель урока: Свойства воды
В этом объяснителе мы научимся объяснять свойства полярной молекулы воды.
Вода необходима для выживания всех организмов на нашей планете. Без надлежащего и устойчивого водоснабжения сельское хозяйство и промышленность не могли бы функционировать. Мы каждый день используем воду для приготовления пищи, уборки и питья.
Одна молекула воды состоит из одного атома кислорода и двух атомов водорода.
Между каждым атомом водорода и центральным атомом кислорода существует ковалентная связь. Итак, молекула имеет две химические связи, и угол между этими химическими связями равен 104,5∘. Молекулярная формула воды HO2.
Каждый элемент периодической таблицы имеет свойство, известное как электроотрицательность.
Определение: Электроотрицательность
Электроотрицательность измеряет, насколько сильно атом притягивает электронную пару (или электронные пары) от химической связи.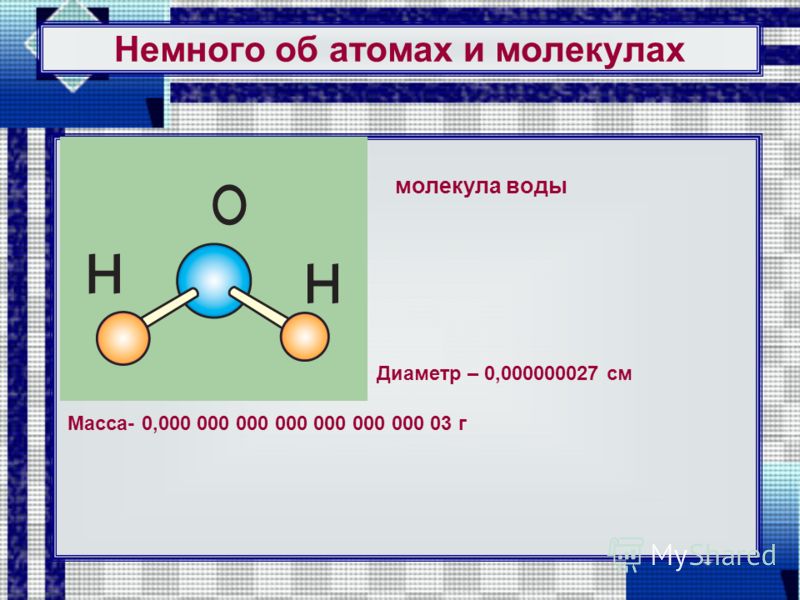
Рассмотрим молекулу воды. Кислород более электроотрицателен, чем водород. Так, электроны ковалентных связей находятся ближе к атому кислорода и дальше от атомов водорода.
Мы можем видеть этот эффект на рис. 2. Оранжевые стрелки показывают, как электроны, образующие каждую ковалентную связь, притягиваются ближе к атому кислорода из-за его более высокая электроотрицательность.
Электроотрицательность кислорода выше, чем у водорода, вызывает отрицательное заряженные электроны располагаются ближе к атому кислорода. Чем ближе электроны, тем на атоме кислорода образуется частичный отрицательный заряд. Частичная оплата (𝛿+,𝛿−) в химии подобны полным зарядам ионов. Однако частичный заряд намного слабее полного заряда.
Ученые называют молекулы полярными, если они имеют постоянные частичные заряды. Есть некоторые исключения из этого, но нам не нужно исследовать это в этом объяснителе; мы можем сказать, что вода является полярной молекулой.
Определение: Полярная молекула
Полярная молекула представляет собой ковалентную молекулу, в которой разница в электроотрицательности между элементами в молекуле относительно велика. В полярной молекуле один конец молекулы слегка положительный, а другой конец слегка отрицательный.
Пример 1. Использование электроотрицательности для объяснения того, почему вода является полярной молекулой
Одна молекула воды состоит из двух атомов водорода и одного атома кислорода. Какое из следующих утверждений объясняет, почему вода полярная молекула?
- Атомы водорода намного меньше атомов кислорода.
- Существует большая разница в электроотрицательности между атомами водорода и атомами кислорода.
- Между молекулами воды существуют межмолекулярные силы, известные как водородные связи.
- Электроотрицательность атомов водорода и атомов кислорода очень похожи.
- В каждой молекуле воды больше атомов водорода, чем атомов кислорода.

Ответ
Полярная молекула – это ковалентная молекула со значительной разницей в электроотрицательности между ее элементами. Эта разница в электроотрицательности означает, что молекула имеет постоянные частичные заряды.
Кислород имеет гораздо более высокую электроотрицательность, чем водород. Пары связывающих электронов от двух ковалентных связей притягиваются ближе к атому кислорода.
Если мы посмотрим на ответы, то увидим, что B — правильный ответ; существует большая разница в электроотрицательности между атомами водорода и атомами кислорода.
Пример 2. Определение частичных зарядов молекулы воды
Кислород более электроотрицателен, чем водород, и притягивает связь электроны в молекуле воды ближе к себе. 𝛿+ и 𝛿- используются для обозначения частичных зарядов в химии. На какой схеме правильно показаны парциальные заряды молекулы воды?
Ответ
Сила, с которой атом притягивает пару электронов, используемых для образования химической связи, измеряется электроотрицательностью. Поскольку кислород имеет более высокое значение электроотрицательности, чем водород, электроны, образующие ковалентные связи, притягиваются ближе к атому кислорода и удаляются от двух атомов водорода.
Поскольку кислород имеет более высокое значение электроотрицательности, чем водород, электроны, образующие ковалентные связи, притягиваются ближе к атому кислорода и удаляются от двух атомов водорода.
Следовательно, атом кислорода имеет частичный отрицательный заряд (𝛿-), и в результате два атома водорода имеют частичный положительный заряд (𝛿+).
Мы можем использовать эту информацию, чтобы определить, что правильный ответ — A.
Другой распространенной полярной молекулой является аммиак (Nh4). Аммиак представляет собой простую молекулу, состоящую из одного атома азота и трех атомы водорода. Как и кислород в молекуле воды, азот гораздо более электроотрицательный. чем водород, что приводит к частичным зарядам внутри молекулы.
Возвращаясь к нашему рассмотрению воды, постоянные частичные заряды в каждой молекуле воды вызывают слабое электростатическое притяжение между частичными зарядами соседних молекул воды. Эти притяжения также можно назвать межмолекулярными силами.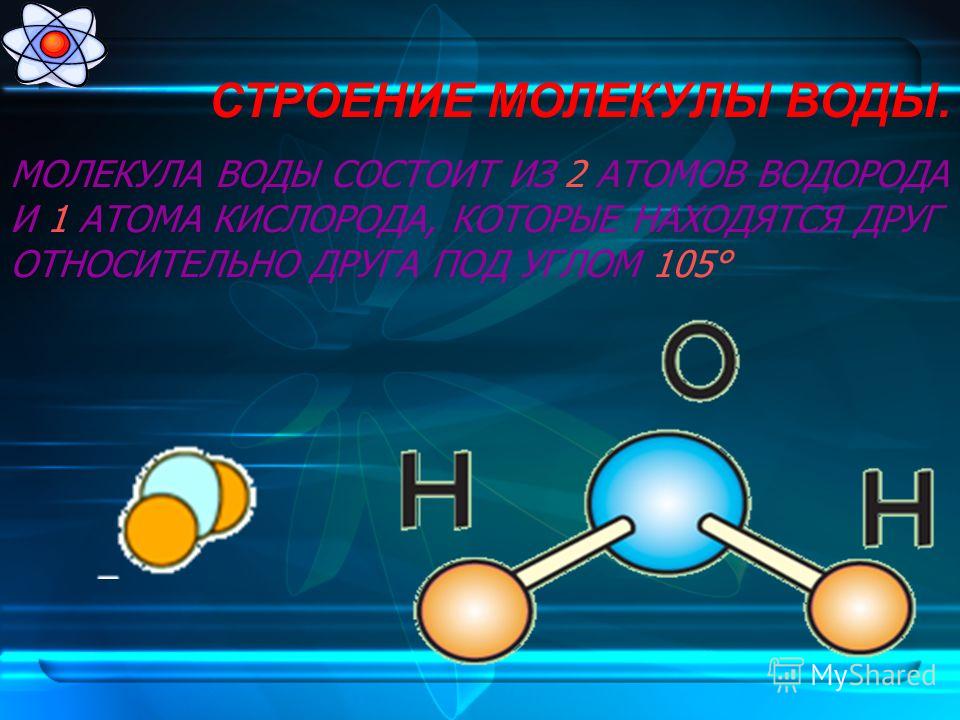
Мы называем это слабым электростатическим притяжением между молекулами воды водородными связями. Хотя мы используем слово связь , это не настоящая химическая связь, и лучше всего рассматривать ее как взаимодействие между молекулами.
Водородные связи слабее ковалентных, но чрезвычайно важны при объяснении и описании физических свойств воды.
Если бы вы попытались представить себе миллиарды и миллиарды молекул воды, которые существуют в стакане воды, вы могли бы начать видеть, как водородные связи образуются и разрываются непрерывно, когда молекулы вращаются и перемещаются, сталкиваясь друг с другом и с контейнером. Этот Идея показана на рис. 5, где водородные связи показаны синими пунктирными линиями.
Химическая связь и силы межмолекулярного притяжения, о которых мы только что говорили, придают воде некоторые очень уникальные свойства. Например, на рис. 6 показаны примеры воды во всех трех состояниях: в виде жидкости в океане, в виде твердого льда в айсберге и, хотя мы этого не видим, в виде водяного пара в воздухе и облаках.
Вода — полярная молекула; как таковые, другие полярные соединения могут растворяться в воде, образуя растворы. По этой причине мы можем описать воду как полярный растворитель.
Такие вещества, как сахар, являются полярными веществами и растворяются в воде. Кроме того, ионные вещества, такие как соль, содержащие заряженные ионы, растворяются в полярных веществах. Нам нужно только подумать о соли в океанах или в чашке чая, чтобы понять, что мы имели непосредственный опыт этих примеров.
Неполярное вещество – это вещество, не содержащее частичных зарядов, поскольку разница в электроотрицательности между элементами атомов в молекулах очень мала.
Определение: неполярная молекула
Неполярная молекула представляет собой ковалентную молекулу, в которой разница в электроотрицательности между элементами в молекуле очень мала.
Однако неполярные растворители, такие как растительное масло, не растворяются в воде, и при добавлении в воду
они разделяются на два слоя.
Вода является отличным полярным растворителем для большинства ионных веществ, таких как соль, и некоторых ковалентных соединений, таких как сахар, которые образуют водородные связи с молекулами воды.
Пример 3: Наименование растворителей, растворяющих ионные вещества
Как называется растворитель, такой как вода, способный растворять ионные вещества, такие как соль?
- Полярный растворитель
- Неполярный растворитель
- Электростатический растворитель
- Ионизированный растворитель
- Растворитель водорода
Ответ
Ионные вещества, такие как хлорид натрия и другие соли Ионы имеют положительный и отрицательный заряд. Когда заряд распределяется таким образом в химии, это называется полярностью.
Некоторые другие вещества без ионного заряда все еще имеют частичный заряд и также называются полярными. Например, вода представляет собой полярную молекулу.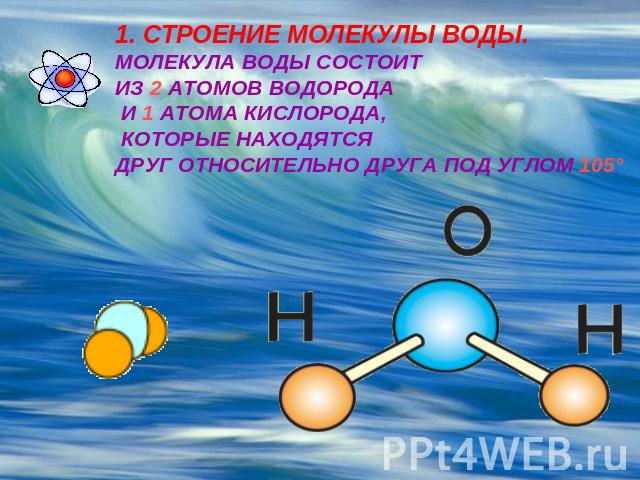
Мы можем использовать стакан с водой, чтобы растворить столовую ложку хлорида натрия. Вещество, которое может растворять полярные вещества, такие как ионные соли, известно как полярный растворитель, поэтому правильный ответ — А, полярный растворитель.
Водородные связи между молекулами воды также существенно влияют на температуру кипения и плавления воды. вода. Давайте на минутку сравним воду с другим соединением: сероводородом (HS2). Водород сульфид очень похож на воду; он имеет атом серы вместо атома кислорода.
Сера находится в 16-й группе периодической таблицы, как и кислород, поэтому можно предположить, что точки плавления и кипения очень похожи. Однако, как показано в таблице 1, температуры плавления и кипения воды и сероводорода сильно различаются!
Таблица 1 : Температура плавления и кипения воды и сероводорода.
| Соединение | Температура плавления (∘C) | Температура кипения (∘C) |
|---|---|---|
| HO2 | 0 | 100 |
| HS2 | −82 | −60 |
Из приведенной выше таблицы видно, что для разделения молекул воды при плавлении и кипении требуется больше энергии. Эта дополнительная энергия необходима для преодоления водородных связей, существующих между отдельными молекулами воды. Молекулы сероводорода не могут образовывать водородные связи, так как разница в электроотрицательности между серой и водородом недостаточно велика.
Эта дополнительная энергия необходима для преодоления водородных связей, существующих между отдельными молекулами воды. Молекулы сероводорода не могут образовывать водородные связи, так как разница в электроотрицательности между серой и водородом недостаточно велика.
Еще одной замечательной характеристикой воды является ее плотность в твердом состоянии, известном как лед. Большинство веществ плотнее, когда они находятся в твердом состоянии; однако вода менее плотная. Когда жидкая вода остывает до температуры ниже 4∘C, молекулы воды образуют большие шестиугольные кристаллы из-за более длинных водородных связей между отдельными молекулами. Когда жидкость замерзает при 0∘C, эти крупные гексагональные кристаллы полностью сформированы, а более длинные водородные связи создают относительно большое пространство между молекулами.
Мы знаем, что плотность — это способ выразить количество массы в данном объеме,
а когда вода принимает форму твердого льда, лед имеет меньшую массу, чем тот же объем жидкой воды;
следовательно, вода становится менее плотной по мере замерзания и превращается в лед. Мы можем видеть более длинные водородные связи
и шестиугольное расположение молекул воды во льду на рисунке ниже.
Мы можем видеть более длинные водородные связи
и шестиугольное расположение молекул воды во льду на рисунке ниже.
Пример 4: сопоставление состояния вещества воды с ее структурным расположением
На рисунке показаны молекулы воды в однородном фиксированном гексагональном расположении, созданном водородными связями.
В каком состоянии вещества вы ожидаете обнаружить воду, если она находится в таком структурном расположении?
- Лед (твердый)
- Вода (жидкая)
- Пар (газ)
Ответ
Молекулы воды образуют большие шестиугольные кристаллы, когда жидкая вода замерзает при 0∘C. Эти шестиугольные кристаллы образуются из-за существования водородных связей между отдельными молекулами.
В жидком состоянии отдельные молекулы воды могут свободно двигаться и вращаться с помощью водородных связей, постоянно образуя и разрывая связи между различными молекулами.
В газообразном состоянии молекулы водяного пара можно рассматривать как независимые единицы с небольшим взаимодействием.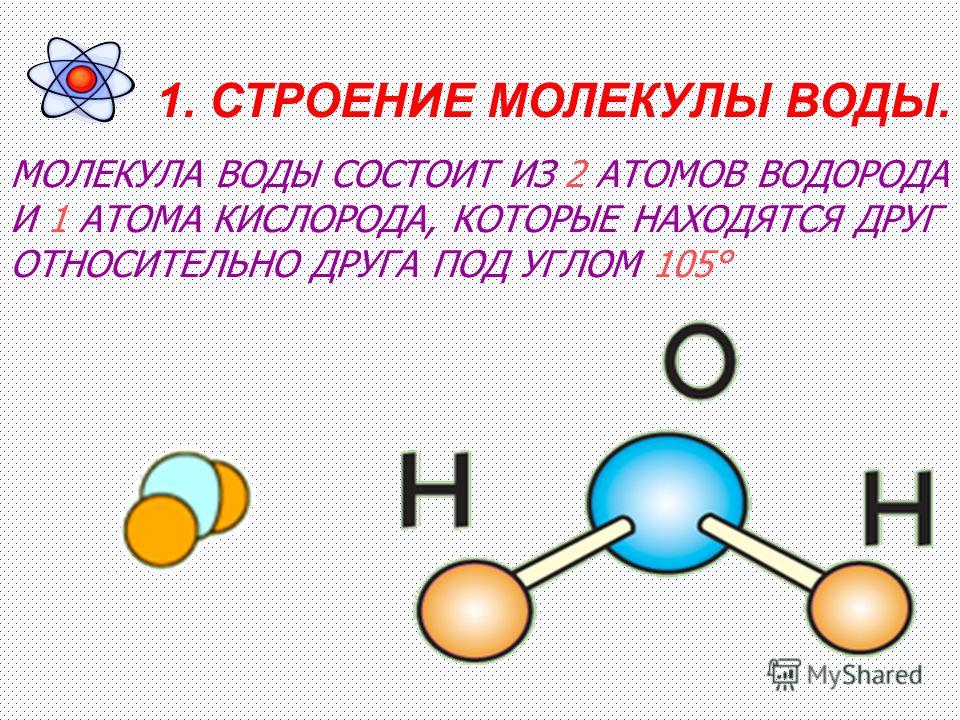
Если мы сравним эти три описания с диаграммой выше, мы увидим, что правильный ответ — A, лед (твердый).
Это уменьшение плотности при замерзании воды объясняет расширение льда при замерзании воды. При замерзании воды масса воды конечно не меняется, но объем увеличивается, и, следовательно, плотность должна уменьшиться. Расширение льда при замерзании воды является причиной для явлений физического выветривания, таких как замораживание-оттаивание, показанное на рисунке 9.. Это может также будьте свидетелями дома, когда бутылки с напитками взрываются в морозильной камере!
Рисунок 10 : Вода заполняет трещины в скале и замерзает, а расширение льда разрушает скалу. Рисунок 11 : Напитки замерзают и расширяются в морозильной камере, разрывая контейнеры.Пример 5: Объяснение того, почему лед плавает на воде
Какая из следующих последовательностей утверждений правильно описывает, почему лед плавает на воде?
- 1
- 5
- 2
- 4
- 3
Ответ
Итак, мы можем начать отвечать на этот вопрос, заявив, что когда вода замерзает, она становится льдом, поэтому мы знаем, что ответ C неверен.
Благодаря водородным связям, существующим между молекулами воды, вода обладает некоторыми уникальными физическими свойствами. Когда вода замерзает и превращается в лед, образуются более длинные водородные связи, поскольку молекулы воды образуют шестиугольные кристаллы. Эти шестиугольные кристаллы имеют относительно большое пространство между собой из-за более длинных водородных связей и заставляют воду расширяться.
Теперь мы видим, что ответ E также неверен.
При замерзании воды количество воды и, следовательно, ее масса не изменяются, но поскольку вода при замерзании расширяется и становится льдом, ее объем увеличивается. Имея эту информацию, мы теперь можем исключить ответ D.
Если какое-либо вещество трансформируется, чтобы иметь больший объем, но ту же массу, то плотность уменьшится. В случае воды это делает лед менее плотным, поэтому правильный ответ — A.
Морская вода содержит соль, и эта соль влияет на ее плотность. В районах океана, где концентрация соли ниже, например, на Северном и Южном полюсах, плавать труднее, поскольку труднее создавать силу против менее плотной жидкости. Напротив, есть места, такие как Мертвое море в Западной Азии, где концентрация соли настолько высока, что люди могут плавать практически без усилий!
Напротив, есть места, такие как Мертвое море в Западной Азии, где концентрация соли настолько высока, что люди могут плавать практически без усилий!
Мы начнем завершать это объяснение с рассмотрения некоторых химических свойств воды. Вода является нейтральным соединение и не проявляет никаких кислотных или основных свойств. Мы можем проверить это с помощью лакмусовой бумажки. Красный или синий лакмус не меняет цвет, если он находится в воде.
Мы можем разложить воду на водород и кислород, используя процесс, известный как электролиз. Во время электролиза мы используем электричество для разрыва связей в химических соединениях. Когда мы явно проводим электролиз воды, мы используем уникальное научное оборудование, известное как вольтаметр Хофмана.
Вольтаметр Хофмана наполнен водой, которую мы подкислили, добавив небольшое количество разбавленной серной кислоты. Добавление кислоты улучшает его проводимость. К вольтаметру присоединяют блок питания, и через подкисленную воду пропускают постоянный ток. Затем вода разделяется в соответствии с
следующее химическое уравнение:
2HO()2H()+O()222lggводаводородкислородэлектролиз
К вольтаметру присоединяют блок питания, и через подкисленную воду пропускают постоянный ток. Затем вода разделяется в соответствии с
следующее химическое уравнение:
2HO()2H()+O()222lggводаводородкислородэлектролиз
На рисунке 14 ниже мы видим вольтаметр Гофмана. Обратите внимание, что газообразного водорода было произведено в два раза больше, чем газообразного кислорода.
Давайте внимательно посмотрим на атомы в этой химической реакции. Нам легко понять, почему мы получаем в два раза больше газообразного водорода, чем кислорода. произведенный газ. На рис. 15 показано, как атомы в двух молекулах воды перестраиваются, образуя две молекулы газообразного водорода и одну молекулу газообразного кислорода. при электролизе воды.
Вода — удивительная молекула со многими необычными характеристиками. Многие из его свойств обусловлены тем, что он является полярной молекулой и существованием водородных связей между молекулами.
Подведем итог тому, что мы узнали о свойствах воды.
Ключевые моменты
- Вода является жизненно важным ресурсом.
- Один атом кислорода и два атома водорода составляют одну молекулу воды.
- Кислород более электроотрицателен, чем водород.
- Полярная молекула представляет собой ковалентную молекулу, в которой разница в электроотрицательности между элементами в молекуле относительно велика.
- На молекуле воды существуют постоянные частичные заряды, что делает молекулу полярной.
- Между молекулами воды существует электростатическое притяжение, известное как водородные связи.
- Вода может существовать в виде жидкости, куска твердого льда и газообразного пара.
- Вода является полярным растворителем, и другие полярные соединения могут растворяться в воде и образовывать растворы.
- Вода имеет высокие температуры плавления и кипения из-за водородных связей между молекулами воды.
- Вода образует шестиугольные кристаллы, когда замерзает и становится льдом.

- Лед менее плотный, чем вода.
- Вода оказывает нейтральное воздействие на синюю и красную лакмусовые бумажки.
- Электролиз может быть использован для разложения воды на кислород и водород.
- Вольтаметр Хофмана используется для электролиза подкисленной воды.
- При электролизе подкисленной воды образуется в два раза больше газообразного водорода, чем газообразного кислорода.
ДК Наука: Молекулы
- / Наука
- / E.энциклопедия Наука
- / Материалы и материалы вещества и материалы
CITE
- Разнообразие молекул
- Простая молекула
- Электроэнергетические молекулы
- Связывание
- Изменение молекул
- . Связывание . Arte Arte. образуют более крупные частицы, называемые молекулами. Они могут соединяться с атомами одного и того же элемента или с атомами разных элементов. Вещества, молекулы которых содержат атомы разных типов, называются соединениями.
Одна пара связана с атомом кислорода.
Две пары, связанные с атомом кислорода как внешние электроны.
Две пары, образующие две ковалентные связи O-H.

В своем жидком состоянии молекулы воды постоянно движутся мимо друг друга, поскольку водородные связи постоянно разрываются и рекомбинируют.
В состоянии газ молекулы воды обладают более высокой кинетической энергией, вызывая разрыв водородных связей.

В своем твердом состоянии молекулы воды расширяются, потому что водородные связи раздвигают молекулы воды. В то же время водородные связи удерживают молекулы воды вместе, образуя кристаллическую структуру. Это дает льду (твердой воде) более низкую плотность по сравнению с жидкой водой.
- Водородная связь — это связь, которая образуется между частично положительно заряженным атомом водорода и электроотрицательным атомом.
- Вода представляет собой полярную молекулу : ее атомы кислорода имеют частичный отрицательный (δ-) заряд, а атомы водорода имеют частичный положительный (δ+) заряд.
- Эти частичные заряды позволяют образовать водородных связей между молекулой воды и соседними молекулами воды или другими молекулами с отрицательным зарядом.
- Благодаря водородным связям молекулы воды обладают свойствами, важными для поддержания жизни.
- Эти свойства включают растворяющую способность, замедление температуры, когезию, поверхностное натяжение, адгезию и капиллярность.

- Факультет
- Неорганическая химия
Чжуан Сюй получил стипендию PPG для выпускников-исследователей
Один из пяти студентов, получивших стипендию PPG для аспирантов лаборатории исследования материалов (MRL) для проведения передовых исследований, Чжуан Сюй сосредоточится на изучении сборки Путь полупроводниковых полимеров.

 Химические реакции могут ИЗМЕНЯТЬ МОЛЕКУЛЫ, и когда это происходит, образуются новые молекулы и, следовательно, новые соединения.
Химические реакции могут ИЗМЕНЯТЬ МОЛЕКУЛЫ, и когда это происходит, образуются новые молекулы и, следовательно, новые соединения.РАЗНООБРАЗИЕ МОЛЕКУЛ
Молекулы могут быть простыми или сложными. Они могут состоять даже из одного атома. Элемент аргон представляет собой молекулу с одним атомом. Другие молекулы могут состоять из двух атомов одного и того же элемента. Молекула кислорода состоит из двух атомов кислорода, связанных вместе. Однако при определенных обстоятельствах три атома кислорода соединяются вместе, образуя молекулу, называемую озоном.
ПРОСТАЯ МОЛЕКУЛА
Молекулы воды (H 2 0) очень просты. Они состоят из двух атомов водорода (H), связанных с одним атомом кислорода (O). Все молекулы воды одинаковы, но отличаются от молекул любого другого вещества. Молекула воды – это наименьшая возможная частица воды. Вы можете разбить его на более мелкие части, но они уже не будут водой. Символы, которые ученые используют для обозначения молекул, называются химическими формулами.
СЛОЖНАЯ МОЛЕКУЛА
Некоторые молекулы, такие как пластик в трубке, содержат сотни или даже тысячи атомов углерода, водорода и хлора, соединенных вместе в длинные извилистые цепочки. Такие сложные молекулы называются полимерами. Они возможны, потому что атомы углерода способны образовывать очень прочные связи с другими атомами углерода. Большинство молекул, из которых состоят живые существа, состоят из сложных полимеров.
СВЯЗЬ
Когда атомы соединяются вместе, образуя молекулы, они удерживаются вместе химическими связями. Эти связи образуются в результате обмена или обмена электронами между атомами. Только электроны в самой внешней оболочке когда-либо участвуют в соединении. Различные атомы используют эти электроны для образования одного из трех различных типов связи: ионной связи, ковалентной связи или металлической связи.
РАЗЛИЧНЫЕ ВИДЫ СВЯЗЕЙ МЕЖДУ АТОМАМИ
ИОННЫЕ СВЯЗИ
В ионных связях электроны передаются от одного атома к другому. Когда натрий и хлор объединяются с образованием хлорида натрия (соли), натрий теряет электрон и становится положительно заряженным; хлор принимает этот электрон и становится отрицательно заряженным. Ионные связи трудно разорвать. Ионные соединения обычно представляют собой твердые вещества с высокой температурой плавления.
Когда натрий и хлор объединяются с образованием хлорида натрия (соли), натрий теряет электрон и становится положительно заряженным; хлор принимает этот электрон и становится отрицательно заряженным. Ионные связи трудно разорвать. Ионные соединения обычно представляют собой твердые вещества с высокой температурой плавления.
КОВАЛЕНТНЫЕ СВЯЗИ
В ковалентной связи электроны распределяются между двумя атомами. Когда два атома кислорода соединяются вместе, образуя молекулу кислорода, они разделяют четыре электрона — по два от каждого атома кислорода. Другими примерами ковалентной связи являются вода (H 2 O) и двуокись углерода (CO 2 ). Ковалентные соединения обычно представляют собой жидкости или газы с низкой температурой плавления.
МЕТАЛЛИЧЕСКИЕ СВЯЗИ
Атомы металлов связаны друг с другом металлическими связями. В этом типе связи все атомы теряют электроны, которые плавают в общем пуле. Электроны в этом бассейне могут свободно перемещаться, поэтому металлы могут так хорошо передавать тепло или электричество. Если одна часть металла нагревается, электроны быстро переносят тепло к другим частям.
Если одна часть металла нагревается, электроны быстро переносят тепло к другим частям.
МЕНЯЮЩИЕСЯ МОЛЕКУЛЫ
Молекулы вокруг вас изменяются и перестраивают свои атомы в химических реакциях, образуя новые молекулы и новые соединения. Когда вы вдыхаете кислород, он претерпевает химические изменения внутри вашего тела и образует новое соединение, углекислый газ, который вы выдыхаете. Катализаторы — это особые типы молекул, которые ускоряют химические реакции, но на самом деле не изменяются сами по себе. Они используются, например, в каталитических нейтрализаторах автомобилей.
SFX REACTION
Взрыв со спецэффектами — это химическая реакция, которая высвобождает энергию. Специалисты-пиротехники хотят, чтобы каждый взрыв был уникальным, поэтому они используют разные типы и количество взрывчатых веществ. В каждой химической реакции некоторые связи между атомами разрываются и образуются новые. Энергия необходима, чтобы разорвать связь, но энергия высвобождается, когда связь образуется. В зависимости от количества и типа разорванных и образовавшихся связей реакция может потреблять или отдавать энергию.
В зависимости от количества и типа разорванных и образовавшихся связей реакция может потреблять или отдавать энергию.
КАТАЛИТИЧЕСКИЙ НЕЙТРАЛИЗАТОР
Когда автомобильный двигатель работает на бензине, он выделяет вредные газы. Автомобили, оснащенные каталитическим нейтрализатором, превращают вредные газы в более безопасные. При попадании в каталитический нейтрализатор газы образуют временные связи с поверхностью катализатора. Это приводит их в тесный контакт друг с другом и позволяет образовываться новым, более безопасным газам.
ФЕРМЕНТЫ НА КУХНЕ
Ферменты — это природные катализаторы. Например, ферменты в дрожжах вызывают подъем теста для хлеба. Когда дрожжи смешиваются с теплой водой и сахаром, они начинают расти и образуются пузырьки углекислого газа. Когда смесь дрожжей добавляется к муке и воде, чтобы сделать тесто, тесто поднимается. Нагрев выпекает хлеб и убивает дрожжи. Ученые используют химические уравнения, чтобы показать, как молекулы изменяются в результате химической реакции.
FIND OUT MORE
| Atoms |
| Chemical Reactions |
| Elements |
Copyright © 2007 Dorling Kindersley
DK Science: Chemical Reactions
DK Science: Periodic Table
DK Science : Matter & Materials
Водородное связывание в воде: Importanec & Effects
Вы когда-нибудь задумывались, почему вода прилипает к вашим волосам после душа? Или как вода поднимается вверх по корневой системе растений? Или почему летние и зимние температуры в прибрежных районах кажутся менее суровыми?
Вода — одно из самых распространенных и важных веществ на Земле. Его многочисленные уникальные свойства позволяют ему поддерживать жизнь от клеточного уровня до экосистемы. Многие уникальные свойства воды обусловлены полярностью ее молекул, особенно их способностью образовывать водородные связи друг с другом и с другими молекулами.
Здесь мы дадим определение водородной связи, остановимся на ее механизмах и обсудим различные свойства воды, придаваемые водородной связью.
Что такое водородная связь?Водородная связь — это связь, которая образуется между частично положительно заряженным атомом водорода и электроотрицательным атомом, обычно фтором (F), азотом (N) или кислородом (O). Примеры того, где можно найти водородные связи, включают молекулы воды, аминокислоты в белковых молекулах и азотистые основания, которые образуют нуклеотиды в двух цепях ДНК.
Как образуются водородные связи?Когда атомы имеют общие валентные электроны, a 9Образуется ковалентная связь 0009 . Ковалентные связи бывают либо полярными , либо неполярными в зависимости от электроотрицательности атомов (способность атома притягивать электроны, когда он находится в связи).
Из-за неравного распределения электронов полярная молекула имеет частично положительную область с одной стороны и частично отрицательную область с другой. Из-за этой полярности атом водорода с полярной ковалентной связью с электроотрицательным атомом (например, азота, фтора и кислорода) притягивается к электроотрицательным ионам или отрицательно заряженным атомам других молекул. Это притяжение приводит к образованию водородной связи.
Из-за этой полярности атом водорода с полярной ковалентной связью с электроотрицательным атомом (например, азота, фтора и кислорода) притягивается к электроотрицательным ионам или отрицательно заряженным атомам других молекул. Это притяжение приводит к образованию водородной связи.
Водородные связи не являются «настоящими» связями в том смысле, в каком таковыми являются ковалентные, ионные и металлические связи. Ковалентные, ионные и металлические связи представляют собой внутримолекулярное электростатическое притяжение, то есть они удерживают атомы вместе внутри молекулы. С другой стороны, водородные связи представляют собой межмолекулярные силы, то есть они возникают между молекулами. Хотя притяжение водородных связей слабее, чем реальные ионные или ковалентные взаимодействия, они достаточно сильны, чтобы создавать существенные свойства, которые мы обсудим позже.
Что такое водородная связь в воде?
Вода состоит из двух атомов водорода, присоединенных ковалентными связями к одному атому кислорода (H-O-H). Вода представляет собой полярную молекулу , потому что ее атомы водорода и кислорода неравномерно делят электроны из-за различий в электроотрицательности .
Вода представляет собой полярную молекулу , потому что ее атомы водорода и кислорода неравномерно делят электроны из-за различий в электроотрицательности .
Каждый атом водорода содержит ядро, состоящее из одного положительно заряженного протона с одним отрицательно заряженным электроном, вращающимся вокруг ядра. С другой стороны, каждый атом кислорода содержит ядро, состоящее из восьми положительно заряженных протонов и восьми незаряженных нейтронов, а вокруг ядра вращаются восемь отрицательно заряженных электронов.
Атом кислорода имеет более высокую электроотрицательность, чем атом водорода, поэтому электроны притягиваются к кислороду и отталкиваются от водорода. Когда образуется молекула воды, десять электронов объединяются в пары на пять орбиталей, распределенных следующим образом:
При образовании молекулы воды остаются две неподеленные пары. Две неподеленные пары связывают себя с атомом кислорода. В результате атомы кислорода имеют частичный отрицательный (δ-) заряд, а атомы водорода имеют частичный положительный (δ+) заряд. Это означает, что молекула воды не имеет суммарного заряда, но атомы водорода и кислорода имеют частичный заряд.
Поскольку атомы водорода в молекуле воды частично заряжены положительно, они притягиваются к частично отрицательно заряженным атомам кислорода в близлежащих молекулах воды, что позволяет образовать водородных связей между близлежащими молекулами воды или другими молекулами с отрицательным зарядом (рис. 1). ). Между молекулами воды постоянно возникают водородные связи. Хотя отдельные водородные связи имеют тенденцию быть слабыми, они оказывают значительное влияние, когда образуются в больших количествах, что обычно имеет место для воды и органических полимеров.
Какое количество водородных связей может образоваться в молекулах воды? Молекулы воды содержат две неподеленные пары и два атома водорода, все из которых связаны с сильно электроотрицательным атомом кислорода. Это означает, что каждая молекула воды может образовать до четырех связей (две, где он является принимающим концом н-связи, и две, когда он является дающим в н-связи).
Это означает, что каждая молекула воды может образовать до четырех связей (две, где он является принимающим концом н-связи, и две, когда он является дающим в н-связи).
Однако, поскольку водородные связи слабее ковалентных, они легко образуются, разрываются и восстанавливаются в жидкой воде. В результате точное количество водородных связей, создаваемых на молекулу, варьируется.
Каковы эффекты и последствия образования водородных связей в воде?Водородная связь в воде придает несколько свойств, важных для поддержания жизни. В следующем разделе мы поговорим о некоторых из этих свойств.
Свойство растворителя Молекулы воды являются превосходными растворителями. Полярные молекулы — это гидрофильные («водолюбивые») вещества, то есть они взаимодействуют с водой и легко растворяются в ней. Это связано с тем, что отрицательный ион растворенного вещества будет притягивать положительно заряженную часть молекулы воды и наоборот, вызывая растворение ионов.
Хлорид натрия (NaCl), также известный как поваренная соль, является примером полярной молекулы. Он легко растворяется в воде, так как частично отрицательный атом кислорода молекулы воды притягивается к частично положительным ионам Na+. С другой стороны, частично положительные атомы водорода притягиваются к частично отрицательным ионам Cl-. Это заставляет молекулу NaCl растворяться в воде.
Замедление температурыВодородные связи в молекулах воды реагируют на изменения температуры, придавая воде ее уникальные характеристики в твердом, жидком и газообразном состояниях.
Водородные связи в молекулах воды придают ей высокую удельную теплоемкость. Удельная теплоемкость относится к количеству теплоты, которое должно быть поглощено или потеряно одним граммом вещества, чтобы его температура изменилась на один градус Цельсия. Высокая удельная теплоемкость воды означает, что для изменения температуры требуется много энергии. Высокая удельная теплоемкость воды позволяет ей поддерживать стабильную температуру, необходимую для поддержания жизни на Земле.
Точно так же водородная связь придает воде высокий уровень h есть испарение , количество энергии, необходимое для превращения жидкого вещества в газообразное. Фактически, для превращения одного грамма воды в газ требуется 586 кал тепловой энергии. Это связано с тем, что водородные связи должны быть разорваны, чтобы жидкая вода могла перейти в газообразное состояние. Как только вода достигает точки кипения (100 ° C или 212 ° F), водородные связи в воде разрываются, в результате чего вода испаряется.
Фактически, для превращения одного грамма воды в газ требуется 586 кал тепловой энергии. Это связано с тем, что водородные связи должны быть разорваны, чтобы жидкая вода могла перейти в газообразное состояние. Как только вода достигает точки кипения (100 ° C или 212 ° F), водородные связи в воде разрываются, в результате чего вода испаряется.
Водородная связь заставляет молекулы воды оставаться близко друг к другу, что делает воду очень когезионным веществом. Это то, что делает воду «липкой».
Когезия относится к притяжению сходных молекул, в данном случае воды, удерживающих вещество вместе. Вода слипается, образуя «капли» из-за своего когезионного свойства. Сплоченность приводит к еще одному свойству воды: поверхностному натяжению.
Поверхностное натяжение Поверхностное натяжение — это свойство, позволяющее веществу сопротивляться натяжению и предотвращать разрыв. Поверхностное натяжение, создаваемое водородными связями в воде, похоже на то, как люди образуют человеческую цепь, чтобы другие не смогли вырваться из их соединенных рук. Как сцепление воды с самой собой, так и сильное прилипание воды к поверхности, которой она касается, заставляют молекулы воды, находящиеся близко к поверхности, двигаться вниз и в сторону.
Как сцепление воды с самой собой, так и сильное прилипание воды к поверхности, которой она касается, заставляют молекулы воды, находящиеся близко к поверхности, двигаться вниз и в сторону.
С другой стороны, подтягивающий воздух воздействует на поверхность воды с небольшой силой. В результате между молекулами воды на поверхности создается чистая сила притяжения, в результате чего получается очень плоский тонкий слой молекул. Молекулы воды на поверхности прилипают друг к другу, предотвращая погружение предметов, лежащих на поверхности. Поверхностное натяжение — вот почему канцелярская скрепка, которую вы осторожно кладете на поверхность воды, может плавать. В этом случае тяжелый предмет или предмет, который вы не положили на поверхность воды осторожно, может нарушить поверхностное натяжение, заставив его утонуть.
Адгезия Адгезия относится к притяжению между различными молекулами. Вода очень клейкая; он придерживается широкого круга различных вещей. Вода прилипает к другим вещам по той же причине, по которой она прилипает к самой себе, — она полярна; таким образом, он притягивается к заряженным веществам. Вода прилипает к различным поверхностям, включая растения, посуду и даже ваши волосы, когда они мокрые после душа. В каждом из этих сценариев адгезия является причиной того, что вода прилипает или смачивает что-либо.
Вода прилипает к другим вещам по той же причине, по которой она прилипает к самой себе, — она полярна; таким образом, он притягивается к заряженным веществам. Вода прилипает к различным поверхностям, включая растения, посуду и даже ваши волосы, когда они мокрые после душа. В каждом из этих сценариев адгезия является причиной того, что вода прилипает или смачивает что-либо.
Капиллярность (или капиллярное действие) — это тенденция воды подниматься вверх по поверхности против силы тяжести из-за ее адгезионных свойств. Эта тенденция связана с тем, что молекулы воды больше притягиваются к таким поверхностям, чем другие молекулы воды. Если вы раньше опускали бумажное полотенце в воду, вы могли заметить, что вода «поднимается» вверх по бумажному полотенцу против силы тяжести; это происходит благодаря капиллярности.
Точно так же мы можем наблюдать капиллярность в ткани, почве и других поверхностях, где есть небольшие пространства, через которые могут двигаться жидкости.
В предыдущем разделе мы обсуждали свойства воды. Как эти биохимические и физические процессы необходимы для поддержания жизни на Земле? Давайте обсудим некоторые конкретные примеры.
Вода, будучи отличным растворителем, может растворять широкий спектр соединений. Поскольку наиболее важные биохимические процессы происходят в водной среде внутри клеток, это свойство воды имеет решающее значение для обеспечения протекания этих процессов. Высокая удельная теплоемкость воды позволяет регулировать температуру больших водоемов. Например, в прибрежных районах летние и зимние температуры менее суровые, чем на больших массивах суши, потому что наземные массивы теряют тепло быстрее, чем вода.
Точно так же высокая теплота парообразования воды означает, что в процессе перехода из жидкого состояния в газообразное расходуется много энергии, вызывая охлаждение окружающей среды. Например, потоотделение у многих живых организмов (включая человека) представляет собой механизм, поддерживающий гомеостаз температуры тела за счет его охлаждения. Когезия, адгезия и капиллярность являются важными свойствами воды, которые обеспечивают поглощение воды растениями. Вода может подниматься по корням благодаря капиллярности. Он также может перемещаться по ксилеме, чтобы доставлять воду к ветвям и листьям.
Когезия, адгезия и капиллярность являются важными свойствами воды, которые обеспечивают поглощение воды растениями. Вода может подниматься по корням благодаря капиллярности. Он также может перемещаться по ксилеме, чтобы доставлять воду к ветвям и листьям.
Водородная связь в воде — основные выводы
Источник:
Advanced Placement for AP Courses Textbook by Texas Education Agency
Campbell Biology Eleventh Edition by Person Higher Education
Exploring our Fluid Earth by Hawai’i University
Сборники по химии по структуре воды
Сборники по химии по водородным связям
Геологическая служба США по адгезии и когезии воды
Геологическая служба США по капиллярному действию и воде
Ученые открывают новый способ получения воды
Университет Иллинойса Урбана-Шампейн
Фото Л. Брайана ШтауффераШАМПЕЙН, Иллинойс — В знакомой школьной демонстрации химии преподаватель сначала использует электричество, чтобы разделить жидкую воду на составляющие ее газы, водород и кислород. Затем, объединив два газа и воспламенив их искрой, инструктор превращает газы обратно в воду с громким хлопком.
Ученые из Университета Иллинойса открыли новый способ приготовления воды, причем без шипучки. Мало того, что они могут производить воду из необычных исходных материалов, таких как спирты, их работа также может привести к созданию лучших катализаторов и менее дорогих топливных элементов.
Мало того, что они могут производить воду из необычных исходных материалов, таких как спирты, их работа также может привести к созданию лучших катализаторов и менее дорогих топливных элементов.
«Мы обнаружили, что нетрадиционные гидриды металлов можно использовать для химического процесса, называемого восстановлением кислорода, который является неотъемлемой частью процесса производства воды», — сказал Захария Хейден, докторант и ведущий автор статьи, принятой к публикации в в журнале Американского химического общества и размещены на его веб-сайте.
Молекула воды (ранее известная как монооксид дигидрогена) состоит из двух атомов водорода и одного атома кислорода. Но вы не можете просто взять два атома водорода и приклеить их к атому кислорода. Реальная реакция образования воды немного сложнее: 2ч3 + О2 = 2ч3О + Энергия.
Уравнение на английском языке гласит: Чтобы получить две молекулы воды (h3O), две молекулы двухатомного водорода (h3) должны быть соединены с одной молекулой двухатомного кислорода (O2). Энергия будет высвобождаться в процессе.
Энергия будет высвобождаться в процессе.
«Эта реакция (2h3 + O2 = 2h3O + Energy) известна уже два века, но до сих пор никто не заставил ее работать в гомогенном растворе», — сказал Томас Раухфус, профессор химии и соответствующий автор статьи.
Хорошо известная реакция также описывает то, что происходит внутри водородного топливного элемента.
В типичном топливном элементе двухатомный водород входит в одну сторону элемента, двухатомный кислород входит в другую сторону. Молекулы водорода теряют свои электроны и становятся положительно заряженными в результате процесса, называемого окислением, в то время как молекулы кислорода получают четыре электрона и становятся отрицательно заряженными в результате процесса, называемого восстановлением. Отрицательно заряженные ионы кислорода объединяются с положительно заряженными ионами водорода, образуя воду и высвобождая электрическую энергию.
«Трудной стороной» топливного элемента является реакция восстановления кислорода, а не реакция окисления водорода, сказал Раухфус. «Однако мы обнаружили, что новые катализаторы для восстановления кислорода могут также привести к новым химическим средствам для окисления водорода».
«Однако мы обнаружили, что новые катализаторы для восстановления кислорода могут также привести к новым химическим средствам для окисления водорода».
Rauchfuss и Heiden недавно исследовали относительно новое поколение катализаторов гидрогенизации с переносом для использования в качестве нетрадиционных гидридов металлов для восстановления кислорода.
В своей статье JACS исследователи сосредоточились исключительно на окислительной реакционной способности катализаторов гидрирования переноса на основе иридия в гомогенном неводном растворе. Они обнаружили, что комплекс иридия влияет как на окисление спиртов, так и на восстановление кислорода.
«Большинство соединений реагируют либо с водородом, либо с кислородом, но этот катализатор реагирует с обоими», — сказал Хайден. «Он реагирует с водородом, образуя гидрид, а затем реагирует с кислородом, образуя воду; и делает это в гомогенном неводном растворителе».
Новые катализаторы могут привести к разработке более эффективных водородных топливных элементов, что существенно снизит их стоимость, сказал Хайден.
Работа финансировалась Министерством энергетики США.
Чтобы связаться с Томасом Раухфусом, позвоните по телефону 217-333-7355; электронная почта: [email protected]
Чтобы связаться с Zachariah Heiden, позвоните по номеру 217-352-1559; электронная почта: [email protected]
Связанные лица
Похожие темы
Каталог
scheelinАлександр
Scheeline
bjmccallБенджамин
МакКолл
r-gennisРоберт
Геннис
j-gerltJohn
Герлт
sgranickСтив
Граник
МгрюбельМартин
Грубель
hergenroPaul
Хергенротер
ХуанВорон
Хуан
mlkraftMary
Крафт
ЛекбандДебора
Лекбанд
йи-луйи
Лу
мартиниСьюзан
Мартини
snairSatish
Наир
ЭолдфилдЭрик
Олдфилд
cmsCharles
Шредер
zanZaida
Лютей-Шультен
СелвинПол
Селвин
sksScott
Сильверман
s-sligarStephen
Слигар
тайхорсЭмад
Тайхоршид
zhao5Huimin
Чжао
pbraunPaul
Браун
mdburkeМартин
Берк
ДжеффчанДжефферсон
Чан
sdenmarkScott
Дания
dlottДана
Длотт
foutЭлисон
Fout
возраст Эндрю
Гевирт
ggirolamGregory
Джиролами
СохиратаСо
Хирата
джайнПрашант
Джайн
jkatzeneJohn
Katzenellenbogen
нмакриНанси
Макри
Дуглас Дуглас
Митчелл
ДжсмурДжеффри
Мур
murphycjКэтрин
Мерфи
р-нуццоРальф
Нуццо
dimerPhilip
Phillips
rauchfusThomas
Rauchfuss
ХоакинХоакин
Родригес-Лопес
СарлахДэвид
Сарлах
kschweizKenneth
Schweizer
ДжсвидлДжонатан
Свидлер
vddonkWilfred
ван дер Донк
renskeRenske
Ван дер Вин
вуравейс Джош
Вура-Вайс
Макуайт7М.
Белый
sczimmerСтивен
Циммерман
клювПитер
Клюв
wklemperWalter
Клемперер
jdmcdonaJ.
Макдональдс
погорелоТарас
Погорелов
mshen233Мей
Шен
ДевунДэвид
Вун
wboulangWilliam
Буланже
rxbRohit
Бхаргава
qchen20Qian
Чен
jianjuncJianjun
Ченг
hy66Hong
Ян
андиномаХосе
Андино Мартинес
decosteDonald
DeCoste
thhuangTina
Хуанг
tjhummelThomas
Hummel
dkellДэвид
Келл
докторкМайкл
Кернер
МарвильКелли
Марвиль
crrayКристиан
Рэй
tlbrownТеодор
Браун
rmcoatesRobert
Коутс
thdjrThom
Даннинг
ДайкстраКлиффорд
Дайкстра
j-jonasДжири
Йонас
j-lisyДжеймс
Лизи
ШеплиДжон
Шепли
pshaplePatricia
Шепли
zumdahl2Steven
Zumdahl
ksuslickКеннет
Суслик
jcoxДженни
Кокс
sqdSean
Драммонд
ШилиСара
Шили
ДжсмэдденДжозеф
Мэдден
cknight4Connie
Рыцарь
ШульцеХезер
Шульце
КбаумгарКина
Финни
adkssnБеатрис
Адкиссон
trabari1Katie
Трабарис
МеткалфКара
Меткалф
ljohnso2Lori
Джонсон
ЛченовеЛесли
Ченовет
вдедоВолали
Дедо
spinnerDavid
Spinner
плблумПатриция
Симпсон
Стивенс2Чад
Стивенс
лсагекарлори
Сейдж-Карлсон
БертольдДебора
Бертольд
кекарлсоКэтрин
Карлсон
sdesmondSerenity
Десмонд
axelson2Jordan
Аксельсон
scbakerStephanie
Бейкер
pflotschPriscila
Фалаган Лотч
dgrayDanielle
Серый
thennes2Tom
Хеннесси
ХолдаНэнси
Холда
aibarrАлехандро
Ибарра
Кимш Сунг Хун
Ким
kocherg2Николай
Кочергинский
philipk2Philip
Кочерил
legare2Stephanie
Legare
алевандоАгнешка
Левандовска
смккомбиСтюарт
Маккомби
jdm5Джастин
МакГлаухлен
egmooreEdwin
Мур
МайерскоуКэтлин
Майерскоу
snalla2Siva
Налла
Романова Елена
Романова
рубахиСтанислав
Рубахин
shvedalxАлександр
Швед
asoudaAlexander
Судаков
xywangXiying
Ван
kwilhelKaren
Вильхельмсен
Уилки Рэнди
Уилки
силонгSilong
Чжан
schlembaMary
Шлембах
триммеллЭшли
Триммелл
emccarr2Elise
Маккаррен
cmersierChristen
Мерсье
атимпермАарон
Тимперман
niesShuming
Nie
hshanHee-Sun
Хань
ммгМутха
Гунасекера
kknightsКатриена
Рыцари
lisawЛиза
Уильямсон
КейнкКэти
Айнк
коленоf1Кейт
Ниф
txiang4Tiange
Сян
j-hummelJohn
Hummel
i-PaulLain
Пол
МунджанджаЛлойд
Мунджанджа
glnGayle
Нельсен
agerardАнна
Жерар
ПауэрсКимберли
Пауэрс
lolshansЛиза
Ольшанский
МирикаЛивиу
Мирика
qingcao2Qing
Цао
lisa3Лиза
Джонсон
тиналамбТина
Баранина
баронпБарон
Петерс
bransle2Sarah
Брэнсли
dylanmh3Дилан
Гамильтон
raegansRaegan
Смит
apm8Ангад
Мехта
ЛевериттДжон
Леверитт
синвсин
Ван
эмиллрева
Миллер
jmill24Жаклин
Миллер
jlbass2Julia
Басс
ramonarРамона
Рудзинский
tlcraneTracy
Кран
cejohnstСелия
Джонстон
адлАмбер
Лабау
cnsolomoCandice
Соломон-Струтц
mikaelbMikael
Баклунд
jacksonnНик
Джексон


 Химическая формула: H₂O
Химическая формула: H₂O

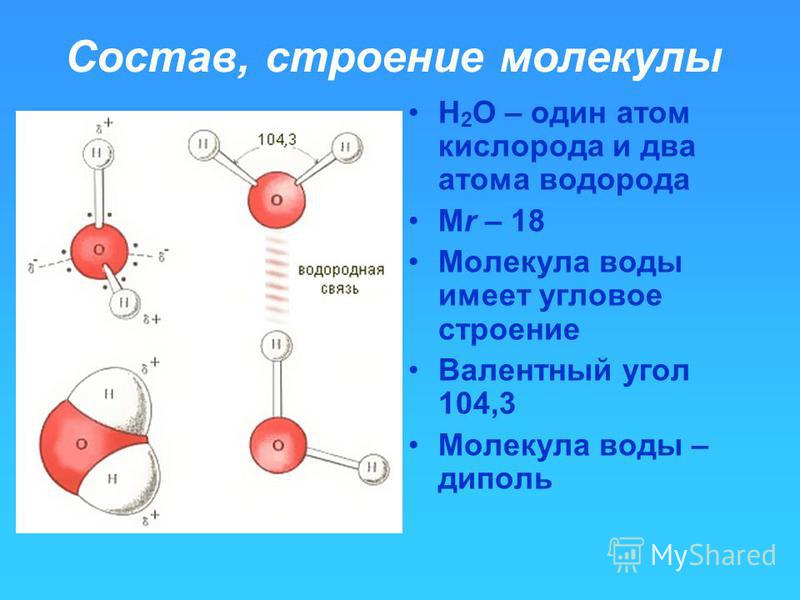
 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/