Все, що вам потрібно знати про молекулу води
Вода — це стихія, якою нам потрібно жити, і щоб на Землі існувало таке життя, яке ми знаємо сьогодні. молекула води Він складається з двох атомів водню та одного атома кисню, з’єднаних ковалентним зв’язком. Це означає, що два атоми водню та атома кисню об’єднані завдяки тому, що вони ділять між собою електрони. Формула молекули води — h3O. Молекула води має багато характеристик, і саме завдяки їй відбувається безліч процесів, що породжують розвиток життя.
Тому ми присвятимо цю статтю, щоб розповісти вам усе, що вам потрібно знати про молекулу води.
Індекс
- 1 Аналіз молекули води
- 2 Взаємодія між молекулами
- 3 Властивості молекули води
Аналіз молекули води
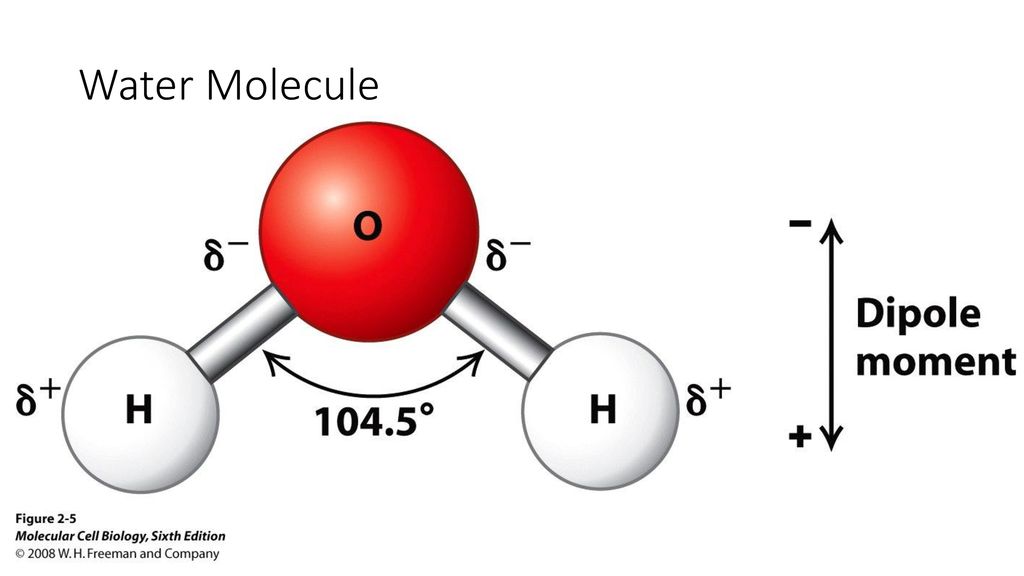
Якщо проаналізувати цю молекулу, то можна побачити, що кут приєднання ковалентного зв’язку між воднем і киснем від 104.5 градусів. Цього можна досягти за допомогою спектроскопічного та рентгенівського аналізу Середня відстань між атомами водню та кисню становить
Цього можна досягти за допомогою спектроскопічного та рентгенівського аналізу Середня відстань між атомами водню та кисню становить
Ці відстані не можна порівняти з тим, що може бачити людське око. Розташування електронів у молекулі води — це те, що передає електричну асиметрію, оскільки існує різний рівень електронегативності між воднем та киснем. Ми називаємо електронегативність до здатність атома притягувати електрони, які діляться у ковалентному зв’язку. Ми пам’ятаємо, що ковалентний зв’язок — це той, який встановлюється між двома неметалевими атомами.
Оскільки кисень має більшу електронегативність, ніж водень, електрони, швидше за все, будуть ближче до атома кисню, ніж до водню. Це тому, що електрони заряджені негативно. Той факт, що електрони переходять переважно до атомів кисню, змушує атом водню мати певний позитивний заряд. Цей заряд називається позитивним частковим зарядом. 
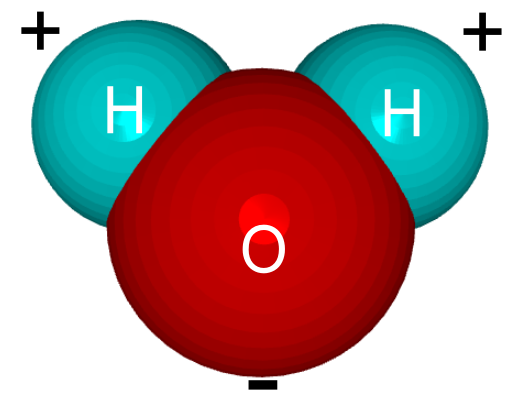
Різниця між позитивними та негативними електронами, близькими до обох атомів, робить молекулу води полярною молекулою. Тобто, молекула має частину з негативним полюсом і іншу частину з позитивним полюсом. Хоча вся молекула є нейтральною, саме від цього полярного характеру походять усі її фізико-хімічні та біологічні властивості.
Взаємодія між молекулами
Коли кілька молекул води знаходяться дуже близько одна від одної, вони здатні встановити тягу між атомами кисню молекул окремо. Це пов’язано з тим, що кисень має негативний частковий заряд, а один із воднів має позитивний частковий заряд. Отже, позитивна частина однієї молекули води притягується до негативної частини іншої молекули води. Цей тип взаємодії між молекулами називається джерелом водню. У цих молекулах трапляється багато, оскільки вони впорядковані таким чином, що кожна молекула води здатна асоціюватися з ще 4 молекулами. Цей тип взаємодії відбувається з льодом.
Зв’язки між воднями відбуваються завдяки тому, що існує атом з негативним частковим зарядом і водень з позитивним частковим зарядом. Це робить посилання не унікальними для води. Ці зв’язки взаємодії також виникають в азоті, фторі та водню в інших молекулах, що містять білки та ДНК.
Це робить посилання не унікальними для води. Ці зв’язки взаємодії також виникають в азоті, фторі та водню в інших молекулах, що містять білки та ДНК.
Давайте подивимось, які фізико-хімічні властивості молекули води. Серед цих властивостей та характеристик можна виділити ємність та розчинник. Не можна забувати, що вода вважається універсальним розчинником. Ще однією характеристикою молекули води є висока питома теплоємність та теплота випаровування. Він також має велику зчеплення та адгезію, ненормальну щільність та функціонує як хімічний реагент.
Якщо ми використовуємо властивості води, то бачимо, що вона здатна розпорошити велику кількість сполук усередині неї завдяки своєму полярному характеру. Як ми вже згадували раніше, хоча вся молекула є нейтральною, тим, що вона має позитивну та негативну частини, є те, що Це дає фізико-хімічні властивості, для яких вода так необхідна для життя. Таким чином, він працює з солями та іншими іонними речовинами, в яких молекула води орієнтує свої полюси. Така орієнтація полюсів задається як функція зарядів двох іонів, ставлячи негативний полюс з одного боку, а позитивний — з іншого. Наприклад, з полярними речовинами, такими як етанол, вода діє подібним чином. Він протиставляє один полюс іншому протилежним знаком речовини.
Така орієнтація полюсів задається як функція зарядів двох іонів, ставлячи негативний полюс з одного боку, а позитивний — з іншого. Наприклад, з полярними речовинами, такими як етанол, вода діє подібним чином. Він протиставляє один полюс іншому протилежним знаком речовини.
Властивості молекули води
Молекула води має високу питому теплоємність. Це специфічне тепло — це не що інше, як кількість тепла, яке потрібно подавати грам води, щоб мати можливість підвищити її температуру на один градус. З іншого боку, ми маємо теплоту випаровування. Це кількість пари, яку потрібно нанести на грам рідини, щоб вона могла перейти на грам пари. Ми знаємо, що молекула води має високу питому теплоємність і випаровування завдяки зв’язкам, які приєднують атоми водню. Тобто, щоб підняти температуру води на один градус, всі молекули повинні збільшити свою вібрацію. Для цього вони розривають водневі зв’язки, щоб вони могли пропустити грам рідкої води до грама водяної пари.
Той факт, що він має велике значення теплоти випаровування, обумовлений тим, що він здатний проходити. Ще однією характеристикою молекули води є когезія. Питання в тенденції до того, що дві молекули повинні бути об’єднані. Ще раз завдяки водневим зв’язкам молекули води зв’язок високий. Приєднання є тенденція двох різних молекул зв’язуватися між собою. Це робить молекулу води високою адгезією до іонних та полярних сполук. Це застосування, яке відбувається, коли трапляється, що вода прилипає до різних поверхонь.
Я сподіваюся, що завдяки цій інформації ви зможете дізнатись більше про молекулу води.
Характеристика води як речовини
Молекула води несиметрична: три ядра утворюють рівнобедрений трикутник з двома ядрами водню в основі і ядром кисню в вершині. Атом кисню в молекулі води приєднує до себе два електрони, що від’єднались від атомів водню, і тим самим здобуває негативний заряд. У свою чергу, обидва атоми водню, позбавлені електронів, стають позитивно зарядженими протонами. Молекула води тому утворює електричний диполь.
Молекула води тому утворює електричний диполь.
Полярна будова води і виникаюче в воді електричне поле обумовлюють велику діелектричну проникність води — величину, що показує, у скільки разів сила взаємодії електричних зарядів зменшується у воді в порівнянні з силами їх взаємодії у вакуумі. Висока діелектрична проникність води зумовлює її велику іонізуючу здатність, тобто здатність розщеплювати молекули інших речовин, що обумовлює сильну дію води як розчинника.
Кожна молекула води, що володіє двома позитивними і двома негативними зарядами, здатна утворити чотири так звані водневі зв’язки, тобто з’єднання позитивно зарядженого ядра водню (протона), хімічно пов’язаного в одній молекулі, з негативно зарядженим атомом кисню, що належить іншій молекулі.
Водяна пара складається переважно з мономірних (одиночних) молекул води, тобто водневі зв’язки практично не реалізуються. У твердому стані (лід) будова води має високий ступінь впорядкування. У кристалах льоду молекули води становлять гексагональну систему з міцними водневими зв’язками.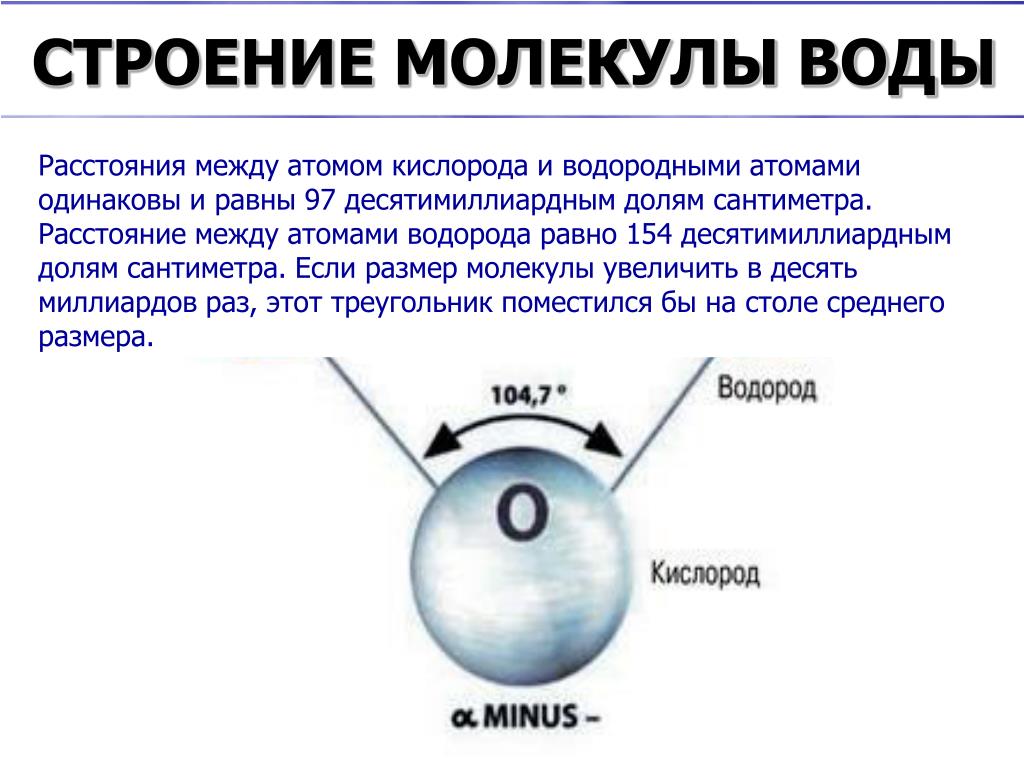 Така структура вельми пухка і, як іноді кажуть, «ажурна». Вода в рідкому стані займає проміжне положення між парою і льодом. У такій воді зберігаються елементи «льодоподібного» молекулярного каркаса, а його порожнечі частково заповнюються одиночними молекулами. Тому «упаковка» молекул у воді, що знаходиться в рідкому стані, більш щільна, ніж у льоду, і плавлення льоду призводить не до зменшення, а до «аномального» збільшення густини води.
Така структура вельми пухка і, як іноді кажуть, «ажурна». Вода в рідкому стані займає проміжне положення між парою і льодом. У такій воді зберігаються елементи «льодоподібного» молекулярного каркаса, а його порожнечі частково заповнюються одиночними молекулами. Тому «упаковка» молекул у воді, що знаходиться в рідкому стані, більш щільна, ніж у льоду, і плавлення льоду призводить не до зменшення, а до «аномального» збільшення густини води.
Перехід від повністю впорядкованої пухкої молекулярної структури, властивої льоду, до більш щільної структурі, властивої воді в рідкому стані, не відбувається миттєво в процесі плавлення льоду, а продовжується і в рідкій воді. При підвищенні температури поряд зі згаданим ущільненням молекулярної структури відбувається і властиве всім речовинам збільшення об’єму води внаслідок зростання інтенсивності теплового руху молекул. У діапазоні підвищення температури від 0 до 4°С переважає процес ущільнення хімічно чистої води, при температурі вище 4°С — теплове розширення, тому вода має «аномальну» властивість — найбільшу густину не при температурі плавлення, а при 4°С.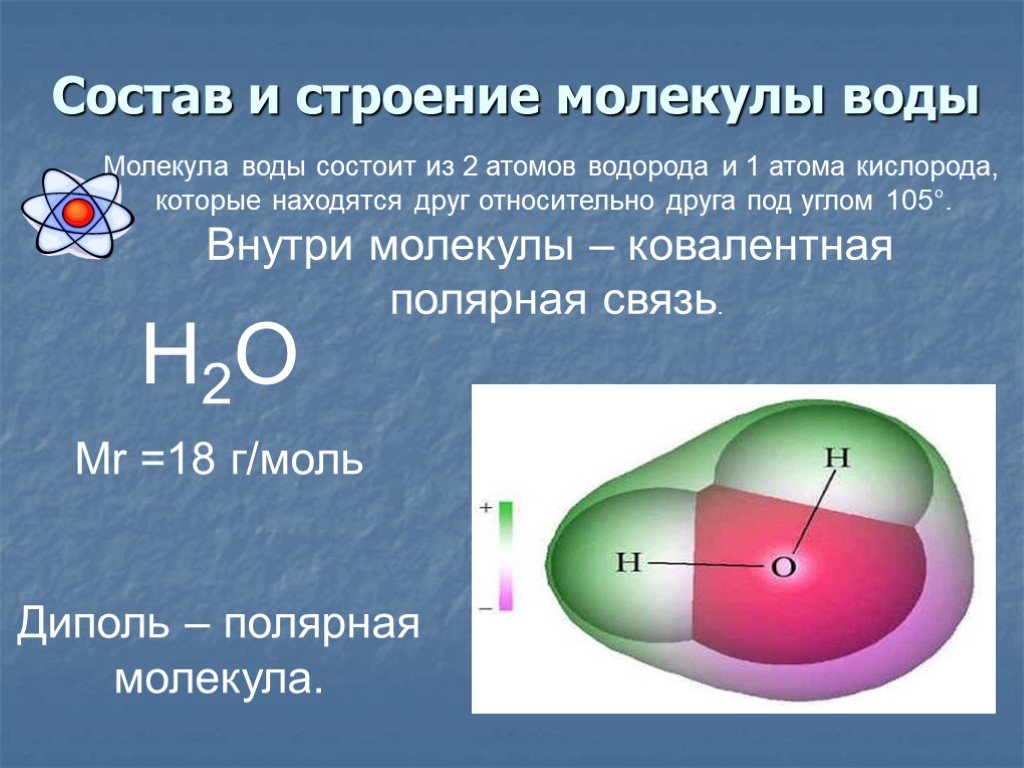
Притаманні воді водневі зв’язки приблизно в десять разів міцніші зв’язків, обумовлених межмолекулярними взаємодіями, які характерні для більшості інших рідин. Тому для подолання цих зв’язків при плавленні, нагріванні і випаровуванні води необхідно набагато більше енергії, ніж у випадку інших рідин. Це визначає ряд «аномалій» теплових властивостей води.
Водень і кисень мають кілька природних ізотопів: 1Н («звичайний» водень), 2Н, або D («важкий» водень, або дейтерій), 3Н, або Т (радіоактивний «надважкий» водень, або тритій), 16O, 17O, 18O. Тому і сама вода має змінний ізотопний склад. Природна вода — це суміш вод різного ізотопного складу. Найбільш поширена вода, що складається з ізотопів 1Н і 16O, частка інших ізотопних видів води незначна — менше 0,27%. Одна з головних причин, що призводять до відмінності ізотопного складу природних вод, — процес випаровування. У результаті випаровування відбувається деяке збагачення води більш важкими ізотопами, а в результаті конденсації — більш легкими.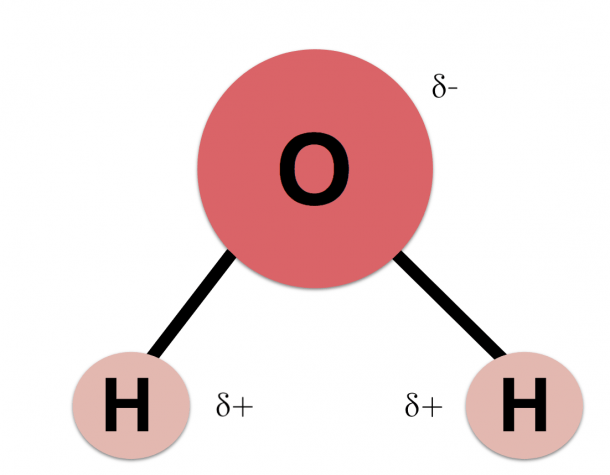 Тому поверхневі води, що формуються атмосферними опадами, містять «важкого» водню (3Н) і «важкого» кисню (18O) менше, ніж океанічні води.
Тому поверхневі води, що формуються атмосферними опадами, містять «важкого» водню (3Н) і «важкого» кисню (18O) менше, ніж океанічні води.
Воду з ізотопним складом 1Н216O називають «звичайної» водою і позначають просто Н2O, решта види води (крім 3Н20) називають «важкої» водою. Іноді «важкою» водою вважають лише дейтерієву воду 2Н2O (або D2O). Вода з ізотопним складом 3Н2O (або Т2O) — так звана «надважка» вода. Її на Землі знаходиться всього 13-20 кг. Відомості щодо фізичних властивостей у гідрології наводяться тільки до «звичайної» води.
Британника
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica.
- Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории. - Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
- Britannica Beyond
Мы создали новое место, где вопросы находятся в центре обучения. Вперед, продолжать. Просить. Мы не будем возражать. - Спасение Земли
Британника представляет список дел Земли на 21 век. Узнайте об основных экологических проблемах, стоящих перед нашей планетой, и о том, что с ними можно сделать! - SpaceNext50
Britannica представляет SpaceNext50. От полёта на Луну до управления космосом — мы исследуем широкий спектр тем, которые подпитывают наше любопытство к космосу!
Страница не найдена
Приносим свои извинения! Этот контент недоступен. Посетите домашнюю страницу Britannica или воспользуйтесь полем поиска ниже.
Поиск в Британике
Викторина Статуя Свободы
5 картин Винсента Ван Гога, которые вживую выглядят еще лучше
Поддерживаемый США отказ от патента на вакцину: объяснение плюсов и минусов
Ученые впервые увидели, как вода накапливает дополнительные протоны
Основы химии
Ученые фиксируют сложную структуру в бассейне льда глубиной молекул
от Lars Fischer, Fionna M.
 D. Samuels на
D. Samuels на
Share на Facebook
Совместный.
Отправить по эл. через воду.
Нейтральная молекула воды состоит из двух атомов водорода, связанных с одним атомом кислорода, при этом вся структура изгибается, чтобы дать молекуле частично положительную сторону и частично отрицательную сторону, как у магнита. Если бы вы могли увеличить стакан с водой, вы бы увидели триллионы таких молекул, а также несколько избыточных отдельных атомов водорода, которые потеряли свои электроны (другими словами, просто протоны). В течение 200 лет исследователи предполагали, что эти протоны перескакивают с одной молекулы воды на другую, прикрепляясь к ближайшей молекуле и отталкивая один из уже связанных там протонов. Затем этот протон связывается со следующим соседом. Теперь группа ученых из Пекина впервые получила изображение таких частиц под микроскопом, что помогло понять, как происходят эти скачки.

Модели предсказали, что этот процесс чаще всего происходит двумя способами. В одном протон связывается непосредственно с одной молекулой воды, превращая ее из нейтральной молекулы в положительный ион. Три окружающие нейтральные молекулы воды ориентируются таким образом, что их частично отрицательные стороны стабилизируют этот заряд. В другом варианте лишний протон находится между отрицательными концами двух нейтральных молекул воды, так что каждая из них разделяет нагрузку положительного заряда.
Исследователи смогли проверить эти ориентации с помощью атомно-силовой микроскопии — метода, который генерирует изображения путем отслеживания наноскопического острия специальной иглы по неровностям на поверхности. Используя это оборудование, Цзин Го, химик из Пекинского педагогического университета, и ее коллеги изобразили сеть воды толщиной в молекулу, застывшую на металлическом листе, и показали, как дополнительные протоны изменили эту сеть. Их работа была опубликована в Наука.

Потребовались невероятно точные измерения, чтобы различить две конфигурации воды. «Положение протонов вдоль водородной связи отличалось всего примерно на 20 пикометров, — говорит Го, — это меньше половины длины самого атома водорода. «Мы очень, очень рады выяснить основные картины после долгой борьбы».
Команда обнаружила, что эти две конфигурации возникают с разной частотой и в разных соотношениях в зависимости от того, к какому типу металла была заморожена вода. Они также использовали электричество, чтобы заставить воду переключаться между различными установками. «Очень поразительно, что они могут [непосредственно] наблюдать за этими вещами», — говорит Томас Кун, химик-теоретик из Падерборнского университета в Германии, не участвовавший в этой работе. «Это открывает двери для изучения механизмов [выработки водорода]», — говорит он. «И, может быть, из этого выйдет что-то хорошее».
Эта статья была первоначально опубликована под названием «Водная сеть» в журнале Scientific American 327, 5, 26 (ноябрь 2022 г.




 D. Samuels на
D. Samuels на